Нагноение послеоперационной раны - причины, профилактика
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Лечение гнойных и септических осложнений ранений: иммунная терапия
Как известно, гнойно-септические процессы сопровождаются угнетением функциональной активности иммунокомпетентных клеток за счет иммуносупрессивного действия экзо- и эндотоксинов микроорганизмов, которое может усилиться под влиянием антибиотикотерапии. При этом уровень свободного эндотоксина увеличивается в плазме крови до 200 раз, вследствие его высвобождения из погибших бактерий, что, несмотря на уменьшение бактериемии, вносит свой вклад в усугубление симптомокомплекса гнойного процесса, провоцируя развитие генерализованной воспалительной реакции [Shenep J.L. et al., Talan D. A.].
Неэффективная терапия антибиотиками без учета спектра микрофлоры пострадавших и при несоблюдении оптимальных сроков ее проведения не только утяжеляет общее состояние больного и способствует формированию резистентных штаммов, но и увеличивает продолжительность лечения и его общую стоимость в среднем на 30%. По данным ВОЗ, летальность в группе больных с гнойно-септическими осложнениями значительно (в 10 и более раз) превышает летальность в группе больных с аналогичными исходными состояниями, но не имевших инфекционных осложнений.
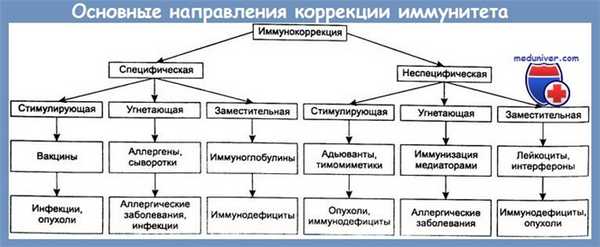
Важную роль в предотвращении генерализации местного гнойного осложнения играет адекватная иммунная терапия. Согласно современным представлениям, используются два вида воздействия на иммунный статус пострадавшего — стимулирующая и заместительная терапия.
Что касается применения иммуностимуляторов (иммуномодуляторов) при гнойно-септических осложнениях, то рядом серьезных исследований доказано, что не всегда их включение в комплекс лечения осложнений сопровождается заметным клиническим эффектом. Как справедливо отметили И. А. Ерюхин и соавт., включение иммунокорригирующих препаратов в комплексное лечение гнойно-септических осложнений хорошо обосновано теоретически, но не всегда имеет яркое клиническое подтверждение их эффективности, особенно при лечении сепсиса. Возможно, как считают авторы, это происходит потому, что учитывается тяжесть процесса, а не его причины. Кроме того, отсутствуют простые и теоретически обоснованные лабораторные и клинические методы исследований, позволяющие идентифицировать динамику воспалительного и иммунного ответа, в том числе -динамику системной воспалительной и противовоспалительной реакций [Bone R. С.].
Это связано с тем, что под влиянием эндотоксикоза иммунокомпетентные клетки могут находиться в состоянии своеобразного «паралича» и не в состоянии адекватно реагировать на стимулирующие воздействия (Гельфанд Б. Р. и др.]. Вероятно именно этим можно объяснить низкую эффективность пептидных препаратов тимуса при тяжелом течении гнойно-септического процесса. Еще более сомнительной является целесообразность применения цитокинов в ранние сроки после тяжелой травмы с кровопотерей или при септических процессах, сопровождающихся «цитокиновой бурей», провоцирующей развитие генерализованной воспалительной реакции и сепсиса. Введение препаратов интерферона-у, интерлейкина-2 в нераспознанную фазу прогрессирующего септического воспаления приводит к развитию генерализованной и неконтролируемой острой воспалительной реакции.
Более эффективными являются иммуноглобулиновые препараты и иммунные антибактериальные плазмы, целесообразность применения которых обусловлена механизмами их действия, а также патогенезом иммунодефи-цитных состояний при тяжелой травме и гнойно-септических осложнениях [Румянцев А. Г. и др., Mitov I.G., Terziiski D.G., Zanetti G. et al., Talan D.A.].
Иммуноглобулин для внутривенного введения имеет ряд существенных преимуществ по сравнению с иммуноглобулинами для внутримышечного введения, так как позволяет в течение короткого времени создать в крови эффективные терапевтические концентрации антител при минимальном риске развития побочных действий. Первичным эффектом иммуноглобулинов является их способность к специфическому распознаванию чужеродных агентов и связывание с ними. Часто само связывание антителами антигенов ведет к выраженному защитному эффекту и не требует активного подключения механизмов неспецифической защиты, как это бывает в случаях нейтрализации токсинов антитоксическими иммуноглобулинами.
Высокоэффективны также и нейтрализующие антитела, которые распознают и нейтрализуют антигены возбудителей, обеспечивающих инвазивность, т. е. способствуют прекращению распространения инфекции. Следует отметить, что не всегда специфическое взаимодействие антител с антигеном приводит к выраженному защитному эффекту. В этих случаях подключаются вторичные неспецифические механизмы, которые, в свою очередь, также стимулируются антителами.
Эффективность иммунотерапии гнойно-воспалительных осложнений в зависимости от сроков её проведения
| Сроки проведения иммунотерапии от первых признаков гнойного осложнения (недели) | % хороших и отличных результатов санации ран и полостей | % хороших и отличных результатов нормализации иммунограммы | Длительность стационарного лечения (дни) |
| 1-я | 885 | 92 | 32+1,8 |
| 3-4-я | 48 | 58 | 49+3,4 |
Вторичные (неспецифические) эффекты иммуноглобулинов — это активизация неспецифических защитных процессов, направленных на нейтрализацию и выведение чужеродных антигенов. Одним из этих механизмов является взаимодействие одного из фрагментов молекулы иммуноглобулина (Fc-фрагмент) с компонентами системы комплемента. За счет активации комплемента происходит лизис комплекса антиген-антитело.
Имуноглобулипы не только связывают генетически чужеродные организму молекулы и клетки, но и выполняют эффекторные и иммуномодулирующие функции, обусловленные усилением физиологических последствий связывания антигена. Кроме того, иммуноглобулины способны регулировать активность Т- и В-лимфоцитов, макрофагов, многократно усиливать антигенспецифический ответ, опосредованный Т-лимфоцитами и комплементом [Климович В.Б., Imbach P. et al.].
Положительный результат от включения в комплексное лечение как стандартного донорского иммуноглобулина, так и обогащенного IgM — пентаглобина — зависит от дозы и сроков их применения. Лишь при условии нейтрализации бактериальных эндотоксинов в течение первых суток после тяжелой травмы или от начала септического процесса можно рассчитывать на уменьшение биологических последствий эндотоксемии.
Одним из препаратов заместительного действия, компенсирующего функциональную недостаточность нейтрофилов у пациентов с гнойно-воспалительными осложнениями, является лейкокоицентрат донорской крови. Приемлемой считается терапевтическая доза, включающая более 1010 клеток, предпочтительнее доза, близкая к 1011 клеток. Трансфузии меньшего количества лейкоцитов не сопровождаются выраженным клиническим эффектом [Hubel K.D.C. et al., Van Buzik J.-A.H., Weisdorf D. J., Ying-Wei Lin et al.].
Несмотря на определенные успехи клинического использования лейкоцитной массы при лечении септических больных, переливание гранулоцитов не вошло в широкую практику лечения инфицированных пациентов с лейкопенией или фагоцитарной недостаточностью. Это обусловлено прежде всего тем, что имеются трудности получения этого компонента крови и его хранения. Установлено, что гранулоциты начинают терять свои функциональные свойства уже через 6 ч после их выделения, поэтому перелиты они должны быть в течение 12 ч после заготовки.
Важным условием применения лейкоцитной массы является строгое соблюдение схемы введения: интервал между трапсфузиями не должен быть более 2 сут. В противном случае можно спровоцировать иммунизирующий эффект, сопровождающийся выработкой противолсйкоцитарных антител. В то же время введение лейкоцитов иммунокомпрометированным пациентам с Т-лимфопенией и относительной недостаточностью Т-хелперов не сопровождается образованием противолейкоцитарных антител.
Суммируя накопленный опыт применения иммунных препаратов в лечении гнойно-воспалительных осложнений в послеоперационном периоде у пострадавших с множественными и сочетанными ранениями груди, следует признать, что использование иммунотропных препаратов существенно улучшает результаты лечения. Наиболее высокая эффективность лечения гнойно-воспалительных осложнений отмечена при проведении иммунотерапии на фоне адекватной антибактериальной, инфузионной, трансфузионной терапии, направленной на улучшение микроциркуляции, уменьшение интоксикации и способствующей выведению иммунных комплексов.
Сравнительный анализ таких показателей, как продолжительность периода санации гнойного очага, улучшение состояния больного, длительность стационарного лечения и положительная динамика параметров иммунограм-мы, свидетельствует о необходимости применения иммунотропных препаратов в ранние сроки развития гнойных осложнений. В наших наблюдениях при таком подходе удалось существенно сократить период купирования гнойного процесса у 88% больных, в результате чего средняя продолжительность лечения больных этой группы составила 32±1,8 дней. Назначение иммунотропных препаратов позже 20-х суток от начала гнойно-воспалительного процесса сопровождалось улучшением состояния и ускорением процесса очищения гнойных полостей только у 48 % больных. Длительность стационарного лечения у этих пациентов была значительно большей и составила в среднем 49+3,4 дня.
Положительная динамика параметров иммунограммы и клинического анализа крови выявлена у 92% больных при назначении иммунотерапии в ранние сроки и у 58% больных — при её проведении в поздние сроки от начала гнойно-воспалительного осложнения.
Необходимо отметить, что не во всех случаях применения иммунопрепаратов в оптимальные сроки были отмечены положительные сдвиги иммунного гомеостаза. В трех наблюдениях после применения тактивина и в двух - - миелопида в составе комплексного лечения пострадавших с гнойными осложнениями вопреки ожидаемому эффекту было отмечено усиление дисбаланса клеточных звеньев иммунной системы со снижением числа Т- и В-клеток и более выраженное подавление кислородного метаболизма нейтрофилов, обеспечивающего бактерицидность в процессе фагоцитоза.
Как правило, отрицательная динамика параметров иммунограммы имелась при проведении иммунотерапии на фоне сохраняющегося гнойного очага, в том числе и при его неадекватном дренировании. В таких случаях иммуносупрессивное действие гнойной интоксикации превалировало над иммуностимулирующим влиянием использованных препаратов. У этих пациентов с помощью иммунотерапии удавалось лишь предупредить развитие фатальной иммунодепрессии при продолжающейся гнойной интоксикации. Отсутствие положительной динамики иммунограммы на фоне лечения является прогностически неблагоприятным признаком и свидетельствует о том, что характер гнойного процесса приобретает признаки хронического. Это заставляет хирурга совместно с клиническим иммунологом искать причины неблагоприятного развития событий, в первую очередь — исключая наличие недренированных очагов гнойной инфекции.
Таким образом, выбор иммунопрепаратов определяется направленностью и степенью изменения параметров отдельных звеньев иммунной системы. Лейкопения и снижение фагоцитарной активности нейтрофилов при наличии гнойного процесса диктуют необходимость применения препаратов, активирующих лейкопоэз и созревание лейкоцитов, а также проведение заместительной терапии донорской лейкоцитной массой. Если на ранней стадии развития гнойного процесса имеется лимфопения и снижение фагоцитарной активности нейтрофилов, показана комбинация тимических пептидов или миелопептидов с иммуноглобулином для внутримышечного введения. При сочетанной недостаточности фагоцитарного и лимфоцитарного звеньев иммунной системы на фоне сохраняющейся интоксикации и повышения уровня циркулирующих иммунных комплексов эффективно (помимо использования иммунокорригирующих препаратов) проведение лечебного плазмафереза.
Видео иммунограмма в норме и при патологии
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нагноение послеоперационной раны - причины, профилактика
Советы при раневой инфекции - нагноении раны после операции
1. Что такое хирургические раневые инфекции и какова их классификация?
Хирургические раневые инфекции (ХРИ) развиваются в течение 30 дней после хирургического вмешательства, за исключением тех случаев, когда в ране остается инородное тело. В случае имплантации инородного материала, опасность раневой инфекции сохраняется в течение года.
В зависимости от глубины поражения тканей раневые инфекции делятся на три клинически значимые категории:
а) Поверхностные ХРИ.
б) Глубокие ХРИ (вовлекающие фасции и мышцы).
в) Полостные ХРИ (распространение инфекции на любые анатомические образования, затронутые хирургическими манипуляциями).
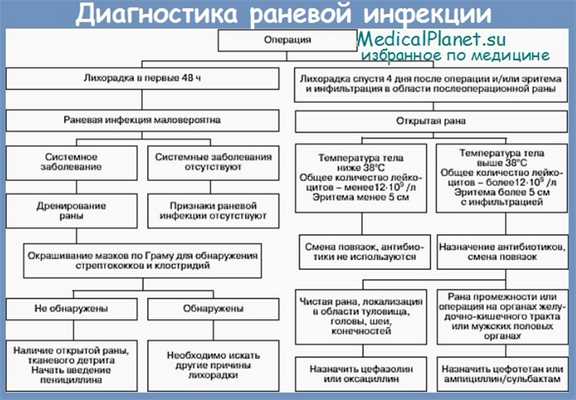
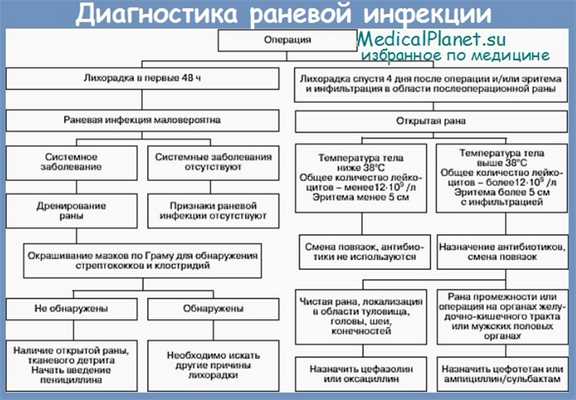
2. Каковы классические признаки поверхностной, глубокой и полостной хирургической раневой инфекции (ХРИ)?
Поверхностные и глубокие хирургические раневые инфекции (ХРИ):
• Calor (жар)
• Tumor (отечность)
• Rubor (покраснение)
• Dolor (боль)
На полостную хирургическую раневую инфекцию (ХРИ) указывают общие симптомы: лихорадка, кишечная непроходимость и/или шок. Для уточнения диагноза могут потребоваться дополнительные исследования.
3. Можно ли предвидеть дальнейшее развитие ХРИ на основании типа раны?
Да. Исходя из степени загрязнения, раны можно отнести к одной из четырех категорий: чистые, чистые-контаминированные, контаминированные и грязные инфицированные. Чистые раны — атравматичные раны без признаков воспаления, с полным соблюдением правил асептики и без вскрытия полых органов. Чистые-контаминированные раны идентичны предыдущим, за исключением того, что вскрывался полый орган.
Контаминированные раны причинены чистым предметом, при минимальном контакте с инфицированным материалом. Грязные инфицированные раны развиваются в результате травмы загрязненным предметом или при значительном попадании инфицированного материала в разрез. По литературным данным, частота нагноения для каждой категории ран составляет 2,1%; 3,3%; 6,4% и 7,1% соответственно.
4. Какие другие факторы, кроме типа раны, позволяют прогнозировать развитие раневой инфекции?
Физическое состояние (но классификации Американского Общества Анестезиологов), результаты интраоперационных бактериальных посевов и продолжительность пребывания в стационаре до операции являются важными прогностическими факторами послеоперационных ХРИ. Важное значение имеет также адекватное регионарное кровоснабжение, что подтверждается низкой частотой нагноения ран в лицевой области.

5. Какие факторы может контролировать хирург для снижения частоты ХРИ?
Снизить частоту послеоперационной инфекции помогает сокращение продолжительности операции, облитерация мертвого пространства, тщательный гемостаз, максимальное уменьшение присутствия чужеродных материалов (включая лишние швы) и бережное обращение с тканями. Применение электрокоагуляции для гемостаза не повышает частоту раневых инфекций.
6. Снижает ли профилактическое назначение системных антибиотиков вероятность инфекции?
Применение антибиотиков при контаминированных и грязных инфицированных ранах абсолютно показано и является скорее лечением, чем профилактикой. При любых чистых контаминированных ранах рекомендуется назначение антибиотиков в качестве профилактики. Первоначально профилактическое лечение антибиотиками при чистых ранах проводилось только в случае имплантации синтетического материала. Общее мнение сводилось к тому, что любая польза от профилактического применения антибиотиков в чистой хирургии превышает потенциальный риск побочных эффектов от неправильного использования.
Однако, строго говоря, после любой операции в ране остается некоторое количество чужеродного материала (например, швы), и даже единственный шов может привести к нагноению за счет занесенных в рапу бактерий, которые сами по себе не вызовут инфекции. Кроме того, крупное проспективное рандомизированное исследование, посвященное профилактическому применению антибиотиков в чистой хирургии, показало очевидное значение профилактики для уменьшения количества ХРИ.
7. Когда нужно проводить антибактериальную профилактику?
Максимально положительный результат достигается при наличии терапевтической концентрации антибиотиков в тканях на момент контаминации. Следовательно, эффективность профилактики повышается, если антибиотики назначаются непосредственно перед хирургическим разрезом; более позднее профилактическое введение антибиотиков бессмысленно. Схемы многократного введения антибиотиков не имеют преимуществ перед однократной дозой. Беспорядочный выбор антибиотиков (не соответствующий больничным рекомендациям) может даже повысить частоту ХРИ.
8. Нужно ли проводить в операционной пульс-гидропрессивную обработку раны?
Да. Было проведено всестороннее исследование результатов пульс-гидропрессивной обработки раны при контаминации мягких тканей. При этом было продемонстрировано, что она в семь раз эффективнее снижает бактериальное загрязнение, чем промывание резиновой грушей. Эластические свойства мягких тканей способствуют удалению микрочастиц в промежутках между подачей жидкости. Оптимальное давление и частота импульсов должны составлять соответственно 4-5 кг на см2 и 800 импульсов в минуту.
9. Позволяют ли антибиотики и гидропрессивная обработка чаще закрывать грязные или контаминированные раны первичным натяжением?
Несмотря на эти эффективные методы терапии, решение о первичном закрытии раны для хирурга остается непростым, требует опыта и врачебной интуиции. Первичное закрытие рапы всегда предпочтительно, поскольку сокращает сроки заболеваемости и улучшает косметический результат. Однако при развитии инфекции последствия достаточно серьезны, и рапу необходимо снова раскрыть. Решение о первичном закрытии рапы принимается с учетом степени контаминации, количества некротической ткани или размеров оставленного мертвого пространства, адекватности кровоснабжения, эффективности дренажей, времени, прошедшего с момента повреждения и имплантации инородного материала.
В целом безопаснее оставить сомнительную рану открытой и предоставить ей возможность заживать вторичным натяжением или выполнить отсроченное закрытие рапы через 3-5 дней. Отсроченные швы являются тем компромиссом, который часто отличает опытного хирурга от восторженного дилетанта.
10. Обычная частота нагноения при типичных операциях.
Холецистэктомия 3%
Паховое грыжесечение 2%
Аппендэктомия 5%
Торакотомия 6%
Колэктомия 12%
11. Какие микроорганизмы чаще всего являются возбудителями раневой инфекции?
Поскольку стафилококк относится к наиболее распространенному на коже микроорганизму, он также чаще всего вызывает ХРИ. Однако ХРИ в ряде зон ассоциируются с другими микроорганизмами. Если была вскрыта кишка, возбудителями инфекции обычно являются представители семейства Enterobacteriaceae и анаэробы; при рассечении желчных путей и пищевода инфекционными возбудителями, помимо названных микробов, становятся энтерококки. Другие зоны, например мочевыводящие пути или влагалище, содержат такие микроорганизмы как стрептококки группы D, Pseudomonas и Proteus.
12. Как раневая инфекция связана с операцией по времени?
В типичных случаях раневая инфекция развивается на 5-7 день после операции; однако может развиться и молниеносная форма. Инфекции, вызванные клостридиями, развиваются при большом количестве нежизнеспособных тканей в закрытом пространстве и являются классическим примером молниеносной формы ХРИ.
13. Каковы первостепенные лечебные мероприятия при развитии ХРИ?
Первостепенное значение имеет дренирование раны. Дренаж ставится путем раскрытия раны или, в случае глубокой инфекции, под контролем компьютерной томографии (КТ) или ультразвукового исследования (УЗИ). Для лечения флегмоны и генерализованного сепсиса также применяется антибактериальная терапия.
14. Что может произойти, если не лечить поверхностную или глубокую ХРИ?
Местно состояние раны ухудшается, инфекция проникает в глубь тканей и продолжает распространяться. Если инфекция быстро прогрессирует, может развиться некротизирующий фасциит. В конечном итоге края рапы расходятся.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Развитие гнойно-септических осложнений происходит на фоне значительного иммунодефицита (в первую очередь, вследствие кровопотери) и массивного инфицирования ран. Ранения шеи, груди и живота во все времена сопровождались нагноением ран. Мы уже упоминали, что в Средние века частое нагноение огнестрельных ран связывали с проникновением «порохового яда» в организм. Лучшим способом борьбы с ядом считали прижигание ран раскаленным железом или кипящим маслом.
Выдающийся русский хирург Н.А. Вельяминов так излагает в статье о Д. Листере свои впечатления о работе хирургического отделения середины XIX в.: «. сидит группа солдат, подхожу и меня обдает невероятное зловоние; вижу — стоит старое, грязное, ослизлое деревянное ведро, наполненное пропитанными гноем и кровью, снятыми с ран перевязками; рядом на грязном табурете лежит зонд «турундник», пинцет, ножницы, ослизлая зловонная губка, тут же «фербанд» — деревянный ящик с отделениями, в котором клочья ваты, куски марли, корпия, турунда, какие-то подозрительного вида мази, липкий пластырь, спринцовка, баночка с карболовым маслом; фельдшер в очень грязном мундире по очереди, не моя рук, переходит от одного больного к другому и что-то делает — это идет перевязка».
Беспомощность хирургов перед гнойными осложнениями иллюстрирует тот факт, что Н. И. Пирогов был под следствием за то, что в его отделении в Военно-медицинской академии умерли 10 гвардейцев, которым была выполнена венесекция в области локтевого сгиба: на аутопсии был обнаружен распространеный тромбоз вен и флегмона верхних конечностей. Авторитетная комиссия пришла к заключению, что причиной смерти стала не операция, выполненная Н. И. Пироговым, а «распространившаяся с неожиданной силой миазма».
По свидетельству проф. Г. И. Турнера, впервые в России проблему асептики и антисептики поднял Н. В. Склифосовский [цит. по Опелю В. А.].
В настоящее время считается, что проникающие ранения груди и живота без повреждений внутренних органов в первые 6 ч не являются безусловно контаминированными и задержка с хирургическим лечением на этот срок приводит к нагноениям ран лишь в 3 % наблюдений. Ранения полых органов брюшной полости в таких же условиях приводят к нагноению ран в 24% наблюдений.

Обычная раневая инфекция проявляется не ранее 4-5-х суток после травмы в виде появления боли в ране, отека и гиперемии мягких тканей в ее окружности. При снятии швов выделяется гнойный экссудат.
Лечение заключается в санации раны и наружном дренировании. Мы предпочитаем методику активного дренирования ран с промыванием и аспирацией. Антибактериальную терапию назначают лишь в тех случаях, когда у пациента имеются признаки системной воспалительной реакции, либо при присоединении неклостридиальной анаэробной флегмоны в окружности раны.
Массивное загрязнение раны бета-гемолитическим стрептококком или неклостридиальными анаэробами приводит к развитию некротической флегмоны уже к концу первых суток после ранения, особенно в тех случаях, когда хирургическая обработка раны выполняется позже 4-6 ч В таких случаях появляются выраженные болевые ощущения, не соответствующие спокойному внешнему виду раны без видимых признаков воспаления.
Внешние проявления некротического фасциита — геморрагические высыпания, некроз кожи, крепитация — появляются в поздней стадии, в то время как диффузное поражение клетчатки и мышц распространяется на большую глубину без резких границ. Характерны быстро нарастающие признаки тяжелого эндотоксикоза с тахикардией, гипотонией и дыхательной недостаточностью. Промедление с широким вскрытием и санацией пораженных тканей резко повышает уровень летальности. Повторная санация пораженных тканей должна проводиться неоднократно с интервалом в 24-36 ч.
Такие пациенты нуждаются в комплексной интенсивной терапии, включающей антибактериальную деэскалационную терапию карбопенемами и препаратами метронидазола.
Гнойные раны
Гнойные раны – это повреждения кожных покровов и подлежащих тканей с формированием гнойного очага. Патология проявляется значительным отеком, гиперемией окружающих тканей и интенсивным болевым синдромом. Боли могут быть дергающими, распирающими, лишающими сна. В ране видны омертвевшие ткани и скопления гноя. Наблюдается общая интоксикация, сопровождающаяся повышением температуры, ознобами, головной болью, слабостью и тошнотой. Лечение комплексное, включает в себя промывание и дренирование ран (при необходимости производится вскрытие гнойных затеков), лечебные повязки, антибиотикотерапию, дезинтоксикационную терапию, иммунокорригирующую терапию и стимуляцию восстановительных процессов.
МКБ-10
Общие сведения
Гнойная рана – дефект тканей, в просвете которого содержится гнойный экссудат, а по краям определяются признаки воспаления. Гнойные раны являются самым распространенным осложнением чистых ран, как случайных, так и хирургических. По различным данным, несмотря на строгое соблюдение стерильности в ходе операций, количество нагноений в послеоперационном периоде колеблется от 2-3 до 30%. Возбудителями гнойного процесса в случайных и хирургических ранах чаще всего становятся так называемые гноеродные микробы (стафилококки, стрептококки и т. д.). Лечением ранее необработанных гнойных ран занимаются хирурги, лечение случайных ран, нагноившихся после ПХО, осуществляют травматологи-ортопеды. Лечение нагноившихся хирургических ран находится в ведении специалистов, проводивших операцию: хирургов, травматологов, сосудистых хирургов, торакальных хирургов, нейрохирургов и т. д.
Причины
В настоящее время как в травматологии и ортопедии, так и в хирургии принято считать, что любая случайная рана является инфицированной, то есть, содержит определенное количество бактерий. Однако бактериальное загрязнение не обязательно влечет за собой нагноение. Для развития инфекции необходимо сочетание следующих факторов: достаточное повреждение тканей; наличие в полости раны нежизнеспособных тканей, инородных тел и излившейся крови; достаточная концентрация патогенных микроорганизмов. Чаще всего в гнойных ранах обнаруживаются гноеродные бактерии (стрептококки, стафилококки, клебсиеллы, протей, кишечная палочка, псевдомонады и т. д.). Вместе с тем, в ряде случаев гнойный процесс может быть вызван пневмококками, шигеллами, сальмонеллами, микобактериями и т. д.
Согласно результатам проведенных исследований, для развития нагноения в нормальных неповрежденных тканях необходимо сто тысяч микробов на 1 гр. ткани. При определенных условиях «критический уровень» бактериальной обсемененности может снижаться. В случае, если в ране есть инородные тела и свернувшаяся кровь, для нагноения достаточно десяти тысяч микробов на 1 гр. ткани. А при лигатурной ишемии, вызванной нарушением питания тканей в области завязывания лигатуры, критический уровень снижается до одной тысячи микробных тел на 1 гр. ткани.
В числе других факторов, увеличивающих вероятность развития гнойного процесса, - локализация и вид раны, общее состояние организма, наличие соматических заболеваний, сахарного диабета и сосудистых нарушений, возраст, конституция и даже время года. Гнойные раны - частое осложнение случайных колотых, рвано-ушибленных ран и ран, сопровождающихся размозжением мягких тканей. Причиной нагноения колотых ран является затруднение оттока вследствие небольшого отверстия на коже, тонкого и длинного раневого канала. Высокая вероятность нагноения рвано-ушибленных ран и ран с размозжением мягких тканей обусловлена наличием обильных загрязнений и/или большого количества нежизнеспособных тканей. Реже всего, благодаря неглубокому раневому каналу и незначительному повреждению краев, нагнаиваются резаные раны.
Лучше всего заживают раны в области головы и шеи. Несколько чаще нагноение возникает при ранах ягодичной области, спины, груди и живота, еще чаще – при повреждении верхних и нижних конечностей. Хуже всего заживают раны стоп. Хороший иммунитет снижает вероятность развития гнойных ран при незначительном бактериальном осеменении. При значительном осеменении и удовлетворительном состоянии иммунной системы нагноение протекает более бурно, но процесс обычно носит локализованный характер и быстрее завершается выздоровлением. Иммунные нарушения становятся причиной более вялого и длительного заживления гнойных ран. Увеличивается вероятность распространения инфекции и развития осложнений.
Тяжелые соматические заболевания влияют на общее состояние организма и, как следствие – на вероятность нагноения и скорость заживления ран. Однако особенно сильное негативное влияние в силу сосудистых и обменных нарушений оказывает сахарный диабет. У пациентов, страдающих этим заболеванием, гнойные раны могут возникать даже при небольших травмах и незначительном бактериальном осеменении. У таких больных наблюдается плохое заживление и выраженная тенденция к распространению процесса. У здоровых молодых людей раны, в среднем, нагнаиваются реже, чем у пожилых, у худых – реже, чем у полных. Вероятность нагноения раны увеличивается летом, особенно в жаркую и влажную погоду, поэтому плановые операции рекомендуют проводить в холодное время года.
Симптомы гнойных ран
Выделяют местные и общие симптомы патологии. К местным симптомам относится дефект тканей с наличием гнойного экссудата, а также классические признаки воспаления: боль, местное повышение температуры, местная гиперемия, отек окружающих тканей и нарушение функции. Боль при гнойной ране может быть давящей или распирающей. При затруднении оттока (вследствие образования корки, формирования затеков, распространении гнойного процесса), скоплении гноя и повышении давления в воспаленной области боль становится очень интенсивной, дергающей и нередко лишает пациентов сна. Кожа вокруг раны горячая. На начальных стадиях, в период образования гноя, наблюдается покраснение кожных покровов. При длительном существовании раны краснота может сменяться багровой или багрово-синюшной окраской кожи.
В месте поражения можно выделить два типа отека. В краях раны – теплый воспалительный. Совпадает с зоной гиперемии, обусловлен нарушением кровотока. Дистальнее раны – холодный реактивный. Гиперемия в этой зоне отсутствует, а отечность мягких тканей вызвана нарушением оттока лимфы из-за сдавления лимфатических узлов в области воспаления. Нарушение функции пораженного отдела связано с отеком и болью, выраженность нарушения зависит от размеров и локализации гнойной раны, а также от объема и фазы воспаления.
Основным признаком гнойной раны является гной – жидкость, содержащая бактерии, тканевый детрит, глобулины, альбумины, ферменты лейкоцитарного и микробного происхождения, жиры, холестерин, примесь ДНК и погибшие лейкоциты. Цвет и консистенция гноя зависят от вида возбудителя. Для стафилококка характерен густой желтый или белый гной, для стрептококка – жидкий зеленоватый или желтоватый, для кишечной палочки – жидкий буро-желтый, для анаэробных микробов – бурый зловонный, для синегнойной инфекции – желтоватый, отливающий сине-зеленым на повязке (этот оттенок гной приобретает при контакте с кислородом во внешней среде). Количество гноя может существенно различаться. Под гноем могут обнаруживаться участки некротической ткани и грануляции.
Из раны в организм пациента поступают токсины, что обуславливает появление симптомов общей интоксикации. Характерно повышение температуры, потеря аппетита, потливость, слабость, ознобы, головная боль. В анализах крови выявляется ускорение СОЭ и лейкоцитоз со сдвигом влево. В анализе мочи обнаруживается белок. В тяжелых случаях возможно повышение уровня мочевины, креатинина и билирубина в крови, анемия, лейкопения, диспротеинемия и гипопротеинемия. Клинически при тяжелой интоксикации может наблюдаться резкая слабость и нарушения сознания вплоть до комы.
В зависимости от преобладающего процесса выделяют следующие стадии гнойного процесса: формирование гнойного очага, очищение и регенерация, заживление. Все гнойные раны заживают вторичным натяжением.
Осложнения
При гнойных ранах возможен целый ряд осложнений. Лимфангит (воспаление лимфатических сосудов, расположенных проксимальнее раны) проявляется красными полосами, направленными от раны к регионарным лимфатическим узлам. При лимфадените (воспалении лимфатических узлов) регионарные лимфоузлы увеличиваются и становятся болезненными. Тромбофлебит (воспаление вен) сопровождается появлением болезненных красных тяжей по ходу подкожных вен. При контактном распространении гноя возможно развитие гнойных затеков, периостита, остеомиелита, гнойного артрита, абсцесса и флегмоны. Самым тяжелым осложнением гнойных ран является сепсис.
Если заживления не происходит, гнойная рана может перейти в хроническую форму. Зарубежные специалисты рассматривают раны без тенденции к заживлению в течение 4 и более недель, как хронические. К числу таких ран относят пролежни, трофические язвы, случайные или операционные длительно незаживающие раны.
Диагностика
Из-за наличия явных местных признаков диагностика гнойных ран не представляет затруднений. Для исключения вовлеченности подлежащих анатомических структур может выполняться рентгенография, МРТ или КТ пораженного сегмента. В общем анализе крови определяются признаки воспаления. Для определения вида и чувствительности возбудителя производится посев отделяемого на питательные среды.
Лечение гнойных ран
Тактика лечения зависит от фазы раневого процесса. На стадии формирования гнойного очага основной задачей хирургов является очищение раны, ограничение воспаления, борьба с патогенными микроорганизмами и детоксикация (при наличии показаний). На второй стадии проводятся мероприятия по стимуляции регенерации, возможно наложение ранних вторичных швов или проведение кожной пластики. На стадии закрытия раны осуществляется стимуляция образования эпителия.
При наличии гноя проводится хирургическая обработка, включающая в себя рассечение краев раны или кожи над очагом, удаление гноя, исследование раны для выявления затеков и, при необходимости – вскрытие этих затеков, удаление некротических тканей (некрэктомию), остановку кровотечения, промывание и дренирование раны. Швы на гнойные раны не накладывают, наложение редких швов допускается только при организации проточно-промывного дренирования. Наряду с традиционными методами лечения гнойных ран применяются современные методики: вакуум-терапия, местная озонотерапия, гипербарическая оксигенация, обработка с использованием лазера, ультразвуковая обработка, криовоздействие, обработка пульсирующей струей антисептика, введение в рану сорбентов и т. д.
По показаниям осуществляется детоксикация: форсированный диурез, инфузионная терапия, экстракорпоральная гемокоррекция и т. п. Все перечисленные мероприятия, как традиционные, так и современные, проводятся на фоне рациональной антибиотикотерапии и иммунокоррекции. В зависимости от тяжести процесса антибиотики могут назначаться перорально, внутримышечно или внутривенно. В первые дни используются препараты широкого спектра действия. После определения возбудителя антибиотик заменяют с учетом чувствительности микроорганизмов.
После очищения гнойной раны предпринимаются меры для восстановления анатомических взаимоотношений и закрытия раны (ранние и поздние вторичные швы, кожная пластика). Наложение вторичных швов показано при отсутствии гноя, некротических тканей и выраженного воспаления окружающих тканей. При этом необходимо, чтобы края раны можно было сопоставить без натяжения. При наличии дефекта тканей и невозможности сопоставить края раны выполняется кожная пластика с использованием островкового и марочного способов, пластика встречными лоскутами, пластика свободным кожным лоскутом или пластика кожным лоскутом на сосудистой ножке.
Раневая инфекция
Раневая инфекция – это комплекс общих и местных патологических проявлений, возникающих при развитии инфекции в случайных или операционных ранах. Патология проявляется болью, ознобом, лихорадкой, увеличением регионарных лимфатических узлов и лейкоцитозом. Края раны отечные, гиперемированные. Наблюдается выделение серозного или гнойного отделяемого, в отдельных случаях образуются участки некроза. Диагноз выставляется на основании анамнеза, клинических признаков и результатов анализов. Лечение комплексное: вскрытие, перевязки, антибиотикотерапия.
Раневая инфекция – осложнение раневого процесса, обусловленное развитием патогенной микрофлоры в полости раны. Все раны, в том числе и операционные, как в гнойной хирургии, так и в травматологии считаются первично загрязненными, поскольку какое-то количество микробов попадает на раневую поверхность из воздуха даже при безукоризненном соблюдении правил асептики и антисептики. Случайные раны загрязнены сильнее, поэтому в таких случаях источником инфекции обычно является первичное микробное загрязнение. При операционных ранах на первый план выступает эндогенное (из внутренней среды организма) или внутригоспитальное (вторичное) инфицирование.
В большинстве случаев возбудителем инфекции в случайных ранах становится стафилококк. Редко в качестве основного возбудителя выступает протей, кишечная и синегнойная палочка. В 0,1% случаев встречается анаэробная инфекция. Через несколько дней пребывания в стационаре флора меняется, в ране начинают преобладать устойчивые к антибактериальной терапии грамотрицательные бактерии, которые обычно становятся причиной развития раневой инфекции при вторичном инфицировании как случайных, так и операционных ран.
Раневая инфекция развивается в случае, когда количество микробов в ране превышает некий критический уровень. При свежих травматических повреждениях у ранее здорового человека этот уровень составляет 100 тыс. микроорганизмов на 1 г ткани. При ухудшении общего состояния организма и определенных особенностях раны этот порог может существенно снижаться.
К числу местных факторов, повышающих вероятность развития раневой инфекции, относится присутствие в ране инородных тел, сгустков крови и некротических тканей. Также имеет значение плохая иммобилизация при транспортировке (становится причиной дополнительной травмы мягких тканей, вызывает ухудшение микроциркуляции, увеличение гематом и расширение зоны некроза), недостаточное кровоснабжение поврежденных тканей, большая глубина раны при малом диаметре раневого канала, наличие слепых карманов и боковых ходов.
Общее состояние организма может провоцировать развитие раневой инфекции при грубых расстройствах микроциркуляции (централизация кровообращения при травматическом шоке, гиповолемические расстройства), нарушениях иммунитета вследствие недостаточного питания, нервного истощения, химических и радиационных поражений, а также хронических соматических заболеваний. Особенно значимы в таких случаях злокачественные новообразования, лейкемия, уремия, цирроз, сахарный диабет и ожирение. Кроме того, снижение сопротивляемости инфекции наблюдается при проведении лучевой терапии и при приеме ряда лекарственных средств, в том числе – иммунодепрессантов, стероидов и больших доз антибиотиков.
Классификация
В зависимости от преобладания тех или иных клинических проявлений гнойные хирурги выделяют две общие формы раневой инфекции (сепсис без метастазов и сепсис с метастазами) и несколько местных. Общие формы протекают тяжелее местных, вероятность летального исхода при них повышается. Самой тяжелой формой раневой инфекции является сепсис с метастазами, который обычно развивается при резком снижении сопротивляемости организма и раневом истощении вследствие потери больших количеств белка.
К числу местных форм относятся:
- Инфекция раны. Является локализованным процессом, развивается в поврежденных тканях с пониженной сопротивляемостью. Зона инфицирования ограничена стенками раневого канала, между ней и нормальными живыми тканями есть четкая демаркационная линия.
- Околораневой абсцесс. Обычно соединен с раневым каналом, окружен соединительнотканной капсулой, отделяющей участок инфекции от здоровых тканей.
- Раневая флегмона. Возникает в случаях, когда инфекция выходит за пределы раны. Демаркационная линия исчезает, процесс захватывает прилежащие здоровые ткани и проявляет выраженную тенденцию к распространению.
- Гнойный затек. Развивается при недостаточном оттоке гноя вследствие неадекватного дренирования или зашивании раны наглухо без использования дренажа. В подобных случаях гной не может выйти наружу и начинает пассивно распространяться в ткани, образуя полости в межмышечных, межфасциальных и околокостных пространствах, а также в пространствах вокруг сосудов и нервов.
- Свищ. Образуется на поздних стадиях раневого процесса, в случаях, когда на поверхности рана закрывается грануляциями, а в глубине сохраняется очаг инфекции.
- Тромбофлебит. Развивается через 1-2 мес. после повреждения. Является опасным осложнением, обусловлен инфицированием тромба с последующим распространением инфекции по стенке вены.
- Лимфангит и лимфаденит. Возникают вследствие других раневых осложнений, исчезают после адекватной санации основного гнойного очага.
Симптомы раневой инфекции
Как правило, патология развивается спустя 3-7 дней с момента ранения. К числу общих признаков относится повышение температуры тела, учащение пульса, ознобы и признаки общей интоксикации (слабость, разбитость, головная боль, тошнота). В числе местных признаков – пять классических симптомов, которые были описаны еще во времена Древнего Рима врачом Аулусом Корнелиусом Сельсусом: боль (dolor), местное повышение температуры (calor), местное покраснение (rubor), отек, припухлость (tumor) и нарушение функции (functio laesa).
Характерной особенностью болей является их распирающий, пульсирующий характер. Края раны отечны, гиперемированы, в полости раны иногда имеются фибринозно-гнойные сгустки. Пальпация пораженной области болезненна. В остальном симптоматика может варьироваться в зависимости от формы раневой инфекции. При околораневом абсцессе отделяемое из раны нередко незначительное, наблюдается выраженная гиперемия краев раны, резкое напряжение тканей и увеличение окружности конечности. Образование абсцесса сопровождается снижением аппетита и гектической лихорадкой.
При раневых флегмонах выявляется существенное повышение местной температуры и резкое ухудшение состояния больного, однако рана выглядит относительно благополучно. Формирование гнойного затека также сопровождается значительным ухудшением состояния пациента при относительном благополучии в области раны. Температура повышается до 40 градусов и более, отмечаются ознобы, вялость, адинамия и снижение аппетита. Гнойное отделяемое отсутствует или незначительное, гной выделяется только при надавливании на окружающие ткани, иногда – удаленные от основного очага инфекции. При свищах общее состояние остается удовлетворительным или близким к удовлетворительному, на коже формируется свищевой ход, по которому оттекает гнойное отделяемое.
Осложнения обусловлены распространением инфекции. При гнойных тромбофлебитах общее состояние ухудшается, в зоне поражения определяются умеренные признаки воспаления, при расплавлении стенки вены возможно формирование флегмоны или абсцесса. Лимфангит и лимфаденит проявляются болезненностью, отечностью мягких тканей и гиперемией кожи в проекции лимфатических узлов и по ходу лимфатических сосудов. Отмечается ухудшение общего состояния, ознобы, гипертермия и повышенное потоотделение. При сепсисе состояние тяжелое, кожа бледная, наблюдается снижение АД, выраженная тахикардия, бессонница и нарастающая анемия.
Лечение раневой инфекции
Лечение заключается в широком вскрытии и дренировании гнойных очагов, а также промывании раны антисептиками. В последующем при перевязках используются сорбенты и протеолитические ферменты. В фазе регенерации основное внимание уделяется стимуляции иммунитета и защите нежных грануляций от случайного повреждения. В фазе эпителизации и рубцевания при больших, длительно незаживающих ранах выполняют кожную пластику.
Прогноз и профилактика
Прогноз определяется тяжестью патологии. При небольших ранах исход благоприятный, наблюдается полное заживление. При обширных глубоких ранах, развитии осложнений требуется длительное лечение, в ряде случаев возникает угроза для жизни. Профилактика раневой инфекции включает в себя раннее наложение асептической повязки и строгое соблюдение правил асептики и антисептики в ходе операций и перевязок. Необходима тщательная санация раневой полости с иссечением нежизнеспособных тканей, адекватным промыванием и дренированием. Пациентам назначают антибиотики, проводят борьбу с шоком, алиментарными нарушениями и белково-электролитными сдвигами.
Читайте также:
- Лечение аневризмы аорты. Окклюзионные поражения ветвей дуги аорты
- Порог ощущения вестибулярного аппарата. Калорический раздражитель вестибулярного анализатора
- Лечение отравления контрастными веществами
- Лучевая диагностика синовиальной кисты дугоотростчатого сустава позвоночника
- Прототекоз и его лечение
