Нарушения регуляции генов факторами транскрипции: полисиндактилия
Добавил пользователь Владимир З. Обновлено: 18.01.2026
В статье представлены современные данные о роли мутаций гена филаггрина в формировании аллергических болезней.
The article presents current data of the role of filaggrina gene mutations in the formation of allergic diseases in children.
На сегодняшний день установлено, что мутации гена филаггрина (FLG) являются важными генетическими факторами риска развития атопического дерматита (АтД). Филаггрин — это один из ключевых белков, присутствующий в эпидермисе кожи уже на третьем месяце жизни ребенка и препятствующий потере воды через роговой слой [1, 2].
Ранее показано, что «атопический марш» предполагает тенденцию развития пищевой аллергии, бронхиальной астмы (БА) и аллергического ринита (АР) у больных с АтД. При этом мутации гена FLG являются факторами риска на каждом шаге в пролонгированном процессе: формирование АтД [3], аллергической сенсибилизации [4], БА у больных с АтД [5] и АР [6]. Таким образом, мутации гена FLG являются важным фактором риска реализации атопии в целом, но с разными шансами для конкретного фенотипа [7].
Тесная связь между мутациями гена FLG и АтД стала важной вехой в генетическом исследовании аллергических заболеваний [7]. Мутации гена FLG объясняют пониженную экспрессию FLG и продуктов его деградации у пациентов с АтД [2]. В настоящее время мутации гена FLG рассматривают как основной фактор риска развития АтД [8, 9], особенно у пациентов с ранним его началом (до 2 лет жизни) и больных с персистирующей БА [10].
В 2006 г. впервые обнаружены две нулевые мутации, р.R501X и с.2282del4, гена FLG у пациентов с вульгарным ихтиозом (наследственным заболеванием, связанным с нарушением кератинизации) в 15 семьях шотландского, ирландского и американцев европеоидного происхождения [3, 11]. При более детальном исследовании привлек внимание факт наличия у нескольких членов семей с ихтиозом также и АтД [12].
Впервые C. N. Palmer и соавт. [13] сообщили о снижении или отсутствии экспрессии гена FLG вследствие мутаций, связанных с потерей его функций, что ведет к нарушению эпидермального барьера и клиническим проявлениям АтД. На сегодняшний день идентифицировано около 40 мутаций гена FLG в европейских и азиатских популяциях [12–14].
Распространенность мутаций гена FLG различается по странам Европы, но р.R501X и с.2282del4 являются двумя наиболее часто встречающимися и имеющими существенную связь с АтД по всему континенту [15]. Однако в Италии данные мутации редки (частота аллелей менее 1%). Таким образом, в различных популяциях к АтД могут предрасполагать различные генетические факторы, что определяет необходимость дальнейшего детального изучения [3, 16].
Большинство исследований показали, что мутации гена FLG ассоциированы с АтД и БА или только с АтД [17–19]. В европейской популяции у носителей мутаций гена FLG (р.R501X и с.2282del4) шанс заболеть АтД практически в 5 раз выше (ОШ = 4,78, 95% ДИ [3,31–6,92]) в сравнении с контролем (ОШ = 1,99, 95% ДИ [1,72–2,31]) [4].
Последние исследования демонстрируют статистически значимую ассоциацию мутаций гена FLG с астмой (ОШ = 1,48, 95% ДИ [1,32–1,66]), но при этом БА сочеталась с АтД (ОШ = 1,11, 95% ДИ [0,88–1,41]) [15]. В японской когорте спектр мутаций гена FLG практически полностью отличается от европейцев и североамериканцев [7]. Только две мутации (р.R501X и р.E2422X) определялись как у европейского, так и у азиатского населения [20, 21].
Исследования, проведенные в РФ, в выборке пациентов с АтД выявили частоту делеции с.2282del4, равной 9,1% (Т. И. Саликова и соавт.). Кроме того, показано, что в Республике Башкортостан данная мутация выявлена у 12,3% больных АтД и лишь у 2,23% индивидов контрольной группы [22]. Ученые из ближнего зарубежья, изучая частоту мутации с.2282del4 у больных аллергодерматозами, обнаружили данную делецию у 9,9% пациентов [23].
В научной литературе также имеются данные об ассоциации мутации с.2282del4 гена FLG с АтД, АР и развитием БА у детей. Ряд авторов указывает на статистически значимую ассоциацию делеции с.2282del4 гена FLG с АР, причем как без АтД (ОШ = 1,78, 95% ДИ [1,16–2,73]), так и при его наличии (ОШ = 2,84, 95% ДИ [2,08–3,88]) [4, 24].
Ген FLG находится в хромосомной области 1q21 в составе эпидермального дифференцировочного комплекса (ЭДК), представляющего собой массивный кластер генов, охватывающий регион около 1,9 млн пар нуклеотидов геномной ДНК человека и принимающий участие в терминальной дифференцировке эпидермиса и образовании рогового слоя [7, 25]. В данном регионе идентифицировано около 45 генов [12]. Там же расположены гены, кодирующие белки, участвующие в формировании рогового конверта: прекурсоры лорикрина, инволюкрина и малых пролин-богатых белков. Другие гены ЭДК кодируют белки, связанные с синтезом профилаггрина и трихохиалина, а также семейство S100A кальцийсвязывающих белков [25]. Таким образом, ЭДК является группой структурно и эволюционно связанных генов, при тесном сотрудничестве которых протекает сложный механизм дифференцировки эпидермиса, нарушение которого ведет к развитию АтД [12].
Термин «филаггрин» (от англ. filament aggregating protein — филамент, агрегирующий белок) впервые введен в 1981 г. для описания класса структурных белков рогового слоя эпидермиса [1]. На ультраструктурном уровне выявлено, что потеря функции гена FLG связана с дезорганизацией нитей кератина, нарушением синтеза ламеллярных телец и архитектоники пластинчатого бислоя [5].
Филаггрин способствует образованию белково-липидного конверта ороговевших клеток, который заменяет плазматическую мембрану при дифференциации кератиноцитов, перекрестно связанных трансглутаминазой. При этом образуется барьер, предотвращающий потерю воды и минимизирующий проникновение аллергенов и микроорганизмов [3].
Ген профилаггрин/филаггрин состоит из трех экзонов и двух интронов. Большая часть белка ЭДК кодируется в третьем экзоне, который является самым большим (более 12 т. п.н.). Филаггрин образуется из профилаггрина и является ключевым белком, способствующим терминальной дифференцировке эпидермиса и образованию защитного барьера кожи [1, 7]. Профилаггрин представляет собой высокофосфорилированный, гистидин-богатый белок с молекулярной массой около 500 кДа [26]. Наибольшее его количество расположено не выше двух слоев рогового слоя. Профилаггрин «хранится» в виде неактивной формы в нерастворимых гранулах кератогиалина зернистого слоя эпидермиса. При увеличении уровня кальция происходит дегрануляция кератогиалиновых гранул [1, 5]. При этом профилаггрин подвергается дефосфорилированию с образованием 10–12 практически идентичных, с массой около 37 кДа, пептидов филаггрина [27], которые связывают кератиновые филаменты. Это приводит к «сжатию» клеток зернистого слоя эпидермиса в сплюснутые чешуйки. Такой цитоскелет вместе с прикрепленными белками и компонентами мембраны претерпевает пространственное перекрестное сцепление с формированием ороговевшей клеточной оболочки — наружного барьерного слоя кожи [26]. Филаггрин участвует в аггрегации кератиновых тонофиламентов, образуя между ними аморфный матрикс. К ним присоединяются белки, полисахариды, липиды, аминокислоты, высвобождающиеся при начинающемся здесь (под влиянием гидролитических ферментов кератиносом и лизосом) распаде ядер и органелл. В итоге образуется сложное по составу соединение кератогиалин [27]. Далее, с помощью различных протеаз, филаггрин подвергается дальнейшей деградации до свободных аминокислот и их производных [1]. Свободные аминокислоты катаболизируются до составных компонентов «натурального увлажняющего фактора», таких как молочная, пирролидонкарбоксильная и уроканиновая кислоты, а также мочевина. Совместно они способствуют гидратации эпидермиса, тем самым повышая барьерную функцию кожи [3]. Кроме того, продукты распада FLG вносят вклад в формирование определенной кислотности кожи. Так, трансуроканиновая и пирролидонкарбоновая кислоты помогают поддерживать определенный градиент рН эпидермиса. Об этом свидетельствует более высокое поверхностное рН эпидермиса при наличии мутаций гена FLG [9].
«Кислотная мантия» рогового слоя обладает противомикробным эффектом. Доказано, что продукты распада филаггрина оказывают тормозящее влияние на рост золотистого стафилококка [28]. Также он изменяет активность целого каскада сериновых протеаз, необходимых для скоординированной эпидермальной дифференцировки и образования рогового конверта [3].
Имеются данные о возможной роли продуктов распада филаггрина в защите от УФ-лучей. В результате фотоизомеризации трансцисуроканиновой кислоты возникают молекулы спектра действия 280–310 нм, находящиеся в диапазоне ультрафиолетовой радиации. Более того, in vitro доказано, что цисуроканиновая кислота обладает иммуномодулирующим действием в человеческих кератиноцитах и лейкоцитах [3].
Филаггрин экспрессируется в коже, переднем преддверье носа и слизистой оболочке рта, но не в респираторном эпителии дыхательных путей или эпителии пищевода [6, 29]. Несмотря на то, что мутации FLG не носят органоспецифического характера, тем не менее есть основания полагать, что они косвенно участвуют в развитии атопических заболеваний «отдаленных» органов. Ассоциация мутаций FLG с другими атопическими нарушениями, вероятно, происходит именно в результате чрескутанной сенсибилизации аллергенами и/или вторично, посредством системного, иммунологического механизма стимуляции через нарушенный кожный барьер [7, 29].
Более того, факт, что БА встречается только у индивидов-носителей мутаций гена FLG с АтД, подтверждает гипотезу о том, что БА является вторичной по отношению к аллергической сенсибилизации, произошедшей после нарушения эпидермального барьера. Мутации гена FLG, по всей видимости, играют роль в хронизации заболевания и IgE-сенсибилизации у пациентов с АтД [19].
Таким образом, предположительно дефицит FLG в коже может предрасполагать к БА у детей c АтД, увеличивая риск сенсибилизации к аэроаллергенам. Однако не следует полагать, что развитие БА является неизбежностью даже у гомозиготных носителей мутаций гена FLG, приводящих к изменению его функции. Кроме того, даже у детей, сенсибилизированных аэроаллергенами, данные мутации следует рассматривать как обязательную предпосылку для развития АтД или БА [29]. Несмотря на то, что до 30% пациентов европейских когорт с АтД имеют нулевые мутации гена FLG, маловероятно, что только это может объяснить увеличение трансэпидермальной воды, которое наблюдается почти у всех пациентов с АтД в активной стадии болезни [30]. Более того, около 40% индивидов-носителей мутации гена FLG вообще не страдают АтД (среди здоровых лиц Северной Европы частота носительства мутаций достигает 12%) [31]. В связи с этим возникает предположение, что только присутствие мутаций гена FLG недостаточно для реализации АтД и/или Th2-адаптивного иммунного ответа. Очевидно, что определенную роль играют и другие генетические дефекты, а также факторы окружающей среды. Вероятно, существуют и такие нарушения эпидермального барьера, которые вносят вклад и/или модулируют эпикутанную сенсибилизацию, что приводит к формированию атопического фенотипа [31].
Таким образом, механизмы, с помощью которых мутации гена FLG вызывают заболевания дыхательных путей, до конца еще не ясны. Чрескожная сенсибилизация и вторичные иммунологические эффекты индукции Th2-цитокинов в эпителии — это только гипотезы, которые требуют дальнейшего детального исследования [7, 19].
Литература
- Sandilands A., Sutherland C., Irvine A. et al. Filaggrin in the frontline: role in skin barrier function and disease // J. Cell. Sci. 2009. Vol. 122. Р. 1285–1294.
- Kezic S., Kemperman P. M., Koster E. S. et al. Loss-of-function mutations in the? laggrin gene lead to reduced level of natural moisturizing factor in the stratum corneum // J. Invest. Dermatol. 2008. Vol. 128 (8). Р. 2117–2119.
- Brown S. J., McLean W. H. One remarkable molecule: filaggrin // J. Invest. Dermatol. 2012. Vol. 132. Р. 751–762.
- Van den Oord R. A., Sheikh A. Filaggrin gene defects and risk of developing allergic sensitisation and allergic disorders: systematic review and meta-analysis // Br. Med. J. 2009. Vol. 339. Р. 1–12.
- Brown S. J., Relton C. L., Liao H. et al. Filaggrin null mutations and childhood atopic eczema: a population-based case-control study // J. Allergy Clin. Immunol. 2008. Vol. 121 (4). Р. 940–946.
- Weidinger S., O’Sullivan M., Illig T. et al. Filaggrin mutations, atopic eczema, hay fever, and asthma in children // J. Allergy Clin. Immunol. 2008. Vol. 121. Р. 1203–209.
- Osawa R., Akiyama M., Shimizu H. Filaggrin gene defects and the risk of developing allergic disorders // Allergol. Int. 2011. Vol. 60. Р. 1–9.
- Flohr С., Mann J. New insights into the epidemiology of childhood atopic dermatitis // Allergy. 2014. Vol. 69 (1). Р. 3–16.
- Jungersted J. M., Scheer H., Mempel M. et al. Stratum corneum lipids, skin barrier function and filaggrin mutations in patients with atopic eczema // Allergy. 2010. Vol. 65. Р. 911–918.
- Stemmler S., Parwez Q., Petrasch-Parwez E. et al. Two common loss–of–function mutations within the filaggrin gene predispose for early onset of atopic dermatitis // J. Invest. Dermatol. 2007. Vol. 127. Р. 722–724.
- Smith F. J., Irvine A. D., Terron-Kwiatkowski A. et al. Loss-of-function mutations in the gene encoding filaggrin cause ichthyosis vulgaris // Nat. Genet. 2006. Vol. 38 (3). Р. 337–342.
- Hoffjan S., Stemmler S. On the role of the epidermal differentiation complex in ichthyosis vulgaris, atopic dermatitis and psoriasis // Br. J. Dermatol. 2007. Vol. 157. Р. 441–449.
- Palmer C. N., Irvine A. D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. 2006. Vol. 38 (4). Р. 441–446.
- Akiyama M. FLG mutations in ichthyosis vulgaris and atopic eczema: spectrum of mutations and population genetics // Br. J. Dermatol. 2010. Vol. 162. Р. 472–477.
- Rodríguez E., Baurecht H., Herberich E. et al. Meta-analysis of filaggrin polymorphisms in eczema and asthma: robust risk factors in atopic disease // J. Allergy Clin. Immunol. 2009. Vol. 123. Р. 1361–1370.
- Cascella R., Cuzzola V. F., Lepre T. et al. Full sequencing of the FLG gene in Italian patients with atopic eczema: evidence of new mutations, but lack of an association // J. Invest. Dermatol. 2011. Vol. 131 (4). Р. 982–984.
- Ziyab A. H., Karmaus W., Zhang H. et al. Association of filaggrin variants with asthma and rhinitis: is eczema or allergic sensitization status an effect modifier? // Int. Arch. Allergy Immunol. 2014. Vol 164 (4). Р. 308–318.
- Morar N., Cookson W. O., Harper J. I., Moffatt M. F. Filaggrin mutations in children with severe atopic dermatitis // J. Invest. Dermatol. 2007. Vol. 127. Р. 1667–1672.
- Barker J. N., Palmer C. N., Zhao Y. et al. Null mutations in the? laggrin gene (FLG) determine major susceptibility to early-onset atopic dermatitis that persists into adulthood // J. Invest. Dermatol. 2007. Vol. 127 (3). Р. 564–567.
- Hamada T., Sandilands A., Fukuda S. et al. De novo occurrence of the filaggrin mutation p.R501x with prevalent mutation c.3321 dela in a Japanese family with ichthyosis vulgaris complicated by atopic dermatitis // J. Invest. Dermatol. 2008. Vol. 128. Р. 1323–1325.
- Chen H., Ho J. C., Sandilands A. et al. Unique and recurrent mutations in the filaggrin gene in Singaporean Chinese patients with ichthyosis vulgaris // J. Invest. Dermatol. 2008. Vol. 128. Р. 1669–1675.
- Гималова Г. Ф. Исследование молекулярно-генетических основ атопического дерматита. Автореф. дис. … канд. биол. наук. Уфа, 2013. 23 с.
- Зуева М. И. Мутации R501 X и 2282 del4 гена FLG у больных аллергодерматозами // Вісник Харківського національного університету імені В. Н. Каразіна. 2011. № 947. С. 93–97.
- Ohshima Y., Yamada A., Hiraoka M. et al. Early sensitization to house dust mite is a major risk factor for subsequent development of bronchial asthma in Japanese infants with atopic dermatitis: results of a 4–year follow–up study // Ann. Allergy Asthma Immunol. 2002. Vol. 89 (3). Р. 265–270.
- Mischke D., Korge B. P., Marenholz I. et al. Genes encoding structural proteins of epidermal cornification and S100 calcium-binding proteins form a gene complex («epidermal differentiation complex») on human chromosome 1q21 // J. Invest. Dermatol. 1996. Vol. 106 (5). Р. 989–992.
- Карунас А. С., Гималова Г. Ф., Федорова Ю. Ю. и др. Анализ ассоциации мутаций в гене профилаггрина с развитием аллергических заболеваний в Республике Башкортостан // Медицинская генетика. 2012. № 1. С. 40–46.
- Michael J. C., Simon G. D., Yiannis V. et al. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009. Vol. 129. Р. 1892–1908.
- Miajlovic H., Fallon P. P., Irvine A. D., Foster T. J. Effect of filaggrin breakdown products on growth of and protein expression by Staphylococcus aureus // J. Allergy Clin. Immunol. 2010. Vol. 126 (6). Р. 1184–1190.
- Ying S., Meng Q., Corrigan C. J., Lee T. H. Lack of filaggrin expression in the human bronchial mucosa // J. Allergy Clin. Immunol. 2006. Vol. 118. Р. 1386–1388.
- Gupta J., Grube E., Ericksen M. B. et al. Intrinsically defective skin barrier function in children with atopic dermatitis correlates with disease severity // J. Allergy Clin. Immunol. 2008. Vol. 121. Р. 725–730.
- Benedetto A. De, Kubo A., Beck L. A. Skin barrier disruption — a requirement for allergen sensitization? // J. Invest. Dermatol. 2012. Vol. 132 (3). Р. 949–963.
С. В. Левашева 1
Э. И. Эткина, доктор медицинских наук, профессор
Л. Л. Гурьева, кандидат медицинских наук
Л. И. Бабенкова, кандидат медицинских наук
А. Р. Бикташева, кандидат медицинских наук
Н. А. Орлова, кандидат медицинских наук
А. А. Фазылова, кандидат медицинских наук
Г. Д. Сакаева, кандидат медицинских наук
Л. Я. Данилова
С. Э. Якута
Нарушения регуляции генов факторами транскрипции: полисиндактилия
Нарушения взаимодействия механизмов развития в эмбриогенезе: синдромы Грейга, Паллистера-Холла, Горлина, Рубинштейна-Тэйби
Процесс эмбриогенеза предполагает согласование многочисленных процессов развития, включая пролиферацию, дифференцировку, миграцию и апоптоз, каждый из которых играет свою роль. Например, для преобразования массы мезодермы в сердце или слоя нейроэктодермы в спинной мозг должно произойти множество процессов.
Чтобы понять, как эти процессы взаимодействуют друг с другом, эволюционные биологи обычно изучают эмбриогенез на модельных организмах, например червях, мухах или мышах. Общие принципы, выявленные на примере этих простых и легко управляемых систем, можно затем использовать для понимания процессов развития у человека.
Конечность позвоночных животных — сравнительно простой и хорошо изученный продукт процессов развития. Не существует геномного представления для руки, где было бы точно прописано, что она около 1 м длиной, с одной проксимальной костью, двумя костями в предплечье и 27 костями в кисти. Вместо этого конечность проходит серию регуляционных процессов, определяющих развитие вдоль трех осей: проксимальнодистальной, дорсальновентральной и переднезадней.
Конечности начинают развиваться как выступы пролиферирующих клеток — почка конечности — вдоль бокового края мезодермы эмбриона человека на 4-й нед развития. Позиция каждой почки конечности вдоль продольной оси эмбриона (ось головахвост) определяется экспрессией в каждом положении специфических факторов транскрипции (TbX4 для нижних и TbX5 для верхних конечностей), вызванной различными комбинациями лигандов FGF. Таким образом, первоначально пролиферативный процесс роста почки конечности активизируется факторами роста и транскрипции.
Почка конечности первоначально растет наружу, расширяясь в стороны от проксимальнодистальной оси конечности. Хотя наиболее очевидный процесс — проксимальнодистальный рост конечности, вскоре после начала роста почки конечности также устанавливаются две другие оси. Переднезадняя ось устанавливается вскоре после начала роста почки конечности, большой палец считается «передней» структурой, так как он находится на краю конечности, контактирующей с верхней частью тела.

Мизинец рассматривается как «заднее» образование, поскольку он находится на стороне почки конечности, расположенной на стороне нижней части тела. При образовании конечности морфоген SHH экспрессируется в «заднем» участке развивающейся почки конечности, формируя градиент уровня экспрессии, первично определяющий установку переднезадней оси развивающейся конечности.
Нарушения в создании переднезадней оси конечности приводят к патологии формирования пальцев типа полидактилии или неразделению пальцев, синдактилиям. Также устанавливается дорсальновентральная ось, заканчиваясь на ладони или подошве на вентральной стороне кисти и стопы соответственно.
Теперь, зная молекулярные основы биологии развития, можно понять механизмы, лежащие в основе синдромов врожденных пороков человека. Например, мутации в гене фактора транскрипции GLI3 определяют причину двух плейотропных синдромов пороков развития, синдрома цефалополисиндактилии Грейга (GCPS) и синдрома Паллистера-Холла. Эти два синдрома включают различающиеся комбинации аномалий конечностей, ЦНС, черепно-лицевой области, дыхательных и мочеполовых путей, вызванных нарушенным балансом синтеза двух различных форм фактора GLI3, названных GLI3 и GLI3R.
GLI3 - часть сигнального пути фактора SHH. Сигнал SHH частично проходит через поверхностные рецепторы клетки, кодируемые геном, названным РТСН1. Мутации в гене РТСН1 вызывают синдромом базальноклеточной невусной карциномы, или синдромом Горлина. Он включает черепно-лицевые аномалии и иногда полидактилию, сходные с наблюдаемыми при синдроме GCPS, но, кроме того, при синдроме Горлина также обнаруживают кисты зубов и восприимчивость к базально-клеточной карциноме.
Сравнивая синдромы Горлина и Грейга, можно увидеть, что в обоих случаях совпадают фенотипические проявления, поскольку гены, поврежденные при данных заболеваниях, имеют перекрывающиеся эффекты в одном и том же генетическом пути развития. Третий белок сигнального пути SHH, белок CREB или СВР, — коактиватор фактора транскрипции GLI3. Мутации в СВР вызывают синдром Рубинштейна-Тэйби, также имеющий общие фенотипические проявления с синдромами Горлина и Грейга.
Можно привести множество других примеров, но важно подчеркнуть, что гены — первичные регуляторы процессов развития, их белковые продукты функционируют на генетических путях развития, и эти пути используются во взаимосвязанных процессах во множестве систем органов. Понимание молекулярных основ функции генов и того, как функции организованы в модули, а также того, как аномалии в модулях вызывают пороки развития и плейотропные синдромы, формирует основу современного клинического метода при врожденных пороках человека.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Далее в статьях на нашем сайте МедУнивер мы рассмотрим основные клеточные и молекулярные механизмы, регулирующие развитие, проиллюстрируем каждый механизм врожденным пороком или болезнью человека, вызванными нарушениями каждого из этих механизмов.
Фундаментальные механизмы, действующие в ходе развития:
• Регуляция генов факторами транскрипции.
• Межклеточная передача сигналов через прямой контакт и морфогены.
• Индукция формы и полярности клеток.
• Перемещение клеток.
• Программируемая смерть клеток.
Регуляция генов факторами транскрипции
Факторы транскрипции управляют развитием, изменяя экспрессию генов, в том числе других факторов транскрипции. Группы функционирующих вместе факторов транскрипции называются транскрипционными регуляторными модулями, и разделение функций этих модулей — важная задача генетики развития.
Некоторые факторы транскрипции активируют целевые гены, другие — подавляют их. Еще другие факторы транскрипции имеют функции как активаторов, так и репрессоров (так называемые бифункциональные факторы транскрипции). Регуляторные модули управляют развитием, заставляя различные комбинации факторов транскрипции экспрессироваться в разных местах и в разное время, что изменяет пространственно-временные показатели развития.
Направляя дифференциальную экспрессию генов в пространстве и во времени, транскрипционные регуляционные модули оказываются центральным элементом развития эмбриона.
Транскрипционный регуляторный комплекс состоит из множества общих факторов транскрипции, соединяемых со специфическими факторами, отвечающими за избирательность транскрипционного комплекса. Большинство общих факторов транскрипции обнаружены в тысячах транскрипционных комплексов по всему геному, и хотя каждый из них необходим, их роль в развитии неспецифична.
Специфические факторы транскрипции также участвуют в формировании комплексов факторов транскрипции, но только в определенных клетках или в определенное время развития, обеспечивая тем самым тонкую регуляцию экспрессии генов и соответственно процессов развития.
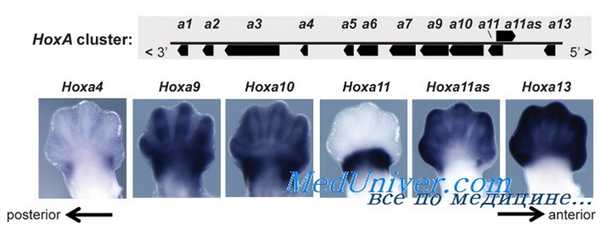
Значение факторов транскрипции для нормального развития видно на примере необычной мутации Нох D13, вызывающей полисиндактилию — неполно доминантное заболевание. Гетерозиготы имеют межфаланговые перепонки и дополнительные пальцы кистей и стоп. Редкие гомозиготы имеют аналогичные, но более выраженные аномалии, а также порок развития костей рук, запястий, стоп и щиколоток.
Мутация Нох D13, вызывающая полисиндактилию, вызвана экспансией полиаланинового участка в N-концевой области белка; нормальный белок содержит 15 остатков аланина, а мутантный — от 22 до 24 остатков. Гетерозиготность по мутации с утратой функции гена Нох D13 имеет небольшое влияние на развитие конечностей, типа рудиментарного дополнительного пальца между I и II костями предплюсны или между IV и V предплюсневыми костями стоп.
Экспансия аланина, вызывающая полисиндактилию, вероятно, использует механизм прироста функции. Независимо от точного механизма, это заболевание показывает, что общая функция генов Нох — определение локального соответствия вдоль главных осей в ходе развития.
Нарушения межклеточной передачи сигналов через прямой контакт и морфогены: ахондроплазия, голопрозэнцефалия
Межклеточные системы связи обычно формируются поверхностными рецепторами клеток и связанными с ними молекулами, называемыми лигандами. Связываясь с лигандом, рецепторы передают их сигналы по внутриклеточным сигнальным путям. Одна из частых пар лиганд-рецептор — факторы роста фибробластов (FGF) и их рецепторы (FGFR).
Известно 23 гена семейства FGF человека, и многие из них играют значительную роль в развитии. FGF служат в качестве лигандов для рецепторов тирозинкиназы. Аномалии FGFR вызывают болезни, например ахондроплазию и другие синдромы, включая аномалии черепно-лицевого развития, так называемые краниосиностозы, поскольку при них происходит преждевременное слияние швов черепа.
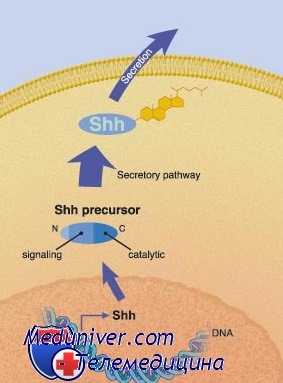
Один из лучших примеров морфогенетического фактора — фактор hedgehog (ёж), первоначально обнаруженный у дрозофил и названный в честь своей способности изменять ориентацию эпидермальных щетинок. Диффузия белка hedgehog создает градиент, от различных концентраций которого по-разному изменяется судьба окружающих клеток.
У людей несколько генов, тесно связанных с фактором hedgehog дрозофил, также кодируют морфогены; один из примеров — ген, неудачно названный Sonic Hedgehog (SHH) по герою известного мультфильма. Хотя специфические программы, управляемые фактором hedgehog у дрозофил, сильно отличаются от их эквивалентов у млекопитающих, основные направления и молекулярные механизмы аналогичны.

Например, секреция белка SHH хордой и базальной пластинкой развивающейся нервной трубки создает градиент, который организует другие типы клеток и тканей в развивающемся головном и спинном мозге. SHH также производится небольшой группой клеток в почке конечности, создавая зону поляризующей активности, отвечающую за асимметрию пальцев конечностей.
Мутации, инактивирующие ген SHH у людей при врожденных пороках, могут наследоваться как аутосомные доминантные признаки. Это показывает, что уменьшения экспрессии гена на 50% достаточно, чтобы вызвать аномальный фенотип, возможно, за счет изменения величины белкового градиента SHH. У больных обычно обнаруживают голопрозэнцефалию, или порок развития средней части лица и переднего мозга, приводящий к раздвоению губы и нёба, гипотелоризму (близко расположенным глазам) и отсутствию структур переднего мозга.
Тем не менее иногда клинические симптомы незначительны, например единственный центральный резец или частичное отсутствие мозолистого тела. Поскольку переменную экспрессивность наблюдали у членов одной и той же семьи, она не может быть следствием других мутаций и отражает действие генов-модификаторов в других локусах или случайных факторов, или и того и другого.
Эпителиально-мезенхимальный переход: молекулярная симфония для факторов транскрипции.

Когда я думаю об опухолевых клетках, то неизменно вспоминаю «Войну и мир»: мужественные командиры со своими солдатами, победные стратегии своих генералов и провальные походы противника (и наоборот), боевые подвиги и полное разорение, развороченное место недавнего боя и даже своеобразное метафоричное небо над Аустерлицем – не спешат больше бешено экспрессируемые белки на борьбу с диверсантами, защитные механизмы сдают оборону, а некоторые и вовсе переходят на сторону врага, и в звенящей от контузии тишине только мириады клеток разбредаются по организму, готовые создавать новые очаги, которые погубят его. Процесс перехода от мира к войне и наоборот это ведь тоже одна из форм пластичности, пластичности нашей жизни, переход от стабильного состояния к шаткому и неустойчивому, а затем закономерное возвращение к покою. Возможно, в этом и проявляются общие закономерности самой природы жизни, ведь к какому бы уровню организации живого мы ни обращались, всегда можно разглядеть общие фундаментальные идеи, указывающие на то, что все в этом мире взаимосвязано.
В части 1 мы с вами уже рассматривали основополагающие принципы, согласно которым протекает трансформация эпителиальных клеток в мезенхимальные. Обобщив, напомним себе, что как одна из форм эпителиальной пластичности, эпителиально-мезенхимальный переход (или трансформация, ЭМТ) включает в себя определенные изменения морфологии клеток эпителия, являющиеся отражением событий, происходящих на молекулярном уровне. Для эпителиальных клеток характерно наличие постоянных межклеточных контактов и адгезия с подлежащими клетками. Специализированные комплексы поверхностных белков эпителиоцитов формируют межклеточные контакты разных типов, благодаря чему поддерживается целостность эпителия. Все эти типы соединений клеток нам знакомы: субапикальные плотные контакты (tight junctions), адгезивные контакты (adherens junctions), десмосомы и хаотично разбросанные щелевые контакты (gap junctions) между латеральными поверхностями. Мезенхимальные же клетки, в отличие от эпителиальных, имеют непостоянную форму и не формируют подобных контактов друг с другом. Инициация ЭМТ влечет за собой разобщение вышеперечисленных соединений, поскольку задействованные в их формировании белки релокализуются либо подвергаются деградации. Разрывы плотных контактов в ходе ЭМТ сопровождаются снижением экспрессии клаудина и окклюдина, а также уменьшением количества белка zonula occludens 1 - ZO1 (белок плотных контактов, обозначается также как TJP1) в области межклеточных соединений. При дестабилизации адгезивных контактов Е-кадгерин подвергается разрушению в цитоплазматической мембране, что считается одним из решающих направляющих событий в развитии ЭМТ. Также экспрессия Е-кадгерина может быть снижена за счет метилирования промотора гена CDH1, мутаций или изменения обусловленной факторами транскрипции регуляции данного гена, ответственного за синтез Е-кадгерина, вследствие чего процесс транскрипции нарушается и синтезируемая мРНК обрывается. В итоге взаимодействие между Е-кадгерином и β-катенином, находящимся в цитоплазме и играющим роль проводника между трансмембранным кадгерином и актиновыми филаментами цитоскелета, более невозможно, и β-катенину грозит та же участь – разрушение. Однако он может избежать ее, например, если клетка реагирует на WNT-сигналинг, так как в этом случае β-катенин не фосфорилируется киназой гликогенсинтазы GSK-3β и локализуется в ядре, связываясь там с энхансерными факторами транскрипции TCF/LEF. Таким образом, вспоминая материал первой части, можно описать ЭМТ как процесс, в ходе которого полярные фиксированные эпителиальные клетки трансдифференцируются, приобретая характеристики подвижных мезенхимальных клеток.
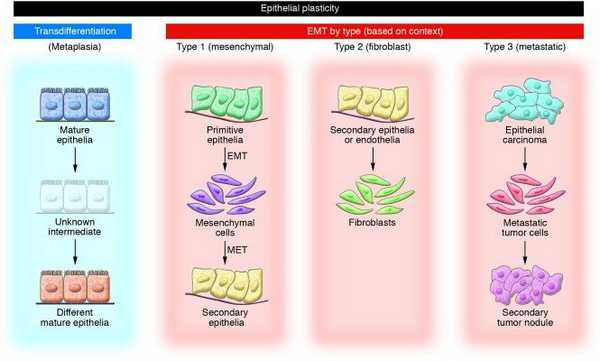
- Незрелые клетки эпителиального фенотипа, которые превращаются в мезенхимальные, из которых потом формируются клетки эпителия в участках, согласно программе гаструляции и миграции клеток нервного гребня.
- эпителиальные/эндотелиальные клетки заполняют интерстициальные пространства фибробластными клетками.
- ЭМТ как часть метастатического процесса при опухолевой прогрессии, когда эпителиальные клетки покидают первичный очаг, мигрируют и реконструируются во вторичную ткань.
Поддержание ЭМТ осуществляется за счет того, что экспрессия контактных белков транскрипционно снижается. Кроме того, в клетках позвоночных были обнаружены важные белковые комплексы – PAR (включает PAR6, PAR3 и атипичную протеинкиназу С – aPKC) и Crumbs-комплекс (представляет собой белок CRB, ассоциированный с Lin‑7 1 (PALS1) и связанным с ним белком плотных контактов – PATJ), расположенные в апикальной части и определяющие границы верхушечной области клетки за счет образования плотных контактов, а также Scribble-комплекс (включает в себя белки SCRIB, DLG и LGL), определяющий базолатеральный полюс клетки. Снижение экспрессии контактных белков препятствует взаимодействию данных белковых комплексов с мембранными структурами, как, например, подавление экспрессии Е-кадгерина становится причиной того, что SCRIB перестает связываться с базолатеральной мембраной, в результате чего клеточная подвижность только усиливается. Репрессия синтеза прочих белков полярности, как то CRB3 и LGL2, также вносит вклад в дестабилизацию эпителиального фенотипа. (см. Схему 3)
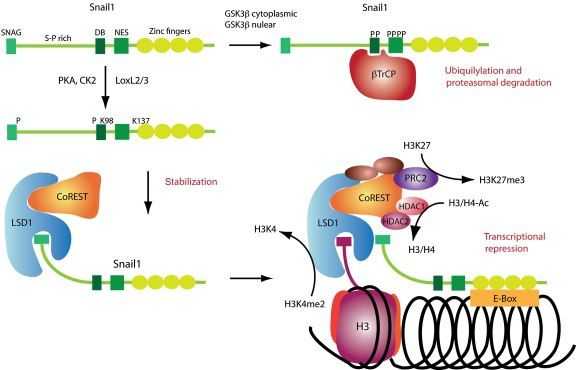
Схема 2.
Важно понимать, что в основе активации мезенхимального фенотипа лежит активность множества факторов транскрипции, которые изменяют генную экспрессию. В настоящем посте мы сконцентрируем внимание на основных регуляторах – транскрипционных факторах SNAIL, TWIST и ZEB – чья экспрессия активируется на самых ранних этапах ЭМТ. Вклад факторов транскрипции в развитие ЭМТ зависит от типа клеток и ткани, задействованных в реализации сигнальных каскадов, потенцирующих ЭМТ. Нередко регуляторы транскрипции оказывают взаимное влияние друг на друга и совершают кооперативную работу по воздействию на таргетные гены. Зачастую одни и те же факторы транскрипции отвечают как за репрессию генов эпителиальных клеток, так и за активацию генов, отвечающих за развитие мезенхимального фенотипа.
Среди транскрипционных факторов SNAIL в клетках позвоночных были идентифицированы SNAIL1 (SNAIL), SNAIL2 (SLUG) и SNAIL3 (Smuc), и все они являются непосредственными активаторами программы ЭМТ как во время физиологического развития организма, так и при фиброзе или опухолевых процессах. Экспрессия генов, обуславливающих основные морфо-функциональные свойства эпителиальных клеток, угнетается за счет связывания фактора транскрипции с мотивом цепи ДНК, называемым E‑box (5′-CANNTG-3′) и имеющимся в составе промоторов целевых генов, что возможно вследствие наличия в структуре транскрипционных факторов высококонсервативных доменов типа «цинкового пальца» на С-терминальном конце. Связываясь с участком E‑box в проксимальной области промотора гена Е-кадгерина, SNAIL1 рекрутирует белковый комплекс PRC2 и связывает его компоненты, благодаря наличию на N-терминальном конце эволюционно консервативного домена SNAG. В состав комплекса PRC2 входят метилтрансферазы гистонов (EZH2, G9a и SUV39H1), корепрессор SIN3A, гистоновые деацетилазы и лизин-специфическая деметилаза (LSD1). Как можно понять из названий, каждый из компонентов комплекса PRC2 направлен на координацию различных модификаций гистонов, в частности – метилирование и ацетилирование гистона H3 по 4-ому остатку лизина, 9-ому и 27-ому (H3K4, H3K9 и H3K27), причем метилирование одних участков препятствует транскрипции хроматина, тогда как ацетилирование этих же участков, напротив, является маркером доступности для осуществления транскрипции. Это крайне важный для понимания момент, поскольку промоторы генов, как и в случае гена Е-кадгерина, имеют обе метки сразу, – и метильную, и ацетильную – что позволяет своевременно активировать ген при поступлении активирующего сигнала и, в то же время, сохранять ген неактивным в отсутствие данного сигнала. Такой двойной контроль промотора гена Е-кадгерина, вероятно, является одой из причин обратимости ЭМТ. (см. Схему 2)

Схема 3.
Вспоминая содержание предыдущего поста, напомним себе, что запуск и поддержание ЭМТ становится возможным именно благодаря сигналам, исходящим из клеточного микроокружения, включая внеклеточный матрикс (коллаген, гиалуроновая кислота). Важную роль в регуляции ЭМТ играют разнообразные растворимые факторы, как, например, эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), фактор роста гепатоцитов (HGF), костные морфогенетические белки (BMPs), трансформирующий фактор роста бета (TGF-β), Notch, Wnt, фактор некроза опухоли альфа (TNF-α) и цитокины. Многие из перечисленных сигнальных молекул индуцируют и экспрессию транскрипционных факторов SNAIL, совершая тем самым еще больший вклад в эпителиально-мезенхимальную трансформацию. Например, рецепторные тирозинкиназы, активированные HGF, FGF или EGF, направляют сигналы по путям RAS-MAPK или PI3K-Akt, что в кооперации с деятельностью TGF-β ведет к активности SNAIL. При этом интересны взаимоотношения между TGF-β и SNAIL: изначально TGF-β индуцирует высокую экспрессию SNAIL, при этом SNAIL позволяет трансформирующимся злокачественным клеткам избегать супрессивного воздействия TGF-β (в частности, обеспечивает уклонение от TGF-β-опосредованного апоптоза), а на поздних стадиях и сам TGF-β становится перебежчиком на темную сторону и уже не подавляет развитие опухоли, а стимулирует ее прогрессию, побуждая активность SNAIL через Smad-зависимые пути.

Белки, отвечающие за развитие эпителиального и мезенхимального фенотипа и их регуляция факторами транскрипции SNAIL, TWIST и ZEB в ходе ЭМТ.
В самом начале поста мы упоминали о взаимосвязи между сигнальным путем Wnt, репрессией гена Е-кадгерина и развитием ЭМТ. В этой взаимосвязи есть место и транскрипционным факторам SNAIL. Например, в клетках рака молочной железы каноничный путь Wnt запускает ЭМТ вследствие инициируемой экспрессии внутриклеточного белка Axin2, что стабилизирует уровень SNAIL, а потому, если исключить активность GSK-3β, то сигнальная передача от Wnt может становиться причиной индукции ЭМТ и последующего опухолевого метастазирования, поскольку активность β-катенина и SNAIL сохранится. Синергия в работе между SNAIL и β-катенином позволяет злокачественным клеткам выживать и распространяться также за счет того, что сигнал от Wnt, передаваемый через белки пути β-катенин/TCF4/Snail, приводит к ингибированию митохондриального дыхания, поскольку угнетается активность цитохромоксидазы COX, а также к гликолитическому переходу, так как клетка начинает усиленно потреблять глюкозу и продуцировать лактат.
Активации SNAIL зачастую вторит активность таких факторов транскрипции как ZEB, что нередко происходит под влиянием совместной деятельности SNAIL1 и TWIST1. Экспрессия ZEB точно так же повышается в ответ на сигналы TGF-β и Wnt, а также факторы роста, запускающие путь RAS-MAPK, что характерно и для регуляции SNAIL. В регуляции активности ZEB участвует и уже знакомый нам комплекс PRC2, который сумоилирует ZEB по окончании трансляции, что обуславливет локализацию данного фактора транскрипции в цитоплазме, в результате чего репрессия генов, вызванная ZEB, ослабевает.
Читайте также:
