Недостаточность адгезии лейкоцитов
Добавил пользователь Morpheus Обновлено: 27.01.2026
Дефицит адгезии лейкоцитов (LAD), является редким аутосомный рецессивный расстройство, характеризующееся иммунодефицит приводящий к повторяющимся инфекции. [1] LAD в настоящее время делится на три подтипа: LAD1, LAD2, и недавно описанный LAD3, также известный как вариант LAD-1 /. В LAD3 иммунные дефекты дополняются Тромбастения Гланцмана склонность к кровотечениям. [2] [3]
Содержание
Характеристики
LAD впервые была признана отдельной клинической единицей в 1970-х годах. Классические описания LAD включали рецидивирующие бактериальный инфекции, дефекты в нейтрофил адгезия и задержка пуповина шелушение. Дефекты адгезии приводят к плохому лейкоциты хемотаксис, особенно нейтрофилы, неспособность образовывать гной и нейтрофилия. [3]
Люди с LAD страдают бактериальными инфекциями, начиная с неонатальный период. Такие инфекции, как омфалит, пневмония, гингивит, и перитонит распространены и часто опасны для жизни из-за неспособности младенца должным образом уничтожить вторгшиеся патогены. Эти люди не образуют абсцессы потому что гранулоциты не может перейти на сайты инфекция.
Причина
Типы недостаточности адгезии лейкоцитов включают LAD1, LAD2 и LAD3. LAD1 - самый распространенный. [ нужна цитата ]
| Тип | OMIM | Ген |
|---|---|---|
| LAD1 | 116920 | ITGB2 |
| LAD2 или CDG2C | 266265 | SLC35C1 |
| LAD3 | 612840 | FERMT3 |
Пациенты с LAD1 имеют унаследованный молекулярный дефект что вызывает дефицит β-2 интегрин субъединица, [4] также называется CD18, который кодируется геном ITGB2, обнаруженным на хромосома 21. Эта субъединица участвует в образовании интегринов β-2 (LFA-1, Интегрин alphaXbeta2, и Mac-1 / CR3 ) путем димеризации с разными субъединицами CD11. [ нужна цитата ]
Мутации в гене ITGB2 приводят к отсутствию, уменьшению или отклонению CD18 экспрессия белка, вызывая отсутствие экспрессии в лейкоцитарной мембране интегринов β-2. Основная функция этих белков - позволить нейтрофилы выходить из кровотока в инфицированные ткани, придерживаясь различных лиганды выраженный эндотелий, например ICAM-1. У пациентов с LAD-I нейтрофилы не могут экстравазировать и бороться с бактериями в тканях. Затем бактерии могут размножаться, что приводит к симптоматический инфекция, которая может беспрепятственно распространиться и нанести серьезный вред важным ткани. [ нужна цитата ]
Диагностика
Обычно диагноз включает в себя несколько предварительных испытаний невосприимчивый функции, включая базовую оценку гуморальная иммунная система и клеточно-опосредованная иммунная система. А WBC дифференциал обнаружит чрезвычайно повышенный уровень нейтрофилов (порядка 6-10 раз от нормы), потому что они не могут покинуть кровеносный сосуд. В случае LAD-I конкретную диагностику выполняет проточной цитометрии. Этот метод позволит выявить отсутствующие или уменьшенные CD18 экспрессия в лейкоцитарной мембране. Недавно были созданы системы пренатальной диагностики, позволяющие раннее выявить заболевание. Диагностика LAD-II включает изучение различных гликозилированных форм трансферрин белок. В LAD-III, как тромбоцит функция также затронута, это можно использовать, чтобы отличить ее от других типов. [ нужна цитата ]
лечение
Прогноз
В исследовании 2009 года сообщалось о результатах 36 детей, перенесших трансплантацию стволовых клеток. На момент наблюдения (среднее время 62 месяца) выживаемость составила 75%. [6]
Эпидемиология
ПМЖВ - редкое заболевание, распространенность которого оценивается в 1 на 100 000 новорожденных, без описанных расовых или этнических пристрастий. Самый распространенный тип - LAD1.
Недостаточность адгезии лейкоцитов
Недостаточность адгезии лейкоцитов является следствием дефекта молекул адгезии, что приводит к дисфункции гранулоцитов и лимфоцитов и развитию рецидивирующих инфекций мягких тканей.
Дефицит адгезии лейкоцитов является следствием недостаточности адгезионных гликопротеинов на поверхности лейкоцитов, что приводит к нарушению межклеточных взаимодействий, нарушению прилипания клеток к стенкам кровеносных сосудов, миграции клеток и взаимодействию с компонентами системы комплемента. Такая недостаточность нарушает способность гранулоцитов (и лимфоцитов) мигрировать через стенки сосудов в ткани, участвовать в цитотоксических реакциях и фагоцитозе бактерий. Тяжесть заболевания коррелирует со степенью недостаточности.
Были идентифицированы три различных типа синдромов:
Нарушение адгезии лейкоцитов 1: недостаток или дефект бета2-интегринов
Нарушение адгезии лейкоцитов 2: отсутствие фукозилированных углеводных лигандов для селектинов
Нарушение адгезии лейкоцитов 3: недостаточная активации всех бета-интегринов (1, 2 и 3)
Тип 1 обусловлен мутациями гена бета-2-интегрин (ITGB2), кодирующего CD18 в бета-2-интегринах. Тип 2 обусловлен мутациями гена переносчика дифосфат глюкозы (GDP)-фукозы. Тип 3 обусловлен мутациями гена FERMT3 (11q13.1), кодирующего синтез kindlin-3 в гемопоэтических клетках.
Симптомы и признаки дефицита адгезии лейкоцитов
Проявление симптоматики нарушения адгезии лейкоцитов обычно начинается в раннем детстве.
Наиболее тяжелые поражения у детей проявляются как рецидивирующие или прогрессирующие некротические инфекции мягких тканей, вызванные стафилококковой или грамотрицательной микрофлорой, периодонтит, плохое заживление ран без образования гноя, лейкоцитоз и продолжительное заживление пупочной ранки (более 3 недель). Количество лейкоцитов высокое даже в периоды ремиссии. С течением времени контролировать инфекции становится все труднее.
Менее тяжелыми проявлениями у детей являются некоторые серьезные инфекции и небольшие отклонения в формуле крови.
При наличии 2 типа часто наблюдается задержка развития.
Диагностика дефицита адгезии лейкоцитов
Проводят исследование адгезивных гликопротеинов на поверхности лейкоцитов
Диагноз нарушения адгезии лейкоцитов подтверждается с помощью моноклональных антител (например, анти-CD11, анти-CD18) и проточной цитометрии, которые показывают отсутствие или тяжелое нарушение адгезионных гликопротеинов на поверхности БКТ. Лейкоцитоз, выявленный при проведении общего анализа крови, не является специфичным.
Рекомендуется генетическое исследование родственных доноров.
Лечение дефицита адгезии лейкоцитов
Поддерживающая терапия с применением профилактических антибиотиков и трансфузиями гранулоцитов
Трансплантация гемопоэтических стволовых клеток
Терапия нарушения адгезии лейкоцитов профилактическими антибиотиками, часто применяемая постоянно (обычно триметоприм/сульфаметоксазол). Также помогает трансфузия гранулоцитов.
Для пациентов со 2 типом дефицита адгезии лейкоцитов следует попытаться провести коррекцию основного дефекта с поддерживающим применением фукозы.
Пациенты с легкой или умеренной формой заболевания могут выжить в молодом возрасте. Большинство пациентов с тяжелой болезнью умирают в возрасте до 5 лет, если не была проведена успешная трансплантация гематопоэтических стволовых клеток.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Дефицит адгезии лейкоцитов
При дефиците адгезии лейкоцитов нарушается функция белых кровяных клеток (лейкоцитов), что приводит к частым инфекциям мягких тканей.
Симптомы дефицита адгезии лейкоцитов обычно возникают в раннем возрасте и включают частые инфекции мягких тканей, таких как десны, кожа и мышцы.
Для диагностики данного заболевания врачи назначают специфические анализы крови.
Лечение включает антибиотики для профилактики инфекций и трансфузии лейкоцитов, однако единственным эффективным лечением является трансплантация стволовых клеток.
При дефиците адгезии лейкоцитов наблюдается недостаток белка на поверхности белых кровяных клеток Компоненты иммунной системы Иммунная система защищает организм от чужеродных или опасных элементов. Такие элементы включают: микроорганизмы (обычно называемые микробами, такие, как бактерии, вирусы и грибки); паразиты. Прочитайте дополнительные сведения . В результате снижается способность лейкоцитов перемещаться к месту внедрения инфекции и уничтожать и расщеплять бактерии или другие чужеродные вещества.
Существует три формы этого расстройства, которые различаются пораженной специфической биохимической частью иммунной системы.
Симптомы дефицита адгезии лейкоцитов
Симптомы дефицита адгезии лейкоцитов обычно возникают в раннем возрасте.
У детей с тяжелыми формами заболевания инфекции развиваются в мягких тканях, таких как десны, кожа и мышцы. Эти инфекции рецидивируют и/или усугубляются, а пораженные ткани могут погибнуть. В зараженных участках гной не образуется. Инфекции становится все труднее контролировать.
Раны заживают плохо.
Часто пуповина долго не отделяется, вплоть до 3 и более недель после рождения. В норме пуповина отпадает сама по себе через неделю или две после рождения.
Большинство детей с тяжелыми формами заболевания умирают к 5 годам, если не выполнить успешную трансплантацию стволовых клеток.
У новорожденных с менее тяжелым течением серьезные инфекции встречаются лишь в редких случаях. Они могут дожить до совершеннолетия без всякого лечения.
У детей с одной из форм дефицита адгезии лейкоцитов часто замедляется интеллектуальное и физическое развитие.
Диагностика дефицита адгезии лейкоцитов
Назначается общий анализ крови с подсчетом форменных элементов. Кроме того, для диагностики дефицита адгезии лейкоцитов используются специфические анализы крови, включая анализ белков на поверхности лейкоцитов (так называемая проточная цитометрия).
Рекомендуется генетическое тестирование у братьев и сестер.
Лечение дефицита адгезии лейкоцитов
Трансплантация стволовых клеток
Лечение дефицита адгезии лейкоцитов включает антибиотики, часто в непрерывном режиме, для профилактики инфекций. Также может помочь переливание гранулоцитов (тип лейкоцитов).
Проводятся исследования генной терапии этого заболевания.
Детям с одним из типов данного заболевания может помочь прием фукозы (сахара)
Дополнительная информация
Ниже приведен ресурс на английском языке, который может быть полезным. Обратите внимание, что составители СПРАВОЧНИКА не несут ответственности за содержание этого ресурса.
Фонд в поддержку лечения иммунодефицитов: Дефицит адгезии лейкоцитов: Исчерпывающая информация о дефиците адгезии лейкоцитов, включая информацию о диагностике и лечении, а также советы для пораженных людей
ПРИМЕЧАНИЕ: Это — пользовательская версия ВРАЧИ: Нажмите здесь, чтобы перейти к профессиональной версии
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Недостаточность адгезии лейкоцитов
Клиника и лечение недостаточности адгезии лейкоцитов - НАЛ
При тяжелой форме недостаточности адгезии лейкоцитов-1 (НАЛ-1) количество b2-интегринов составляет менее 0,3% нормы, при умеренном фенотипе патологии оно достигает 2-7 %. В первом случае грудные дети часто страдают хроническими бактериальными инфекциями кожи, слизистой оболочки рта, прямой кишки и половых органов. У них поздно отпадает пуповина, что связано обычно с инфекцией ее культи. Поражения кожи могут прогрессировать до крупных хронических язв с различной микрофлорой, включая анаэробную.
Язвы заживают медленно, требуют многомесячного лечения антибиотиками, а часто и пластических операций с пересадкой кожи. Обычно развивается гингивит, характерный для тяжелой нейтропении, с ранним выпадением молочных, а затем и постоянных зубов.
Возбудители инфекций при недостаточности адгезии лейкоцитов - НАЛ-1 также сходны с таковыми при тяжелой нейтропении и включают Staphylococcus aureus и кишечную грамотрицательную флору (Escherichia coli). Больные подвержены и грибковым инфекциям (Candida и Aspergillus). Как и при тяжелой нейтропении, типичные признаки воспаления (набухание, покраснение и потепление пораженной ткани) могут отсутствовать.
Гноя нет, и в биоптатах инфицированной ткани обнаруживается лишь немного нейтрофилов. В крови же их количество во время инфекции обычно превышает 30 000, а иногда и 100 000 в 1 мкл. В интервалах между инфекциями нейтрофильный лейцоцитоз (> 12 000/мкл) сохраняется. В присутствии даже небольшого количества функционирующих интегринов на поверхности нейтрофилов тяжесть и частота инфекций у детей оказываются гораздо меньшими, чем при тяжелой форме НАЛ-1.
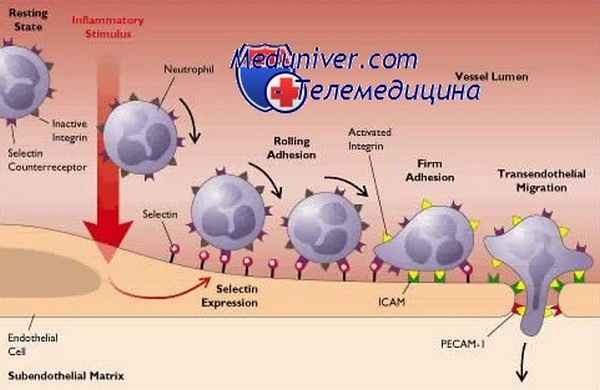
Диагностировать недостаточность адгезии лейкоцитов - НАЛ-1 легче всего с помощью проточной цитометрии с моноклональными антителами к CD11b, позволяющей обнаруживать этот антиген на стимулированных и нестимулированных нейтрофилах. При исследовании адгезии нейтрофилов и моноцитов, агрегации, хемотаксиса и опосредованного iC3b фагоцитоза, как правило, выявляются резкие нарушения, прямо зависящие от степени молекулярного дефекта.
Реакции гиперчувствительности замедленного типа остаются нормальными; у большинства больных сохраняется и синтез специфических антител. Однако в ряде случаев наблюдается снижение зависимых от Т-лимфоцитов реакций антител на повторную вакцинацию столбнячным и дифтерийными анатоксинами и вирусом полиомиелита. НАЛ-2 диагностируют по отсутствию сиалил-Lex на нейтрофилах.
Лечение недостаточности адгезии лейкоцитов (НАЛ-1) зависит от фенотипа этого состояния, который, в свою очередь, определяется уровнем экспрессии функционально интактных интегринов CD11/CD18. При тяжелой НАЛ-1 (полном отсутствии комплекса CD11/CD18) методом выбора является ранняя трансплантация аллогенного костного мозга. Все другие меры в лучшем случае оказываются лишь паллиативными. Больным профилактически назначают триметоприм/сульфаметоксазол, и они должны находиться под пристальным наблюдением, чтобы не пропустить развитие инфекции.
При ее возникновении эмпирически применяют антибиотики широкого спектра действия. Плохо заживающие поражения кожи и слизистых оболочек требуют длительной антибиотикотерапии, и поэтому важно определить природу возбудителя, проводя посевы тканевых биоптатов.
Хотя генная терапия пока невозможна, недостаточности адгезии лейкоцитов (НАЛ-1) идеально подходит для этого способа лечения, так как (судя по существованию ее легких форм) даже небольшая коррекция функции нейтрофилов должна ослабить проявления патологии. В отдельных случаях могут помочь добавки фукозы, которые быстро снижают лейкоцитоз, индуцируют появление молекул сиалил-Lex и увеличивают адгезивные свойства лейкоцитов.
Прогноз недостаточности адгезии лейкоцитов. Тяжесть инфекций зависит от степени недостаточности b2-интегринов. Дети с выраженным их дефицитом часто погибают в грудном возрасте, а выжившим больным грозят тяжелые системные инфекционные заболевания. При умеренной недостаточности b2-интегринов инфекции развиваются реже и больные обычно живут дольше.
Дефицит адгезии лейкоцитов
Дефицит адгезии лейкоцитов (ДАЛ) — редкое наследственное заболевание, крайне опасное из-за тяжелейшего врожденного иммунодефицита: фагоцитарные клетки неспособны проникнуть в ткани, оставляя таким образом клетки беззащитными перед вирусами и бактериями.
В настоящее время выделяют три формы ДАЛ: ДАЛ-1, ДАЛ-2 и ДАЛ-3 (последнюю также называют «вариантом ДАЛ-1»). Чтобы разобраться в этом, сначала следует проследить механизм перехода лейкоцитов в ткань.
Механизм проникновения лейкоцитов в очаг воспаления
Лейкоциты активируются в фазу альтерации различными хемоаттрактантами (из группы медиаторов воспаления), которые в дальнейшем способствуют миграции лейкоцитов и их последующему выходу в ткани. Выделяют две группы аттрактантов:
— «Классические» аттрактанты — N-формильные бактериальные пептидные антигены [1], белки системы комплемента С3а и С5а, а также различные липидные молекулы по типу лейкотриена В4 [2].
— Т. н. «селективные» аттрактанты — группа белков суперсемейства хемокинов, которые можно условно разделить на 4 группы: CXC, CX3C, CC и C (названы так по наличию двух первых остатков цистеина — парных и высококонсервативных) [2], [3].
Хемоаттрактанты связываются со специфическими рецепторами лейкоцитов и вызывают их перемещение по «градиенту хемоаттракции», то есть к месту очага воспаления. У человека известно около 18 хемокиновых рецепторов, все они связаны с G-белками и состоят из 7 трансмембранных доменов, что является типичным для многих рецепторов [2]. При активации этих рецепторов начинает синтезироваться группа молекул адгезии, которая необходима для последовательного каскадного перехода лейкоцитов в ткань.
Изначально лейкоциты движутся с током крови, постепенно выходя из осевого потока на периферию и приближаясь к стенке сосуда (маргинация), после чего лейкоциты прикрепляются к эндотелию и просачиваются сквозь него непосредственно к месту повреждения.
Классически выделяют три этапа в процессе достижения тканевого очага воспаления [4]: «качание», обусловленное селектинами; активация лейкоцитов под влиянием хемокинов и внедрение в ткань, опосредованное интегринами.
В настоящее время эти этапы несколько расширены (см. рис.1) [5]. Первым этапом остается «качание» или «перекатывание» лейкоцитов, обусловленное особыми белками — селектинами и интегинами.
Селектины можно назвать молекулами распознавания и прикрепления. Большинство лейкоцитов секретируют селектин P, клетки эндотелия (воспаленные) — селектины Е и L. Основной рецептор для всех них — P-селектиновый гликозилированный рецептор-1 (PSGR-1). Именно за счет него лейкоциты способны прочно прикрепиться к эндотелию; благодаря ему же лейкоциты, которые не обладают необходимым «рецепторным паспортом», не могут пройти в очаг воспаления.
Интегрины — еще одна группа белков, обладающих адгезивными свойствами. В их группе выделяют два основных подсемейства: β1- и β2-интегрины, также имеются и другие. Наиболее важными являются следующие представители:
- α4β7-интегрин — необходим для прикрепления к рецепторам клеточной адгезии слизистой сосуда MADCAM-1 (англ. mucosal vascular addressin cell-adhesion molecule-1);
- α4β1-интегин или VLA4 (англ. very late antigen-4) — необходим для прикрепления к внеклеточному рецептору адгезии VCAM-1 (англ. vascular cell-adhesion molecule-1);
- β2-интегрин — необходим для соединения с внутриклеточным рецептором адгезии ICAM-1 (англ. intracellular adhesion molecule-1).
- Также имеется αLβ2-интегрин, имеющий аббревиатуру LFA-1( lymphocyte function-associated antigen-1), который также связывается с ICAM-1 рецептором [5].
Все эти сложности нужны лейкоциту для того, чтобы перейти в фазу «медленного качания», а затем и вовсе остановиться. «Захват» лейкоцитов происходит путем прочного связывания интегринов с белками VCAM и ICAM (их относят к суперсемейству иммуноглобулинов, синтезируются эндотелиоцитами под влиянием медиаторов воспаления) [6].
Чтобы произошло прочное связывание (адгезия), также нужны молекулы-регуляторы — уже знакомые нам хемокины (основные — ИЛ-4, ФНО). Они могут содержаться в кровотоке, транспортироваться эндотелиоцитами или синтезироваться активированными тромбоцитами и тучными клетками. Также эти хемокины обладают высокой аффинностью к упомянутым рецепторам, ассоциированным с G-белком (GPCR – G-protein coupled receptor) [5].
Условно считается, что β1-интегрины — молекулы эозинофилов, моноцитов и лимфоцитов, связываются с VCAM, а β2- интегрины — белки нейтрофилов и базофилов – с ICAM [22]; с их помощью лейкоцит прочно прикрепляется к эндотелию. После этого начинается финальный этап — трансмиграция.
Проникновение через стенку сосуда — чрезвычайно сложный процесс. Начинается он с медленного перемещения или «ползания» фагоцита по эндотелию (с помощью макрофагального антигена 1 — MAC1, рис.1). Лейкоцит «ищет» удобное место для миграции в ткань. Мигрировать лейкоцит способен как через межклеточное пространство (в большинстве случаев), так и непосредственно через клетку (таков механизм трансмиграции лейкоцитов в ЦНС) [5].
Между эндотелиоцитами лейкоцит проникает благодаря крайне гибкой мембране, он буквально «просачивается» сквозь межклеточные соединения. Процесс этот довольно длителен и сложен, занимает 15–20 минут и регулируется множеством хемокинов, цитокинов и др. [5, 22].
Трансцеллюлярно (непосредственно через эндотелиоцит) фагоцит проходит с помощью недавно открытого транспортного механизма — везикуло-вакуолярных органелл (VVO) [7]. Это небольшие мембранные структуры, предположительно специализированные транспортеры лейкоцитов (а именно нейтрофилов) через тело эндотелиоцита.
Рисунок 1 | Поэтапное проникновение лейкоцита через эндотелий сосуда [5].
Наконец, преодолев эндотелий, фагоцитарная клетка оказывается в очаге воспаления, где наводит порядок и способствует восстановлению ткани.
Из описанного выше механизма активации лейкоцитов и проникновения их в очаг воспаления становится понятна важность правильной работы всех задействованных молекул. Но вследствие определенной генетической мутации адгезивная способность лейкоцитов может быть нарушена — такое состояние называется дефицитом адгезии лейкоцитов (ДАЛ).
Классифицируют ДАЛ исключительно по виду дефектных молекул (и генов, их кодирующих). Клиническая картина, подход к диагностике и возможному лечению (или купированию заболевания) одинаковы в общих чертах, хотя имеются и нюансы.
Дефицит адгезии лейкоцитов 1 типа
ДАЛ 1 типа — редкое заболевание, передающееся по аутосомно-доминатному типу наследования. Этот первичный иммунодефицит кодируется геном ITGB2, отвечающим за экспрессию β2-интегринов (CD11/CD18). Распространенность заболевания — 1:1 000 000, в литературе можно встретить всего около 300 случаев [8], [9].
Впервые о нем сообщили как о полноценном самостоятельном заболевании в 1997 году [10], хотя в литературе и ранее были описаны случаи иммунодефицитов по причине дефекта β2-интегринов. Больше всего страдают нейтрофилы, которые не способны проникнуть в ткань.
Клинически это проявляется рецидивирующими жизнеугрожающими бактериальными и грибковыми инфекциями [11], [12]. Зачастую иммунодефицит проявляет себя очень рано, причем инфекции быстро переходят в септическую форму.
Отличительная особенность любого ДАЛ — отсутствие гноя в очаге воспаления. На коже и слизистых обнаруживаются очаги некроза, в детском возрасте смертность крайне высока. В дальнейшем (если грамотно устранять все инфекции) болезнь проявляет себя не так остро, более взрослые пациенты страдают от тяжелых гингивитов и хронических периодонтитов, но вероятность летального исхода у них существенно ниже.
Диагностика может осуществляться методами генной инженерии, но для ДАЛ-1 это нецелесообразно. Гораздо чаще выявляют маркеры CD11/CD18 методом проточной цитометрии — привычный и даже рутинный анализ в иммунологии [8]. Соответственно, при отсутствии данных маркеров можно говорить о ДАЛ 1 типа.
Единственным методом лечения ДАЛ-1 на данный момент является аллогенная трансплантация гемопоэтических клеток (АТГК) [13]. На протяжении с 1993 по 2007 год АТГК была произведена 36 пациентам в возрасте от 2 мес до 14 лет (средний возраст — 9 месяцев). Выживаемость составила около 75 %. Важно отметить, что большая часть смертей произошла по причине невозможности найти HLA-совместимого донора.
Наконец, ДАЛ-1 можно купировать и сдерживать с помощью грамотной антибиотикотерапии, причем это тот самый случай, когда антибиотики следует применять и в качестве профилактики [11].
Дефицит адгезии лейкоцитов 2 типа
В основе ДАЛ-2 — дефект селектинов и, как следствие, невозможность «перекатывания» лейкоцитов по эндотелию. Но, в отличие от ДАЛ-1, этиология иммунодефицита не так очевидна, хотя бы потому, что известно всего лишь около 10 случаев данного заболевания [11].
Молекулярная природа ДАЛ-2 — недостаточность белка-переносчика ГДФ-фукозы (фукозилирование — одна из необходимых модификаций трансмембранных рецепторов адгезии [15]); сам белок переносчик — GFTP (англ. GDP-fucose transport protein) кодируется геном SLC35C1, он же FUCT1 [16].
Также дефицит вышеупомянутого GFTP приводит к еще двум редким феноменам: нарушение синтеза антигенов ABO-системы (бомбейский феномен) и недостаточность антигенов системы Льюиса [17]. Таким образом, дефект одного гена FUCT1 приводит сразу к трем редчайшим патологиям, которые крайне тяжело поддаются корректировке.
Клиническая картина, как ни странно, зачастую более мягкая в сравнении с ДАЛ1. Лейкоциты, хотя и лишены правильно работающих селектинов, все же имеют абсолютно интактные интегрины, то есть, хотя бы какая-то часть фагоцитов все же способна проникает в ткань и оказывает защиту от инфекции, которые становятся менее серьезными, чем в предыдущем случае. Иммунодефицит проявляется в основном на первом году жизни, в более взрослом периоде осложнения не так выражены (хотя и остается хронический периодонтит) [11].
Однако же не все так хорошо, как хотелось бы. Недостаточность все того же транспортера GFTP может проявляться (хоть и редко) задержкой роста и умственной отсталостью [18].
Диагностировать ДАЛ-2 можно на основании сочетанного феномена бомбейской группы крови и отсутствия антигенов Льюиса; окончательным же доказательством существования патологии будет генетический анализ гена FUCT1 [11].
Лечение ДАЛ-2 обычно протекает безрезультатно. На сегодняшний день помимо симптоматического лечения антибиотиками медицине предложить, в общем-то, нечего. Единственным более-менее эффективным может быть прием L-фукозы орально. По крайней мере, в исследовании состояние пациентов кратковременно улучшилось; однако спустя месяц нейтрофилы перестали реагировать на подобную поддержку [19].
Дефицит адгезии лейкоцитов 3 типа
Часто ДАЛ-3 относят к разновидностям ДАЛ-1 типа, однако такой подход вряд ли правильный. ДАЛ-3 гораздо более агрессивное заболевание, которое практически невозможно купировать.
Этиология болезни заключается в дефекте гена FERMT3, который отвечает за синтез всех β-интегринов. Результатом становится полная неспособность лейкоцита к хоть какому-нибудь прикреплению к эндотелиоцитам, не говоря уже о проникновении через стенку сосуда [11].
Помимо обычных тяжелых инфекций больные страдают также геморрагическим синдромом (наподобие тромбастении Гланцмана — продолжительность кровотечения составляет более 15 минут при норме 2–6 мин [20]. Это вполне ожидаемо, так как тромбоциты в процессе агрегации используют β3-интегрины.
ДАЛ-3 на сегодня выявлен примерно у 20 семей во всем мире. Это крайне тяжелая форма ДАЛ с высокой летальностью, зачастую новорожденные в таких семьях очень быстро умирали, причем еще до постановки диагноза.
В дополнение к уже описанной клинической картине (рецидивирующие тяжелые инфекции, отсутствие гноя, геморрагический синдром) можно назвать дефект костной ткани наподобие остеопетроза (остеосклероз, мраморная болезнь) [21]. Выявляется не у всех пациентов, однако подобная патология может существенно помочь в постановке диагноза.
Собственно диагностика проводится с помощью генного анализа. Существует ряд тестов, в которых можно распознать дефект нейтрофилов, например, тест с неопсонизированным зимозаном [11], который поможет дифференцировать ДАЛ-3 от ДАЛ-1. Однако подобные тесты требуют времени, а заболевание зачастую не оставляет шанса на раздумья.
Лечение мало отличается от такового при других формах ДАЛ. Это трансфузии гранулоцитов и (в данном случае) тромбоцитов, причем число трансфузий может достигать 50 в год. Единственным же способом этиотропной терапии остается аллогенная трансплантация гемопоэтических клеток [11].
Читайте также:
