Окислительный обмен в сердце. Микромиомаляции при врожденных пороках сердца
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Механизмы фиброза миокарда при пороках. Сосуды сердца при врожденных пороках
Ряд исследователей допускает прямую кристаллизацию волокон соединительной ткани в межтканевой жидкости под влиянием веществ типа ферментов, выделяемых фибробластами или другими мезенхимальными клетками, или даже без такого влияния [Должанский и Руле (Doljanski u. Roulet, 1933); Робб-Смис (Robb-Smith, 1944, 1945); Даблин, 1946; Э. 3. Юсфина, 1946; М.Ф.Иваницкая, 1947].
На основании обнаруженного нами, а также Neuber (1912), Е. И. Чайкой (1940), А. И. Смирновой-Замковой (1946, 1947), Т. Е. Ивановской (1948) увеличения количества решетчатых волокон в гипертрофированных отделах миокарда и указанных выше литературных данных можно предположить, что аргирофильные волокна в миокарде при его гипертрофии вырабатываются при участии сердечных мышечных элементов. Это тем более вероятно, что нам не удавалось видеть гиперпластической мезенхимальной клеточной реакции, за счет которой можно было бы отнести образование решетчатых волокон.
Выше мы уже разобрали возможность существования при врожденных пороках сердца единственной коронарной артерии или трех коронарных артерий. Это не дает нам возможности согласиться с Литтманном и Фоно (1954), утверждающими, что кровоснабжение сердца, даже при тяжелых видах врожденных пороков, всегда постоянно и осуществляется через две коронарные артерии.
Наши данные (1956) о возможности развития третьей коронарной артерии при врожденных пороках сердца в последующем были подтверждены Н. В. Архангельской (1959). В исследованиях А. М. Гофмана (1949), Б. В. Огнева, В. Н. Саввина и Л. А. Савельевой (1954) удалось найти указания на возможность развития третьей, недоразвитой коронарной артерии при различных заболеваниях, но не при врожденных пороках сердца. Мы полагаем, что варианты отхождения коронарных артерий при врожденных пороках сердца должны считаться теснейшим образом связанными с функцией различных частей порочного сердца во внутриутробном периоде развития плода.
Для того чтобы получить всестороннее представление об изменениях сосудов сердца при врожденных пороках, мы применили несколько методик их исследования.
Для изучения ангиоархитектоники сердца при врожденных пороках была использована рентгеноанатомическая методика исследования. Для стереоангиорентгенографии применена инъекционная методика с использованием углекислого свинца (М. С. Толгская, 1941) по способу, предложенному В. Д. Арутюновым (1961).
Методикой стереоангиорентгенографии мы исследовали всего 33 сердца: 11 —при врожденных пороках сердца, 12 — при гипертрофии сердца другой этиологии (при гипертонической болезни, общем атеросклерозе и при митральном стенозе ревматической этиологии), а также 10 сердец здоровых людей в возрасте от 11 месяцев до 38 лет, погибших от различных случайных причин. Мы полагали, что наиболее полное представление о характере изменений сосудов сердца при врожденных пороках можно получить лишь в случае исследования в качестве контроля сердец не только здоровых людей, но и сердец больных, страдавших гипертонической болезнью и приобретенными пороками сердца.
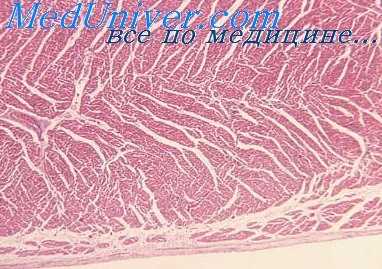
Самым главным результатом применения рентгеноанатомической методики изучения сосудов сердца явилось обнаружение резкого увеличения количества интрамуральных сосудистых ветвей в гипертрофированных отделах миокарда во всех наблюдениях, при всех исследованных видах врожденных пороков сердца.
Окислительный обмен в сердце. Микромиомаляции при врожденных пороках сердца
Путем новейших биохимических исследований Бинг (Bing, 1959) установил, что окислительный обмен в сердце идет не только за счет углеводов. Методом интубации коронарного синуса было обнаружено, что сердце человека использует молочную кислоту, пировиноградную кислоту, жирные кислоты, кетоновые тела и аминокислоты, что указывает на многообразие источников энергии в миокарде. Потребление жирных кислот миокардом увеличивается после употребления организмом больших количеств жира. Это, по мнению автора, свидетельствует о возможности отложения жира в сердечной мышце. Запасы жирных кислот предотвращают истощение запасов углеводов.
Эти данные заставляют задуматься о фактическом значении появления свободных капель липоидов в саркоплазме мышечных волокон. Если данные Бинга подтвердятся, то появление свободных капель жира в саркоплазме мышечных волокон не всегда можно будет отнести к дистрофическим процессам.
Только благодаря применению гистотопографического метода исследования нам удалось обнаружить, что у детей и у молодых людей при врожденных пороках сердца развиваются деструктивные изменения (микромиомаляции, или микроинфаркты, миокарда), и проследить их развитие до образования кардиосклероза.
Были обнаружены все стадии развития микромиомаляций: от свежего очага некроза мышечных волокон с начинающейся клеточной реакцией вокруг до развития вначале грануляционной, а затем грубой волокнистой соединительной ткани в участке некроза. При этом все стадии развития микромиомаляций можно было иногда наблюдать в одном и том же сердце.
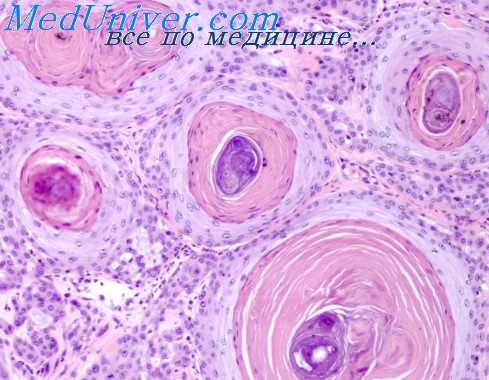
Микроинфаркты миокарда и свежие рубцы после них обнаружены в 18 наблюдениях: при тетраде Фалло — в 9 наблюдениях, при пентаде Фалло— в 2 наблюдениях; при триаде Фалло, трикуспидальной атрезии, большом дефекте межжелудочковой перегородки, изолированном дефекте межпредсердной перегородки, диффузном расширении общего ствола легочной артерии в сочетании с открытым овальным окном межпредсердной перегородки, болезни Лютембахера, врожденном сужении артериального конуса левого желудочка — по одному наблюдению.
Микроинфаркты миокарда и свежие рубцы после них при тетраде Фалло только в правом желудочке обнаружены в 4 наблюдениях, только в левом желудочке — в 2 наблюдениях, одновременно в правом и левом желудочках— в 2 наблюдениях, только в межжелудочковой перегородке — в 1 наблюдении.
Микроинфаркты миокарда в стадии начинающейся организации имелись в 14 наблюдениях, только что возникшие микромиомаляций — в 4 наблюдениях.
Приведенные материалы свидетельствуют о том, что микромиомаляций чаще всего развиваются в наиболее гипертрофированной части миокарда, несущей главную тяжесть функциональной нагрузки при той или иной форме порочного кровообращения. Так, например, микроинфаркты миокарда при врожденном сужении артериального конуса левого желудочка и при трикуспидальной атрезии развились в левом, наиболее гипертрофированном желудочке, в то время как при тетраде и пентаде Фалло и при других видах врожденных пороков сердца они чаще всего были обнаружены в правом, наиболее гипертрофированном желудочке.
Важно отметить также, что микромиомаляции, развивающиеся при врожденных пороках сердца, являются одним из источников кардиосклероза. Привлекает внимание и то, что микроинфаркты миокарда возникают без поражений коронарных артерий сердца, которыми можно было бы объяснить их развитие. Наши соображения о возможных причинах возникновения микромиомаляции при врожденных пороках сердца у маленьких детей при почти интактных коронарных артериях сердца будут изложены в следующем разделе исследования.
- Вернуться в оглавление раздела "Кардиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Соединительная ткань сердца при пороках. Коллагенизация сердца при врожденных пороках
Для оценки состояния миокарда важно точное знание изменений не только паренхиматозных элементов, но и межуточной ткани сердца. В результате работы, проведенной нами в 1946—1949 гг. в лаборатории, руководимой действительным членом АМН СССР проф. И. В. Давыдовским, было установлено, что в сердце при гипертонической болезни, митральном стенозе и хронической неспецифической пневмонии наряду с гипертрофией мышечных волокон возникает гиперплазия и коллагенизация интрамуральных решетчатых волокон. Эти сложные процессы, происходящие в соединительнотканном скелете гипертрофированного миокарда и являющиеся одной из причин кардиосклероза, могут способствовать развитию декомпенсации сердца.
При изучении аргирофильной стромы сердца при врожденных пороках нами обнаружено, что гипертрофия мышечных волокон сопровождается гиперплазией интрамуральных решетчатых волокон, причем выявлен параллелизм между этими процессами: наиболее интенсивно гиперплазия решетчатых волокон выражена в участках наибольшей гипертрофии миокарда, т. е. во внутренних слоях стенки, трабекулярных и папиллярных мышцах правого желудочка, при тетраде, пентаде, триаде Фалло и в тех же отделах миокарда левого желудочка при врожденном сужении артериального конуса левого желудочка.
Гиперплазия аргирофильной стромы миокарда выражается в увеличении количества интрамуральных аргирофильных волокон. Одним из основных механизмов новообразования продольных решетчатых волокон является их расщепление. Подобному расщеплению, правда, в меньшем объеме, подвергаются и длинные поперечные решетчатые волокна, перекидывающиеся через 3—4 мышечных волокна, а также наиболее утолщенные перимизиальные решетчатые волокна. Последние местами расщеплены с краю, однако не полностью и не больше чем на два волокна.
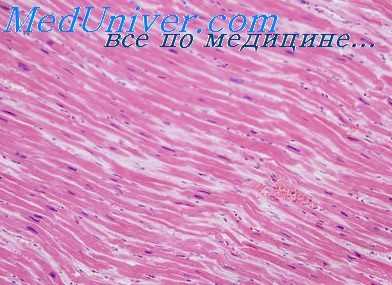
Новообразованные интрамуральные продольные и поперечные решетчатые волокна подвергаются коллагенизации. На быструю коллагенизацию новообразованных решетчатых волокон указывают А. И. Смирнова-Замкова (1947, 1949) и Е. И. Чайка (1940). Большой интерес представляют биохимические исследования В. Н. Ореховича, А. А. Тустановского и И. Е. Плотниковой (1948) над кристаллическими белками. Этим авторам удалось получить кристаллический белок, названный ими проколлагеном вследствие его способности при некоторых условиях превращаться в коллаген. Кристаллы этого белка имеют вид нитей или иголок, располагающихся параллельно друг другу. Авторы предполагают, что коллаген в организме образуется в результате синтеза белков типа проколлагена.
Приведенные исследования, по-видимому, могут служить биохимическим доказательством правильности морфологического положения о возможности превращения аргирофильных волокон в коллагеновые.
Система наружной аргирофильной мембраны, т. е. сеть перимизиальных решетчатых волокон, оплетающих мышечные волокна миокарда, не выявляется при обычных окрасках.
Однако в гипертрофированном сердце часть волокон из системы наружной аргирофильной мембраны может быть выявлена при окраске пикрофуксином вследствие их коллагенизации.
Внутренняя аргирофильная мембрана, т. е. сеть решетчатых волокон, расположенных в стенках артерий малого и среднего калибров, при врожденных пороках сердца изменена не была.
Кровоснабжение гипертрофированных отделов сердца. Кровоснабжение сердца при врожденном пороке
В далеко зашедших стадиях гипертрофии миокарда при гипертонической болезни и при ревматизме при наличии кардиосклероза также имеется гипоксия миокарда, однако отсутствует второе условие, необходимое, как мы думаем, для новообразования сосудов — незакончившаяся дифференцировка миокарда. Вот почему при гипертонической болезни и при ревматических пороках сердца не наблюдается такого большого количества сосудов в гипертрофированных отделах миокарда.
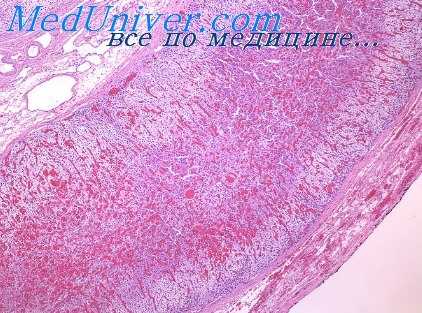
Возникает вопрос, почему авторы (Шонмакерс и Штратман, 1955), изучавшие ангиоархитектонику сердца при врожденных пороках, не обратили внимания на увеличение количества интрамуральных сосудистых ветвей. Мы думаем, что эти авторы выбрали не лучшую методику ангиорентгенографического исследования. Для проверки правильности наших наблюдений одни и те же сердца мы пробовали снимать на рентгеновскую пленку, заключенную в кассету с усиливающими вольфраматными экранами, как это делает большинство авторов, и на пленку, помещенную в пакет из черной бумаги при условии увеличенной в 10—15 раз экспозиции, как предложил В. Д. Арутюнов (1961).
При сравнении полученных ангиорентгенограмм оказалось, что на пленке, заключенной в кассету, сеть интрамуральных ветвей значительно реже, а рельеф получившихся сосудов менее четкий, чем на пленке, помещенной в пакет из черной бумаги. Предварительная проверка методик ангиорентгенографии и определила выбор наилучшей из них.
Мы привели ссылки на единичные, найденные нами в литературе, исследования, посвященные изучению сосудов сердца при врожденных пороках с помощью методики ангиорентгенографии. При ознакомлении с работами, авторы которых изучали сосуды сердца не при врожденных пороках сердца, а при гипертрофии другой этиологии, оказалось, что по вопросу о кровоснабжении гипертрофированного сердца до сих пор нет единого мнения.
А. Н. Надежин (1896), Христиан (Christian, 1927), Уорн (Wearn, 1928), Роберте (Roberts, 1941), Гросс и Спарк (Gross a. Spark, 1937), С. С. Вайль (1934—1940) считают, что между ростом гипертрофированных мышечных волокон и увеличением числа сосудов в миокарде нет параллелизма. Рюль (Ruhl, 1938), Линцбах (Linzbach, 1947), Т. Е. Ивановская (1948) обнаружили некоторое увеличение количества капилляров в миокарде, однако считают, что оно недостаточно для повышенной потребности гипертрофированного миокарда в кровоснабжении.
Док (Dock, 1941), Р. М. Коган (1947) полагают, что имеющаяся в здоровом сердце система сосудов вполне достаточна для кровоснабжения гипертрофированного сердца.
Грегг, Притчард, Чапей (Gregg, Pritchard, Shipley, 1943) установили в эксперименте на животных, что сужение легочной артерии приводит к усилению коронарного кровотока, особенно по системе правой коронарной артерии. Однако авторы не обнаружили новообразования сосудов в миокарде (опыты были произведены на половозрелых животных).
Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Врожденные пороки сердца - весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий – глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца – болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой - электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Читайте также:
