Осложнения операций на задней черепной ямке
Добавил пользователь Alex Обновлено: 29.01.2026
Список сокращений
ВВЭ — венозная воздушная эмболия
НВД — наружный вентрикулярный дренаж
ТМО — твердая мозговая оболочка
ЗЧЯ — задняя черепная ямка
Опухоли задней черепной ямки являются наиболее частой нейроонкологической патологией детского возраста [1, 2]. Подавляющее большинство их представлено медуллобластомами, пилоидными астроцитомами и эпендимомами [1]. Более половины опухолей локализуются по средней линии, занимая анатомически червь мозжечка и полость IV желудочка [1, 3]. Они часто вызывают окклюзионную гидроцефалию. Исторически подавляющее большинство таких опухолей оперировались в положении «сидя». Эта тенденция значительно изменилась в последние 30 лет. Так, сегодня 95% всех операций на ЗЧЯ в Японии проводятся в положении «лежа», для США и Европы эти цифры составляют 80 и 60% соответственно [4—6]. Каждое из этих положений имеет свои преимущества и недостатки. Важно отметить, что мировая тенденция перехода на положение «лежа» связана, главным образом, с высоким риском ВВЭ, развивающейся при выполнении операции в положении «сидя» [6].
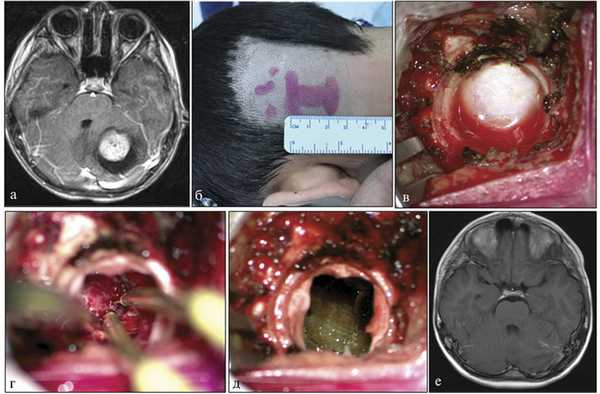
Наше решение о селективном использовании положения «лежа» было продиктовано не одной этой причиной. С 1999 по 2013 г. первый автор использовал только положение «сидя» для удаления опухолей ЗЧЯ. За этот период выполнено 606 операций. У пациентов с большими/гигантскими опухолями (чаще это были пилоидные астроцитомы с кистами) хирург часто сталкивался с проблемой резкого западения мозжечка и обрыва «мостиковых» вен, иногда вне зоны хирургического доступа. Такая ситуация вела либо к массивной кровопотере, либо к ВВЭ, вызывала значительный стресс как у пациента, так и у бригады, увеличивала время операции, в ряде случаев — приводила к стойкому неврологическому дефициту. Поэтому начиная с 2013 г. мы стали селективно использовать положения «лежа» при полушарных пилоидных астроцитомах мозжечка. Этот первичный опыт позволил нам оценить хирургические особенности непривычного положения, особенности расположения оборудования и участников операции, понять возможные ограничения и сложности, получить уверенность в возможности выполнения более сложных операций. С середины 2016 г. на фоне тенденции к использованию keyhole-доступов мы шире стали использовать положение «лежа на животе» в хирургии небольших опухолей ЗЧЯ, иногда удаление опухолей средних размеров проводилось даже из фрезевого отверстия (рис. 1). Рис. 1. Пример использования burhole-доступа для удаления средних размеров пилоидной астроцитомы мозжечка в положении «лежа». а — на предоперационном МРТ в режиме Т1 с контрастом визуализируется опухоль с небольшой кистой. Картина характерна для пилоидной астроцитомы; б — разметка кожного разреза; в — наложено фрезевое отверстие диаметром 12 мм; г — завершающий этап удаления опухоли из фрезевого отверстия; д — общий вид раны после выполнения гемостаза; е — контрольная МРТ в режиме Т1 с контрастом, выполненная через 2 мес после операции, подтверждает радикальность удаления опухоли. С конца 2016 г. мы начали «рутинное» использование положения «лежа на животе» и при опухолях IV желудочка. С ноября 2016 г. по сентябрь 2017 г. первым автором этой статьи выполнено 113 операций по поводу опухолей ЗЧЯ у детей, их них лишь 4 операции — в положении «сидя». Таким образом, менее чем за год положение «лежа на животе» стало основным в хирургии всех опухолей ЗЧЯ в практике первого автора этой статьи, в которой мы хотим поделиться своими практическими соображениями как об использовании положения «лежа на животе», так и о тех преимуществах и недостатках, которые с ним связаны.
Общее представление об удалении опухоли IV желудочка в положении «лежа на животе»
Особенности подготовки пациента
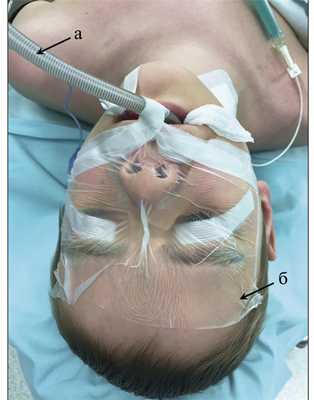
С хирургической точки зрения, пациент не требует какой-либо особой подготовки. Из анестезиологических особенностей важно то, что при установке венозных катетеров для инфузии различных жидкостей необходимо учитывать, что верхняя часть тела пациента будет абсолютно недоступной для анестезиолога после драпировки операционного поля и расположения вокруг пациента хирургической бригады. Оротрахеальная интубация осуществляется армированной трубкой в связи с вероятностью перегиба обычной трубки, особенно малого диаметра. Установка желудочного зонда желательна во всех случаях в связи с высоким риском регургитации (мы используем орогастральное зондирование. По окончании операции зонд удаляется в операционной). Под веки закладывается защитный глазной гель и вся область лица тщательно заклеивается стерильной прозрачной пленкой (рис. 2). Рис. 2. Интубация и подготовка лица пациента для предотвращения возможного затекания антисептика в глаза при обработке операционного поля. а — использование армированной трубки позволяет избежать проблем с ее перегибом; б — область глаз широко заклеивается «инцизионной» изолирующей пленкой для предотвращения возможного затекания антисептика. В самом начале использования положения «лежа на животе» в хирургии ЗЧЯ у нас было 2 случая химического кератита из-за затекания средства для обработки операционного поля в заклеенные по «общепринятой методике» глаза. Объяснение оказалось очень простым: в положении «лежа на животе» область латерального угла глаза является одной из самых нижних точек лица, куда стекает дезинфицирующее средство при обработке операционного поля. Использование мочевого катетера желательно даже при планировании очень коротких операций, так как в случае необходимости поставить его во время операции будет проблематично.
Особенности планирования операции
Хирург работает с одной или двух сторон от пациента, располагаясь на линии его плеч. Основное направление оптической оси микроскопа: «под острым углом» к проекции дна IV желудочка (рис. 3). Рис. 3. Схематическая иллюстрация угла обзора микроскопа по отношению к дну IV желудочка. Красная пунктирная линия изображает угол по отношению к дну IV желудочка, под которым обычно происходят манипуляции в ране при правильном позиционировании пациента на операционном столе. Наше первоначальное опасение касалось доступности наиболее ростральных отделов опухоли — в области водопровода мозга и верхнего паруса. Как хирургической опыт, так и анализ данных МРТ с геометрическими построениями «углов атаки» полностью развеял это предубеждение (рис. 4). Рис. 4. Интраоперационное фото вида на устье сильвиевого водопровода после удаления медуллобластомы червя мозжечка и IV желудочка. а — край кожной раны; б — дно IV желудочка (ромбовидная ямка); в — дистальное устье сильвиевого водопровода. Наибольшие трудности доставляет ипсилатеральный заднебоковой полюс опухоли. Примерно в 1/3 случаев приходится менять положение хирурга и микроскопа и быть готовыми работать с двух сторон от пациента. Для максимального комфорта манипуляций голову пациента следует согнуть таким образом, чтобы плоскость дна IV желудочка была по возможности максимально приближена к вертикальной. В этом случае проблем с ростро-каудальной доступностью полюсов опухоли не наблюдается (рис. 5). Рис. 5. Положение пациента на операционном столе для удаления опухоли IV желудочка. На врезке вверху показана проекция структур мозга. Разрез кожи примерно на 1/3 иногда даже в 2 раза короче аналогичного разреза при положении «сидя». В среднем достаточно 5 см разреза. В отличие от положения «сидя», нижнее удлинение разреза не увеличивает доступность ростральных отделов IV желудочка. Сейчас мы планируем нижний край разреза на уровне верхнего края С1 позвонка или даже края большого затылочного отверстия при широком промежутке С0—С1 (в ряде случаев мы удаляли опухоль IV желудочка через анатомически широкий промежуток С0—С1, что невозможно сделать в положении «сидя»). Хирургу стоит больше беспокоиться о латеральной доступности опухоли — именно она диктует размер краниотомии. Вне зависимости от выраженности гидроцефалии мы не используем наружный вентрикулярный дренаж (НВД) интраоперационно (в положении «сидя» у всех пациентов с гидроцефалией НВД имплантируется сразу после введения их в наркоз).
Особенности расположения персонала и оборудования
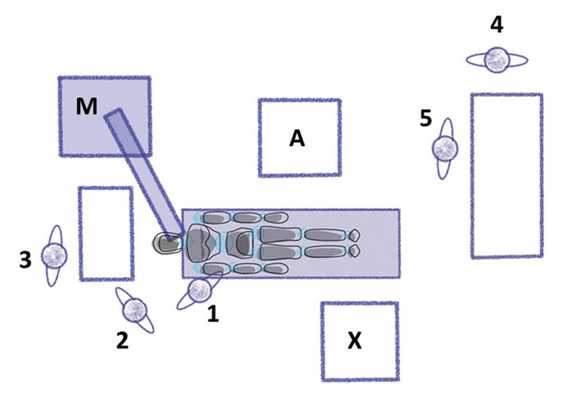
Мы адаптировали имеющееся у нас расположение оборудования, учитывая, что такие приборы, как наркозный аппарат, консоли с приборами, микроскоп, фактически стационарны и могут быть перемещены только в небольших пределах (рис. 6). Рис. 6. Схема расположения участников операции. 1 — хирург; 2 — ассистент; 3 — операционнная сестра; 4 — анестезиолог; 5 — анестезистка; А — анестезиологическая консоль с наркозным аппаратом; М — микроскоп; Х — хирургическая консоль со всем оборудованием. Такой подход к решению проблемы «привыкания» всех участников операции показал высокую эффективность. Фактически все они, кроме хирурга, продолжали работать в привычных условиях. Кроме того, предложенная расстановка позволяет при необходимости легко и быстро поменять сторону работы хирурга.
Особенности манипуляций
Работа на мягких тканях и выполнение краниотомии мало отличаются от таковых в положении «сидя». При долго существующей выраженной гидроцефалии следует быть готовыми к выраженному венозному кровотечению из эмиссариев (контролируется воском). В большинстве случаев вскрытие ТМО не требует выполнения «классического» Y-образного разреза — достаточно V-образного до уровня атланто-окципитальной мембраны. В случае выраженного окципитального и/или маргинального синусов разрез ТМО следует производить максимально быстро и полно, после чего контролировать кровотечение наложением зажима и прошиванием синуса обвивным швом. Самым неэффективным следует признать попытки гемостаза (клипирование, коагуляция и т. д.) при частичном вскрытии ТМО. После вскрытия ТМО она подшивается к мягким тканям внутри операционной раны, а не отводится на «держалках» наружу. Такой метод позволяет эффективнее развести края ТМО, обеспечить широкие «углы атаки», что особенно актуально при уменьшенном кожном разрезе. В связи с несколько повышенной кровоточивостью тканей, стеканием всех жидкостей в зону операции края костного распила обкладываются ватниками. Далее вскрывается арахноидальная мембрана большой цистерны, спинальное субарахноидальное пространство тампонируется ватником и далее через отверстие Мажанди начинается этап удаления опухоли. При нерасширенном отверстии Мажанди возможно использование теловелохороидального доступа или рассечение нижнего паруса IV желудочка. Благодаря положению пациента шпатели не применяются (более того они скорее всего будут мешать, занимая место в ране). Используется метод «динамической ретракции», когда попеременно ретрактором является один из инструментов в руках хирурга. Первый этап — внутренняя декомпрессия ‒ проводится в направлении «сверху вниз», его цель — выйти к области обычно расширенных ростральных отделов IV желудочка (область устья водопровода). Устье водопровода мы сразу тампонируем ватником для предотвращения затекания крови в желудочковую систему. При правильной укладке пациента и вертикальной позиции дна IV желудочка риск повреждения ствола минимален, хотя такой хорошей анатомической ориентировки, как при положении «сидя», в начале удаления нет. После выхода в ростральные отделы IV желудочка ориентировка в ране и взаимоотношения опухоль/ствол становятся ясными, и дальнейшее удаление опухоли мало отличается от удаления в положении «сидя». Самый большой недостаток — фактическая невозможность эффективной работы без отсоса. В начале операции рана постоянно наполняется ликвором с кровью и требует активной аспирации. По мере удаления опухоли кровотечение и количество ликвора уменьшаются и работать становится комфортнее. По мере удаления опухоли рана имеет тенденцию к расправлению стенок (мы работаем без ретракторов). Чтобы удержать стенки раны в удобном для манипуляции положении, следует использовать ватники, которые укладываются на место удаленной опухоли и позволяют атравматично смещать края мозговой раны по ходу операции. Этап гемостаза особенностей не имеет.
Особенности раннего послеоперационного периода
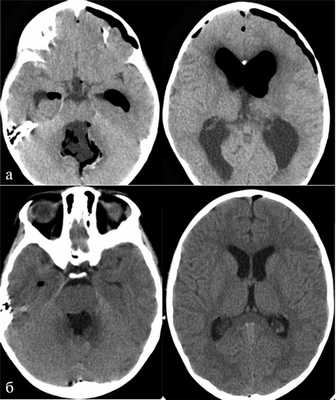
Наш опыт показывает, что при удовлетворительном предоперационном состоянии пациента, отсутствии данных за инфильтрацию ствола во время операции и значимых отклонений в течении анестезии, пациенты, оперированные в положении «лежа», могут после пробуждения быть переведены в общее отделение. Уровень их активности и бодрствования в первые несколько суток, по нашим субъективным оценкам, выше, чем у аналогичных пациентов, оперированных в положении «сидя». Основным объяснением этого феномена мы видим меньшую степень пневмоцефалии и особенно меньшее количество воздуха в желудочковой системе (рис. 7). Рис. 7. Количество интракраниального воздуха в 1-е сутки после операции в зависимости от положения пациента на операционном столе. а — КТ пациента после удаления медуллобластомы червя мозжечка и IV желудочка в положении «сидя». Обращает на себя внимание выраженная пневмоцефалия, сглаженность и сдавленность субарахноидальных пространств, несмотря на наличие у пациента функционирующего НВД, установленного в начале операции; б — КТ пациента после удаления медуллобластомы червя мозжечка и IV желудочка в положении «лежа». Отмечается минимальное количество интракраниального воздуха, хорошая релаксация желудочковой системы, широкие субарахноидальные пространства. Следует отметить, что в положении лежа мы не используем периоперационный НВД вне зависимости от степени выраженности гидроцефалии. Возможно, некоторый вклад в раннюю активизацию вносят и отсутствие НВД, и меньший объем диссекции мягких тканей (менее выраженный болевой синдром). Некоторые пациенты могли быть выписаны на 2—3-и сутки после операции в хорошем состоянии. Такой ранней выписки мы не наблюдали ни у одного пациента, оперированного в положении «сидя».
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Применение современных нейрохирургических технологий привело к тому, что в ведущих специализированных клиниках такие показатели, как послеоперационная летальность и периоперационные осложнения, приобретают следовые значения. С онкологической точки зрения, дифференцированные подходы к комбинированному лечению в ряде наблюдений позволяют достичь длительной ремиссии или даже полного выздоровления детей с данной патологий. В целом следует отметить, что за несколько последних десятилетий результаты лечения опухолей задней черепной ямки стали не столь плачевны.
В условиях сложившейся парадигмы даже небольшие и редкие осложнения операции носят откровенный трагический оттенок. Дальнейшее снижение рисков хирургических осложнений является, безусловно, актуальной прикладной задачей. Периоперационные проблемы, связанные с позиционированием больного на операционном столе, представляют отдельную группу осложнений.
В целом требования к позиционированию хирургического пациента на операционном столе включают удобство для пациента, адекватное поддержание общего гомеостаза (гемодинамика, оксигенация), предотвращение травм суставов, нервных стволов и пролежней, комфортный подход к хирургическому полю и возможность адекватного использования хирургического оборудования (операционные микроскопы, эндоскопы и т.п.). С этих позиций положение «сидя» является одним из самых опасных в хирургии вообще и нейрохирургии в частности. Прежде всего это воздушная эмболия, обрывы «мостиковых» вен и позиционные плекситы. Последние, конечно, весьма тяжелы в плане восстановления, но, в отличие от первых, не несут откровенной угрозы жизни пациента и не приводят к тяжким последствиям. Поэтому стремление избежать указанных проблем за счет смены позиции пациента весьма понятно.
Ю.В. Кушель и соавт. в публикации «Хирургия опухолей задней черепной ямки у детей в положении «лежа на животе» подробно оценивает достоинства и недостатки альтернативной положению «сидя» позиции. В статье подробно изложены не только особенности хирургической техники удаления опухолей задней черепной ямки у детей, но и такие важные составляющие позиционирования, как «венозный» доступ, профилактика кератитов, расположение медицинского оборудования и персонала, что позволяет представить данную публикацию как описание полноценной хирургической технологии. Статья, безусловно, представляет интерес для большого круга нейрохирургов, практикующих в зоне представленного интереса, и может служить примером скрупулезного вдумчивого анализа «простых» — только на первый, непосвященный взгляд хирургических проблем.
Что касается собственного опыта в хирургии опухолей задней черепной ямки вообще и у детей в частности, то положение на операционном столе выбирается индивидуально в зависимости от возраста, телосложения, сопутствующих заболеваний и анатомического варианта расположения новообразования в ходе предоперационного планирования путем сравнения рисков возможных осложнений.
В заключение хочется поздравить команду авторов с еще одной изящной и полезной публикацией.
Осложнения операций на задней черепной ямке
Существует четыре возможных подхода к лечению пациентов с опухолями мостомозжечкового угла (ММУ) и внутреннего слухового прохода (ВСП):
(1) наблюдение;
(2) микрохирургическое удаление;
(3) стереотаксическая радиохирургия;
(4) комбинированное лечение.
Наблюдение возможно за небольшими бессимптомными опухолями, либо за опухолями, которые не растут со сколько-нибудь значимой скоростью. В одном исследовании, в котором анализировалось естественное течение заболевания у 552 пациентов, которым проводился последовательный МР-контроль в среднем в течение 3,6 лет, значимый рост отмечался у 17% опухолей, ограниченных внутренним слуховым проходом (ВСП), и у 28,9% опухолей, выходящих за пределы внутренних слуховых проходов (ВСП).
Если опухоль растет, обычно этот рост выявляется в течение первых 5 лет с момента постановки диагноза. Тем не менее, не все опухоли характеризуются таким медленным ростом. Некоторые из них растут стремительно. Таким пациентам лечение нужно оказывать в достаточно короткие сроки, чтобы предотвратить развитие возможных осложнений (снижения слуха, головокружения, сдавления ствола мозга, гидроцефалии, комы и смерти).
Динамику заболевания при небольших опухолях разумно оценивать при помощи аудиометрии и МРТ. Обычно МРТ и аудиометрию повторяют через шесть месяцев после постановки диагноза. Если значительного роста нет, в дальнейшем исследования можно повторять один раз в год. В мета-анализе случаев с небольшими опухолями и хорошим слухом, у пациентов с медленно растущими опухолями (< 2.5 мм) вероятность сохранения слуха была выше, чем у пациентов с быстро растущими образованиями (75% и 32%, р< 0,0001).
Микрохирургическое удаление может быть слухосохраняющим и слухоразрушающим. Существуют разные критерии, ориентируясь на которые можно выбрать тот или иной подход, но в первую очередь учитываются степень снижения слуха и размер опухоли. Под «рабочими» показателями слуха понимают реально достижимые показатели, которых больному будет достаточно для восприятия речи. «Рабочий» слух может подразумевать как нормальный или почти нормальный слух, так и показатели, что которых возможна реабилитация при помощи слухового аппарата.
Ориентироваться можно на правило «50/50». Если РТА (или SRT) хуже 50 дБ ПС, a SDS меньше 50% (класс D и Е по классификации AAO-HNS или классы 3,4,5 по Gardner-Robertson), считается, что слух пациента выходит за пределы «рабочего» уровня. В целом, сохранение рабочего слуха (класс А и В по AAO-HNS) возможно только у 40-50% больных с опухолями менее 2 см.
Сохранение слуха возможно при использовании доступа через среднюю черепную ямку и ретросигмоид-ного (PC) доступа. Транслабиринтный (ТЛ) доступ не подразумевает сохранения слуха; он обеспечивает наилучшую визуализацию ММУ и наименьшее интраоперационное смещение мозжечка, но в ущерб слуху. Кроме размера опухоли и уровня слуха также нужно ориентироваться на локализацию опухоли, возраст пациента, состояние вестибулярного аппарата, предпочтения хирурга и пациента. Транслабиринтный и ретросигмоидный доступы будут описаны ниже. Все операции на ММУ рутинно сопровождаются интраоперационным мониторингом состояния лицевого нерва.
а) Транслабиринтный доступ к опухоли задней черепной ямки. И хотя транслабиринтный доступ не подразумевает сохранения слуха, он удобен для опухолей любого размера и любой локализации. Он позволяет хирургу полностью визуализировать мостомозжечковый угол (ММУ) и внутренний слуховой проход (ВСП), в том числе наиболее латеральную часть ВСП. Также он позволяет хирургу достаточно легко визуализировать оба вестибулярных нерва, т.к. при этом доступе лицевой нерв будет лежать медиальнее.
Операция начинается со стандартного С-образного разреза, аналогичного таковому при мастоидэктомии, с тем лишь исключением, что разрез выполняется немного дальше кзади. Выполняется широкая мастоидэктомия. Затем удаляется кость с сигмовидного синуса, твердой мозговой оболочки задней и средней черепных ямок. Некоторые хирурги предпочитают оставлять небольшой участок кости на уровне сигмовидного синуса («островок Билла»), чтобы защитить синус от инструментов и вращающегося бора во время выделения и удаления опухоли.
Затем выполняется лабиринтэктомия, ВСП скелетонизируется от уровня дна (наиболее латеральной части) до внутреннего слухового прохода. Нужно удалить кость на протяжении 270° вдоль окружности ВСП. Достаточно часто при сверлении в области ниже ВСП и выше луковицы яремной вены происходит вскрытие водопровода улитки. При этом из отверстия начинает изливаться ликвор, происходит умеренная декомпрессия задней черепной ямки.
Затем аккуратно вскрывается твердая мозговая оболочка задней черепной ямки ниже верхнего каменистого синуса и выше луковицы яремной вены. После этого можно визуализировать седьмой и восьмой черепные нервы, их выход из моста и ход вдоль ММУ к ВСП. Латеральнее, на уровне дна ВСП, можно пропальпировать «гребень Билла», отделяющий лицевой нерв спереди от верхнего вестибулярного нерва сзади. Поперечный гребень разделяет ВСП на верхний и нижний отделы.
После удаления опухоли дефект обычно закрывается трансплантатом из внутрибрюшной жировой клетчатки, поскольку герметично закрыть дефект в твердой мозговой оболочке через этот доступ невозможно. Чтобы предотвратить назоликворею среднее ухо и слуховая труба заполняются надкостницей или мышцей, антрум и клетки сосцевидного отростка укрываются височной фасцией и/или костным воском. Жировой трансплантат укладывается в дефект после краниотомии, рана послойно ушивается над жировой тканью.

Этапы транслабиринтного доступа при резекции акустической невриномы.
(а) Полная мастоидэктомия.
(б) Декомпрессия средней черепной ямки, сигмовидного синуса, твердой мозговой оболочки задней черепной ямки.
(в) Лабиринтэктомия.
(г) Скелетонизация внутреннего слухового прохода.
(д) Удаление кости с внутреннего слухового прохода.
(е) Отделение опухоли от лицевого нерва.
(ж) Внутренний слуховой проход после удаления образования.
(з) Заполнение послеоперационного дефекта жировой тканью.
AN, акустическая невринома. IAC, внутренний слуховой проход. НС, горизонтальный полукружный канал.
MFD, твердая мозговая оболочка средней черепной ямки. PC, задний полукружный канал. PFD, твердая мозговая оболочка средней черепной ямки.
SC, верхний полукружный канал. SS, сигмовидный синус. Стрелка, наковальня. VII, лицевой нерв.
б) Ретросигмоидный доступ к опухоли задней черепной ямки. Преимущество ретросигмоидного доступа заключается в том, что он знаком большинству нейрохирургов, которые иногда еще называют его субокципитальным. Эти два термина часто используют взаимозаменяемо, хотя ретросигмоидный доступ обычно проходит чуть ближе к сигмовидному и поперечному синусам. В отдельных случаях использование этого доступа позволяет сохранить слух пациенту, тем не менее, если требуется доступ к латеральной трети внутреннего слухового прохода (ВСП), шансы на сохранение слуха невелики.
Если делается попытка сохранить слух, интраоперационно выполняется исследование слуховых вызванных потенциалов (СВП). Важно следить за тем, чтобы растворы антисептиков не попадали в наружный слуховой проход, потому что это исказит результаты исследования СВП.
Операция начинается с разреза, аналогичного разрезу при транслабиринтном доступе. Важно широко обнажить заднюю часть верхушки сосцевидного отростка и основание черепа. Чтобы минимизировать болевые ощущения со стороны шеи в послеоперационном периоде, грудино-ключично-сосцевидную мышцу рассечь нужно как можно ближе к коже, в месте ее крепления к сосцевидному отростку, а не разрезать ее брюшко, расположенное ниже. Затем при помощи режущих и алмазных боров проводится краниэктомия в области кзади от сигмовидного синуса и ниже поперечного синуса. В этой области часто можно встретить эмиссарные вены сосцевидного отростка, проходящие за сигмовидным синусом.
Для гемостаза используется биполярная коагуляция и костный воск. Если планируется выполнение аутокраниопластики, костную стружку нужно собирать. Отверстие в кости должно составлять около 3 см в диаметре.
Затем твердая мозговая оболочка вскрывается вдоль заднего края сигмовидного синуса острым путем и крепится в открытом виде плетеными нейлоновыми нитками. Часто опухоль можно удалить без высверливания ВСП, это зависит от того, насколько опухоль распространяется латеральнее ВСП. Если приходится прибегнуть к высверливанию ВСГ1, для предотвращения попадания костной стружки за твердую мозговую оболочку необходима губка с желатином или другой барьерный материал; поскольку это позволяет уменьшить послеоперационную головную боль и предотвратить развитие асептического химического менингита.
К моменту удаления опухоли края твердой мозговой оболочки обычно оказываются высохшими, но почти во всех случаях можно добиться их регидратации путем простого орошения. Это необходимо для первичного ушивания мозговой оболочки и герметичного закрытия дефекта. При необходимости укрепить область ушивания твердой мозговой оболочки можно фрагментом мышцы или каким-либо синтетическим материалом. Чтобы снизить риск развития хронической послеоперационной головной боли, важно разделять твердую мозговую оболочку и слой мышцы. Для этого на мозговую оболочку можно уложить смесь костной стружки с кровью («костная глина»), а затем внутрибрюшной жир.
в) Многоэтапное удаление опухоли задней черепной ямки и комплексное лечение. В некоторых случаях полному удалению опухоли могут воспрепятствовать технические сложности во время операции, либо интраоперационное изменение общего состояния больного. Иногда пожилым пациентам или пациентам, имеющим противопоказания к операции, у которых имеется опухоль большого размера, проводится только экономная резекция с целью декомпрессии ствола мозга. Этот подход позволяет избежать длительного наркоза, который требуется для полного удаления. В случае субтотальной или почти полностью удаленной опухолью остается три варианта дальнейших действий:
(1) наблюдение за ростом оставшейся опухоли;
(2) второй этап операции для полного удаления;
(3) послеоперационная стереотаксическая хирургия (комплексное лечение).
Принимая решение следует обязательно учитывать всю полученную клиническую информацию, это позволяет значительно повысить шанс сохранения функции лицевого нерва, особенно в случаях крупных вестибулярных шванном (ВШ).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Анестезия при нейроэндоскопической операции. Осложнения
В нейроэндоскопии используются твердые, полугибкие или гибкие эндоскопы, которые вводятся в полость черепа через грепанационпое отверстие, а затем сквозь паренхиму мозга проводятся в желудочковую систему. Операции проводятся на областях, доступных через желудочковую систему.
Другие нейроэндоскопические процедуры:
• Биопсия интра- и паравентрикулярных опухолей.
• Марсупиализация кист краниофариигиомы.
• Марсупиализация арахноидальных кист
• Фенестрация прозрачной перегородки.
Предоперационная оценка перед нейроэндоскопической операцией:
• Используются стандартные принципы анестезиологического осмотра детей перед нейрохирургической процедурой.
• Перед проведением процедур, включающих марсупализацию кист целесообразен анализ снимков.
• Как и при других хирургических вмешательствах с длительной внутричерепной гипертензией, у пациентов возможно недоедание и дегидратация.
• Симптомы повышенного ВЧД или визуализациотшое подтверждение масс-эффекта, вызванного кистой, должны усилить бдительность во время операции в отношении к нестабильности сердечной деятельности, возникающей из-за внезапных изменений давления между внутричерепными пространствами.

Анестезия при нейроэндоскопической операции
Применяются стандартные принципы нейроанестезии:
• Если эндоскопическая вентрикулостомия третьего желудочка предшествует формальному обследованию задней черепной ямки, то в соответствии с ним подбирается и метод анестезии.
• Интраоперационная нестабильность сердечно-сосудистой системы, особенно брадикардия, чаще всего хирургического происхождения и в большинстве случаев связана с:
- с чрезмерным промыванием или с блокированием оттока жидкости диатермией вблизи чувствительных зон.
• Интраоперационная анальгезия может проводиться фентанилом.
• В послеоперационном периоде вполне достаточно будет легкой перораль-ной анальгезии.
Мониторинг в ходе нейроэндоскопической операции. Прямое измерение артериального давления можно использовать для подстраховки при эндоскопической вентрикулостомии III желудочка, но это не является обязательным. Подобный мониторинг подойдет для более инвазивных нейроэндоскопических процедур, таких как марсупализация кист.
Осложнения нейроэндоскопической операции
Реакиия Кушинга:
• Гипертеизия и брадикардия, развивающиеся вследствие повышения ВЧД.
• Чаще всего вызвана нарушением оттока промывных жидкостей.
Нестабильность сердечной деятельности или аритмии. Могут быть вызваны прямой хирургической травмой или агрессивным промыванием для контроля кровотечения.
Кровотечение. Может стать причиной прекращения операции. Всегда оставляется наружный вентрикулярный дренаж.
Одностороннее расширение зрачка. Зрительный нерв и перекрест лежат в относительной близости к III желудочку и могут быть повреждены при диатермии во время эндоскопической вентрикулостомии III желудочка, вызывая временное расширение зрачка в раннем послеоперационном периоде. Специального лечения не требуется, но возникновение одностороннего расширения зрачка необходимо детально описать в истории болезни во избежание последующих недоразумений.
Несахарный диабет (НД). Чаще всего встречается после операций по поводу кист краниофарингеом. Этим пациентам необходим специфический мониторинг для выявления несахарного диабета в послеоперационном периоде.
Советы анестезиологам по ведению нейроэндоскопической операции:
• При нестабильности сердечной деятельности, скажите хирургам, например: «Прекратите промывание!»
• Смотрите на мониторы анестезии, а не на интересное видео на экране эндоскопа.
• Сама по себе операция не очень болезненна, однако промывание обычно связано с проблемами.
• Не продолжайте попытки установить артериальный катетер новорожденным и детям, если это не удалось сразу. Преимущества инвазииного мониторинга у маленьких детей ограничены.
Основная цель операции по удалению опухоли мостомозжечкового угла (ММУ) — сохранение жизни пациента. В современную эпоху микрохирургии основания черепа летальные исходы и инсульты встречаются крайне редко, в настоящий момент все усилия направлены на уменьшение числа осложнений. Мероприятия по сокращению числа общехирургических осложнений известны: раннее удаление всех ненужных катетеров (катетер Фолея, артериальные катетеры), ранняя выписка, использование медицинских пневмокомпрессоров, антибиотики в периоперационном периоде, побудительная спирометрия. Но некоторые осложнения характерны именно для операций на основании черепа.
Согласно результатам одного мета-анализа, в котором оценивались результаты порядка 5964 операций, риск возникновения ликвореи может достигать 10,6%, при этом он не связан с возрастом пациента или размером опухоли. Ликвор может вытекать через нос (назоликоврея), через ухо (отоликворея) или через разрез кожи. Для лечения используются слабительные, постельный режим, люмбальный дренаж и/или хирургическая пластика дефекта. Бактериальный менингит, еще одно осложнение, на фоне ликвореи встречается чаще, лечится внутривенными антибиотиками.
Асептический менингит возникает при попадании костной стружки или других раздражителей под твердую мозговую оболочку, обычно назначаются кортикостероиды. Если у пациента в послеоперационном периоде развивается лихорадка и клиника менингита, следует провести тщательную диагностику (люмбальная пункция, анализ ликвора).
Также после удаления опухолей мостомозжечкового угла (ММУ) и внутреннего слухового прохода (ВСП) возможно возникновение раннего или отложенного пареза лицевого нерва. Ранний паралич обычно возникает вследствие нейропраксии из-за растяжения нерва при удалении опухоли. Такие повреждения чаще встречаются при удалении опухолей большого диаметра. В редких случаях возникает полный паралич лицевого нерва после его пересечения или другой ятрогенной травмы. Отложенный паралич возникает либо при реактивации латентной вирусной инфекции, либо при отложенном отеке лицевого нерва.
Он может возникать у 15% больных, некоторые врачи для снижения риска такого осложнения рекомендуют в периоперационном периоде назначать противовирусные препараты. Назначение в предоперационном периоде кортикостероидов позволяет снизить риск и раннего, и отложенного нареза. У большинства пациентов с отложенным парезом функция нерва восстанавливается, у 90% восстановление происходит в полном объеме.
Достаточно часто пациенты жалуются на головную боль, как после операций транслабиринтным, так и ретросигмоидным доступом, но чаще головная боль встречается все-таки при ретросигмоидных операциях. Как уже говорилось выше, для того, чтобы снизить вероятность развития длительного болевого синдрома, во время операции нужно отделить твердую мозговую оболочку от выйной мускулатуры.
Тиннитус часто беспокоит пациентов еще до операции. И хотя некоторые пациенты отмечают, что после лечения шум в ухе исчез или стал меньше, у некоторых пациентов, напротив, шум появляется с новой силой. Каких-либо общепринятых методов предотвращения тиннитуса или предсказания вероятности его появления не существует.
И хотя шаткость и вертиго (головокружение) не являются осложнением, после операции они встречаются достаточно часто, особенно при использовании транслабиринтного доступа. Обычно симптомы обратно пропорциональны ослаблению калорических реакций в предоперационном обследовании. Пациенты, у которых внутреннее ухо до операции страдало сильнее, уже начали вырабатывать компенсационные механизмы (со стороны ЦНС и противоположного уха), поэтому одностороннее отключение внутреннего уха влияет на них в меньшей степени.
Неоценима роль ранней выписки (с поддержкой) и вестибулярной реабилитации, которая начинается с первого дня. Полноценная вестибулярная терапия большинству больных после выписки не требуется.
Ключевые моменты:
• Двумя наиболее распространенными опухолями мостомозжечкового угла (ММУ) являются вестибулярная шваннома и менингиома.
• Двумя доступами, не подразумевающими сохранение слуха, являются транслабиринтный и ретросигмоидный доступ.
• Существует четыре возможных подхода к лечению пациентов с опухолями мостомозжечкового угла (ММУ) и внутреннего слухового прохода (ВСП):
(1) наблюдение;
(2) микрохирургическое удаление;
(3) стереотаксическая радиохирургия;
(4) комбинированное лечение (хирургическое удаление + послеоперационная радиохирургия).
• Золотым стандартом диагностики вестибулярной шванномы (ВШ) является МРТ головного мозга и ВСП с гадолинием.
• Нейрофиброматоз 2 (НФ2) — это аутосомно-доминантное генетическое заболевание, развитие которого обусловлено мутацией гена на хромосоме 22 (22q12), которая вызывает нарушение строения белка-супрессора опухолевого роста, мерлина.
• Наиболее распространенным типом менингиомы является тип I по ВОЗ.
• У пациентов с поражением ретрокохлеарного отдела слухового анализатора часто встречается парадоксальный феномен, когда увеличение громкости речи сопровождается снижением ее восприятия.
ЛТ — лучевая терапия
МРТ — магнитно-резонансная томография
GTR — (gross total resection) тотальное удаление
Опухоли центральной нервной системы являются вторыми по частоте среди онкологических заболеваний детского возраста и занимают первое место среди солидных опухолей у детей. Частота новообразований центральной нервной системы у детей в возрасте от 0 до 19 лет составляет 3,5—4,0 на 100 тыс. детского населения [1—3]. Ежегодно в России регистрируют 1000—1200 новых случаев опухолей головного мозга [4]. 60—70% их располагается инфратенториально [5]. Среди опухолей ЗЧЯ у детей выделяются три наиболее распространенных гистологических варианта: медуллобластома (40%), астроцитома (20—35%) и эпендимома (10%) [4, 6].
Лечение первично выявленных злокачественных нейроэпителиальных опухолей ЗЧЯ у детей изучается достаточно давно. В настоящий момент существует множество различных протоколов лечения данных опухолей, которые приводят к существенным положительным результатам. Одним из основных способов лечения первичных злокачественных опухолей ЗЧЯ является хирургическая резекция, выполняемая первым этапом. Степень радикальности этой операции — важный прогностический фактор [6—8].
Несмотря на достигнутые успехи в лечении злокачественных нейроэпителиальных опухолей, многие из них рецидивируют. Так, для детей с медуллобластомами 5-летняя и 10-летняя безрецидивная выживаемость составляет 81±2 и 75,8±2,3 мес соответственно; общая выживаемость — 87±1,8 и 81,3±2,1 мес соответственно [9]; при анапластических эпендимомах средний период без прогрессирования — 66,2 мес (от 11 дней до 23 лет) [10]. По мнению детских нейроонкологов, максимально радикальное удаление локальных рецидивов злокачественных нейроэпителиальных опухолей ЗЧЯ улучшает общий прогноз, позволяет более эффективно использовать дополнительные схемы адъювантного лечения, а при эпендимомах является единственной эффективной опцией.
Цель настоящего исследования — оценить степень радикальности удаления рецидивов злокачественных нейроэпителиальных опухолей ЗЧЯ у детей, а также вероятность развития и структуру послеоперационных осложнений.
Материал и методы
Работа основана на результатах анализа проспективной группы пациентов детского возраста, оперированных в НМИЦ нейрохирургии по поводу рецидива злокачественных нейроэпителиальных опухолей ЗЧЯ в период с 2002 г. по июнь 2015 г. Были прооперированы 50 детей (30 мальчиков и 20 девочек) одним хирургом. Возраст пациентов на момент повторной операции составил от 1,4 до 14,6 года (медиана 5,8 года). Все дети проходили комплексное лечение у онкологов, и при выявлении рецидива опухоли направлялись в НМИЦ нейрохирургии для решения вопроса о повторной операции. Операцию предлагали только тем пациентам, которым, по экспертной оценке хирурга с большим опытом выполнения подобных вмешательств, основанной на МРТ и клинической картине, предполагалось возможным радикальное удаление опухоли. Из общего числа направленных на консультацию детей в повторной операции было отказано примерно каждому 5-му ребенку (около 20%). Такие дети чаще всего получали лучевую терапию в различных вариантах.
Радикальность удаления опухоли определяли в соответствии со следующими критериями: тотальное удаление (gross total resection, GTR) — нет остатков опухоли на контрольных МРТ с контрастом, нет упоминания об инфильтрации опухолью окружающих тканей в протоколе операции; «почти тотальное удаление» (near total resection — NTR) — нет остатков опухоли на контрольных МРТ с контрастом, но есть упоминание о явной зоне инфильтрации опухолью ствола мозга или поражении ею корешков черепно-мозговых нервов; «субтотальное удаление» (subtotal resection — STR) — остаточная ткань опухоли любого объема на контрольных МРТ с контрастом.
Для оценки послеоперационных осложнений анализировали следующие показатели: до- и послеоперационный неврологический статус, общехирургические осложнения, длительность нахождения в реанимации, длительность госпитализации, необходимость в дополнительных оперативных вмешательствах.
Результаты
В анализируемой серии отмечено значительное превалирование анапластических эпендимом над медуллобластомами — 37 (74%) и 13 (26%) соответственно. Это объясняется тем, что адъювантная терапия анапластических эпендимом ограничивается лучевой терапией, которая часто малоэффективна. В связи с этим онкологи чаще направляют детей с рецидивом анапластической эпендимомы для повторного удаления. Нужно отметить, что некоторые пациенты были оперированы многократно, поэтому расчет проводился по количеству операций. Всего выполнено 58 повторных оперативных вмешательств. Из них тотальное удаление было достигнуто в 53 (91,4%) случаях, субтотальное — в 3 (5,2%) и почти полная резекция — в 2 (3,4%).
Средняя подолжительность стационарного лечения составила 15,7 койко-дня (от 6 до 51 дня), средний койко-день после операции — 12 (4‒47 дней), среднее количество дней в реанимации — 3,2 (0—23 дня).
Для оценки послеоперационного неврологического статуса мы разделили пациентов на 4 группы. В 1-ю группу вошли 35 (60,4%) детей, не имевших значимых нарушений после операции. Во 2-ю группу вошли 9 (15,5%) детей, у которых после операции отмечалось нарастание неврологического дефицита, но к моменту выписки он регрессировал. В 3-ю группу отнесены 13 (22,4%) детей, которые были выписаны со стойким неврологическим дефицитом. Вне этих групп был 1 (1,7%) ребенок с неврологическим дефицитом, приведшим к летальному исходу. Этому ребенку, одному из 3 детей, выполнили субтотальное удаление опухоли.
У пациентов первых двух групп при радикальном удалении опухоли отсутствовали послеоперационные неврологические осложнения, поэтому результат оценивали как очень хороший. При анализе послеоперационного статуса в 3-й группе самым частым вариантом неврологических нарушений являлся бульбарный синдром, который в подавляющем большинстве случаев был единственным проявлением патологии (11 случаев из 13). У 7 таких пациентов возникла необходимость трахеостомии. В 2 случаях дополнительно выявлялись глазодвигательные нарушения, в 1 из них развился мозжечковый мутизм. У 1 пациента отмечалась пирамидная недостаточность, еще у 1 — поражение VII и VIII нервов. У нескольких больных после операции развились инфекционные осложнения и ликворея. Менингит развился у 3 пациентов, из них 2 были из 1-й группы. Ликворея отмечена в 2 случаях. Частота развития ликвореи и менингита не превышала частоты таких осложнений у пациентов с первичными вмешательствами на ЗЧЯ.
У 8 (13,8%) пациентов в течение 1-го месяца после удаления опухоли возникла необходимость в шунтирующих операциях. Во всех случаях выполнялось вентрикулоперитонеальное шунтирование.
Клинические примеры
Наблюдение 1
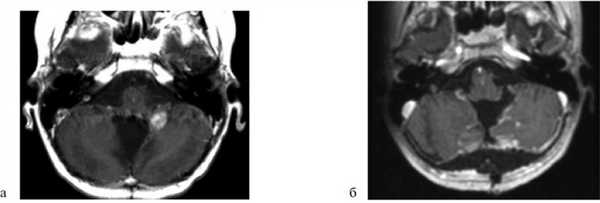
Пациент А., 14 лет. Госпитализирован 16.06.15. Диагноз: медуллобластома червя и левой гемисферы мозжечка. Состояние после субтотального удаления опухоли 17.05.10, установки резервуара Оммайя, ЛТ и ПХТ. Рецидив опухоли (рис. 1, а). Рис. 1. Наблюдение 1: пациент А. а — МРТ до операции (режим T1 с контрастом); б — МРТ через 1,5 мес после операции (режим T1 с контрастом). Пояснения в тексте.
В неврологическом статусе при поступлении: мозжечковая симптоматика (шаткость в позе Ромберга, без сторонности, пальценосовую пробу выполняет правильно с выраженной интенцией, походка атактическая).
16.06.15 выполнена операция: удаление рецидивной медуллобластомы в области средней ножки мозжечка (GTR). После операции в течение ночи ребенок наблюдался в реанимации. В неврологическом статусе отрицательной динамики не наблюдалось. Дыхание самостоятельное, через естественные дыхательные пути. Питание самостоятельное. На 6-е сутки выписан. Через 1,5 мес после удаления опухоли выполнена контрольная МРТ головного мозга: признаков остатка опухоли нет (см. рис. 1, б).
Наблюдение 2
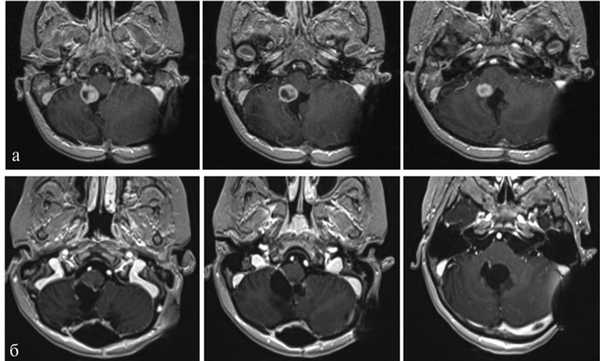
Пациентка Б., 4 года. Госпитализирована 12.05.15. Диагноз: анапластическая эпендимома IV желудочка. Состояние после удаления опухоли 18.07.12. Вентрикулоперитонеальное шунтирование 06.08.13. Состояние после ПХТ и Л.Т. Рецидив опухоли (рис. 2, а). Рис. 2. Наблюдение 2: пациентка Б. а — МРТ до операции (режим T1 с контрастом); б — МРТ через 1 мес после операции (режим T1 с контрастом). Пояснения в тексте.
В неврологическом статусе при поступлении: мозжечковая симптоматика (шаткость в позе Ромберга, пальценосовая проба с легкой интенцией с двух сторон, походка атактическая).
12.05.15 выполнена операция: удаление парастволового узла рецидива эпендимомы ЗЧЯ справа с мониторингом вызванных моторных потенциалов (GTR).
После операции несколько часов наблюдалась в отделении реанимации. В неврологическом статусе отмечен легкий парез VI нерва справа, сохранялась мозжечковая симптоматика. На 6-е сутки девочка выписана из стационара. На МРТ через месяц признаков опухоли нет (см. рис. 2, б).
Наблюдение 3
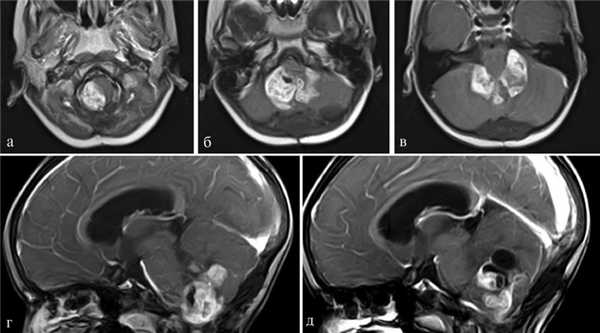
Пациентка Д., 4 года. Госпитализирована в институт 15.09.14. Диагноз: рецидив анапластической эпендимомы ствола и IV желудочка. Окклюзионная гидроцефалия. Состояние после удаления опухоли 20.06.12. Состояние после ЛТ и ПХТ (рис. 3). Рис. 3. Наблюдение 3: пациентка Д. Дооперационное МРТ-исследование, режим T1 с контрастом. а, б, в — аксиальная проекция; г, д — сагиттальная проекция. Пояснения в тексте.
Вопрос хирургического лечения рецидивов злокачественных нейроэпителиальных опухолей ЗЧЯ у детей остается мало освещенным в литературе. Нам не удалось найти публикаций с четко обоснованными и определенно сформулированными показаниями к повторным операциям. Более того, среди нейрохирургов бытует мнение, что повторные операции при злокачественных опухолях ЗЧЯ являются более опасными. Поиск в базе медицинской периодической литературы PubMed обнаружил лишь одну статью [11], где затрагивается вопрос хирургического лечения рецидивов внутричерепных эпендимом. В статье приведены данные ретроспективного анализа историй болезни 22 детей с рецидивами интракраниальных эпендимом, у 18 из которых опухоль изначально располагалась инфратенториально. Согласно результатам работы, сроки общей выживаемости удалось значительно улучшить путем повторных операций (преимущественно GTR) и дальнейшей адъювантной терапии. Вопросы относительно рисков хирургического лечения, связанных с ним возможных осложнений, показаний и противопоказаний к хирургическому удалению рецидивов опухолей остаются неуточненными. Тем не менее, согласно современным рекомендациям, в частности рекомендациям Национального института рака (США), хирургическое лечение показано при всех рецидивах злокачественных нейроэпителиальных опухолей ЗЧЯ у детей.
Полученные нами результаты в группе пациентов с рецидивами анапластических эпендимом и медуллобластом ЗЧЯ свидетельствуют в пользу активной хирургической тактики в ряде клинических ситуаций. К сожалению, вряд ли будет возможна какая-либо стандартизация показаний к операции. Основной критерий отбора пациентов в нашей серии — мнение хирурга о возможности выполнить максимально радикальное удаление с приемлемыми рисками. Очевидно, что такие показания будут различными в клинической практике каждого хирурга. Опираясь на свой опыт, заметим, что многие локальные рецидивы злокачественных нейроэпителиальных опухолей ЗЧЯ имеют достаточно хорошую «отграниченность» от окружающих нейрососудистых образований. Очевидно, что шансы на успешное радикальное удаление в такой ситуации максимальны. В связи с этим существенную помощь могут оказать дальнейшие исследования, направленные на поиск МРТ-признаков степени инфильтративности рецидивов опухоли.
Заключение
Анализ нашей серии показал, что тотальное удаление при достаточно четко отграниченных рецидивах злокачественных нейроэпителиальных опухолей ЗЧЯ в детском возрасте может быть достигнуто более чем в 91% случаев. Немаловажно, что данная хирургия сопровождается приемлемыми рисками: в раннем послеоперационном периоде умер 1 ребенок (летальность составила 1,7%), стойкий неврологический дефицит возник лишь в 13 случаях, что составляет 22,4% от общей группы пациентов, а единственным возникающим в отдаленном периоде осложнением было развитие гидроцефалии, проявления которой могут быть полностью купированы шунтирующими операциями.
The authors eclare no conficts of interest.
Тактика лечения больных с рецидивами медуллобластомы и эпендимомы до настоящего времени остается открытым вопросом в нейроонкологии.
Результаты лечения детей с эпендимомой до сих пор неудовлетворительны, а 5-летняя бессобытийная выживаемость не превышает 70% [1]. Опухоль рецидивирует более чем у 1 /3 больных, несмотря на проведение комбинированного или комплексного лечения. Радикальное удаление эпендимомы и лучевая терапия значимо улучшают результаты лечения, в то время как эффективность химиотерапии до сих пор обсуждается в литературе [1, 2].
Ситуация с лечением детей с медуллобластомами несколько иная. Опухоль хорошо отвечает на лучевую и химиотерапию. Это снижает роль радикальности операции по результатам лечения. Ведутся исследования по выявлению групп больных, где интенсивность терапии можно уменьшить или даже минимизировать. Поэтому, несмотря на то что медуллобластома формально является более злокачественной, чем эпендимома, результаты лечения больных с медуллобластомой лучше (более 80—85% 5-летней бессобытийной выживаемости).
Схожая ситуация складывается и при лечении больных с рецидивом опухоли: показано по возможности радикальное удаление с повторной лучевой терапией у больных с эпендимомой [1] и активное использование химиотерапии при медуллобластомах.
Таким образом, настоящая статья, рассматривающая важные и сложные вопросы радикальности и осложнений повторных хирургических вмешательств при злокачественных нейроэпителиальных опухолях задней черепной ямки (ЗЧЯ) у детей, чрезвычайно актуальна. На большом клиническом материале (50 больных) показано, что удаление рецидива опухоли (медуллобластомы или эпендимомы) в ЗЧЯ возможно с высокой степенью радикальности и низким уровнем послеоперационных осложнений. Так, тотальное или почти тотальное удаление было достигнуто в 95% случаев, что является очень хорошим показателем.
К сожалению, в статье не указаны критерии, по которым больные отбирались на операцию. Отмечено лишь, что они были субъективными и не претендуют на уровень «клинических рекомендаций». Однако даже субъективное мнение опытного хирурга может представлять большой интерес для его коллег.
Послеоперационные осложнения, в том числе развитие гидроцефалии, были отмечены более чем у 20% больных. С одной стороны, это показывает, что данные операции вполне выполнимы и не относятся к вмешательствам высокого риска, но, с другой — возможные осложнения также следует учитывать, принимая решение об удалении остатков опухоли или ее рецидива.
В дальнейшем хотелось бы проследить отдаленные результаты лечения этих больных — какую терапию они получили после операции, каковы показатели общей и бессобытийной выживаемости, тем более что времени для наблюдения прошло достаточно. Безусловно, интересно сравнить результаты оперированных и неоперированных больных, чтобы убедиться, что предпринятые усилия по удалению опухоли не были напрасны.
В целом приведенные данные показывают, что радикальное удаление отграниченного опухолевого узла является относительно безопасным и выполнимым этапом лечения у детей с рецидивом злокачественной опухоли ЗЧЯ.
С.С. Озеров (Москва)
1. Bouffet E, Hawkins CE, Ballourah W et al. Survival benefit for pediatric patients with recurrent ependymoma treated with reirradiation. Int J Radiat Oncol Biol Phys. 2012 Aug 1;83(5):1541-1548. Epub 2012 Jan 13.
2. Messahel B, Ashley S, Saran F et al. Relapsed intracranial ependymoma in children in the UK: patterns of relapse, survival and therapeutic outcome. Eur J Cancer. 2009;45(10):1815-1823.
Читайте также:
