Остеорадионекроз головы и шеи - лучевая диагностика
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России, 125284 Москва, 2-й Боткинский пр-д, д. 3, Российская Федерация
ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, Томск
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Особенности терапии сопровождения лучевого лечения больных с опухолями головы и шеи
В публикации освещены основные вопросы переносимости при проведении одновременно лучевой и таргетной терапии больных с опухолями головы и шеи. На примере клинического наблюдения показано течение побочных эффектов и затронуты ключевые вопросы подготовки к лечению и терапии сопровождения. Представлено состояние пациента в поздние сроки и обсуждена связь между адекватным лечением ранних реакций, отсроченным состоянием и качеством жизни больных.
В настоящее время перед онкологами стоят связанные между собой задачи излечения от онкологического процесса, реабилитации, социальной адаптации и сохранения высокого качества жизни больных. Применение методов противоопухолевого воздействия нередко ограничивает состояние пациентов, требующее адекватной поддерживающей терапии на всех этапах лечения и реабилитации. Результаты лучевого и химиолучевого лечения больных с опухолями головы и шеи неотъемлемо связаны с адекватной сопроводительной терапией, в том числе нутритивной поддержкой, ранозаживляющей терапией, своевременной профилактикой и лечением вторичной инфекции, постоянным контактом и психологической поддержкой пациентов, а также с адекватным обезболиванием. Особое значение вышесказанное приобретает в свете внедрения все более агрессивных методов терапии и хирургии с целью снижения смертности, превышающей в мире 270 тыс. человек в год [1].
Большинство пациентов обращаются в специализированные онкологические учреждения уже на поздних стадиях процесса и с признаками нутритивной недостаточности. Энергозатраты постепенно растут, что без соответствующего увеличения калорийности пищи может приводить к потере 1—2 кг мышечной массы в месяц [2—4]. Важно отметить, что потеря массы тела на фоне опухолевой прогрессии врачей нередко не беспокоит, в то время как сам пациент не может адекватно скорректировать свою диету. В ряде исследований показано, что более чем у 50% больных облучение начинают на фоне нутритивной недостаточности, а к моменту завершения лечения частота ее проявления превышает 80% [5—7]. Как сама опухоль, так и лучевые реакции в виде мукозита могут препятствовать нормальному пероральному питанию. С другой стороны, следствием выраженной нутритивной недостаточности является раннее проявление и более тяжелое течение лучевых реакций, что приводит к вынужденному перерыву в курсе облучения и потере его эффективности [8, 9].
Важнейшее условие успешной лучевой терапии — сохранение жизнеспособности нормальных тканей, находящихся в зоне облучения. Современные методы подведения доз ионизирующего излучения направлены на минимизацию лучевых реакций и повреждений. Между тем воздействие ионизирующего излучения на окружающие здоровые ткани исключить полностью не удается [10—13]. В результате лучевая терапия может приводить к местным побочным эффектам облучения, выраженность которых в первую очередь зависит от суммарной поглощенной дозы ионизирующего излучения. Немаловажными факторами являются объем облучаемых тканей и распределение доз в этом объеме, а также методика фракционирования и сроки проведения лучевого лечения.
Общей особенностью местных лучевых побочных эффектов является наличие скрытого периода между облучением и появлением первых клинических проявлений. Чем больше интенсивность подведенного ионизирующего излучения, тем короче этот период. Важной особенностью местных лучевых повреждений является прогрессирование морфологических изменений с ухудшением клинических проявлений, приобретающих хронический характер. Наиболее распространенным побочным эффектом, возникающим в ходе лучевой терапии у больных орофарингеальным раком, является лучевой мукозит (эпителиит), развивающийся более чем у 60% пациентов при проведении стандартного режима фракционирования и практически у 100% больных при нетрадиционных режимах или химиолучевой терапии [14, 15]. Ведущие радиотерапевты свидетельствуют, что более чем в 40% случаев при проведении облучения с лекарственной модификацией развиваются побочные эффекты тяжелой степени [16—19]. Мукозит играет ключевую роль при лучевой терапии рака головы и шеи, а также значительно влияет на качество жизни больных в процессе лечения и после его завершения. Необходимо отметить, что спектр ранних побочных явлений значительно шире и также включает дерматит, ксеростомию, накопление вязкого секрета, дисгевзию, дисфагию, одинофагию, алопецию в области облучения, осиплость, присоединение вторичной инфекции в области облучения или в результате аспирации. Кроме того, дефекты слизистой оболочки могут стать входными воротами для оппортунистических инфекций, например кандидоза. Побочные эффекты во многом взаимосвязаны патогенетически и провоцируют друг друга, причем неадекватное ведение пациента с ранними лучевыми реакциями может приводить к поздним лучевым повреждениям. Через 1,5—2 нед после окончания лучевой терапии проявления реакции слизистых обычно купируются. Вкусовые ощущения восстанавливаются через 1—2 мес, а слюноотделение — через 2—5 мес, иногда и в более поздние сроки.
Лучевой дерматит кожи головы и шеи также представляет собой часто возникающий побочный эффект при лучевой терапии опухолей головы и шеи. Его проявления во многом недооценены, однако на самом деле значительно влияют на переносимость лечения и качество жизни пациентов [20, 21]. Местные лучевые реакции кожи челюстно-лицевой области проявляются в основном в виде эритемы и сухого эпидермита, возникающих при дозе более 20 Гр. При их возникновении перерыв в лечении не требуется, поскольку купируются они самостоятельно либо при местной ранозаживляющей терапии. При облучении метастатических узлов на шее и подведении суммарной очаговой дозы (СОД) 50 Гр дерматит бывает более выраженный и достигает степени влажного эпидермита. С момента проявлений лучевого дерматита и до полного стихания реакций показано применение ранозаживляющих местных средств (гели, метилурациловая мазь, рибофлавин), а также солнцезащитных средств. Кожу необходимо оберегать от трения и раздражения. Для борьбы с ксерозом используют крем с мочевиной, масляный раствор витамина А. Характерная черта развития тяжелых лучевых дерматитов – длительное, прогрессирующее и нередко рецидивирующее течение нарушений микроциркуляции, трофических и обменных процессов в облученных тканях. Как выяснилось в последнее время, существует ряд патофизиологических и клинических особенностей развития лучевого дерматита на фоне таргетной терапии, которые позволяют говорить об отдельной форме — биолучевом дерматите [22]. Такой вариант дерматита характеризуется более выраженным ксерозом, интенсивным воспалительным ответом, выраженным истончением эпидермиса, некрозом эпидермиса и поверхностных слоев дермы, а также выраженной экссудацией. .Биолучевой дерматит имеет раннее начало (на 1—2-й неделе), более острый характер течения и ранние сроки репарации. Дефекты кожи могут стать входными воротами для оппортунистических инфекций, например Staphylococcus aureus. Поэтому очевидно, что ранозаживляющая терапия является ключевым компонентом терапии сопровождения в рамках борьбы с лучевым мукозитом и дерматитом.
Таким образом, лучевое лечение больных с опухолями головы и шеи требует соответствующей сопроводительной терапии, в том числе нутритивной поддержки, ранозаживляющей терапии, своевременной профилактики и лечения вторичной инфекции, постоянного контакта и психологической поддержки пациентов, а также адекватного обезболивания. При этом аналгезирующую терапию используют как при болевом синдроме, формирующемся в результате опухолевого поражения, так и при возникающих в процессе терапии лучевых реакциях. Любой компонент терапии сопровождения одинаково важен, поскольку его отсутствие или неадекватное применение может сказаться не только на качестве жизни больного, но и на результатах лечения основного заболевания.
В постлучевом периоде нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним нужно относиться бережно. В ранние сроки не рекомендуется выполнять инвазивные диагностические процедуры и биопсию без крайней необходимости. Показан подбор диеты при необходимости в сочетании с противорефлюксными препаратами. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита. Пациенту должно быть рекомендовано продолжить контроль за массой тела, а также проводить оценку нутритивного статуса и степени нутритивной недостаточности при каждом контрольном обследовании. На усмотрение курирующего специалиста можно в дальнейшем назначать нутритивную терапию, предпочтительно сипинг.
Таким образом, вопрос об адекватности поддерживающей терапии и последующей реабилитации пациентов, получающих лучевое и химиолучевое лечение по поводу опухолей головы и шеи, остается одной из актуальных проблем в современной онкологии, что демонстрирует приведенное ниже клиническое наблюдение.
Клиническое наблюдение
Пациент К., 52 года, считает себя больным с декабря 2012 г., когда впервые обратил внимание на появление боли в горле, дискомфорт при приеме пищи, постоянную субфебрильную температуру. Гнусавость отмечал ранее в течение года. Обратился к врачу по месту жительства. Проводимая антибактериальная терапия эффекта не дала. Обратился в районный онкологический диспансер Пензы, где был заподозрен и верифицирован рак глотки. Направлен в МНИОИ им. П.А. Герцена, куда обратился в феврале 2013 г.
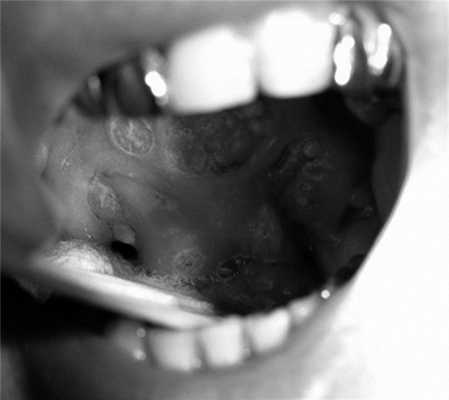
В беседе пациент предъявлял жалобы на чувство инородного тела в горле, гнусавость, выраженные боли в глотке, а также помеху при глотании пищи и жидкости. В анамнезе курение отрицал. При осмотре больного определялось опухолевое поражение ротоглотки, включая мягкое небо, с переходом за среднюю линию и на твердое небо, небную миндалину, дужки, стенку рото- и носоглотки. Просвет глотки был значительно сужен, а нижний полюс опухоли недостижим (рис. 1). Рис. 1. Картина распространения опухолевого процесса до начала лечения (описание в тексте). На шее с обеих сторон очаговой патологии не выявлено.
Данные МРТ: картина объемного образования носо-, рото- и гортаноглотки смешанного характера роста с выраженным экзофитным компонентом размером 51×38 мм, протяженностью не менее 66 мм. Верхний полюс опухоли ниже уровня левого слухового валика на 5—6 мм. С учетом ограничения интерпретации на фоне артефактов создавалось впечатление, что образование исходит из левой боковой стенки ротоглотки — зональность не прослеживается. Отмечалось пролабирование опухоли в клетчатку ретрофарингеального и сонного пространства с вовлечением нижнего отдела верхнего и среднего констрикторов глотки. На этом уровне задний контур образования плотно прилежал преимущественно к левой длинной мышце шеи с вовлечением ее фасции. Образование на визуализируемом уровне вовлекало левые отделы мягкого неба, дужки и миндаликовую нишу, несколько деформировало левые отделы корня. Латеральный контур на этом уровне вовлекал нижние отделы латеральной крылонебной мышцы. Нижний полюс опухоли располагался на уровне гортаноглотки по левой стенке в виде утолщения, в проекции плоскости, проведенной через апикальные отделы лепестка надгортанника. Визуализировались единичные лимфатические узлы левой подбородочной области (размер 12×9 мм), а также по ходу сосудов шеи в верхней трети с обеих сторон до 10 мм.
При гистологическом исследовании биопсийного материала опухоли правой небной миндалины выявлен инфильтративный рост плоскоклеточного рака с наклонностью к ороговению. Иммуногистохимическое исследование (АТ к белку р16) — положительная реакция в клетках опухоли.
На основании результатов проведенных исследований диагностирован рак ротоглотки IVA стадии, cT4N0M0. Тактика лечения обсуждена на междисциплинарном консилиуме с участием радиолога, хирурга и химиотерапевта, рекомендовано проведение одновременного химиолучевого лечения. Учитывая соматическое состояние пациента, сопутствующую патологию и показатели функции почек, в качестве лекарственного компонента лечения применялся цетуксимаб.
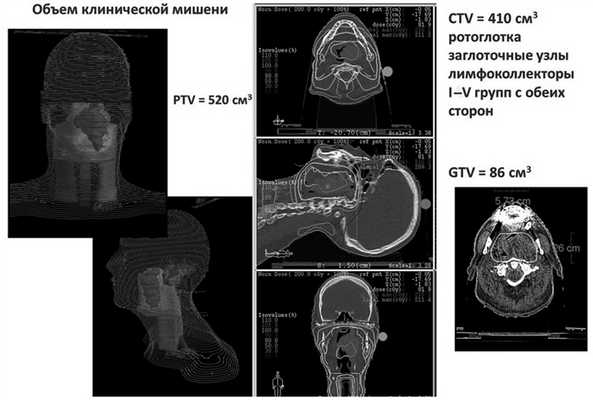
Риск нутритивной недостаточности по критериям MUST, опросникам NRS-2002 и ESMO был оценен как высокий. Учитывая соматическое состояние пациента, локализацию и объем опухолевого поражения, план биолучевого лечения по радикальной программе, в том числе объем облучения 520 см 3 , риск развития выраженных побочных эффектов лечения (мукозита, дерматита) также был оценен как высокий (рис. 2). Рис. 2. Дозное распределение при лучевом терапевтическом воздействии на локорегионарную область ротоглотки, включая заглоточные лимфатические узлы и лимфоколлекторы шеи Ib—IV групп с обеих сторон. PTV — планируемый объем облучения мишени; CTV — клинический объем мишени; GTV — макроскопический объем опухоли.
С 05.03.13 по 16.05.13 проведено одновременное химиолучевое лечение в разовой очаговой дозе (РОД) 2 Гр до СОД 70 Гр с цетуксимабом (стартовая доза 800 мг, далее 1 раз в неделю, поддерживающая доза 500 мг) (см. рис. 2). В процессе терапии имели место выраженные лучевые реакции в виде мукозита III степени RTOG, проявившиеся на ранних сроках (СОД 24 Гр), которые потребовали незапланированного перерыва в лечении в течение 14 календарных дней (СОД 40 Гр) (рис. 3). Рис. 3. Клиническая картина динамики мукозита в процессе лечения. Также отмечались характерные для таргетного препарата кожные реакции в виде папулезно-пустулезных высыпаний на коже лица, головы, груди, шеи, максимально выраженные до III степени через 2 дня после 4-го введения цетуксимаба, на фоне дерматита лица и шеи II степени в проекции полей облучения (рис. 4). Рис. 4. Клиническая картина динамики дерматита в процессе лечения. Пациенту проведены облучение в полном объеме, а также все запланированные введения цетуксимаба.
С 1-го дня лучевого лечения проведена профилактическая ранозаживляющая терапия гелем с деринатом с последующей интенсификацией обработок по мере проявления мукозита. Больному было рекомендовано ежедневно полоскать полость рта теплыми дезинфицирующими растворами, например отваром ромашки, шалфея и др. Назначена механически и химически щадящая богатая белком диета с исключением алкогольных напитков. Также пациенту на пике лучевых реакций потребовалась обезболивающая терапия, проведение которой позволило обеспечить удовлетворительное качество жизни и полноценное питание пациента per os на всем протяжении лечения и после его завершения. Нутритивную поддержку проводили, используя специализированное питание нейтрального вкуса, с расчетом объема по энергетическим затратам и потерям белка, а также подключением смесей с пищевыми волокнами при появлении запора. В рамках борьбы с дерматитом проводили увлажнение и обработку кожи кремом с витамином K, а также такие профилактические меры, как защита кожи от солнца и механических травм. Следует отметить, что пациент тщательно выполнял все назначения.
При осмотре через 1 нед после окончания химиолучевой терапии клинически экзофит опухоли не определялся. Отмечено стихание мукозита до I степени RTOG и дерматита до I степени RTOG (см. рис. 3, 4). Далее еще через 1 нед лучевые реакции стихли полностью. По данным контрольного обследования через 1,5 мес получены данные, подтверждающие полный эффект, признаков остаточной опухоли не выявлено. Пациент оставлен под наблюдением. В поздние сроки единственным негативным последствием являлась ксеростомия I степени RTOG, не мешающая пациенту жить и работать в привычном ему до болезни ритме. В настоящее время безрецидивный срок наблюдения пациента составляет 6 лет.
Таким образом, в рамках существующих подходов к лечению больных с опухолями головы и шеи требуются не только высокий уровень методик противоопухолевого воздействия, но и комплексная программа терапии сопровождения и реабилитации. При детальном рассмотрении переносимости биолучевой терапии обращает на себя внимание достаточно интенсивное течение лучевых реакций с ранним их развитием до III степени RTOG и быстрым стиханием по завершении лечения. Вынужденный 14-дневный перерыв в облучении не выходит за рекомендованные в мировой практике рамки сроков реализации радикального курса, позволяющие говорить о полноценной реализации противоопухолевого эффекта. Полученный результат лечения в полной мере подтверждает этот факт. Терапия сопровождения, если не обеспечивает отсутствие выраженных реакций в силу, видимо, их неизбежности на современном уровне развития лучевой и лекарственной терапии, все же позволяет оптимизировать сроки проведения специального лечения, максимально нивелировать проявления мукозита и дерматита как с точки зрения качества жизни пациентов, так и ускорения их реабилитации по завершении курса облучения. Это особенно важно в случае этапного комбинированного и комплексного лечения больных с опухолями головы и шеи. Таким образом, мультидисциплинарный подход к ведению этой сложной категории больных с применением адекватного сопроводительного лечения позволяет рассчитывать на достаточно хорошую переносимость агрессивных методик химиолучевого лечения даже при значительных объемах облучения и у соматически отягощенных больных. В последние годы это позволяет значительно чаще брать на лечение пациентов, которым ранее в нем было отказано либо план химиолучевой терапии которых не был бы реализован в полном объеме.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Остеорадионекроз головы и шеи - лучевая диагностика
а) Терминология:
1. Аббревиатура:
• Остеорадионекроз (ОРН)
2. Определение:
• Осложнение лучевой терапии: некроз костной ткани, отсутствие заживления
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Смешанные литические/склеротические изменения у пациента, ранее получавшего лучевую терапию:
- Изъязвление кожи или слизистой оболочки, обнажение кости
- Часто осложняется патологическим переломом или инфекцией
- Отсутствие дискретного мягкотканного образования позволяет отличить ОРН от рецидива опухоли
• Локализация:
о Челюсти и основание черепа (голова и шея):
- Нижняя челюсть » верхняя челюсть или лицевой скелет
- Височная или клиновидная кость в основании черепа
- Также описан ОРН лобной и подъязычной кости
• Размер:
о Может быть ограниченным или распространенным
2. Рекомендации по визуализации:
• Лучший метод диагностики:
о КТ в костном окне
о Диффузное воспаление мягких тканей в отсутствие объемного образования
• Выбор протокола:
о Тонкосрезовая КТ в костном окне с реформатированием в корональной и сагиттальной плоскости:
- Мультипланарное реформатирование используется для планирования операции и возможной реконструкции
о При клиническом подозрении на присоединение инфекции или рецидив опухоли показана КТ с КУ
3. Рентгенография:
• Экстраоральная рентгенография:
о Смешанные литические/склеротические изменения костей
о Распространенность поражения и деструкция часто недооцениваются на рентгенограммах
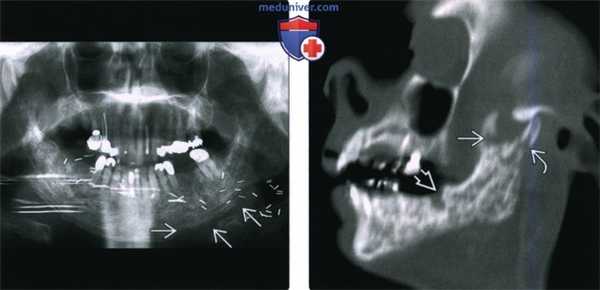
(Слева) На ортопантограмме у пациента, которому было выполнено оперативное вмешательство в сочетании с облучением полости рта, определяется диффузное утолщение и склероз нижней челюсти, утолщение трабекул и отсутствие дифференцировки кортикальной пластинки в области нижнего края нижней челюсти слева.
(Справа) При сагиттальной (под углом) реконструкции определяется, что нижняя челюсть имеет неоднородную структуру за счет множественных очаговых просветлений; определяется нарушение целостности кортикальной пластинки, утолщение и склероз трабекул и кортикальной пластинки. Обратите внимание на глубокий дефект, оставшийся после удаления моляра. Шейка мыщелка нижней челюсти и венечный отросток фрагментированы.
4. КТ при остеорадионекрозе головы и шеи:
• КТ с КУ:
о Отек и индурация мягких тканей даже в отсутствие суперинфекции
о При присоединении инфекции ограниченные участки патологического накопления контраста или небольшие абсцессы о Фистулы, открывающиеся в кожу
• КТ в костном окне:
о Деструкция кортикальной пластинки на фоне смешанных литических и склеротических изменений:
- Литические изменения проявляются разрушением трабекул, впоследствии возникает склероз
о Секвестрация и фрагментация костной ткани
о Включения газа в пораженных участках нижней челюсти или прилежащих к ней зонах некроза тканей
о Может осложняться патологическим переломом, форсирующим проявления заболевания
• ПЭТ/КТ:
о Гиперфиксация ФДГ в зоне ОРН:
- Вероятно, вследствие воспаления
о Для обнаружения рецидива опухоли важно результаты ПЭТ интерпретировать совместно с результатами КТ с КУ
5. МРТ при остеорадионекрозе головы и шеи:
• Т1ВИ:
о Диффузный сигнал низкой интенсивности в костном мозге
о Возможно наличие признаков деструкции кортикальной пластинки
• Т2ВИ:
о Диффузный сигнал высокой интенсивности в костном мозге
о Возможен также отек ближайших тканей
• Т1ВИ С+ FS:
о Диффузное накопление контраста в костном мозге
о Отсутствие солидных объемных образований поблизости
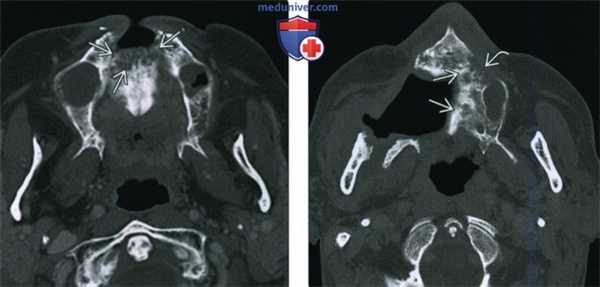
(Слева) При аксиальной КТ в коаном окне у пациента, получавшего лучевую терапию по поводу ПКР носовой перегородки, определяются литические изменения в передних отделах верхней челюсти, визуализируется фрагмент разрушенной кости.
(Справа) При аксиальной КТ в костном окне у другого пациента определяются изменения, обусловленные резекционным вмешательством на небе справа, видны также очаги литического и склеротического характера в верхней челюсти слева, которая также была подвергнута облучению. Верхняя челюсть относительно устойчива к лучевому воздействию и мало подвержена ОРН. Лучевые признаки ОРН верхней челюсти идентичны таковым для нижней челюсти, других костей лицевого скелета и основания черепа.
в) Дифференциальная диагностика остеорадионекроза головы и шеи:
1. Остеомиелит:
• Смешанные литические/склеротические изменения костей у пациента с инфекциями зубов или после удаления зуба в отсутствие облучения
• Остеомиелит может сочетаться с ОРН; эти патологические состояния часто сложно отличить
2. Бисфосфонатный остеонекроз:
• Смешанные литические/склеротические изменения костей у пациентов, которым ранее внутривенно вводились бисфосфонаты
• Данные о лучевой терапии в анамнезе отсутствуют
3. Плоскоклеточный рак альвеолярного гребня:
• Преимущественно деструкция костей и изъязвление слизистой
• Солидное мягкотканное образование, накапливающее контраст
• Дифференциальная диагностика ОРН в первую очередь проводиться с рецидивом ПКР
4. Радиационно-индуцированная вторая первичная опухоль:
• Возникает много лет (обычно >8) спустя после лучевой терапии
• Чаще всего - саркома, мягкотканное объемное образование
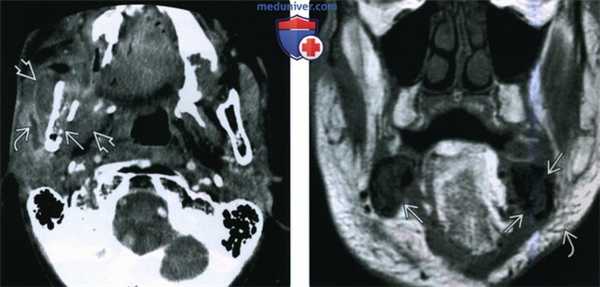
(Слева) При аксиальной КТ с КУ определяются признаки остеорадионекроза нижней челюсти справа, осложненного инфекцией жевательного пространства. Определяется дефект кортикальной пластинки, а также выраженный отек околоушной железы и жевательных мышц. Визуализируется расширенный проток околоушной железы, заполненный воспалительным дебрисом.
(Справа) При корональной МРТ Т1ВИ определяется диффузное замещение сигнала, типичного для жира, в костном мозге. Визуализируются также множеавенные дефекты кортикальной пластинки. Уплотнение и отек подкожной жировой ткани также часто обнаруживаются при ОРН нижней челюсти.
г) Патология:
1. Общая характеристика:
• Этиология:
о Лучевое повреждение мелких кровеносных сосудов:
- Обструктивная артериопатия в результате разрушения клеток эндотелиальной выстилки кровеносных сосудов
- Снижение способности костей противостоять стрессам
о ОРН часто провоцирует инфекция или травма, в т.ч. удаление зуба или биопсия
• Сопутствующие патологические изменения:
о Бактериальная инфекция на фоне некроза костной ткани:
- Согласно существующей теории остеомиелит не является первичным заболеванием
2. Стадирование, классификация остеорадионекроза головы и шеи:
• Для стадирования и клинической градации используются различные системы
• Стадирование остеорадионекроза челюстей по Store и Boysen:
о Стадия 0: дефекты только слизистой оболочки
о Стадия I: лучевые признаки ОРН + интактная слизистая
о Стадия II: лучевые признаки ОРН + обнажение кости
о Стадия III: обнажение кости, ОРН + орокутанная фистула
3. Макроскопические и хирургические особенности:
• Некроз и фрагментация кости с секвестрами и спикулами
• Изъязвление, ранимость слизистой оболочки; обнажение кости
4. Микроскопия:
• Некроз кости, преимущественно обусловленный гипоксией:
о Облитерация артерий, в том числе нижней альвеолярной, вследствие облучения
• Гипоцеллюлярность костной ткани, омертвление надкостницы
• В биоптате могут обнаруживаться признаки остеонекроза, остеомиелита, резидуальной опухоли или рецидива
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Изъязвление кожи или слизистой оболочки с обнажением омертвевшей кости у пациента, ранее подвергнутого облучению головы и шеи:
- Из костей лицевого скелета чаще всего поражается нижняя челюсть
- Через язву слизистой оболочки полости рта может просматриваться кость
• Другие признаки/симптомы:
о Формирование свища, открывающегося в кожу
о Боль во рту, тризм, дизестезия, зловонное дыхание
о Инфицирование жевательного пространства с мелкими абсцессами
2. Эпидемиология:
о Возникновение ОРН обусловлено множеством факторов:
- Опухоль: риск выше в случае первичных опухолей III/IV стадии
- План лучевой терапии: повышение риска связано с большей дозой, увеличением поля облучения, уменьшением времени терапии:
Лучевая терапия с модулированной интенсивностью (ЛТМИ) позволяет снизить облучение костей, уменьшая риск ОРН
- Лечение: риск повышается, если операция (мандибулэкто-мия или иная остеотомия) сочетается с лучевой терапией
- Факторы риска со стороны пациента: несоблюдение гигиены полости рта, злоупотребление алкоголем и курение
3. Течение и прогноз:
• Заболеваемость ОРН • Пик заболеваемости: первые 6-12 месяцев после лучевой терапии
4. Лечение:
• Наиболее важным моментом перед лучевой терапией является профилактика:
о Удаление пораженных зубов и лечение заболеваний периодонта перед облучением
о Улучшение нутриционного статуса перед лучевой терапией и во время ее
о Отказ от табака и алкоголя
• Консервативное лечение: антибиотикотерапия и местные ирригации
• Гипербарическая оксигенация для стимуляции ангиогенеза, а также как дополнительный метод лечения при сопутствующих инфекциях:
о Перед оксигенацией абсолютно необходимо исключить резидуальную опухоль/рецидив
• На ранних стадиях: секвестрэктомия с закрытием дефекта
• При прогрессировании: резекция кости с последующей реконструкцией
е) Диагностическая памятка:
1. Следует учесть:
• ОРН у любого пациента, подвергнутому облучению, у которого вновь возникла боль, незаживающая язва, литические/склеротические изменения костей
• Абсолютно необходимо исключить рецидив ПКР как причину болевой симптоматики и деструкции кортикальной пластинки:
о Солидное мягкотканное образование позволяет заподозрить опухоль
• ОРН может возникать спустя годы после лучевой терапии, тем не менее, если >8 лет, нужно предполагать радиационно-индуцированную саркому, особенно, при наличии мягкотканного образования
2. Советы по интерпретации изображений:
• Местные инфекционные осложнения или патологические переломы
3. Рекомендации по отчетности:
• Распространенность поражения, дефекты кортикального слоя, обнажение кости и наличие спикул, секвестрация
а) Терминология:
• Остеорадионекроз
• Осложнение лучевой терапии: некроз костной ткани, нарушение заживления
б) Визуализация:
• Нижняя челюсть» верхняя челюсть или основание черепа
• Часто сочетается с отеком и индурацией мягких тканей
• Сложно исключить суперинфекцию
• КТ: смешанные литические/склеротические изменения костей, секвестрация
• МРТ: гипо- на Т1 ВИ, гипер- на Т2 ВИ вследствие отека
• Часто диффузное контрастное усиление
(Слева) При аксиальной КТ в коаном окне у пациента после лучевой терапии определяются типичные изменения смешанного характера (литические и склеротические), а также нарушение целостности кортикальной пластинки правой половины нижней челюсти. Обратите внимание на включения газа в кости, а также внутрикостный секвестр («кость внутри кости»).
(Справа) При аксиальной КТ в костном окне у другого пациента визуализируется участок остеорадионекроза преимущественно литического характера с дефектом кортикальной пластинки и внутрикостными включениями газа. Определяется также патологический перелом тела нижней челюсти слева со смещением отломков. (Слева) При аксиальной КТ в костном окне визуализируется «лунка» удаленного зуба нижней челюсти, рядом с которой видны небольшие включения газа, свидетельствующие об эрозии слизистой оболочки. Определяется «просветление» подлежащей кости в виде «дымки». При осмотре видна обнаженная кость.
(Справа) Ha МР Т1ВИ С+ в аксиальной проекции у этого же пациента определяется накопление контраста в нижней челюсти и диффузное контрастное усиление мягких тканей щеки и языка возле нее. Лучевые изменения в сочетании с лучевой терапией в анамнезе, отеком правой половины лица и обнажением кости наиболее сопоставимы с ранним оасторадионекрозом.
в) Дифференциальная диагностика:
• Остеомиелит
• Бисфосфонатный остеонекроз
• Плоскоклеточный рак (ПКР) альвеолярного гребня
• Радиационно-индуцированная 2-я первичная опухоль
г) Патология:
• Гиповаскуляризация костного мозга вследствие повреждения мелких кровеносных сосудов во время лучевой терапии
• Потеря костной тканью способности противостоять стрессовым воздействиям: инфекциям и травмам
• Может быть также спровоцирован биопсией или удалением зуба
• Часто осложняется патологическим переломом
д) Клинические особенности:
• Чаще всего возникает после лучевой терапии по поводу ПКР полости рта
• Изъязвление слизистой оболочки рта и обнажение кости
• Пик заболеваемости: первые 6-12 месяцев после лучевой терапии
• Может возникать спустя годы после лучевой терапии
е) Диагностическая памятка:
• Боль в челюсти, незаживающая язва слизистой, литические/склеротические изменения костей (КТ)
• Необходимо исключить рецидив ПКР как вероятную причину изменений
2. Определение:
• Некроз кости и нарушение заживления как осложнение лучевой терапии
1. Общая характеристика:
• Лучший диагностический критерий:
о Смешанные (литические и склеротические) изменения костей после облучения:
- Изъязвление кожи или слизистой оболочки с обнажением кости
- Остеорадионекроз часто осложняется переломом, а также инфицированием
- Отсутствие дискретного мягкотканного объемного образования помогает отличить остеорадионекроз от рецидива опухоли
• Локализация:
о Голова и шея: преимущественно челюсти и основание черепа:
- Нижняя челюсть >> верхняя челюсть и другие кости лицевого скелета
- Височная и клиновидная кость основания черепа
- Также описан остеорадионекроз лобной и подъязычной кости
• Размер:
о Поражение может быть местным или распространенным
о Может сочетаться с некрозом окружающих мягких тканей
2. Рекомендации по визуализации:
• Лучший метод диагностики:
о КТ в костном окне
о Диффузные воспалительные изменения мягких тканей в отсутствие объемного образования
• Выбор протокола:
о Тонкосрезовая КТ с использованием костного алгоритма с реформатированием в корональной и сагиттальной плоскости:
- Мультипланарное реформатирование используется для планирования операции, в т.ч. возможного реконструктивного вмешательства
- Необходимо реформатирование в сагиттальной плоскости (под углом) параллельно углу нижней челюсти
о КТ с контрастным усилением при клиническом подозрении на присоединение инфекции или рецидив опухоли
3. Рентгенография:
• Экстраоральная рентгенография:
о Смешанные (литические и склеротические) изменения костей
о Распространенность поражения и деструкции часто недооцениваются на рентгенограммах
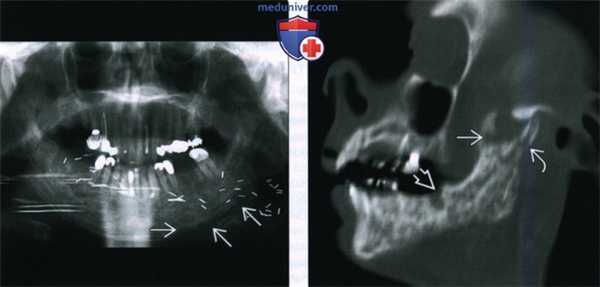
(Слева) На панорамной дентальной рентгенограмме у пациента, которому ранее было выполнено оперативное вмешательство и осуществлялась лучевая терапия полости рта, определяется диффузное утолщение и остеосклероз нижней челюсти, утолщение и деформация трабекул, нарушение дифференцировки кортикальной пластинки в области нижнего края нижней челюсти слева.
(Справа) При сагиттальной КТ (по углом) определяются множественные неоднородные «просветления» в кости, нарушение целостности кортикального слоя, утолщение и склероз трабекул и кортикальной пластинки. Обратите внимание на глубокую «лунку», оставшуюся после экстракции моляра. Определяется также фрагментация венечного отростка и шейки мыщелка.
4. КТ при остеорадионекрозе челюсти:
• КТ с контрастным усилением
о Отек и индурация мягких тканей даже в отсутствие суперинфекции
о При присоединении инфекции патологическое накопление контраста или появление небольших абсцессов
о Часто также возникают свищи, открывающиеся в кожу
• КТ в костном окне:
о Нарушение целостности кортикального слоя на фоне смешанного (литического и склеротического) компонента:
- Разрушение трабекул приводит к появлению изменений литического характера; затем происходит склерозирование
о Часто обнаруживаются секвестрированные спикулы костной ткани, костные фрагменты
о В патологически измененной нижней челюсти и в расположенных поблизости некротических тканях часто присутствуют пузырьки газа
о Может обнаруживаться патологический перелом, возникновение которого ускоряет появление симптомов
• ПЭТ/КТ:
о Выраженное накопление радиофармпрепарата в зоне ОРН:
- Вероятно, обусловленное воспалительным компонентом
о Для обнаружения рецидива опухоли результаты ПЭТ важно интерпретировать совместно с результатами КТ с контрастным усилением
о Даже если ПЭТ/КТ и КТ с контрастным усилением свидетельствуют о рецидиве опухоли, обнажение кости со стороны полости рта или кожи однозначно свидетельствует в пользу остеорадионекроза
5. МРТ при остеорадионекрозе челюсти:
• Т1ВИ:
о Диффузный гипоинтенсивный сигнал в костном мозге
о Может также обнаруживаться нарушение целостности кортикального слоя
• Т2ВИ:
о Диффузный гиперинтенсивный сигнал в костном мозге
о Возможно наличие признаков отека окружающих тканей
• Т1ВИ FS С+:
о Диффузное контрастное усиление костного мозга
о Отсутствие солидного объемного образования поблизости
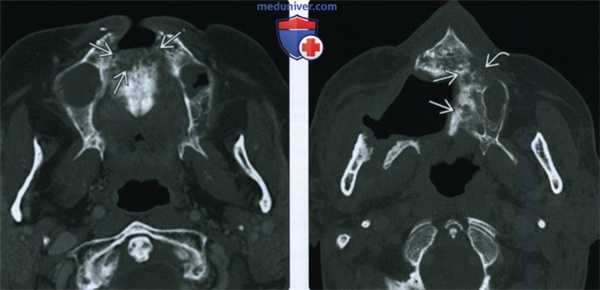
(Слева) При аксиальной КТ в костном окне у пациента, получавшего лучевую терапию по поводу плоскоклеточного рака носовой перегородки, визуализируется очаг литического характера в передних отделах верхней челюсти, представляющий собой треугольный участок деструкции костной ткани.
(Справа) При аксиальной КТ в костном окне у другого пациента определяются признаки выполненной резекции неба справа, а также изменения смешанного (склеротического и литического) характера в верхней челюсти слева, которая подвергалась облучению. Верхняя челюсть является относительно устойчивой к ионизирующему излучению, в ней редко возникает остеорадионекроз. Лучевые признаки идентичны таковым при поражении других костей лицевого скелета и основания черепа.
в) Дифференциальная диагностика остеорадионекроза челюсти:
1. Остеомиелит:
• Смешанные (литические и склеротические) изменения костей у пациента с инфекциями зубов или с «лункой» после экстракции зуба, в отсутствие данных о лучевой терапии в анамнезе
• Остеомиелит может обнаруживаться на фоне остеорадионекроза; эти два состояния часто бывает сложно дифференцировать
2. Бисфосфонатный остеонекроз:
• Изменения костной ткани смешанного (литического/склеротического) характера у пациента, получавшего лечение бисфосфонатами
• Данные о лучевой терапии в анамнезе отсутствуют
3. Плоскоклеточный рак альвеолярного гребня:
• Преимущественно деструктивные изменения костей и изъязвление слизистой
• Мягкотканное объемное образование, накапливающее контраст
• Остеорадионекроз в первую очередь нужно дифференцировать с рецидивом плоскоклеточного рака
4. Радиационно-индуцированная вторая первичная опухоль:
• Возникает спустя много лет (обычно >8) после лучевой терапии
• Чаще всего саркома, мягкотканное объемное образование
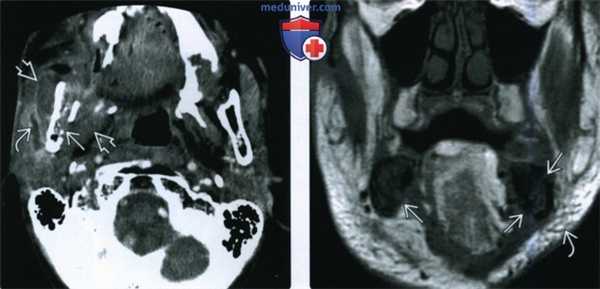
(Слева) При аксиальной КТ с КУ определяется остеорадионекроз нижней челюсти справа, осложненный инфицированием жевательного пространства. Определяется также нарушение целостности кортикальной пластинки и диффузный, выраженный отек жевательных мышц и околоушной слюнной железы, расширение ее выводного протока, заполненного дебрисом воспалительного характера.
(Справа) При МРТ Т1ВИ в корональной проекции определяется диффузное замещение сигнала, в норме наблюдающегося в костном мозге, и характерного для жира. Пристствуют множественные участки нарушения целостности кортикальной пластинки. Индурация и отек подкожных тканей являются часто встречающимися изменениями при остерадионекрозе нижней челюсти.
1. Общая характеристика:
• Этиология:
о Ионизирующее излучение повреждает мелкие сосуды:
- Происходит разрушение эндотелиальной выстилки кровеносных сосудов, приводящее к обструктивной артериопатии
- Снижается способность костной ткани противостоять стрессам
о Остеорадионекроз часто провоцирует инфекция или травма, в т.ч. удаление зуба или биопсия
• Сопутствующие патологические изменения:
о В некротически измененной костной ткани часто присутствует бактериальная инфекция
- Считается, что остеомиелит не является первичным
- Остеорадионекроз часто сочетается с грам-положительной бактериальной инфекцией (актиномикозом)
2. Стадирование, классификация:
• Для стадирования и клинической градации используются различные системы
• Классификация Store и Boysen:
о Стадия 0: только дефекты слизистой оболочки
о Стадия I: рентгеновские признаки ОРН + интактная слизистая
о Стадия II: рентгеновские признаки ОРН + обнажение кости
о Стадия III: обнаженная кость с признаками остеорадионекроза + орокутанные фистулы
3. Макроскопические и хирургические особенности:
• Некроз и фрагментация кости с наличием секвестров и спикул
• Изъязвление слизистой оболочки с обнажением кости
4. Микроскопия:
• Некроз костной ткани, обусловленный преимущественно гипоксией:
о Облитерация артерий, в т.ч. нижней альвеолярной артерии, обусловленная лучевой терапией
• Гипоцеллюлярность костной ткани с нежизнеспособной надкостницей
• При исследовании биоптата могут обнаруживаться признаки остеонекроза, остеомиелита, рецидивной либо резидуальной опухоли
1. Проявления:
• Типичные признаки/симптомы:
о Изъязвление кожи или слизистой оболочки с некрозом и обнажением кости у пациента, который ранее подвергался лучевой терапии (головы и шеи):
- Нижняя челюсть из костей лицевого черепа поражается чаще всего
- Возможно возникновение язв с обнажением кости
• Другие признаки/симптомы:
о Формирование свища, открывающегося в кожу
о Боль во рту, тризм, дизестезия, неприятный запах изо рта
о Инфицирование жевательного пространства, мелкие абсцессы
2. Демография:
• Эпидемиология:
о На заболеваемость ОРН влияют множество факторов:
- Опухоль: риск выше на третьей и четвертой стадии
- Планирование лучевой терапии: повышение риска связано с более высокой дозой, большим полем облучения, укорочением времени лечения
о Лучевая терапия с модулированной интенсивностью (ЛТМИ) способствует уменьшению лучевой нагрузки на кость и снижению заболеваемости ОРН:
- Лечение: риск повышается в связи с оперативным вмешательством (мандибулэктомия или иная остеотомия)
- Факторы риска, зависящие от пациента: повышение риска связано с недостаточной гигиеной полости рта, злоупотреблением алкоголем и табакокурением
3. Течение и прогноз:
• Заболеваемость ОРН • Пик заболеваемости: первые 6-12 месяцев после облучения
4. Лечение:
• Профилактика является наиболее значимым моментом перед лучевой терапией:
о Удаление зубов и санация периодонта до лучевой терапии
о Улучшение питания до и во время лечения
о Отказ от табака и алкоголя
• Консервативное лечение: антибиотикотерапия и местные ирригации
• Гипербарическая оксигенация для стимуляции ангиогенеза и как вспомогательный метод в лечении сочетанных инфекций:
о Перед осуществлением гипербарической оксигенации необходимо исключить резидуальную и рецидивную опухоль
• Секвестрэктомия и первичное закрытие раны на ранних стадиях заболевания
• Резекция кости и реконструктивное вмешательство при тяжелом прогрессирующем заболевании
1. Следует учесть:
• Остеорадионекроз у пациентов, перенесших лучевую терапию, у которых вновь появилась боль, незаживающие язвы слизистой оболочки, литические/склеротические изменения костей (КТ)
• Необходимо исключить рецидив плоскоклеточного рака как источник боли и разрушения кортикальной пластинки:
о Мягкотканное образование позволяет склониться к опухоли
• Остерадионекроз может возникать спустя несколько лет после лечения; так, если после терапии прошло >8 лет, нужно исключать радиационно-индуцированную саркому, особенно, если обнаруживается мягкотканное образование
2. Советы по интерпретации изображений:
• Местная инфекция или патологический перелом
3. Рекомендации по отчетности:
• Распространенность поражения, нарушение целостности кортикального слоя, наличие спикул со стороны обнаженной кости, наличие секвестров
Клинический случай радионекроза челюсти и периимплантита после лучевой терапии
Остеорадинекроз (ОРН) нижней челюсти является серьезным осложнением, которое может возникнуть у пациентов после курса радиотерапии в ходе комплексного лечения новообразований области головы и шеи. Предрасполагающими факторами при этом остаются доза облучения, локализация опухоли, травма зубов в анамнезе и компрометированное состояние стоматологического статуса.
Чаще всего именно у пациентов возрастной категории 50+ регистрируются новообразования головы и шеи и, как правило, у большинства пациентов в этом возрасте имеются дентальные имплантаты, которые играют роль опорных элементов под ортопедические конструкции. Результаты дентальной имплантации, как и состояние периимплантантных тканей, являются некими составляющими элементами в структуре этио-патофизиологического процесса возникновения радионекроза челюстей после проведённой радиотерапии.
Имеющиеся на сегодня исследования по большей мере сконцентрированы на изучении перспектив дентальных имплантатов, установленных до процедуры терапевтического облучения, или же на определении прогноза таких конструкций после такого ятрогенного вмешательства. Но вопрос эффекта радиотерапии на полностью остеоинтегрированный имплантат по-прежнему остается дискуссионным и открытым, поэтому данная статья посвящена описанию изменений периимплантатных структур после терапевтического облучения на примере конкретного клинического случая.
Клинический случай
66-летний пациент был направлен в нашу больницу для дальнейшего лечения ОРН нижней челюсти. 7 лет назад ему проводилась установка титановых инстраосcальных конструкций на месте отсутствующих 35, 36, 45 и 47 зубов. При этом в ходе определенного времени все установленные имплантаты удачно остеоинтегрировались, что было подтверждено в ходе численных повторных контрольных визитов.
Через некоторое время у него диагностировали левостороннюю ротоглоточную карциному, лечение которой проводили посредством лучевой терапии с общей дозой 70 Гр через 2 года после имплантационного вмешательства. В ходе анализа медицинской документации было обнаружено, что левая челюсть была включена в зону терапевтического облучения.
Через 4 года после радиотерапии пациент начал испытывать болевые ощущения в области имплантатов, установленных с левой стороны, в том же участке у него наблюдалось значительное воспаление и отечность десен. После постановки диагноза периимплантита ему было проведено консервативное лечение, состоящее из местной ирригации области поражения и периодического приема антибиотиков на протяжении 6 месяцев. Однако симптомы поражения только усиливались, и он был направлен в нашу больницу для проведения дальнейшего лечения патологии.
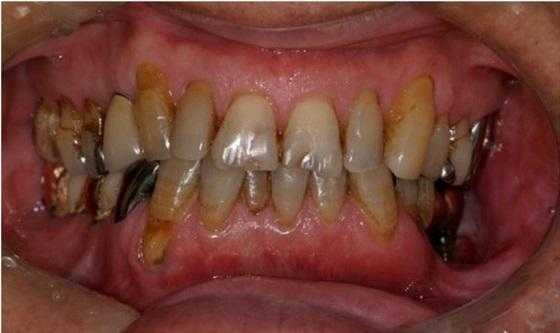
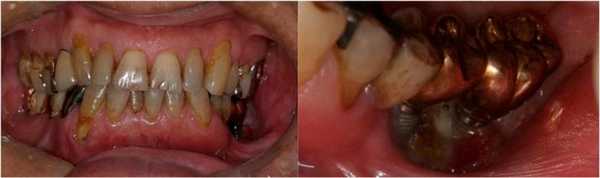
В ходе клинического исследования у пациента был обнаружен болезненный отек левой щеки и гипестезия нижней губы с левой стороны, при этом возможность открытия рта была ограничена до ширины полтора пальца, а вокруг дентальных имплантатов с левой стороны наблюдался некроз альвеолярной кости, воспаление слизистой и периодическое гноеотделение (фото 1).
Фото 1. Клиническая ситуация до лечения.
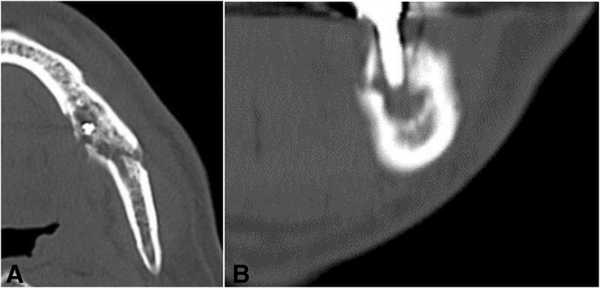
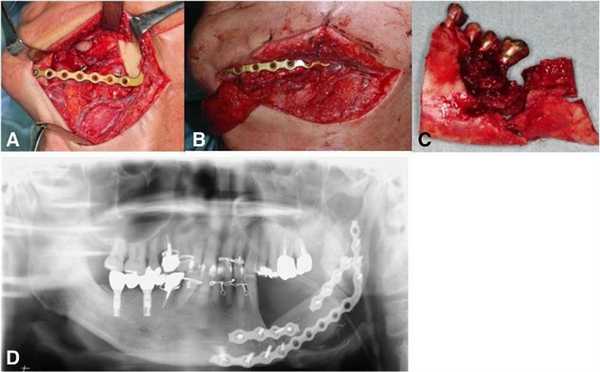
На ортопантомограмме контурировалась слабо демаркационная зона деструкции костной ткани в области имплантатов на месте 35 и 36 зубов, при этом поражение достигало нижнего края челюсти, что в результате спровоцировало возникновение патологического перелома. Вокруг имплантатов с правой стороны челюсти никаких патологических поражений отмечено не было (фото 2). С помощью КТ-сканирования удалось подтвердить деструкцию нижней челюсти слева и наличие линии перелома через всю толщу костной ткани (фото 3).
Фото 2. Ортопантомограмма пациента до лечения.
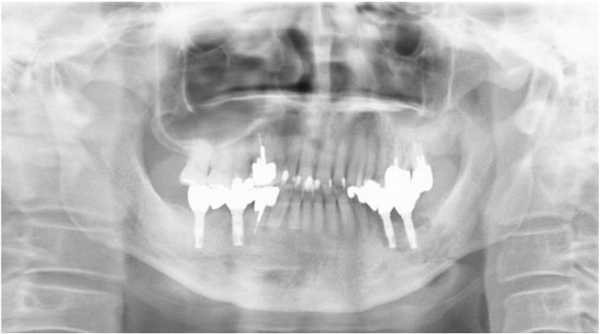
Фото 3. КТ-изображения нижней челюсти с левой стороны: а) аксиальный срез в области левого первого моляра; b) корональный срез в области левого первого моляра.
На первом этапе лечения пациент прошел курс 30 сеансов гипербарической кислородной терапии, что позволило лишь незначительно улучшить имеющиеся симптомы поражения. Учитывая, что на рентгенологических снимках не было замечено никакого прогрессирования области деструкции, была проведения частичная резекция области нижней челюсти с последующим восстановлением дефектного участка посредством свободного микроваскулярного лоскута из малоберцовой кости. Фиксация трансплантата проводилась с использованием титановой пластины (фото 4).
Фото 4: а) Сегментированная резекция пораженного участка нижней челюсти; b) локализированный костный трансплантат из области малоберцовой кости; c) резецированная нижняя челюсть; d) ортопантомограмма после операции.
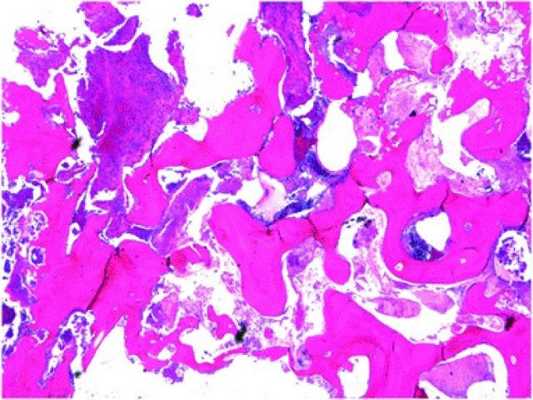
В ходе гистопатологического исследования резецированного участка нижней челюсти было обнаружено потерю остеоцитов и остеобластов в структуре ткани и заполнение костных полостей грибковой массой, а также инфильтрацию области поражения воспалительными клетками с присутствующими признаками фиброза в кости (фото 5).
Фото 5. Гистологический вид резецированного участка нижней челюсти (окраска гематоксилин-эозином).
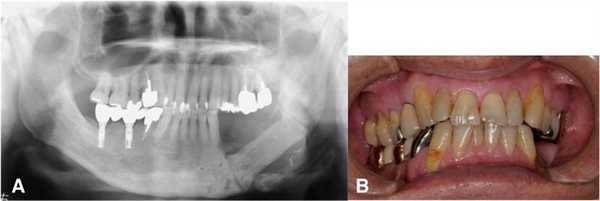
В качестве окончательного был поставлен диагноз остеорадионекроз. В ходе послеоперационного наблюдения никаких дополнительных поражений в области других имплантатов замечено не было, признаки остеорадионекроза челюсти не рецидивировали, резидуальная часть тканей оставалась интактной (фото 6).
Фото 6. a) Ортопантомограмма через год после хирургического вмешательства; b) вид полости рта через 1 год после хирургического вмешательства.
В данной статье проанализирован клинический случай возникновения ОРН нижней челюсти вокруг дентальных имплантатов, установленных до начала проведения лучевой терапии у пациента.
По нашим наблюдениям, это уже третий подобный случай, описанный в литературе. Granström и коллеги сообщали о трех случаях развития ОРН вокруг дентальных имплантатов, помещенных до радиотерапии для поддержки транскожного протеза. В свою очередь Slama также сообщил о случае ОРН нижней челюсти в области имплантатов после терапевтического облучения. Исходя их этого, можно предположить, что наличие имплантата играет некую роль в развитии ОРН у пациента после радиотерапии.
Ozen и коллеги, исследуя повышение дозы от рассеянного излучения на границе раздела фаз костной ткани и дентального имплантата, пришли к выводу, что увеличение радиационной дозы, действующей на альвеолярную кость происходит непосредственно вблизи титанового винта, и может достигать повышения на целых 21%. На расстоянии уже 2 мм от титановой поверхности увеличение ионизирующей дозы было минимальным, при этом, очевидно, что увеличение радиационной локальной нагрузки на 15-21% может спровоцировать процесс остеонекроза нижней челюсти в периимплантатной области. При этом Beyzadeoglu сообщили, что изменение длины пучков облучения, как и угла их прохождения, значительно не влияет на суммарную дозу поражения, которая может спровоцировать остеонекроз.
Из вышеописанного можно сделать вывод, что область интерфейса имплантат-кость подвергается повышенному облучению в результате эффекта рассеивания радиационного потока посредством самой титановой конструкции, которая может находится в поле терапевтического действия радиации.
Кроме того, причина ОРН может крыться в действии бактериальной инфекции, ассоциированной с имплантатом. Часто вокруг фиксированных металлокерамических конструкций, как и вокруг конструкций с опорой на имплантаты, наблюдаются области гингивита, что, в свою очередь, провоцирует удушение состояния гигиены полости рта, а это вызывает дальнейшую повышенную бактериальную контаминацию периимплантатного участка.
Лучевая терапия посредством воздействия на сосуды, фибробласты и различные регуляторные факторы роста провоцирует нарушение процесса физиологического заживления ран, а также вызывает развития специфического состояния – иммунодефицита. Все это, в свою очередь, снижает уровень резистентности периимплантатных тканей относительно бактериальных агентов полости рта, тем самым увеличивая риск развития периимплантита. Slama и коллеги сообщали о случаях наличия периимплантита до начала развития ОРН, и в нашей ситуации периимплантит прогрессировал вплоть до ОРН. Хорошо известно, что защитная функция окружающих тканей намного слабее вокруг имплантатов, чем вокруг естественных зубов, поэтому вполне вероятно, что периимплантатный мукозит, вызванный лучевой терапией, может легко прогрессировать, переходя в агрессивный периимплантит, и последующее более тяжелое инфекционное поражение костей челюсти.
Выводы
В последнее время дентальные имплантаты стали популярной опцией лечения пациентов с симптомами частичной или полной адентии. Как следствие, число пациентов, проходящих через курс радиотерапии и имеющих дентальные имплантаты, также прогрессивно увеличивается. Для детального анализа эффекта облучения на прогноз дентального имплантата необходимо проведение более прецизионных и выборочных исследований, которые помогут сделать однозначные выводы по этому поводу.
Авторы: Yuji TeramotoEmail author, Hiroshi Kurita, Takahiro Kamata, Hitoshi Aizawa, Nobuhiko Yoshimura, Humihiro Nishimaki, Kazunobu Takamizawa
Читайте также:
- Примеры аргонлазерной фотокоагуляции (транспупиллярной термотерапии) меланомы хориоидеи
- Заживление проникающих ранений глазного яблока. Особенности
- Реберный хондрит (синдром Титце): атлас фотографий
- Препараты расширяющие и сужающие зрачок
- Венозно-лимфатическая мальформация глазницы (лимфангиома глаза)
