Папиллярная аденокарцинома эндометрия (серозно-папиллярная аденокарцинома)
Добавил пользователь Morpheus Обновлено: 27.01.2026
Резюме. Ендометріальна інтраепітеліальна карцинома на сьогодні розцінюється як рання форма серозної папілярної карциноми ендометрія. Морфологічна картина характеризується заміщенням атрофічного поверхневого епітелію ендометрія та епітелію залоз ендометрія крупними атиповими поліморфними клітинами. Імуногістохімічно характеризується вираженим рівнем експресії білка р53 та високим індексом проліферативної активності Кі-67. Ця патологія часто асоційована з інвазивною серозною папілярною карциномою у інших ділянках ендометрія, що зумовлює необхідність розширенного хірургічного втручання у разі виявлення морфологічної картини ендометріальної інтраепітеліальної карциноми у матеріалі діагностичного вишкрібання порожнини матки. Навіть у разі відсутності інвазивного компоненту можливий розповсюджений метастатичний процес. Враховуючи рідкість цієї патології, розробка лікувальних заходів потребує подальшого вивчення.
Резюме. Эндометриальная интраэпителиальная карцинома на данный момент рассматривается как ранняя форма серозной папиллярной карциномы эндометрия. Морфологическая картина характеризуется замещением атрофичного поверхностного эпителия эндометрия и эпителия желез эндометрия крупными атипичными полиморфными клетками. Иммуногистохимически характеризуется выраженным уровнем экспрессии белка р53 и высоким индексом пролиферативной активности Ki-67. Данная патология часто ассоциирована с инвазивной серозной папиллярной карциномой в других участках эндометрия, что обусловливает необходимость расширенного хирургического вмешательства в случае выявления морфологической картины эндометриальной интраэпителиальной карциномы в материале диагностического выскабливания полости матки. Даже при отсутствии инвазивного компонента возможен распространенный метастатический процесс. Учитывая редкость этой патологии, разработка подходов к лечению требует дальнейшего изучения.
Серозная папиллярная карцинома эндометрия — редкая форма рака эндометрия, составляющая около 5–10% в структуре всех случаев злокачественных процессов в эндометрии. Данный гистологический вариант характеризуется крайне агрессивным клиническим течением и неблагоприятным прогнозом [1, 7]. В отличие от типичной эндометриальной карциномы, которая, как правило, развивается на фоне атипической гиперплазии эндометрия, для серозной папиллярной карциномы условный неинвазивный предшественник длительное время был неизвестен. Первые публикации, посвященные изучению этого вопроса, стали появляться в начале 90-х годов XX в. [2, 5]. При исследовании участков эндометрия, расположенных рядом с очагами инвазивной серозной папиллярной карциномы, в 90% случаев можно выявить специфическую морфологическую картину, характеризирующуюся замещением поверхностного эпителия эндометрия, а также эпителия желез, атипичными полиморфными клетками [2, 9]. Дальнейшее изучение этого вопроса показало, что данный процесс в ряде случаев возможен и при отсутствии инвазивной серозной папиллярной карциномы. Для описания таких случаев были предложены различные термины, такие как «карцинома in situ» и «поверхностная карцинома эндометрия». Однако, учитывая, что даже при отсутствии инвазивного компонента, у части пациенток наблюдался распространенный метастатический процесс [8, 9], для того чтобы не сбивать с толку клиницистов и пациентов, было принято решение использовать термин «эндометриальная интраэпителиальная карцинома» как более точно отражающий наличие злокачественного потенциала у данного процесса [5, 7].
Эндометриальная интраэпителиальная карцинома (ЭИК), как и серозная папиллярная карцинома эндометрия, отмечается преимущественно у пациенток в возрасте 60 лет и старше, наиболее частым клиническим проявлением является кровотечение в менопаузе. ЭИК, как правило, развивается на фоне атрофичного эндометрия без активного воздействия эстрогена, что отличает ее от других аденокарцином эндометрия [6]. К тому же, довольно часто очаги ЭИК определяются в полипе эндометрия атрофичного типа [4].
Для микроскопической картины характерно замещение атрофичного поверхностного эпителия эндометрия и эпителия желез эндометрия атипичными полиморфными клетками, содержащими крупное ядро с везикулярным хроматином и обильную цитоплазму и большим количеством фигур митоза. Вышеописанные клетки располагаются однорядно вдоль базальной мембраны пораженной железы или, реже, могут формировать микропапиллярные структуры. Иммуногистохимическое исследование позволяет выявить высокую экспрессию белков р53 и Ki-67, что характерно и для серозной папиллярной карциномы эндометрия [2, 3, 7].
Диагностика ЭИК сложна, поскольку необходимо различать ее от атипической гиперплазии эндометрия, для которой также характерно наличие атипичных желез [7]. В отличие от атипической гиперплазии эндометрия, которая развивается в виде очагов на фоне типичной гиперплазии эндометрия, фоном для ЭИК является атрофичный эндометрий [6]. Для ЭИК характерна более выраженная степень клеточной и ядерной атипии, а также большое количество фигур митоза. Кроме особенностей морфологического строения, при иммуногистохимическом исследовании, как указывалось выше, уровень пролиферативной активности и уровень экспрессии белка р53 значительно выше в случае ЭИК, чем при атипической гиперплазии эндометрия [2]. Кроме атипической гиперплазии эндометрия, дифференциальную диагностику необходимо проводить с некоторыми доброкачественными метапластическими и дегенеративно-регенераторными процессами в эндометрии, которые могут симулировать злокачественный процесс, вследствие своих структурных особенностей. Примером такого состояния может быть синцитиальная папиллярная метаплазия эпителия эндометрия, которая является ответом эпителия эндометрия на раздражение, например на длительное кровотечение [3]. Этот процесс характеризуется появлением на поверхности эндометрия скоплений и пластов крупных полиморфных клеток с атипичным ядром и обильной эозинофильной цитоплазмой. Местами формируются тонкие папиллярные структуры. Внутри клеточных пластов определяются скопления нейтрофилов. Такой доброкачественный процесс наблюдается, как правило, на фоне десквамативных изменений в окружающей ткани эндометрия. Кроме особенностей морфологического строения, при иммуногистохимическом исследовании отмечается отсутствие экспрессии белка р53 и низкий уровень индекса Ki-67 в случае доброкачественных метапластических процессов, в отличие от высокой пролиферативной активности и выраженной диффузной экспрессии белка р53 в случае ЭИК [3].
Дальнейшие исследования показали, что даже в случае выявления в материале диагностического выскабливания участков эндометрия с очагами ЭИК без признаков инвазивного роста, высока вероятность присутствия инвазии в других участках эндометрия, не попавших в материал соскоба. Поэтому в случае выявления ЭИК при гистологическом исследовании материала, полученного при диагностическом выскабливании, рекомендуется проведение расширенной пангистерэктомии с последующим тщательным гистологическим исследованием операционного материала [9]. Во многих случаях при последующем исследовании операционного материала определяют участки инвазивной серозной папиллярной карциномы. При подтверждении наличия ЭИК без сопутствующей серозной папиллярной карциномы прогноз считается благоприятным. Хотя, как уже упоминалось выше, в ряде случаев ЭИК с доказанным отсутствием инвазии наблюдался распространенный метастатический процесс. Это обусловливает необходимость дальнейшего изучения подходов к диагностике и лечению, что сильно затрудняется редкой частотой данной патологии [9].
Заключение
ЭИК представляет собой особую форму карциномы эндометрия, являющуюся ранней стадией развития серозной папиллярной карциномы эндометрия. Данный процесс имеет характерные особенности морфологического строения и иммунофенотип, позволяющие отличить его от атипической гиперплазии эндометрия и некоторых доброкачественных метапластических процессов. Учитывая высокую вероятность выявления участков инвазивной серозной папиллярной карциномы рядом с очагами ЭИК, при гистологической картине ЭИК в материале диагностического выскабливания полости матки рекомендуется проведение последующей пангистерэктомии. С учетом высокой вероятности развития метастатического процесса необходимо дальнейшее изучение подходов к диагностике и лечению пациенток с этой патологией.
Случай из практики
Пациентка, 60 лет. Менопауза 10 лет. Обратилась к врачу по поводу начавшегося маточного кровотечения. Было выполнено диагностическое выскабливание полости матки. В материале соскоба среди масс крови отмечаются довольно крупные фрагменты раздробленного полипа эндометрия атрофичного типа (рис. 1). Поверхностный эпителий эндометрия и эпителий части желез замещен крупными атипичными полиморфными клетками, содержащими крупное ядро с везикулярным хроматином, обильную цитоплазму (рис. 2). Вышеописанные клетки располагаются вдоль базальной мембраны пораженной железы и в отдельных железах формируют микропапиллярные структуры (рис. 3). В участках атипичной выстилки отмечаются фигуры митоза. При иммуногистохимическом исследовании отмечается выраженный уровень экспрессии белка р53 (рис. 4) и высокий индекс пролиферативной активности Ki-67.
Рис. 1. В материале соскоба из полости матки фрагменты полипа эндометрия атрофичного типа с отдельными атипичными железами. Окраска гематоксилином и эозином, х100
Рис. 2. В отдельных железах атрофичная эпителиальная выстилка замещена атипичными полиморфными клетками. Окраска гематоксилином и эозином, х200
Рис. 3. Фрагмент железы, выстланной атипичными полиморфными клетками, имеющими крупное ядро с везикулярным хроматином, обильную цитоплазму. Окраска гематоксилином и эозином, х400
Рис. 4. Позитивная ядерная реакция на наличие экспрессии белка р53. Иммуногистохимическое окрашивание, клон DO-7, производитель Dako, система визуализации EnVision, chromogene DAB, х400
Патогистологическое заключение: эндометриальная интраэпителиальная карцинома эндометрия на фоне полипа эндометрия атрофичного типа.
Папиллярная аденокарцинома эндометрия (серозно-папиллярная аденокарцинома)
Папиллярная аденокарцинома эндометрия (серозно-папиллярная аденокарцинома)
Особое внимание исследователи обращают на такой гистологический подтип, как папиллярная аденокарцинома, на долю которой приходится 1 — 10% всех аденокарцином. Некоторые авторы также используют термины «папиллярно-серозная аденокарцинома» и «серозно-папиллярная аденокарцинома». Папиллярные аденокарциномы эндометрия известны на протяжении многих лет.
Christopherson и соавт. представили Cullen иллюстрацию данной опухоли в 1900 г. Серозно-папиллярный рак матки рассматривается как особая, крайне агрессивная злокачественная опухоль. С точки зрения двух патогенетических вариантов РЭ (первый с признаками гиперэстрогении, а второй без них) серозно-папиллярный рак относится к последнему. Для пациенток с этим гистологическим типом характерен более старший возраст, отсутствие ожирения и наличие родов в анамнезе; опухоли имеют высокую степень злокачественности и быстро распространяются за пределы матки.
Выживаемость низкая. Hendrickson в начале 1980-х годов обратил внимание на то, что серозно-папиллярный вариант из более чем 250 больных РЭ выявили только у 10 %, но они составили 50 % всех случаев неуспешного лечения. Гистологическая картина напоминает низкодифференцированный серозный РЯ, который склонен к прорастанию в кровеносные или лимфатические сосуды.
Хорошо сформированные сосочки покрыты неопластическими клетками с низкой степенью дифференцировки. Необходимо отличать сосочковую структуру и синцитиальную метаплазию от доброкачественных поражений эндометрия, т. к. наличие только сосочковой структуры не означает присутствия серозно-папиллярного рака. Макроскопически матка может казаться нормальной, но при этом не исключена обширная инвазия в миометрий. Большинство серозно-папиллярных опухолей анеуплоидные с высоким процентом клеток в S-фазе.
Позднее в литературе появилось много небольших статей по данной проблеме. В одной из самых больших выборок, представленных Goff и соавт., приведены данные о 50 больных РЭ: в 33 случаях это был только серозпо-папиллярный рак, в 17 — этот рак сочетался с другими морфологическими вариантами. У 36 (72%) пациенток заболевание распространялось за пределы матки, что служило свидетельством о неблагоприятном прогнозе.
Метастазы в лимфоузлах обнаружены у 36% больных без инвазии в миометрий, у 50% — с прорастанием опухоли менее чем на 1/2 толщины миометрия и у 40 % — с инвазией в наружную часть миометрия. Среди пациенток, у которых опухолевые клетки обнаружены в сосудах, заболевание распространилось за пределы матки в 85 % случаев. Но и без признаков поражения сосудов у 58 % пациенток также отмечалась диссеминация за пределами матки. Степень дифференцировки и глубина инвазии не представляли собой значимые прогностические факторы прогрессирования заболевания.
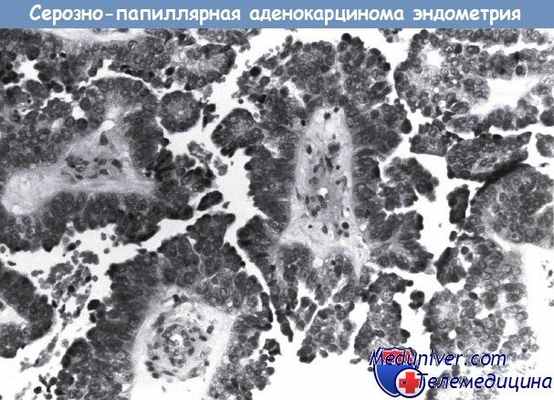
Серозно-папиллярная аденокарцинома эндометрия.
Сходство с серозным раком яичников очевидно.
Особого внимания заслуживает тот факт, что у 14 (28%) пациенток заболевание было ограничено эндометрием, но при этом у 36% обнаружены метастазы в лимфоузлах, у 43% — диссеминация по брюшине, у 50 % — положительный результат цитологического исследования смывов из брюшной полости. Эти результаты практически полностью совпадают с данными, полученными при обследовании пациенток с инвазией в наружную часть миометрия.
В представленной работе наличие опухолевых клеток в кровеносных или лимфатических сосудах — единственный значимый прогностический фактор распространения заболевания за пределы матки. Даже если серозно-папиллярный рак ограничен полипом, диссеминация за пределами матки наблюдается у 30—50 % больных. Ввиду низкой выживаемости больных РЭ с этим гистологическим типом опухоли вполне обоснованы стремления улучшить этот показатель за счет адъювантной терапии. Лучевая терапия (ЛТ) на область таза оказалась неэффективной по причине быстрого прогрессирования заболевания и распространения его за пределы таза.
Интересные случаи представлены Parkash и Carcangiu: у 6 пациенток через 10 лет и более (в среднем 16 лет) после ЛТ по поводу рака шейки матки развились рецидивы, гистологическое исследование которых выявило серозно-папилляриый рак. Эти данные охватывают 7,5 % всех случаев этого морфологического варианта РЭ, диагностированных в Йельском университете в течение указанного времени. Хотя и другие авторы обращали внимание на эту взаимосвязь, ЛТ, по-видимому, не служит главной причиной развития этих опухолей. Ряд исследователей для лечения серозно-папиллярной аденокарциномы эндометрия применяли схемы полихимиотерапии (ПХТ), которые используют при РЯ, учитывая сходство гистологических картин этих опухолей. Положительные эффекты при этом не отмечались.
Levenback и соавт. из M.D. Anderson Cancer Centre провели лечение 20 женщин с серозно-папиллярной аденокарциномой по схеме, включавшей цисплатин, доксорубицин и циклофосфамид (РАС). В эту группу входили больные с опухолями, размер которых можно было определить (при выраженных стадиях и рецидивах заболевания). Только у 2 из 11 пациенток достигнут объективный ответ. Во время ревизии органов брюшной полости у 6 больных заболевание за пределы матки не распространялось; выживаемость в этой группе женщин была выше. 5-летняя выживаемость равнялась 23 % для всех пациенток.
Данные, отличные от указанных выше, представили Rosenberg и соавт. на основании анализа 31 больной с клинически диагностированной I стадией серозно-папиллярного РЭ, причем в 21 случае опухоли были низкодифференцированными (G3).
После хирургического лечения (радикальная гистерэктомия с двусторонней тазовой лимфаденэктомией) проводили адъювантную ЛТ и 4 курса цисплатина и эпирубицина. Ни одна из пациенток с этим гистологическим типом РЭ не умерла и не имела рецидивов заболевания при средней продолжительности наблюдения 32 мес. по сравнению с 16 (53%) из 30 больных в группе исторического контроля, которым проводили менее интенсивную терапию (р = 0,021). Не все пациентки из группы интенсивной терапии получили запланированное лечение: только 53 % полностью закончили терапию по протоколу.
Так, например, 3 больные не получили ЛТ, что наводит на мысль о том, что XT, возможно, представляет более важный компонент адъювантной терапии. Для сравнения отметим, что 11 (64%) из 17 пациенток в группе исторического контроля, получившие ЛТ, умерли из-за прогрессирования основного заболевания. Остается только надеяться, что в ближайшем будущем для этого агрессивного варианта РЭ будет определена оптимальная схема адъювантной терапии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Папиллярная аденокарцинома эндометрия (серозно-папиллярная аденокарцинома)
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Москва, Россия
Аденокарцинома шейки матки
Журнал: Онкология. Журнал им. П.А. Герцена. 2017;6(1): 76‑80
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Москва, Россия
В статье приводятся современные данные по эпидемиологии, этиологии, классификации, путям распространения, клинике, диагностике, дифференциальной диагностике, характеристике отдельных форм заболевания, лечению, факторам прогноза и профилактике аденокарциномы шейки матки.
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Москва, Россия
В последние десятилетия произошло резкое увеличение частоты аденокарциномы шейки матки (АКШМ). Если в 50—60-е годы ХХ века плоскоклеточный рак шейки матки (ПКР) составлял 95% всех раковых опухолей шейки матки, то в последние десятилетия его частота снизилась до 75% за счет увеличения частоты АКШМ. Такое изменение соотношения частоты ПКР и АКШМ связано с широким внедрением метода цитологического скрининга, при котором предраковые заболевания стали значительно чаще выявляться и соответственно снижаться частота выявления ПКР. В то же время частота АКШМ стала значительно увеличиваться (до 20—25%).
Существуют сходные этиологические факторы АКШМ и ПКР в виде вируса папилломы человека (ВПЧ). Однако существуют различия в их частоте. В возникновении ПКР чаще играет роль ВПЧ 16-го типа, при АКШМ ВПЧ 16-го типа обнаруживается у 50%, а при ПКР — только у 15% больных [1, 2]. Использование оральных контрацептивов обусловливает частоту возникновения АКШМ и ПКР в равной степени [3]. Курение представляет фактор риска более существенный при возникновении ПКР и в меньшей степени — АКШМ [4]. Больше факторов риска отмечается при АКШМ, подобно таковым при раке эндометрия (ожирение, отсутствие беременности и родов) [5, 6].
Морфологическая классификация АКШМ включает в себя различные варианты аденокарциномы.
Аденокарцинома in situ
эндоцервикальная аденокарцинома, обычный тип;
серозная (папиллярная серозная);
аденокарцинома, смешанная с нейроэндокринной карциномой.
Аденокарцинома (АК) in situ — заболевание, характеризующееся наличием железистых структур, выстланных атипическим железистым эпителием с нарушением ядерно-цитоплазматического соотношения, ядер клеток, богатых хроматином. Опухолевые железы не прорастают в подлежащую ткань.
Средний возраст больных на 10—15 лет меньше, чем при инвазивной АКШМ.
Клетки опухоли содержат белок р16 и маркер Ki-67. Характерным является отсутствие рецепторов эстрогенов и прогестерона.
АКШМ обычного типа является наиболее частой формой А.К. Клетки ее содержат относительно небольшое количество муцина.
При муцинозном типе АКШМ в цитоплазме опухолевых клеток содержится слизь в виде вакуолей. Муцинозная АКШМ имеет 3 формы — желудочную, кишечную и перстневидно-клеточную. Первая форма характеризуется наличием желез желудочного типа. При второй клетки напоминают таковые карциномы толстой кишки. При третьей клетки имеют вид перстневидных, они обычно присутствуют в качестве незначительного компонента в смеси с желудочной или кишечной формой.
Ворсинчато-железистый вариант АКШМ характеризуется наличием сложных ветвящихся отростков, напоминающих тубуловорсинчатую аденому толстой кишки.
Эндометриоидная АКШМ может иметь строение эндометриоидного рака эндометрия с малым содержанием или полным отсутствием внутриклеточного муцина.
Светлоклеточная АКШМ представляет собой высокодифференцированный вариант железисто-плоскоклеточной карциномы с выраженной воспалительной инфильтрацией стромы.
Серозная АК идентична серозной АК эндометрия. Она состоит из сосочковых образований, выстланных полиморфными клетками, и диагностируется только при отсутствии рака эндометрия.
Мезонефральный вариант АКШМ возникает из мюллеровских остатков, состоит из трубчатых желез, выстланных кубическими клетками с эозинофильной цитоплазмой, в просвете желез содержится гиалин.
АК, смешанная с нейроэндокринной карциномой, характеризуется тем, что в ней содержатся клетки нейроэндокринного типа вместе с вариантами АК обычного типа.
Важное значение для клинициста с точки зрения тактики лечения имеет степень распространения опухоли.
Стадирование АК шейки матки проводится по стадиям (FIGO) и распространенности опухолевого процесса (TNM).
Пути распространения
Местное распространение АК на эндометрий происходит у 4—17% больных. АК может переходить на параметральную клетчатку, что приводит к сдавлению мочеточника. Нарушение пассажа мочи может быть также обусловлено сдавлением мочеточника увеличенными лимфатическими узлами [6—8].
При значительном распространении опухоли могут поражаться мочевой пузырь и прямая кишка [6].
Поражение лимфатических узлов происходит в обычной последовательности: парацервикальные, гипогастральные, наружные подвздошные, общие подвздошные, люмбальные и паховые. Возможно и поражение лимфатических узлов в другой последовательности. Поражение надключичных лимфатических узлов встречается редко.
Гематогенное метастазирование отмечается у 5% пациенток. При этом поражаются легкие, печень, кости, кишечник, головной мозг. Метастазы в яичниках чаще встречаются при АК, чем при ПКР (5 и 0,7% соответственно) [8—10].
Важное значение имеет обнаружение раковых клеток АК в брюшной полости, что встречается в 6,7% случаев. При этом у всех этих больных возникает рецидив заболевания [10].
Клиника
Клиническая картина при АК довольно скудна, что затрудняет раннее выявление заболевания [6]. У больных наблюдаются межменструальные кровянистые выделения различной степени. В менопаузальном периоде появляются кровянистые выделения из половых путей. При прогрессировании заболевания в малом тазу могут появиться опухолевые образования. У 50% больных отмечается эндофитный рост опухоли с диффузным распространением, в связи с чем шейка матки приобретает бочкообразную форму. Реже встречается язвенная форма, при которой поражается и экзоцервикс.
Диагностика
Диагностика АКШМ не всегда является простой задачей [6, 11]. При визуальном исследовании поверхность шейки матки может быть не изменена. Патология не всегда выявляется и при бимануальном исследовании.
При АКШМ отмечается уплотнение шейки матки, а при переходе опухоли на поверхность влагалищной части обнаруживается язва [6].
Цитологическое исследование мазков из цервикального канала также не всегда позволяет сразу установить правильный диагноз [10]. У 60% больных оно может быть неинформативным. Изменение цитологической картины с появлением эхографических признаков патологии требует углубленного исследования: гистероскопии, выскабливания цервикального канала, конусовидной биопсии шейки матки.
Определение опухолевых маркеров (РЭА, СА 125, СА 19.9) имеет значение в диагностике заболевания, при этом отмечается корреляция между уровнем маркеров и стадией заболевания.
Важное диагностическое значение для выбора тактики лечения имеют дополнительные методы исследования. В качестве обязательных процедур рекомендуется УЗИ брюшной полости, включая малый таз [6]. Необходимые данные могут быть получены и при использовании других диагностических методов. Так, МРТ органов малого таза информативна при оценке глубины инвазии опухоли и ее отношения к соседним органам и тканям и в 71—97% случаев позволяет поставить верный диагноз. При К.Т. малого таза и забрюшинного пространства можно выявить метастазы в лимфатических узлах, а при ПЭТ провести молекулярную визуализацию опухоли и ее отношение к соседним органам и тканям.
Поражение опухолевым процессом соседних органов может потребовать проведение колоноскопии или цистоскопии.
Дифференциальная диагностика
АКШМ следует дифференцировать от преинвазивной формы рака, АК эндометрия, метастатического поражения шейки. Отличительными чертами инвазивного роста АК являются инфильтративный рост, наличие реактивного состояния клеток стромы. В отличие от рака эндометрия клетки АК не содержат рецепторы эстрогенов и прогестерона. Для метастатического поражения шейки матки опухолью железистого строения характерным является отсутствие поверхностного поражения органа при наличии опухолевых элементов в просвете кровеносных и лимфатических сосудов.
Лечение
Комплекс мероприятий по лечению больных АКШМ изложен по материалам практических рекомендаций по лекарственному лечению злокачественных опухолей (Russco, 2015, с. 139—149).
Лечебные мероприятия начинаются после обязательного гистологического подтверждения диагноза. Они определяются степенью распространенности опухолевого процесса и общим состоянием пациентки.
При преинвазивной АКШМ показана экстирпация матки. Женщинам репродуктивного возраста, желающим сохранить детородную функцию, может быть произведена конизация шейки матки с последующим тщательным гистологическим исследованием.
Микроинвазивная карцинома
Критериями, которые позволяют диагностировать микроинвазивный РШМ, являются глубина инвазии и ее распространенность. Выполнения только биопсии шейки матки, как правило, бывает недостаточно. Адекватным минимальным хирургическим вмешательством, позволяющим диагностировать микроинвазию опухоли в строму шейки матки, является конизация шейки матки.
IA1 стадия (инвазия 3 мм и менее; горизонтальное распространение 7 мм и менее)
Опухолевые эмболы в лимфатических и кровеносных сосудах не меняют стадию заболевания. Адекватным объемом хирургического вмешательства при РШМ IA1 стадии является конизация шейки матки с последующим выскабливанием оставшейся части цервикального канала и по показаниям полости матки при отсутствии опухоли в краях резекции и соскобе из оставшейся части цервикального канала [12]. Если в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала обнаруживаются дисплазия или клетки рака, риск остаточной опухоли достаточно высокий и, прежде чем определять дальнейшую тактику лечения, необходимо провести повторную конизацию. Это нужно для уточнения степени поражения шейки матки и определения объема последующей операции. Если при глубине инвазии опухоли в строму до 3 мм обнаруживаются раковые эмболы в кровеносных или лимфатических сосудах, возрастает риск метастатического поражения регионарных лимфатических узлов (до 15%). В этом случае больной следует выполнить модифицированную расширенную экстирпацию матки с придатками (или без придатков) (операция II типа).
IA2 стадия (инвазия более 3 и 5 мм и менее; горизонтальное распространение 7 мм и менее)
— При РШМ IA2 стадии показано выполнение модифицированной расширенной экстирпации матки (II тип).
— При противопоказаниях к хирургическому лечению может проводиться лучевая терапия (ЛТ).
— При необходимости сохранить детородную функцию у больной РШМ IA2 стадии FIGO считает возможным выполнить широкую конизацию шейки матки с экстраперитонеальной или лапароскопической тазовой лимфаденэктомией либо расширенную трахелэктомию (II тип).
IB1 и IIА1 стадии (опухоль менее 4 см)
— Показана расширенная экстирпация матки (операция III типа) или ЛТ/химиолучевая терапия по радикальной программе.
— Применение комбинации хирургического лечения с ЛТ достоверно увеличивает частоту осложнений.
— При наличии метастазов в тазовых лимфатических узлах обязательно выполнять поясничную лимфаденэктомию.
Группа высокого риска прогрессирования: при наличии одного из факторов высокого риска прогрессирования после расширенной экстирпации матки III типа (метастазы в лимфатических узлах, поражение параметриев или опухоль в краях резекции влагалища) показано проведение адъювантной химиолучевой терапии (ЛТ + еженедельное введение цисплатина в дозе 40 мг/м 2 на протяжении ЛТ).
Группа промежуточного риска прогрессирования: при отсутствии факторов высокого риска прогрессирования после расширенной экстирпации матки III типа, но при наличии как минимум двух факторов из трех (инвазия опухоли более чем на 1/3 толщины миометрия шейки матки; инвазия опухолью лимфатических и кровеносных сосудов; большой размер первичной опухоли — 4 см и более) показано проведение адъювантной ЛТ.
Группа низкого риска прогрессирования: при отсутствии факторов высокого риска прогрессирования после расширенной экстирпации матки III типа, но при наличии одного фактора из трех (инвазия опухоли более чем на 1/3 толщины миометрия шейки матки; инвазия опухолью лимфатических и кровеносных сосудов; большой размер первичной опухоли — 4 см и более) адъювантное лечение не показано.
— С целью сохранения фертильности возможно выполнение расширенной трахелэктомии (III тип).
— При невозможности проведения хирургического лечения по медицинским показаниям или по выбору пациентки возможно проведение ЛТ/химиолучевой терапии по радикальной программе.
IB2 и IIА2 стадии (опухоль более 4 см)
Возможны несколько вариантов лечения.
— Расширенная экстирпация матки (операция III типа). При наличии метастазов в тазовых лимфатических узлах обязательно выполняется поясничная лимфаденэктомия. Адъювантное лечение проводится по тем же принципам, что и при IB1 и IIА1 стадиях РШМ.
— Химиолучевое лечение (ЛТ + еженедельное введение цисплатина в дозе 40 мг/м 2 на протяжении ЛТ). Проведение адъювантной гистерэктомии после химиолучевой терапии не рекомендовано.
— Неоадъювантная химиотерапия (ХТ) с последующей расширенной экстирпацией матки III типа. Адъювантное лечение проводится по тем же принципам, что и при IB1 и IIА1 стадиях РШМ (см. выше).
IIВ—IVA стадии
— Стандартом является проведение химиолучевого лечения (ЛТ + еженедельное введение цисплатина в дозе 40 мг/м 2 на протяжении ЛТ). Перед Л.Т. при необходимости выполняется КТ/МРТ брюшной полости и малого таза, ПЭТ/КТ для оценки распространенности процесса.
— Ряд авторов допускают возможность проведения хирургического вмешательства при РШМ IIB стадии. Это позволяет избежать поздних осложнений ЛТ и химиолучевого лечения у пациенток, не имеющих факторов неблагоприятного прогноза (метастазы в лимфатических узлах, поражение параметриев и др.). У молодых пациенток можно сохранить функцию яичников и эластичность влагалища. При наличии метастазов в лимфатических узлах у молодых пациенток, производится транспозиция яичников из зоны облучения. Кроме того, удаление первичной опухоли предотвращает возникновение радиорезистентности первичной опухоли. Недостатками выполнения операции на первом этапе является риск осложнений, связанный с комбинированным или комплексным лечением пациенток.
— В случае метастатического поражения тазовых и/или поясничных лимфатических узлов возможно выполнение экстраперитонеальной лимфаденэктомии с последующим проведением химиолучевой терапии по радикальной программе. При поражении поясничных лимфатических узлов облучение проводится расширенным полем.
— Химиолучевая терапия по радикальной программе должна проводиться не более 6—7 нед, в адекватных дозах (85—90 Гр на т. А, 55—60 Гр на т. В). Увеличение продолжительности химиолучевой терапии снижает выживаемость больных.
— Эффективность проведения неоадъювантной ХТ перед операцией изучается.
— Проведение неоадъювантной ХТ с последующей ЛТ не улучшает выживаемость по сравнению с проведением только ЛТ.
— У части больных без перехода опухоли на стенку таза альтернативой химиолучевому лечению может служить экзентерация малого таза (особенно при наличии свищей). Выполнять это вмешательство можно первичным больным РШМ IVA стадии и больным с центральным рецидивом, вовлекающим мочевой пузырь и/или прямую кишку, не переходящим на стенку таза, при отсутствии диссеминации по брюшине и отдаленных метастазов. Чаще выполняется тотальная экзентерация малого таза (включающая удаление мочевого пузыря, матки, влагалища и прямой кишки). В редких случаях операция может быть ограничена передней экзентерацией (удаление мочевого пузыря, матки, влагалища) или задней экзентерацией (удаление матки, влагалища и прямой кишки).
— При наличии триады симптомов (односторонний отек нижней конечности, ишиалгия и блок мочеточника), когда в большинстве случаев диагностируется переход опухоли на стенку таза, хирургическое лечение не показано. Таким больным возможно проведение паллиативного лечения.
IVВ стадия
Для пациенток с отдаленными метастазами вариантом лечения является системная платиносодержащая химиотерапия, возможна монотерапия цисплатином (см. системная химиотерапия).
Папиллярная аденокарцинома эндометрия (серозно-папиллярная аденокарцинома)
При РТМ опухоль имеет в основном экзофитную форму анатомического роста, реже эндофитную и смешанную. Преимущественно опухолевый процесс локализуется в области дна матки (47,5 %), но может поражать перешеек (27,6 %) или всю полость матки (24,9 %).
Согласно морфологической классификации (ВОЗ, 2002) выделяют следующие эпителиальные опухоли тела матки.
1. Эндометриоидная аденокарцинома (с плоскоклеточной метаплазией, папиллярная, секреторная, с реснитчатыми клетками).
2. Муцинозный рак.
3. Папиллярный серозный рак.
4. Светлоклеточный рак.
5. Смешанная аденокарцинома.
6. Плоскоклеточный рак.
7. Переходноклеточный рак.
8. Мелкоклеточный рак.
9. Недифференцированный рак.
Степень дифференцировки
1. Высокодифференцированный рак (G1) — солидное строение имеют не более 5% опухоли (участки плоскоклеточного строения и округлые скопления опухолевых клеток, напоминающие морулу, не учитываются).
2. Умереннодифференцированный рак (G2) — солидное строение имеют 6—50% опухоли.
3. Низкодифференцированный рак (G3) — солидное строение имеют более 50% опухоли.
При аденокарциноме с плоскоклеточной метаплазией степень дифференцировки определяется по железистому компоненту. При выраженном ядерном атипизме, не соответствующем тканевому, снижают степень дифференцировки на один пункт.
Приведенная классификация применима для любых аденокарцином эндометрия и муцинозного рака. Степень дифференцировки папиллярного серозного и светлоклеточного рака определяется в основном ядерным атипизмом. Большинство авторов предлагают считать любую такую опухоль низкодифференцированной.
Эндометриоидная аденокарцинома
Наблюдается в 80 % случаев РТМ. В 15–25 % аденокарцинома эндометрия имеет участки плоскоклеточной метаплазии. Ранее считалось, что если участки плоскоклеточной метаплазии носят доброкачественный характер, то опухоль следует называть аденоакантомой, а если злокачественный — то железисто-плоскоклеточным раком. Позже было показано, что состояние плоскоклеточного компонента не влияет на прогноз, поэтому в настоящее время используют один термин "аденокарцинома с плоскоклеточной метаплазией".
Муцинозный рак
Выявляют у 5–9 % больных РТМ. В большинстве случаев опухоль высокодифференцированная и не отличаются по течению от эндометриоидной аденокарциномы.
Папиллярный серозный рак
Составляет 3–4 % наблюдений РТМ. Морфологически опухоль сходна с папиллярным серозным раком яичников и маточных труб. Характерны раннее лимфогенное метастазирование, глубокая инвазия миометрия и диссеминация по брюшине. Прогноз неблагоприятный.
Светлоклеточный (мезонефроидный) рак
Светлоклеточный РТМ также относится к редким гистологическим формам и составляет менее 5 % наблюдений РТМ. Чаще наблюдается у пожилых больных, отличается чрезвычайно агрессивным течением и неблагоприятным прогнозом.
Смешанная аденокарцинома
При этой гистологической форме РТМ большую часть опухоли составляет эндометриоидная аденокарцинома или муцинозный рак и не менее 10 % опухоли представлено папиллярным серозным или светлоклеточным раком.
Плоскоклеточный рак
Плоскоклеточный РТМ встречается крайне редко (в литературе описано не более 70 случаев) и имеет неблагоприятный прогноз.
Переходноклеточный рак
При этой форме РТМ не менее 90 % опухолевых клеток напоминают клетки уротелия.
Недифференцированный рак
Недифференцированный РТМ встречается редко (6 %), чаще у пациенток пожилого возраста. Прогноз неблагоприятный.
Синхронный рак эндометрия и яичников
Большие проблемы возникают у клиницистов и морфологов в решении вопросов дифференциальной диагностики первичного РТМ с метастазами в яичники и синхронного рака эндометрия и яичников. По данным литературы, синхронный рак эндометрия и яичников наблюдается в 1,4–3,8 % наблюдений злокачественных опухолей женских половых органов. Прогноз при синхронном раке эндометрия и яичников чаще благоприятный. С целью дифференциальной диагностики проводят иммуногистохимическое исследование и проточную цитометрию. Важное значение имеют данные макро- и микроскопическое исследование операционного материала.
Аденокарцинома матки
Аденокарцинома матки – самая частая злокачественная опухоль эндометрия. На неё приходится 80% всех случаев онкологического заболевания. Основной метод лечения – хирургическая операция. После неё часто проводится облучение, химиотерапия, гормональная терапия. В клинике СОЮЗ проводятся не только открытые, но и малоинвазивные лапароскопические хирургические вмешательства для удаления злокачественной опухоли.
Причины аденокарциномы матки
Факторы риска аденокарциномы матки:
- высокий уровень эстрогенов;
- отсутствие родов в анамнезе;
- поздняя менопауза;
- прием тамоксифена;
- возраст после 55 лет.
Приблизительно 5% случаев заболевания связаны с наследственными синдромами. Большая их часть приходится на синдром Линча.
Симптомы аденокарциномы матки
Первые симптомы аденокарциномы матки:
- межменструальные кровотечения в репродуктивном возрасте;
- продолжение кровотечений в постменопаузе.
Кровотечения появляются у 90% женщин с аденокарциномой эндометрия. Но этот симптом обладает низкой специфичностью, так как аналогичные проявления возникают при многих других гинекологических патологиях. Интенсивность кровотечения имеет прямую корреляцию с риском онкологического заболевания. То есть, чем сильнее кровотечения, тем выше вероятность, что его причиной является злокачественная опухоль.
На поздних стадиях появляются другие симптомы:
- потеря веса;
- тазовые боли;
- слабость.
Стадии аденокарциномы матки
В большинстве случаев стадия аденокарцинома матки определяется только по результатам хирургического вмешательства, после интраоперационной ревизии и исследования удаленных тканей в лаборатории.
- Стадия 1 – Опухоль не выходит за пределы миометрия (мышечного слоя матки).
- Стадия 2 – Опухоль не выходит за пределы матки.
- Стадия 3 – Возможно поражение маточных труб, яичников, влагалища, околоматочной клетчатки, появление регионарных метастазов.
- Стадия 4 – Прорастание в мочевой пузырь, прямую кишку, отдаленные метастазы (включая располагающиеся в брюшной полости и паховые лимфоузлы).
Диагностика аденокарциномы матки
Для подтверждения диагноза требуется получение образцов тканей эндометрия. Для этого используется:
- аспирационная биопсия эндометрия;
- диагностическое выскабливание.
Для определения клинической стадии и планирования операции используются такие методы диагностики аденокарцинома матки:
- УЗИ органов брюшной полости и малого таза;
- МРТ малого таза с контрастом, если на УЗИ выявлены признаки поражения паренхиматозных органов;
- возможно также проведение КТ для лучшей визуализации лимфоузлов.
При подозрении на появление отдаленных метастазов аденокарциномы матки:
- рентген грудной клетки или КТ;
- ПЭТ или ПЭТ-КТ.
До операции обычно нельзя достоверно установить стадию онкологического процесса. Это связано с тем, что на момент хирургического вмешательства только 10% пораженных метастазами лимфоузлов увеличены в размерах.
Анализ крови на СА-125 не используется для ранней диагностики рака эндометрия. Но уровень этого онкомаркера определяют, чтобы оценить вероятность распространения опухоли за пределы половой системы.
Лечение аденокарциномы матки
При подтверждении аденокарциномы матки, лечение всегда хирургическое, независимо от стадии. Только при наличии абсолютных противопоказаний к операции проводят радикальную лучевую терапию. Иногда она позволяет добиться такого же результата, но вероятность успеха ниже.
Операция при аденокарциноме матки
Стандартная операция при аденокарциноме матки – удаление матки с придатками (яичниками и фаллопиевыми трубами). У женщин до 45 лет на 1 стадии заболевания возможно сохранение яичников (если нет генетических причин развития рака эндометрия).
Некоторым женщинам также требуется удаление тазовых лимфоузлов. Показаниями обычно является 2 стадия заболевания и выше. На 1 стадии лимфодиссекция выполняется при инвазии миометрия более чем наполовину или высокой степени злокачественности опухоли (G3).
После операции удаленный препарат и лимфоузлы исследуют для определения патоморфологической стадии онкологического заболевания. В лаборатории проверяют, какие лимфоузлы поражены метастазами, есть ли опухолевые эмболы, прорастание опухоли в миометрий, какая глубина инвазии, гистологический тип опухоли, степень её злокачественности, вовлечение соседних органов и т.д. Эта важнейшая информация позволяет врачу лучше спланировать дальнейшую терапевтическую тактику.
Даже на 4 стадии эффективное хирургическое лечение всё ещё возможно у некоторых женщин. Но кроме матки и придатков, лимфоузлов и окружающих матку тканей врачам также приходится полностью или частично удалять другие органы, вовлеченные в онкологический процесс.
Другие методы лечения аденокарциномы матки
После удаления матки аденокарцинома может рецидивировать без дополнительного лечения. Для снижения риска рецидива на 2 стадии и выше, а иногда и на 1 стадии, применяется лучевая терапия и химиотерапия. Лучевая терапия проводится не только дистанционная, но и внутриполостная (брахитерапия). У многих женщин дополнительно используется гормональная терапия.
Прогноз при аденокарциноме матки
Прогноз аденокарциномы матки зависит не только от стадии заболевания, но и от степени злокачественности опухоли (G1, G2 или G3). Обычно эта форма рака более благоприятная в плане прогноза, чем другие его варианты.
При обнаружении опухоли на стадии 1-2 большинство женщин могут быть вылечены с помощью операции. Даже на 3 стадии заболевания качественное лечение позволяет добиться пятилетней выживаемости пациентов на уровне 65-70%. Прогноз значительно хуже на 4 стадии аденокарциномы матки – пятилетняя выживаемость около 15%.
Куда обратиться при аденокарциноме матки
Для максимально щадящего и эффективного лечения аденокарциномы матки вы можете обратиться в клинику СОЮЗ. Наши преимущества:
- Точная диагностика обеспечивает раннее выявление рака и приблизительную оценку стадии заболевания ещё до операции.
- Раздельное диагностическое выскабливание матки проводится под контролем гистероскопии, что обеспечивает высокую безопасность этой процедуры.
- У молодых женщин на ранней стадии возможно лечение аденокарциномы эндометрия с помощью органосохраняющей операции.
- Точное определение группы риска рецидива рака – обеспечивает лучшее планирование лечения, часто позволяет избежать избыточного лечения после операции.
- Для удаления матки с придатками проводятся малоинвазивные лапароскопические хирургические вмешательства. После них пациенты восстанавливаются легче и быстрее.
- Адекватное удаление тазовых лимфоузлов у пациентов с начальной стадией аденокарциномы позволяет избежать послеоперационного облучения.
- Возможность выполнения даже самых сложных операций, включая экзентерацию малого таза для лечения 4 стадии рака без отдаленных метастазов.
Чтобы пройти лечение аденокарциномы матки в клинике СОЮЗ, запишитесь на прием к гинекологу или онкологу.
Читайте также:
