Патогенез инфаркта миокарда. Механизмы развития инфаркта миокарда
Добавил пользователь Morpheus Обновлено: 28.01.2026
Инфаркт миокарда – это наиболее тяжелая клиническая форма ишемической болезни сердца (ИБС).
Инфаркт миокарда характеризуется некрозом (омертвением) участка сердечной мышцы вследствие продолжительного нарушения кровообращения (ишемии) в миокарде. Чаще всего развивается в левом желудочке.
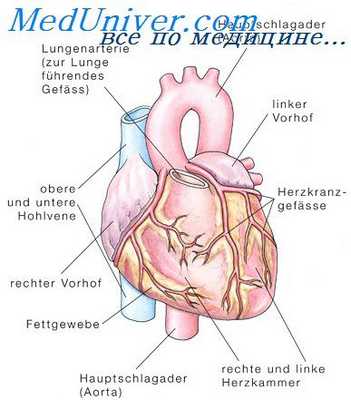
Сердце представляет собой мышечный мешок и играет роль насоса в организме, перегоняя кровь. Кислород к сердечной мышце доставляют крупные коронарные сосуды. При закупорке какого-либо сосуда тромбом, кровоснабжение миокарда прекращается, кровь не поступает, вследствие чего участок, лишенный кислорода, погибает.
В течение 30 минут сердечная мышца еще жизнеспособна, далее начинается процесс необратимых изменений.
В зависимости от размеров очага некроза различают крупноочаговый и мелкоочаговый инфаркт миокарда. Мелкоочаговый инфаркт характеризуется отсутствием патологического зубца Q (характерный диагностический критерий, определяемый на электрокардиограмме).
По стадиям развития выделяют следующие периоды:
- развивающийся – 0-6 часов;
- острый – от 6 часов до 7 суток;
- заживающий или рубцующийся - от 7 до 28 дней;
- заживший - начиная с 29 суток.
Описанное деление очень относительно и имеет ценность скорее для описательных и исследовательских целей.
По течению выделяют:
- классический вариант - заболевание с типичными симптомами (боль, ее характер и локализация)
- атипичное - другая локализация боли или проявления инфаркта;
- астматический вариант (клиника сердечной астмы или отека легких, сопровождающиеся тяжелой одышкой),
- абдоминальный (боли в верхней части живота, тошнота, рвота, диарея),
- аритмический (проявляется различными видами нарушений ритма сердца),
- цереброваскулярный (клиника, сходная с нарушением мозгового кровообращения),
- безболевая форма (симптомы либо отсутствуют, либо очень незначительны).
Также инфаркт может быть:
- рецидивирующий – появление новых очагов некроза до 28 дней
- повторный инфаркт миокарда – появление новых очагов некроза через 28 дней от предыдущего инфаркта.
Основной причиной развития инфаркта миокарда является атеросклероз коронарных артерий. Также возможен инфаркт при нарушении свертываемости крови – коагулопатиях. Кроме того, к заболеванию может привести спазм коронарных сосудов.
Предрасполагающие факторы инфаркта миокарда:
- возраст (мужчины старше 45 лет, женщины старше 55 лет);
- пол (у мужчин инфаркт миокарда встречается в 3-5 раз чаще, чем у женщин);
- малоподвижный образ жизни (гиподинамия);
- наследственность;
- злоупотребление алкоголем;
- курение, в том числе и пассивное; ; ; ;
- перенесенный ранее инфаркт миокарда;
- психическая лабильность и неустойчивость к стрессам;
- неправильное питание (повышенное потребление животных жиров).
Главным признаком заболевания является интенсивная боль за грудиной (ангинозная). Боль, как правило, возникает в ночные или утренние часы.
Боль длится 20 и более минут, а купируется только через несколько часов наркотическими препаратами.
Важно! Нитраты (нитроглицерин) при инфаркте миокарда неэффективны.
Болевые ощущения возникают внезапно и носят жгучий характер («кинжальная» боль или «кол в груди»). В других случаях болевой синдром похож на приступ стенокардии – боль давящая, как будто схватило обручем или сдавило в тиски.
Боль иррадиирует в левую руку, вызывая покалывание и онемение в запястье и пальцах. Возможна иррадиация в область шеи, плечо, нижнюю челюсть, межлопаточное пространство.
Еще одной характеристикой боли является ее волнообразность, она то уменьшается, то усиливается.
На фоне болевого приступа отмечается значительная бледность кожных покровов, обильный холодный пот. Больной ощущает чувство нехватки воздуха, учащается пульс. Кроме того, появляется страх смерти.
В некоторых случаях единственным признаком инфаркта миокарда является внезапная остановка сердца.
Симптомы атипичных форм инфаркта миокарда
Описанная выше симптоматика встречается не во всех случаях инфаркта миокарда. Иногда наблюдается атипичное течение заболевания:
Абдоминальная форма. Протекает по типу панкреатита и характеризуется болями в эпигастральной области, икотой, метеоризмом, тошнотой и рвотой. При пальпации живота определяется его безболезненность, признаки раздражения брюшины отсутствуют.
Астматическая форма. Напоминает приступ бронхиальной астмы, появляется и усиливается одышка, возникает сухой, непродуктивный кашель.
Аритмическая форма ставится, когда преобладают различные виды нарушений ритма сердца.
Безболевая (малосимптомная) форма. Встречается редко, чаще у пожилых людей. Безболевая форма характерна для больных сахарным диабетом вследствие нарушения чувствительности и проявляется слабостью, нарушением сна, подавленным настроением и чувством дискомфорта за грудиной.
Церебральная форма. Инфаркт миокарда с церебральной формой встречается у больных с отягощенным неврологическим анамнезом и возникает на фоне сниженного или повышенного артериального давления. Проявляется головной болью, головокружением, тошнотой, рвотой, нарушением зрения, помрачнением сознания, а людей старческого возраста вследствие нарушения мозгового кровотока возможно развитие психозов.
В диагностике инфаркта миокарда огромное значение имеет симптоматика и сбор истории заболевания, но при атипичных формах на первый план выходят инструментальные и лабораторные методы:
- Общий анализ крови. В крови определяется лейкоцитоз, повышенное СОЭ;
- Определение в крови тропонина T и I, МВ-КФК;
- Электрокардиограмма (ЭКГ) в 12 отведениях. Для инфаркта миокарда классическими изменениями на ЭКГ являются патологический зубец Q и подъем сегмента ST как минимум в двух последовательных отведениях. Идеальным вариантом будет сравнение ЭКГ во время приступа с ЭКГ, которые были сделаны ранее, при отсутствии какой-либо клинической картины. К сожалению, некоторые нарушения ритма сердца не позволяет точно диагностировать инфаркт по пленке. Поэтому важны и другие методы обследования.
- Эхокардиография (ЭхоКГ). Помогает оценить сократительную способность миокарда и выявить зону, где сокращения слабые, но ЭхоКГ также не может дать точные и однозначные данные о наличии инфаркта, поскольку нарушения сократимости могут быть не только при некрозе ткани сердца , но и при недостаточности кровоснабжения (ишемии).
- Коронарная ангиография позволяет выявить стенозированную или закупоренную артерию и при необходимости провести ее стентирование.
- Магнитно-резонансная томография (МРТ) четко выявляет очаг пораженного миокарда, помогает дифференцировать ишемическую и воспалительную природу патологии.
При подозрении на инфаркт миокарда больному необходимо
- прекратить какую-либо физическую нагрузку,
- обеспечить доступ свежего воздуха (открыть окно),
- облегчить дыхание (расстегнуть воротник),
- помочь ему принять удобное положение (полусидя или лежа с приподнятой головой),
- принять таблетку нитроглицерина под язык или 1 дозу нитроспрея, если в течение 5 минут болевой синдром не уменьшился, а нитроглицерин переносится хорошо, необходимо принять таблетку еще раз. Если боль за грудиной или дискомфорт не исчезают в течение 5 минут после повторного приема нитроглицерина и если обычно таблетки действуют быстрее, необходимо немедленно вызвать бригаду СМП.
- также разжевать 250 мг аспирина, то есть ½ таблетки (в таком виде лекарство быстрее попадет в кровь) и при наличии клопидогрела - 300 мг .
- при отсутствии нитросодержащих препаратов можно использовать валидол, валокордин или валосердин 40-50 капель.
- обязательно измерить артериальное давление
В случае остановки сердца и дыхания немедленно приступить к непрямому массажу сердца и искусственному дыханию (дыхание «рот в рот»). Было доказано, что эффективность сердечно-легочной реанимации больше зависит от поддержания кровообращения, чем от дыхания, поэтому начинать необходимо именно с надавливаний на грудину частотой примерно 100 в минуту. Если рядом с больным находится 1 человек рекомендуется проводить реанимацию в соотношении 30 надавливаний к 2 вдохам. Если 2 человека, то 15 к 1.
Одни и те же симптомы могут быть признаками разных заболеваний, а болезнь может протекать не по учебнику. Не пытайтесь лечиться сами — посоветуйтесь с врачом.
Лечение больного с инфарктом миокарда осуществляется реаниматологом в палате интенсивной терапии или кардиологом в специализированном отделении (инфарктном). Терапия при данном заболевании преследует следующие цели:
- купировать боль;
- ограничить распространение некроза;
- восстановить коронарный кровоток;
- предупредить ранние осложнения.
Перечисленные цели достигаются путем сложной, но четкой организации работы СМП и сосудистого центра. В первую очередь необходимо восстановить кровоток по коронарным артериям. Для этого в зависимости от временного интервала используются:
- Чрескожное вмешательство - балонная ангиопластика и стентирование (восстановление просвета сосуда с помощью раздувания специального баллона и постановка каркаса в этом месте);
- Операция коронарного шунтирования (восстановление тока крови с использованием протеза или других артерий для обхода окклюзированного участка сосуда);
- Тромболитическая терапия - внутривенное введение препаратов для растворения тромбов.
Хирургические методы используются только после проведения коронарной ангиографии, которую необходимо сделать абсолютно всем пациентам с подозрением на инфаркт миокарда.
Тромболитики выбирают при невозможности проведения хирургического лечения в ближайшие 90 минут.
В дополнение к терапии, направленной на восстановление кровотока по пораженному сосуду, для лечения также используются следующие группы препаратов:
- Наркотические анальгетики (морфин, промедол) для обезболивания и успокоения больного,
- Ингаляции кислорода,
- Антитромботические препараты (клопидогрел+аспирин) и антикоагулянты (внутривенные гепарин, фраксипарин в острую фазу процесса или пероральные Прадакса, Брилинта в более поздний период заболевания)для предотвращения повторного тромбоза коронарных артерий,
- Ингибиторы АПФ (каптоприл, зофеноприл) или сартаны (валсартан) для улучшения прогноза заболевания,
- Бета адреноблокаторы (метопролол, пропранолол, атенолол) для урежения ЧСС и снижения вероятности повторного или рецидивирующего инфаркта и появления жизнеугрожающих аритмий,
- Статины (аторвастатин, симвастатин) в высоких дозах.
Больному создается полный физический и психический покой. Постельный режим назначается в зависимотси от тяжести состояния пациента, в основном он длится 24 часа и не больше, что обусловлено профилактикой тромбозов.
Лечение в стационаре в среднем длится 21-28 дней, после чего больной проходит реабилитацию амбулаторно. Пациенту, перенесшему инфаркт миокарда, рекомендуют диету с ограничением жиров и углеводов, но обогащенную свежими овощами и фруктами, назначается прием аспирина (пожизненно), статинов, антикоагулянтов и других перпаратов, улучшающих прогноз.
Больным с избыточным весом необходимо его сбросить. Также показаны регулярные умеренной и низкой интенсивности физические нагрузки в течение минимум 30 минут 5 раз в неделю (ходьба и лечебная физкультура).
Прогноз при инфаркте миокарда зависит от того, как быстро начато лечение, размеров некроза, локализации очага, тяжести течения заболевания.
Осложнения инфаркта миокарда делятся на ранние и поздние. Ранние осложнения развиваются в острый период заболевания и обуславливают высокую летальность.
Патогенез инфаркта миокарда. Механизмы развития инфаркта миокарда
Рассмотрим последовательно три составные части патогенеза инфаркта миокарда, а также связь между патогенезом и клиникой. Наиболее характерное проявление атеросклероза — это фиброзная атеросклеротическая бляшка, т. е. фиброатерома. Её "внешние черты" определяются двумя факторами (М. J. Davies, N. Woolf, 1991):
а) соотношением липидного и соединительнотканного компонентов;
б) расположением развивающейся бляшки в просвете сосуда.
Не существует какого-то типового "чертежа" атеросклеротической бляшки. От строения бляшки зависит клиническое течение заболевания (развитие осложнений). Именно разрыв таких поражений часто приводит у сорокалетних мужчин к тромбозу коронарной артерии с дальнейшим развитием обширного инфаркта (аневризмы сердца) или к внезапной смерти.
Как отмечают М. J. Davies (1990); R. Т. Lee, P. Libby (1997), два варианта нарушения целостности бляшки могут приводить к тромбозу венечной артерии:
- разрыв бляшки;
- деэндотелизация (поверхностная эрозия) бляшки.
Разрыв атеросклеротической бляшки с полным или частичным тромбозом коронарной артерии — наиболее частая причина развития коронарных катастроф: нестабильной стенокардии, инфаркта миокарда, внезапной смерти (V. Fuster et al., 1992). Образование необтурирующих или кратковременно закупоривающих коронарную артерию тромбов обусловливает такие клинические проявления ИБС, как нестабильная стенокардия (с болями в состоянии покоя) и мелкоочаговый инфаркт миокарда. Обтурирующий (на протяжении длительного времени) тромбоз — патогенетическая основа крупноочагового (трансмурального) инфаркта миокарда (R. L. Ridolfi, G. M. Hutchins, 1977). Формирование вследствие разрыва бляшки как обтурирующего, так и не обтурирующего тромба может приводить к внезапной смерти. Кроме того, выброс в кровоток атероматозного содержимого расположенной в аорте бляшки может вызвать эмболию артерий мозга и других органов.
Это объясняется хорошим развитием коллатеральных сосудов при длительно существующих стенозирующих бляшках (в ответ на часто возникающую ишемию миокарда — приступы стенокардии).
Чем же отличаются на микроскопическом уровне "уязвимые" бляшки, которые, разорвавшись, могут вызвать острую коронарную недостаточность, от стабильных? "Уязвимые" бляшки:
- "эксцентричны", т. е. занимают лишь часть окружности артерии; - богаты липидами (липидное ядро занимает > 50 % их общего объёма);
- имеют тонкую соединительнотканную оболочку с малым содержанием гладкомышечных клеток (ГМК) и большим количеством макрофагов и Т-лимфоцитов, т. е. клеток воспаления (М. J. Davies, А. С. Thomas, 1985; М. J. Davies, 1990; М. J. Davies et al., 1993; P. Libby, 1995).
Уточним, что клетки воспаления (макрофаги, Т-лимфоциты), концентрация которых повышена в нестабильной бляшке, продуцируют различные цитокины, в частности интерлейкин 6 (interleukin 6, сокращённо IL6), которые могут активировать гладкомышечные клетки (S. Kinlay, P. Ganz, 1997). Программированная гибель (апоптоз) гладкомышечных клеток в оболочке бляшки, причины развития которой сейчас только изучаются, также может повышать вероятность разрыва бляшки (R. Т. Lee, P. Libby, 1997).
Упомянутые выше факторы — это внутренние причины, делающие бляшку нестабильной, склонной к разрыву.
Причины инфаркта миокарда. Этиология инфаркта миокарда.
Этиология инфаркта миокарда — полифакторная (в большинстве случаев действует не один фактор, а их комбинация). ФР ИБС (их более 20): АГ, гиперлипидемия, курение, физическая детренированность, избыточный вес, СД (у пожилых диабетиков на фоне ИМ в 4 раза чаще появляются аритмии и в 2 раза чаще — ОСН и КШ), выраженный стресс. В настоящее время можно так перечислить обстоятельства с максимальными коэффициентами риска ИБС (в порядке убывания): наличие близких родственников, у которых ИБС возникала до 55 лет, гиперхолестеринемия более 7 ммоль/л, курение более 0,5 пачки в сутки, гиподинамия, СД.
Главный фактор инфаркта миокарда (в 95%) — неожиданный тромбоз коронарной артерии в области атеросклеротической бляшки с закупоркой артерии или ее субтотальным стенозом. Уже в 50 лет атеросклероз коронарных артерий отмечается у половины людей. Обычно тромб возникает на поврежденном эндотелии в месте разрыва волокнистой «шапки» бляшки (патофизиологический субстрат ОКС). В этой зоне также накапливаются медиаторы (тромбоксан Аг, серотонин, АДФ, фактор активации тромбоцитов, тромбин, тканевый фактор и др.), которые стимулируют дальнейшую агрегацию тромбоцитов, эритроцитов и механическое сужение коронарной артерии. Этот процесс имеет динамический характер и может циклично приобретать разные формы (частичная или полная окклюзия коронарной артерии или ее реперфузия). Если нет достаточного коллатерального кровообращения, то тромб закрывает просвет артерии и вызывает развитие ИМ с повышением сегмента ST. Тромб имеет размер 1 см в длину и состоит из тромбоцитов, фибрина, эритроцитов и лейкоцитов.
На вскрытии тромб часто не находят вследствие его посмертного лизиса. После окклюзии коронарной артерии гибель клеток миокарда начинается не сразу, а через 20 мин (это — прелетальная фаза). Запаса кислорода в миокарде хватает только на 5 сокращений, потом сердце «голодает» с развитием «ишемического каскада» — последовательности событий после коронарной окклюзии. Нарушается диастолическое расслабление волокон миокарда, что приводит в последующем к уменьшению систолической сократимости сердца, появлению на ЭКГ признаков ишемии и клиническим проявлениям. При трансмуральном поражении миокарда (всей стенки) этот процесс завершается через 3 ч. Но гистологически кардиомиоцит некротизируется только через 12—24 ч после остановки коронарного кровотока. Более редкие причины ИМ:

• длительный спазм коронарной артерии (в 5%), особенно у молодых, на фоне стенокардии Принцметала. Ангиографически патологию в коронарных артериях могут и не выявить. Спазм коронарной артерии, обусловленный дисфункцией эндотелия, может повреждать целостность эндотелия атероскле-ротической бляшки, а возникает, как правило, на фоне длительных отрицательных эмоций, умственного или физического перенапряжения, избыточной алкогольной или никотиновой интоксикации. При наличии подобных факторов часто возникает «адреналовый некроз» миокарда вследствие большого выброса катехоламинов. Такой вид ИМ чаще возникает у молодых «интравертов» (которые «переваривают все в себе»). Обычно у этих больных нет выраженной Ст или указаний на нее в анамнезе, но есть воздействие коронарных ФР;
• поражения коронарных артерий (коронариты) при узелковом панартериите (УГЛА), СКВ, болезни Такаясу, ревматоидном артрите, острой ревматической лихорадке (2-7% от всех ИМ), т.е. ИМ может быть синдромом, осложнением других заболеваний;
• эмболия коронарных сосудов при инфекционном эндокардите, тромбоэмболии из левых камер сердца на фоне имеющегося мурального тромбоза ЛЖ или ЛПр, врожденных аномалиях коронарных артерий;
• муральное утолщение коронарных артерий на фоне метаболических или пролиферативных заболеваний интимы (гомоцистеинурия, болезнь Фабри, амилоидоз, ювенильный склероз интимы, коронарный фиброз, обусловленный рентгеновским облучением грудной клетки);
• миокардиальный дисбаланс кислорода — несоответствие притока крови по коронарным артериям к потреблению кислорода миокардом (например, при аортальных пороках, тиреотоксикозе, длительной гипотензии). Так, у ряда больных с достаточно выраженным атеросклеротическим поражением коронарных артерий, но без разрыва бляшки, ИМ возникает при состояниях, когда существенно снижена доставка кислорода к миокарду. На ЭКГ у этих больных обычно определяется глубокий отрицательный зубец Т и депрессия сегмента ST;
• гематологические нарушения — полицитемия, тромбоцитоз, выраженная гиперкоагуляция и ДВС-синдром.
Патогенез инфаркта миокарда. Механизм развития инфаркта миокарда.
Как правило, без атеросклероза коронарных артерий нет и инфаркта миокарда. Адекватность коронарного кровообращения метаболическим запросам миокарда определяется тремя основными факторами: величиной коронарного кровотока, составом артериальной крови и потребностью миокарда в кислороде. Для образования тромба в коронарной артерии обычно необходимы тоже три фактора: патологические изменения в ее интиме вследствие атеросклероза, активация в системе тромбообразования (рост коагуляции, агрегации тромбоцитов и эритроцитов, наличие сладж-феномена в МЦК, снижение фибринолиза) и пусковой фактор, способствующий взаимодействию двух первых (например, спазм артерии).
Атеросклероз коронарных артерий прогрессирует с годами и суживает их просвет, порождая атеросклеротические бляшки. Затем вследствие действия факторов, способствующих разрыву (рост напряжения по всей окружности бляшки, ухудшение реологических свойств крови, большое количество воспалительных клеток, инфекция), нарушается целостность бляшки: обнажается ее липидное ядро, эрозируется эндотелий и обнажаются коллагеновые волокна. К дефекту прилипают активированные тромбоциты и эритроциты, чем запускается каскад свертывания и формирование тромбоцитарных пробок с последующим наслоением фибрина Возникает резкое сужение просвета коронарной артерии, вплоть до ее полной окклюзии
Обычно от формирования тромбоцитарного тромба до тромботической окклюзии коронарной артерии проходит 2—6 дней, что клинически соответствует периоду нестабильной стенокардии.
Хроническая тотальная закупорка коронарной артерии не всегда связана с последующим развитием ИМ От коллатерального кровотока, как и от других факторов (например, от уровня метаболизма миокарда, размеров и локализации зоны его поражения, снабжавшейся закупоренной артерией, скорости развития коронарной обструкции), зависит жизнеспособность клеток миокарда Коллатеральное кровообращение обычно хорошо развито у больных с тяжелой Ст (сужением просвета более чем на 75% в одной или нескольких коронарных артериях), выраженной гипоксией (тяжелые анемия, ХОБЛ и врожденные «синие» пороки) и ГЛЖ Наличие тяжелого стеноза коронарной артерии (более 90%) с регулярно повторяющимися периодами ее полной окклюзии позволяет существенно ускорить развитие коллатералей.
Частота развития коронарных коллатералей через 1—2 недели после инфаркта миокарда варьирует, достигая 75-100% у больных с персистирующей окклюзией коронарных артерий и только 20—40% у пациентов с субтотальной окклюзией
В случаях 1, 2, отмеченных на рисунке, инфаркт миокарда обычно не развивается вследствие доставки крови из соседней коронарной или другой артерии, а формируется в случае 3 (когда спазмирована дополнительно питающая миокард артерия) или 4 (ее просто нет) На фоне существенного сужения коронарной артерии разрыв атеросклеротической бляшки, приводящий к ИМ, происходит под действием триггеров, например ФН или стресса. Стресс (эмоциональный или физический) стимулирует выброс катехоламинов (они оказывают гистотоксический эффект) и повышает потребление кислорода миокардом. Сердце — это важная рефлексогенная зона. Негативный психоэмоциональный стресс (смерть близких, их тяжелая болезнь, выяснение отношений с начальством и др ) часто является «спичкой, дающей факел» - ИМ
Инфаркт миокарда может спровоцировать и чрезмерная ФН (например, марафон, статический подъем больших тяжестей) даже у молодых лиц.
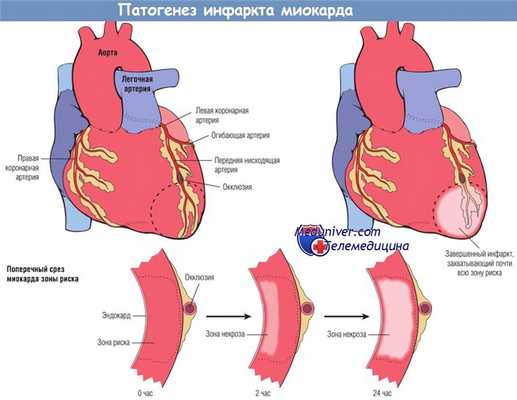
Развитие инфаркта миокарда после острой окклюзии коронарной артерии.
Некроз начинается в небольшой области миокарда под эндокардом, в центре ишемизированной зоны.
Область, перфузируемая обтурированной артерией, является зоной риска поражения миокарда (область внутри пунктирной линии).
Обратите внимание, что очень узкая область миокарда, находящаяся непосредственно под эндокардом, не подвергается некрозу, т.к. в нее поступает кислород из крови путем диффузии непосредственно из полости желудочка.
Микроинфаркт ( Мелкоочаговый инфаркт миокарда )
Микроинфаркт — это патологическое состояние, характеризующееся развитием в сердечной мышце небольших очагов некроза вследствие существенного уменьшения объема регионального коронарного кровотока. Пациенты жалуются на боль в области сердца, слабость, головокружение, одышку и лихорадку. Состояние может осложниться кардиальной недостаточностью, нарушениями ритма, тромбоэмболией или перикардитом. Клиническая картина часто отсутствует или выражена минимально. Диагностика включает в себя лабораторные методы, ЭКГ, ЭхоКГ и коронароангиографию. Лечение комплексное, осуществляются консервативные мероприятия, по показаниям применяются инвазивные методы.
МКБ-10
Общие сведения
Микроинфаркт в клинической практике обычно называют «мелкоочаговый инфаркт миокарда» или «не Q-инфаркт». Частота встречаемости патологии за последнее время значительно выросла и составляет до 50-70% от всех некротических повреждений сердечной мышцы. Это повышение объясняется улучшением качества диагностики, особенно вследствие повсеместного распространения измерения уровня биохимических маркеров распада кардиомиоцитов, а также повышением общей осведомленности населения о ранних тревожных симптомах. Перечисленные факторы позволяют своевременно диагностировать патологию, начать соответствующую терапию при малой площади поражения. Средний возраст пациентов — 65 лет, доля мужчин составляет 60%.
Причины микроинфаркта
Обычно этиология мелко- и крупноочаговых повреждений сходна. В отличие от последних, при некрозе без образования зубца Q происходит лишь частичная окклюзия просвета сосуда либо закупорка мелкой артерии с достаточной компенсацией в виде активации коллатерального кровотока. Одни и те же патологические процессы могут привести к поражениям различной площади. Велика роль предрасполагающих факторов: наличие у пациента вредных привычек и хронического стресса, гипертония, неполноценное питание, погрешности в диете, алиментарное ожирение, сопровождаемое гиперхолестеринемией, гиподинамия. Непосредственными причинами мелкоочаговых инфарктов в современной кардиологии считаются:
- Атеросклеротическое поражение коронарных сосудов. Атеросклероз является основной причиной микроинфарктов, на долю которой приходится до 97% наблюдений. Нарушения обмена белка и липидов ведут к увеличению уровня холестерина, способного откладываться на стенках сосудов, особенно мелких коронарных. Окклюзия артерии провоцирует существенное ограничение притока крови, уменьшение снабжения тканей кислородом и питательными веществами. При критически низких значениях наступает гибель клеток, формируется очаг некроза.
- Осложнения других заболеваний. Микроинфаркт вследствие других патологий развивается у 1-3% больных, носит синдромальный характер. К омертвлению миокарда чаще всего приводят системные нозологии (васкулиты, болезнь Такаясу, системная красная волчанка), нарушения метаболизма с поражением интимы сосудов (амилоидоз, мукополисахаридоз), эмболии коронарных артерий на фоне инфекционных процессов, дефектов свертывающей или клапанной систем.
Патогенез
Как некроз сердечной мышцы, микроинфаркт, прежде всего, связан с нарушением коронарного кровообращения вследствие атеротромбоза. Он начинается с повреждения холестериновой бляшки, которое может быть вызвано, например, резким скачком артериального давления. Развитие местной воспалительной реакции потенцирует привлечение лейкоцитов в зону поражения. Они, в свою очередь, начинают вырабатывать специфические биологически активные вещества — медиаторы, обладающие свойством активировать свертывающую и угнетать противосвертывающую систему крови.
При повреждении интимы сосуда обнажаются коллагеновые волокна, что стимулирует переход тромбоцитов в активную форму. В результате адгезии и агрегации клетки оседают на стенке артерии с образованием тромба. Обычно этот процесс сопровождается спазмом гладкой мускулатуры сосуда. Возникает окклюзия просвета с существенным ухудшением кровоснабжения миокарда. Однако при микроинфаркте ишемия не достигает критических значений, некроз имеет небольшую площадь, не является трансмуральным и не затрагивает проводящую систему сердца.
Классификация
Понятие микроинфаркт входит в общую номенклатуру инфаркта сердечной мышцы, является его отдельной разновидностью. Ему соответствует характеристика «мелкоочаговый», однако при морфологическом исследовании размер некроза без образования патологического Q-зубца может быть сопоставимым с теми случаями, когда этот элемент ЭКГ наблюдался. Поэтому более важным признаком является наличие либо отсутствие нарушений нормального движения сигнала по проводящей системе сердца. В настоящее время используется классификация патологии, в основе которой лежат причины и механизмы ее возникновения. Выделяют пять типов микроинфаркта:
- Первый тип. Спонтанный, связанный с ишемией на фоне нарушения нормальной циркуляции крови по коронарным сосудам малого диаметра. Преимущественной причиной является образование атеросклеротической бляшки с дальнейшими процессами ее деградации.
- Второй тип. Инфаркт, связанный с вторичными причинами ишемии миокарда. Провоцирующими факторами становятся повышение потребности кардиомиоцитов в кислороде, коронароспазм, анемия, аритмия, чрезмерно низкое или высокое артериальное давление.
- Третий тип. Внезапная сердечная смерть с подтвержденными признаками дефицита кровообращения в кардиальной мышце. Часто сочетается с блокадой левой ножки пучка Гиса.
- Четвертый тип. Микроинфаркт развивается после проведения чрескожного коронарного вмешательства, причина - тромбоз коронарного стента.
- Пятый тип. Некроз миокарда является последствием аортокоронарного шунтирования.
Симптомы микроинфаркта
Заболевание имеет слабовыраженные клинические проявления вплоть до их полного отсутствия. Возможна ситуация, когда пациент узнает о том, что перенес микроинфаркт, только на ежегодном плановом осмотре. Симптомы крайне неспецифичны, патология иногда протекает под маской обычного ОРВИ. Больной ощущает слабость, непродолжительную субфебрильную лихорадку, головокружение, одышку и боль за грудиной. Приступ продолжается от 30 минут до 2 часов. При улучшении состояния пациент, как правило, не обращается за медицинской помощью, болезнь остается нераспознанной.
При атипичном течении процесса, характерном для молодых людей, формируются особые клинические формы с существенным преобладанием тех или иных явлений. Например, при астматическом варианте микроинфаркта затруднено дыхание, невозможен полный вдох и выдох; при церебральном — часто возникают синкопальные состояния. При поражении участков миокарда, расположенных близко к диафрагме, к клинике микроинфаркта добавляются абдоминальные боли, тошнота и рвота.
Возможно появление дополнительных признаков, связанных с общими нарушениями деятельности кровеносной системы: похолодание, отечность конечностей, частые головные боли, повышенное потоотделение, редкие колющие боли в кардиальной области, посинение носогубного треугольника. Пожилые люди и пациенты, страдающие сахарным диабетом, из-за особенностей физиологии и патофизиологии имеют более высокий болевой порог. У этих категорий больных микроинфаркт практически всегда протекает бессимптомно.
Осложнения
Чаще всего после перенесенной патологии наблюдается формирование кардиальной недостаточности с застойными явлениями по обоим кругам кровообращения вплоть до развития сердечной астмы. При распространении повреждения на основные пути проводящей системы могут наблюдаться различные по характеру нарушения ритма и проводимости. К другим осложнениям относят тромбоэмболии, перикардиты и повторные инфаркты.
Диагностика
Главными задачами врача-кардиолога на этапе обследования пациента являются установление того факта, что предъявляемые жалобы развиваются именно вследствие ишемических процессов в миокарде, оценка риска развития осложнений и неблагоприятных исходов. При физикальном обследовании микроинфаркт часто никак себя не проявляет либо выявляются только неспецифические признаки, поэтому на первое место выходят дополнительные методы диагностики. К ним относятся:
- Электрокардиография. Всем больным с подозрением на инфаркт миокарда в первую очередь проводится ЭКГ в 12 отведениях. Признаками нарушения нормального кровоснабжения сердца считают депрессию или элевацию сегмента ST, инверсию и увеличение амплитуды зубца Т, появление ранее недиагностированных неполных блокад ножек пучка Гиса. Нормальная исходная запись не исключает наличие некроза, но позволяет отнести пациента к группе низкого риска.
- Лабораторные исследования. Производится определение уровня маркеров гибели кардиомиоцитов — сердечных тропонинов (I или Т), КФК и МВ-КФК. Превышение допустимых пределов в совокупности с наличием ангинозного приступа является достаточным основанием для постановки диагноза. При незначительной площади повреждения маркеры могут быть в норме, поэтому дополнительно определяется концентрация медиаторов воспаления — С-реактивного белка, интерлейкинов 1 и 6, миелопероксидазы.
- Эхокардиография. Особенно значимый метод исследования при микроинфарктах без существенных признаков ишемии на ЭКГ. С помощью УЗИ можно визуализировать участки миокарда с нарушением местной сократимости. В пользу повреждения сердечной мышцы говорит сниженная систолическая функция желудочков. Используя ЭхоКГ, можно выявить сопутствующую патологию, провести дифференциальную диагностику с пороками сердца и аневризмой аорты.
- Коронароангиография. Золотой стандарт диагностики микроинфаркта, назначается как для подтверждения диагноза, так и для определения дальнейшей тактики терапии. В ходе коронарографии оценивается состояние коронарных сосудов, наличие и степень сужения их просвета, присутствие тромбов в кровотоке. Рентгенологическая методика также используется при решении вопроса о необходимости инвазивного вмешательства.
Дифференциальная диагностика состояния может вызывать затруднения, особенно при отсутствии специфических методов исследования и стертой клинической картине. Чаще всего различение проводится с другими сердечно-сосудистыми заболеваниями (расслаивающаяся аневризма аорты, тромбоэмболия легочной артерии, миокардит) и плевритом. При атипичных формах с наличием абдоминальных симптомов важно дифференцировать некроз кардиальной мышцы от язвенной болезни желудка, кишечной колики, холецистита и панкреатита.
Лечение микроинфаркта
Принципы лечения мелкоочаговых процессов в целом сходны с таковыми при более обширных инфарктах миокарда. Главными целями являются восстановление или максимально возможное улучшение коронарного кровотока, улучшение качества жизни пациента и профилактика осложнений. При любом обоснованном подозрении на некроз кардиомиоцитов необходима госпитализация, строгий постельный режим, ингаляции кислорода и постоянный ЭКГ-контроль. Варианты возможной терапии:
- Медикаментозное лечение. Основным направлением в рамках консервативного воздействия является применение антитромботических препаратов (аспирин, клопидогрел, тиклопидин), блокаторов гликопротеиновых рецепторов тромбоцитов и антикоагулянтов (гепарин). Эти средства помогают улучшить прогноз, предупредить расширение зоны некроза. Для снятия ангинозного приступа назначаются нитраты, бета-адреноблокаторы и наркотические анальгетики. При дисфункции левого желудочка и артериальной гипертензии используются ингибиторы АПФ, статины для коррекции уровня холестерина, липопротеинов низкой и очень низкой плотности.
- Инвазивные методы. При существенной окклюзии венечного сосуда, высоком риске осложнений, неэффективности медикаментозного лечения показано хирургическое вмешательство. Возможно проведение транслюминальной баллонной коронарной ангиопластики со стентированием. Методика помогает восстановить объем кровотока, однако процедура чревата повреждением липидной бляшки. В перечень возможных манипуляций входит коронарное шунтирование, особенно при поражении ветвей левой коронарной артерии.
После выписки больной должен придерживаться назначаемой ему комплексной терапии, направленной на профилактику прогрессирования коронарного атеросклероза и ишемических явлений. Используются дезагреганты, ингибиторы АПФ и гиполипидемические средства, при необходимости – антиангинальные препараты. Из-за приема достаточно больших доз медикаментов, угнетающих активность тромбоцитов, осуществляется профилактика геморрагических осложнений.
Прогноз и профилактика
При своевременном оказании необходимого объема медицинской помощи прогноз благоприятный. Частота развития серьезных осложнений у пациентов при госпитализации по поводу микроинфаркта составляет не более 5%, после выписки из больницы — 15%. Профилактика заключается в регулярном прохождении осмотров, посещении кардиолога со снятием ЭКГ, особенно лицами старшего возраста. Важными моментами являются отказ от курения, рациональное питание с уменьшенным количеством насыщенных жиров, достаточный уровень физической активности, контроль артериального давления и уровня липидов крови.
1. Инфаркт миокарда: патофизиологические механизмы развития, диагностическая стратегия и тактика лечения/ под ред. Снежинского В.А. – 2015.
Читайте также:
