Патогенез респираторного дистресс-синдрома.
Добавил пользователь Alex Обновлено: 29.01.2026
Респираторный дистресс-синдром обусловлен недостаточностью легочного сурфактанта в легких новорожденных, чаще всего тех, кто родился на сроке 37 недель беременности. Риск увеличивается со степенью недоношенности. Симптомы и признаки включают затрудненное дыхание, вовлечение вспомогательных мышц и раздувание крыльев носа, появляются они вскоре после рождения. Диагноз клинический; пренатальный риск может быть оценен с помощью тестов на созревание легких плода. Лечение – терапия сурфактантом и поддерживающее лечение.
Этиология
Редкие случаи являются наследственными, вызванными мутациями генов сурфактантного белка (SP-B и SP-C) и АТФ-связывающего транспортного белка A3 (ABCA3).
Патофизиология
Легочный сурфактант – это смесь фосфолипидов и липопротеинов, выделяемых пневмоцитами типа II (см. Легочная функция новорожденных Функции легких новорожденного Переход от жизни в утробе матери к жизни вне ее включает многочисленные изменения в физиологии и функциях. Также Проблемы перинатального периода. (См. также Структура и функции печени (Liver. Прочитайте дополнительные сведения ). Он уменьшает поверхностное натяжение водной пленки, выстилающей альвеолы, тем самым уменьшая стремление альвеол к спаданию и работу, необходимую для их надувания.
При суфрактантной недостаточности для открытия альвеол необходимо большее давление. Без недостаточного давления в легких развиваются диффузные ателектазы, вызывающие воспаление и отек легких Отек легких Отек легких – острая тяжелая левожелудочковая недостаточность с легочной венозной гипертензией и альвеолярным отеком. При отеке легких появляются выраженная одышка, потливость, хрипы и иногда. Прочитайте дополнительные сведенияОсложнения
Осложнения респираторного дистресс-синдрома включают внутрижелудочковые кровоизлияния Внутрижелудочковое кровотечение и/или внутрипаренхимное кровоизлияния Стимуляция сокращения матки и родов иногда приводит к нанесению физических травм ребенку. Риск неонатальных травм в результате тяжелых или травматических родов снижается за счет увеличения использования. Прочитайте дополнительные сведения , бронхолегочную дисплазию Бронхолегочная дисплазия (БЛД) Бронхолегочная дисплазия (БЛД) является хроническим заболеванием легких новорожденного, которое обычно вызывается длительной искусственной вентиляцией и определяется возрастом недоношенности. Прочитайте дополнительные сведения ).
Клинические проявления
Симптомы РДС включают частое затрудненное кряхтящее дыхание, появляющееся немедленно или в течение нескольких часов после родов, с втяжениями грудины и раздуванием крыльев носа. Если ателектазы и дыхательная недостаточность прогрессируют, симптомы ухудшаются: появляются цианоз, вялость, нарушение дыхания и апноэ, что в конечном итоге может привести к сердечной недостаточности, если не будет произведено адекватное расширение легких, вентиляция и насыщение кислородом.
Новорожденные массой 1000 г могут иметь легкие настолько ригидные, что они не в состоянии инициировать или поддерживать дыхание в родильном зале.
При осмотре дыхательные шумы ослаблены и могут быть слышны хрипы.
Диагностика
Состав газов артериальной крови (ГАК; гипоксемия и гиперкапния)
Рентгенография грудной клетки
Посев крови, спинномозговой жидкости (СМЖ) и аспирата из трахеи
Диагноз РДС ставят на основании клинических проявлений, в т.ч. с учетом факторов риска; состава газов артериальной крови, свидетельствующего о гипоксемии и гиперкапнии; и рентгенографии грудной клетки. Рентген грудной клетки выявляет диффузные ателектазы, классически описываемые как имеющие вид матового стекла с заметными скоплениями воздуха на бронхограмме, и низкое расширение легкого; проявления слабо коррелируют с клинической тяжестью.
Дифференциальный диагноз включает:
Новорожденным обычно требуется посев крови. Культуральные исследования спинномозговой жидкости (СМЖ) не делают рутинно после рождения, из-за низкой распространенности менингита, ассоциированого с ранним неонатальным сепсисом, но они могут проводиться в отдельных случаях (например, при выявлении грамотрицательных бактерий в гемокультурах, подозрении на сепсис новорожденных с поздним началом) ( 1 Справочные материалы по диагностике Респираторный дистресс-синдром обусловлен недостаточностью легочного сурфактанта в легких новорожденных, чаще всего тех, кто родился на сроке 37 недель беременности. Риск увеличивается со степенью. Прочитайте дополнительные сведения ). Клинически отличить пневмонию, вызванную стрептококками группы В, от РДС чрезвычайно трудно. Таким образом, как правило, антибиотики назначаются до получения результатов посева.
Скрининг
Респираторный дистресс-синдром можно предположить пренатально с помощью тестов зрелости легких плода, которые получены из амниотической жидкости получают путем амниоцентеза или собранные из влагалища (при разрыве околоплодных оболочек) и которые могут помочь определить оптимальные сроки родов. Это показано для элективных родов до 39 недель, когда сердцебиение плода, уровень человеческого хорионического гонадотропина и УЗИ не могут подтвердить гестационный возраст, и неэлективных родов на сроках 34–36 недель.
Исследования амниотической жидкости включают в себя
Исследование индекса стабильности пенообразования (больше суфрактанта в амниотической жидкости, более высокая стабильность пены, которая формируется при встряхивании жидкости в сочетании с этанолом)
Риск респираторного дистресс-синдрома значительно ниже при соотношении лецитин/сфингомиелин > 2, наличии фосфатидил глицерина, индексе стабильности пены = 47 или соотношения сурфактант/альбумин > 55 мг/г.
Справочные материалы по диагностике
1. Srinivasan L, Harris MC, Shah SS: Lumbar puncture in the neonate: Challenges in decision making and interpretation. Semin Perinatol 36(6):445–453, 2012. doi: 10.1053/j.semperi.2012.06.007
Прогноз
Прогноз при лечении превосходный, смертность 10%. При адекватной вспомогательной искусственной вентиляции даже в качестве единственного способа в конечном счете начинает вырабатываться сурфактант, после чего РДС разрешается в течение 4–5 дней. Однако в то же время тяжелая гипоксемия может привести к множественной органной недостаточности и смерти. Большая степень недоношенности связана с более высоким риском возникновения хронических заболеваний легких, бронхолегочной дисплазии или их комбинации.
Лечение
Сурфактант интратрахеально, если есть показания
Дополнительный кислород по мере необходимости
Механическая вентиляция по мере необходимости
Сурфактант ускоряет восстановление и снижает риск пневмоторакса Пневмоторакс Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения , интерстициальной эмфиземы Интерстициальная легочная эмфизема (ИЛЭ) Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения , внутрижелудочкового кровоизлияния Внутрижелудочковое кровотечение и/или внутрипаренхимное кровоизлияния Стимуляция сокращения матки и родов иногда приводит к нанесению физических травм ребенку. Риск неонатальных травм в результате тяжелых или травматических родов снижается за счет увеличения использования. Прочитайте дополнительные сведения и смерти в больнице в течение 1 года. Дополнительные средства для замены суфрактанта включают в себя
Берактант – это липидный экстракт бычьего легкого, дополненный белками В и С, колфосцерила пальмитатом, пальмитиновой кислотой и трипальмитином; дозировка 100 мг/кг каждые 6 часов, по необходимости до 4 доз.
Порактант альфа представляет собой модифицированный экстракт, полученный из рубленого легкого свиньи, содержащий фосфолипиды, нейтральные липиды, жирные кислоты и связанные с суфрактантом белки В и С. Дозировка 200 мг/кг с последующим переходом на 2 дозы по 100 мг/кг через каждые 12 часов по необходимости.
Кальфактант – это экстракт теленка легких, содержащий фосфолипиды, нейтральные липиды, жирные кислоты и связанные с суфрактантом белки В и С. Дозировка составляет 105 мг/кг каждые 12 часов до 3 доз по необходимости.
Lucinactant is a synthetic surfactant with a pulmonary surfactant protein B analog, sinapultide (KL4) peptide, phospholipids, and fatty acids; dose is 175 mg/kg every 6 hours up to 4 doses.
Сурфактанты животного происхождения, как правило, считаются более эффективными, чем синтетические.
Растяжимость легких может быстро улучшаться после терапии. Пиковое давление аппарата ИВЛ при вдохе, возможно, нужно будет быстро снизить для уменьшения риска легочной утечки воздуха. Другие параметры аппарата ИВЛ (например, FIO2, уровень) тоже, возможно, потребуется уменьшить.
Справочные материалы по лечению
1. Blennow M, Bohlin K: Surfactant and noninvasive ventilation. Neonatology 107(4):330–336, 2015. doi: 10.1159/000381122
2. Bohlin K, Gudmundsdottir T, Katz-Salamon M, et al: Implementation of surfactant treatment during continuous positive airway pressure. J Perinatol 27(7):422–427, 2007. doi: 10.1038/sj.jp.7211754
3. Aldana-Aguirre JC, Pinto M, Featherstone RM, Kumar M: Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: A systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed 102(1):F17–F23, 2017. doi: 10.1136/archdischild-2015-310299
Профилактика
Когда плод должен родиться в период с 24-й по 34-ю недели, введение матери 2 доз бетаметазона по 12 мг внутримышечно с интервалом 24 часа или 4 доз дексаметазона по 6 мг внутривенно или внутримышечно каждые 12 часов за не менее чем 48 часов до родов вызывает образование сурфактанта у плода и снижает риск респираторного дистресс-синдрома либо уменьшает его тяжесть. ( Преждевременные роды Преждевременные роды Роды (схватки, приводящие к открытию шейки матки), начавшиеся до 37 недель, считаются преждевременными. Факторы риска включают предродовой разрыв околоплодных оболочек, аномалии матки, инфекции. Прочитайте дополнительные сведения ).
Профилактическая интратрахеальная терапия сурфактантами, назначаемая новорожденным с высоким риском развития РДС (младенцы, родившиеся 30 недель по сроку гестации, особенно в отсутствие дородового воздействия кортикостероидов), снижает риск неонатальной смертности и развития некоторых форм легочной заболеваемости (например, пневмоторакса Пневмоторакс Синдромы утечки воздуха в легких связаны с оттоком воздуха из нормального легочного воздушного пространства. (См. также Обзор перинатальных респираторных нарушений (Overview of Perinatal Respiratory. Прочитайте дополнительные сведения ).
Ключевые моменты
Респираторный дистресс-синдром (РДС) обусловлен недостаточностью легочного сурфактанта, что обычно наблюдается только у новорожденных, родившихся при 37 недель беременности. Недостаточность ухудшается с увеличением степени недоношенности.
В связи с недостаточностью сурфактанта, альвеолы закрываются или не могут раскрыться и в легких развиваются диффузные ателектазы, вызывающие воспаление и отек легких.
В дополнение к вызванной дыхательной недостаточности, РДС увеличивает риск внутрижелудочкового кровоизлияния, напряженного пневмоторакса, бронхолегочной дисплазии, сепсиса и смертельного исхода.
Диагностика клиническая и с рентгеном грудной клетки, исключение пневмонии и сепсиса проведением соответствующих посевов.
Если ожидаются преждевременные роды, то необходима оценки зрелости легких путем исследования амниотической жидкости на соотношение лецитина/сфингомиелина, стабильность пены или соотношения суфрактанта/альбумина.
При необходимости оказывают респираторную поддержку и интратрахеально вводят сурфактнант, если ребенку требуется немедленная интубация или ухудшается состояние дыхания при назальном постоянном положительном давлении в дыхательных путях.
Дайте матери несколько доз кортикостероидов парентерально (бетаметазон, дексаметазон), если время позволяет, и она должна родить на сроке от 24 недель и 34 недель беременности. Кортикостероиды вызывают продукцию суфрактанта плода и снижают риск и/или тяжесть РДС.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Патогенез острого респираторного дистресс-синдрома
Острый респираторный дистресс-синдром (ОРДС) является частым осложнением многих заболеваний. Полиэтиоло-гичность обуславливает особенности морфологических изменений легких, клинического течения ОРДС. Цель — анализ патогенеза ОРДС с позиций общепатологических процессов, лежащих в основе его развития. Материал и методы. Исследованы более 200 легких людей, погибших в результате тяжелой сочетанной травмы и умерших в результате пневмонии, осложненной ОРДС. В экспериментах (более 150) на крысах моделировали различные варианты повреждения легких: ИВЛ-индуцированное повреждение легких с различными параметрами вентиляции; реперфузионные (блокада системного кровотока пережатием сосудистого пучка сроком на 12 минут с последующим восстановлением сердечной деятельности и дыхания); нарушение микроциркуляции (введение в яремную вену раствора тромбоплас-тина); кровопотеря; аспирация ацидин-пепсина; закрытая травма груди. Гистологическое исследование различных отделов правого и левого легких проводили через 1, 3 часа, 1 и 3 суток после начала эксперимента. Кусочки легких фиксировали в 10% растворе нейтрального формалина и заливали в парафин. Гистологические срезы окрашивали гематоксилином и эозином, по Ван-Гизону, Вейгерту, применялась ШИК-реакция. Результаты. Влияние факторов агрессии (травма, кровопотеря, аспирация, инфекции и др.) ведут к повреждению легких и, в частности, структур аэ-рогематического барьера (эндотелия, альвеолярного эпителия, их базальных мембран). В свою очередь альтерация клеточных и внеклеточных структур сопровождается повышением проницаемости сосудов гемомикроциркуляторно-го русла, что приводит к развитию некардиогенного отека легких (интерстициального, альвеолярного), являющегося центральным звеном в патогенезе острого респираторного дистресс-синдрома. Заключение. Диагностика ранних проявлений ОРДС должна учитывать характер фактора агрессии, признаки, подтверждающие альтерацию легких, и, в частности, структур аэрогематического барьера. нарушение оксигенирующей функции легких, развитие некардиогенного отека легких, отсутствие признаков левожелудочковой недостаточности. Ключевые слова: острый респираторный дистресс-синдром, патогенез.
Об авторах
Список литературы
1. Черняев А. Л., Самсонова М. В.
3. Каменева Е. А.Диагностика и интенсивное лечение острого респираторного дистресс-синдрома у больных с тяжелой сочетанной травмой: автореф. дис. . д-ра мед. наук. М., 2010. 46.
4. Марченков Ю. В.Механизмы развития и пути коррекции гипоксии у больных с тяжелой осложненной торакальной травмой: автореф. дис. . д-ра мед. наук. М., 2010. 46.
5. Смелая Т. В.Генетическая предрасположенность, патоморфоз, лечение внебольничной и нозокомиальной пневмонии: автореф. дис. . д-ра мед. наук. М., 2010. 48.
6. Лысенко Д. В.Диагностика ранних стадий острого повреждения легких при тяжелой сочетанной травме (клинико-эксперименталь-ное исследование): автореф. дис. . канд. мед. наук. М., 200 24.
7. Городовикова Ю. А.Роль аспирации в развитии острого повреждения легких у больных с изолированной черепно-мозговой травмой: автореф. дис. . канд. мед. наук. М., 2009. 24.
8. Зорина Ю. Г.Коррекция нарушений легочного газообмена модифицированным методом «мобилизации альвеол» у больных после операций реваскуляризации миокарда (клинико-эксперименталь-ное исследование): автореф. дис. . канд. мед. наук. М., 2009. 19.
9. Кузовлев А. Н.Диагностика острого респираторного дистресс-синдрома при нозокомиальной пневмонии: автореф. дис. . канд. мед. наук. М., 2010. 24.
10. Голубев А. М, Мороз В. В.Патогенез острого повреждения легких. Сб. мат-лов Всерос. конгр. анестезиологов и реаниматологов и XI-й съезд Федерации анестезиологов и реаниматологов. СПб.; 2008: 512.
11. Мороз В. В., Голубев А. М., Кузовлев А. Н.Отек легких: классификация, механизмы развития, диагностика.Общая реаниматология.2009. 5 (1): 83—88.
12. Городовикова Ю. А., Мороз В. В., Голубев А. М., Марченков Ю. В., Чур-ляев Ю. А.Аспирационное острое повреждение легких у больных с изолированной тяжелой черепно-мозговой травмой.Общая реаниматология.2009; 5(3): 11—13.
13. Сундуков Д. В, Голубев А. М., Лелиовская А. А., Шаман П., Городови-кова Ю. А.Морфология острого повреждения легких при аспирации крови.Медицинская экспертиза и право.2010; 4: 39—41.
14. Мороз В. В., Голубев А. М., Кузовлев А. Н., Смелая Т. В.Острое повреждение легких при пневмониях.Общая реаниматология.2008; 4 (3): 106—111.
15. Мороз В. В., Голубев А. М., Мещеряков Г. Н., Лысенко Д. В.Способ моделирования острого повреждения легких. Патент на изобретение № 2285961 от 20. 10. 2006 г.
16. Мороз В. В., Голубев А. М.Принципы диагностики ранних проявлений острого повреждения легких.Общая реаниматология.2006; 2 (4): 5—7.
17. Мороз В. В., Голубев А. М.Классификация острого респираторного дистресс-синдрома.Общая реаниматология.2007; 3 (5—6): 7—9.
18. Голубев А. М., Смелая Т. В., Мороз В. В., Попов А. А., Толбатов А. А., Ме-дунецкая С. В.Внебольничная и нозокомиальная пневмония: клини-ко-морфологические особенности.Общая реаниматология.2010; 6 (3): 5—14.
19. Кузовлев А. Н., Мороз В. В., Голубев А. М., Половников С. Г., Смелая Т. В.Диагностика острого респираторного дистресс-синдрома при нозокомиальной пневмонии.Общаяреаниматология.2009; 5 (6): 5—12.
20. Moroz V., Goloubev A., Kuzovlev A. N.Acute respiratory distress syndrome: new classification.Semin. Cardiothorac. Vasc. Anesth.2010; 14 (1): 46.
21. Kuzovlev A. N., Moroz V. V., Goloubev A. M., Polovnikov S. G.Diagnosis of acute respiratory distress syndrome in nosocomial pneumonia.Semin. Cardiothorac. Vasc. Anesth.2010; 14 (4): 231—241.
22. Мороз В. В., Голубев А. М., Чурляев Ю. А., Лысенко Д. В.Диагностика ранних проявлений острого повреждения легких (методические рекомендации). М.; 2008.
23. Каменева Е. А., Разумов А. С., Григорьев Е. В., Голубев А. М.Острый респираторный дистресс-синдром при тяжелой сочетанной травме. Диагностика и лечение (методические рекомендации). «Кемеровская государственная медицинская академия Росздрава», Департамент охраны здоровья населения Кемеровской области. Кемерово; 2010.
24. LeTourneauJ. L., PinneyJ., Phillips C. R.Extravascular lung water predicts progression to acute lung injury in patients with increased risk.Crit. Care Med.2012; 40 (3): 847—854.
Респираторный дистресс-синдром (РДС) у недоношенных детей
Синдром дыхательных расстройств или «респираторный дистресс-синдром» новорожденного представляет собой расстройство дыхания у недоношенных детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта и незрелостью легких. Это один из самых распространенных диагнозов у детей, родившихся на сроке менее 34 недель гестации. РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде у новорожденных. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребенка при рождении.
Причины развития РДС у новорожденных
Основные причины развития РДС у новорожденных - это нарушение образования в альвеолах легких специального вещества – сурфактанта, связанное с функциональной и структурной незрелостью легочной ткани. Сурфактант представляет собой природное вещество, состояще из фосфолипидов и четырех видов белка, которое покрывает стенки дыхательных пузырьков – альвеол.
Легкие плода до родов находятся в спавшемся состоянии , легочные пузырьки – альвеолы напоминают сдувшиеся воздушные шарики. После рождения ребенок делает первый вдох, легкие расправляются и из сдувшихся шарики должны превратиться в надутые. Однако все структуры легких у малышей с массой тела менее 1500 г при рождении незрелые. Они менее воздушные и более полнокровные, а самое главное, в них отмечается недостаток сурфактанта.

Рентгенологическая картина РДС зависит от тяжести заболевания – от небольшого уменьшения пневматизации до «белых легких». Характерными признаками являются: диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма).
Профилактика и лечение РДС у недоношенных детей
При угрозе преждевременных родов на 32 неделе гестации и менее беременная женщина должна быть госпитализирована в акушерский стационар III уровня (в перинатальный центр), где имеется отделение реанимации новорожденных. Риск развития РДС тем выше, чем более недоношенным рождается ребенок. Но этот риск можно снизить. Для этого всем беременным женщинам на сроке гестации 23-34 недели при угрозе преждевременных родов проводят курс гормональной терапии кортикостероидами для профилактики РДС недоношенных и снижения риска возможных неблагоприятных осложнений у ребенка таких, как ВЖК и НЭК. Возможны две альтернативные схемы пренатальной профилактики РДС: Бетаметазон – 12 мг внутримышечно через 24 часа, всего 2 дозы на курс; или Дексаметазон – 6 мг внутримышечно через 12 часов, всего 4 дозы на курс. Стероидные гормоны ускоряют созревание легких у плода. Максимальный эффект терапии развивается спустя 24 часа после начала терапии и продолжается неделю. К концу второй недели эффект от терапии стероидами значительно снижается. Повторный курс профилактики РДС рекомендован только спустя 2-3 недели после первого в случае повторного возникновения угрозы преждевременных родов на сроке беременности менее 33 недель.
Профилактически уже в первые 20 минут жизни всем детям, родившимся на сроке гестации 26 недель и менее при отсутствии проведения их матерям полного курса антенатальной профилактики стероидами проводится введение сурфактанта в легкие. Также сурфактант в родильном зале вводится всем новорожденным гестационного возраста ≤ 30 недель, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения первые 20 минут жизни. Недоношенным детям гестационного возраста > 30 недель, потребовавшим интубации трахеи в родильном зале при сохраняющейся зависимости от FiО2 > 0,3-04. Наиболее эффективное время введения – первые два часа жизни. Недоношенным детям на стартовой респираторной терапии методом СРАР в родильном зале при потребности в FiО2 ≥ 0,5 и более для достижения SpО2 = 85% к 10 минуте жизни и отсутствии регресса дыхательных нарушений, а так же улучшения оксигенации в последующие 10-15 минут.
В неонатологии используют сурфактант, получаемый из легких животных, свиней или коров. Вещество проходит тщательную очистку от любых инфекционных агентов (вирусов, бактерий), в также специфических животных белков, что исключает развитие аллергических реакций. Сурфактант представляет собой белый раствор, который вводится через трубочку прямо в легкие ребенка. Он быстро распространяется по всем дыхательным путям и буквально на глазах увеличивает насыщение крови кислородом. В некоторых случаях ребенок нуждается в двухкратном или даже трехкратном введении сурфактанта.
Повторное введение сурфактанта с лечебной целью рекомендовано: детям гестационного возраста ≤35 недель на СРАР, уже получившим первую дозу сурфактанта, при переводе их на искусственную вентиляцию легких в связи с нарастанием дыхательных нарушений
Недоношенным, родившимся на сроке гестации 32 недели и менее в случае отсутствия дыхания или при нерегулярном дыхании в первые 20 секунд проводится продленный вдох для наиболее эффективного расправления альвеол и формирования функциональной остаточной емкости легких. После восстановления спонтанного дыхания проводится респираторная терапия с положительным давлением в дыхательных путях методом СРАР (Сontinuous Positive Airway Pressure), что помогает поддерживать легкие в расправленном состоянии даже когда ребенок делает выдох.
Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне респираторной терапии нерегулярности сердцебиения иили отсутствии самостоятельного дыхания.
Потребность в дополнительной оксигенации до 45-50%, а так же в высоком давлении к концу вдоха у недоношенных новорождённых является показанием для перевода на высокочастотную осцилляторную вентиляцию легких (ВЧОВЛ).
Высокочастотная ИВЛ – это особый, высокотехнологичный метод проведения искусственной вентиляции легких. При ВЧОВЛ отсутствуют привычные дыхательные движения, так как здесь не происходит привычного вдоха и выдоха. Газообмен обеспечивается за счет высокочастотных колебаний воздушной смеси – осцилляций. При этом можно увидеть, как грудная клетки ребенка колеблется. Преимуществом такой респираторной терапии является то, что газообмен в легких происходит практически непрерывно, что необходимо в тех случаях когда легкие ребенка очень незрелые и ли в них имеется воспалительный процесс.
При ВЧО ИВЛ за счет стабилизации объема альвеол происходит уменьшение ателектазов (участков слипания легочных альвеол), увеличение площади газообмена и улучшение легочного кровотока. В результате правильно проводимой терапии достигается уменьшение вентиляционно-перфузионного соотношения, уменьшается потребность в высокой концентрации кислорода. При этом уменьшается дыхательный объем, снижается перерастяжение легких и уменьшается риск повреждения легких за счет баро - и волюмотравмы.
Острый респираторный дистресс-синдром (ОРДС)
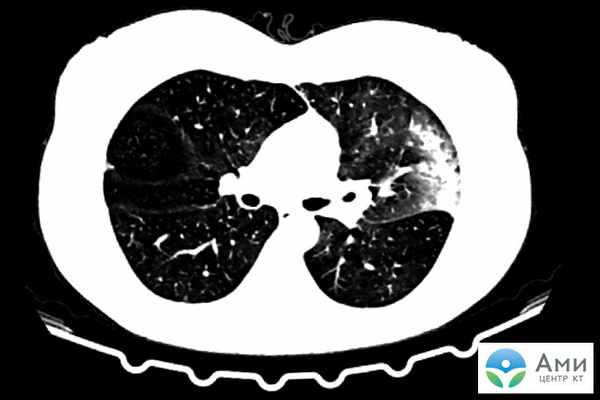
Острый респираторный дистресс-синдром (ОРДС) — это тяжелое осложнение острых респираторных заболеваний, которое заключается в обширном двухстороннем воспалении легких с инфильтратами и отеком. Развивается в очень короткий срок: воспалительный процесс поражает легочную паренхиму в течение 12-48 часов, пациенту необходима искусственная вентиляция легких (ИВЛ).
С первых часов пациента беспокоит нехватка дыхания, кашель, боль в груди. Острый респираторный дистресс-синдром обнаружили и начали исследовать только с 1960-х гг. Характеризуется высоким показателем летальности.
ОРДС возникает из-за непосредственного повреждения легких (утопление, травматизация, пересадка легких, вдыхание ядовитого газа) или в результате непрямого повреждения легких (сепсис, панкреатит, ожоги, передозировка лекарствами и наркотиками).
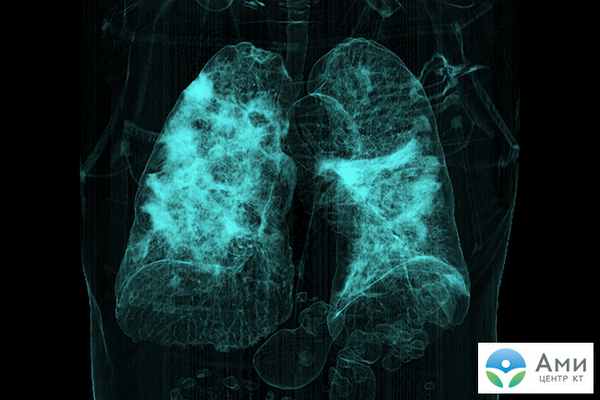
Обширное воспаление легких может вызвать осложнения на сердце или спазм легочных сосудов, у некоторых пациентов наблюдается фиброз легких как исход ОРДС. Острый респираторный дистресс-синдром — основная причина смертности при коронавирусе Sars-Cov2.
На сканах КТ ОРДС визуализируется набором специфических признаков: множественные фрагментарные участки «матового стекла» кортикальной формы с обеих сторон, увеличенная в размере легочная ткань, утолщение межальвеолярных стенок (симптом «лоскутного одеяла» или «булыжной мостовой»).
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 20 лет
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 20 лет
- Котов М.А. Опыт применения компьютерной томографии в диагностике заболеваний органов дыхания у детей / Материалы X Невского радиологического Форума (НРФ-2018). – СПб., 2018, Лучевая диагностика и терапия. 2018. № 1 (9). — С. 149.
- Панов А.А. Пневмония: классификация, этиология, клиника, диагностика, лечение, 2020.
- Бова А.А. Пневмонии: этиология, патогенез, клиника, диагностика, 2016.
- Chl Hong, M.M Aung , K. Kanagasabai , C.A. Lim , S. Liang , K.S Tan. The association between oral health status and respiratory pathogen colonization with pneumonia risk in institutionalized adults, 2018.
- Yang-Pei Chang, Chih-Jen Yang, Kai-Fang Hu, A-Ching Chao, Yu-Han Chang, Kun-Pin Hsieh, Jui-Hsiu Tsai, Pei-Shan Ho, Shen-Yang Lim. Risk factors for pneumonia among patients with Parkinson's disease: a Taiwan nationwide population-based study, 2016.
- Клинические рекомендации по диагностике, лечению и профилактике тяжелой внебольничной пневмонии у взрослых. Министерство здравоохранения РФ, 2019.
Мы перезвоним, подберём удобное для записи время и ответим на вопросы.
Оператор обрабатывает входящие заявки с 8:00 до 22:00
Нажимая на кнопку, вы даете согласие на обработку персональных данных в соответствии с Федеральным законом от 27.07.2006 г. № 152-ФЗ «О персональных данных».
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
IX Международная студенческая научная конференция Студенческий научный форум - 2017

Острый респираторный дистресс-синдром характеризуется сложными механизмами патогенеза, тяжелыми нарушениями газообмена в легких и высокой летальностью, что и определяет необходимость поиска новых путей улучшения диагностики и результатов лечения этого заболевания.
Несмотря на развитие медицинских технологий, за последние 20 лет отмечается только тенденция к снижению летальности больных с ОРДС, которая, к сожалению, остается очень высокой - от 22% до 74%.
Благодаря развитию современных медицинских технологий, имеется большой арсенал методов диагностики и лечения ОРДС.
Глава I: Этиология. Патогенез.Патоморфологические изменения.
Этиология
Синдром описан Эсбахом в 1967 г. и назван по аналогии с дистресс-синдромом новорожденных, который обусловлен врожденным дефицитом сурфактанта. При респираторном дистресс-синдроме взрослых дефицит сурфактанта вторичен. В литературе часто используются синонимы респираторного дистресс-синдрома взрослых: шоковое легкое, некардиогенный отек легких.
Непосредственными и наиболее частыми причинами острого респираторного дистресс-синдрома взрослых являются сепсис (в том числе абдоминальный), панкреатит, генерализованные лёгочные инфекции. К развитию синдрома может привести аспирация кислого желудочного содержимого, пресной или солёной воды, вдыхание ядовитых газов или дыма, ингаляция кислорода в высоких концентрациях. Часто первичными этиологическими факторами острого респираторного дистресс-синдрома взрослых служат травма и травматический шок. Острый респираторный дистресс-синдром взрослых осложняет ожоги и механические повреждения, в том числе переломы костей, травмы головы, ушиб лёгких, повреждения внутренних органов. Это осложнение нередко развивается после оперативных вмешательств, у пациентов с онкологическими заболеваниями после операций типа Герлока и Льюиса. Массивная трансфузия консервированной крови без микрофильтров также может быть источником значительного лёгочного микроэмболизма и первичным этиологическим фактором заболевания. Доказана возможность развития респираторного дистресс-синдрома взрослых после применения экстракорпорального кровообращения ("постперфузионное лёгкое").
Диссеминирование внутрисосудистое свёртывание крови – одна из причин полиорганной недостаточности и лёгочной дисфункции. Перенесённые критические состояния (длительная гипотензия, гиповолемия, гипоксия, кровопотеря), переливание больших объёмов крови и растворов рассматриваются как возможные этиологические факторы острого респираторного дистресс-синдрома взрослых. Жировая эмболия – одна из причин лёгочного поражения. Лекарственные препараты (наркотические анальгетики, декстраны, салицилаты, тиазиды и другие) также можно стать причиной этого осложнения.
Патогенез
Основная патология – повреждение (разрушение) лёгочного альвеолярно-капиллярного барьера. Патофизиологические изменения: набухание и отёк альвеолярно-капиллярной мембраны, образование в ней межклеточных щелей, развитие интерстициального отёка. Острый респираторный дистресс-синдром взрослых – это не просто форма лёгочного отёка, вызванная повышенной капиллярной проницаемостью, но и проявление общей системной патологической реакции, приводящей к дисфункции не только лёгких, но и других органов.
Патофизиологические последствия лёгочного отёка при респираторном дистресс-синдроме взрослых включают уменьшение лёгочных объёмов, значительное снижение податливости лёгких и развитие больших внутрилёгочных шунтов. Преобладание кровотока в соотношении вентиляция/кровоток обусловлено перфузией невентилируемых сегментов лёгкого. Снижение остаточного объёма лёгких тоже отражается на неравномерности этого соотношения.
Разрушение лёгочного сурфактанта и уменьшение его синтеза также могут быть причинами снижения функциональных лёгочных объёмов и способствовать нарастанию отёка лёгких. Увеличение поверхностного натяжения альвеол снижает гидростатическте давление в интерстиции и способствует повышению содержания воды в лёгких. Уменьшение податливости отёчного лёгкого приводит к интенсификации работы органов дыхания и сопровождается усталостью дыхательной мускулатуры. Количественно степень отёка лёгких соответствует объёму внутрисосудистой воды в лёгких, величина которого постепенно увеличивается, что во многом обусловливает клиническую и рентгенологическую картину нарушения. Неспецифическая диссеминированная реакция способствует образованию внутрисосудистых тромбов в системе лёгочной артерии и повышению давления в ней. Симптом повышения давления в системе лёгочной артерии обычно обратим, не связан с левожелудочковой недостаточностью и, как правило, не превышает 18 мм Hg. Обратимость лёгочной гипертензии при остром респираторном дистресс-синдроме взрослых в пределах 72 часов его развития подтверждается при назначении нитропруссида. Иными словами, лёгочная гипертензия при остром респираторном дистресс-синдроме взрослых не носит столь манифестирующего характера, как при гидростатическом (кардиогенном) отёке лёгких. Обычно давление заклинивания лёгочной артерии бывает в пределах нормы. Лишь в терминальной стадии острого респираторного дистресс-синдрома взрослых возможно повышение давления заклинивания лёгочной артерии, что связано с сердечной недостаточностью. У пациентов, умирающих от прогрессирования лёгочной недостаточности и неспособности лёгких выполнять газообменную функцию при остром респираторном дистресс-синдроме взрослых, обычно наблюдается выраженное снижение податливости (растяжимости) лёгких, глубокая гипоксемия и увеличение мёртвого пространтсва с гиперкапнией. При патоморфологических исследованиях у них выявляется обширный интерстициальный и альвеолярный фиброз.
Глава II: Клиническая картина. Диагностика.Лечение острого респираторного дистресс-синдрома взрослых. Осложнения. Прогноз.
Клиническая картина
Признаки острого респираторного дистресс-синдрома взрослых могут быть вначале невыраженными и оставаться незамеченными: могут развиваться в течение нескольких часов или дней (например, при сепсисе). Иногда развитие острого респираторного дистресс-синдрома взрослых совпадает с инцидентом, который может вызвать это осложнение (например, аспирация желудочного содержимого). Общие признаки – одышка, сухой кашель, дискомфорт за грудиной, состояние неполной адекватности. Более отчётливые признаки появляются при умеренно выраженной или тяжёлой форме острого респираторного дистресс-синдрома взрослых. В этот период развивается цианоз. При аускультации лёгких – бронхиальное дыхание, возможны грубые крипитирующие хрипы. Состояние пациента ухудшается: у него нарастает тяжёлая дыхательная недостаточность по гипоксемическому варианту. Острый респираторный дистресс-синдром взрослых достигает пика в среднем через 24—48 часов от начала повреждения и заканчивается массивным, обычно двусторонним поражением лёгочной ткани.
Выделяются 4 стадии острого респираторного дистресс-синдрома взрослых:
1-я стадия – повреждение (до 6 часов после стрессового воздействия).§ Пациент, как правило, не предъявляет никаких жалоб. Обычно при клиническом и рентгенологическом исследованиях изменений в лёгких не выявляются;
2-я стадия – мнимое благополучие (6—12 часов после стрессового воздействия). Наиболее ранний признак острого респираторного дистресс-синдрома взрослых – одышка; затем появляется тахикардия, снижается РаО2, возникают сухие хрипы в лёгких, жёсткое дыхание. На рентгенограмме – усиление сосудистого компонента лёгочного рисунка, переходящее в интерстициальный отёк лёгких.
3-я стадия – дыхательная недостаточность (12—24 часа после стрессового воздействия). Одышка, тахипноэ, участие вспомогательной мускулатуры в дыхании, тахикардия, цианоз, РаО2 менее 50 мм Hg, несмотря на ингаляцию 60 % кислорода. Появление влажных хрипов в лёгких свидетельствует о накоплении жидкости в альвеолах. На рентгенограмме – выраженный интерстициальный отёк лёгких, на фоне усиленного сосудистого рисунка очаговоподобные тени, иногда горизонтальные линии. Видны явные инфильтративные тени, представляющие периваскулярную жидкость. В связи с тяжестью состояния рентгеноргафическое исследование лёгких приходится проводить в положении пациента лёжа, при этом он ме не может сделать полноценный вдох и задержать дыхание. В этих случаях на рентгенограмме – кажущееся расширение скрдечно-сосудистой тени, что иногда трактуется как кардиогенный отёк лёгких.
4-я стадия – терминальная. Прогрессирование симптомов: глубокая артериальная гипоксемия, цианоз, сердечно-сосудистая недостаточность, шок, полиорганная недостаточность, альвеолярный отёк лёгких.
Диагностика
В связи с отсутствием чувствительных маркёров лёгочного эпителиального и эндотелиального повреждения диагноз острого респираторного дистресс-синдрома взрослых ставится на основании комплекса клинических, лабораторных и рентгенологических данных.
Газовый состав артериальной крови. Обычно наблюдается выраженная артериальная гипоксеми, во многих случаях гипокапния. При прогрессировании синдрома РаО2 < 50 мм Hg, несмотря на оксигенотерапию (FiО2 >0,6), в поздней стадии заболевания возможна гиперкапния.
Рентгенография грудной клетки. На рентгенограмма вначале отмечаются малоинтенсивные пятнистые затемнения с нечёткими контурами диаметром 0,3 см, располагающиеся по периферии на фоне умеренного снижения прозрачности лёгочной ткани и значительного усиления лёгочного рисунка; в дальнейшем – усиление мелкоклеточной пятнистости по всему лёгочному полю, но с преобладанием её по периферии. Снижается прозрачность лёгочной ткани, и это распространяется на большие участки лёгких (диффузные двусторонние инфильтраты). Во многих случаях бывает рентгенологически трудно дифференцировать некардиогенный отёк лёгких от кардиогенного.
Лечение острого респираторного дистресс-синдрома взрослых
Основные цели терапии острого респираторного дистресс-синдрома взрослых:
поддержание адекватного транспорта кислорода;
уменьшение лёгочного отёка (накопления воды в лёгких) без угрозы для почечной функции;
профилактика и борьба с инфекциями и суперинфекциями; адекватное питание (энтеральное и парэнтеральное).
При остром респираторном дистресс-синдроме взрослых катетеризация лёгочной артерии является важной диагностической манипуляцией, позволяющей в процессе лечения дать оценку давления заклинивания лёгочной артерии, уровня кислорода, провести выбор величины положительного давления в конце выдоха и баланса жидкости в организме.
Поддержание адекватного транспорта кислорода. Ликвидация гипоксии достигается путём улучшения лёгочного, циркуляторного, гемического и тканевого транспортов кислорода.
Респираторная поддержку необходимо проводить у всех пациентов с острым респираторным дистресс-синдромом лёгких при первых же признаках дыхательной недостаточности. Необходимо подчеркнуть важность ранней вспомогательной вентиляции, поскольку длительная дисфункция лёгких не обеспечивает потребностей тканей в кислороде, что приводит к клеточной смерти и полиорганной недостаточности. Если масочный способ вспомогательной искусственной вентиляции лёгких не даёт положительного результата, следует провести интубацию трахеи. Решающую роль играет выбор режима вспомогательной искусственной вентиляции лёгких. В некоторых случаях отказ от применения традиционной искусственной вентиляции лёгких даёт больший эффект. Сразу же после интубации трахеи респиратор необходимо установить в режим вспомогательной искусственной вентиляции лёгких при сохранённм самостоятельном дыхании. Наиболее целесообразным считается режим синхронизированной перемежающейся принудительной вентиляции (SIMV) в сочетании с поддержкой давлением (CPAP). Важен контроль концентрации вдыхаемого кислорода, давления на вдохе и дыхательного объёма (8—12 мл/кг массы тела пациента). Нет доказательств, что режимы высокочастотной искусственной вентиляции лёгких могут улучшить результаты лечения пациентов с острым респираторным дистресс-синдромом взрослых.
Режим положительного давления в конце выдоха – наиболее эффективный способ поддержания адекватного насыщения организмом кислородом у пациентов с острым респираторным дистресс-синдромом взрослых. Этот метод улучшает насыщение крови кислородом, способствует повышению функциональной остаточной ёмкости лёгких и восстановлению спавшихся альвеол. При остром респираторном дистресс-синдроме взрослых нужно обращать внимание как на показатели газового состава крови, так и на гемодинамику. Поддержание адекватного транспорта кислорода требует постоянного контроля параметров гемодинамики. Снижение сердечного выброса обусловливает необходимость обязательного применения средств инотропной поддержки. При этом используются симпатомиметические лекарственные препараты – добутамин в дозе 2—15 мкг/кг/мин или допамин в низких или средних дозах (до 10 мкг/кг/мин). В более высоких дозах допамин вызывает сужение лёгочных вен и повышает давление заклинивания лёгочной артерии. Вазоплегические лекарственные препараты при остром респираторном дистресс-синдроме взрослых противопоказаны. Величины доставки и потребления кислорода – важные критерии в лечении острого респираторного дистресс-синдрома взрослых. Доставку (норма 110 мл/м2) нужно поддерживать на сверхнормальном уровне.
Профилактика и лечение инфекций. Если острый респираторный дистресс-синдром взрослых возник в результате сепсиса или системной воспалительной реакции, применяются все методы лечения, включая массивную антибактериальную терапию. Важно не допустить развития новых инфекционных осложнений: нозокомиальной пневмонии и других суперинфекций, значительно ухудшающих результаты лечения.
Осложнения
В процессе лечения острого респираторного дистресс-синдрома взрослых важно учитывать возможность осложнений: баротравмы лёгких, бактериальной пневмонии, левожелудочковой недостаточности, синдрома диссеминированного внутрисосудистого свёртывания крови. Баротравма лёгких (клинические симптомы: пневмоторакс, пневмомедиастинум, подкожная эмфизема) – частое осложнение при проведении искусственной вентиляции лёгких у пациентов с респиратоным дистресс-синдромом взрослых. Высокий риск баротравмы обусловлен значительным снижением податливости лёгких. Этот риск особенно велик при показателе податливости лёгких менее 20 см Н2О.
Скорее всего, баротравма обусловлена перерастяжением отдельных альвеол, что коррелирует с высоким пиковым давлением вдоха. Левожелудочковая недостаточность может быть вызвана многими причинами, и надёжным контролем служит гемодинамический мониторинг, включая давление заклинивания лёгочной артерии.
Прогноз
Статистически не было доказано преимущество какой-либо методики лечения в уменьшении показателя смертности при остром респираторном дистресс-синдроме взрослых. Частота летальных исходов возрастает , если в процесс вовлечены другие органы. Смертность у пациентов с острым респираторным дистресс-синдромом взрослых в большей степени зависит от наличия полиорганной недостаточности и в меньшей – от лёгочной дисфункции. После перенесённого отсрого респираторного дистресс-синдрома взрослых, как это ни удивительно, лёгкие могут восстановить почти нормальную функцию. Однако в исходе этого синдрома могут развиваться состояния, требующие длительного респираторного лечения.
Заключение
Однако сложные механизмы патогенеза, отсутствие научно обоснованного комплексного подхода к профилактике, дифференциальной диагностике и дифференцированному лечению ОРДС, вызванного различными причинами на разных стадиях заболевания, определяют сохраняющуюся высокую летальность данного контингента больных. Этим обусловлена необходимость поиска новых путей улучшения результатов лечения ОРДС.
Список литературы
Афонин А. Н., Мороз В. В., Карпун Н. А. Острое повреждение лёгких, ассоциированное с трансфузионной терапией. Общая реаниматология 2009;
Багненко С. Ф., Шах Б. Н., Лапшин В. Н. Коррекция расстройств микроциркуляции и профилактика реперфузионных нарушений у пострадавших с сочетанной шокогенной травмой. Клиническая физиология микроциркуляции 2007;
Бородай Е. А. Морфологические изменения в легких у пострадавших с тяжелой механической травмой. Труды НИИ общей реаниматологии РАМН. М., 2003:
Власенко А.В., Закс И.О., Мороз В.В. Нереспираторные методы терапии синдрома острого паренхиматозного поражения легких (обзор зарубежной литературы, часть I)// Вестник интенсивной терапии, 2001. - №2.
Галушка С. В., Мороз В. В., Власенко А. В. Кислородный долг как критерий прогноза у больных с полиорганной недостаточностью. Анест. и реаниматол. 2001;
Городовикова Ю. А., Голубев А. М., Мороз В. В. Аспирационное острое повреждение лёгких (экспериментальное, морфологическое исследование). Общая реаниматология 2008;
Читайте также:
