Патологическая анатомия метастазов в хориоидею
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Среди новообразований сосудистой оболочки глаза наиболее часто встречаются меланома хориоидеи и метастаз в хориоидею. Заболеваемость увеальной меланомы по обращению составляет 6,23-13 случаев на 1 млн населения [1]. Частота выявления внутриглазных метастазов, по данным разных авторов, существенно отличается и составляет от 1,2 до 14,5% [2, 3].
Значительная часть больных с вторичным поражением органа зрения имеет множественные отдаленные метастазы других локализаций и находится под наблюдением онкологов, не обследуясь у офтальмолога. Вместе с тем метастаз в сосудистую оболочку глаза может быть первым проявлением генерализации злокачественной опухоли, а также встречаться при отсутствии онкологического анамнеза. Поражение сосудистой оболочки у онкологического больного, с другой стороны, может быть как вторичным, так и являться проявлением первичной множественности злокачественных опухолей.
Своевременная ранняя дифференциальная диагностика первичного и метастатического поражения хориоидеи имеет решающее значение для пациента, так как подходы к лечению принципиально различаются. Дифференциация характера опухоли в ряде случаев является сложной задачей и требует комплексного подхода. Важное значение имеют данные анамнеза, которые должны быть интерпретированы в соответствии с клинической картиной. Обязательным является полноценное обследование по органам (УЗИ, КТ, МРТ, сцинтиграфия, ПЭТ, при необходимости пункция патологических образований). На сегодняшний день ОКТ и ФАГ наряду с УЗИ являются стандартными исследованиями для диагностики внутриглазных образований. ТИАБ с цитологическим исследованием проводят по показаниям при невозможности верификации с применением неоперационных методик ввиду риска диссеминации опухолевых клеток.
В январе 2014 года в Отделение неотложной помощи ОКБ обратился пациент Б., 75 лет, с жалобами на резкое снижение зрения правого глаза неделю назад на фоне приступа кашля. Страдает сахарным диабетом 2 типа более 30 лет, течение тяжелое, применяет инсулин. При обследовании выявлен частичный гемофтальм, по УЗИ определялась +ткань. Был направлен на консультацию офтальмоонколога.
В анамнезе у пациента нефрэктомия по поводу умеренно-дифференцированного почечно-клеточного рака в 2006 году в ММА им. И.М. Сеченова, наблюдается у онколога. По данным последнего осмотра без рецидива и прогрессирования.
При обследовании острота зрения правого глаза: правильная светопроекция, внутриглазное давление — 12 мм рт.ст. Передний отрезок в пределах возрастной нормы, в хрусталике выраженные помутнения под задней капсулой, начальные — в кортексе.
В стекловидном теле взвесь элементов крови, плавающие помутнения, глубже лежащие среды не видны. На глазном дне левого глаза картина непролиферативной диабетической ретинопатии. При УЗИ правого глаза частичный гемофтальм, вторичная отслойка сетчатки, +ткань грибовидной формы с проминенцией до 6,9 мм (рис. 1). При обследовании по органам без очагового поражения и рецидива рака почки.
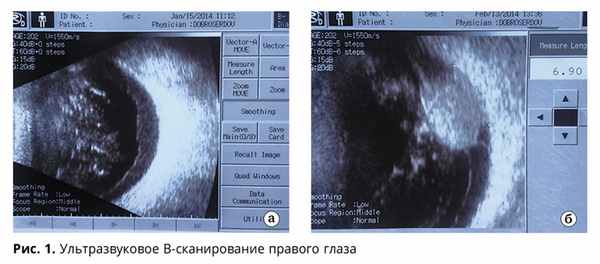
В многопрофильном стационаре 18.02.14 г. пациенту произведена энуклеация правого глаза, при гистологическом исследовании опухоль верифицирована как смешанно-клеточная меланома хориоидеи. В апреле и июне пациент прошел диспансерные осмотры офтальмоонколога, стеклопрепараты энуклеированного глаза не предоставлял. При обследовании анофтальм справа, полость протезирована, небольшое слизистое отделяемое, без уплотнений, регионарные лимфоузлы без особенностей. По повторному запросу предоставил стеклопрепараты энуклеированного глаза в июле 2014 года. При пересмотре стеклопрепаратов в ОКБ: в присланном материале опухоль хориоидеи с прилежащим участком склеры.
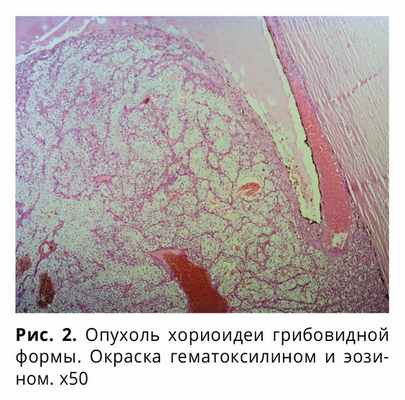
Опухоль имеет грибовидную форму, представлена солидной пролиферацией полигональных клеток со светлой широкой цитоплазмой, в цитоплазме единичных клеток видны гранулы желто-коричневого пигмента, сосудистая сеть хорошо развита, с тромбозами, кровоизлияниями, имеются очаговые некрозы опухоли, митозы не дифференцируются (рис. 2, 3).
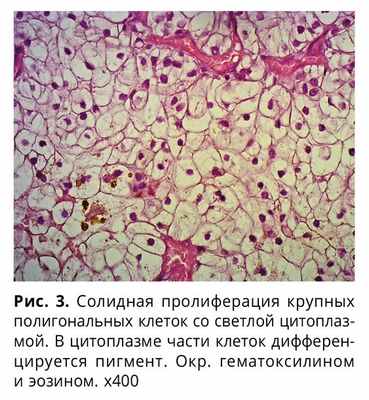
Учитывая морфологическую картину и данные анамнеза, для подтверждения метастаза почечно-клеточного рака было проведено иммуногистохимическое исследование, которое выявило диффузную экспрессию в опухолевых клетках в виде выраженной цитоплазматической реакции с акцентом на мембрану панцитокератина и диффузную экспрессию в опухоли в виде выраженной ядерной реакции в опухолевых клетках РАХ8, а к S-100 и мелану А опухолевые клетки оказались негативны, что определило иммунофенотип образования соответствующим иммунофенотипу первичной опухоли.
Наиболее часто в сосудистую оболочку глаза метастазирует рак молочной железы (33-87%), на втором месте, по данным разных авторов, метастазы рака легкого (15-29,5%), а также метастазы без выявленного первичного очага (5,7-17%). Метастазы рака почки встречаются относительно редко и составляют 1-3% [2, 4-6]. Чаще всего проводить дифференциальную диагностику метастатического очага приходится с увеальной меланомой, значительно реже с гемангиомой хориоидеи и опухолеподобными заболеваниями [1, 4, 5].
Комплексное обследование включает анализ анамнеза, тщательного обследования по органам, клинической картины и данных инструментальных методов обследования. Внутриглазная опухоль чаще локализуется в хориоидее, преимущественно в центральных отделах глазного дна и на ранних стадиях выглядит как округлый проминирующий очаг с нечеткими границами, более плотный и компактный при меланоме и более рыхлый при метастазе. Для меланомы хориоидеи более характерна правильная полушаровидная или грибовидная форма опухоли, хотя, по данным литературы, встречаются и грибовидные гемангиомы [7]. При метастатическом поражении чаще встречается неправильная конфигурация опухоли («двугорбая», «трехгорбая», полигональная, «стелящаяся»). Кровоизлияния на поверхности опухоли более характерны для меланомы, чем для метастаза. Обе опухоли могут быть неравномерно пигментированы. Беспигментные опухоли значительно реже встречаются при меланоме, чем пигментированные, в то время как метастазы преимущественно беспигментны. Пигментация на отдельных участках сетчатки над метастазом может быть усилена за счет реактивной пролиферации пигментного эпителия или организации старых кровоизлияний с накоплением на поверхности метастаза гемосидерина [8]. Многофокусность и бинокулярность поражения могут существенно помочь при диагностике, так как многофокусное, так и билатеральное поражение при увеальной меланоме является крайне редким. Ранний отек сетчатки с тенденцией к относительно быстрому слиянию очагов с резким снижением зрения характерны для метастазов. При ультразвуковом исследовании в случае метастатического поражения чаще встречается неправильная форма опухоли, а также преобладание диаметра опухоли над ее высотой. Грибовидная форма очага на глазном дне типична для меланомы, но встречается и при гемангиоме хориоидеи. Экскавация хориоидеи вследствие роста опухоли характерна для меланомы и гемангиомы.
Таким образом, у онкологического пациента с безрецидивным на протяжении 8 лет после радикального лечения рака почки течением, не имеющим отдаленных метастазов, грибовидная кровоточащая опухоль сосудистой оболочки была расценена как проявление первичной множественности опухолей. Между тем гистоиммунохимическим исследованием подтвержден метастаз почечно-клеточного рака. Проведенная операция (энуклеация) может быть расценена как радикальное хирургическое лечение очагового метастаза, что отвечает современным представлениям о лечении одиночных вторичных опухолей.
Литература
- Бровкина А.Ф. Внутриглазные опухоли. Руководство по клинической офтальмологии. – М. МИА, 2014. – 771 с.
- Таджиева З.А. Метастатические опухоли органа зрения (аспекты клиники и лечения): Дис. … канд. мед. наук. М., 1988. – 162 с.
- Augsburger J.J., Guthoff R., Metastatic cancer to the eye // In: Yanoff M and Duker JS. Ophthalmology, 3rd ed. – Mosby, 2008. – P. 906-911.
- Гришина Е.Е., Лернер М.Ю., Федотова О.Ф. О трудностях дифференциальной диагностики метастатических опухолей и первичных меланом хориоидеи // Врач. – 2001. – № 9. – С. 21-22.
- Пармон Я.В., Саакян С.В. Комплексная диагностика метастазов в хориоидею у больных без предшествующего онкологического анамнеза // Голова и шея. – 2013. – Т. 2. – № 9. – С. 7-11.
- Shields J.A. Metastatic tumors to the uvea // Int. Ophalmol. Clin. – 1993. – Vol. 33 (3). – P. 155-161.
- Murray AK, Shields JA Mushroom-shaped choroidal hemangioma // Am. J. Ophthalmol. – 1996. – Vol. 122. – N3. – P.434-436.
- Вит В.В. Опухолевая патология органа зрения. – Одесса: Астропринт, 2009. – Т. 1 – С. 340-342.
Сборник научных трудов «190 лет. Московская глазная больница», Москва, 2016 г.
Метастаз меланомы кожи в сосудистую оболочку глаза
В статье представлены три редких клинических случая метастаза меланомы кожи в сосудистую оболочку глаза. Обследованы три пациентки в возрасте 49, 53 и 67 лет соответственно. У двух обнаружен монокулярный солитарный метастаз хориоидеи через 7 и 45 месяцев после диагностики меланомы кожи ягодицы и стопы соответственно. У третьей пациентки без отягощенного онкологического анамнеза выявлено бинокулярное многофокусное метастатическое поражение сосудистой оболочки глаза. При тщательном осмотре одномоментно обнаружена меланома ягодицы с подкожными метастазами в области шеи и груди. Во всех случаях диагноз метастаза подтвержден комплексом клинико-инструментальных методов исследования, включавших изучение анамнеза, стандартное офтальмологическое обследование, ультразвуковое дуплексное сканирование, флуоресцентную ангиографию и оптическую когерентную томографию.
- КЛЮЧЕВЫЕ СЛОВА: метастаз в сосудистую оболочку глаза, меланома кожи, ультразвуковое дуплексное сканирование, флуоресцентная ангиография, оптическая когерентная томография
В статье представлены три редких клинических случая метастаза меланомы кожи в сосудистую оболочку глаза. Обследованы три пациентки в возрасте 49, 53 и 67 лет соответственно. У двух обнаружен монокулярный солитарный метастаз хориоидеи через 7 и 45 месяцев после диагностики меланомы кожи ягодицы и стопы соответственно. У третьей пациентки без отягощенного онкологического анамнеза выявлено бинокулярное многофокусное метастатическое поражение сосудистой оболочки глаза. При тщательном осмотре одномоментно обнаружена меланома ягодицы с подкожными метастазами в области шеи и груди. Во всех случаях диагноз метастаза подтвержден комплексом клинико-инструментальных методов исследования, включавших изучение анамнеза, стандартное офтальмологическое обследование, ультразвуковое дуплексное сканирование, флуоресцентную ангиографию и оптическую когерентную томографию.
Рис. 2. Эхографическая картина метастаза меланомы кожи в сосудистую оболочку глаза (В-сканирование). Стелющаяся форма опухоли с неровной поверхностью
Рис. 3. Эхографическая картина метастаза меланомы кожи (режим цветового допплеровского картирования). Равномерное распределение цветовых картограмм потоков внутриопухолевых сосудов по всей толщине с перпендикулярным поверхности опухоли расположением. Стре
Рис. 5. Флуоресцентная ангиография. Артериальная фаза. Гипофлуоресценция в зоне очага опухоли (обозначена стрелкой), отсутствие контрастирования собственных сосудов опухоли
Рис. 6. Флуоресцентная ангиография. Поздняя фаза (через 40 минут от начала исследования). Неравномерная гиперфлуоресценция в зоне очага опухоли, мелкофокусная гиперфлуоресценция на поверхности опухоли (обозначена стрелками)
Рис. 7. Томографический скан (оптическая когерентная томография) метастаза меланомы кожи. Неровный хориоидальный профиль в зоне образования, диффузный отек и расслоение нейроэпителия сетчатки над опухолью, серозная отслойка нейроэпителия, интраретинальные
Метастазы меланомы в сосудистую оболочку глаза (хориоидею) составляют примерно 2–3% всех внутриглазных метастазов [1–4]. Метастазы меланомы в орган зрения встречаются, как правило, у пациентов с диссеминированными метастазами в терминальных стадиях болезни. У 90% больных на момент обнаружения метастатического поражения имеются другие дистантные метастазы. Показано, что прижизненная диагностика случаев внутриглазных метастазов меланомы кожи чрезвычайно низка. При аутопсии умерших от меланомы кожи (при жизни не предъявляли глазных жалоб) у 33,3% из них выявлен метастаз в сосудистую оболочку глаза [5].
В литературе описаны единичные случаи метастазов в хориоидею меланомы кожи [6–9], меланомы слизистых оболочек (прямой кишки, пищевода и влагалища) [4, 10, 11] и казуистически редкие случаи метастазов увеальной меланомы в сосудистую оболочку контралатерального глаза [12]. Внутриглазные метастазы кожной меланомы и увеальной меланомы составляют 1,9–4,4% и 0,7–1,2% всех внутриглазных метастазов соответственно [4].
Интервал от момента диагностики первичной опухоли до появления метастаза в сосудистую оболочку глаза значительно варьируется и составляет от двух месяцев до 16 лет (в среднем три года) [2–4, 6–9]. Жизненный прогноз у пациентов с внутриглазными метастазами меланомы кожи неблагоприятный – от одного до девяти месяцев (в среднем семь месяцев) [2–4, 9, 10].
Метастаз в хориоидею необходимо дифференцировать прежде всего от первичной увеальной меланомы. Схожесть клинической картины метастазов в хориоидею и увеальных меланом, особенно при монокулярном солитарном новообразовании и в отсутствие у больного предшествующего онкологического анамнеза, а также высокая частота первично-множественных опухолей у больных увеальной меланомой (УМ) (2–15%) [13, 14]) обусловливают необходимость применения комплекса инструментальных методов исследования.
Морфологические методы исследования играют основную роль в диагностике природы новообразования, дифференцировании первичной опухоли и вторичного поражения. В офтальмоонкологии к хирургической биопсии при внутриглазной опухоли относится энуклеация. У пациентов с метастазами в сосудистую оболочку глаза неблагоприятный жизненный прогноз, а также высокий риск двустороннего поражения (до трети случаев). Энуклеация приводит к значительному ухудшению качества жизни таких пациентов. В связи с этим предпочтительно использование пункционных методов биопсии – тонкоигольной аспирационной биопсии. Однако из-за анатомических особенностей глаза, характера роста и локализации метастазов в хориоидею, риска осложнений, недостаточной эффективности данного метода применение тонкоигольной аспирационной биопсии также ограничено [15]. Не случайно возрастает роль неинвазивных методов исследования.
Материал и методы исследования
Обследованы три пациентки в возрасте 49, 53 и 67 лет с метастазами меланомы кожи в сосудистую оболочку глаза. Всем больным проведено комплексное обследование, включавшее изучение анамнеза жизни, стандартное офтальмологическое и общеклиническое обследование (осмотр пациента, рентгенография органов грудной клетки, ультразвуковое исследование (УЗИ) органов брюшной полости, консультация онколога), ультразвуковое дуплексное сканирование (GE Voluson 730 Pro (Германия)), флуоресцентную ангиографию на фундус-камере Carl Zeiss Jena (Германия), оптическую когерентную томографию на ретиноангиотомографе HRA+OCT (Heidelberg Engineering, Германия).
Результаты и их обсуждение
В Московский научно-исследовательский институт глазных болезней им. Гельмгольца обратились три пациентки с жалобами на снижение зрения на одном глазу, искажение предметов, пелену перед глазом. У двоих в анамнезе хирургическое лечение по поводу меланомы кожи (ягодицы и стопы). Интервал от момента диагностики меланомы кожи до появления глазных жалоб составил 7 и 45 месяцев соответственно. На момент офтальмологического обследования отсутствовали данные о наличии метастазов в другие органы. Третья пациентка без отягощенного онкологического анамнеза.
Схожесть клинической картины с УМ обусловила необходимость определения характера опухоли с помощью дополнительных инструментальных методов исследования (УЗИ, флуоресцентная ангиография, оптическая когерентная томография). Выявление бинокулярного многофокусного поражения у пациентки без отягощенного онкологического анамнеза позволило предположить метастатическую природу внутриглазных новообразований. В связи с этим был проведен полный осмотр пациентки, в результате которого обнаружили меланому кожи ягодицы, подкожные метастазы шеи и груди, а также увеличение подмышечного лимфатического узла на стороне поражения.
Дуплексное сканирование, включавшее двумерную серошкальную эхографию и допплеровские режимы, проведено всем пациенткам (четыре глаза). Проминенция (h) опухоли варьировалась от 2,0 до 3,5 мм, максимальный диаметр основания (d) – от 9,0 до 16,0 мм. Условный показатель соотношения h/d варьировался от 0,14 до 0,39. При обследовании в В-режиме в двух глазах форма опухоли была стелющаяся (в виде полоски) с эхографически неровной поверхностью (рис. 2), в других двух – куполообразная (чечевицеобразная) форма с ровной поверхностью. Эхографический признак экскавации хориоидеи, встречающийся в 70% случаев при УМ [16], не выявлен ни в одном случае. Акустическая плотность исследуемых образований, по данным денситометрических показателей в различных участках образования, определялась как неоднородная и в среднем составила 108,7 усл. ед. При исследовании больных в режиме цветового допплеровского картирования во всех случаях визуализировали признаки внутриопухолевого кровотока. Общим для исследуемых образований явилось равномерное распределение внутриопухолевых сосудов по всей толщине опухоли и ближе к верхушке с расположением цветовых картограмм потоков собственных сосудов опухоли преимущественно перпендикулярно поверхности опухоли (вертикальный ход сосудов) и параллельно друг другу (рис. 3).
Таким образом, основные ультразвуковые признаки характерны для метастазов в сосудистую оболочку глаза: низкий показатель h/d, преимущественно неправильная и стелющаяся форма опухолей с неровным контуром, отсутствие хориоидальной экскавации, относительно высокая акустическая плотность, а также особенности расположения цветовых картограмм потоков внутриопухолевых сосудов [16].
При проведении флуоресцентной ангиографии у данных пациенток зафиксировано отсутствие контрастирования собственных сосудов опухоли, а также гипо- и изофлуоресценция в зоне опухоли в ранние фазы ангиографии (преартериальная, артериальная и артериовенозная фазы) с постепенным нарастанием слабоконтрастной неравномерной гиперфлуоресценции с сохранением стойкой слабоконтрастной гиперфлуоресценции в позднюю фазу (через 40 минут от начала исследования) (рис. 4–6). У всех больных выявлена также мелкофокусная гиперфлуоресценция по типу pinpoint на поверхности и по периферии опухоли. Данные особенности ангиографической картины характерны для метастатического поражения хориоидеи [17].
Проведенная оптическая когерентная томография позволила выявить дополнительные изменения в сетчатке над опухолью, характерные для метастазов в хориоидею [18]: выпуклую деформацию сетчатки с неровным хориоидальным профилем в зоне локализации образования, диффузный отек и расслоение нейроэпителия над опухолью, наличие серозной отслойки нейроэпителия и отслоек ретинального пигментного эпителия над опухолью, а также наличие гиперрефлективных фокусов и суб- и интраретинальных депозитов (рис. 7).
Цитологическая верификация диагноза (тонкоигольная аспирационная биопсия) не была проведена у данных пациенток из-за высокого риска интра- и послеоперационных осложнений и технических сложностей при заборе биоптата, связанных с постэкваториальным расположением опухоли (задний полюс глаза) и недостаточной толщиной опухоли для эффективного забора клеток опухоли.
Таким образом, проведенное обследование, включавшее изучение анамнеза и данные комплексного неинвазивного инструментального исследования, позволило подтвердить во всех случаях метастаз меланомы кожи в сосудистую оболочку глаза. Все пациентки были направлены для дальнейшего обследования и лечения к онкологу.
Применение комплекса клинико-инструментальных неинвазивных методов исследования, а также прицельное изучение анамнеза позволили подтвердить диагноз метастаза меланомы кожи в сосудистую оболочку глаза у трех пациенток. У пациентки без отягощенного онкологического анамнеза при офтальмологическом обследовании подтверждено метастатическое бинокулярное поражение. Проведенный дополнительный общий осмотр позволил одномоментно выявить первичную опухоль.
Ранняя диагностика внутриглазных метастазов дает возможность своевременно выбрать адекватный метод лечения, что влияет на качество и продолжительность жизни больных.
Метастатическое поражение органа зрения
Для цитирования: Гришина Е.Е. Метастатическое поражение органа зрения. Клиническая офтальмология. 2001;2(1):15.
В последние годы наблюдается рост метастатических опухолей органа зрения, что, по всей вероятности, связано с увеличением продолжительности жизни онкологических больных [3]. Есть мнение, что процент прижизненной диагностики внутриглазных метастазов в несколько раз ниже, чем при аутопсийных исследованиях. Так, Eliasi–Rad В. с соавторами (1996 г.) при вскрытии 741 больных, умерших от рака, у 93 (12,6%) обнаружили внутриглазные метастазы [1]. Возможно, и эти данные не отражают частоту метастатического поражения органа зрения, так как далеко не каждый больной, умерший от злокачественной опухоли, подвергается вскрытию, а если вскрытие и производится, то глазное яблоко часто исключается из гистологического исследования, то есть истинная частота метастазов в глаз и орбиту может быть значительно выше. Существует даже точка зрения, что в наши дни метастатический рак хориоидеи является одной из наиболее часто встречающихся внутриглазных опухолей [2]. Последнее утверждение сомнительно, но очевидно, что офтальмологи выявляют далеко не все случаи метастатического поражения органа зрения, и значительная часть бессимптомно протекающих метастазов так и остается не выявленной.
Наиболее частыми первичными опухолями, при которых возникают метастазы в орган зрения, являются рак молочной железы, рак легкого и кожная меланома. С меньшей частотой, но практически все виды опухолей могут метастазировать в глаз и орбиту. По нашим данным, больные с метастазами рака молочной железы составляют 67,5% среди всех пациентов с метастатическим поражением органа зрения. Второе место по частоте метастазирования в глаз и орбиту занимает рак легкого – 14,4%. Совокупность всех остальных первичных опухолей (кожная меланома, рак кишечника, желудка, щитовидной и предстательной желез, матки, яичников и т.д.) составляет 18,1% (табл.).
Следует особо подчеркнуть, что метастатическое поражение органа зрения может быть первым проявлением скрыто протекающей первичной опухоли, что по нашим данным составляет около 11%. это особенно характерно для рака легкого.
Возможность выявления метастаза в орган зрения раньше первичной опухоли обязывает офтальмологов изучать особенности клинического проявления метастатических опухолей. Клиническая картина метастатической опухоли зависит от поражения определенного отдела органа зрения и гистогенеза первичной опухоли.
Метастатические опухоли глаза и орбиты при раке молочной железы, как правило, возникают через 2–4 года с момента диагностики первичной опухоли. Возможно развитие внутриглазного метастаза даже через 10–11 лет с момента диагностики рака молочной железы. При раке легкого и других злокачественных опухолях метастатическое поражение органа зрения развивается значительно раньше: в 77% случаев в течение первого года с момента диагностики первичной опухоли.
Среди метастазов в орган зрения солидных опухолей преобладают внутриглазные опухоли (рис. 1). В основном наблюдается поражение задних отделов сосудистой оболочки – хориоидеи. По нашим данным, метастазы в радужку и цилиарное тело возникают приблизительно в 10 раз реже, чем метастазы в хориоидею.
Метастатические опухоли радужки при раке молочной железы выглядят, как рыхлые белые или желтоватые образования с нечеткими границами, вызывающие в той или иной степени деформацию зрачка (рис. 2). Внешне они напоминают воспалительную гранулему или беспигментную лейомиому, но, в отличие от последних, характеризуются локальным расширением эпибульбарных сосудов на стороне поражения радужки, быстрыми темпами роста опухоли и отсутствием клеточного выпота в стекловидное тело. Метастаз рака легкого выглядит в виде слабо васкуляризированной опухоли с бугристой поверхностью и напоминает беспигментную меланому. Необходимо обратить внимание на то, что на поверхности метастатической опухоли, в отличие от первичных опухолей радужки, как правило, не видно сосудов. Нередко наблюдается многофокусное поражение радужки. Мы наблюдали у одной больной метастаз рака молочной железы в виде узкой полоски желтоватой ткани вдоль всего угла передней камеры, что привело к развитию вторичной некомпенсированной глаукомы. У другой больной метастаз кожной меланомы выглядел в виде диффузной инфильтрации радужки пигментированной тканью с формированием задних синехий. Метастатическое поражение радужки и цилиарного тела в 80% случаев сопровождается развитием вторичной глаукомы или иридоциклитом с “сальными” преципитатами на эндотелии.
Метастатическая опухоль хориоидеи, как правило, характеризуется быстрыми темпами роста и нарастанием симптоматики. Основным симптомом хориоидальных метастазов является снижение остроты зрения. Это обусловлено преимущественной локализацией метастатической опухоли в центральных отделах глазного дна. При отсутствии лечения в случае отказа больных или несвоевременной диагностики хориоидального метастаза у 13 больных мы наблюдали быстрое (в течение 1 месяца) значительное увеличение размеров опухоли и выраженное снижение остроты зрения от 0,8–1,0 до светоощущения.
Следует отметить, что приблизительно у 10% больных метастазы в хориоидею не сопровождаются какими–либо субъективными жалобами и выявляются случайно при осмотре.
На ранних стадиях метастаз в хориоидею выглядит как желтовато–беловатый рыхлый очаг с нечеткими границами. Для хориоидальных метастазов рака молочной железы характерно увеличение опухоли по площади, при незначительном росте в высоту – “стелющаяся опухоль” (рис. 3). При юкстапапиллярной локализации метастатической опухоли ее нередко принимают за переднюю ишемическую нейропатию. По мере роста опухоли появляется вторичная отслойка сетчатки, как правило, с выраженным транссудатом (рис. 4). Отслойка сетчатки возникает не только над опухолью, но и в отдалении от нее. В этих случаях внимательный осмотр всех отделов глазного дна помогает избежать ошибочного диагноза первичной отслойки сетчатки. Метастатическая опухоль бывает похожей на гемангиому хориоидеи, но, в отличие от нее, характеризуется быстрыми темпами роста. При раке легкого, щитовидной железы, кишечника, как правило, формируется умеренно проминирующий узел неправильной формы, нередко “двугорбый” или “трехгорбый”. Узловую форму роста метастатической опухоли при раке легкого или щитовидной железы приходится дифференцировать с беспигментной меланомой хориоидеи. Кровоизлияния на поверхности опухоли, гемофтальм встречаются редко. Кровоизлияние в стекловидное тело затрудняет диагностику, и диагноз метастатического рака хориоидеи устанавливается только при морфологическом исследовании удаленного глаза.
Нередко наблюдается многофокусное поражение хориоидеи. У каждого пятого больного с хориоидальными метастазами выявляется поражение обоих глаз. Учитывая это, необходимо проводить тщательный осмотр обоих глаз с широким зрачком.
При ультразвуковом исследовании метастазов отмечается небольшая плотность опухоли, малая ее проминенция (до 3 мм) при относительно большом диаметре. Мы ни разу не встретили грибовидную форму опухоли и не отметили экскавацию склеры, столь характерную для первичной меланомы хориоидеи.
Для метастазов в орбиту рака молочной железы характерно, как правило, медленное течение. Пристеночное расположение опухоли приводит к смещению глаза в контрлатеральную сторону. Постепенно развивается экзофтальм. Субъективно больных беспокоит диплопия из–за ограничения подвижности глаза. Нередко появляется образование, которое больные сами прощупывают под одной из стенок орбиты. Опухоль, доступная пальпации, имеет, как правило, плотную консистенцию, бугристую поверхность, спаяна с подлежащими тканями. Описанная выше клиническая картина характерна для аденокарциномы или инфильтративного протокового рака молочной железы. Метастаз скиррозной формы рака молочной железы имеет иную клиническую картину. Опухоль – более плотная, быстро прорастает в прилежащие ткани. Очень рано развивается офтальмоплегия в сочетании с энофтальмом. Метастатические опухоли рака желудка, легкого, щитовидной железы характеризуются, как правило, быстрым (в течение 1–2 мес) развитием симптомов, присущих злокачественной опухоли орбиты: появлением экзофтальма, чаще осевого, невоспалительного отека век, хемоза. Нередко развивается застойный диск зрительного нерва с последующим снижением остроты зрения.
Метастатические опухоли придаточного аппарата глаза встречаются крайне редко, и их клинические проявления плохо изучены. На ранних этапах заболевания метастатическое поражение век выглядит, как обычный халязион. У онкологических больных халязионы следует подвергать хирургическому лечению с обязательным направлением удаленного материала на гистологическое исследование. Определяющая роль в диагностике метастаза принадлежит морфологическому исследованию биоптата.
Таким образом, для метастатических опухолей радужки характерны следующие клинические признаки: слабая васкуляризация, возможность многофокусного поражения, быстрые темпы роста и раннее развитие вторичной глаукомы и иридоциклита.
Для хориоидального метастаза типичны небольшая плотность опухолевого узла, относительно маленькая проминенция опухоли при значительном ее диаметре, преимущественная локализация в парамакулярных и парапапиллярных отделах, возможность развития на глазном дне нескольких опухолевых узлов, вовлечение в опухолевый процесс обоих глаз.
При метастатическом поражении тканей орбиты преимущественно развивается безболезненный экзофтальм со смещением глаза. Рано появляются офтальмоплегия и диплопия. Для скирра молочной железы характерно развитие энофтальма в сочетании с офтальмоплегией и затруднением репозиции – “вколоченный глаз”.
Метастатическая опухоль должна быть включена в дифференциально–диагностический ряд заболеваний при обследовании больных с внутриглазной гипертензией, иридоциклитом, при подозрении на вторичную отслойку сетчатки, при синдроме одностороннего экзофтальма.
Знание клинических особенностей метастатических опухолей и тщательно собранный анамнез помогают своевременной диагностике метастатического поражения органа зрения. Ранняя диагностика и своевременное лечение метастатических опухолей позволяют предупредить слепоту и развитие болевого синдрома, обусловленного вторичной глаукомой, и улучшить качество жизни наиболее тяжелой категории онкологических больных с метастатическим поражением органа зрения.
Литература
1. Eliassi–Rad B., Albert D.M., Green W.R. Frequency of ocular metastases in patients dying of cancer in eye bank populations. // Br.J. of Ophthalmol. – 1996. – vol. 80 (2). – р. 125–128.
2. Maran R., Grinbaum A., Ashkenazi I. [Ocular metastatic carcinoma– rare or common?]. // Harefuah. – 1994. – vol. 129 (9). – p. 510–513, 563.
3. McCartney A. Intraocular metastasis. // Br. J. of Ophthalmol. – 1993. – vol. 77. – p.133.
4. Nelson C., Hertzberg B., Klintworth G. A historic study of 716 unselected eyes in patients with cancer of the time of death. // Ann J. Ophthalmol.– 1983. –vol.– 95. – p. 788–793.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Патологическая анатомия метастазов в хориоидею
Современные технологии лечения продлевают жизнь онкологическим больным. Это приводит к тому, что пациенты “доживают” до метастазирования в те органы и системы, которые не вполне типичны для данной патологии.
Особенность поражения ЦНС – крайне неблагоприятный прогноз, который вынуждает клиницистов проводить из-за этого ургентные лечебные мероприятия даже при наличии диссеминации процесса и множественном поражении других органов и тканей. Однако своевременное и многокомпонентное лечение с учетом индивидуальных показаний позволяет продлить жизнь больных на многие месяцы и даже годы. При этом особое значение имеют быстрое установление диагноза и выбор тактики воздействия — лучевой и химиотерапии, таргетных средств и ингибиторов ангиогенеза, а также проведение в случае необходимости хирургического вмешательства.
В настоящее время не разработаны стандарты оказания помощи данной категории пациентов, и лечение проводят эмпирически в зависимости от подготовки и индивидуальных особенностей врача.
При одной только стероидной терапии продолжительность жизни не превышает 2 мес, лучевая терапия увеличивает ее до 5, а комбинация лучевой и химиотерапии позволяет добиться средней выживаемости порядка 6-9 мес. Средняя продолжительность жизни пациентов с высоким индексом Карновского, отсутствием менингеального и экстракраниального распространения, а также с ограниченным, поддающимся противоопухолевой терапии экстрацеребральным процессом может достигать года и более. Показанием к хирургическому вмешательству служат инфратенториальное поражение с признаками атаксии и солитарные метастазы большого объема (особенно кистозного строения), расположенные в гемисфере. При комбинации лучевой терапии с иссечением метастазов улучшаются показатели длительной выживаемости пациентов, что также наблюдают и в случае использования высокодозного прецизионного облучения (гамма- и кибер-нож). При множественных поражениях и необходимости облучения всего объема головного мозга режимы фракционирования не играют существенной роли.
Основной подход при проведении конвенциональной лучевой терапии по поводу метастазов в головном мозге – облучение всего его объема, обычно в ускоренном режиме, хотя рандомизированные исследования в этом направлении продолжаются. До введения этой высокоэффективной методики лучевой терапии в повседневную клиническую практику на рубеже 50-х годов ХХ в. медиана выживаемости данного контингента пациентов не превышала 1-2 мес. В большинстве ситуаций для профилактики отека в течение первых нескольких суток облучения необходимо назначение дексаметазона по 12-30 мг с последующим резким снижением дозы вдвое.
Используют два боковых противолежащих поля. Особое внимание обращают на адекватность включения в объем воздействия основания черепа и задней черепной ямки. При этом либо экранируют глаза, либо разворачивают поля в соответствии с проекцией основания черепа таким образом, чтобы нижние границы располагались на уровне II шейного позвонка Разовая очаговая доза может составлять от 2,5 до 4-5 Гр, суммарная – 20-35 Гр. Расчет проводят на срединную плоскость. Как правило, наблюдают выраженный регресс метастазов и купирование неврологической симптоматики. При этом в соответствии с рекомендациями МАГАТЭ практикуют увеличение РОД до 4 Гр с точки зрения экономической целесообразности, поскольку режимы фракционирования существенно не влияют на отдаленный прогноз. Следует учитывать, что существенно ускоренное фракционирование, в отличие от традиционного подведения дозы 30 Гр за 10 сеансов, может сопровождаться повышенным риском возникновения новых внутримозговых метастазов ввиду меньшей суммарной физической поглощенной дозы. Однако стандартным подходом в большинстве клиник остается ежедневное облучение всего объема головного мозга в дозе от 3 до 30-33 Гр. Боязнь отдаленных осложнений данного вида лечения часто оказывается гипертрофированной с учетом ожидаемой продолжительности жизни пациентов. Нарушение когнитивных функций у больных при тотальном облучении головного мозга отмечают сразу же после начала лучевой терапии. Это сохраняется после окончания лечения, однако оно ограничено лишь вербальной памятью и не должно служить поводом для отказа от лечения.
В случае стереотаксического лучевого воздействия проводят однократное облучение метастазов в дозе 20-30 Гр. Показания к этому методу – ограниченное количество депозитов (не более 5-10), максимальный их размер не более 3-4 см, отсутствие выраженного масс-эффекта и окклюзионной гидроцефалии. В определенном смысле стереотаксическое облучение конкурирует с оперативным вмешательством при комбинации этих методик с тотальным облучением головного мозга. Наилучших результатов при стереотаксической радиохирургии добиваются в случае небольших очагов, чей диаметр не превышает 1,5-2 см. При этом увеличение отступов от края опухоли свыше 1 мм не ведет к повышению эффективности облучения. Подобную тактику можно использовать даже при увеличении числа метастазов и их локализации в жизненно важных зонах – стволе головного мозга и кавернозном синусе. Медиана выживаемости при облучении на гамма-ноже варьирует от 5-6 мес при метастазах меланомы до года и более в случае почечно-клеточного рака. Очаговое поражение головного мозга без первично выявленной опухоли сопровождается наихудшими результатами лечения, выживаемость не превышает 3 мес. Однако при отсутствии экстракраниальных метастазов и проведении системной химиотерапии иногда добиваются приемлемых показателей. В некоторых центрах хирургическое удаление метастазов сопровождается установкой в послеоперационную полость системы с радиоактивным йодом-125 (GliaSite) или губки с химиопрепаратами (нитрозомочевиной, антрациклинами). При этом весьма перспективной представляют комбинацию данных методик с тотальным облучением головного мозга. Дополнение облучения всего объема головного мозга стереотаксической радиохирургией и/или операцией позволяет увеличить медиану выживаемости в 1,5-2 раза. Однако исследователи не прекращают споры о целесообразности комбинации послеоперационного стереотаксического облучения с тотальным воздействием на головной мозг. Комбинация стереотаксического и тотального облучения головного мозга не очень влияет на выживаемость пациентов по сравнению с одним лишь локальным воздействием, однако частота обнаружения новых очагов снижается примерно в 1,5 раза. Тотальное облучение головного мозга – адекватный метод как самостоятельного лечения метастатического поражения ЦНС, так и в комбинации со стереотаксическим облучением. Оно в первую очередь показано при множественных очагах поражения и неудовлетворительном общем состоянии больного. В случае резекции одиночных метастазов или радиохирургического вмешательства тотальное краниальное облучение служит разумным дополнением в большинстве клинических ситуаций.
Облучение пациентов с метастатическим поражением спинного мозга и/или позвоночника с переходом на нервные структуры осуществляют по тем же принципам. Обычно применяют заднее прямое вертебральное поле или два паравертебральных под углами с захватом поперечных отростков позвонков и отступами от границ поражения в краниокаудальном направлении порядка 2 см. Лучевую терапию проводят в ускоренном режиме – 3 Гр×10 раз, 4-5 Гр×4-5 раз ежедневно или (в амбулаторном режиме) 2-3 сеанса в 1 неделю. Так как разработаны экономически оправданные режимы фракционирования при метастазах в кости, отчетливо прослеживают тенденцию к однократному облучению спинного мозга в разовой поглощенной дозе 8 Гр. При этом его эффективность по критерию купирования и предупреждения болевого и неврологических (компрессия спинного мозга) синдромов не отличается от фракционированного. В случае необходимости возможно повторное воздействие. Изменение тактики лечения данного неблагоприятного контингента пациентов с использованием комбинации методов привело к увеличению средней продолжительности жизни до 1,5-2 лет и более при относительно торпидном течении основного заболевания. В настоящее время врачи общей лечебной практики должны рассматривать больных с метастатическим поражением головного мозга как подлежащих активному лечению, а не только симптоматической медикаментозной лучевой терапии.
Версия для слабовидящих Карта сайта
Меланома вульвы
Меланома вульвы – злокачественная опухоль, происходящая из меланоцитов и располагающаяся в области больших половых губ, клитора или малых половых губ. Проявляется зудом, ощущением жжения, болью, неприятным запахом, увеличением паховых лимфатических узлов, дизурическими нарушениями или дискомфортом при мочеиспускании. В области поражения пальпируется объемное образование. При изъязвлении опухоли возникают кровотечения. Диагноз устанавливается на основании клинических симптомов, данных осмотра и дополнительных исследований. Лечение – хирургическое вмешательство, химиотерапия, иммунотерапия.
Общие сведения
Патологическая анатомия меланомы вульвы
Данные о частоте поражения различных областей вульвы разнятся. Одни специалисты утверждают, что в 50% случаев меланома вульвы располагается в области больших половых губ, а на зоны клитора и малых половых губ приходится по 25% от общего количества опухолей. Другие полагают, что заболевание чаще поражает клитор и малые половые губы. Информация о происхождении опухоли также противоречива. Общепризнанным является факт, что меланома вульвы чаще развивается из меланоцитов на неизмененном участке кожи. При этом мнения о вероятности перерождения невусов расходятся.
Одни онкологи говорят, что каждая четвертая меланома вульвы возникает на месте пигментного, пограничного или смешанного невуса, что указывает на необходимость онкологической настороженности в отношении пигментных образований данной области. Другие считают, что злокачественное перерождение невусов области вульвы встречается крайне редко. Внешне меланома может напоминать полип или узелок, выступающий над поверхностью кожи. В 5% случаев обнаруживается язвенная поверхность.
Две трети меланом вульвы пигментированы, остальные лишены пигментации. Каждая пятая опухоль окружена сателлитными узелками – мелкими опухолевидными образованиями, напоминающими просяные зерна. Метастазы в регионарные лимфоузлы выявляются у 24-74% больных. Несмотря на одностороннюю локализацию опухоли, у некоторых пациенток наблюдается двухстороннее поражение пахово-бедренных узлов. Возможно гематогенное метастазирование при отсутствии метастазов в регионарные лимфатические узлы. Обычно меланома вульвы метастазирует в печень и легкие, реже – в кости, надпочечники, почки и мозг. Не исключается поражение других органов и тканей.
Классификация меланом вульвы
С учетом гистологических особенностей различают три формы меланомы вульвы: поверхностную (4%), узловую (20%) и слизистую лентигиозную (52%). У 24% больных выявляются смешанные неклассифицируемые формы. Слизистая лентигиозная форма поражает преимущественно преддверие влагалища и область клитора. Поверхностная и слизистая лентигиозная меланомы вульвы растут как горизонтально, так и вертикально, узловая меланома – преимущественно вертикально. Последний тип опухоли быстро проникает глубоко в подлежащие ткани и имеет самый неблагоприятный прогноз.
Одним из основных прогностических критериев меланомы вульвы является глубина инвазии, поэтому специалисты широко используют классификацию Кларка, составленную с учетом данного показателя:
- 1 уровень – новообразование не выходит за пределы эпидермиса. Метастазы при неинвазивной опухоли отсутствуют.
- 2 уровень – злокачественные клетки проникают в сосочковый слой дермы на глубину не более 1 мм. Метастазы при данном уровне инвазии выявляются у 5% пациентов.
- 3 уровень – меланома вульвы прорастает сосочковый слой дермы на глубину 1,1-2 мм. Метастазы при этом уровне инвазии обнаруживаются у 50% больных.
- 4 уровень – новообразование проникает в ретикулярный слой дермы.
- 5 уровень – меланома выходит за пределы кожи и прорастает подкожную жировую клетчатку.
С учетом клеточного состава выделяют четыре типа меланом вульвы: веретенообразные, эпителиоидные, полиморфные и напоминающие невус. Около четверти опухолей не классифицируются по определенному типу.
Симптомы меланомы вульвы
Пациентки могут предъявлять жалобы на боли, зуд, ощущение жжения или раздражения. Возможно увеличение паховых лимфоузлов, неприятный запах, нарушения мочеиспускания или дискомфорт при мочеиспускании. При изъязвлении меланомы вульвы появляются скудные мажущие кровянистые или сукровичные выделения. Некоторым пациенткам удается рассмотреть пигментированный или обесцвеченный участок кожи либо прощупать опухолевидное образование в области наружных половых органов.
Меланомы вульвы, возникшие в области неизмененной кожи, как правило, вызывают большую онкологическую настороженность по сравнению с малигнизированными врожденными или приобретенными пигментными невусами. Существует ряд признаков, облегчающих распознавание злокачественного перерождения таких невусов. Подозрение на меланому вульвы должно возникнуть при быстром росте и увеличении плотности невуса, потемнении или депигментации невуса, очаге гиперемии вокруг пигментного образования, изъязвлении, кровоточивости или трещинах на поверхности невуса, появлении сателлитных узелков и папилломатозных выростов, а также увеличении регионарных лимфоузлов.
Диагностика и лечение меланомы вульвы
Диагноз устанавливается на основании жалоб, данных общего и гинекологического осмотра и результатов гистологического исследования. Биопсия при меланоме вульвы категорически противопоказана из-за опасности распространения процесса при проведении любых инвазивных процедур. Основным способом забора образцов является снятие мазков-отпечатков. Для выявления отдаленных метастазов больных с меланомой вульвы направляют на УЗИ печени, рентгенографию грудной клетки, сцинтиграфию и рентгенографию костей, УЗИ надпочечников, КТ надпочечников, МРТ головного мозга, КТ головного мозга и другие исследования.
Тактику лечения определяют с учетом распространенности процесса. При меланомах вульвы толщиной менее 0,75 мм осуществляют хирургическое иссечение новообразования с 1 см окружающих неизмененных тканей на поверхности и 1-2 см – в глубине. При новообразованиях толщиной 0,75-2 мм объем иссекаемых здоровых тканей увеличивают до 3 и более см. При меланомах вульвы, окруженных сателлитными узелками, объем иссекаемых тканей измеряют от края наиболее удаленного сателлита. Затем проводят срочное интраоперационное гистологическое исследование. При выявлении злокачественных клеток в крае иссеченных тканей объем хирургического вмешательства увеличивают.
При наличии метастазов в регионарные лимфатические узлы осуществляют пахово-бедренную лимфаденэктомию. При меланомах вульвы без признаков метастазирования тактику определяют индивидуально. Специалисты указывают на высокую вероятность развития регионарных микрометастазов (при отсутствии клинических признаков злокачественные клетки в пахово-бедренных лимфоузлах выявляются у 25-50% пациентов). С учетом этого, в сомнительных случаях профилактическую лимфаденэктомию проводят даже при внешне неизмененных лимфатических узлах. В послеоперационном периоде назначают химиотерапию опухоли и иммунохимиотерапию. При генерализации процесса хирургическое вмешательство не показано, используется полихимиотерапия и иммунотерапия.
Меланома вульвы является крайне злокачественным новообразованием с высокой склонностью к метастазированию. Прогноз неблагоприятный за исключением опухолей, не выходящих за пределы эпидермиса. Суммарная пятилетняя выживаемость составляет 21,7-54%. Более чем в половине случаев продолжительность жизни больных меланомой вульвы не превышает 2 лет с момента постановки диагноза. Отмечается высокая склонность к рецидивированию, частота рецидивов не зависит от тактики лечения первичной опухоли.
Читайте также:
