Печеночная энцефалопатия. Причины печеночной энцефалопатии.
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Какие клинические симптомы позволяют диагностировать ПЭ? Каковы проявления неврологических нарушений на разных стадиях развития ПЭ? В чем заключаются особенности развития ПЭ при алкоголизме? Каких ошибок должен избежать врач при лечении ПЭ?
Какие клинические симптомы позволяют диагностировать ПЭ?
Каковы проявления неврологических нарушений на разных стадиях развития ПЭ?
В чем заключаются особенности развития ПЭ при алкоголизме?
Каких ошибок должен избежать врач при лечении ПЭ?
Этиология и патогенез
Печеночная энцефалопатия (ПЭ) представляет собой потенциально обратимое расстройство нервной и психической деятельности, возникающее при любом из заболеваний печени, протекающем с недостаточностью печеночно-клеточной функции. В большинстве случаев ПЭ осложняет течение терминальной стадии хронических диффузных заболеваний печени или острого некротизирующего (фульминантного) гепатита. Установлено, что при поражении печени любой этиологии ПЭ может привести к развитию комы и стать непосредственной причиной смерти пациента (см. таблицу 1).
Патогенез ПЭ не до конца установлен. Считается, что развитие ПЭ является результатом сочетанного влияния на ЦНС нескольких механизмов, активность которых инициируется и поддерживается выраженным нарушением печеночного клиренса токсинов и метаболитов (см. рисунок 1). Наиболее существенным для развития ПЭ считают:
- быстро нарастающее увеличение концентрации аммиака в плазме;
- увеличение плазменной концентрации и нарушение баланса между синтезом и катаболизмом нейротрансмиттеров и их предшественников в ЦНС.
Клинические симптомы и диагноз ПЭ. Тип и количество избыточных, «токсических» метаболитов, циркулирующих в плазме и ЦНС, в той или иной степени коррелируют с различными симптомами ПЭ, к числу которых относят:
Механизм развития ПЭ
К ранним признакам нарушений сознания (НС) при ПЭ относят уменьшение спонтанных движений, фиксированный взгляд, заторможенность, апатию. Для нарушения сознания при ПЭ в принципе характерны сонливость и инверсия нормального ритма сна и бодрствования. При этом ухудшение состояния и переход сонливости в кому могут произойти в течение очень короткого времени. Для определения степени НС нередко применяют шкалу Глазго (см. таблицу 2). Однако в клинической практике для оценки глубины НС именно при ПЭ используют более простую качественную шкалу, в соответствии с которой:
- для I стадии НС характерны ослабление концентрации внимания, эйфория и тревожность;
- для II стадии характерны появление сонливости, дезориентация, изменения личности и неадекватное поведение;
- на III стадии НС развиваются ступор, гиперсомния и спутанность сознания, однако больной может выполнять простые команды и произносить слова членораздельно;
- при IV степени НС пациент впадает в кому и контакт с ним оказывается невозможен.
Неврологические нарушения при ПЭ в целом не носят специфического характера и могут также развиваться при уремии, выраженной дыхательной и сердечной недостаточности. Однако одним из наиболее патогномоничных неврологических симптомов ПЭ считают развитие «хлопающего» тремора (астериксиса), отличительной чертой которого является неспособность пациента удерживать фиксированную позу. Наибольшая выраженность гиперкинеза мышц конечностей при поддержании постоянной позы и его уменьшение при движении позволяют дифференцировать астериксис от тремора при алкогольном делирии и нейроэнцефалопатии.
Наиболее надежным способом определить степень нарушений интеллекта при ПЭ является проведение теста связывания чисел (тест Рейтана). Изменения личности и интеллекта при ПЭ наиболее трудны для диагностики, поскольку всегда накладываются на конституциональные, приобретенные ранее нарушения и всегда требуют оценки в динамике. Наибольшие трудности в клинической практике встречаются при дифференциальной диагностике ПЭ и нарушений личности, развивающихся при хроническом злоупотреблении алкоголем (токсическая или алкогольная энцефалопатия, наличие которой прямо не влияет на исход острой ПЭ, однако определяет риск развития делирия на фоне алкогольного абстинентного синдрома). Важно, что при алкоголизме острая ПЭ может развиться при любой из клинико-морфологических форм алкогольной болезни печени (см. рисунок 2).
ПЭ у больных алкоголизмом в целом имеет те же характерные признаки, что и в остальных случаях, однако у них часто наблюдается мышечная ригидность, гиперрефлексия, клонус стоп. Алкогольный делирий отличается от «чистой» ПЭ продолжительным двигательным возбуждением, повышенной активностью вегетативной нервной системы, бессонницей, устрашающими галлюцинациями и быстрым мелким тремором (см. таблицу 3). Часто наблюдается выраженная анорексия, сопровождающаяся тошнотой и рвотой.
- Сонливость
- Расстройства сна
- Инверсия ритма сна
- Невнятная речь, дисфазия
- «Хлопающий» тремор (выражен в покое и минимален при движениях)
- Спутанность сознания
- Повышение мышечного тонуса глубоких сухожильных рефлексов
- Повышение аппетита
- Повышение активности ВНС
- Двигательное и психическое возбуждение
- Бессонница
- Галлюцинации
- Тремор, исчезающий в покое и нарастающий при движении
- Анорексия
Характерной особенностью ПЭ является изменчивость клинической картины. Диагностировать ПЭ легко, например, у больного с циррозом печени,
с массивным желудочно-кишечным кровотечением или сепсисом, при обследовании которого определяют спутанность сознания и хлопающий тремор. В случае, когда очевидных причин ухудшения состояния выявить не удается и признаков цирроза печени также нет, распознать начало ПЭ невозможно, если не придать должного значения малозаметным признакам синдрома. Большое значение при этом могут иметь данные анамнеза, полученные от членов семьи, заметивших изменения в состоянии или поведении больного.
У больных с острой ПЭ без признаков хронической портальной гипертензии (варикозные вены передней стенки живота, отечно-асцитический синдром, спленомегалия, заболевание печени или алкоголизм в анамнезе) диагностика на догоспитальном этапе особенно затруднена. В этих случаях она должна базироваться, во-первых, на тщательном изучении анамнеза, если это возможно; во-вторых — на анализе эффективности применения стандартной неспецифической терапии комы. Дифференциальный диагноз у больных без цирроза печени необходимо проводить с рядом заболеваний, приводящих к внезапному и выраженному нарушению сознания (см. таблицу 4).
У больных циррозом печени и активным портосистемным шунтированием важнейшим вопросом диагностики также является определение причин, приведших к развитию ПЭ (см. таблицу 5).
- нарушения электролитного баланса (прием диуретиков, массивная рвота, выраженная диарея)
- длительное голодание
- прекращение приема алкоголя (абстинентный синдром)
- массивный лапароцентез
- из варикозных вен пищевода и желудка
- из острых гастродуоденальных язв (печеночная портальная гастропатия)
- при синдроме Мэллори-Вейсса
- при хирургическом пособии или травме
- острый алкогольный эксцесс
- прием опиатов, бензодиазепинов, барбитуратов
- cпонтанный бактериальный перитонит
- инфекции мочевыводящих путей
- бронхолегочная инфекция
В большинстве случаев любой из перечисленных выше факторов либо напрямую подавляет функции ЦНС, либо нарушает их опосредованно — угнетая функцию печени, увеличивая концентрацию азотсодержащих продуктов в кишечнике и количество крови, протекающей, минуя печень, через портокавальные анастомозы.
Лабораторные данные занимают довольно скромное место в диагностике ПЭ. Известно, что ни функциональные печеночные пробы, ни повышенная концентрация аммиака в плазме прямо не коррелируют с выраженностью нарушений сознания.
Лечение ПЭ
Лечение ПЭ преследует три базовые цели:
- выявление и немедленное устранение факторов, провоцирующих ПЭ;
- уменьшение количества аммиака и других токсинов, образующихся в кишечнике в процессе пищеварения и жизнедеятельности микробной флоры;
- нормализацию обмена нейромедиаторов.
Схематично лечение ПЭ (III и IV стадии) представлено в таблице 6.
- Поддержание калорийности рациона на уровне 2000 ккал/сут
- Поддержание водно-электролитного баланса:
- контроль гиповолемии: для коррекции гиповолемии под контролем ЦВД вводить 5-или 10-процентный р-р глюкозы или альбумина, а не изотонический р-р;
- коррекция гипокалиемии до уровня выше 3,5 ммоль/л;
- отмена диуретиков.
Объем лечебных мероприятий при ПЭ относится к числу стандартных и выверенных клинической практикой алгоритмов неотложной помощи, поскольку эффективность лечения прямо зависит от как можно более раннего начала терапии. В этом смысле фармакотерапия ПЭ прямо относится к презумпции скорой медицинской помощи. Тем не менее на практике оказывается, что пациенты с ПЭ, как на догоспитальном этапе, так и в условиях стационара, нередко не получают адекватного лечения. Более того, во многих случаях больным назначают фармакотерапию, которая способна спровоцировать ухудшение состояния сознания и нарушение вегетативных функций. К числу наиболее распространенных ошибок лечения можно отнести:
- недостаточную инфузию концентрированных растворов глюкозы, обладающих помимо энергонесущей активности также ярким осмотическим действием, что важно при угрожающем отеке мозга;
- необоснованное и неконтролируемое введение изотонического и других неконцентрированных полиионных растворов, что влечет за собой прямую угрозу развития отека мозга и легких;
- недооценку важности планового назначения осмотических слабительных и экстренной очистки кишечника высокими осмотическими клизмами (эффективно уменьшают всасывание аммиака в кишечнике и его бактериальную контаминацию, способствуют снижению портального давления);
- недооценку опасности диуретической терапии, массивного лапароцентеза и назначения седативных средств в отношении углубления стадии ПЭ.
Одной из наиболее существенных причин проведения неадекватного лечения нередко является часто неудовлетворительная диагностика ПЭ. Как ни парадоксально, сегодня во всех звеньях здравоохранения на фоне реально существующих регламентирующих врачебную деятельность документов выявление и точная квалификация ПЭ как угрожающего жизни осложнения основного заболевания печени в значительной степени утратила практический смысл. Например, при алкогольной болезни печени и в практике СМП, и в стационаре ПЭ нередко вообще не диагностируется, поскольку включена в редко используемые рубрики «острая или подострая печеночная недостаточность», «острый гепатит», «острое отравление алкоголем» или «абстинентное состояние». В подавляющем большинстве случаев при выявлении алкогольной болезни печени с нарушением сознания на практике ставятся диагнозы, соответствующие рубрикам К.70.0 — К.70.2, что нисколько в случае с ПЭ не отражает реального положения дел (см. таблицу 7). Кроме того, термин «ПЭ» при диагностике часто подменяется термином «токсическая (алкогольная) энцефалопатия», что влечет за собой недооценку тяжести состояния больного и риска летального исхода и позднее начало специфического лечения.
- К 70.0: алкогольная жировая дистрофия печени
- К 70.1: алкогольный гепатит
- К 70.2: алкогольный фиброз/склероз печени
- К 71: токсические поражения печени:
- 71.0 — с холестазом
- 71.1 — с некрозом
- 71.2 — по типу острого гепатита
- 71.5 — по типу хронического гепатита
- 71.7 — с фиброзом и циррозом печени
- К 72.0: острая и подострая печеночная недостаточность
- К 71.1: хроническая печеночная недостаточность
- К 76.6: портальная гипертензия
- G 31.2: дегенерация ЦНС, вызванная алкоголем
- G 61.1: алкогольная полинейропатия
- F 10.0: острое отравление, вызванное употреблением алкоголя
- F 10.3: абсистентное состояние, вызванное употреблением алкоголя
- F 10.4: абсистентное состояние с делирием, вызванное употреблением алкоголя
- F 10.2: хронический алкоголизм (алкогольная зависимость)
При выявлении ПЭ на догоспитальном этапе пациенты с III и IV стадиями нарушения сознания должны быть немедленно госпитализированы в отделение интенсивной терапии.
Прогноз ПЭ
Прогноз ПЭ всецело зависит от выраженности печеночно-клеточной недостаточности и времени начала лечения. При циррозе печени у больных с относительно сохранной функцией паренхимы и интенсивным коллатеральным кровообращением прогноз лучше, а у больных с острым гепатитом — хуже. Прогноз существенно улучшается, если удается быстро устранить факторы, ведущие к усугублению ПЭ: инфекцию, передозировку диуретиков или кровопотерю. Однако наиболее эффективным способом улучшить прогноз является как можно более точная диагностика и раннее начало лечения ПЭ.
Энцефалопатия Вернике - симптомы и лечение
Что такое энцефалопатия Вернике? Причины возникновения, диагностику и методы лечения разберем в статье доктора Абдусаламовой Саиды Мусаевны, невролога со стажем в 8 лет.
Над статьей доктора Абдусаламовой Саиды Мусаевны работали литературный редактор Вера Васина , научный редактор Роман Люкманов и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Энцефалопатия Вернике (Wernicke encephalopathy) — это неврологическое заболевание, вызванное дефицитом тиамина, или витамина В1. При болезни нарушается память, зрение, равновесие и походка [1] . В эмоциональном плане может преобладать эйфория или, наоборот, безразличие и вялость.
Энцефалопатию Вернике и синдром Корсакова объединяют в синдром Вернике — Корсакова. Эти патологии представляют собой различные стадии заболевания:
- энцефалопатия Вернике — острый синдром, требующий экстренного лечения;
- синдром Корсакова — хроническое неврологическое состояние, которое обычно возникает как следствие энцефалопатии Вернике.
Острая энцефалопатия была описана немецким психоневропатологом Карлом Вернике в 1881 году. Он отмечал спутанность сознания, паралич глазных мышц и нарушение походки у пациентов. Эти симптомы Вернике связал с результатами вскрытия, обнаружив точечные кровоизлияния в головном мозге. Одновременно с ним это состояние описал французский офтальмолог Шарль Гайе, поэтому заболевание ещё называют синдромом Гайе — Вернике.
![Признаки энцефалопатии Вернике на снимке МРТ [22]]()
Несколько лет спустя русский психиатр Сергей Корсаков описал хронический амнестический синдром, при котором пациенты не запоминали текущие события, но могли помнить прошлый опыт, осознанно воспринимать новые ситуации и обучаться на базе полученных когда-то знаний, т. е. их интеллект был почти в норме.
Распространённость
Среди людей в возрасте 30–70 лет синдром Вернике — Корсакова встречается примерно в 2 % случаев. В группу риска входят пожилые пациенты, бездомные и психические больные [19] [20] . Среди тех, кто умер от употребления алкоголя, признаки заболевания выявляют у 29–59 % пациентов [5] [6] .
Факторы риска энцефалопатии Вернике
- ; и другие расстройства пищевого поведения[9] ;
- тяжёлый токсикоз беременных[10][11] ;
- операции на желудочно-кишечном тракте, особенно для лечения ожирения[12][15] ;
- рак с метастазами и химиотерапия [19] ;
- трансплантация органов;
- гемодиализ или перитонеальный диализ;
- СПИД;
- наследственная предрасположенность [20] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы энцефалопатии Вернике
Самый распространённый признак энцефалопатии Вернике — это нарушение памяти. Особенно страдает кратковременная память, из-за чего пациенты не могут запомнить ничего нового. Иногда пропадает долговременная память, и в редких случаях пробелы в воспоминаниях заполняются событиями, которые на самом деле не происходили. Также появляется безразличие и невнимательность, становится сложно концентрироваться и нарушается ориентация в пространстве [1] [20] . У некоторых пациентов из-за прекращения приёма алкоголя развивается делирий. Сознание при энцефалопатии угнетено меньше чем у 5 % пациентов, но без лечения болезнь может прогрессировать до ступора, комы и смерти [1] .
Другой типичный симптом энцефалопатии Вернике — это нарушение осанки, равновесия и походки. При тяжёлом течении пациенты не могут ходить совсем. В более лёгких случаях они передвигаются медленно короткими шагами.
Третий характерный симптом — это нарушение движения глаз. Может возникать нистагм и паралич мышц глаза. Нистагм — это неконтролируемые ритмичные движения глаз. Обычно при энцефалопатии он возникает при взгляде вправо, влево или наверх [1] . Паралич глазных мышц практически всегда двусторонний, т. е пациент не может отвести глаза ни вправо, ни влево. Кроме того, зрачки либо не сразу сужаются от прямого потока света, либо один из них не сужается совсем. На тяжёлых стадиях болезни движение глаз и реакция зрачков утрачиваются полностью. В редких случаях возникает птоз века.
Симптомы могут появиться одновременно, но чаще сперва нарушается координация движений, а через несколько дней или недель развиваются остальные признаки болезни [1] . Также при энцефалопатии Вернике может снижаться вес и возникать слабость, боль и ощущение покалывания в ногах [1] .
К редким симптомам энцефалопатии Вернике относятся гипотензия, обморок и пониженная температура тела, при которой могут нарушаться реакция зрачков [12] .
Патогенез энцефалопатии Вернике
Основная причина синдрома Вернике — Корсакова — это дефицит тиамина.
К такому дефициту приводит:
- Недостаточное потребление тиамина с пищей. Взрослому человеку в сутки требуется 1–2 мг этого витамина. Его запасы в организме составляют 30–50 мг, поэтому резервы могут истощиться за несколько недель. Люди, злоупотребляющие алкоголем, часто заменяют пищу спиртным, из-за чего не потребляют достаточно тиамина.
- Нарушение кишечного всасывания тиамина. Алкоголь повреждает слизистую оболочку кишечника и подавляет механизм, ответственный за всасывание тиамина в кишечном тракте.
- Ухудшение способности печени накапливать запасы витамина. Эта способность снижается при регулярном употреблении алкоголя [17] .
- Угнетение процессов фосфорилирования — замещения атома водорода в молекулах химических соединений остатками кислот фосфора. Всасываясь из кишечника, тиамин фосфорилируется и превращается в тиаминпирофосфат — свою активную форму. Чрезмерное употребление алкоголя замедляет эти процессы.
Потребность в тиамине повышается при физической нагрузке, нервно-психическом напряжении, в холодном климате (нужно на 30–50 % больше тиамина) и при высоком содержании углеводов в рационе. Также больше тиамина требуется при беременности и кормлении грудью, желудочно-кишечных заболеваниях (особенно, если они сопровождаются поносом), лечении антибиотиками, сахарном диабете, острых и хронических инфекциях.
Недостаток тиамина приводит к поражению периферических нервов и различных мозговых структур: сосцевидного тела, таламуса, мозжечка, голубого пятна, центрального серого вещества среднего мозга, ядер глазодвигательных нервов и вестибулярных ядер. Реже повреждаются холмики, своды, области перегородки, гиппокамп и кора головного мозга [1] .
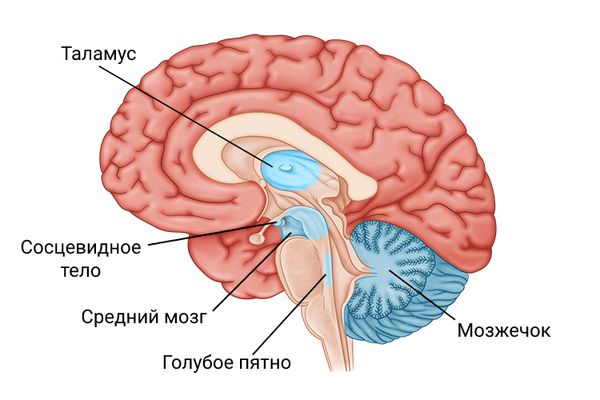
Примерно в половине случаев при вскрытии наблюдается потеря клеток Пуркинье — нейронов коры мозжечка. Последние изменения схожи с теми, которые обнаруживаются при алкогольном повреждении мозжечка. Они могут возникать и без других поражений Вернике. Таким образом, при алкоголизме в принципе повреждаются многие структуры головного мозга, а дефицит тиамина усугубляет это и приводит к развитию энцефалопатии Вернике.
Классификация и стадии развития энцефалопатии Вернике
Варианты дебюта острой энцефалопатии Вернике:
- Заболевание начинается с психического расстройства — нарушается сон, появляются зрительные и слуховые галлюцинации, возникает психомоторное возбуждение и тревога.
- Сперва появляются судороги — подёргивание языка, губ, глаз и мышц лица. Может возникать паралич глазных мышц, слабость мышц затылка и общее снижение мышечной силы.
- Возникают соматические расстройства — симптомы воспаления поджелудочной железы, печени, желчного пузыря и пищевого отравления: сухость кожи и языка, вздутие живота, жидкий стул, тахикардия , гипотензия с частыми случаями резкого падения артериального давления и обмороками.
- Развивается острое инфекционное заболевание — начинается как ОРЗ, может быть подозрение на менингит, температура повышается до 40–41 °C, пациент выглядит истощённым, появляется желтушность белков глаз, кожа бледная с синеватыми прожилками или синюшная, дыхание неглубокое и учащённое. Из-за нарушений иммунитета почти неизбежно развивается пневмония[2] .
Стадии развития энцефалопатии Верники
- Появляется сонливость или возбуждение, тяжело засыпать, сон становится беспокойный, с ранними и частыми пробуждениями, снятся кошмары.
- Снижается аппетит, появляется отвращение к жирной и богатой белками пище, возникает рвота, тошнота и астения.
- Нарушается память, ухудшается восприятие информации, возникают бредовые расстройства и ложные воспоминания.
- Появляются зрительные галлюцинации, которые сочетаются со сложными повторяющимися движениями.
- Возникают эпилептические припадки.
- Нарушается сознание — возникает оглушение (нарушение ориентации в пространстве, сильная сонливость, замедление речи и движений), сопор и кома [1] .
Осложнения энцефалопатии Вернике
Энцефалопатия Вернике может привести к смерти — на запущенных стадиях болезни погибает 10–20 % пациентов [20] . Чаще всего cмepть наступает из-за сопутствующих патологий, вызванных алкоголизмом: пневмонии, туберкулёза лёгких, печёночной недостаточности и септицемии (сепсиса без гнойных метастазов).
В части случаев может развиться корсаковской психоз, психоорганический или псевдопаралитический синдром. Для этих патологий характерно снижение памяти и сообразительности, ослабление воли, неустойчивость настроения, снижение трудоспособности, эйфорическое настроение и бред величия. Если заболевание не лечить, со временем развивается сопор, кома и пациент погибает.
Диагностика энцефалопатии Вернике
Лабораторные и инструментальные методы могут быть полезны для подтверждения энцефалопатии Вернике, но в первую очередь её диагностируют по симптомам.
Осмотр
При осмотре врач обращает внимание на следующие признаки:
- нарушение питания, из-за чего снижается вес, эластичность кожи и деформируются ногти;
- вегетативная дисфункция, при которой понижено давление, учащается сердцебиение и повышается потливость;
- нарушение движений глаз;
- расстройство сознания и координации движений.
Диагноз энцефалопатии Вернике среди пациентов, страдающих алкоголизмом, ставится при наличии двух признаков из четырёх.
Лабораторные исследования
Лабораторных исследований, которые позволяли бы достоверно определить энцефалопатию Вернике, не существует. Можно измерить уровень тиамина в крови, но по результатам анализов нельзя определить, сколько его содержится в мозге. Поэтому такой анализ необязателен, но он может играть вспомогательную роль для подтверждения диагноза.
Инструментальная диагностика
Может применяться компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). С помощью КТ определяют участки пониженной плотности в центральном сером веществе среднего мозга и в части таламуса, но в большинстве случаев этот метод не выявляет очаговой патологии при острой энцефалопатии.
Наиболее эффективный метод диагностики энцефалопатии Вернике — это МРТ. Интерпретировать результаты МРТ сможет только врач.
Дифференциальная диагностика
Энцефалопатию Вернике следует отличать от следующих заболеваний:
- ;
- гипоксической энцефалопатии, т. е. вызванной недостаточным снабжением мозга кислородом;
- височной эпилепсии;
- сотрясения мозга; с тельцами Леви (отложениями белка в областях мозга, связанных с памятью, движением и мышлением);
- герпетического энцефалита;
- транзиторной глобальной амнезии (внезапного временного эпизода потери памяти, не связанного с инсультом или судорогами);
- опухоли третьего желудочка мозга; ; [19][20] .
При лихорадке или других признаках инфекции центральной нервной системы требуется люмбальная пункция. Во время процедуры врач извлекает небольшое количество жидкости из пространства вокруг позвоночника с помощью тонкой иглы. Затем этот образец исследуют в лаборатории.
При подозрении на бессудорожные припадки эпилепсии может быть назначена электроэнцефалография (ЭЭГ) [1] .
Лечение энцефалопатии Вернике
Пациентам с подозрением на энцефалопатию Вернике нужно немедленно ввести тиамин. Затем диагноз подтверждается с помощью лабораторных тестов или КТ/МРТ, заодно с их помощью отслеживается динамика.
Тиамин вводят инъекционно, поскольку при алкоголизме или истощении он плохо поглощается в желудочно-кишечном тракте. Инъекции делают три раза в сутки в течение двух дней, затем один раз в сутки в течение пяти дней [17] .
К возможным побочным реакциям относится анафилаксия и бронхоспазм, но они встречаются крайне редко.
После выписки из больницы нужно перестать употреблять алкоголь и продолжать приём тиамина в таблетках, также рекомендуется восполнять магний, дефицит других витаминов и питательных веществ.
Кроме того, пациентам будет полезно потреблять пищу, богатую тиамином: спаржу, говядину, свинину, печень, сухое молоко, орехи, овёс, апельсины, яйца, семена подсолнечника и льна, чечевицу, горох, дрожжи, брокколи, лук, зелёную фасоль, морковь, капусту, помидоры, зелёный горошек, зелень свёклы, брюссельскую капусту, шпинат, баклажаны. Некоторые продукты, такие как рис, макароны, хлеб, крупы, хлопья и мука, специально обогащают тиамином.
Прогноз. Профилактика
Без лечения энцефалопатия Вернике приводит к коме и смерти. Чем быстрее введён тиамин, тем лучше прогноз [1] . Большинство пациентов полностью избавляются от паралича глазных мышц, но в 60 % случаев сохраняется горизонтальный нистагм, т. е. глаз может отклоняться вправо или влево. Только у 40 % пациентов восстанавливается координация движений — дефициты могут варьировать от сохранения медленной шаркающей походки до неспособности ходить совсем. Также могут остаться трудности с обучением и нарушение памяти, которые становятся заметны по мере прояснения сознания.
Профилактика энцефалопатии Вернике
Чтобы предотвратить заболевание, людям из группы риска рекомендуется принимать тиамин в таблетках. В группу риска входят пожилые люди, беременные женщины, бездомные, пациенты с психическими заболеваниями, алкоголизмом, СПИДом, болезнями желудочно-кишечного тракта (синдромом мальабсорбции, болезнью Крона, хронической диареей и рвотой).
Энцефалопатия Вернике может быть вызвана внутривенным введением глюкозы, поэтому пациентам с дефицитом тиамина нужно ввести тиамин до или во время процедуры.
Печеночная энцефалопатия
Печеночная энцефалопатия – одно из наиболее тяжелых осложнений печеночной недостаточности, заключающееся в токсическом поражении ЦНС и проявляющееся изменениями личности, снижением интеллекта, депрессией, неврологическими и эндокринными расстройствами. Для установления диагноза проводят биохимические пробы печени, УЗИ печени и желчного пузыря, МРТ и КТ печени и желчевыводящих путей, электроэнцефалографию. Лечение печеночной энцефалопатии включает диетотерапию, эрадикацию инфекционного агента, очищение кишечника, подавление кишечной микрофлоры, симптоматические мероприятия.
Общие сведения
Печеночная энцефалопатия при заболеваниях печени встречается не так уж часто, однако имеет очень тяжелый исход – до 80% случаев печеночной комы заканчиваются смертью пациента. Гепатологи отмечают интересный факт: развитие энцефалопатии на фоне острой печеночной недостаточности практически всегда является фактором, исключающим цирроз печени в будущем. При хронических поражениях печени это осложнение развивается гораздо чаще, чем при острых; является потенциально обратимым, но при этом оказывает значительное влияние на социальную активность и трудоспособность пациента. Патогенез и механизмы развития ПЭ на сегодняшний день до конца не изучены, исследованием этой проблемы занимаются ведущие специалисты в области гастроэнтерологии. Раскрытие механизмов развития печеночной энцефалопатии приведет к разработке патогенетического лечения и позволит снизить смертность от этого грозного осложнения печеночной недостаточности.
Причины печеночной энцефалопатии
Выделяют несколько типов печеночной энцефалопатии, в зависимости от причин ее развития: ПЭ, связанная с острой печеночной недостаточностью, с попаданием в кровоток кишечных нейротоксинов, с циррозом печени. Факторами развития острой печеночной недостаточности с печеночной энцефалопатией могут служить острые вирусные гепатиты, алкогольный гепатит, рак печени, другие заболевания, сопровождающиеся гепатоцитолизом, лекарственные и другие интоксикации. Причиной попадания в кровоток кишечных нейротоксинов может быть активное и чрезмерное размножение облигатной флоры кишечника, употребление слишком больших количеств белковой пищи. Цирроз печени с развитием печеночной энцефалопатии характеризуется замещением нормально функционирующих гепатоцитов соединительной рубцовой тканью с угнетением всех печеночных функций.
Запустить процесс гибели гепатоцитов и токсического поражения головного мозга могут следующие факторы: кровотечения из желудка и кишечника, злоупотребление алкоголем, неконтролируемый прием медикаментов, постоянные запоры, избыточное употребление белка, инфекции, операции, развитие перитонита на фоне асцита.
При печеночной недостаточности в организме развивается целый комплекс патологических нарушений: изменение КОС и водно-электролитного состояния крови, гемостаза, онкотического и гидростатического давления и т. д. Все эти изменения значительно нарушают работу таких клеток, как астроциты, которые представляют собой треть всей клеточной массы головного мозга. На астроциты возложена функция регуляции проницаемости барьера между тканью головного мозга и кровью, обезвреживания токсинов, обеспечения поступления в клетки мозга электролитов и нейротрансмиттеров. Постоянное воздействие на астроциты аммиака, в избытке поступающего в кровоток при печеночной недостаточности, приводит к ухудшению их функционирования, повышению ликворопродукции, развитию внутричерепной гипертензии и отека головного мозга. Кроме аммиака, токсическое воздействие на астроциты способны оказывать ложные нейротрансмиттеры, жирные кислоты и аминокислоты, магний, продукты распада углеводородов и жиров.
Симптомы печеночной энцефалопатии
В клинической картине печеночной энцефалопатии выделяют различные неврологические и психические нарушения. Обычно к ним относят расстройства сознания (патологическая сонливость, фиксация взгляда, заторможенность с последующим развитием сопора, комы), нарушения сна (в дневное время пациент патологически сонлив, а в ночное предъявляет жалобы на бессонницу), нарушения поведения (раздражительность, эйфория, безучастность, апатия), интеллекта (забывчивость, рассеянность, нарушения письма), монотонность речи. Появление либо усиление сладковатого печеночного запаха изо рта связано с нарушением метаболизма меркаптанов (продуктов жизнедеятельности кишечной флоры) в печени, в связи с чем они начинают выводиться через дыхательные пути.
У многих пациентов признаком печеночной энцефалопатии является астериксис – несимметричные крупноразмашистые аритмичные подергивания, возникающие в мышцах конечностей, туловища и шеи при их тоническом напряжении. Обычно астериксис выявляется при вытягивании рук вперед, напоминает суетливые движения кистей и пальцев. Достаточно часто при печеночной энцефалопатии поражается терморегуляционный центр, из-за чего может отмечаться пониженная или повышенная температура, либо же чередование эпизодов гипотермии и гипертермии.
По течению выделяют острую и хроническую форму печеночной энцефалопатии. Острая энцефалопатия развивается очень быстро и может приводить к развитию комы в течение нескольких часов или дней. Хроническая форма развивается медленно, иногда в течение нескольких лет.
В своем развитии печеночная энцефалопатия проходит несколько стадий. В начальной стадии (субкомпенсации) появляются незначительные изменения психики (апатия, бессонница, раздражительность), сопровождающиеся иктеричностью кожи и слизистых. На стадии декомпенсации изменения психики усугубляются, пациент становится агрессивным, появляется астериксис. Возможны обмороки, неадекватность поведения. В терминальной стадии происходит угнетение сознания вплоть до сопора, однако реакция на болевые раздражители еще сохраняется. Последняя стадия печеночной энцефалопатии – кома, реакция на раздражители отсутствует, развиваются судороги. На этой стадии погибает девять из десяти пациентов.
Диагностика печеночной энцефалопатии
Целью диагностики при печеночной энцефалопатии служит выявление ее симптомов, установление степени тяжести и стадии заболевания. Большое значение для выявления печеночной энцефалопатии имеет правильно собранный анамнез (упоминание о перенесенных вирусных гепатитах, злоупотреблении алкоголем, бесконтрольном приеме медикаментов). Консультация гастроэнтеролога должна быть проведена как можно раньше, и данный специалист обязан уделить достаточно внимания неврологической симптоматике и признакам расстройств психики. Следует помнить, что появление симптомов поражения стволовых структур мозга у пациентов в коме говорит о возможности летального исхода в ближайшие часы.
Проводят общий анализ крови (выявляет анемию, снижение количества тромбоцитов, лейкоцитоз с токсической зернистостью нейтрофилов), исследуют коагулограмму (из-за угнетения белково-синтезирующей функции печени развивается коагулопатия дефицита, затем ДВС-синдром), печеночные пробы (отмечается повышение активности трансаминаз, ЩФ, Г-ГТП, растет уровень билирубина). При необходимости возможно проведение других лабораторных тестов, которые укажут на поражение внутренних органов (полиорганную недостаточность).
Для выяснения степени поражения печени могут потребоваться такие неинвазивные исследования, как УЗИ печени и желчного пузыря, МРТ печени и желчевыводящих путей, КТ желчевыводящих путей. Обязательно производится пункционная биопсия печени для выяснения точной причины печеночной недостаточности. Оценка степени поражения головного мозга осуществляется с помощью электроэнцефалографии.
Дифференциальный диагноз печеночной энцефалопатии проводят с другими (внепеченочными) причинами поражения головного мозга: внутричерепная катастрофа (геморрагический инсульт, кровоизлияние в желудочки мозга, разрыв аневризмы церебральных сосудов и пр.), инфекции ЦНС, метаболические расстройства, внепеченочные причины повышения уровня азота в крови; алкогольные, лекарственные и послесудорожные энцефалопатии.
Лечение печеночной энцефалопатии
Терапия печеночной энцефалопатии является сложной задачей, и начинать ее нужно с устранения причин этого состояния, лечения острой либо хронической печеночной недостаточности. В схему лечения печеночной энцефалопатии включают диетотерапию, очищение кишечника, снижение уровня азота, симптоматические мероприятия.
Следует снизить количество поступающего с пищей белка до 1г/кг/сут. (при условии переносимости такого рациона пациентом) на достаточно длительное время, так как у некоторых больных возврат к нормальному содержанию белка вызывает повторное появление клиники печеночной энцефалопатии. На время диеты назначаются препараты аминокислот, ограничивается содержание соли.
Для обеспечения эффективного выведения аммиака с калом необходимо достигнуть опорожнения кишечника не менее двух раз за сутки. С этой целью производятся регулярные очистительные клизмы, назначаются препараты лактулозы (их прием необходимо продолжить и на этапе амбулаторного лечения). Также улучшает утилизацию аммиака орнитин, сульфат цинка.
Антибактериальная терапия включает назначение препаратов широкого спектра действия, проявляющих активность преимущественно в просвете кишечника (неомицин, ванкомицин, метронидазол и др.). С седативной целью при печеночной энцефалопатии нежелательно назначать препараты бензодиазепинового ряда, предпочтение отдают галоперидолу.
Течение печеночной энцефалопатии может осложниться отеком головного мозга, кровотечениями, аспирационной пневмонией, панкреатитом; поэтому лечение пациентов на 3-4 стадии заболевания должно осуществляться в отделении реанимации.
Прогноз и профилактика печеночной энцефалопатии
Прогноз при печеночной энцефалопатии зависит от нескольких факторов, но в целом неблагоприятный. Выживаемость лучше в случаях, когда энцефалопатия развилась на фоне хронической печеночной недостаточности. При циррозе печени с печеночной энцефалопатией прогноз ухудшается при наличии желтухи, асцита, пониженного уровня белка в крови. При острой печеночной недостаточности прогноз хуже у детей до 10 лет и взрослых после 40 лет, на фоне вирусного гепатита, желтухи и гипопротеинемии. Летальность на 1-2 стадиях печеночной энцефалопатии 35%, на 3-4 стадии – 80%. Профилактика данной патологии заключается в отказе от алкоголя и неконтролируемого приема медикаментов, лечении заболеваний, которые приводят к развитию печеночной энцефалопатии.
Цирроз печени - симптомы и лечение
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
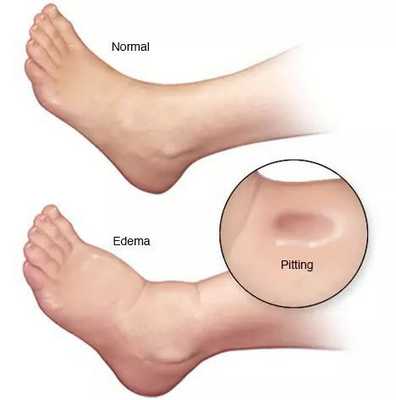
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
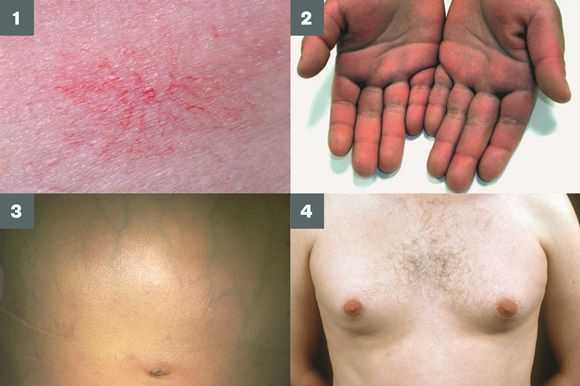
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Острая печеночная недостаточность
Острая печеночная недостаточность – патологический симптомокомплекс, развивающийся при изменениях паренхимы печени и сопровождающийся нарушением ее функций. Острая печеночная недостаточность характеризуется признаками печеночной энцефалопатии (немотивированной слабостью, сонливостью, адинамией, возбуждением), диспепсическими расстройствами, появлением и нарастанием желтухи, отеков, асцита, геморрагического диатеза; в тяжелых случаях – развитием печеночной комы. Диагностика острой печеночной недостаточности основывается на клинических данных, результатах исследования печеночных проб, КЩС, ЭЭГ. Лечение острой печеночной недостаточности требует проведения инфузионной терапии, витаминотерапии, гормонотерапии, плазмафереза, гемодиализа, гемосорбции, лимфосорбции, кислородных ингаляций, гипербарической оксигенации.
Острая печеночная недостаточность – тяжелый синдром, в результате которого развиваются грубые метаболические нарушения, интоксикация организма продуктами белкового обмена, геморрагический синдром, нарушения деятельности ЦНС, печеночная кома. В гастроэнтерологии и гепатологии острой печеночной недостаточностью могут осложняться различные заболевания и патологические состояния. Смертность пациентов от печеночной недостаточности составляет 50-80%.
Причины острой печеночной недостаточности
Острая печеночная недостаточность является исходом целого ряда патологических процессов, приводящих к обширным дистрофическим, фиброзным или некротическим изменениям паренхимы печени. Она может развиваться при тяжелом течении гепатитов различной этиологии (вирусных, лекарственных, аутоиммунных), циррозе, гепатозе, обтурации желчных протоков, отравлениях гепатотропными токсичными веществами и ядами (соединениями фосфора, мышьяка, несъедобными грибами, фармакологическими препаратами), при инфузии крови, не совпадающей по групповой принадлежности и др. Иногда острая печеночная недостаточность возникает как следствие нарушения печеночного кровообращения, которое встречается при ожогах, сепсисе, массивном кровотечении, тромбозе воротной вены и т. д.
Непосредственными пусковыми факторами развития острой печеночной недостаточности могут выступать прием алкоголя или лекарственных препаратов с гепатотоксическим действием, наркоз при операциях, хирургические вмешательства (например, портокавальное шунтирование, лапароцентез при асците), желудочно-кишечное кровотечение, избыток белка в пище, почечная недостаточность, поносы. У пациентов с имеющимся поражением печени (гепатит, цирроз) острая печеночная недостаточность может быть спровоцирована интеркуррентными инфекциями, перитонитом, тромбофлебитом воротной вены и др. состояниями.
Патологические сдвиги, развивающиеся в организме при острой печеночной недостаточности, обусловлены накоплением в крови соединений (аммиака, аминокислот, фенолов), оказывающих церебротоксическое действие, нарушением водно-электролитного и кислотно-щелочного баланса, расстройствами кровообращения и др. факторами. При острой печеночной недостаточности в наибольшей степени нарушается детоксикационная функция печени, а также снижается участие печени в различных обменных процессах (белковом, углеводном, жировом, витаминном, электролитном и т. д.).
Классификация острой печеночной недостаточности
Выделяют три формы острой печеночной недостаточности: эндогенную (спонтанную), экзогенную (индуцированную) и смешанную. Функциональная недостаточность, развивающаяся при непосредственном поражении паренхимы печени, расценивается как эндогенная. В основе экзогенно обусловленной печеночной недостаточности лежит расстройство кровообращения в печени, что приводит к сбросу крови, насыщенной токсинами (в первую очередь, аммиаком), в общий круг кровообращения. При смешанной печеночной недостаточности имеют место оба патологических механизма – эндогенный и экзогенный.
По выраженности функциональных нарушений печени различают три степени гепатопатии. При гепатопатии легкой степени клинические проявления поражения печени отсутствуют. С помощью лабораторных тестов выявляются умеренные функциональные нарушения (повышение ферментов, билирубинемия, увеличение уровня трансаминаз и др.).
Гепатопатия средней степени характеризуется появлением клинических симптомов: гепатомегалии, болезненности печени, приступов печеночной колики, желтушности кожных покровов и склер, явлений геморрагического диатеза. В крови нарастает гипербилирубинемия, гипопротеинемия, диспротеинемия.
Тяжелая гепатопатия соответствует стадии острой печеночной недостаточности. К вышеназванным проявлениям присоединяются симптомы печеночной энцефалопатии и печеночной комы, развивающиеся на фоне грубого нарушения функций печени.
Симптомы острой печеночной недостаточности
Клиническая стадия острой печеночной недостаточности (печеночная энцефалопатия) характеризуется сонливостью, которая может сменяться возбуждением, адинамией, прогрессирующей слабостью. Отмечаются диспепсические расстройства: тошнота, потеря аппетита, рвота, поносы. Нарастают отеки, явления геморрагического диатеза, желтухи, интоксикации, асцита, лихорадка.
В прекоматозном периоде развиваются нервно-психические нарушения: головокружение, замедление речи и мышления, расстройства сна, слуховые и зрительные галлюцинации, спутанность сознания, тремор пальцев, двигательное возбуждение. Могут отмечаться кровотечения из носа, десен, варикозно-расширенных вен пищевода.
Предвестниками приближающееся печеночной комы служат боли в подреберье, появление «печеночного» запаха изо рта, уменьшение печени в размерах. Собственно печеночная кома характеризуется утратой сознания; судорогами, гипотермией, аритмией, появлением патологических рефлексов, полиорганной недостаточностью.
Диагностика острой печеночной недостаточности
Распознавание острой печеночной недостаточности проводится с учетом симптоматики, результатов исследования биохимических показателей (в т. ч. печеночных проб), КЩС, инструментальных исследований (электроэнцефалографии).
Лабораторными признаками острой печеночной недостаточности служат анемия, тромбоцитопения, гипербилирубинемия (уровень билирубина может повышаться в 5 и более раз), увеличение активности сывороточных трансаминаз. В терминальной стадии острой печеночной недостаточности выражены гипохолестеринемия, гипоальбуминемия, снижение ПТИ и др. факторов свертывания, гипогликемия, гипокалиемия, отмечается нарушение кислотно-основного состояния.
Исследование ЭЭГ в зависимости от стадии острой печеночной недостаточности выявляет нарушение (неравномерность, замедление или исчезновение) альфа-ритма, доминирование тета- и дельта-волн.
Лечение острой печеночной недостаточности
Центральное место в лечении острой печеночной недостаточности занимает инфузионная терапия, направленная на дезинтоксикацию, улучшение микроциркуляции, метаболизма, коррекцию электролитных нарушений, восстановление кислотно-щелочного равновесия. При острой печеночной недостаточности показано внутривенное введение растворов глюкозы, альбумина, декстрана, реополиглюкина, сорбита, маннита и др. При введении большого объема жидкости для профилактики отека головного мозга и легких применяются диуретики.
Производится назначение витаминов (аскорбиновой кислоты, тиамина, рибофлавина, пиридоксина гидрохлорида, цианокобаламина, никотинамида). При геморрагическом синдроме показано введение растворов викасола, аминокапроновой кислоты, этамзилата натрия; при дефиците факторов свертывания и признаках ДВС-синдрома осуществляется трансфузия больших объемов плазмы. Прогрессирование острой печеночной недостаточности требует применения глюкокортикоидных гормонов (преднизолона), антибиотиков (аминогликозидов, цефалоспоринов).
С дезинтоксикационной целью используют плазмаферез, гемосорбцию, лимфосорбцию, гемодиализ. Для стимуляции иммунологической активности применяют УФО крови, для борьбы с гипоксией - гипербарическую оксигенацию, кислородные ингаляции.
Прогноз и профилактика острой печеночной недостаточности
Своевременная интенсивная терапия острой печеночной недостаточности существенно улучшает прогноз. При глубокой печеночной коме развиваются необратимые изменения, приводящие к гибели пациента.
Профилактика острой печеночной недостаточности требует адекватного лечения первичных заболеваний печени, исключения действия гепатотоксических или церебротоксических веществ, провоцирующих факторов.
Читайте также:

![Признаки энцефалопатии Вернике на снимке МРТ [22]](/pimg3/pechenochnaya-entsefalopatiya-prichini-C1650F.jpeg)