Переносчики американского трипаносомоза. Иммунитет при американском трипаносомозе
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Болезнь Шагаса, известная также как американский трипаносомоз, — потенциально опасное для жизни заболевание, вызываемое простейшим паразитом Trypanosoma cruzi.
По имеющимся оценкам, паразитарным возбудителем болезни Шагаса T cruzi заражено от 6 до 7 млн человек в мире. Болезнь Шагаса встречается преимущественно в эндемичных районах 21 страны континентальной части Латинской Америки 1 , где ранее она в основном передавалась людям и другим млекопитающим через продукты жизнедеятельности триатомовых клопов (переносчиков), известных под разными названиями в зависимости от географической области, в том числе как «поцелуйные клопы».
Болезнь Шагаса названа именем бразильского врача и ученого Карлуса Рибейру Жустиниану Шагаса, который открыл эту болезнь в 1909 г. В мае 2019 г. по решению семьдесят второй сессии Всемирной ассамблеи здравоохранения был учрежден Всемирный день борьбы с болезнью Шагаса, отмечаемый 14 апреля (в этот день в 1909 г. Карлус Шагас диагностировал первый случай этой болезни у человека — двухлетней девочки по имени Беренис.
Распространение
Ранее распространение болезни Шагаса ограничивалось исключительно сельскими районами континентальной части Региона стран Америки — преимущественно Латинской Америки (за исключением островов Карибского бассейна). Однако в настоящее время, главным образом в результате роста мобильности населения за последние десятилетия, большинство лиц с данной инвазией проживают в городских районах (урбанизация заболевания), в результате чего она все чаще встречается в Соединенных Штатах Америки, Канаде, многих европейских странах, а также в некоторых странах Африки, Восточного Средиземноморья и Западной части Тихого океана.
Передача заболевания
В Латинской Америке паразиты T. сruzi передавались в основном в результате контакта с продуктами жизнедеятельности инфицированных кровососущих триатомовых клопов. В сельских или пригородных районах эти потенциальные переносчики паразитов, как правило, обитают в трещинах стен или крыш жилых домов и таких бытовых построек, как курятники, загоны для скота и складские помещения. В дневное время они обычно прячутся, а по ночам становятся активными и питаются кровью млекопитающих, в том числе людей. Обычно они кусают в открытые участки кожи, в частности на лице (отсюда распространенное название «поцелуйные клопы»), и выделяют продукты своей жизнедеятельности рядом с местом укуса. Паразиты проникают в организм человека, когда он инстинктивно втирает эти выделения в место укуса, глаза, рот или трещину на коже.
T. cruzi может также передаваться:
- при потреблении пищевых продуктов, загрязненных T. cruzi, например в результате их соприкосновения с продуктами жизнедеятельности триатомовых клопов или сумчатых (такая передача, как правило, вызывает вспышки с одновременным заражением целых групп людей и более высокой заболеваемостью и смертностью);
- от инфицированной матери новорожденному ребенку во время беременности или родов;
- при переливании крови или препаратов крови, полученных у инфицированных доноров;
- при трансплантации некоторых органов, взятых у инфицированных доноров;
- в случае лабораторных инцидентов.
Признаки и симптомы
Болезнь Шагаса протекает в двух стадиях. Первая — острая — стадия длится около двух месяцев после заражения. В острой стадии в крови циркулирует большое количество паразитов, однако в большинстве случаев симптомы болезни отсутствуют или протекают в легкой форме и являются неспецифическими. Менее чем у 50% людей, укушенных триатомовым клопом, характерными первыми видимыми признаками могут быть поражения кожи или багровый отек век на одном глазу. Кроме того, они могут включать лихорадку, головную боль, увеличение лимфатических узлов, бледность, мышечную боль, затрудненное дыхание, отеки и боль в области живота и груди.
На протяжении второй стадии паразиты концентрируются в основном в сердце или мускулатуре пищеварительного тракта. Спустя одно–три десятилетия до 30% пациентов начинают страдать нарушениями сердечной деятельности, а до 10% пациентов — желудочно-кишечными (обычно в виде гипертрофии пищевода или толстой кишки), неврологическими или комбинированными расстройствами. В последующие годы у таких пациентов инвазия может приводить к поражению сердечной мышцы и нервной системы с последующей сердечной аритмией или прогрессирующей сердечной недостаточностью и внезапной смертью.
Лечение
Болезнь Шагаса можно лечить бензнидазолом, а также нифуртимоксом, что позволяет уничтожить паразита. Если лечение обоими препаратами начато вскоре после инфицирования в начале острой стадии, его эффективность составляет почти 100%, в том числе в случаях врожденной инвазии. Однако, чем дольше сохраняется инвазия, тем менее эффективными становятся эти препараты, а в более пожилом возрасте чаще развиваются побочные реакции. Лечение показано также пациентам с реактивированной инфекцией (например, в результате подавления иммунитета) и пациентам в начальной хронической стадии, в том числе девочкам и женщинам детородного возраста (до или после беременности) для профилактики врожденной передачи инвазии.
Лечение следует предлагать взрослым пациентам с инвазией, особенно при отсутствии симптомов, поскольку лечение противопаразитарными препаратами может также предотвращать или сдерживать прогрессирование заболевания. В остальных случаях следует сбалансированно учитывать потенциальные преимущества лекарственного лечения для предотвращения или задержки развития болезни Шагаса и длительность лучения (до двух месяцев), а также возможные побочные реакции (которыми страдают до 40% взрослых пациентов, получающих лечение). Бензнидазол и нифуртимокс не должны принимать беременные женщины или пациенты с почечной или печеночной недостаточностью. Нифуртимокс также противопоказан людям с неврологическими или психиатрическими расстройствами. Дополнительно пациенту может потребоваться специфическое лечение нарушений сердечной деятельности, желудочно-кишечных или неврологических расстройств.
Борьба и профилактика
Изначально (более 9 000 лет назад) T. сruzi поражал только диких животных. Позднее эта инвазия распространилась на домашних животных и людей. Ликвидировать ее не представляется возможным в связи с наличием большого резервуара паразитов T. cruzi среди диких животных в странах Америки. Таким образом, целями борьбы являются элиминация передачи заболевания и своевременное оказание медицинской помощи лицам с инвазией.
Против болезни Шагаса не существует профилактической вакцины. T. cruzi может инфицировать несколько видов триатомовых клопов, большинство из которых встречаются в странах Америки. Самым эффективным способом профилактики болезни Шагаса в Латинской Америке является борьба с переносчиками. Во всех странах для предотвращения инвазий в результате переливания крови или пересадки органов, а также для более эффективной диагностики и оказания помощи затронутым группам населения необходимо проводить скрининг крови.
В зависимости от географического района ВОЗ рекомендует следующие методы профилактики заболевания и борьбы с ним:
- опрыскивание жилых помещений и придомовой территории инсектицидами остаточного действия;
- ремонт домов и поддержание чистоты в быту для предотвращения инфестации переносчиками болезни;
- принятие индивидуальных профилактических мер, таких как использование прикроватных сеток, соблюдение надлежащих мер гигиены при приготовлении, транспортировке, хранении и употреблении пищи;
- организация информационных, просветительских и разъяснительных мероприятий по вопросам принятия профилактических мер и методов эпиднадзора с учетом потребностей различных субъектов и различных сценариев;
- скрининг доноров крови;
- тестирование доноров и реципиентов органов, тканей и клеток;
- обеспечение доступа к диагностике и лечению лиц, которым по медицинским основаниям показано или рекомендовано проведение противопаразитарного лечения, особенно детей и женщин детородного возраста до наступления беременности; и
- скрининг новорожденных и детей более старшего возраста, рожденных инфицированными матерями, которые не получали противопаразитарного лечения, для обеспечения своевременной диагностики и лечения.
Согласно расчетам, расходы на оказание медицинской помощи пациентам с сердечной, желудочно-кишечной, неврологической или комбинированной формой заболевания более чем на 80% превышают стоимость мероприятий по опрыскиванию инсектицидами остаточного действия для борьбы с переносчиками и профилактики инфицирования.
Деятельность ВОЗ
С 1990-х гг. в рамках сотрудничества с Секретариатом Панамериканской организации здравоохранения достигнуты значительные успехи в борьбе с паразитами и переносчиками болезни в Латинской Америке, а именно на территории Южного конуса, Центральной Америки, стран Андского пакта и стран Амазонских межправительственных инициатив. Эти международные инициативы позволили существенно уменьшить масштабы передачи инвазии и повысить доступность средств диагностики и противопаразитарного лечения.
Кроме того, в континентальных странах Латинской Америки благодаря обеспечению всеобщего скрининга всеми банками крови существенно снижен риск передачи инвазии при переливании крови. Всеобщий скрининг крови введен также в банках крови Соединенных Штатов Америки и большинства стран Европы и Западной части Тихого океана, где регистрируются случаи заболевания.
Эти достижения стали возможны благодаря решительным усилиям государств-членов, затронутых болезнью, а также благодаря наращиванию потенциала их организаций в области научных исследований и борьбы с этой болезнью при поддержке со стороны многих международных партнеров.
В 2005 г. Всемирная организация здравоохранения включила болезнь Шагаса в число забытых тропических болезней. Это способствовало более широкому признанию заболевания как проблемы общественного здравоохранения на международной арене и позволило противодействовать дезинформации, укреплять социальный запрос и политический курс на решение проблем, связанных с болезнью Шагаса, и устранять пробелы в научных исследованиях и разработках в области ее профилактики, выявления и комплексного оказания помощи, в том числе для выработки средств диагностики и лечения, информирования о лекарственных препаратах, методов решения социальных вопросов, информационных, просветительских и коммуникационных инструментов.
В принятой в 2020 г. дорожной карте по забытым тропическим болезням на 2021–2030 гг. предусматривается пять целей в области борьбы с болезнью Шагаса:
- верификация ликвидации передачи болезни переносчиками в жилых помещениях;
- верификация ликвидации гемотрансфузионной передачи болезни;
- верификация ликвидации передачи болезни при пересадке органов;
- элиминация врожденной болезни Шагаса;
- повышение уровня охвата противопаразитарным лечением целевых категорий населения до 75%.
В то же время будет необходимо решить ряд дополнительных проблем. К ним относятся:
- трудности в сохранении и закреплении успехов, достигнутых в области профилактики и контроля инфекции, особенно в контексте санитарно-эпидемиологических и социально-экономических последствий пандемии COVID-19;
- появление болезни Шагаса в районах, ранее считавшихся свободными от нее, например в бассейне Амазонки;
- продолжение циркуляции болезни в регионах, где принимаются меры по контролю инфекции, например в регионе Чако в Аргентине или на территории Многонационального Государства Боливия;
- распространение болезни, преимущественно обусловленное растущим перемещением населения между Латинской Америкой и остальным миром;
- наличие контингента лиц с инвазией, проживающих в странах/районах, где учреждения здравоохранения имеют мало информации и опыта в отношении этой болезни;
- предупреждение последствий низкой осведомленности или нехватки знаний, стигматизация и/или дискриминация в связи с болезнью Шагаса;
- низкий уровень регистрации случаев болезни, слабый мониторинг и эпиднадзор и низкий уровень верификации успехов, достигнутых в области борьбы с заболеванием; и
- недостаточная доступность услуг по диагностике и лечению для миллионов лиц с инвазией.
Для достижения цели по элиминации передачи болезни Шагаса и предоставлению медицинской помощи инфицированным и больным людям как в эндемичных, так и в неэндемичных районах ВОЗ намерена расширять сетевое взаимодействие на глобальном уровне и усиливать региональный и национальный потенциал, уделяя основное внимание таким мерам, как:
- укрепление систем регистрации случаев, национальных информационных систем и глобального эпидемиологического надзора;
- повышение информированности о болезни Шагаса и о проблемах, с которыми сталкиваются затронутые ею группы населения;
- разработка инновационных стратегий, направленных на прерывание передачи болезни переносчиками (в рамках концепций «Единое здоровье» и «Экоздоровье»);
- предупреждение передачи заболевания при переливании крови и пересадке органов;
- содействие разработке наиболее эффективных и практичных диагностических тестов и алгоритмов/протоколов для расширения скрининга и диагностирования случаев инвазии;
- расширение мер первичной профилактики передачи врожденной инвазии и ведения случаев врожденной и приобретенной инвазии;
- формирование консенсуса относительно надлежащего ведения пациентов на основе актуальных данных, в том числе при сочетанных инфекциях и на фоне других болезней (таких как COVID-19, ВИЧ/СПИД, стронгилоидоз и т. д.);
- содействие разработке комплексных подходов с учетом широкого круга аспектов проблемы.
1 Аргентина, Белиз, Боливия (Многонациональное Государство), Бразилия, Чили, Колумбия, Коста-Рика, Эквадор, Сальвадор, Французская Гайана, Гватемала, Гайана, Гондурас, Мексика, Никарагуа, Панама, Парагвай, Перу, Суринам, Уругвай и Венесуэла (Боливарианская Республика).
Переносчики американского трипаносомоза. Иммунитет при американском трипаносомозе
Патогенез американского трипаносомоза. Клиника американского трипаносомоза
Характерной особенностью T. cruzi является проникновение ее в клетки миокарда, мускулатуры скелета. вентральной нервной системы, надпочечников, гистофигоцитной системы, различных органов й тканей, где паразиты размножаются в лейшманиальной стадии. Именно присутствием и воздействием этих форм обусловливается ряд специфических для данной инфекции непосредственных поражений миокарда и других клеток и тканей.
Диагноз устанавливается по клиническим, паразитологическим и эпидемиологическим данным.
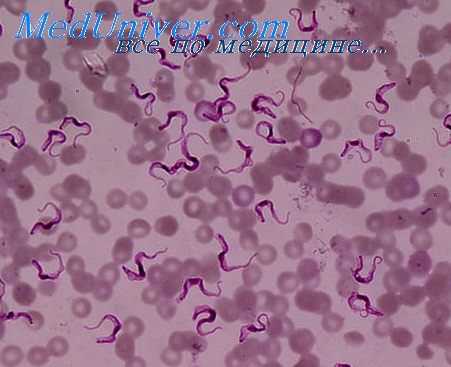
Трипаносомы в крови больных людей и животных в острой фазе инфекции легко обнаруживают в препаратах из периферической кроки (нативные препараты, мазки и толстые капли, окрашенные по Романовскому). В хронической фазе инфекции трипаносомы в крови не обнаруживаются или обнаруживаются в виде единичных экземпляров после длительного просмотра препаратов под микроскопом. Для выявления этих случаев наиболее эффективным является кормление на больном человеке или на животном клопов (триатомовых), в которых единичные трипаносомы, имеющиеся в поглощенной крови, размножаются и легко могут быть обнаружены — ксенодиагностика. Применяется также изоди а гностическая проба, т. е. прививка крови лабораторным животным. Ввиду малого количества трипаносом в крови для получения положительного результата следует вводить по возможности больше крови. Выделение культур из крови больного в хронической форме инфекции редко дает положительный результат.
При работе с Т. cruzi необходимо тщательное соблюдение мер предосторожности. так как известны случаи лабораторного заражения через укол кожи иглой от шприца, содержащего культуру вирулентных трипаносом.
Лейшманиальные формы при жизни хозяина могут быть выявлены лишь путем биопсии доступных для этой операции кусочков органов. Готовят препараты-оттиски и срезы, в которых также встречаются переходные критидиальные и трипаносомные формы. Наиболее показательно выявляются паразиты в срезах, фиксированных жидкостью Карнуа и окрашен них по Романовскому.
Применяются также серологические реакции: реакции преципитации, реакция агглютинации, реакция связывания комплемента — реакция Guerreiго—Machado (R. G. M.), сокращенно называемая реакцией Машадо. В качестве антигена при реакции преципитации используется экстракт из трипаносом; при реакции агглютинации — живые трипаносомы из крови зараженных животных или из культуры; при реакции Машадо—экстракт из пораженной сердечной мышцы или из культуры. Реакция преципитации и реакция агглютинации положительны в высоком проценте в острой фазе инфекции. По мере прогрессировать болезни титр преципитинов и агглютининов снижается, титр комплементсвязывающих антител увеличивается. Реакция Машадо высокоспецифична; она широко используется для выявления хронических форм инфекции.
У лиц с нарушением сердечной деятельности, проживающих в эндемичных очагах, реакция Машадо часто бывает положительной, чти указывает на специфическую этнологию миокардитов. Так, по данным Cakieira Brant (1963). из 400 человек с положительной реакцией Машадо изменения кардиограммы наблюдались у 352 (88"о), из 822 человек с отрицательной реакцией— лишь у 77 (9,4%).
При наличии симптомов менингоэнцефалнта трнпаносомы иногда могут быть обнаружены в спинномозговой жидкости.
С успехом была применена методика выявления антител с помощью реакции иммунофлуоресценции в эксперименте на животных, непрямой метод (Fife и Mushel, 1959).
Применяется также кожная проба с экстрактом культуры Т. cruzi.
- Вернуться в оглавление раздела "Биология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Географическое распространение трипаносомоза. Трипаносомоз Американский - Болезнь Шагаса
Трипаносомоз, вызываемый T.gainbiense, распространен в Африке в пределах 14 с. ш. и 13 ю. ш.; болезнь, возбудителем которой является Т. rhodesiense, регистрируется в восточной части Африки, несколько к северу от экватора и до 20 ю. ш..
Зона распространения африканского трипаносомоза характеризуется разной степенью эндемичности — от активных очагов с эпидемическими вспышками (Нигерия, Танзания и др.) до обширных областей, где, несмотря на наличие переносчика, болезнь практически не встречается (Нигер, Сьерра-Леоне, Южная Родезия, Судан и др.).
Африканский трипаносомоз распространен преимущественно среди сельского населения. Риску заражения особенно подвержены люди, живущие в малонаселенных зонах, рабочие, занятые на прокладке железнодорожных линий, строительстве дорог, рыбаки, лесорубы, охотники, сборщики каучука и др. Чем теснее контакт между человеком и переносчиком, тем выше уровень зараженности населения. Контакт человека с мухами особенно велик в разгар засушливого сезона, что определяет сезонность заболеваемости трипаносомозом.
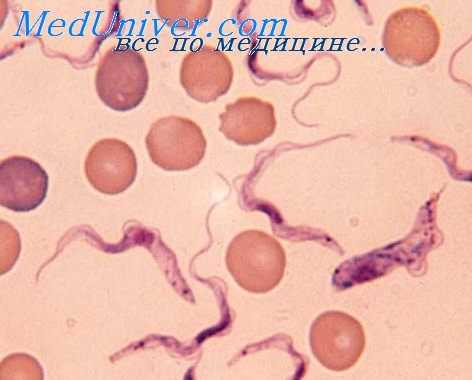
Трипаносомоз Американский - Болезнь Шагаса
Болезнь Шагаса (русс к.), frypanosomosis americana (лат,), south american trypanosomiasis, Chagas disease (англ.), trypanosomose americairic. maladie de Chagas (франц.), Chagas Krankheit, enfermedad de Chagas (iicn.), doenca de Chagas, molestia de Chagas (португ.)
Трипаносомоз американский — протозойная болезнь, протекающая в острой форме, чаще у детей. — первичный аффект на коже, лихорадка, увеличение лимфатических узлов, печени и селезенки, иногда тяжелые поражения сердца и центральной нервной системы, или, преимущественно у взрослых, в хронической форме — специфический миокардит, поражение пищеварительного тракта (мегаэзофагус, мегаколон и др.). Передается Через триатомовых клопов подсемейства Triatominae семейства Reduviidae (хищные клопы).
Болезнь была открыта в Бразилии Шагасом в начале XX века.
Этиология. Возбудитель — Trypanosoma (Schizotrypanum) eruzi Chagas, 1909 относится к семейству Trypanosomatidac Dofiein, 1901.
Т. cruzi в крови человека и животных встречается в форме трипаносомы. Длина ее около 20 и., тело часто характерно изогнуто в виде буквы «S» или полулуния, задний конец заострен. Ядро в центре, кинетопласт у заднего конца тела, округлой формы, более крупный, чем у других трипаносом млекопитающих, в окрашенных мазках несколько выходит за края паразита. Ундулирующая мембрана узкая, длина свободного конца жгута соответствует примерно 1/3 длины тела паразита. Размножения паразитов на стадии трипаносом в крови человека и животных не происходит.
Паразиты размножаются в гистофагоцитной системе разных органов (печень, селезенка, лимфатические узлы, почки, кишечник, кожа), в нейроглии, в клетках скелетной мускулатуры, мышцы сердца, гладких мышц и др., а также в клетках кожи, Трипаносомы внедряются в клетку, утрачивают ундулирующую мембрану и жгут, округляются и превращаются в лейшманиальные формы размером от 1,5 до 4— 5 u. На этой стадии паразиты размножаются путем простого деления. Когда в клетке образуется большое количество паразитов, она разрушается.
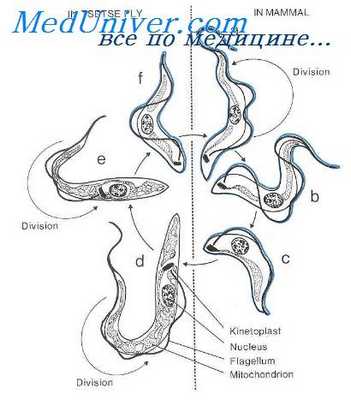
Скопление таких свободно лежащих лейшманиальных форм можно наблюдать в различных органах, особенно в мышце сердца. У вышедших из клетки лейшманиальных форм отрастает жгут, они вытягиваются, у них образуется ундулирующая мембрана, и они превращаются в критидиальные формы. а затем в трипаносомы, которые выходят в кровь. При этом критидиальные формы могут размножаться. Трипаносомные формы в крови не размножаются.
Клопы-переносчики заражаются, насасываясь крови на больном животном или человеке, имеющем трипаносом в крови. В желудке клопа трипаносомы превращаются в критидиальные формы. многократно делятся, передвигаются к заднему отделу кишечника; в прямой кишке образуются более мелкие критидиальные формы. которые затем превращаются в метациклические трипаносомы, сходные с кровяными, но более узкие.
При развитии трипаносом в переносчике иногда образуются также и лейшманиальные формы, но они не являются обязательными в этом цикле. Метациклические трипаносомы в клопах появляются через 5—15 дней после заражения на человеке или животном. После кровососания у клопов часто происходит дефекация, в результате чего кожа и слизистая оболочка губ, конъюнктивы загрязняются фекалиями клопа, содержащими мета циклические трипаносомы, которые внедряются в ранку или место расчеса.
Заражение животных может также происходить в результате разгрызания и заглатывания зараженных клопов.
Возбудитель культивируется на среде MNN и др. Размножение в культуре происходит в критидиальной форме. Получены культуры на курином эмбрионе и в культуре ткани—эмбриональная ткань крысы и клетки HeLa.
Штаммы, выделенные от зараженных людей, животных и клопов, различаются между собой по степени вирулентности (интенсивность паразитемни, количество лейшманиальных форм во внутренних органах экспериментальных животных, способность давать рецидивы), а также по избирательности паразита в отношении органов, в которых происходит его размножение (миотропные, нейротропные). Иммунология. Люди в высокой степени восприимчивы к Т. cruzi.
Течение инфекции зависит от уровня сопротивляемости организма. При высокой сопротивляемости острая фаза инфекции легко преодолевается — выздоровление наступает через 3—4 недели. У людей ослабленных инфекция может закончиться летальным исходом или перейти в хроническую форму с различной длительностью течения: 10—20 лет 1963), 50 лет (Salgado и др., 1962).
В эндемичных очагах острая лихорадочная форма инфекции с большим количеством трипаносом в периферической крови наблюдается главным образом у маленьких детей. У взрослых часто встречается легкая стертая, иногда бессимптомная форма инфекции. В хронической фазе инфекции, наступающей вслед за острой, наблюдается высокая сопротивляемость к повторному заражению (суперинфекции) даже массивным количеством трнпаносом.
В условиях эксперимента у белых мышей можно вызвать развитие иммунитета путем искусственной иммунизации штаммами трнпаносом, утратившими вирулентность при длительном их культивировании на искусственных средах (Pizzi и др., 1954; Kagan и Norman, 1961).
Установлено также развитие иммунитета у мышей после перенесения инфекции, вызванной вирулентными штаммами с одновременной дачей примахина (Pizzi и др., 1954). Отрицательные результаты были получены при иммунизации мышей убитыми (мертиолатом) трипаносомами.
Введение сыворотки иммунных мышей с целью пассивной передачи иммунитета малоэффективно (Kagan и Norman, 1961). Крысы, перенесшие инфекцию Т. cruzi, иммунны к повторному заражению и передают слабую степень иммунитета детенышам (Koloclny, 1939). Сыворотка переболевших крыс обладает профилактическими свойствами.
Развитие инфекции сопровождается выраженным фагоцитозом паразитов и образованием преципитинов, агглютининов, комплементсвязывающих антител.
Лизиса трипаносом в крови больных людей и животных, как это имеет место при сонной болезни и трипаносомозах животных, не отмечается. Не наблюдаетея также лизиса лейшманнальных форм.
Реакцией преципитации в геле с антигеном из сердца, поперечнополосатых мышц, печени, почек здоровых морских свинок показано наличие аутоантител у зараженных Т. cnizi морских свинок и у больных миокардитом людей, проживающих в эндемичном по болезни Шагаса очаге.
По данным Adler (1958a), критидиальные формы в культуре под влиянием сыворотки иммунного кролика превращаются в лейшманиальные формы, образуется синцитии с большим количеством ядер.
Африканский трипаносомоз человека (сонная болезнь)
Африканский трипаносомоз человека, также известный как сонная болезнь, относится к трансмиссивным паразитарным заболеваниям. Его возбудителям являются паразитирующие простейшие, принадлежащие к роду трипаносом. Они передаются человеку при укусе мухи цеце (род Glossina), инфицированной от людей или животных, выступающих в роли хозяев этих патогенных для человека паразитов.
Муха цеце обитает только в Африке к югу от Сахары, и передавать болезнь могут лишь некоторые ее виды. По неизвестным на сегодняшний день причинам во многих районах ареала обитания мухи цеце случаи сонной болезни не отмечаются. Наиболее подвержены укусам мухи цеце и, следовательно, данной болезни жители эндемичных сельских районов, занимающиеся сельским хозяйством, рыболовством, животноводством и охотой. Случаи болезни могут отмечаться как на территории отдельных деревень, так и в целом регионе. В пределах отдельно взятого инфицированного района интенсивность распространения болезни может сильно варьироваться от одного сельского поселения к другому.
Формы африканского трипаносомоза человека
Африканский трипаносомоз человека имеет две формы в зависимости от вида возбудителя:
Существует еще одна форма трипаносомоза, которая встречается преимущественно в Латинской Америке. Она известна как американский трипаносомоз, или болезнь Шагаса. Возбудитель болезни Шагаса относится к другому подроду Trypanosoma, передается другими переносчиками и вызывает заболевание, клинические проявления которого отличаются от африканского трипаносомоза человека.
Трипаносомоз животных
Другие виды и подвиды паразитов рода Trypanosoma являются патогенными для животных и вызывают трипаносомоз у некоторых видов диких и домашних животных. Трипаносомоз крупного рогатого скота называют нагана. Трипаносомоз домашних животных, особенно крупного рогатого скота, серьезно подрывает экономическое развитие инфицированных сельских районов.
Животные могут быть носителями патогенных для человека паразитов, особенно T.b. rhodesiense, причем домашние и дикие животные являются важным резервуаром последнего. Животные могут быть также инфицированы T.b. gambiense и, вероятно, могут также выступать в качестве его резервуара, хотя и в меньшей степени. Тем не менее реальная роль животного резервуара в эпидемиологии гамбийской формы болезни до сих пор недостаточно изучена.
Крупные эпидемии
За последнее столетие в Африке произошло несколько эпидемий:
- эпидемия 1896-1906 гг., преимущественно затронувшая Уганду и бассейн реки Конго;
- эпидемия 1920 г., затронувшая ряд африканских стран; и
- последняя по времени эпидемия, начавшаяся в 1970 г. и продолжавшаяся до конца 1990-х гг.
В 1920 г. борьба с эпидемией велась силами передвижных бригад, которые выполняли скрининг миллионов людей, проживающих в районах высокого риска. К середине 1960-х гг. распространение болезни было взято под контроль, и на всем континенте регистрировалось менее 5 000 случаев заболевания. После такого успеха эпиднадзор был ослаблен, в связи с чем болезнь вернулась, и к 1970 г. в нескольких регионах ее вспышки разрослись до эпидемии. В 1990-е гг. и в начале XXI века благодаря усилиям ВОЗ, осуществлению национальных программ по борьбе с болезнью, двустороннему сотрудничеству и деятельности неправительственных организаций (НПО) тенденция к росту заболеваемости была остановлена.
Поскольку число новых случаев заболевания африканским трипаносомозом человека за период с 2000 по 2012 г. значительно сократилось в результате международных координированных усилий, в Дорожной карте ВОЗ по борьбе с забытыми тропическими болезнями была поставлена цель по его элиминации как проблемы общественного здравоохранения к 2020 г. и ликвидации передачи инфекции (сведение числа случаев к нулю) к 2030 г.
Бремя болезни
Сонная болезнь угрожает здоровью миллионов людей в 36 странах Африки к югу от Сахары. Многие из них проживают в отдаленных районах с ограниченным доступом к необходимой медицинской помощи, что затрудняет эпиднадзор и, следовательно, диагностику и лечение больных. Кроме того, важными факторами, способствующими передаче инфекции, являются перемещение населения, вооруженные конфликты и нищета.
Текущий ареал распространения заболевания
Показатели распространенности болезни варьируются между странами, а также между районами на территории отдельно взятой страны.
Механизм передачи и симптомы
Болезнь передается главным образом при укусе инфицированной мухи цеце, однако известны и другие механизмы передачи инфекции:
- передача инфекции от матери ребенку: трипаносомы могут проходить через плаценту и инфицировать плод;
- возможна механическая передача через других кровососущих насекомых, однако эпидемиологическая значимость этого пути передачи инфекции неизвестна;
- известны случаи случайного инфицирования персонала лабораторий в результате травмы зараженной иглой;
- есть сведения о передаче паразита половым путем.
На первой стадии инфекции трипаносомы размножаются в подкожных тканях, крови и лимфе. Эта стадия известна как гемолимфатическая фаза болезни, для которой характерны приступы лихорадки, головная боль, увеличение лимфоузлов, боль в суставах и зуд.
На второй стадии паразиты проходят гематоэнцефалический барьер и инфицируют центральную нервную систему. Эта стадия известна как неврологическая, или менингоэнцефалитическая. В целом на этой стадии появляются наиболее очевидные признаки и симптомы болезни: изменение поведения, спутанность сознания, сенсорные расстройства и нарушение координации движений. Важным клиническим признаком на этой стадии является нарушение цикла сна, которое и дало название этой болезни. Без лечения сонная болезнь считается смертельной, хотя известны случаи здорового носительства инфекции.
Ведение болезни: постановка диагноза
Ведение болезни осуществляется в три этапа:
- Скрининг на предмет выявления вероятной инфекции. Он включает серологическое исследование (возможно только в отношении T.b. gambiense) и проверку на наличие клинических признаков, в частности увеличения шейных лимфатических узлов.
- Поиск паразита в биологических жидкостях.
- Определение стадии болезни. Для этого выполняется клиническое обследование пациента и в некоторых случаях исследование спинномозговой жидкости, полученной путем люмбальной пункции.
Во избежание необходимости применения сложных и тяжелых методов лечения диагностика должна выполняться как можно раньше до развития неврологической стадии заболевания.
Ввиду длительного и бессимптомного течения первой стадии сонной болезни, вызванной T. b. gambiense, рекомендуется организация тщательного и активного скрининга групп риска с целью выявления пациентов на ранней стадии заболевания и ограничения дальнейшего распространения инфекции посредством их лечения, после которого они перестают выступать в качестве резервуара. Всесторонний скрининг населения требует серьезных финансовых вложений в кадровые и материальные ресурсы. В Африке, особенно в отдаленных районах с наибольшей распространенностью заболевания, этих ресурсов часто не хватает. В результате часть инфицированных умирает еще до постановки диагноза и получения лечения.
Тип лечения зависит от формы и стадии заболевания. Раннее выявление болезни повышает шансы на успешное излечение. Ввиду того что паразит может сохранять жизнеспособность в течение длительного времени и вызывать рецидивы через много месяцев после окончания терапии, для оценки результатов лечения пациенты должны оставаться под наблюдением в течение периода продолжительностью до 24 месяцев, в рамках которого следует проводить клиническое обследование пациентов и выполнять лабораторные исследования физиологических жидкостей, в том числе в некоторых случаях спинномозговой жидкости, полученной путем люмбальной пункции.
Для успешного лечения болезни на второй стадии необходимо применение лекарственных препаратов, способных преодолевать гематоэнцефалический барьер и нейтрализовать паразита в центральной нервной системе.
Препараты для лечения болезни на первой стадии:
- Пентамидин: впервые получен в 1940 г., используется для лечения сонной болезни, вызванной T.b. gambiense, на первой стадии. Несмотря на наличие серьезных побочных эффектов, препарат в целом хорошо переносится.
- Сурамин: впервые получен в 1920 г., используется для лечения болезни, вызванной T.b. rhodesiense, на первой стадии. Препарат имеет ряд нежелательных побочных эффектов, включая нефротоксическое действие и аллергические реакции.
Препараты для лечения болезни на второй стадии:
Препараты для лечения заболевания на обеих стадиях:
Фексинидазол – пероральный препарат для лечения гамбийской формы африканского трипаносомоза человека. В 2019 г. препарат был включен в Перечень основных лекарственных средств ВОЗ и рекомендован в руководстве ВОЗ по лечению африканского трипаносомоза человека. Препарат показан в качестве терапии первой линии на первой и нетяжелой второй стадии заболевания. Он принимается в течение 10 дней через 30 минут после приема твердой пищи под наблюдением квалифицированного медицинского персонала. В настоящее время проводятся клинические испытания этого препарата для лечения родезийской формы трипаносомоза.
Частно-государственные партнерства
В 2000 и 2001 гг. ВОЗ учредила частно-государственное партнерство с компаниями Aventis Pharma (в настоящее время Sanofi) и Bayer HealthCare, в результате чего была создана программа по эпиднадзору и борьбе с данным заболеванием под руководством ВОЗ, в рамках которой эндемичным странам предоставляется поддержка в осуществлении противоэпидемических мероприятий и бесплатно поставляются лекарственные препараты.
Партнерство неоднократно продлевалось в 2006, 2011, 2016 и 2021 г. Успехи в сокращении числа случаев сонной болезни и появление реальной перспективы ее элиминации побудили ряд других партнеров из частного сектора поддержать инициативу ВОЗ по элиминации болезни как проблемы общественного здравоохранения и обеспечению ликвидации передачи инфекции к 2030 г.
ВОЗ оказывает содействие и техническую поддержку национальным программам по борьбе с сонной болезнью.
Организация на безвозмездной основе поставляет эндемичным странам противотрипаносомные лекарственные средства в рамках частно-государственных партнерств с компаниями Sanofi (пентамидин, меларсопрол, эфлорнитин и фексинидазол) и Bayer HealthCare (сурамин и нифуртимокс). Отгрузка и транспортировка лекарственных препаратов осуществляется совместно с логистическим отделением организации «Врачи без границ» MSF-Logistics.
Для содействия разработке новых и недорогостоящих средств диагностики ВОЗ в 2009 г. создала банк образцов биоматериалов, которыми могут пользоваться исследователи. В банке, размещенном в Институте Пастера в Париже, хранятся образцы крови, сыворотки, спинномозговой жидкости, слюны и мочи, взятые у пациентов, инфицированных обеими формами болезни, а также образцы, взятые у неинфицированных людей из эндемичных районов.
В 2014 г. в целях активизации и поддержки усилий по элиминации болезни по инициативе ВОЗ была создана координационная сеть по африканскому трипаносомозу человека. В число партнеров этой сети вошли национальные программы по борьбе с сонной болезнью, организации, занимающиеся созданием новых лекарственных и диагностических средств, международные и неправительственные организации, а также организации-доноры.
Читайте также:
