Перспективы изучения актина
Добавил пользователь Alex Обновлено: 30.01.2026
На сегодняшний день существуют работы, посвященные … вообще. Однако мы решили изучить эту тему на примере своего класса/школы и в этом заключается новизна нашего исследования.
Цель работы
Основная цель работы — ответить на вопрос … / доказать, что …
Задачи
Для достижения поставленной цели нам необходимо решить следующие задачи:
Для достижения этой цели поставлены следующие задачи:
К задачам работы относятся:
Изучить литературу по теме
Выяснить значение терминов …
Найти примеры … в … / собрать материал … / изучить состав … / измерить уровень …
Провести опрос / эксперимент / наблюдение
Сравнить/ сопоставить /проанализировать полученные результаты
Сделать выводы о …
ГЛАВЫ
Первая глава (теоретическая)
Основные термины и понятия, история вопроса
Ключевые понятия для нашего исследования – это ….
Иванов В.В. в книге … определяет понятие … как …
Петров В.В. понимает под термином …
Сидоров С.С. рассматривает … как …
Андреев А.А. в книге «…» дает следующее определение …
Сайт … предлагает следующее определение понятия …
В статье Иванова «…» в журнале «…» говорится, что …
Принято считать, что …
Вначале обратимся к истории вопроса …
История вопроса подробно освещена на страницах современных энциклопедий, например … , а также на сайте … Впервые ….
Из книги … мы узнали, что …
Как пишет Иванов И.И. … в статье … «…», …
По мнению Иванова В.В. …
Возможно, это связано …
Распространённым является мнение, что …
При этом необходимо подчеркнуть, что …
Вторая глава – описание исследования
Для того чтобы выяснить … мы решили провести опрос … среди учащихся / родителей нашего класса. Опрос проводился посредством анкетирования / опроса в социальных сетях. В опросе приняли участие … учащихся и … родителей.
Респондентам были заданы следующие вопросы: …
Исследование проводилось на материале …
В качестве материала для исследования мы взяли ….
Источником примеров стали …
Результаты анкетирования представлены в таблице 1.
На рисунке 2 вы можете видеть …
На рисунке 3 представлены …
В данном случае мы видим … / имеем дело с …
При этом нельзя не отметить …
Обращает на себя внимание тот факт, что …
ВЫВОДЫ, ЗАКЛЮЧЕНИЕ
Выводы по главам
На основании всего вышесказанного мы можем констатировать …
Все вышесказанное дает нам возможность сделать следующие выводы: …
Как видно из всего, сказанного выше …
Из вышесказанного следует, что …
Подводя итоги вышесказанному необходимо отметить следующее …
Подводя итоги главе 2 необходимо подчеркнуть …
Подводя промежуточные итоги, мы можем сказать, что …
В результате проведенного исследования мы выяснили, что …
В заключении необходимо отметить …
Проведенное исследование позволило нам сделать следующие выводы …
В ходе проведённого исследования было выявлено / установлено, что …
Таким образом, мы убедились …
Все вышесказанное доказывает, что …
На основании вышесказанного логично предположить, что …
Все вышесказанное убеждает нас в том, что …
Наиболее правдоподобной нам кажется версия …, потому что …
Найденные и проанализированные нами примеры позволяют выявить следующую закономерность: …
Заключение
Перспективы дальнейшего исследования
Перспективы дальнейшего исследования проблемы мы видим в более подробном / детальном изучении …
В перспективе было бы интересно …
На наш взгляд было бы интересно изучить / исследовать / рассмотреть …
Кроме …, рассмотренных в данной работе, по нашему мнению было бы интересно изучить …
Работа рассматривает лишь один из аспектов проблемы. Исследования в этом направлении могут быть продолжены. Это могло бы быть изучение не только …, но и …
Назначение работы
Исследование может быть полезно и интересно учащимся школ, которые увлекаются … , а также всем, кто интересуется …
Результаты нашего исследования могли бы помочь ребятам в …
Работа может представлять интерес для …
Результаты исследования могут быть использованы учителями при подготовке уроков / конкурсов / викторин по теме ….
Работа может быть использована для проведения дальнейших исследований …
Практическая значимость исследования заключается в том, что его результаты легли в основу разработанных нами правил … / памятки по … для …
Перспективы изучения актина
В исследованиях механизма полимеризации актина и контроля за этим процессом достигнут существенный прогресс. Однако еще предстоит выяснить, как различные пути передачи сигнала обеспечивают организацию актинового цитоскелета в функционально специализированные структуры.
В частности, какие конкретные белки осуществляют нуклеацию, копирование и образование сшивок при формировании филоподий? Какие белки необходимы для организации контрактильного кольца?
Три отдельных элемента цитоскелета (актиновые филаменты, микротрубочки и промежуточные филаменты) интенсивно взаимодействуют между собой. Например, транспортируемые везикулы и органеллы способны продвигаться по актиновым филаментам и микротрубочкам, моторы микротрубочек связываются с промежуточными филаментами и транспортируют их, а миозиновые моторы и другие белки, связывающие актин, обнаружены в комплексе с белками, связывающимися с микротрубочками.
В настоящее время исследователи выясняют, каким образом взаимодействуют элементы цитоскелета и какие последствия имеют для клетки такие взаимодействия.
Многое еще предстоит выяснить в отношении функций большинства представителей семейства миозинов. Мы располагаем информацией о процессах, в которых принимают участие белки семейства миозинов, однако детали функционирования в этих процессах белковых моторов пока неизвестны.
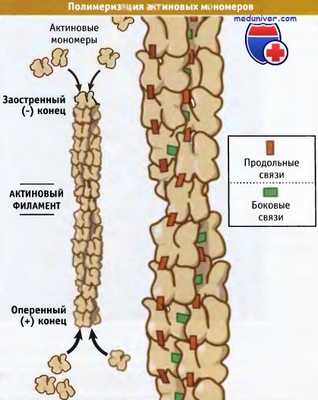
Актиновые мономеры собираются «голова к хвосту»,
образуя двунитевые поляризованные филаменты.
К числу наиболее актуальных вопросов относятся следующие: Почему для функционирования белков систем передачи сигнала необходимы моторные домены (миозин II, -IX, и -XVI)? Какую роль в эндоцитозе и движении мембран играют такие миозины, как миозин-I и -VI? Какова роль миозинов в регуляции структуры богатых актином клеточных выростов (миозин-I, -VI, -VII, и -XV)? Исследователи продолжают изучать биохимические, структурные и клеточные свойства миозинов, помогающие понять молекулярные механизмы их функционирования.
Актиновый цитоскелет представляет собой опорную структуру, которая позволяет клетке принимать определенную форму, обеспечивает подвижность и изменение местоположения ее внутренних структур и органелл. Эти динамические свойства цитоскелета обеспечиваются за счет сборки и разборки актиновых филаментов, которые представляют собой структурно поляризованные полимеры, состоящие из актиновых мономеров. В клетке сборка актиновых филаментов из мономеров и процесс их обратной разборки находятся под строгим контролем со стороны многих белков, связывающихся с актином.
Эти белки регулируют полимеризацию новых актиновых филаментов, предотвращают полимеризацию актиновых мономеров, контролируют длину филаментов и сшивают их между собой. Взаимодействие процессов передачи сигнала с белками, связывающими актин, представляет собой один из способов контроля динамики и структурного состояния цитоскелета.
Миозины представляют собой белки, способные связываться с актином, которые для выполнения механической работы используют энергию, высвобождающуюся при гидролизе АТФ. Миозины обнаружены во всех клетках эукариот и представляют собой большое семейство белков, включающее, по меньшей мере, восемнадцать белковых групп. Структура и биохимические свойства различных изоформ миозинов, которые возникли в ходе эволюции, позволяют им выполнять в клетке разнообразные роли.
Миозины участвуют в процессах мышечного и клеточного сокращения, в транспорте мембран и везикул, в регуляции формы и полярности клеток, а также в системе передачи сигналов.
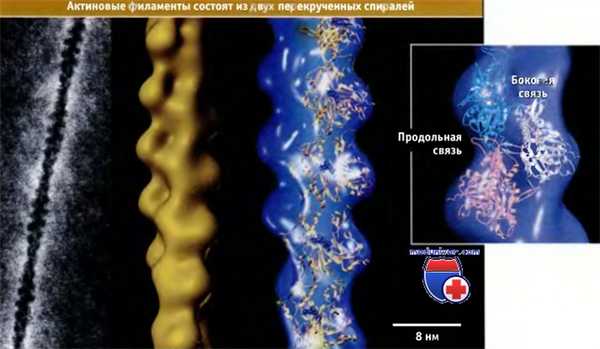
(Слева) Фотография актинового филамента, сделанная с помощью электронного микроскопа.
(В середине) Модель актинового филамента, построенная на основании трехмерной реконструкции электронных микрофотографий.
(Справа) Атомные структуры актиновых мономеров расположены на фоне трехмерной модели и иллюстрируют размещение субъединиц в одной цепи актинового филамента.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Строение саркомера и сокращение мышцы
• Миозин II представляет собой мотор, обеспечивающий сокращение мышц
• Актин и миозин II являются основными компонентами саркомера, основной единицей сокращения поперечнополосатых мышц
Мышцы представляют собой ткань, способную к сокращению, которая обеспечивает движение тела и подвижность органов. В соответствии с внешним видом сократительных волокон, мышцы можно подразделить на две основных группы: поперечнополосатые и гладкие. Волокна поперечнополосатых мышц называются так потому, что при большом увеличении можно видеть их характерную исчерченность. К этой группе относятся скелетные и сердечная мышцы.
Скелетные мышцы обеспечивают подвижность скелета, а сердечная сокращение сердца. Волокна гладких мышц не исчерченные и имеют веретенообразную форму. Эти мышцы образуют стенки органов, например мочевого пузыря, кровеносных сосудов и желудочно-кишечного тракта.
Белковый мотор, который обеспечивает сокращение мышц, относится к семейству миозина II. Этот миозин принадлежит к числу наиболее распространенных белков позвоночных, он легко выделяется и поэтому является одним из хорошо изученных белков.
На рисунке ниже представлено строение молекулы миозина II, состоящей из шести полипептидных цепей: двух тяжелых и двух наборов, каждый из которых состоит из двух легких цепей.
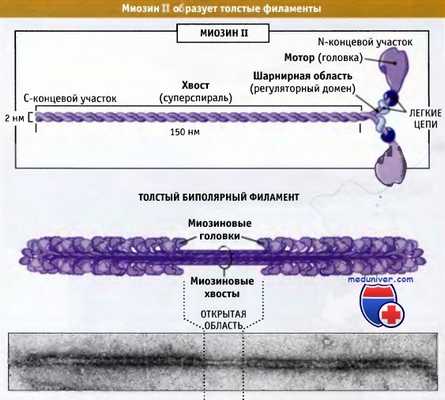
Миозин II представляет собой гексамерный комплекс,
состоящий из двух тяжелых цепей и двух пар различных легких цепей.
Эти комплексы собираются в биполярные толстые филаменты.
Дистальный участок хвоста мышечного миозина II связан с другими молекулами миозина II, образуя волокна, состоящие примерно из 300 молекул миозина. Эти волокна биполярны, и моторные домены всех миозинов направлены от центральной зоны. Эти волокна называются толстые биполярные филаменты. В настоящем разделе мы обсудим организацию и роль миозина II в сокращении поперечнополосатых мышц. Эти вопросы хорошо изучены.
Поперечнополосатые мышцы состоят из пучков мышечных волокон. Последние представляют собой крупные многоядерные клетки, длина которых варьирует от нескольких миллиметров до нескольких сантиметров, а диаметр составляет 20-100 мкм. Рисунок ниже показывает, что каждое мышечное волокно состоит более чем из 1000 миофибрилл, которые представляют собой палочковидные органеллы, способные к сокращению. Миофибриллы состоят из повторяющихся единиц, которые называются саркомеры. Саркомеры расположены друг за другом и обусловливают характерную исчерченность мышц.
Саркомеры представляют собой основные сокращающиеся единицы поперечнополосатых мышц; при сокращении и расслаблении мышцы их длина изменяется. Как показано на рисунке ниже, саркомеры содержат толстые филаменты, состоящие, главным образом, из биполярных филаментов миозина II, и тонких филаментов, которые содержат актиновые нити и регуляторные белки. Оперенные концы актиновых филаментов с одной стороны прикреплены к структуре саркомера, которая носит название Z-диск. При этом все актиновые филаменты с одной стороны Z-диска имеют одинаковую полярность.
Актиновые филаменты прикрепляются к Z-диску и копируются за счет связывания с копирующим белком (CapZ), что предотвращает деполимеризацию актиновых филаментов. Заостренные концы актиновых филаментов ориентированы к центру саркомера и копированы тропомодулином. С актиновыми филаментами также взаимодействует белок небулин; он может регулировать сборку волокон и длину тонких филаментов.
Толстые филаменты находятся в центре, на М-линии, между Z-дисками. М-линия представляет собой структуру, состоящую из гибко связанных биполярных толстых филаментов; эти связи скрепляют толстые филаменты, гексагонально расположенные внутри. Наряду с М-линией, белок филаментов, который называется титаном, образует эластичные связи между Z-дисками и миозиновыми волокнами. Титин обеспечивает центровку толстых филаментов в саркомере и действует как пружина, которая не допускает растягиваться саркомеру.
Тонкие и толстые филаменты переплетаются, образуя трехмерную решетчатую структуру. Поскольку саркомер биполярен, в обеих половинах миозиновые моторы по отношению к актину ориентированы одинаково. При сокращении моторные домены миозина толстых филаментов взаимодействуют с актином тонких филаментов. При сокращении саркомер укорачивается за счет скольжения тонких и толстых филаментов относительно друг друга, что сближает соседние Z-диски к центру саркомера. По мере продвижения головок миозина к зазубренным концам актиновых филаментов, длина толстых и тонких филаментов остается постянной.
Ширина саркомера в расслабленной мышце позвоночных составляет около 3 мкм, а при сокращении она становится около 2,4 мкм.
В мышечном волокне укорачиваются группы, состоящие из тысяч саркомеров, что приводит к укорачиванию всей мышцы. Общая длина укороченного мышечного волокна определяется двумя факторами: длиной, на которую укорачивается каждый саркомер, и количеством саркомеров в группе. Процентная величина, на которую происходит укорачивание мышечных волокон, одна и та же, независимо от их длины.
Величина усилия, генерируемого саркомером, пропорционально числу акто-миозиновых взаимодействий в половине саркомера, а величина усилия, которое развивает мышчное волокно, пропорционально числу параллельно расположенных саркомеров. Таким образом, штангисты увеличивают свою силу за счет увеличения площади поперечного сечения мышц, а не за счет их длины.
Как показано на рисунке ниже, сокращение поперечнополосатых мышц регулируется с участием тропонин-тропомиозинового комплекса, который связан с актином в тонких филаментах. Молекулы тропомиозина представляют собой суперспирализованные полипептиды длиной 40 нм. Она располагаются друг за другом вдоль актиновых спиралей. Тропонин представляете собой комплекс из трех различных белков: тропонина С, тропонина I и тропонина Т. Один комплекс связывается с тропомиозином так, что они располагаются вдоль тонких филаментов через 40 нм интервалы.
При низких концентрациях ионов кальция тропомиозин находится в таком состоянии, что пространственно блокирует сайт связывания миозина на актине, так что мышца расслабляется и гидролиз АТФ под действием миозина происходит очень медленно. За счет взаимодействия актина с миозином релаксированные саркомеры способны к пассивному растяжению, оказывая небольшое сопротивление.
Нервные импульсы вызывают выход кальция в цитозоль из саркоплазматического ретикулума. Последний представляет собой органеллу, которая депонирует кальций в мышце. Повышение уровня кальция в цитозоле приводит к его связыванию с тропонином-С и к конформационным изменениям в молекуле белка. В результате этих изменений тропомиозин отходит от миозин-связывающего сайта в актине, и миозин получает возможность взаимодействовать с актином и генернировать усилия за счет механохимического цикла.
Скелетные мышцы состоят из мышечных волокон, содержащих миофибриллы и представляющих собой удлиненные клетки.
Миофибриллы способны к сокращению и содержат повторяющиеся структурные единицы, называемые саркомерами. На конце каждого саркомера находится Z-диск, к которому через CapZ (кэпирующий белок) присоединяются актиновые филаменты.
Толстые миозиновые филаменты соединяются с Z-диском через белок титин и вплетаются между актиновыми филментами.
Небулин проходит от Z-диска к тропомодулину. Однако как он связывает актин, пока неизвестно. Сокращение мышцы происходит, когда толстые миозиновые филаменты присоединяются к актиновым и перемещают их таким образом,
что Z-диски сдвигаются относительно друг друга. При этом длина саркомера уменьшается. Чем длиннее миофибрилла (т. е. чем больше саркомеров), тем более она укорачивается при сокращении.
Однако в процентном отношении величина укорачивания не зависит от числа саркомеров. Сокращение поперечнополосатых мышц регулируется уровнем Са2+ в цитозоле,
который определяет положение комплекса тропонин/тропомиозин относительно миозина и актина.
Белки регулирующие полимеризацию актина
• Полимеризация актина и динамика филаментов регулируются белками, относящимися к группе Rho малых G-белков
• Активация белков Rho, Rac и Cdc42 индуцирует образование ламеллоподий, филоподий и сократительных филаментов соответственно
Как отмечалось в предыдущей статье, серия событий, приводящих к перестройке актинового цитоскелета, начинается с поступления внешних сигналов, которые запускают внутриклеточную систему их реализации, активирующую белки WASP/Scar.
Многие агенты внешней среды, например ростовые факторы, хемоаттрактанты и хеморепелленты, которые способствуют миграции клетки и изменению ее формы, связываются с трансмембранными рецепторами. Передача сигнала именно через эти рецепторы приводит к активации белков группы Rho, относящихся к мономерным G-белкам, причем различные рецепторы ответственны за активацию различных белков.
Белки Rho представляют собой ГТФазы и относятся к подгруппе Ras, которые обладают способностью активироваться при обмене ГДФ на ГТФ. У человека идентифицировано по меньшей мере двадцать различных генов, кодирующих белки группы Rho. На основании первичной структуры и клеточных функций эти белки можно подразделить на подгруппы, которые обозначаются Rho, Rac и Cdc42. Многие белки играют критическую роль в регуляции изменений актинового цитоскелета в ответ на внешние сигналы.
Белки подгрупп Rac и Cdc42 способствуют перестройке актиновых структур за счет активации белков WASP/Scar и WAVE. Последние, в свою очередь, активируют комплекс Arp2/3. Рисунок ниже иллюстрирует результат активации белков Rac, Cdc42 и Rho, для каждого из которых в клетке существуют различные мишени и которые поэтому индуцируют образование различных актиновых структур.
Белки подгруппы Rac индуцируют образование ламеллоподий и мембранных складок (роффлов), структур, близких к ламеллоподиям, и способным отходить от дорзальной поверхности клетки и втягиваться обратно. Эти белки непосредственно не взаимодействуют с белками WAVE, однако могут высвобождать их из неактивного комплекса, так что последние способны связываться с комплексом Arp2/3. Белки подгруппы Cdc42 непосредственно связываются с WASP; это связывание приводит к переходу WASP из неактивной формы в активную, которая способна стимулировать комплекс Arp2/3. Активация белков Cdc42 обеспечивает образование связок актиновых филаментов и рост филоподий.
Белки подгруппы Rho стимулируют образование сократимых филаментов, содержащих актин и миозин II (напоминающих стресс-фибриллы). Предполагается, что эти сократимые филаменты помогают клетке противостоять механическим воздействиям; они также определяют адгезивные свойства клеток и принимают участие в их формообразовании. Сигналы, исходящие от Rho белков, приводят к фосфорилированию легких цепей миозина, что активирует немышечный миозин.
Белки Rho также стабилизируют миозин-содержащие филаменты, активируя киназу (LIM киназу), которая фосфорилирует кофилин и ингибирует процессы разрезания и деполимеризации актиновых филаментов. Также белки этой подгруппы участвуют в активации нуклеации актиновых филаментов в клетках дрожжей, вызываемой формином.
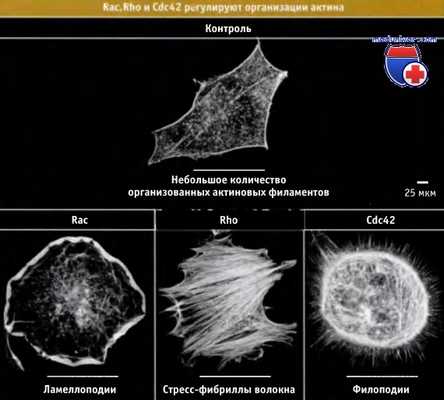
Активация Rac, Rho или Cdc42 в клетке приводит к образованию актиновых структур различного типа.
После окрашивания актиновых структур клетки исследовали во флуоресцентном микроскопе.
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
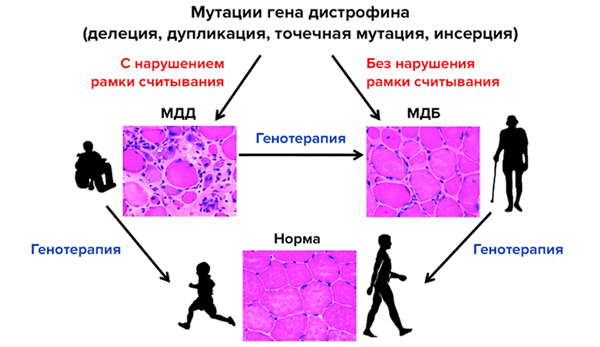
Новость
Принцип генной терапии миодистрофии Дюшенна/Беккера. Миодистрофию Дюшенна (МДД) вызывают мутации гена дистрофина (DMD), приводящие к сдвигу рамки считывания, а более мягкую миодистрофию Беккера (МДБ) — мутации без смещения рамки считывания. Лечения этой болезни пока нет. Генная терапия поможет улучшить или даже восстановить функции мышц.
Автор
Редакторы
Мышечная дистрофия Дюшенна — тяжелейшее Х-связанное заболевание, эффективного лечения которого до сих пор нет. В одном из последних номеров Science вышли целых три статьи об успешном тестировании на мышиных моделях технологии CRISPR/Cas9 для лечения этой болезни. Может быть, у этого подхода есть шанс добраться и до клиник?
Мышечная дистрофия Дюшенна, от которой страдает один из 3600-5000 новорожденных мальчиков, вызывается отсутствием дистрофина — белка, который соединяет цитоскелет и внеклеточный матрикс в мышечном волокне и обеспечивает его стабильность при сокращении (рис. 1). Из-за мутаций гена DMD рамка считывания при трансляции его мРНК сдвигается, и синтез белка преждевременно прекращается. Врожденная болезнь очень быстро прогрессирует: ее диагностируют в возрасте около четырех лет, а к 10 годам ребенку обычно уже нужна инвалидная коляска. Это происходит потому, что без дистрофина волокна повреждаются, и как только регенеративная способность мышечных волокон исчерпывается, они заменяются фиброзной и жировой тканями [1]. Как показывают исследования, когнитивные функции у ребенка тоже могут быть нарушены [2]. Больше 30 лет с таким заболеванием, как правило, не живут, а смерть наступает от сердечных и респираторных осложнений. Более мягкий вид миодистрофии, связанной с геном DMD, — это мышечная дистрофия Беккера, когда мутации не приводят к смещению рамки считывания [3].
Дистрофин находится на внутриклеточной поверхности сарколеммы вдоль всей длины мышечных волокон и входит в состав дистрофин-ассоциированного гликопротеинового комплекса (ДАГК, DGC). Он связывается одним концом с F-актином цитоскелета, а другим — с β-дистрогликаном, что стабилизирует волокна во время сокращения. Ген дистрофина — один из самых длинных у человека.
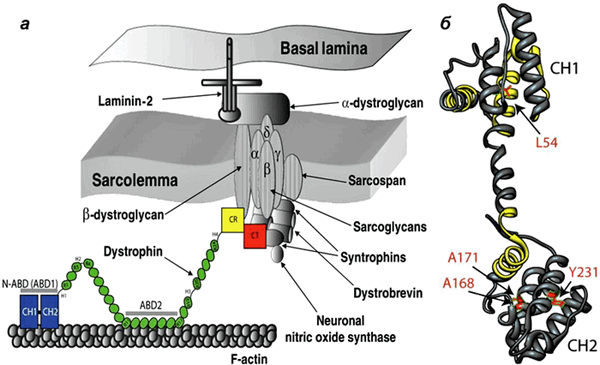
Рисунок 1. Мутации в дистрофине — причина развития миодистрофии Дюшенна. а - Дистрофин связывается с актиновыми филаментами (часть цитоскелета) через домены N-ABD и ABD2) и с ДАГК через домены CR и CT. б — Кристаллическая структура N-ABD дистрофина. Зоны связывания с актином показаны желтым, четыре хорошо изученных мутации, вызывающих заболевание, — красным.
Излечивать мышечную дистрофию Дюшенна пока не умеют, а сегодняшняя терапия направлена на замедление прогрессирования болезни и лечение осложнений [4], [5]. «Золотой стандарт» — это кортикостероиды, которые были предложены в качестве лечения еще несколько десятилетий назад. Однако их применение вызывает множество побочных эффектов.
Неудивительно, что многие группы генетиков и молекулярщиков занимаются разработкой пре- и постнатального лечения миодистрофии Дюшенна. Болезнь в основном изучают на различных линиях мышей. В одном из последних номеров Science опубликовали сразу три независимых работы по методам лечения мышечной дистрофии Дюшенна [6–8]. Исследовательские группы возглавили Эрик Олсон (Eric Olson) из Техасского университета, Эми Уаджерс (Amy Wagers) из Гарвардского университета и Чарльз Герсбах (Charles Gersbach) из Университета Дьюка. Все группы для восстановления функции мышц использовали методику пропуска экзонов, при которой один или несколько экзонов удаляются из мРНК (рис. 2). В таком случае белок получается короче, но всё же может выполнять свою поддерживающую и заякоривающую функции в мышечном волокне, а «досадное обстоятельство» — лишний стоп-кодон — тоже оказывается «пропущенным».
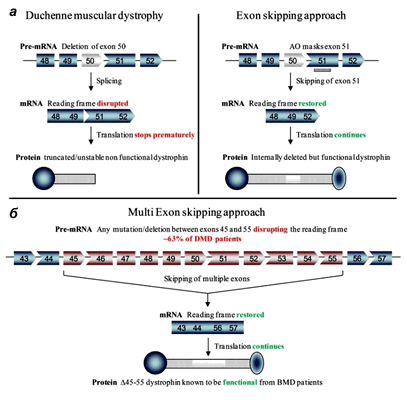
Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD присутствуют мутации, нарушающие рамку считывания при синтезе белка. Например, при делеции экзона 50 появляется «внерамочная» мРНК, что приводит к синтезу усеченного нефункционального или нестабильного дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б — Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов 45–55, мутации которых встречаются примерно у 63% пациентов, то образовавшийся короткий дистрофин приведёт к трансформации стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип.
У стратегии удаления экзонов есть даже преимущества перед воссозданием полной длины гена: ее проще разработать, чем восстановить индивидуальные делеции каждого пациента [7].
Для вырезания «лишних» нуклеотидных последовательностей исследователи воспользовались технологией редактирования генома CRISPR (clustered regularly interspaced short palindromic repeats) / Cas9 (CRISPR-associated protein 9) [9], которую, между прочим, только что разрешили применить в опытах на эмбрионах одному лондонскому институту [10].
Конкурирующие лаборатории: кто первым воплотит технологию в терапию для человека?
Ученые трех лабораторий успешно применили технологию пропуска экзонов in vivo на стандартном объекте — мышах — и показали, что их метод помогает восстановить рамку считывания и частично восстановить синтез дистрофина. Поскольку даже невысокий его уровень (3–15% от нормального) приносит терапевтическую пользу, результаты работ можно назвать успешными.
Группа Эрика Олсона уже не в первый раз использует метод CRISPR/Cas9 в своих работах по мышечной дистрофии Дюшенна. В 2014 году ученые исправили мутацию в зародышевой линии мышей и предотвратили развитие болезни. Однако, поскольку пренатальное редактирование генома на человеческих эмбрионах (пока?) запрещено, исследователям пришлось придумать способ постнатального применения технологии.
В их последней работе для доставки необходимых для редактирования компонентов в ткани использовался аденоассоциированный вирус-9 (AAV9, adeno-associated virus-9) [6]. Исследователи испытали несколько способов введения AAV9 в различные дни после рождения мышат. Во всех случаях экспрессия гена дистрофина в сердечной и скелетных мышцах восстановилась, но в разной степени. Более того, продукция белка увеличивалась с 3 до 12 недель после инъекций, а через 4 недели после инъекций улучшилась функция скелетных мышц. «Сейчас задача для исследователей из центра Уэллстоун заключается в том, чтобы перенести открытия с мышиной модели на пациентов с миодистрофией», — говорит Прадип Маммен (Pradeep Mammen), содиректор центра Уэллстоун.
Группа Эми Уаджерс провела во многом похожий эксперимент [8]. После множества подготовительных этапов работы по редактированию генома и пропуску экзона на клетках и животных их опыт тоже увенчался успехом: программируемые CRISPR-комплексы в составе аденоассоциированного вируса (AAV) были доставлены с помощью локального и системного введения к дифференцированным скелетным волокнам, кардиомиоцитам и сателлитным мышечным клеткам новорожденных и взрослых мышей. Если редактирование направлено только на мышечные волокна, то эффект со временем может сойти на нет. Однако, как отмечает Уаджерс, редактирование генов в сателлитных клетках может обеспечить гораздо более длительный результат. Оно способно привести к созданию пула регенеративных клеток, несущих отредактированный ген дистрофина, и в результате обычной репарации мышц отредактированный ген окажется и в мышечных волокнах.
Наконец, как все уже догадались, ученые под руководством Чарльза Герсбаха тоже обнаружили терапевтический эффект применения AAV-CRISPR/Cas9 в мышиной модели [7]. Внутрибрюшинное введение вирусного вектора новорожденным мышам привело к восстановлению синтеза дистрофина в абдоминальных мышцах (мышцах живота), диафрагме и сердце через семь недель после инъекции. Как отмечают авторы, терапия сердечной и легочной мышц крайне важна, поскольку именно их отказ зачастую приводит к смерти пациентов с болезнью Дюшенна. Внутривенное введение AAV-векторов шестинедельным мышам тоже привело к значительному восстановлению продукции дистрофина в сердечной мышце. «Остается еще много работы по переделке [технологии] в терапию для человека и подтверждения ее безопасности, — говорит Герсбах. — Но результаты наших первых экспериментов уже весьма воодушевляющие». Группа собирается оптимизировать систему доставки и оценивать эффективность и безопасность стратегии на более крупных животных (рис. 3). Какая же из трех лабораторий обгонит других и первой сможет провести испытания на человеке?
Терапия миодистрофии Дюшенна: старые и новые подходы
По словам Олсона, главное отличие новой стратегии с использованием вектора, вмещающего в себя компоненты для редактирования генома, от других терапевтических методов в том, что она устраняет причину болезни. А какие еще подходы разрабатывают ученые?
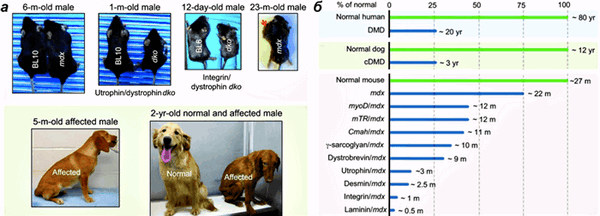
Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху: у мышей mdx симптомы проявляются только в старости, и они склонны к образованию рабдомиосарком — опухолей мышечного происхождения. Размер мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей.
Один из многообещающих подходов — это клеточная терапия. Хотя опыты с внутримышечной инъекцией миобластов от здоровых доноров провалились, технологии с использованием стволовых клеток и индуцированных плюрипотентных стволовых клеток (ИПСК) пока успешно испытываются на моделях не только миодистрофии Дюшенна, но и болезни Альцгеймера, Паркинсона, Хантингтона, спинальной мышечной атрофии, бокового амиотрофического склероза, аутизма и шизофрении [14–16]. Например, в 2013 году исследователи из Бостонской детской больницы (Boston Children’s Hospital’s Stem Cell Program) с помощью смеси трех малых молекул (форсколина, основного фактора роста фибробластов bFGF и ингибитора гликогенсинтазы киназы-3) перепрограммировали ИПСК из кожи пациентов с миодистрофией Дюшенна в мышечные клетки, которые затем успешно прижились у мышей. Сейчас из ИПСК получены кардиомиобласты и нейроны [2].
Другие исследования показывают, что восстановление нормального уровня синтеза оксида азота (NO), который снижается у больных из-за нарушения активности NO-синтазы (nNOS), ослабляет воспаление, повышает активность собственных стволовых клеток и реконструирует морфологию и функции скелетных мышц [3].
Уже в фазе II клинических испытаний находится препарат Givinostat — ингибитор гистондеацетилаз, который замедляет прогрессирование болезни в мышиной модели.
Такой массированный экспериментальный удар по миодистрофии Дюшенна вселяет надежду. Станет ли технология CRISPR/Cas9 ведущей в разработке терапии, которую смогут принять на вооружение клиницисты? Возможно, не за горами и публикации похожих работ по другим заболеваниям, где нужно избавиться от мутаций в одном-единственном гене? Это мы узнаем из ближайших выпусков Science (а также других почетных журналов).
Читайте также:
- Результаты алкоголизации межреберных нервов. Результаты межреберной блокады
- Обмен жиров и их депонирование. Жиры печени
- Диагностика мешотчатой аневризмы по КТ, МРТ, ангиограмме
- Взаимодействия антителообразующих клеток. Влияние клеток на синтез антител
- Симптомы дефицита кальция в организме. Как восполнить нехватку кальция?
