Обмен жиров и их депонирование. Жиры печени
Добавил пользователь Morpheus Обновлено: 28.01.2026
Функции и задачи печени. Анатомия печени с точки зрения физиологии
Печень как самостоятельный орган выполняет многообразные функции, которые часто оказы ваются взаимосвязанными. Это становится особенно заметным при заболеваниях печени, которые сопровождаются одновременными нарушениями многих функций. Цель данных статей по физиологии на сайте — дать обзорные представления об основных функциях печени, включая:
(1) фильтрацию и депонирование крови;
(2) метаболизм белков, жиров, углеводов, гормонов и чужеродных веществ;
(3) образование желчи;
(4) депонирование витаминов и железа;
(5) образование факторов коагуляции.
Печень является самым крупным органом тела, ее масса составляет около 2% общей массы тела, или 1,5 кг у взрослого человека. Основной функциональной единицей печени является печеночная долька, представляющая собой структуру цилиндрической формы длиной несколько милли метров, диаметр дольки колеблется от 0,8 до 2 мм. Печень человека состоит из 50000-100000 отдельных долек.
Срез дольки печени располагается вокруг центральной вены, открывающейся в печеночную вену, которая, в свою очередь, впадает в полую вену. Сама долька состоит из многочисленных печеночных клеточных пластинок (две из них показаны на рисунке ниже), которые ради ально отходят от центральной вены наподобие спиц в колесе.
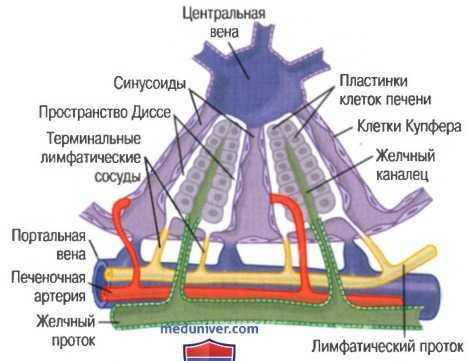
Основные структуры дольки печени. Показаны клеточные пластинки печени, кровеносные сосуды, система желчных ходов, лимфатическая система, состоящая из пространств Диссе и внутридольковых лимфатических сосудов
Каждая клеточная пластинка состоит из двух рядов клеток, между ними располагается мелкий желчный каналец, который опорожняется в желчный проток, лежащий в фиброзной перегородке, разделяющей соседние печеночные дольки.
В перегородке располагаются мелкие портальные венулы, которые получают кровь главным образом от гастроинтестинального тракта, оттекающую по воротной вене. Отсюда кровь течет в плоские ветвящиеся печеночные синусоидные капилляры, которые находятся между печеночными пластинками, а затем поступает в центральную вену. Таким образом, клетки печени длительно контактируют с венозной кровью, оттекающей по воротной вене.
В междольковой перегородке проходит печеночная артериола. Эти ар-териолы обеспечивают артериальной кровью ткани перегородки между соседними дольками. Многие мелкие артериолы несут кровь непосредственно в печеночные синусоидные капилляры, при этом наиболее частым вариантом является их впадение в синусоидные капилляры в области, расположенной на 1/3 расстояния от междольковой перегородки до центральной вены.
Кроме печеночных клеток, между двумя синусоидными капиллярами расположены два типа клеток:
(1) типичные эндотелиальные клетки;
(2) крупные купферовы клетки (также называемые ретикулоэндотелиальными клетками), которые являются макрофагами, постоянно присутствующими на границе между синусоидными капиллярами и способными фагоцитировать бактерии и прочие чужеродные вещества в крови печеночных синусоидных капилляров.
Эндотелий синусоидных капилляров снабжен чрезвычайно большими порами, диаметр некоторых из них равен 1 мкм. За этим слоем, располагаясь между ним и печеночными клетками, находятся узкие пространства, названные пространствами Диссе, или перисинусоидальными пространствами. Миллионы пространств Диссе связаны с лимфатическими сосудами в межлобулярных перегородках, поэтому избыток жидкости в этих пространствах имеет возможность перемещаться в лимфатическую систему. В связи с наличием крупных пор в эндотелии синусоидных капилляров вещества из плазмы легко проникают в пространства Диссе, и большая часть белков плазмы легко диффундирует в эти пространства.
Учебное видео анатомии печени, строения и схемы печеночной дольки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Обмен жиров и их депонирование. Жиры печени
а) Обмен жирами между жировой тканью и кровью. Тканевые липазы. Как обсуждалось ранее в статьях на сайте (просим вас пользоваться формой поиска выше), большие количества липаз присутствуют в жировой ткани. Некоторые из этих ферментов катализируют реакции, позволяющие депонировать в клетках триглицериды из хиломикронов и липопротеинов. Другие, будучи активированы гормонами, вызывают расщепление триглицеридов в жировых клетках с высвобождением свободных жирных кислот.
Вследствие быстрого обмена жирных кислот триглицериды в жировых клетках обновляются каждые 2-3 нед. Это означает, что жиры, хранящиеся в клетках сегодня, — совсем не те жиры, которые хранились там в прошлом месяце. Этот факт доказывает, что депонирование жиров представляет собой динамическое состояние.
б) Жиры печени. Главными функциями печени в связи с метаболизмом жиров являются:
(1) расщепление жиров на более мелкие составляющие, пригодные для использования на энергетические нужды;
(2) синтез триглицеридов, главным образом из углеводов и в меньшей степени — из белков;
(3) синтез других липидов из жирных кислот, особенно холестерола и фосфолипидов.
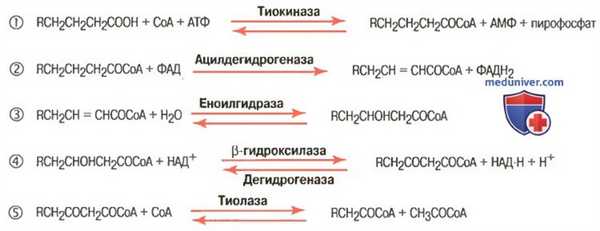
Бета-окисление жирных кислот в результате дает ацетилкоэнзим А
Большие количества триглицеридов появляются в печени:
(1) на ранних стадиях голодания;
(2) при сахарном диабете;
(3) в ряде других случаев, когда жиры вместо углеводов используются для энергетических целей.
В этих условиях большие количества триглицеридов мобилизуются из жировой ткани, транспортируются в виде свободных жирных кислот кровью и вновь превращаются в триглицериды в печени, где происходит большинство начальных стадий расщепления жиров.
Таким образом, в нормальных физиологических условиях общее количество триглицеридов в печени зависит в основном от уровня использования жиров как источника энергии.
Клетки печени, помимо триглицеридов, содержат большие количества холестерола и фосфолипидов, которые постоянно синтезируются печенью. Кроме того, клетки печени отличает большая по сравнению с прочими тканями способность к преобразованию жирных кислот, в которых отмечается увеличение ненасыщенных связей, поэтому триглицериды печени обладают большим количеством ненасыщенных связей, чем триглицериды жировой ткани.
Способность печени увеличивать количество ненасыщенных связей в жирных кислотах функционально важна для всех тканей организма, т.к. многие структурные компоненты клеток включают достаточное количество ненасыщенных жиров, главным источником которых является печень.
в) Использование триглицеридов для получения энергии. Образование аденозинтрифосфата. Почти 40% калорий обычного рациона американца обеспечивают жиры, что почти эквивалентно количеству калорий, источником которых служат углеводы, поэтому использование жиров в энергетических целях не уступает по значимости использованию углеводов. Кроме того, многие поступающие с пищей углеводы преобразуются в триглицериды, которые потом депонируются и позднее используются в виде жирных кислот, высвобождающихся из триглицеридов, в энергетических целях.
1. Гидролиз триглицеридов. Первым этапом использования триглицеридов в качестве источника энергии является их гидролиз до жирных кислот и глицерола. Далее как жирные кислоты, так и глицерол транспортируются кровью в активные ткани, где окисляются, давая энергию. Почти все клетки, за редким исключением (например, клетки мозга и красные клетки крови), могут использовать жирные кислоты в целях получения энергии.
Глицерол, попадая в клетки, под влиянием клеточных ферментов сразу преобразуется в глицерол-3-фосфат, который включается в гликолитический путь расщепления глюкозы и таким образом служит для получения энергии. Прежде чем жирные кислоты могут быть использованы для получения энергии, они должны подвергнуться следующим преобразованиям.
2. Поступление жирных кислот в митохондрии. Расщепление и окисление жирных кислот возможно только в митохондриях, поэтому первым этапом использования жирных кислот является их транспорт в митохондрии. Этот процесс опосредован переносчиком, в качестве которого выступает карнитин. Попав в митохондрию, жирная кислота отщепляется от карнитина и подвергается расщеплению и окислению.
Механизмы транспорта и метаболизма жиров (липидов)
После всасывания в эпителий кишки свободные жирные кислоты и 2-моноглицериды вновь образуют триглицериды и вместе с фосфолипидами и холестеролом включаются в хиломикроны. Хиломикроны транспортируются с током лимфы через грудной проток в верхнюю полую вену, попадая таким образом в общий кровоток.
Внутри хиломикрона триглицериды гидролизуются липопротеинлипазой, что приводит к высвобождению жирных кислот на поверхности кровеносных капилляров в тканях. Это обусловливает транспорт жирных кислот в ткани и последующее образование остатков хиломикронов, обедненных триглицеридами. Эти остатки затем забирают эфиры холестерола из липопротеинов высокой плотности, и частицы быстро захватываются печенью. Данную систему транспорта жирных кислот пищевого происхождения называют экзогенной транспортной системой.
Также существует эндогенная транспортная система, предназначенная для внутриорганного транспорта жирных кислот, образованных в самом организме. Липиды транспортируются из печени в периферические ткани и обратно, а также переносятся из жировых депо к различным органам. Транспорт липидов от печени к периферическим тканям включает согласованные действия ЛПОНП, липопротеинов промежуточной плотности (ЛППП), липопротеинов низкой плотности (ЛПНП) и липопротеинов высокой плотности (ЛПВП). Частицы ЛПОНП подобно хиломикронам состоят из большого гидрофобного ядра, образованного триглицеридами и эфирами холестерола, и поверхностного липидного слоя, состоящего в основном из фосфолипидов и холестерола.
ЛПОНП синтезируются в печени, и отложение жира в периферических тканях является их основной функцией. После попадания в кровоток ЛПОНП подвергаются воздействию липопротеинлипазы, которая гидролизует триглицериды до свободных жирных кислот. Свободные жирные кислоты, происходящие из хиломикронов или ЛПОНП, могут быть использованы в качестве источников энергии, структурных компонентов фосфолипидных мембран или превращаться обратно в триглицериды и в таком виде сохраняться. Триглицериды хиломикронов и ЛПОНП также подвергаются гидролизу липазы печени.
Частицы ЛПОНП посредством гидролиза триглицеридов превращаются в более плотные, меньшие по размеру холестерол- и триглицерид-обогащенные остатки (ЛППП), которые удаляются из плазмы с помощью рецепторов печеночных липопротеинов или могут быть превращены в ЛПНП. ЛПНП являются основными липопротеинами-переносчиками холестерола.
Возврат липидов из периферических тканей в печень часто называют обратным транспортом холестерола. Частицы ЛПВП участвуют в этом процессе, забирая холестерол из тканей и других липопротеинов и перенося его в печень для последующей экскреции. Еще один вид транспортировки, существующей между органами, — перенос жирных кислот из жировых депо к органам для окисления.
Жирные кислоты, получаемые в основном в результате гидролиза триглицеридов жировой ткани, секретируются в плазму, где соединяются с альбумином. Связанные с альбумином жирные кислоты переносятся по градиенту концентрации в ткани с активным метаболизмом, где и используются преимущественно в качестве источников энергии.
В течение последних 20 лет только несколько исследований были посвящены вопросу транспорта липидов в перинатальном периоде (результаты этих исследований в данном издании не представлены). Очевидна необходимость более детального изучения этой проблемы.
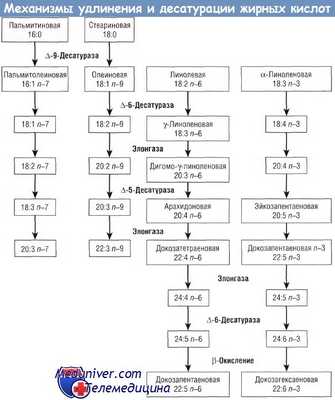
Жирные кислоты используются в качестве строительного материала в составе липидов клеточной стенки, в качестве источников энергии, а также откладываются «про запас» в виде триглицеридов преимущественно в жировой ткани. Некоторые омега-6 и омега-3 ДЦПНЖК являются предшественниками биологически активных метаболитов, используемых в сигнальной системе клеток, регуляции генов и других метаболически активных системах.
Вопрос о роли ДЦПНЖК ARA и DHA в процессе роста и развития ребенка является одним из важнейших вопросов в исследованиях, проводимых в области детской нутрициологии в течение последних двух десятилетий.
Липиды являются одними из основных компонентов клеточных мембран. Значительное количество исследований в области физиологии липидов посвящено двум жирным кислотам — ARA и DHA. ARA обнаружена в составе клеточных мембран всех структур организма человека; она является предшественником эйкозаноидов 2-й серии, лейкотриенов 3-й серии и других метаболитов, которые включены в сигнальные системы клеток и процесс генной регуляции. Исследования, посвященные DHA, часто указывают на ее структурную и функциональную роль в составе клеточных мембран.
Эта жирная кислота обнаружена в высокой концентрации в сером веществе головного мозга, а также в палочках и колбочках сетчатки. Исследования постепенного исключения из диеты животных омега-3 жирных кислот показали, что содержащие 22 атома углерода омега-6 ДЦПНЖК (например, 22:5 п—6) способны структурно, но не функционально заменить 22:6 n-3. При неадекватном уровне 22:6 n-3 в тканях выявляются нарушения зрения и познавательных способностей. Было показано, что изменение содержания 22:6 n-3 в тканях влияет на нейротрансмиттерную функцию, активность ионных каналов, сигнальные пути и экспрессию генов.
Ткани и органы. Печень
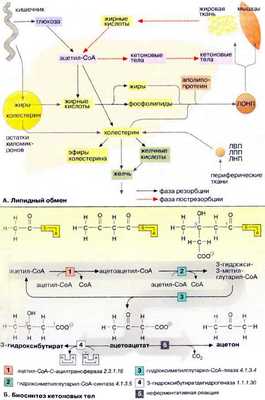
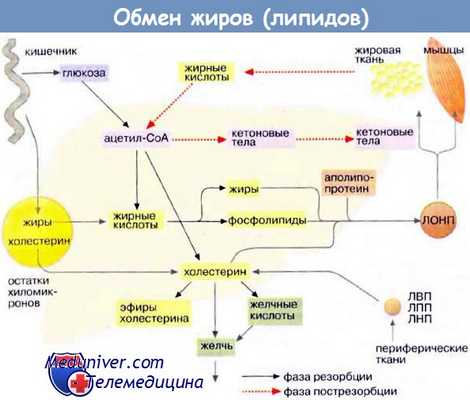
Печень является главным местом синтеза жирных кислот, жиров, кетоновых тел и холестерина. Жиры могут также синтезироваться в жировой ткани, однако ее основной функцией остается депонирование липидов.
А. Метаболизм липидов
Обмен липидов в печени тесно связан с превращением углеводов и аминокислот. При поступлении питательных веществ в фазе резорбции (см. с. 300) глюкоза через промежуточное образование ацетил-КоА (ацетил-СоА) конвертируется в жирные кислоты . Печень может также извлекать жирные кислоты из липопротеинов, поступающих из желудочно-кишечного тракта (в виде хиломикронов ) и других тканей (см. с. 272). Жирные кислоты используются для биосинтеза триглицеринов и фосфолипидов . При связывании жиров с аполипопротеинами образуются липопротеиновые комплексы очень низкой плотности [ЛОНП (VLDL), см. с. 272]. Они попадают в кровь и переносятся в другие ткани, прежде всего в жировую и мышечную ткань.
В фазе пострезорбции (см. с. 300), особенно в период поста или голодания, обмен липидов идет в обратном направлении, организм обращается к собственным запасам. В этих условиях жиры поступают из жировой ткани в кровь, переносятся в печень, распадаются в результате β-окисления до ацетил-КоА и, наконец, превращаются в кетоновые тела .
Холестерин поступает в организм из двух источников — с пищей и за счет эндогенного синтеза, причем большая часть холестерина синтезируется в печени. Биосинтез холестерина начинается с ацетил-КоА (см. с. 174). Полученный холестерин используется в синтезе желчных кислот (см. с. 306), встраивается в клеточные мембраны (см. с. 216), депонируется в жировых каплях в составе эфиров жирных кислот. Остальная часть поступает в кровь в составе липопротеиновых комплексов [ЛОНП (VLDL)] и переносится в другие ткани. Печень способствует обмену холестерина благодаря тому, что служит местом, худа поступают с кровью и где подвергаются расщеплению липопротеиновые комплексы [ЛВП, ЛПП, ЛНН (HDL, IDL, LDL), см. с. 272], содержащие холестерин и его эфиры с жирными кислотами.
Б. Биосинтез кетоновых тел
При высокой концентрации ацетил-КоА в митохондриях гепатоцитов происходит конденсация двух молекул ацетил-КоА с образованием ацетоацетил-КоА [ 1 ]. Присоединение еще одной ацетильной группы [ 2 ] приводит к 3-гидрокси-З-метилглутарил-КоА (ГМГ-КоА) [ 3 ], который после отщепления ацетил-КоА превращается в ацетоуксусную кислоту (ацетоацетат) ( цикл Линена ). При восстановлении последней получается 3-гидроксибутират [ 4 ], а при неферментативном декарбоксилировании — ацетон [ 5 ]. Все три соединения принято называть «кетоновыми телами», что не совсем правильно, поскольку в 3-гидроксимасляной кислоте отсутствует кетогруппа!
Кетоновые тела поступают из печени в кровь, где они хорошо растворимы. Концентрация кетоновых тел в крови возрастает в фазе пострезорбции (фаза голодания). Наряду с жирными кислотами 3-гидроксибутират и ацетоацетат в этот период являются основными энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через легкие. После 1-2 недели голодания кетоновые тела начинают использоваться в качестве источника энергии нервными тканями. Однако при этом для обеспечения цитратного цикла необходимо минимальное количество глюкозы.
Если биосинтез кетоновых тел превышает потребности организма, они накапливаются в крови (кетонемия) и, наконец, выводятся с мочой (кетонурия). Оба феномена наблюдаются во время длительного голодания (углеводная недостаточность) и при заболеваний диабетом (Diabetes mellitis). Хотя 3-гидроксимасляная кислота является слабой кислотой (рК а примерно 4), возрастание концентрации кетоновых тел вызывает изменение рН в крови ( кетоацидоз , см. с. 280). Кетонурия и кетоацидоз могут быстро привести к электролитному сдвигу (нарушению ионного гомеостаза) и потери сознания (кетоацидозной коме) и, следовательно, опасны для жизни.
Печень: общие сведения
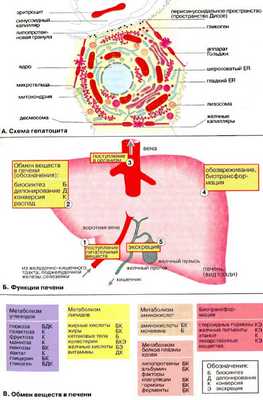
Печень — самый крупный орган в организме человека и животных; у взрослого человека она весит 1,5 кг. Хотя печень составляет 2-3% массы тела, на нее приходится от 20 до 30% потребляемого организмом кислорода,
А. Схема гепатоцита
Печень состоит примерно из 300 млрд клеток. 80% из которых составляют гепатоциты . Клетки печени занимают центральное место в реакциях промежуточного метаболизма. Поэтому в биохимическом отношении гепатоциты являются как бы прототипом всех остальных клеток.
Б. Функции печени
Важнейшими функциями печени являются метаболическая, депонирующая, барьерная, экскреторная и гомеостатическая.
Метаболическая ( 2Б, К ). Продукты расщепления питательных веществ поступают в печень ( 1 ) из пищеварительного тракта через воротную вену. В печени протекают сложные процессы обмена белков и аминокислот, липидов, углеводов, биологически активных веществ (гормонов, биогенных аминов и витаминов), микроэлементов, регуляция водного обмена. В печени синтезируются многие вещества (например, желчи), необходимые для функционирования других органов.
Депонирующая ( 2Д ). В печени происходит накопление углеводов (например, гликогена), белков, жиров, гормонов, витаминов, минеральных веществ. Из печени в организм постоянно поступают макроэргические соединения и структурные блоки, необходимые для синтеза сложных макромолекул ( 3 ).
Барьерная ( 4 ). В печени осуществляется обезвреживание (биохимическая трансформация) чужеродных и токсичных соединений, поступивших с пищей или образовавшихся в кишечнике, а также токсических веществ экзогенного происхождения ( 2К ).
Экскреторная ( 5 ). Из печени различные вещества эндо- и экзогенного происхождения либо поступают в желчные протоки и выводятся с желчью (более 40 соединений), либо попадают в кровь, откуда выводятся почками.
Гомеостатическая (на схеме не приведена). Печень выполняет важные функции по поддержанию постоянного состава крови (гомеостаза), обеспечивая синтез, накопление и выделение в кровь различных метаболитов, а также поглощение, трансформацию и экскрецию многих компонентов плазмы крови.
В. Обмен веществ в печени
Печень принимает участие в метаболизме почти всех классов веществ.
Метаболизм углеводов. Глюкоза и другие моносахариды поступают в печень из плазмы крови. Здесь они превращаются в глюкозо-6-фосфат и другие продукты гликолиза (см. с. 302). Затем глюкоза депонируется в виде резервного полисахарида гликогена или превращается в жирные кислоты. При снижении уровня глюкозы печень начинает поставлять глюкозу за счет мобилизации гликогена. Если запас гликогена оказывается исчерпанным, глюкоза может синтезироваться в процессе глюконеогенеза из таких предшественников, как лактат, пируват, глицерин или углеродный скелет аминокислот.
Метаболизм липидов. Жирные кислоты синтезируются в печени из ацетатных блоков (см. с. 170). Затем они включаются в состав жиров и фосфолипидов, которые поступают в кровь в форме липопротеинов. В то же время жирные кислоты поступают в печень из крови. Для энергообеспечения организма большое значение имеет свойство печени конвертировать жирные кислоты в кетоновые тела, которые затем вновь поступают в кровь (см. с. 304).
В печени идет синтез холестерина из ацетатных блоков. Затем холестерин в составе липопротеинов транспортируется в другие органы. Избыток холестерина превращается в желчные кислоты или выводится из организма с желчью (см. с. 306).
Метаболизм аминокислот и белков. Уровень аминокислот в плазме крови регулируется печенью. Избыточные аминокислоты расщепляются, аммиак связывается в цикле мочевины (см. с. 184), мочевина переносится в почки. Углеродный скелет аминокислот включается в промежуточный метаболизм как источник для синтеза глюкозы (глюконеогенез) или как источник энергии. Кроме того, в печени осуществляется синтез и расщепление многих белков плазмы крови.
Биохимическая трансформация. Стероидные гормоны и билирубин, а также лекарственные вещества, этанол и другие ксенобиотики поступают в печень, где они инактивируются и конвертируются в высоко полярные соединения (см. с. 308).
Депонирование. Печень служит местом депонирования энергетических резервов организма (содержание гликогена может достигать 20% массы печени) и веществ-предшественников; здесь также депонируются многие минеральные вещества, следовые элементы, ряд витаминов, в том числе железо (около 15% всего железа, содержащегося в организме), ретинол, витамины A, D, K, B 12 и фолиевая кислота.
Читайте также:
- Клиника неврогенной формы гипертиреоза. Тахипсихизм и кардиоэритизм
- Спорадический зоб. Диффузно-узловое увеличение щитовидной железы
- Лучевая диагностика проводника зуба
- Отторжение трансплантанта. Реакция отторжения трансплантата. Клеточные реакции отторжения трансплантата. Аллоантитела. Типирование антигенов ( Аг ).
- Обзор кристаллических артритов
