Перспективы изучения апоптоза
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
ДНЦ ФПД (Благовещенск)
В области персонализированной медицины, молекулярной биологии и генетики
- Выявление новых молекулярных механизмов, опосредующих эффекты основных климатических факторов на дыхательную систему, и определение их роли в развитии респираторной патологии.
- Поиск генов-кандидатов и исследование функциональной значимости генетических полиморфизмов и экспрессии данных генов в аспекте формирования патологических состояний респираторного тракта, вызванных воздействием неблагоприятных факторов окружающей среды; исследование роли взаимодействия генных и средовых факторов в патогенезе заболеваний органов дыхания.
- Исследование молекулярных механизмов, обеспечивающих и модулирующих взаимодействие климатических и микробиогенных экологических факторов на уровне респираторного тракта; изучение роли данных механизмов в развитии инфекционной и неинфекционной патологии органов дыхания.
- Молекулярно-биологическая и молекулярно-генетическая характеристика представителей семейства катионных каналов с транзиторным рецепторным потенциалом, экспрессированных в дыхательных путях, как основных молекул, обеспечивающих рецепцию большинства физико-химических стимулов внешней среды.
- Исследование возможностей фармакологической модуляции/блокады сигнальных молекул и каскадов, опосредующих развитие респираторных реакций в ответ на действие геофизических и биологических факторов.
- Разработка новых методов диагностики и прогнозирования патологических состояний респираторного тракта с использованием верифицированных молекулярных биомаркеров.
- Разработка патогенетически обоснованных методов и средств персонализированной терапии болезней органов дыхания на основе фармакогенетики, метаболомики и протеомики.
В области пульмонологии
- Ассоциативный анализ измененной реактивности дыхательных путей с мутациями генов-кандидатов термо-, осмо- и механорецепции.
- Поиск биомолекулярных и клинико-функциональных маркеров воспаления и ремоделирования дыхательных путей для ранней неинвазивной диагностики патологических состояний.
- Изучение клинико-функциональных паттернов дыхательной системы при наиболее распространенных болезнях органов дыхания (ХОБЛ и бронхиальная астма) в климато-географических условиях Дальнего Востока и Крайнего Севера.
- Разработка инновационных методов функциональной трехмерной комьютерно-рентгенографической волюметрии легких и ее диагностических приложений.
- Системный анализ и моделирование функционального состояния дыхательной системы при действии экстремальных факторов окружающей среды с использованием средств искусственного интеллекта.
В области перинатологии
- Исследование влияния персистирующих вирусных инфекций на течение беременности, исходы родов и формирование респираторной системы плода и новорожденного.
- Исследование молекулярных и генетических механизмов формирования фетоплацентарной недостаточности при герпесвирусной, цитомегаловирусной и гриппозной инфекциях.
- Разработка методов ультраструктурной идентификации путей проникновения патогенных вирусов в ткани плаценты и плода.
- Изучение особенностей эпигенетической регуляции метаболизма системы мать-плацента-плод при персистирующих вирусных инфекциях во время беременности.
- Определение роли морфофункциональных изменений эритроидных элементов в генезе фето-плацентарной недостаточности при персистирующих вирусных инфекциях.
- Фундаментальное обоснование инновационных методов пренатальной диагностики нарушений органогенеза дыхательной системы плода и способов их профилактики и коррекции.
ИНСТИТУТ ОХРАНЫ МАТЕРИНСТВА И ДЕТСТВА (г. Хабаровск)
В области иммунологии и клеточных технологий
- Изучение иммунорегуляторных взаимодействий субпопуляций иммунокомпетентных клеток, механизмов активации и апоптоза клеток иммунной системы с целью поиска эффективных подходов к селективной коррекции иммунного ответа.
- Исследование пептидергической регуляции тканевого гомеостаза в аспекте применения синтетических аналогов олигопептидов в качестве стимуляторов управляемой регенерации в системе органов дыхания.
- Изучение иммуномодулирующих и регенераторных эффектов низкомолекулярных биорегуляторов морского происхождения.
- Разработка клеточных технологий, направленных на ткано-органную репарацию в системе органов дыхания.
В области молекулярно-генетических исследований
- Изучение молекулярно-генетических механизмов участия перинатально-значимых инфекций в формировании патологии беременности, плаценты, плода и новорожденного.
- Изучение молекулярно-генетических механизмов резистентности бактерий и ее распространенности в детской популяции.
- Мониторинг этиологии бронхолегочных заболеваний с целью определения фено- и генотипов возбудителей инфекций, циркулирующих в регионе.
- Исследование распространенности полиморфизмов генов, ассоциированных с бронхолегочной патологией, выявление возрастных и половых групп риска по наиболее значимым полиморфизмам.
- Разработка и апробация методов диагностики, лечения и профилактики внутриутробных инфекций, a также инфекций бронхолегочной системы у детей.
Охрана здоровья матери и ребенка
- Исследование адаптационного потенциала и компенсаторно-приспособительных возможностей организма ребенка и беременной женщины в условиях действия ксенобиотиков и дисбаланса микроэлементов в окружающей среде.
- Выявление этиопатогенетических и молекулярно-генетических факторов риска развития отклонений в состоянии респираторного здоровья беременных женщин и детей.
- Разработка диагностики преморбидных состояний, провоцируемых нарушением элементного гомеостаза, и эффективных схем первичной профилактики наиболее распространенных заболеваний респираторной системы у беременных женщин и детей коренного и пришлого населения Дальневосточного региона на популяционном и индивидуальном уровнях.
ИНСТИТУТ медицинской климатологии и восстановительного лечения (г. Владивосток)
- Разработка системного подхода к анализу биоматериала путем комбинации методов протеомики, метаболомики, биоинформатики.
- Изучение структурно-функциональной реорганизации липидного матрикса цитоплазматических и субклеточных мембран в норме, в условиях функционального напряжения и истощения гомеостатических систем.
- Расшифровка клеточных, лиганд-рецепторных, молекулярно-биологических механизмов реализации межсистемных взаимодействий; изучение специфических механизмов иммуннобиологического надзора, установление их роли в возникновении и обратимости различных метаболических дефектов.
- Изучение морфогенеза важнейших общепатологических процессов в органах-мишенях; установление механизмов клеточной гибели (апоптоз, некроз) и регенерации органов-мишеней на моделях заболеваний висцеральных систем.
- Изучение эффекторных механизмов ответной реакции гомеостатических систем на экологические, природные и преформированные факторы.
- Изучение механизмов взаимодействия природных и синтетических биомодификаторов с мембранными и внутриклеточными мишенями для разработки высокоэффективных медицинских технологий системного иммуннометаболического действия.
- Поиск новых молекулярных мишеней для фармакологической регуляции иммунометаболических процессов; разработка инновационных технологий доклинической диагностики и этапной реабилитации.
Разработка технологий восстановительного лечения
- Изучение структурно-функциональных резервов висцеральных систем; выявление особенностей континуумов кардиореспираторной, кардиоренальной, гепатокардиальной систем при формировании хронических заболеваний органов дыхания и коморбидных состояний; выявление маркеров ранней диагностики заболеваний органов дыхания и ассоциированных коморбидных состояний.
- Изучение механизмов саногенеза функциональных систем организма в процессе восстановительного лечения заболеваний органов дыхания и коморбидных состояний.
- Изучение механизмов влияния природных и преформированных физических факторов на состояние висцеральных систем, функциональные резервы организма.
- Разработка принципиально новых и оптимизация апробированных медицинских технологий профилактики и реабилитации с использованием природных, преформированных физических факторов, фармпрепаратов.
- Физио- и фармакоэкономическая оценка восстановительных технологий в доклиническом периоде, при обострении и ремиссии заболевания; разработка экономически целесообразных фармакологических и немедикаментозных технологий.
Исследования в области медицинской экологии
- Изучение медико-экологических характеристик окружающей среды в Дальневосточном регионе.
- Изучение причинно-следственных связей развития экологообусловленной патологии органов дыхания.
- Системный анализ ответной реакции органов дыхания и триггерных систем организма на воздействие факторов внешней среды на органном, клеточном, субклеточном и геномном уровнях с использованием средств искусственного интеллекта.
- Разработка информационно-аналитических моделей комплексного, многоуровневого воздействия климато-экологических условий на формирование респираторной патологии.
- Определение экопатогенной роли мелкодисперсных атмосферных взвесей.
- Прогнозное моделирование состояния здоровья населения Дальневосточного региона.
- Разработка системы оценочных критериев сано- и патогенных свойств окружающей среды для определения риска распространения экологозависимых заболеваний и регламентирование эффективности использования ресурса в лечебно-оздоровительных целях.
- Оценка рекреационного потенциала природных ресурсов, паспортизация рекреационных объектов и территорий.
- Создание новых информационных технологий, программных продуктов для обработки медико-экологической информации.
Достижения
Проведенные в ДНЦ ФПД фундаментальные исследования позволили раскрыть основные механизмы адаптационных реакций дыхательной системы в экстремальных экологических условиях, установить ключевые молекулярно-генетические механизмы действия холода на органы дыхания и их роль в развитии бронхолегочных заболеваний, расшифровать механизмы повреждающего действия вируса герпеса и цитомегаловируса на фетоплацентарную систему, раскрыть закономерности развития патологии органов дыхания у детей и подростков под действием неблагоприятных экологических факторов на онтогенез дыхательной системы, исследовать пептидергическую регуляцию тканевого гомеостаза в аспекте применения синтетических аналогов олигопептидов как стимуляторов управляемой регенерации в системе органов дыхания, всесторонне развить представления о роли липидома в генезе прогрессирования воспаления, обосновать применение широкого спектра рекреационных технологий в восстановительной терапии болезней органов дыхания.
В ходе исследований в области изучения нового класса мембранных белков – ионных каналов с транзиторным рецепторным потенциалом выявлено, что они являются перспективными молекулярными мишенями для лекарственных воздействий в персонифицированной терапии и профилактике наиболее распространенных хронических болезней органов дыхания, зависимых от действия геофизических факторов: бронхиальной астмы и хронической обструктивной болезни легких. В ряде исследований сотрудников ДНЦ ФПД, выполненных, в том числе, в сотрудничестве с китайскими коллегами, раскрыта роль холодовых рецепторов TRPM8, температурных и осмотических рецепторов TRPV1 и TRPV4 в генезе патологических реакций, лежащих в основе возникновения и прогрессирования хронических болезней органов дыхания. Установлены генетические детерминанты нарушения функции температурных и осмотических рецепторов в виде мутаций генов ионных каналов семейства TRP.
Мониторинг этиологии бронхолегочных заболеваний с учетом эпидемического окружения зарубежных популяций позволил определить фено- и генотипы ряда новых вариантов возбудителей, циркулирующих в регионе. Так, исследования циркуляции фенотипов S.pneumoniae с применением методов молекулярной генетики и MLST показали преобладание серовариантов, ассоциированных с инвазивной инфекцией и резистентностью к антимикробным препаратам. Филогенетически пневмококк имеет высокую вероятность происхождения от общего предка со штаммами из Китая, США и Великобритании. Установлено значительное увеличение роста резистентности S.pneumoniae к антимикробным препаратам. В 51% случаев выявлена полирезистентность. Анализ молекулярной характеристики Mycoplasma pneumoniaе у детей с внебольничной пневмонией в осенне-зимний период 2016-2017 гг. выявил мутации в гене 23S рРНК, ассоциированной с нарушением связывания антибиотиков и формированием устойчивости к макролидам. Мониторинг циркуляции и изменений молекулярных характеристик респираторных возбудителей играет стратегическую роль в сохранении респираторного здоровья населения Дальнего Востока в связи с географической близостью с регионами с высокой распространенностью макролидрезистентной M. рneumoniae (КНР – более 90%, Япония – 50-90%)
Внеплановая вакцинопрофилактика пневмококковой инфекции 13-валентной конъюгированной вакциной (ПКВ13) в районах, пострадавших от экстремального паводка осенью 2013 года (в Хабаровском крае, Амурской области и Еврейской автономной области), позволила сформировать типоспецифический иммунный ответ против группы заболеваний, вызываемых пневмококком. У детей младшего возраста, привитых ПКВ-13, степень защиты от пневмококковой инфекции превышала 90%. В целом, применение ПКВ 13 снизило инфекционный фон следующего (после паводка) - 2014 года в 3 раза.
Существенным вкладом в развитие респираторной реабилитации явились результаты научных изысканий ДНЦ ФПД по оценке рекреационного потенциала Дальнего Востока, изучению механизмов действия природных лечебных факторов (климат, лечебные грязи, минеральные воды, биологически активные вещества, полученные из Дальневосточного сырья). Проведена инвентаризация бальнеологических ресурсов Дальневосточного региона и выделены лечебно-оздоровительные местности (Камчатка, Амурская область, Хабаровский и Приморский край, Сахалин, Курилы). Высокий социально-экономический эффект разработанных патогенетически ориентированных методов профилактики и восстановительного лечения заболеваний органов дыхания с использованием рекреационного ресурса юга Дальнего Востока обусловлен существенной минимизацией расходов на медицинскую помощь, повышением качества жизни пульмонологических больных. Внедрение в Приморском крае разработанной долгосрочной программы медицинской реабилитации детей, страдающих бронхиальной астмой, позволило сократить число обращений к врачам в поликлинику в 2 раза, случаев госпитализации в 2,5 раза. При этом расходы на медикаментозное лечение снизились на 72%. При реализации дифференцированных комплексов восстановительного лечения больных хронической обструктивной болезнью легких, с использованием рекреационных ресурсов юга Дальнего Востока снижены прямые затраты на лечение в 3,2 раза, показатель «затраты-эффективность» уменьшился в 7,8 раз.
Признанием высокого научного потенциала ДНЦ ФПД стала победа в 2014 г. в конкурсе Российского научного фонда на получение грантов по приоритетному направлению деятельности РНФ «Проведение фундаментальных научных исследований и поисковых научных исследований коллективами существующих научных лабораторий (кафедр)», на котором среди лабораторий 47 учреждений ДВО РАН на Дальнем Востоке по всем отраслям знаний победителями были признаны лишь 2 проекта, в том числе проект ДНЦ ФПД 14-25-00019 «Молекулярно-клеточные и генетические механизмы осмотической реактивности дыхательных путей человека». В настоящее время в ДНЦ ФПД выполняются исследования по 5 научным проектам – победителям конкурсов Российского фонда фундаментальных исследований и 1 проекту при поддержке гранта Российского научного фонда.
В ДНЦ ФПД функционирует объединенный диссертационный совет по специальностям «Пульмонология» и «Патологическая физиология».
Издается авторитетный научный журнал «Бюллетень физиологии и патологии дыхания», входящий в Перечень журналов, рекомендованных ВАК для публикаций материалов кандидатских и докторских диссертаций.
Перспективы изучения апоптоза
К числу фундаментальных механизмов, регулирующих функционирование системы иммунитета, относится апоптоз. Этот ключевой процесс поддержания клеточного гомеостаза контролируется и регулируется многочисленными факторами - сигнальными молекулами, запускающими и реализующими программированную клеточную смерть (ПКС). К ним относятся: фактор некроза опухоли (TNF), цитокины, рецепторы к этим молекулам, внутриклеточные мессенджеры, стимуляторы и ингибиторы апоптоза, ростовые факторы, СD40-лиганд, протеинкиназы, сериновые протеазы эндонуклеазы и др.
С позиции апоптоза можно объяснить механизмы формирования хронической инфекционной патологии (ХИП) различной природы, поскольку дисбаланс между пролиферативной активностью клеток и ПКС ведёт к патологическим изменениям органов и тканей. При инфекциях существуют факторы, индуцирующие и ингибирующие ПКС. Главным способом киллинга вирусинфицированных клеток являются рецепторный и перфорин-гранзимовый механизмы индукции апоптоза. Инфекционный процесс сопровождается усилением продукции активных кислородных радикалов, запускающих гибель клеток по митохондриальному пути. Следствием вирусиндуцированного повреждения ДНК являются р53-опосредованные реакции развития апоптоза. Актуальна комплексная оценка молекулярных механизмов дизрегуляции апоптотической гибели иммунокомпетентных клеток (ИКК) крови при ХИП с учетом клинических особенностей патологического процесса, что позволит получить новые данные фундаментального характера о ПКС при хроническом воспалении.
Цель исследования - изучение роли и механизмов молекулярных путей модуляции апоптоза ИКК периферической крови в патогенезе ХИП. Выявлены общие закономерности и особенности реализации ПКС ИКК у пациентов с хроническими вирусными инфекциями. Определена чувствительность лимфоцитов крови к апоптогенным стимулам с различным механизмом действия. Дана комплексная характеристика состояния путей регуляции апоптоза ИКК. Установлено, что нарушение реализации ПКС является одним из звеньев иммунопатогенеза хронических инфекций.
Показано, что дисбаланс клеточного звена иммунитета при ХИП на разных стадиях сопряжён с нарушением ПКС - его ингибированием или стимулированием. Выявлена дискоординированость вступления в процесс апоптоза CD8+-лимфоцитов, что определяет характер иммунологических расстройств, повышенная чувствительность лимфоцитов пациентов с хроническими вирусными инфекциями к апоптоз-модулирующим факторам с различными механизмами действия. Продемонстрировано нарушение реализация TNFα-опосредованного пути программированной гибели лимфоцитов крови при хроническом вирусном гепатите вследствие изменения функционирования рецепторного аппарата клетки. Выявлено стимулирование митохондриального пути апоптоза лимфоцитов крови.
Таким образом, изучение механизмов ПКС раскрывает новые патофизиологические аспекты ХИП, что может служить основой для разработки молекулярных технологий воздействия на передающие пути сигналов реализации апоптоза ИКК с целью проведения направленной патогенетически обоснованной коррекции иммунных нарушений и своевременной профилактики осложнений, угрожающих жизни пациентов. Эти технологии могут оказаться полезными для создания новых методов молекулярной терапии, прогнозирования эффективности лечения инфекционной патологии.
Перспективы изучения апоптоза
Перспективы изучения апоптоза
Вопрос «Что дальше?», по крайней мере, философский. Как сказано в одном произведении, «трудно его видеть: всегда оно в движении, это будущее». Хотя прогнозирование вряд ли относится к числу научных дисциплин, мы можем поразмышлять об исследованиях, которые, может быть, прояснят пока еще непонятные аспекты клеточной гибели.
Однако следует иметь в виду, что одна из особенностей биологии, которая делает ее такой интересной, состоит в ее непредсказуемости. Учитывая это, посмотрим на будущее исследований в области гибели клеток.
Хотя мы подробно описали два пути апоптоза, их, конечно, больше. Каспаза-2 относится к инициаторным каспазам, которая связывается с адаптерной молекулой RAIDD и при этом активируется (в активации каспазы-2 также участвует другая молекула, PIDD). Тем не менее мы еще очень мало знаем о том, каким образом и когда этот путь апоптоза начинает играть свою роль, хотя на этот счет появляются некоторые предположения.
Каспаза-2 может участвовать в апоптозе, индуцированным тепловым шоком, изменениями клеточного метаболизма, и, в некоторых случаях, повреждениями в ДНК. Аналогичным образом, почти ничего не известно об активации каспазы-4 и о той роли, которую она может играть в апоптозе или воспалении. Напротив, в то время как мы знаем достаточно много об активации каспазы-8 и ее роли в апоптозе, мы не представляем, какое участие в процессе развития принимает эта протеаза и ее партнеры, FADD и c-FLIP (как отмечалось выше, нокаут этих генов вызывает летальность на ранних стадиях эмбриогенеза).
Не всегда клеточная гибель в организме происходит по пути апоптоза. Некоторые формы некроза могут представлять собой контролируемые процессы (а не просто являться следствием случайного повреждения клеток). Вместе с тем последние исследования сосредоточены на изучении другой формы клеточной гибели, которая сопровождается процессом аутофагии. Аутофагия наблюдается у клеток всех эукариот, и смысл ее заключается в том, что она представляет собой форму получения энергии, необходимой для выживания при отсутствии питательных компонентов. Пока мы не знаем, вызвана ли «аутофагальная клеточная гибель» аутофагией или другой причиной.
В последующие несколько лет мы будем являться свидетелями установления взаимосвязи между основными путями апоптоза и другими внутриклеточными событиями Сигналы со стороны клеточного цикла, цитоскелета, систем репарации, стрессорных реакций, ионов кальция и других ионов, а также метаболических реакций влияют на отдельные элементы процессов апоптоза, но мало что известно об этих сигналах и их мишенях применительно к апоптотическому механизму в целом.
Столь же важными являются сигналы, поддерживающие выживаемость клеток. Нам также необходимо лучше понимать их природу. В нормальном развитии тканей критическую роль играют сигнальные пути, блокирующие апоптоз, однако при неправильном функционировании они могут привести к нежелательному разрастанию тканей и к развитию опухолей. Хотя известно много механизмов, обеспечивающих жизнеспособность клеток, детали их функционирования, обеспечивающие блокирование апоптоза, остаются предметом интенсивных исследований.
Нам еще предстоит многое выяснить в области апоптоза, но, как следует из материалов настоящей главы, мы уже немало понимаем. Несмотря на это, мы пока еще не использовали наши знания для эффективной борьбы с болезнями. В настоящее время, для предупреждения апоптоза при некоторых случаях повреждения тканей, проходят клинические испытания ингибиторы каспаз. Ингибиторы Bax и Bak могут выступать как агенты для предотвращения нежелательной гибели клеток на ранних (и обратимых) стадиях процесса.
Наоборот, ингибиторы из семейства антиапоптотических белков Bcl-2 используются как противораковые агенты. Такой подход представляется перспективным. Фармакологические ингибиторы IAPs используются для усиления активации каспазы в клетках опухолей и также проявляют определенную эффективность (хотя мы точно не знаем, действительно ли они действуют по этому механизму).
С уверенностью можно сделать одно предсказание в области иссследования механизмов клеточной гибели: интерес к ней не будет потерян.
Апоптоз представляет собой форму клеточной гибели клеток животных, которая играет роль в процессах нормального развития и тканевого гомеостаза, а также в патологических состояниях организма, включая вирусные инфекции и рак. В ходе апоптоза клетки «упаковываются», подготавливаясь к быстрому удалению фагоцитами. Процесс апоптоза включает действие серии протеаз, называемых каспазами. Активация каспаз происходит при протекании одного или нескольких путей апоптоза.
У млекопитающих два наиболее изученных пути апоптоза представляют внешний путь с участием рецепторов, и собственный, митохондриальный путь. При внешнем пути связывание специализированных рецепторов клеточной гибели, относящихся к подгруппе семейства рецепторов TNF, вызывает димеризацию инициаторной каспазы-8 и активирует фермент. В свою очередь, каспаза расщепляет и активирует эффекторные каспазы-3 и -7, которые регулируют апоптоз. При митохондриальном пути белки семейства Bcl-2 вызывают разрушение наружной мембраны митохондрий и выход в цитозоль белков. Высвобождающийся таким образом цитохром с активирует APAF-1, который образует олигомеры, и, в свою очередь, связываясь с инициаторной каспазой-9, активирует ее.
Инициаторная каспаза расщепляет и активирует эффекторные каспазы-3 и -7, участвующие в апоптозе.
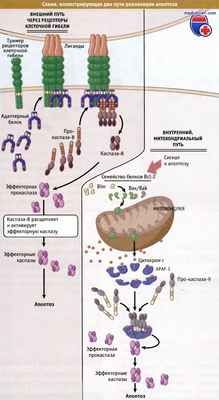
Представлены два пути реализации апоптоза у позвоночных.
Путь через рецепторы клеточной гибели (также носящий название внешний путь) запускается, когда специфические лиганды гибели, относящиеся к семейству TNF, находят свои рецепторы.
Митохондриальный путь (также называемый внутренним, или собственным, путем)
реализуется при нарушении проницаемости наружной мембраны митохондрий в результате взаимодействий белков семейства Bcl-2 и высвобождения межмембранных белков.
К числу последних относится цитохром С, который при взаимодействии с белками цитозоля запускает активацию каспаз.
Эти процессы подробно рассмотрены в последующих статьях на сайте.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
АПОПТОЗ КЛЕТОК ГОЛОВНОГО МОЗГА В ЭПИЛЕПТИЧЕСКИХ ОЧАГАХ ПРИ ФАРМАКОРЕЗИСТЕНТНОЙ ВИСОЧНОЙ ЭПИЛЕПСИИ
Актуальность. Поиск причин возникновения эпилепсии и разработка новых методов её коррекции — важнейшие задачи современной неврологии. Исследования последних лет посвящены изучению роли нейронального апоптоза при эпилепсии, вопрос гибели глиальных клеток остается малоизученным. Однако именно взаимодействие нейронов и глии модулирует физиологические функции мозга и лежит в основе многих неврологических заболеваний, что указывает на важность комплексного изучения морфофункционального состояния этих клеток при эпилепсии. Цель работы. Оценить значение апоптотической гибели нейронов и глии в патогенезе фармакорезистентной височной эпилепсии по наличию экспрессии caspase-3 в клетках головного мозга и ультраструктурным проявлениям.
Материалы и методы. Объект исследования — биоптаты коры и белого вещества головного мозга в зоне эпилептических очагов от 20 пациентов с фармакорезистентной височной эпилепсией. Материал для группы сравнения получен при аутопсиях от 6 пациентов без эпилепсии. Выполнены иммуногистохимическиие реакции с антителами к caspase-3 и ультраструктурный анализ биоптатов.
Результаты. Во всех случаях (100%) у больных с эпилепсией выявлена экспрессия caspase-3 в глиоцитах с преимущественной локализацией в коре височной доли. Экспрессия caspase-3 в нейронах обнаружена в 20% наблюдений в единичных клетках. В группе сравнения экспрессия caspase-3 отмечалась только в единичных глиоцитах коры. С помощью электронной микроскопии в коре обнаружено значительное число нейронов с признаками апоптоза на разных стадиях развития этого процесса. В глиальных клетках апоптотические изменения наблюдались преимущественно в олигодендроцитах как в коре, так и в белом веществе мозга.
Заключение. Обнаруженная экспрессия caspase-3 в глиоцитах коры и белого вещества эпилептических очагов свидетельствует об активном участии глии в патогенезе эпилепсии. С помощью электронной микроскопии нами установлено, что основную часть апоптотически гибнущих клеток глии составляют олигодендроглиоциты, что в частности объясняет известный феномен повреждения миелина в эпилептических очагах. Факт электронно-микроскопического обнаружения большого числа апоптотически измененных нейронов в биоптатах коры при незначительной экспрессии в них caspase-3 может свидетельствовать об иной природе возникновения нейронального апоптоза. Таким образом, глио-нейрональный апоптоз при фармакорезистентной эпилепсии имеет значительное проявление, что влияет на прогрессирование заболевания, создавая условия для развития эпилептического статуса и когнитивных расстройств. Дальнейшее изучение этого вопроса открывает перспективы новой терапевтической стратегии в лечении эпилепсии.
Ключевые слова
Об авторах
Российский научно-исследовательский нейрохирургический институт имени профессора А. Л. Поленова, филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России
Россия
Соколова Татьяна Владиславовна - научный сотрудник научно-исследовательской лаборатории патологической анатомии.
Ул. Маяковского, д. 12, Санкт-Петербург, 191014
Российский научно-исследовательский нейрохирургический институт имени профессора А. Л. Поленова, филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России
Россия
Забродская Юлия Михайловна - доктор медицинских наук, заведующий научно-исследовательской лабораторией патологической анатомии РНХИ им. проф. А.Л. Поленова
Федеральное государственное бюджетное учреждение науки «Институт эволюционной физиологии и биохимии им. И.М. Сеченова» Российской академии наук; Федеральное Государственное Бюджетное Военное Образовательное Учреждение Высшего Образования «Военно-Медицинская Академия имени С.М.Кирова» Министерства Обороны Российской Федерации
Россия
Парамонова Наталья Михайловна - научный сотрудник лаборатории молекулярной эндокринологии и нейрохимии, ФГБУН ИЭФБ им. И. М. Сеченова РАН, и научный сотрудник лаборатории клеточных технологий НИЦ ФГБВОУ ВО ВМедА им. С. М. Кирова МО РФ
Российский научно-исследовательский нейрохирургический институт имени профессора А. Л. Поленова, филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России
Россия
Доброгорская Любовь Николаевна - научный сотрудник научно-исследовательской лаборатории патологической анатомии
Lyubov N. Dobrogorskaya - researcher at laboratory of pathology
Российский научно-исследовательский нейрохирургический институт имени профессора А. Л. Поленова, филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России
Россия
Касумов Вугар Рауфович - доктор медицинских наук, старший научный сотрудник отделения функциональной и реконструктивной нейрохирургии
Российский научно-исследовательский нейрохирургический институт имени профессора А. Л. Поленова, филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России; Федеральное Государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации
Россия
Касумов Вугар Рауфович - доктор медицинских наук, старший научный сотрудник отделения функциональной и реконструктивной нейрохирургии РНХИ им. проф. А.Л. Поленова
Российский научно-исследовательский нейрохирургический институт имени профессора А. Л. Поленова, филиал Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России; Федеральное Государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации
Россия
Ситовская Дарья Александровна - научный сотрудник научно-исследовательской лаборатории патологической анатомии РНХИ им. проф. А.Л. Поленова
Список литературы
1. Khachatryan VA, Bersnev VP, Shershever AS et al. Diagnostics and treatment of progredient forms of epilepsy. Desyatka, 2008. p. 264. In Russian [Хачатрян В.А., Берснев В. П., Шершевер А. С. и др. Диагностика и лечение прогредиентных форм эпилепсии. СПб.:Десятка, 2008. с. 264].
2. Bergin P, Sadleir L, Legros B et. al. An International Pilot Study of an Internet-Based Platform to facilitate clinical research in epilepsy. Epilepsia. 2012; 53: 1829–1835.
3. Henshall D.C., Engel T. Contribution of apoptosis-associated signaling pathways to epileptogenesis: lessons from Bcl-2 family knockouts. Frontiers in Cellular Neuroscience. 2013; 7: Article 110.
4. Sokolova TV, Zabrodskaya YuM, Bazhanova ED et al. The role of glionneuronal apoptosis in the pathogenesis of pharmacoresistant epilepsy. Neurosurgery and neurology of childhood. 2015; 4(46): 71-84. In Russian [Соколова Т.В., Забродская Ю.М., Бажанова Е.Д. и др. Роль глионейронального апоптоза в патогенезе фармакорезистентной эпилепсии. Нейрохирургия и неврология детского возраста. 2015, 4(46): 71-84].
5. Simon D Shorvon. Handbook of Epilepsy Treatment. Wiley-Blackwell. 2010. 300 p.
6. Ryabukha NP, Bersnev VP. Multifocal epilepsy (etiopathogenesis, clinic, diagnosis and surgical treatment). SPb.: RNHI, 2009. p. 216. In Russian [Рябуха Н. П., Берснев В.П. Многоочаговая эпилепсия (этиопатогенез, клиника, диагностика и хирургическое лечение). СПб.: РНХИ, 2009. с. 216].
7. Hader WJ, Tellez-Zenteno J, Metcalfe A et al. Complications of epilepsy surgery – asystematic review of focal surgical resections and invasive EEG monitoring. Epilepsia. 2013; 54: 840–847.
8. Kasumov VR, Bersnev VP, Stepanova TS. The method of extracerebral electrical stimulation in the system of surgical treatment of patients with pharmacoresistant epilepsy. Neurological herb of Bechterev VM. 2009; XLI (3): 41-44. In Russian [Касумов, В.Р., Берснев В.П., Степанова Т.С. и др. Метод внемозговой электростимуляции в системе хирургического лечения больных с фармакорезистентной эпилепсией. Неврол. вестн. им. В.М. Бехтерева. 2009, XLI(3): 41–44].
9. Sloviter, RS. Progress on the issue of excitotoxic injury modi- fication vs. real neuroprotection; implications for post-traumatic epilepsy. Neuropharmacology. 2011; 61: 1048–1050.
10. Crunelli V, Carmignoto G, Steinhäuser C. Novel astrocyte targets: new avenues for the therapeutic treatment of epilepsy. Neuroscientist. 2015; 21(1): 62-83.
11. Gaykova ON, Paramonova NM, Suvorov AV. The value of white matter damage in the brain in the pathogenesis of locally caused epilepsy. Russian Neurosurgical Journal. 2011; 3(1): 19-24. In Russian [Гайкова О.Н., Парамонова Н.М., Суворов А.В. Значение повреждения белого вещества головного мозга в патогенезе локально обусловленной эпилепсии. Рос. Нейрохирург. журн. 2011, 3 (1): 19-24].
13. Douglas A. Coulter, Christian Steinhauser. Role of Astrocytes in Epilepsy. Cold Spring Harb Perspect Med. 2015; 5(3):a022434
15. Noebels J, Avoli M, Rogawski M et. al. Jasper's basic mechanisms of the epilepsies. Oxford University Press. 2012. 1264p.
16. Engel T, Henshall D.C. Apoptosis, Bcl-2 family proteins and caspases: the ABCs of seizure-damage and epileptogenesis. Int J Physiol Pathophysiol Pharmacol. 2009; 1(2): 97-115.
17. Veresov VG. Structural biology of apoptosis. Minsk: Belorus. Nauka, 2008; p.200. In Russian [Вересов В.Г. Структурная биология апоптоза. Минск: Белорус. Наука, 2008. с. 398].
18. Yunkerov VI, Grigoriev SG. Mathematical-statistical processing of medical research data. SPb: VMedA, 2005. p. 292. In Russian [Юнкеров В.И., Грирорьев С.Г. Математико-статистическая обработка данных медицинских исследований. Санкт-Петербург: ВМедА, 2005. с. 292].
19. Devinsky O, Vezzani A, Najjar S et al. Glia and epilepsy: excitabilbty and inflammation. Trends in Neurosciences. 2013; 36 (3): 174-84.
20. Medvedev YuV, Bersnev VP, Kasumov VR et al. Effect of the degree of severity of brain gliosis on the severity of the course of the disease in patients with medically-resistant forms of locally caused epilepsy. Neurosurgery. 2010; 4: 65-90. In Russian [Медведев Ю.А., Берснев В.П., Касумов В.Р. и др. Влияние степени выраженности глиоза мозга на тяжесть течения заболевания у больных с медикаментозно–резистентными формами локально обусловленной эпилепсии. Нейрохирургия. 2010, 4: 65 – 90].
21. Crunelli V, Carmignoto G, Steinhäuser C. Novel astrocyte targets: new avenues for the therapeutic treatment of epilepsy. Neuroscientist. 2015; 21(1): 62-83.
22. Novozhilova AP, Gaikova ON. Cell gliosis of a white substance of the human brain and its significance in the pathogenesis of focal epilepsy. Morphology. 2001; 2: 20-24. In Russian [Новожилова А.П., Гайкова О.Н. Клеточный глиоз белого вещества большого мозга человека и его значение в патогенезе очаговой эпилепсии. Морфология. 2001, 2: 20-24].
24. Manto M, Oulad ben Taib N, Luft AR. Modulation of excitability as an early changes leading to structural adaptation in the motor cortex. J. Neurosci. Res. 2006; 83: 177-180.
25. Dudina JV. Symptomatic temporal lobe epilepsy. Vladivostok, Reya, 2008; p.300. In Russian [Дудина Ю.В. Симптоматическая височная эпилепсия. Владивосток: Рея, 2008. с. 300].
26. Liou AKF., Clark RS, Henshall DC. To die or not to die for neurons in ischemia, traumatic brain injury and epilepsy: a review on the stress-activated signaling pathways and apoptotic pathways. Prog. Neurobiol. 2003; 69: 103–142.
27. Henshall D.C., Simon R. Epilepsy and apoptosis pathways. J. of Cerebral Blood Flow and Metabolism. 2005; 25: 1557–1572.
28. Hu X, Wang JY, Gu R et al. The relationship between the occurrence of intractable epilepsy with glial cells and myelin sheath – an experimental study. Eur Rev Med Pharmacol Sci. 2016; 20 (21): 4516-4524.
29. Henshall DC, Clark RS, Adelson PD et al. Alterations in bcl-2 and caspase gene family protein expression in human temporal lobe epilepsy. Neurology. 2000; 55 :250–257.
30. Lapato AS, Szu JI, Hasselmann JPC et al. Chronic demyelination-induced seizures. Neuroscience. 2017; 27(346): 409-422.
31. Luo Y, Hu O, Zhang Q et al. Alterations in hippocampal myelin and oligodendrocyte precursor cells during epileptogenesis. Brain Res. 2015; 19(1627): 154-64.
32. Kıray H, Lindsay S, Hosseinzadeh S et al. The multifaceted role of astrocytes in regulating myelination. Experimental Neurology. 2016, 283:541–549.
Молекулярно-биологический маркер Bcl-2 при колоректальном раке: характеристика, роль в механизмах регуляции апоптоза, влияние на прогноз (обзор литературы)

Обоснование. За последние десятилетия проведено большое количество исследований, посвященных изучению молекулярно-биологических маркеров (МБМ) при колоректальном раке (КРР). Белок Вcl-2 (B-cell lymphoma-2) - один из наиболее изучаемых МБМ и привлекает внимание исследователей многих специальностей как при изучении канцерогенеза, так и во взаимосвязи с прогнозом заболевания. Цель. Привести детальную характеристику МБМ Bcl-2; рассмотреть его роль в механизмах регуляции апоптоза; представить современные данные относительно прогностической значимости этого белка при КРР. Материалы и методы. Для написания данного обзора литературы осуществлен поиск отечественных и зарубежных публикаций в российских и международных системах поиска (PubMed, eLibrary и др.) за последние 2-30 лет. Результаты. Определение экспрессии антиапоптотического белка Вcl-2 в опухоли может давать дополнительную информацию о клиническом течении злокачественного процесса независимо от лечебного воздействия, о биологическом поведении опухоли: быстроте роста, способности к инвазии и метастазированию (т.е. о прогнозе заболевания). Заключение. В научной литературе накапливаются данные о влиянии аномальной экспрессии ингибитора апоптоза Вcl-2 на клиническое течение и прогноз КРР, однако имеются лишь единичные работы, анализирующие взаимосвязь Вcl-2 с метастазированием КРР и факторами, влияющими на инвазивный потенциал опухолевых клеток. На сегодняшний день нет единого мнения о прогностической значимости белка Вcl-2 для больных КРР. В ряде работ по КРР показана корреляция повышенной экспрессии Bcl-2 в опухолевых клетках с относительно благополучным течением заболевания и хорошей выживаемостью больных. Другими авторами показано, что опухоли, высокоэкспрессирующие Bcl-2, наоборот, являются более агрессивными по сравнению с таковыми без экспрессии маркера. Существует ряд исследований, в которых прогностическое значение белка Bcl-2 не подтверждается. Многие вопросы, касающиеся корреляции данного МБМ с клинико-морфологическими характеристиками опухоли, также нуждаются в уточнении. Все сказанное - предмет дальнейших исследований.
Ключевые слова
Полный текст
Об авторах
Анна Дмитриевна Даренская
Наталья Валериевна Доброва
канд. мед. наук, ст. науч. сотр. отд-ния химиотерапии и комбинированного лечения злокачественных опухолей НИИ клинической онкологии им. Н.Н.Трапезникова
Евгения Владиславовна Степанова
д-р мед. наук, вед. науч. сотр. лаб. биомаркеров и механизмов опухолевого ангиогенеза НИИ экспериментальной диагностики и терапии опухолей
Список литературы
© Даренская А.Д., Доброва Н.В., Степанова Е.В., 2019
Эта статья доступна по лицензии Creative Commons Attribution-NonCommercial 4.0 International License.
Читайте также:
