Перспективы изучения раковых клеток
Добавил пользователь Alex Обновлено: 19.01.2026
Rb как ген супрессор опухолевого раста и входа клетки в клеточный цикл
• В точке рестрикции клетка принимает решение о необходимости деления
• pRb представляет собой супрессор опухоли, который может предотвращать клетку от прохождения через точку рестрикции
• pRb может быть инактивирована за счет мутаций, взаимодействия с онкобелками, или усиления пути передачи сигнала, опосредованного Ras
Разнообразные сигналы, поступающие в клетку, должны подвергнуться интеграции, обработке, и в конце концов использоваться для принятия окончательного решения относительно ее роста, пребывания в состоянии покоя или дифференцировки. Как отмечено выше, две альтернативы делению заключаются или в выходе клетки из цикла в обратимое покоящееся состояние, или в необратимом ее выходе в состояние постмитотической дифференцировки.
Принятие клеткой решения — расти или пребывать в состоянии покоя — происходит в определенной фазе цикла, В специфической точке принятия решения, в конце периода G1, до наступления перехода G1-S, клетка принимает решение, должна ли она разделиться или перейти в фазу покоя, называемую G0. Эта точка принятия решения называется точкой рестрикции (R). Когда клетка прошла через точку R, она становится коммитированной к прохождению остальной части цикла (т. е. оставшейся части фазы G1, фазы S, G2 и М) практически автоматически, если не произойдут какие-либо генетические или метаболические нарушения. На рисунке ниже показан клеточный цикл и точка рестрикции.
Принятию решения о прохождении через точку R способствуют митогенные сигналы, которые клетка получила с начала G1 периода. Наоборот, такому решению не способствует большое количество антимитотических сигналов, например полученных с участием системы TGF-b. По-видимому, решение пройти через точку R принимается достаточно произвольным образом всеми типами раковых клеток человека.
Белок, играющий критическую роль в принятии клеткой решения о прохождении через точку R, представляет собой продукт гена ретинобластомы, pRb. Он существует в гипо- и гиперфосфорилированном состояниях. В гипофосфорилированном состоянии белок pRb блокирует прохождение клетки через точку R, а в гиперфосфорилированном разблокирует проход и направляет клетку в позднюю G1-фазу.
В различных опухолях человека, включая ретинобластомы и остеосаркомы, о которых шла речь раньше, происходит утрата pRb из-за инактивирующей мутации, затрагивающей обе копии гена Rb. В клетках карциномы шеи белок становится функционально неактивным, поскольку блокируется онкобелком вируса папилломы человека, играющего роль этиологического (провоцирующего) агента для большинства таких опухолей.
Наряду с контролем клеточного деления (регулируя прохождение через фазу G1 цикла), pRb может взаимодействовать с рядом факторов транскрипции, запуская тканеспецифические программы дифференцировки клеток. Например, при мышечной дифференцировке белок может взаимодействовать с транскрипционными факторами, ответственными за индукцию генов, специфичных для мышечных клеток. Поэтому pRb может связывать прекращение пролиферации клеток с дифференцировкой.
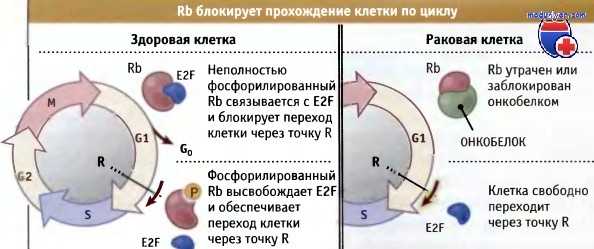
Rb представляет собой основной ген-супрессор опухолевого роста.
Он блокирует прохождение клетки по циклу за счет связывания с факторами транскрипции E2F,
и блокирует транскрипцию генов, необходимых для вхождения в S-фазу.
Видео стадии и фазы клеточного цикла клетки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Перспективы изучения раковых клеток
Механизм инвазии и метастазирования раковых клеток
• Некоторые клетки первичной опухоли могут проникать в кровь и лимфатические сосуды (интравазация)
• Процесс инвазии часто требует прохождения через соседний тканевой барьер
• Клетки, попавшие в кровеносные сосуды, могут заселять другие органы
• Метастазирование, или заселение других тканей, обычно приводят к смерти индивидуума
Клетки опухоли могут продолжать пролиферировать в течение нескольких лет или десятилетий, оставаясь на том месте, где она первоначально образовалась. Такие первичные опухоли могут дорастать до такого размера, когда они начнут представлять собой опасность разрушения жизненно важных тканей и нарушения критических физиологических функций организма.
На долю первичных опухолей приходится лишь около 10% общей смертности от онкологических заболеваний. Основная смертность от рака вызвана миграцией раковых клеток от места первичной опухоли в другие органы.
По мере увеличения размера опухоли, некоторые клетки, расположенные с краю, начинают преодолевать физический барьер, сдерживающий их распространение. Например, для эпителиальных опухолей этот барьер образуется базальной мембраной, разделяющей слой эпителиальных клеток и прилегающую строму.
Пройдя через базальную мембрану, некоторые раковые клетки могут попасть в кровь и лимфатические сосуды (этот процесс называется интравазация) и использовать их как пути миграции в отдаленные органы.
Отделившись от первичной опухоли, раковые клетки попадают в чужеродное окружение. Многие из них погибают, находясь в токе крови и при попадании в капилляры или небольшие лимфатические сосуды отдаленных органов. Некоторым удается покинуть сосуд (экстравазация) и попасть в окружающие ткани. При этом также обычно раковые клетки погибают. Лишь в редких случаях им действительно удается найти орган, в котором клетки могут существовать и образовать новую крупную колонию раковых клеток — метастаз.
Места образования метастазов могут определяться анатомией (например, направлением кровеносных сосудов, ведущих от первичной опухоли к органу-мишени) или факторами роста новой ткани. Клетки карциномы ободочной кишки преимущественно метастазируют в печень, попадая туда через воротную вену, отводящую кровь прямо от кишки к печени. Клетки опухоли молочной железы часто образуют метастазы в кости, головном мозге и легких.
Опухоль предстательной железы также метастазирует в кости. Причины специфики метастазирования в полной мере не выяснены. В то же время последствия его очевидны: метастазы доставляют раковым больным основные страдания, и в большинстве случаев метастазирование опухоли служит причиной летального исхода онкологических заболеваний.
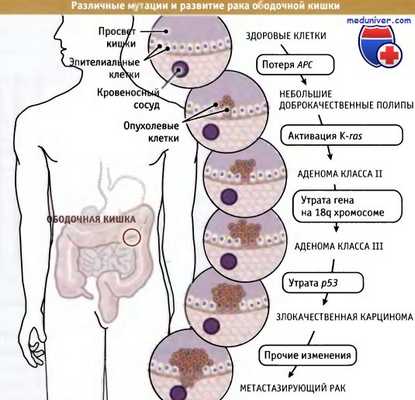
При развитии колоректальных раков малигнизация инициируется мутациями в АРС гене,
а различные стадии развития опухоли связаны с возникновением дополнительных мутаций.
В течение нескольких последующих десятилетий исследования рака будут продвигаться в нескольких направлениях. Вначале будут продолжаться дальнейшие исследования взаимосвязи между белками внутриклеточных сигнальных цепей, в результате которых будет получено больше информации о деталях их функционирования. Эта информация может быть использована для идентификации новых мишеней действия противоопухолевых средств.
На самом деле принципы разработки противораковых средств будут претерпевать существенные изменения, связанные с эволюцией наших представлений о строении и метаболизме раковой клетки, разработкой экспресс-методов построения трехмерной структуры белков-мишеней и новых методов конструирования лекарственных препаратов in silico, которые сделают ненужными проведение трудоемкого и дорогого скрининга сотен и тысяч химических соединений, а также с внедрением новых методов доклинического моделирования эффективности лекарственных препаратов, до применения их у больных на первой стадии клинических испытаний.
Одновременно развитие методов функционального скрининга генома позволит классифицировать подтипы опухолей, обладающие различной чувствительностью к новым поколениям лекарственных препаратов.
Наряду с перечисленными практическими аспектами, значительно возрастет объем наших теоретических знаний в области причин возникновения злокачественных опухолей. Вполне вероятно, например, что окажется возможным сформулировать некоторые закономерности, которым подчиняется трансформация клеток человека, что позволит понять, почему в геноме различных типов раковых клеток существуют и взаимодействуют различные типы мутантных аллелей.
Мы также больше узнаем о патогенезе рака. Обычно глубина наших знаний определялась концептуальными моделями, в которых мутации были движущими силами в развитии опухоли. Однако в настоящее время кажется вероятным, что преимущественное развитие опухоли в одних тканях, по сравнению с другими, определяется негенетическими механизмами, особенно воспалением. Таким образом, мы больше узнаем о том, каким образом эти негенетические механизмы, которые рассматриваются как процессы, промотирующие развитие опухоли, взаимодействуют с мутантными аллелями в геноме предраковых клеток и приводят к развитию злокачественной опухоли.
Это также должно позволить нам глубже проникнуть в причинные механизмы рака, о которых в настоящий момент мало что известно, за исключением случаев рака, вызванного курением. Все это, в свою очередь, окажется чрезвычайно полезным, поскольку позволит изменить наш рацион и образ жизни с тем, чтобы понизить смертность от онкологических заболеваний в большей степени, чем это сейчас возможно при использовании различных лекарственных препаратов, которые предлагаются химиками, биохимиками и фармакологами в качестве новых средств лечения рака.
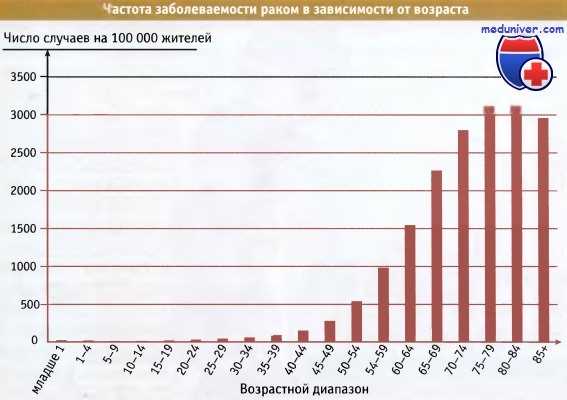
Одним из показателей многоступенчатости опухолевого процесса служит определенный возраст,
характерный для развития заболевания.
Данные любезно предоставлены Национальным институтом исследования рака.
Развитие опухоли можно сравнить с многоактной драмой. По крайней мере шесть этапов проходят здоровые клетки, прежде чем постепенно превратиться в полностью злокачественные. Вероятно, на каждом этапе происходят изменения генотипа, и, таким образом, фенотипа клеток. Такая сложность развития опухолевого процесса находит себе логическое оправдание: на пути растущей опухоли находится много барьеров, каждый из которых препятствует вступлению клеток в очередную стадию ее образования. Соответственно, каждый этап многоступенчатого развития опухоли представляет собой успешное преодоление очередного барьера на пути продвижения клеток к состоянию злокачественного, агрессивного роста.
Такая сложная система противоопухолевой защиты организма является высокоэффективной. Возможно, что на протяжении жизненного периода человека подавляющее большинство первичных опухолей не проходит все этапы, приводящие к развитию диагносцируемых злокачественных новообразований, представляющих угрозу для жизни. Вероятно, у всех людей преклонного возраста в различных органах присутствуют сотни, а может быть, тысячи клонов предраковых клеток, переходу которых в злокачественные опухоли препятствуют концентрические линии защиты, связанные со всеми клетками и тканями.
К ним принадлежат механизмы, регулирующие вхождение клеток в состояние покоя и в апоптоз при активации онкогенов, переход в состояние покоя и кризиса при возобновлении циклов роста и деления, механизмы блокирующие доступность растущей опухоли к кровеносным сосудам, и механические барьеры, физически ограничивающие наиболее агрессивные и инвазивные раковые клетки.
Однако рак развивается, и у 20% населения западных стран многочисленные этапы развития опухоли достигают завершения. Очевидно, что вероятность развития опухолей существенно увеличивается под влиянием различных канцерогенных факторов, с которыми наш организм сталкивается на протяжении жизни, таких как рацион и образ жизни. Сейчас мы знаем, что такие факторы, как курение, потребление избыточного количества жира и мяса, воздействие излучения, полнота и отсутствие беременностей в значительной степени увеличивают риск развития различных раков. Иногда известно, что каждый из этих факторов оказывает прямое или непрямое действие на индукцию генетических изменений, приводящих к образованию мутантных генов, участвующих в различных этапах развития опухоли.
Генетический механизм, управляющий двумя этими этапами, пока остается совершенно непонятным.
Цель раковых исследований состоит в том, чтобы составить полный список всех дефектов, необходимых для превращения здоровой клетки в опухолевую. В свою очередь, это позволит исследователю написать биографию возникшей раковой клетки, в которой будет подробно задокументирован каждый шаг ее образования. В заключение, по мере того как будут выяснены детали этого сложного пути, будут найдены молекулярные мишени для действия лекарственных средств.
Раковые клетки
Раковые клетки (злокачественные, атипичные, опухолевые клетки) – это клетки, которые в результате мутаций изменили свой внешний вид и функции, перестали быть похожими на нормальные клетки в соответствующей ткани. Наиболее характерные свойства раковых клеток: «бессмертие», способность к бесконтрольному размножению и распространению в организме. Строго говоря, раковыми можно назвать только клетки злокачественных опухолей из эпителиальных тканей. По отношению к другим злокачественным новообразованиям термин «рак» не применяют.

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
- находиться в отведенном ей месте: это обеспечивается за счет клеточной адгезии, то есть способности клеток «слипаться» между собой;
- размножаться только тогда, когда это необходимо;
- специализироваться на выполнении определенных функций: для этого каждая клетка сознательно себя ограничивает, активирует одни гены и «отключает» другие;
- «чинить» свою ДНК, если в ней произошли «поломки», мутации;
- совершить «самоубийство», если в ней произошли непоправимые патологические изменения, или если она «состарилась».
Во многом эти функции обеспечиваются за счет того, что клетки в организме постоянно «общаются» между собой и реагируют на определенные сигнальные молекулы. Раковая клетка эти сигналы игнорирует. Она начинает жить так, как будто она тут одна и не должна считаться с интересами соседей:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не слипается с соседними клетками. На поверхности «бунтарей» исчезают молекулы, которые удерживают их в нужном месте среди соседей. За счет этого раковая клетка может отрываться от первичной опухоли и путешествовать по организму. Во время этого путешествия она погибает или оседает в каком-нибудь органе, создает свои клоны и образует новый опухолевый очаг — метастаз.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Не «ремонтируют» свою ДНК. В итоге в опухолевых клетках накапливается все больше мутаций, они становятся менее дифференцированными и быстрее размножаются. Они не подвержены апоптозу — запрограммированной клеточной смерти.
При предраковых состояниях клетки тоже теряют свойства нормальных. Но они отличаются и от раковых, в первую очередь тем, что не могут распространяться в организме.
Особая разновидность злокачественных опухолей — так называемый «рак на месте» (in situ). Клетки уже являются раковыми, но пока еще не распространились за пределы своей изначальной локализации. Технически карцинома in situ — не рак, но ее принято рассматривать как самую раннюю стадию рака.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Гены-супрессоры опухолей сдерживают размножение клеток, восстанавливают поврежденную ДНК, вызывают апоптоз — запрограммированную клеточную смерть. Примеры таких генов: BRCA1, BRCA2, TP53 (кодирует белок p53 — «страж генома», который запускает апоптоз в поврежденных клетках).
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).
Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
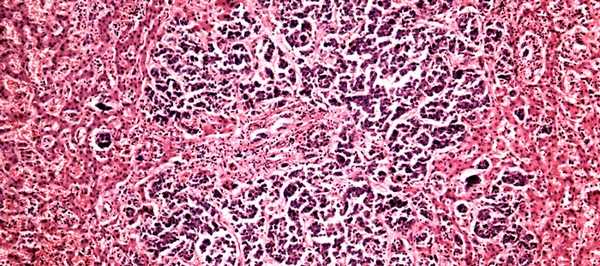
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.

Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадъювантной терапией.
Другие методы лечения:
- Химиопрепараты обладают разными механизмами действия, но все они сводятся к повреждению и уничтожению быстро размножающихся клеток. В первую очередь, конечно же, раковых, но страдают и некоторые нормальные ткани, из-за этого могут возникать серьезные побочные эффекты.
- Лучевая терапия действует аналогично химиопрепаратам, поражая быстро размножающиеся клетки.
- Таргетные препараты воздействуют на молекулы, которые помогают раковым клеткам быстро размножаться, выживать и защищаться от иммунной системы. Например, существуют блокаторы HER2, о котором речь шла выше, ингибиторы VEGF — вещества, с помощью которого опухолевые клетки «выращивают» для себя кровеносные сосуды.
- Иммунотерапия помогает иммунной системе обнаруживать и уничтожать опухолевые клетки.
В «Евроонко» применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Опухолевые разговоры, или Роль микроокружения в развитии рака
Обзор
Автор
Редактор
Клетки многоклеточного организма существуют не сами по себе, а в создаваемом ими самими тканевом окружении, подобно людям, являющимся элементами общества. Клеточная микросреда не только играет важнейшую роль в поддержании функционирования клетки, но и сама активно на него влияет. Реципрокные динамические взаимодействия между клеткой и ее окружением играют решающую роль в развитии онкологических заболеваний, ставших бичом нашего времени. Развитие современных технологий лабораторного изучения клеток и их микроокружения позволяет отследить эти процессы в беспрецедентных деталях и даже смоделировать в лаборатории микросреду по своему желанию.
Написание и размещение этой статьи оплачено ООО «Компания Хеликон», специализирующейся на комплексном оснащении биологических лабораторий и поставке решений на основе микрофлюидики. «Хеликон» никак не влиял на содержание этой статьи.
Жизнь на Земле начиналась с простейших организмов, состоящих из одной клетки, которой приходилось быть самостоятельной и самодостаточной. Однако со временем начали появляться и более сложные существа. Клетки в них уже различались внешне и отвечали за разные функции организма, хотя всё еще могли быть не разнесены в пространстве. Что же касается современных многоклеточных организмов — тут уже не скроешь высокую сложность их устройства и сотни типов клеток, образующих ткани, складывающие всё тело: от носа до кончика хвоста. И здесь клетки должны работать особенно слаженно.
Для этой цели в ходе эволюции выработалась система «общения» между клетками, похожая на нашу речь, только вместо слов в ней используются молекулы. Так, клетки могут «общаться» и с дальними соседями (как это происходит в гормональной системе), и со своим ближайшим окружением — микросредой. Среди важных примеров такого взаимодействия — появление дифференцированных клеток из клетки-предшественницы — например, стволовой клетки (СК). Стоит только вспомнить схему гемопоэза (рис. 1): из одной мультипотентной (способной дать начало целой родословной) клетки в результате многостадийного процесса под влиянием различных сигналов появляются и разнообразнейшие варианты иммунных клеток, и форменные элементы крови.
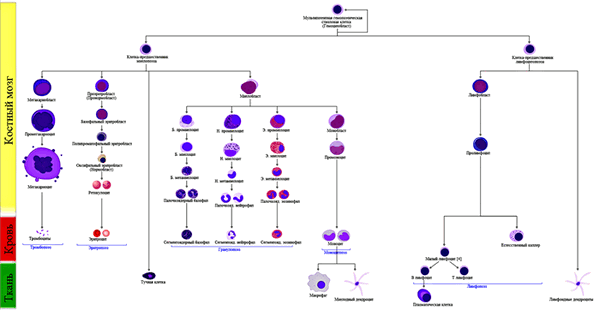
Рисунок 1. Постэмбриональный гемопоэз у человека: гемопоэтическая СК костного мозга дает начало миелопоэзу и лимфопоэзу. Рисунок из «Википедии». Чтобы посмотреть рисунок в полном размере, нажмите на него — он откроется в новой вкладке.
Специализированную физиологическую микросреду, в которой находится СК, называют тканевой нишей. Она поддерживает основные характеристики, отличающие стволовую клетку от всех остальных: плюрипотентность и способность самообновляться [1]. Начнет ли клетка делиться либо останется в покоящемся состоянии, тоже во многом зависит от среды вокруг нее [2, 3].
* — Если природа иногда очень неуместно наделяет клетки «стволовыми» свойствами, то человек старается сделать это целенаправленно — не просто индуцировать плюрипотентность у подходящих типов клеток, но учесть все возможные последствия такого перепрограммирования: «Была клетка простая, стала стволовая» [5], «Снежный ком проблем с плюрипотентностью» [6], «В поисках клеток для ИПСК — шаг за шагом к медицине будущего» [7]. — Ред.
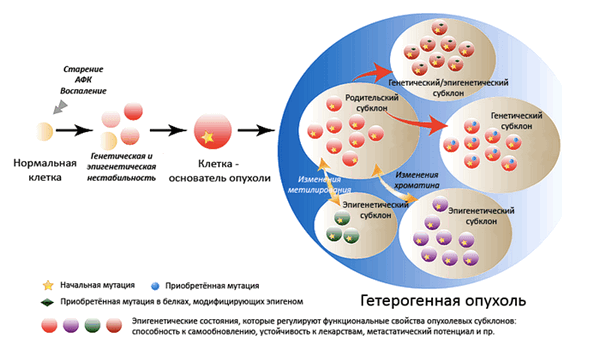
Рисунок 2. Гетерогенная структура опухоли. На начальном этапе онкогенеза хроническое воспаление, накопление активных форм кислорода (АФК) и старение способствуют клональной экспансии клеток с генетическими или эпигенетическими нарушениями. Впоследствии в этих клетках могут произойти дополнительные мутации, и тогда они могут дать начало злокачественной опухоли. Сама опухоль вскоре оказывается гетерогенной, состоящей из нескольких субпопуляций раковых клеток, — благодаря «побочным» мутациям или эпигенетическим изменениям. Рисунок из [9], адаптирован.
Более того, раковые клетки (РК), выделяя сигнальные молекулы, подготавливают специальные ниши для будущих метастазов. В этой связи крайне перспективной становится возможность манипулировать раковыми стволовыми клетками, влияя не на них самих, а на их микросреду или на окружение метастазов. Некоторые исследователи утверждают, что будущее противоопухолевой терапии — это разработка препаратов, направленных на РСК и метастатические ниши.
Структура микроокружения
Микроокружение первичной опухоли (появившейся недавно «с нуля» и еще только готовящейся дать метастазы) очень разнородно. В него входят другие клетки, кровеносные сосуды, внеклеточный матрикс (ВКМ) и целый коктейль из сигнальных молекул. Эти факторы не только поступают извне, но и секретируются самими РК. Иными словами, это двунаправленный процесс: и рак влияет на свою среду, и среда влияет на рак (рис. 3) [17]. Один из классических примеров — это то, как опухоли увеличивают для себя приток питательных веществ. Они выделяют молекулы (например, фактор роста эндотелия сосудов, VEGF), воздействующие на соседние эндотелиальные клетки и провоцирующие рост сосудов — ангиогенез [18].
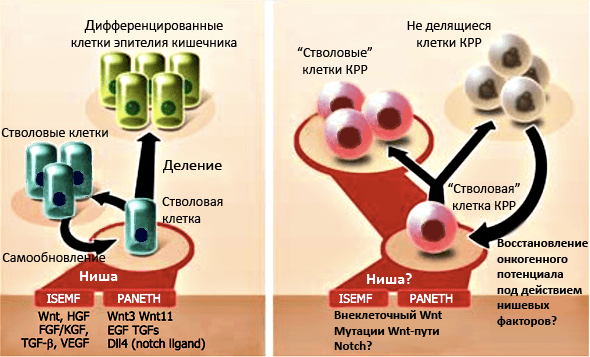
Рисунок 3. Регуляция ниши стволовых клеток нормального кишечного эпителия и колоректального рака. Слева — Сигнальные молекулы, секретируемые кишечными субэпителиальными миофибробластами (ISEMFs) и клетками Панета (Paneth), способствуют обновлению пула СК и нормальной кишечной пролиферации. Справа — Состав микроокружения способствует размножению клеток колоректального рака (КРР) либо их переходу в состояние покоя, из которого они — под влиянием того же микроокружения — могут выйти и восстановить свой онкогенный потенциал. Рисунок из [17], адаптирован.
Роль воспалительных реакций
Микроокружение опухоли характеризуется постоянным воспалением. М2-макрофаги, нейтрофилы, тучные клетки, повышенная концентрация медиатора воспаления оксида азота (NO), многие провоспалительные цитокины — всё это способствует процветанию РК и увеличению агрессивности рака [19]. Поддерживают развитие опухоли также регуляторные Т-клетки и Т-хелперы 2 типа.
Среди сложнейшей сети сигнальных путей особое место по отношению к раку отводится двум системам, приводящим к активации генов, — NF?B и STAT3. Эти факторы транскрипции могут начать работу в ответ на многое: воспаление, бактериальные или вирусные антигены, стресс, свободные радикалы. Используя эти пути, опухоль образуется, пролиферирует, активирует процессы ангиогенеза и инвазии, метастазирует — в общем, делает практически всё для собственного развития. Как оказалось, активация NF?B задействована даже в формировании резистентности рака к химиотерапии и облучению. Эти виды лечения эффективно убивают дочерние раковые клетки, но редко уничтожают сами РСК [19], что обычно имеет печальные последствия в форме обострения болезни спустя какое-то время.
Однако иммунное микроокружение опухоли может оказывать и обратное влияние. Тогда в него включены другие клетки: M1-макрофаги, Т-хелперы 1 типа, цитотоксические Т-клетки, АПК и естественные киллеры [20]. Переключение с антиопухолевого режима на проопухолевый сейчас активно изучается. К примеру, недавно показано, как рак подавляет нормальные функции эффекторных Т-клеток [21].
Внеклеточный матрикс
Внеклеточный матрикс — это каркас микроокружения, формирующий его механическую структуру*. Его создают мезенхимальные клетки: фибробласты, хондроциты, остеобласты. Состав внеклеточного матрикса очень сложен и многообразен: в него входят коллагены — основные белки соединительной ткани (например, коллаген типа IV), протеогликаны, гликопротеины (фибронектин и ламинин-1) и другие компоненты. Ключевые ферменты матрикса — матриксные металлопротеиназы (ММП), разрушающие практически любой белок внеклеточного пространства и тем самым преобразующие его структуру. Двунаправленное влияние ВКМ и РК при некоторых условиях может способствовать прогрессированию опухоли, влиять на ее агрессивность и способность расселяться по всему организму [20]. Например, не только опухолевая клетка для своего роста ремоделирует матрикс, выделяя ММП, но их могут выделять и стромальные клетки микроокружения, облегчая инвазию РК.
* — Внеклеточный матрикс — это вообще святая святых многоклеточной организации. Это «духовные скрепы» и платформа для реализации «организменного законодательства», призванного ограничить права (свободу) индивидуальных клеток и навязать обязанности — всё сугубо для процветания целого организма. Почему это выгодно отдельным клеткам, как неразумные бунтуют, формируя опухоли, и как вообще складывалась в эволюции вся эта система клеточной кооперации, рассказано в статье «Дипломатия клеток: взлёты и падения» [22]. — Ред.
Метастазирование и метастатические ниши
Метастазирование — это процесс распространения и расселения клеток первичной опухоли по организму и образования новых опухолей. Оказывается, вторичная опухоль образуется не в случайном месте, а в зоне с подходящим микроокружением, которую дистанционно «подготовила» первичная опухоль посредством сигнальных молекул. До попадания РК такая ниша считается преметастатической, а после — метастатической (рис. 4). Сложные взаимодействия между попавшей в нишу клеткой и микросредой обеспечивают успешное разрастание метастаза из одной клетки, принимающейся активно делиться.
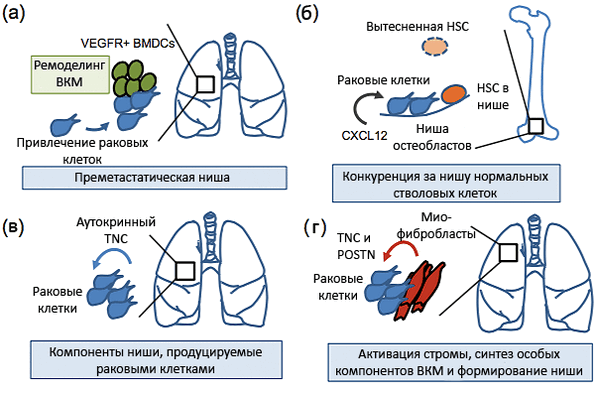
Рисунок 4. Метастатические ниши в период ранней колонизации отдаленных органов. а — Системные изменения, вызванные первичной опухолью молочной железы: мобилизация рецептора 1 фактора роста эндотелия сосудов (VEGFR1) и клеток костного мозга (BMDCs), привлечение РК в легкие, ремоделирование внеклеточного матрикса (ВКМ) и формирование преметастатической ниши, которая способствует колонизации легких клетками рака молочной железы. б — Клетки рака простаты попадают в нишу остеобластов, конкурируя с гемопоэтическими стволовыми клетками (HSCs). Хемокин CXCL12 способствует колонизации путем взаимодействия с рецептором CXCR4. в — Клетки рака молочной железы приносят с собой свой «нишевый материал», тенасцин C (TNC), ускоряя этим колонизацию легких. г — Активированные миофибробласты секретируют компоненты метастатической ниши TNC и периостин (POSTN), усиливая рост метастаза. Рисунок из [2], адаптирован.
Метастатические ниши (МН) рассеяны по всему организму и даже могут перемещаться с развитием болезни. Их можно найти и в гипоксичных областях, и во фронтах инвазии, и даже в обычных нишах СК [2]. Влияние РК на микроокружение позволяет перенастроить изначально неподходящие окружающие условия себе на пользу. Состав МН схож с микроокружением первичной опухоли: он представлен сосудистой сетью, компонентами внеклеточного матрикса и стромы — мезенхимальными и иммунными клетками. Микросреда отличается крайне активной «жизненной позицией». Она не только может «спрятать» РК от атак иммунной системы, но и перепрограммировать дифференцированную РК в РСК. Сложная смесь из факторов роста, хемокинов, гормонов и ферментов помогает РСК выжить и образовать метастаз.
У опухолевой клетки, попадающей в нишу, есть два пути. При неблагоприятных условиях она может перейти в состояние покоя, а при благоприятных — напротив, начать делиться и формировать метастаз. Предполагается, что РК может оставаться в нише, не делясь даже несколько десятков лет. Некоторые ученые выдвигают гипотезу, что покоящиеся метастазы присутствуют в организме с первой стадии рака, а не с четвертой (терминальной), как принято считать. В таком случае РК просто выжидает подходящего момента, а с изменением внешней среды «просыпается» и берется за работу.
Такое «переключение режимов» тоже регулируется молекулярным содержанием ниши и взаимодействием между МН и РК. Например, для регуляции состояния покоя, как показывают исследования, важен баланс между концентрацией белков семейства TGFβ и промитогенными цитокинами. У покоящихся клеток обнаружены и особые взаимодействия с внеклеточным матриксом — временная адгезия к его компонентам [23].
Как считают исследователи, терапия, нарушающая функцию микроокружения раковой клетки, очень перспективна. Например, если мишенью препарата станет МН, то можно добиться невероятных результатов: не только предотвратить появление метастазов, но и вылечить уже существующие. Но для этого сначала предстоит узнать больше о взаимодействии окружения и клетки, находящей приют в этой «тихой гавани».
Модели изучения микроокружения
Сегодня существует множество моделей изучения того, как микросреда изменяет отдельные клетки и их ДНК, и сопутствующее оборудование становится всё более компактным, автоматизированным и многофункциональным.
Раньше для выращивания клеток в культуре преимущественно использовались двухмерные (плоские) матрицы. На них было показано, что ограничением формы или подвижности клетки можно спровоцировать деление, апоптоз или даже дифференцировку мезенхимальных СК человека. Сейчас к этим моделям добавились и трехмерные модели из синтетических гидрогелей и матриц, основанных на коллагеновых волокнах. С их помощью удалось обнаружить, что у клеток, культивируемых в 2D- или 3D-окружении, различаются* фенотип, клеточно-матриксная адгезия и даже экспрессия генов.
* — О том, как чипы различных размеров и разной архитектурной сложности направляют дифференцировку мышиных нейрональных клеток-предшественниц в нейроны либо глию, можно прочитать в статье [24].
Для более корректного сравнения клеток, выращенных в двух- и трехмерной среде, разработаны специальные микролунки: одиночная клетка контактирует с плоской поверхностью, на которую нанесены адгезивные лиганды. Так, изменяя упругость подложки, можно манипулировать формой клетки в пространстве [25].
Близкий подход применяется для изучения метастатических ниш. Например, в 2013 году ученые создали модель спящих костных метастазов при раке груди. К этому исследователей подтолкнуло то, что примерно у трети больных раком груди уже на ранней стадии в костном мозге обнаруживают раковые клетки. Метастазы же развиваются только у половины из них — иногда спустя десятилетия после постановки диагноза. Возникло предположение, что «пробуждение» РК провоцируют факторы микросреды и (или) системные изменения. Эту гипотезу ученые и проверили на модели. 3D-коллагеновая биоматрица, в которой культивируют клетки костного мозга вместе с разными раковыми клетками, во многом воспроизводит естественную костную метастатическую нишу. Как оказалось, с помощью изменения ключевых сигнальных путей, отвечающих за переход клетки в состояние «спячки», можно манипулировать РК: искусственная ниша может и поддерживать, и ингибировать переход клеток в состояние покоя [26].
На похожей модели другая группа исследователей показала, что фармакологическое ингибирование сигналинга киназ определенного семейства не дает спящим клеткам рака груди вновь начать делиться. Поскольку для пролиферации нужна также активация другого гена, то параллельная терапия двумя ингибиторами вызывает апоптоз и задерживает рост метастазов. Авторы указывают, что такое комбинированное лечение может предотвратить повторное развитие рака молочной железы [27].
В наш век развития передовых биотехнологий было бы странно, если бы уже не были придуманы специальные приборы для отслеживания процессов опухолевой инвазии и эпителиально-мезенхимального перехода. К примеру, появились микрофлюидные технологии с различными механическими препятствиями и хемотаксическими градиентами. На одной из таких моделей обнаружено, что мигрирующая эпителиальная РК движется быстрее, если митохондрия находится в ее «головной» части [28].

Комбинированная система Polaris от Fluidigm Corp.
Микрофлюидика на службе исследователей клеточных ниш
Изучение единичных клеток с помощью биочипов на основе технологий микрофлюидики впервые было предложено в 2013 году, когда компания Fluidigm Corp. (США) анонсировала первый чип для профилирования гетерогенных популяций клеток [29]. Чип С1 TM позволил исследователю объединить захват отдельных клеток, лизис, обратную транскрипцию и амплификацию в единый автоматический протокол, тем самым решая большинство существующих проблем со скоростью эксперимента и надежностью и воспроизводимостью получаемых данных.
Довольно быстро биочипы заняли свою нишу во многих областях науки и медицины: изучении стволовых клеток, иммунологии, эпигенетике и, конечно, в онкологии. Так, с помощью биочипов была проведена одна из самых масштабных работ по определению клональности мутаций у пациентов с острым лимфобластным лейкозом. Результаты дали основания полагать, как именно происходило развитие заболевания в каждом конкретном случае [30].
В 2015 году Fluidigm Corp. анонсировала новую комбинированную систему Polaris TM , которая позволяла не только профилировать популяцию в целом, но и изучать влияние микроокружения на конкретные единичные клетки. На одном чипе теперь можно было выбрать клетки с интересующим иммунофенотипом, изолировать их в индивидуальных камерах и задать определенные параметры клеточной ниши.
Помимо манипуляций с потоками среды и газа, температурой и влажностью, в камеры клеток можно вводить дополнительные факторы, в том числе сигнальные молекулы, РНК, вирусы и бактерии. Такая свобода действий позволяет, во-первых, смоделировать практически любое клеточное состояние — апоптоз ли, пролиферацию, воспаление, гипоксию, дифференцировку или синтез специфических белков, а во-вторых, получать воспроизводимые и надежные результаты, гарантировать которые могут только приборы с высоким уровнем автоматизации. Более того, с того момента, как клетка попадает на чип, за каждым мгновением ее жизни ведется наблюдение, что позволяет напрямую соотносить изменения в микроокружении с фенотипом и экспрессией генов конкретной клетки.
Приборы типа Polaris TM открывают огромные перспективы в области изучения клеточного микроокружения, какую бы конечную цель не ставил перед собой исследователь — проверить эффективность нового лекарства, изучить новый сигнальный каскад или посмотреть, как меняется фенотип клетки в тех или иных условиях [31, 32].
Читайте также:
