Первичный билиарный холангит
Добавил пользователь Евгений Кузнецов Обновлено: 07.01.2026
Первичный билиарный холангит (ПБХ; ранее известный как первичный билиарный цирроз) – это аутоиммунное заболевание печени, характеризующееся прогрессирующим разрушением внутрипеченочных желчных протоков, что приводит к холестазу, циррозу Цирроз печени Цирроз – финальная стадия печеночного фиброза, который приводит распространенному нарушению печеночной архитектоники. Цирроз характеризуется образованием узлов регенерации, окруженных плотной. Прочитайте дополнительные сведения и печеночной недостаточности. Пациенты обычно асимптоматичны при осмотре, но могут жаловаться на утомляемость или иметь симптомы холестаза (например, зуд, стеаторею) или цирроза (например, портальную гипертензию Портальная гипертензия Портальная гипертензия – повышенное давление в воротной вене. Наиболее частыми причинами этого состояния являются цирроз (в развитых странах), шистосоматоз (в эндемических областях) или сосудистые. Прочитайте дополнительные сведения , асцит). Лабораторные исследования показывают холестаз, повышение уровней IgM, и, что характерно, в сыворотке определяются антимитохондриальные антитела. Биопсия печени может потребоваться для постановки диагноза и определения стадии болезни. Лечение включает урсодезоксихолевую кислоту, обетихолевую кислоту, холестирамин (при зуде), дополнительные жирорастворимые витамины и, при выраженном заболевании, трансплантацию печени Трансплантация печени Трансплантация печени занимает 2-е место среди трансплантаций солидных органов. (См. также Обзор трансплантации (Overview of Transplantation)). Показания для проведения трансплантации печени. Прочитайте дополнительные сведения .
Этиология первичного биллиарного холангита (ПБХ)
Первичный билиарный холангит (ПБХ) – наиболее частая причина хронического холестаза у взрослых. Большинство (95%) случаев встречаются у женщин в возрасте от 35 до 70 лет. ПБЦ также может иметь семейный характер. Генетическая предрасположенность, возможно связанная с Х-хромосомой, вероятно входит в число причинных факторов. Возможно, имеется наследственная патология иммунной регуляции.
Вовлечен аутоиммунный механизм; антитела вырабатываются к антигенам, расположенным на внутренних митохондриальных мембранах, что происходит в > 95% случаев. Эти антимитохондриальные антитела (AMA) представляют собой серологический отличительный признак ПБХ, они не цитотоксичны и не вовлечены в повреждение желчных протоков.
ПБХ ассоциирован с другими аутоиммунными заболеваниями, такими как системный склероз Системная склеродермия Системная склеродермия – это редкое хроническое заболевание неизвестной этиологии, характеризующееся развитием диффузного фиброза, а также патологическим изменением сосудов кожи, суставов и. Прочитайте дополнительные сведения , CREST-синдром (также известный как ограниченная склеродермия Системная склеродермия Системная склеродермия – это редкое хроническое заболевание неизвестной этиологии, характеризующееся развитием диффузного фиброза, а также патологическим изменением сосудов кожи, суставов и. Прочитайте дополнительные сведенияТ-клетки атакуют мелкие желчные протоки. CD4 и CD8 Т-лимфоциты напрямую атакуют клетки желчного эпителия. Триггер иммунологической атаки на желчные протоки неизвестен. Подверженность чужеродным антигенам, таким как инфекционные (бактериальные или вирусные) или токсические агенты, может быть провоцирующим событием. Эти чужеродные антигены могут быть структурно схожи с эндогенными белками (молекулярная мимикрия); следующая затем иммунологическая реакция может стать аутоиммунной и самовоспроизводящейся. Разрушение и потеря желчных протоков приводят к нарушению формирования желчи и ее секреции (холестазу). Задерживающиеся в клетках токсические вещества, такие как желчные кислоты, затем вызывают дальнейшее повреждение, в частности – гепатоцитов. Хронический холестаз, следовательно, ведет к воспалению печеночной клетки и формированию рубцов в перипортальных областях. При прогрессировании фиброза Фиброз печени Фиброз печени – это сверхвыраженный процесс заживления с образованием избыточного количества соединительной ткани, инкорпорированной в ткань печени. Происходит сверхпродукция экстрацеллюлярного. Прочитайте дополнительные сведения в цирроз Цирроз печени Цирроз – финальная стадия печеночного фиброза, который приводит распространенному нарушению печеночной архитектоники. Цирроз характеризуется образованием узлов регенерации, окруженных плотной. Прочитайте дополнительные сведения печеночное воспаление постепенно уменьшается.
AMA-негативный ПБХ характеризуется аутоантителами, такими как антинуклеарные антитела (АНА), антитела к гладкой мускулатуре, или и те и другие, и имеет клиническое течение и ответ на лечение, подобные таковым при ПБХ. Однако АМА отсутствуют.
Симптомы и признаки ПБХ
Примерно у половины пациентов симптомы отсутствуют. Симптомы или признаки могут появляться во время любой стадии заболевания и включать в себя недомогание или служить отражением холестаза (и последующей мальабсорции жиров, что может приводить в дефициту витаминов и развитию остеопороза), гепатоцеллюлярной дисфункции или цирроза Цирроз печени Цирроз – финальная стадия печеночного фиброза, который приводит распространенному нарушению печеночной архитектоники. Цирроз характеризуется образованием узлов регенерации, окруженных плотной. Прочитайте дополнительные сведения .
Симптомы обычно развиваются незаметно. Зуд, недомогание, сухость во рту и глазах являются основными симптомами в > 50% случаев и могут предшествовать другим симптомам в течение месяцев или лет. Заболевание может манифестировать болью или дискомфортом в верхнем правом квадранте живота (10%), большой плотной безболезненной печенью (25%), спленомегалией (15%), гиперпигментацией (25%), ксантелазмами (10%) и желтухой (10%). Со временем появляются все признаки и осложнения цирроза. Периферическая нейропатия и другие аутоиммунные нарушения, ассоциированные с первичным билиарным холангитом, также могут клинически манифестировать.
Диагностика ПБХ
Печеночные пробы: холестаз с повышенным уровнем щелочной фосфатазы
Положительные антимитохондриальные антитела (АМА) или ПБС-специфические аутоантитела (например, sp100 или gp210)
Биопсия печени: негнойный деструктивный холангит и разрушение междольковых желчных протоков
Диагноз подтверждается при наличии 2 из 3 предыдущих критериев.
У асимптоматичных пациентов первичный билиарный холангит (ПБХ) диагностируют случайно – по типичным отклонениям в биохимических тестах, а именно по повышению уровней щелочной фосфатазы и гамма-глутамилтранспептидазы (ГГТ). ПБХ необходимо предполагать у женщин среднего возраста с классическими симптомами (например, необъяснимым зудом, недомоганием, дискомфортом в правом верхнем квадранте живота, желтухой) или с лабораторными показателями, характерными для холестатического заболевания печени: повышением уровней щелочной фосфатазы (обычно в 1,5 раза выше нормы) и ГГТ и минимальными изменениями в уровнях аминотрансфераз (аланинаминотрансферазы [АЛТ], аспартатаминотрансферазы [АСТ], обычно в 5 раз ниже нормы). Сывороточный билирубин обычно нормален на ранних стадиях, его повышение означает прогрессирование заболевания и ухудшение прогноза.
При подозрении на ПБХ необходимо проведение исследований печени для измерения сывороточного IgM (повышенного при ПБХ) и АМА. Иммуноферментный анализ (ИФА) чувствителен в 95% и специфичен в 98% при ПБЦ; ложнопозитивные результаты могут встречаться при аутоиммунном гепатите (тип I). Другие аутоантитела (например, антинуклеарные антитела [AНA], антитела к гладкой мускулатуре, ревматоидный фактор) также могут присутствовать. Внепеченочная билиарная обструкция должна быть исключена. Первым шагом часто является проведение ультрасонографии, но в конечном счете необходимо проводить МРХПГ, а иногда и эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ). Биопсия печени Биопсия печени Биопсия печени предоставляет информацию о структуре печени и характере ее повреждения (тип и степень, наличие фиброза); эта информация может быть необходима не только для диагноза, но также. Прочитайте дополнительные сведения необходима для подтверждения АМА-негативного ПБХ. Биопсия печени помогает исключить другие холестатические диагнозы (медикаментозно индуцированное заболевание печени, саркоидоз, ПБХ, билиарную обструкцию, аутоиммунный гепатит) или подозрение на сопутствующие заболевания печени (аутоиммунный гепатит или неалкогольный стеатогепатит). Биопсия печени позволяет выявить патогномоничные поражения желчных протоков, даже на ранних стадиях. При прогрессировании ПБЦ он становится морфологически неотличимым от других форм цирроза. Биопсия печени также помогает определить стадию ПБХ.
У некоторых пациентов с ПБХ наблюдаются признаки перекреста с аутоиммунным гепатитом (АЛТ превышает нормальный диапазон более чем в 5 раз, IgG превышает нормальный диапазон более чем в 2 раза, положительные антитела к гладкомышечным клеткам и умеренный или тяжелый интерфейсный гепатит при биопсии печени).
Прогноз при ПБХ
Обычно ПБХ прогрессирует до терминальной стадии в течение 15–20 лет, хотя уровень прогрессирования варьирует. ПБХ может не ухудшать качество жизни в течение многих лет. У бессимптомных пациентов они развиваются в течение 2–7 лет болезни, однако их может не быть 10–15 лет. Как только развиваются симптомы, ожидаемая средняя продолжительности жизни составляет 10 лет. Предикторы быстрого прогрессирования включают следующие:
Первичный билиарный холангит/цирроз печени: руководящие принципы лечения
Первичный билиарный холангит (прежнее название «первичный билиарный цирроз») — это аутоиммунное заболевание печени, при котором цикл иммуноопосредованного поражения эпителиальных клеток желчевыводящих путей, холестаз и прогрессирующий фиброз могут достигнуть терминальной стадии — цирроза печени. Предрасположенность к заболеванию в равной степени обусловлена как генетическими, так и экологическими факторами. Наибольшую распространенность первичного билиарного холангита отмечают у женщин и пациентов в возрасте старше 50 лет. Поскольку заболевание чаще диагностируется с помощью сочетания печеночных проб и тестов на наличие антимитохондриальных антител, а большинство пациентов не имеют цирроза печени, термин «билиарный холангит» является более точным. Течение заболевания обычно ухудшает качество жизни пациентов, а лечение требует пожизненного противодействия прогрессированию болезни и снижения симптоматической нагрузки.
Терапия при первичном билиарном холангите включает урсодезоксихолевую кислоту и обетихолевую кислоту наряду с экспериментальными и ранее одобренными фармацевтическими средствами. Лечение ориентировано на применении урсодезоксихолевой кислоты и стратификации риска на основе исходных и терапевтических факторов, включая ответ на лечение. При непереносимости урсодезоксихолевой кислоты или высоком риске заболевания, о чем свидетельствует неэффективность лечения с применением урсодезоксихолевой кислоты (обычно проявляющаяся повышением уровня щелочной фосфатазы >1,67 × верхнюю границу нормы и/или повышением концентрации билирубина в крови), возможна терапия второй линии, включающая обетихолевую кислоту.
В марте 2018 г. в журнале «Gut» опубликованы новые руководящие принципы лечения и подробные рекомендации по ведению пациентов с первичным билиарным холангитом, разработанные Британским обществом гастроэнтерологов (British Society of Gastroenterology), Великобритания. Руководящие принципы подготовлены с использованием систематического обзора публикаций в базах данных PubMed, Medline и Cochrane. При составлении рекомендаций использована классификация оценки, разработки и анализа GRADE, в соответствии с которой они подразделены на сильные и слабые с уровнем доказательности от высокого до умеренного, низкого и очень низкого. Данные будут полезны для врачей, медсестер и самих пациентов, хотя преимущественно ориентированы на гастроэнтерологов и гепатологов.
Характеристиками первичного билиарного холангита являются устойчивое повышение (продолжительностью более 6 мес) уровня щелочной фосфатазы в сыворотке крови, довольно часто наличие гранулематозного воспаления портальных трактов, сопутствующим лимфоцитарно опосредованным повреждением (и деструкцией) мелких внутрипеченочных желчных протоков, холестазом и типичным набором сывороточных и секреторных аутоантител. У большинства пациентов описанное состояние прогрессирует с развитием билиарного фиброза и, в конечном счете — цирроза. Скорость цирротических изменений вариабельна и поддается модификации путем применения урсодезоксихолевой кислоты.
Эпидемиология
Этиология
Первичный билиарный холангит этиологически является иммуноопосредованным повреждением билиарных путей в результате взаимодействия иммуногенетических и экологических триггеров с наличием точек кластеризации болезни. Подтвержденными факторами риска являются курение и рецидивирующие инфекции мочевыводящих путей. Холестаз и/или зуд в период предыдущей беременности также связан с повышением риска развития первичного билиарного холангита. Необходимо документировать рецидивирующие инфекции мочевыводящих путей и связанные с беременностью холестазы, а также рекомендовать прекращение курения, учитывая его прямую взаимосвязь с прогрессированием заболевания.
Диагностика
Диагностическая точность сочетания холестатических сывороточных тестов и специфических серологических маркеров достигает >95% по своей чувствительности и специфичности, поэтому анализ крови лежит в основе диагностики первичного билиарного холангита. Подозрение на первичный билиарный холангит справедливо по отношению к пациентам с иначе необъяснимым повторным повышением щелочной фосфатазы в сыворотке крови, а также гамма-глутамилтрансферазы.
Во всех подобных случаях следует проверять наличие аутоантител с помощью теста ELISA в соответствии с местной практикой, что является достаточным для подтверждения диагноза у большинства пациентов без применения биопсии. При подозрении на альтернативное аутоиммунное заболевание тест ELISA может обладать большей чувствительностью и менее подвержен неспецифичной реактивности, возникающей в результате высокого титра поликлональных иммуноглобулинов IgM, наблюдаемого при первичном билиарном холангите. Наличие специфических антинуклеарных или антицентромерных антител чаще всего бывает достаточным для диагностики серонегативного первичного билиарного холангита, однако достоверно о наличии серонегативного заболевания можно судить лишь при наличии материалов биопсии.
Учитывая доброкачественный прогноз при наличии антимитохондриальных антител и нормальных результатов печеночных проб, для таких пациентов не рекомендуется ни биопсия, ни применение урсодезоксихолевой кислоты. Однако рекомендуется ежегодно на первичном медико-санитарном уровне проводить повторные печеночные пробы.
Нет никаких доказательств того, что концентрация антимитохондриальных антител, превышающая диагностический порог, имеет какое-либо прогностическое значение. Поэтому после установления четкого диагноза повторное измерение не рекомендуется. Кроме того, титр аутоантител может снижаться под влиянием урсодезоксихолевой кислоты. Иммунофлуоресцентный метод, также используемый для диагностики первичного билиарного холангита, позволяет выявить тонкие вариации специфичности аутоантител.
Роль визуализации в диагностике первичного билиарного холангита в значительной степени исключает альтернативные диагнозы. Для большинства пациентов достаточно скрининга ультразвуковой визуализации. Особое внимание уделяется исключению первичного склерозирующего холангита и похожих на него заболеваний у пациентов с серонегативным холангитом при помощи магнитно-резонансной холангиопанкреатографии. Наличие желчных камней у пациентов с первичным билиарным холангитом довольно часто является потенциальной причиной задержки диагностики. На терминальной стадии первичного билиарного холангита визуализация цирротических осложнений выполняется так же, как при циррозе печени любой другой этиологии.
Гистологические особенности
Адекватность любой биопсии обусловлена клинической задачей, но в целом биопсийный материал печени должен иметь достаточный объем для визуализации паренхимы и количества портальных трактов (предлагается более 11). Картина первичного билиарного холангита включает деструктивный гранулематозный лимфоцитарный холангит, ведущий к прогрессирующей потере желчных протоков, а также хроническому холестазу, фиброзу и циррозу. Другие видимые особенности включают лимфоцитарную активность, паренхиматозное некротизирующее воспаление и узловатую регенеративную гиперплазию. Точные критерии прогностической биопсии печени при первичном билиарном холангите еще предстоит установить, равно как и роль конкретных систем оценки.
Биопсия периферических лимфатических узлов, увеличение которых довольно часто отмечают при первичном билиарном холангите (и вообще при заболеваниях печени), обычно выявляет наличие реактивно-воспалительных изменений, которые предположительно являются частью основного патологического процесса.
Дифференциальная диагностика
Определение диагноза первичного билиарного холангита обычно вызывает небольшую путаницу из-за специфичности и чувствительности аутоантител. Следует проявлять осторожность при серонегативном типе холангита, для которого основным дифференцируемым заболеванием является первичный склерозирующий холангит. Другие возможные диагнозы включают саркоидоз, болезнь трансплантата против хозяина, идиопатическое нарушение кровообращения, вызванное лекарственным повреждением печени, и варианты генетических холестатических синдромов. Также следует осторожно интерпретировать низкий титр антимитохондриальных антител из-за возможности ложной позитивности аутоантител при воспалительных состояниях, в частности неалкогольной жировой болезни печени.
Сопутствующие заболевания
Первичный билиарный холангит в основном ассоциирован с другими аутоиммунными состояниями, отражающими общую иммуногенетическую восприимчивость (наиболее сильная ассоциация с синдромом Шегрена). У пациентов с выраженной слабостью следует учитывать наличие заболеваний щитовидной железы (присутствует у 25% пациентов) или анемии с иммунной/аутоиммунной этиологией (включая пернициозную анемию, аутоиммунную гемолитическую анемию и целиакию).
Остеопороз также часто отмечают при первичном билиарном холангите, хотя его правильнее рассматривать в качестве осложнения метаболических изменений, наблюдаемых при холестазе, включая снижение абсорбции жирорастворимых витаминов.
До сих пор не установлено, связаны ли повторные инфекции мочевыводящих путей при первичном билиарном холангите с основным заболеванием или агрессивное лечение инфекции мочевыводящих путей оказывает влияние на естественную историю первичного билиарного холангита. Однако рецидивирующие инфекции мочевыводящих путей являются потенциальной причиной снижения качества жизни.
Руководящие принципы
Наличие у пациента антимитохондриальных или специфических антиядерных антител в титре 1:40 или выше (при соответствующих признаках холестаза по биохимическим показателям и отсутствии альтернативного объяснения) обычно является достаточным основанием для установления диагноза первичного билиарного холангита (сильные рекомендации с высоким уровнем доказательности).
Все пациенты с первичным билиарным холангитом нуждаются в пожизненном наблюдении, причем различное течение болезни у разных пациентов может потребовать различной интенсивности наблюдения (сильные рекомендации, умеренный уровень доказательности).
Оценка риска должна учитывать тяжесть заболевания и его активность в начальном и последующих этапах, молодой возраст наступления болезни (младше 45 лет) и мужской пол. При этом рекомендуется комплексное исследование: печеночные пробы, ультразвуковая визуализация для выявления открытого цирроза и спленомегалии, переходная эластография (сильная рекомендация, умеренный уровень доказательности).
Выявление пациентов с наибольшим риском прогрессирования заболевания осуществляется на основании показателей биохимического анализа после одного года терапии с применением урсодезоксихолевой кислоты (сильная рекомендация, высокий уровень доказательности).
Предполагается, что если пациенты при лечении урсодезоксихолевой кислотой имеют уровень щелочной фосфатазы в крови >1,67 × верхнюю границу нормы и/или повышенную концентрацию билирубина
Рекомендуемый объем перорального применения урсодезоксихолевой кислоты составляет 13–15 мг/кг/сут в качестве фармакотерапии первой линии для всех пациентов с первичным билиарным холангитом. По возможности лечение должно быть продолжительным (сильная рекомендация, высокий уровень доказательности).
Рекомендуется оценивать выраженность симптомов, особенно физической слабости и зуда. Клиницисты должны учитывать, что тяжесть симптомов не коррелирует со стадией болезни (сильная рекомендация, умеренный уровень доказательности).
При подозрении на аутоиммунный гепатит необходимо выполнить биопсию печени для экспертного клинико-патологического исследования и провести соответствующее лечение (сильная рекомендация, умеренный уровень доказательности);
Все пациенты с первичным билиарным холангитом должны иметь возможность обратиться к группам поддержки (сильная рекомендация, умеренный уровень доказательности);
Клиницистам, наблюдающим пациентов с первичным билиарным холангитом, рекомендуется рассмотреть возможность внедрения инструментов клинического аудита для документирования с целью улучшения качества медицинской помощи (сильная рекомендация, низкий уровень доказательности).
Лечение: урсодезоксихолевая кислота
Терапия с применением урсодезоксихолевой кислоты в объеме 13–15 мг/кг/сут приемлема для большинства пациентов. Потенциальные признаки стероидзависимого аутоиммунного гепатита рассматриваются исключительно после биопсии печени и экспертного гепатологического исследования. Неадекватный эффект применения урсодезоксихолевой кислоты (в соответствии с утвержденными критериями) связан с повышенным риском смерти или необходимостью трансплантации печени. Концепция отказа от лечения с применением урсодезоксихолевой кислоты развивается, и в данное время ни один критерий риска не был признан оптимальным; однако снижение уровня щелочной фосфатазы в сыворотке крови соответствует лучшему результату лечения по сравнению с другими прогностическими факторами, такими как концентрация билирубина, возраст пациента и количество тромбоцитов. Помимо этого, хорошие рекомендации получила простая и легкая в применении методика стратификации «Toronto», критерием риска в которой служит значение щелочной фосфатазы, по меньшей мере в 1,67 раза превышающее верхнюю границу нормы и/или аномальный уровень общего билирубина.
Обетихолевая кислота
Обетихолевая кислота представляет собой полусинтетический аналог гидрофобной желчной кислоты, обладающий высокоселективными свойствами по отношению к фарнезоидному Х-рецептору, оказывающему экспоненциальный активационный эффект на эндогенный аналог хенодезоксихолевой кислоты. Обетихолевая кислота также индуцирует экспрессию гормонов кишечника, в частности фактора роста фибробластов. Ядерный рецептор фарнезоидного Х-рецептора является центральным транскрипционным датчиком метаболических каскадов желчных кислот, а фарнезоидный Х-рецептор обильно экспрессируется в печени и энтероцитах. Основным геном фарнезоидного Х-рецептора в кишечнике является фактор роста фибробластов-19, который представляет собой энтерокин, секретируемый в портальную кровь при стимуляции желчных кислот. Фактор роста фибробластов-19, достигая печени, активирует рецептор фактора роста фибробластов-4/β-Klotho, инициируя внутриклеточные пути, подавляющие 7-α-гидроксилазу холестерина, который является ограничивающим скорость ферментом при синтезе желчных кислот. Передача сигналов фарнезоидного Х-рецептора непосредственно регулирует активность генной экспрессии в синтезе желчных кислот, а также их секреции, транспорте, абсорбции и детоксикации. Кроме того, сигнализация фарнезоидного Х-рецептора влияет на реакции воспаления, регуляцию метаболизма и процесс фиброзного преобразования печени.
Согласно инструкции, обетихолевую кислоту назначают в объеме до 5 мг/нед с начальной максимальной дозой 10 мг 2 раза в неделю. У пациентов с циррозом, особенно после подтверждения наличия портальной гипертензии, необходимо усилить раннюю оценку безопасности (например повторять анализы крови ежемесячно), а в контексте развития декомпенсации или прогрессирования заболевания может быть указана доза или момент прекращения лечения с применением обетихолевой кислоты.
Применение обетихолевой кислотой связано с дозозависимым обострением зуда, что приводит к прекращению лечения у 1–10% пациентов. Эти наблюдения подчеркивают важность титрования дозы с/без своевременного назначения рифампицина для контроля симптомов. У пациентов, получавших обетихолевую кислоту, также возможны (обратимые) изменения уровней липидов в сыворотке крови; в частности небольшое снижение липопротеинов высокой плотности. Пока неизвестно, влияют ли эти последствия на долгосрочный риск развития сердечно-сосудистых заболеваний.
Управление симптомами
Симптомы первичного билиарного холангита оказывают значительное влияние на качество жизни пациентов. Возможно, эти руководящие принципы помогут клиницистам стандартизировать подход к их управлению. Авторы полагают, что мониторинг симптомов с количественной оценкой (шкала Likert или многомерное измерение качества жизни при первичном билиарном холангите, PBC-40 QoL measure) позволяет адекватно определять ответ на терапию. Существующий риск возврата симптомов при прекращении терапии для большинства пациентов требует длительного лечения. Симптомы первичного билиарного холангита обычно не коррелируют с тяжестью заболевания и не улучшаются при терапии урсодезоксихолевой кислотой.
Зуд является одним из характерных холестатических симптомов при первичном билиарном холангите. Приблизительно 80% пациентов испытывают зуд в течение некоторого времени в различных стадиях заболевания, но он усиливается при ухудшении состояния печени. Обструкция желчных протоков как причина зуда, должна быть исключена с учетом повышенного риска развития желчнокаменной болезни. Секвестранты желчи (такие как холестирамин) используют в качестве терапии первой линии, но переносимость часто является источником побочных эффектов, включая вздутие живота и запоры.
Важно отметить, что секвестранты желчи должны быть назначены за 2–4 ч до или после приема других лекарств (в частности урсодезоксихолевой кислоты), поскольку они препятствуют всасыванию в кишечнике. Рифампицин является полезным агентом второй линии. Несколько проспективных рандомизированных плацебо-контролируемых исследований показали, что рифампицин эффективен для устранения холестатического зуда. Этот эффект был подтвержден в метаанализе. Существуют опасения по поводу возможных побочных эффектов рифампицина (включая гепатотоксичность и гемолиз), поэтому пациенты, начавшие лечение, нуждаются в регулярных анализах крови. Также важно помнить, что рифампицин влияет на метаболизм витамина К и противомикробную резистентность. Опиатные антагонисты все чаще применяют в качестве терапии третьей линии для снижения ощущения зуда.
Рекомендации
Медикаментозное лечение первичного билиарного холангита
Первичный билиарный холангит (который раньше назывался первичным билиарным циррозом) является хроническим заболеванием печени, вызванным разрушением небольших внутрипеченочных желчных протоков (каналов, которые переносят желчь, вырабатываемую печенью), что приводит к застою желчи (холестазу), повреждению печени и замещению клеток печени фиброзной соединительной тканью (циррозу печени). Лучший способ лечения людей с первичным билиарным холангитом не ясен. Мы стремились разрешить этот вопрос путем поиска существующих клинических испытаний на эту тему. Мы включили все рандомизированные испытания (клинические исследования, в которых людей в случайном порядке распределяют в одну из двух или более групп вмешательств), которые были опубликованы до февраля 2017 года. Мы включили только те испытания, в которых участники с первичным билиарным холангитом ранее не подвергались трансплантации печени. Помимо применения стандартных Кокрейновских методов, позволяющих сравнивать только два вида лечения одновременно (прямое сравнение), мы запланировали использование расширенного метода, позволяющего сравнивать множество различных видов лечения, которые сравнивали в исследованиях в отдельности (сетевой мета-анализ). Однако из-за характера доступной информации мы не смогли определить, являются ли результаты сетевого мета-анализа надежными. Поэтому мы применяли стандартную Кокрейновскую методологию.
Характеристика исследований
Мы обнаружили 74 рандомизированных клинических испытания (5902 участника). 46 из них (4274 участника) предоставили информацию по одному или нескольким показателям (исходам). Исследования включали людей с первичным билиарным холангитом с наличием или отсутствием симптомов; с наличием или отсутствием антимитохондриальных антител (АМА) (показатель первичного билиарного холангита), независимо от того, проходили ли они ранее лечение или нет. Средний период наблюдения составлял от одного месяца до восьми лет в тех испытаниях, в которых была представлена эта информация.
Финансирование: девять исследований не имели дополнительного финансирования или были финансированы сторонами, не заинтересованными в результатах. Тридцать одно испытание было частично или полностью финансировано фармацевтическими компаниями, которые получили бы пользу (выгоду) от результатов испытаний. В остальных испытаниях не было информации об источнике финансирования.
Качество доказательств
В целом, качество доказательств было очень низким, и во всех испытаниях был высокий риск смещения, означающий возможность неверных выводов, переоценивающих пользу или недооценивающих вред того или иного вида лечения из-за способов проведения испытаний.
Основные результаты
Надежных доказательств снижения смертности при применении какого-либо вмешательства, по сравнению с отсутствием вмешательства, не было. Также не было доказательств снижения серьезных осложнений или осложнений любой тяжести при каком-либо виде лечения, по сравнению с отсутствием лечения. Ни в одном из испытаний не сообщали о связанном со здоровьем качестве жизни (мера удовлетворенности человека своей жизнью и здоровьем) в какой-либо момент времени.
В целом, в настоящее время отсутствуют доказательства пользы какого-либо вмешательства при первичном билиарном холангите. Существует значительная неопределенность в этом вопросе, и необходимы дальнейшие рандомизированные клинические испытания высокого качества.
Первичный билиарный холангит в эпоху урсодезоксихолевой кислоты: достижения и проблемы терапии
Цель обзора: обобщить текущие знания об этиопатогенезе и клинические особенности первичного билиарного холангита (ПБХ), осветить актуальные вопросы диагностики, лечения и стратификации рисков у пациентов с ПБХ.
Основные положения. ПБХ (ранее — первичный билиарный цирроз) — хроническое воспалительное аутоиммунное заболевание, при котором первоначально поражаются холангиоциты междольковых желчных протоков. ПБХ наблюдается в первую очередь у женщин среднего возраста. Без лечения ПБХ обычно прогрессирует до цирроза печени и печеночной недостаточности. Инициация и прогрессирование ПБХ — многофакторный процесс с влиянием на генетический, эпигенетический, иммунологический статус пациента различных факторов окружающей среды. Ранняя диагностика ПБХ значительно улучшилась благодаря выявлению классических серологических маркеров — антимитохондриальных антител. В 1980-х годах ПБХ был ведущим показанием для трансплантации печени.
Урсодезоксихолевая кислота (УДХК) в настоящее время является препаратом первой линии, большинство пациентов с ПБХ на фоне терапии имеют нормальную продолжительность жизни. Однако 1 из 3 пациентов не отвечает на лечение УДХК, поэтому клинически важна оценка биохимического ответа через год от начала терапии.
Заключение. Ранняя диагностика и стратификация пациентов с ПБХ низкого и высокого риска резистентности к терапии УДХК имеют большое клиническое значение для индивидуального подхода к лечению и определения необходимости дополнительной медикаментозной терапии.
Авторы заявляют об отсутствии возможных конфликтов интересов.
Первичный билиарный холангит (ПБХ) — хроническое, медленно прогрессирующее холестатическое заболевание печени аутоиммунной природы, характеризующееся негнойным деструктивным холангитом с поражением в первую очередь внутридольковых и септальных желчных протоков, приводящее при естественном течении к билиарному циррозу печени.
Одним из самых ранних упоминаний о билиарном циррозе принято считать наблюдение итальянского врача и патологоанатома Джованни Морганьи в 1761 г., описавшего плотную зеленую печень при длительно протекавшей многолетней желтухе. В 1851 г. английские врачи T. Аддисон and В. Галл впервые описали 5 случаев болезни, клинически проявлявшейся ксантомами и ксантелазмами, и сделали выводы о причастности печени к развитию заболевания, обозначив синдром как необструктивный билиарный цирроз, позднее он получил название синдрома Аддисона — Галла [1].
В дальнейшем предлагались различные номенклатурные названия, такие как гипертрофический цирроз печени с хронической желтухой [2], подострый холангит [3], интерстициальный хронический гепатит с гипертрофией печени, холангиолитический гепатит и цирроз, ксантоматозный билиарный цирроз [4], перихолангиолитический билиарный цирроз, хронический негнойный деструктивный холангит [5].
Спустя столетие, в 1950 г., был принят к широкому применению термин «первичный билиарный цирроз», предложенный Е.Х. Ареном и соавт. [6].
Уже в 1959 г. Шейла Шерлок выступала против этого термина, поскольку у многих пациентов не было цирроза [7].
К середине 1960-х гг. сформировались теории об участии иммунной системы в развитии заболевания. В дальнейшем серия работ Д. Дониак, Ш. Шерлок и соавт. позволила утвердить идею аутоиммунных реакций как важных звеньев патогенеза; начался поиск специфических антител [8, 9].
В 1967 г. была доказана роль антимитохондриальных антител (АМА) [10], позднее, в 1988 г., выявлены АМА М2, а в 1989 г. — субтипы Е2 [11].
Прогноз выживаемости пациентов значительно улучшился после того, как в 80-х годах прошлого столетия начали применять урсодезоксихолевую кислоту (УДХК). Термин «первичный билиарный цирроз» постоянно подвергался критике в связи с неточностью и неправильным отражением сути, предпринимались попытки его переосмысления [5].
Предложение о смене названия первичного билиарного цирроза на первичный билиарный холангит было одобрено Советом управляющих Европейской ассоциацией по изучению болезней печени в ноябре 2014 г., Советом управляющих Американской ассоциацией по изучению печени в апреле 2015 г. и Советом управляющих Американской гастроэнтерологической ассоциации в июле 2015 г.
РАСПРОСТРАНЕННОСТЬ И ЗАБОЛЕВАЕМОСТЬ
В последние годы отмечается тенденция к увеличению заболеваемости и распространенности ПБХ 14. Вероятно, этот рост вызван повышением точности диагностики, появлением новых методов лабораторного скрининга, формированием больших баз данных благодаря развитости системы здравоохранения некоторых стран и доступности медицинского обслуживания в отдельных регионах.
По данным многочисленных исследований, ПБХ встречается преимущественно среди женщин. Результаты исследований показывают, что по всему миру примерно 1 из 1000 женщин старше 40 лет имеет ПБХ [12]. Соотношение женщин и мужчин варьируется, в среднем оно составляет 10 : 1. Распространенность и заболеваемость ПБХ имеют неравномерное распределение по всему миру. Заболеваемость ПБХ колеблется от 0,33 до 5,8 на 100 000 жителей в год, а коэффициент распространенности варьирует от 1,91 до 40,2 на 100 000 жителей [13]. Среди населения стран Европы средняя заболеваемость ПБХ составляет 1-2 на 100 000 человек в год, в странах Азии более низкие показатели заболеваемости и распространенности, чем в западных странах 16.
Данные по распространенности и заболеваемости ПБХ в Российской Федерации в настоящий момент отсутствуют.
Следует отметить, что эпидемиологические исследования могут представлять собой только верхушку айсберга, поскольку имеются сведения, что АМА-позитивные люди без заболевания печени встречаются в два раза чаще, чем АМА-позитивные с заболеванием печени [16].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ПБХ считается многофакторным заболеванием. В последнее время ведущую роль в возникновении ПБХ отводят взаимодействию генетических и эпигенетических факторов риска с экологическими триггерами, приводящему к иммуноопосредованному повреждению желчных протоков с последующим развитием холестаза, дуктопении. Все это в итоге вызывает фиброз и цирроз печени.
В пользу аутоиммунного генеза ПБХ свидетельствует ряд фактов. Основной комплекс гистосовместимости человека HLA вовлечен в патогенетические механизмы ПБХ, как и при многих других аутоиммунных заболеваниях. Для классических генов HLA наиболее сильная связь выявлена с DRB*08 [17]. Широкомасштабные исследования генома (GWAS) ПБХ находят самую сильную связь с однонуклеотидными полиморфизмами (SNP) в области HLA [18].
ПБХ часто сочетается с другими аутоиммунными заболеваниями, включая синдром Шегрена и хронический тиреоидит [19, 20]; специфические AMA обнаруживаются в сыворотке более 90% пациентов с ПБХ и почти не выявляются у лиц без ПБХ [21, 22]. Кроме того, эпидемиологические данные указывают на увеличение распространенности ПБХ среди родственников первой линии, а также братьев и сестер. Индекс конкордантности у монозиготных близнецов составляет 63% — он один из самых высоких среди таковых у прочих аутоиммунных заболеваний [23]. Наконец, при гистологическом исследовании плотные инфильтраты, состоящие из Т- и В-лимфоцитов, обнаруживаются вблизи пораженных внутрипеченочных желчных протоков [24].
Патогенетические механизмы ПБХ в настоящий момент остаются не полностью изученными. ПБХ является хроническим холестатическим аутоиммунным заболеванием, поражающим эпителиальные клетки внутрипеченочных желчных протоков. Его «визитная карточка» — выявляемые в крови специфичные АМА, а также характерная гистологическая картина поражения желчных протоков [27].
Морфологически ПБХ характеризуется как хронический деструктивный холангит с образованием гранулем в печени, а дегенерация и некроз холангиоцитов вызывают деструктивные изменения и приводят к исчезновению внутрипеченочных желчных протоков малого или среднего размера [28].
AMA представляют собой специфические для данной патологии аутоантитела, обнаруживающиеся среди всех трех классов иммуноглобулинов, синтезирующиеся плазмоцитами, которые могут проходить через эпителий желчных протоков и нарушать митохондриальную функцию холангиоцитов [29]. Это происходит путем повреждения молекул липоевой кислоты, присутствующей на 2-оксокислых дегидрогеназных комплексах, расположенных на внутренней мембране митохондрий [29]. Кроме потери гуморальной толерантности наблюдается повышение уровня аутореактивного кластера дифференцировки: CD4+, CD8+, ПДК-Е2-специфических Т-клеток в печени [29]. Под действием триггерных факторов происходит активация иммунных клеток (включая макрофаги), воздействующих на Т-лимфоциты, которые продуцируют ФНО-α, индуцирующий старение и апоптоз холангиоцитов, а также ИФН-γ, стимулирующий дальнейшее образование цитотоксических Т-лимфоцитов, и ИЛ-4, способствующий активации В-клеток и дальнейшей продукции антител, специфичных для ПДК-Е2.
Одним из возможных патофизиологических механизмов патогенеза ПБХ является гипотеза желчного бикарбонатного (HCO3) зонтика, базирующаяся на данных экспериментальных, клинических и генетических исследований, в основе которой лежит положение о том, что холангиоциты (и гепатоциты) создают защитный апикальный щелочной барьер, стабилизирующий гликокаликс, путем секреции бикарбоната (HCO3) в просвет желчного протока. Этот щелочной барьер сохраняет соли желчных кислот (ЖК) в их полярном, непроницаемом для мембраны состоянии [30, 31].
Желчная секреция при ПБХ нарушается в связи с возникающими дефектами в работе переносчиков и каналов, расположенных на апикальной и базолатеральной мембране холангиоцитов, задействованных в образовании HCO3. Неисправный апикальный бикарбонатный (HCO3)-секреторный аппарат ослабляет щелочной барьер, что приводит к частичному протонированию глицин-конъюгированных (pKa 4) вместо таурин-конъюгированных (pKa 1-2) желчных солей, в результате чего образующиеся глицин-конъюгированные ЖК становятся аполярными и приобретают способность пересекать мембрану холангиоцитов независимо от активности транспортеров солей желчи, тем самым индуцируя апоптоз в холангиоцитах [32].
Разрушающиеся клетки желчных протоков секретируют медиаторы, воздействующие на синусоидальные клетки, среди которых выделяют клетки Ито (звездчатые) — основные клетки, синтезирующие экстрацеллюлярный матрикс в поврежденной печени [33]. В здоровой ткани печени звездчатые клетки находятся в пространстве Диссе и являются основным депо витамина А, участвуют в регуляции фиброгенеза. В результате прогрессирующего хронического повреждения клетки Ито активируются, дифференцируются в миофибробластоподобные клетки, приобретая сократительные, провоспалительные и профибротические свойства [34]. В последующем это приводит к нарушению взаимодействия фибротических и антифибротических механизмов, избыточному синтезу экстрацеллюлярного матрикса и формированию фиброза печени.
ДИАГНОСТИКА ПЕРВИЧНОГО БИЛИАРНОГО ХОЛАНГИТА
Диагноз основан на сочетании клинических симптомов, биохимической картины холестаза, сохраняющейся более шести месяцев, и наличии в сыворотке АМА. Ряд антинуклеарных антител (ANA) связаны с ПБХ, из них специфичны для заболевания gp210, sp100, которые необходимо определять в случае отрицательных АМА. Всем пациентам с холестазом и отрицательными АМА следует проводить магнитно-резонансную холангиопанкреатографию. Биопсия печени должна выполняться, когда описанные выше диагностические мероприятия не выявили причину хронического внутрипеченочного холестаза. Биопсия адекватного качества должна содержать не менее 11 портальных полей [14, 34, 35]. Диагноз ПБХ может быть установлен, когда имеются два из следующих трех критериев:
биохимические данные холестаза, а именно повышение уровня щелочной фосфатазы (ЩФ);
наличие AMA- или ANA-специфических антител (sp100, gp210);
гистологические признаки невоспалительного деструктивного холангита и разрушения междольковых желчных протоков (уровень доказательства III, сила рекомендаций 1) [14, 34, 35].
ПБХ следует подозревать у всех пациентов с персистирующим синдромом холестаза и такими симптомами, как кожный зуд и усталость ( табл. 1 ).
Рекомендации Европейской ассоциации по изучению болезней печени (2017) по диагностике первичного билиарного холангита [14]
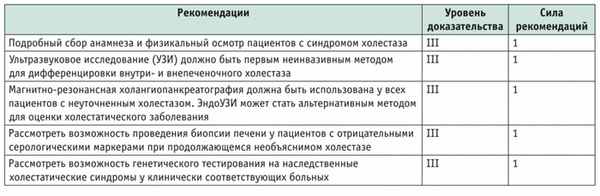
И еще немаловажное положение: наличие изолированного повышения титра АМА недостаточно для диагностики ПБХ. Европейская ассоциация по изучению болезней печени рекомендует пациентам с нормальными биохимическими показателями цитолиза и холестаза и позитивными AMA ежегодное наблюдение с биохимической оценкой (уровень доказательства III, сила рекомендаций 1).
Более 60% больных при постановке диагноза не имеют клинических проявлений заболевания. Типичные проявления ПБХ:
Первичный билиарный цирроз
Первичный билиарный цирроз (ПБЦ) — хроническое, предположительно аутоиммунное заболевание, при котором нарушены процессы иммунной регуляции, и внутрипеченочные желчные протоки постепенно разрушаются иммунной системой человека как чужеродные антигены.
Термин «первичный билиарный цирроз» не совсем точен, так как на ранних стадиях заболевания цирроза еще нет. Более правильно название «хронический негнойный деструктивный холангит».
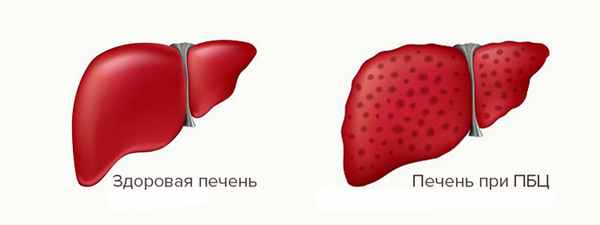
Стадии ПБЦ
Первичный билиарный цирроз развивается медленно.
Воспаление начинается в мелких желчных протоках, разрушение которых блокирует нормальный отток желчи в кишечник — в медицинской терминологии этот процесс называют холестаз (при этом в анализах крови повышаются такие показатели как щелочная фосфатаза и ГГТП).
Холестаз
Холестаз — один из важных аспектов первичного билиарного цирроза.
При продолжающемся разрушении желчных протоков воспаление распространяется на близлежащие клетки печени (гепатоциты) и приводит к их гибели (некрозу). В анализах крови при этом выявляют синдром цитолиза (повышение АЛТ и АСТ). При продолжающейся гибели печеночных клеток происходит замещение их соединительной тканью (развитие фиброза).
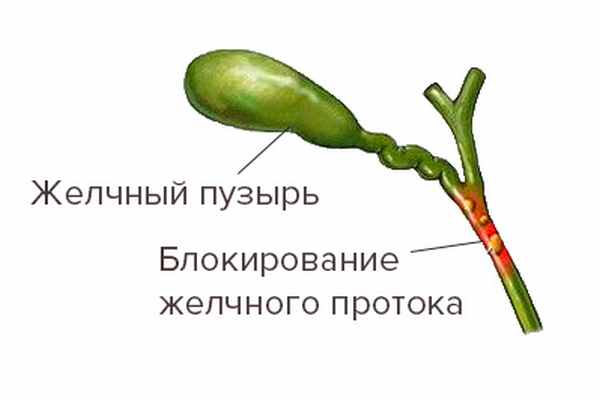
Совокупное воздействие (прогрессирующее воспаление, снижение количества функционирующих печеночных клеток, наличие фиброза и токсичность желчных кислот, накапливающихся внутри печени) достигает кульминации с исходом в цирроз печени.
Цирроз
Цирроз печени - это стадия заболевания, при которой замещается ткань печени фиброзом и образуются узлы (рубцы). Формирование цирроза происходит только в поздней стадии ПБЦ.
Группы риска
Заболевание встречается по всему миру. Распространенность колеблется в широких пределах 19-240 больных на 1 млн населения. Наиболее высокие показатели в странах Северной Европы. Возраст пациентов к началу заболевания от 20 до 90 лет (в среднем 45-50 лет).
Имеются многочисленные свидетельства роли иммунных и генетических факторов в развитии ПБЦ.
- Доля женщин среди больных с ПБЦ составляет 90%.
- Выявление у 95-98 % больных с ПБЦ антимитохондриальных антител (АМА) — в том числе высокоспецифичных для ПБЦ АМА-М2.
- ПБЦ в 50% случаев ассоциирован с другими аутоиммунными синдромами.
- Высокая конкордантность (наличие определенного признака у обоих) по ПБЦ у однояйцевых близнецов.
Но к настоящему времени значимых ассоциаций между первичным билиарным циррозом и определенными генами выявить не удалось. Так же первичный билиарный цирроз обладает некоторыми особенностями, нехарактерными для аутоиммунных заболеваний: встречается только во взрослом возрасте и плохо отвечает на иммуносупрессивную терапию.
Симптомы ПБЦ
На начальных стадиях заболевания (в доклинической стадии, часто при «случайном» выявлении изменений в анализах) при первичном билиарном циррозе человека может ничего не беспокоить.
Но при развитии клинической картины, все проявления ПБЦ можно разделить на три группы:
1. Симптомы, обусловленные собственно первичным билиарным циррозом.
2. Осложнения цирроза печени.
1. Проявления сопутствующих аутоиммунных синдромов
Инфекция мочевыводящей системы
Наиболее распространенным симптомом ПБЦ является усталость (повышенная утомляемость), которая возникает у 70% больных. Следует отметить, что значительная усталость может быть причиной нарушения сна или депрессивного состояния.
Часто такие пациенты в первой половине дня чувствуют себя хорошо, но отмечают «упадок сил» уже в послеобеденное время, что требует отдыха или даже сна. Большинство людей с ПБЦ отмечают, что сон не придает им сил.
Заболевание начинается внезапно, чаще всего с зуда кожи на ладонях рук и подошвах ног, не сопровождающегося желтухой. Позже он может распространиться на все тело. Интенсивность кожного зуда может усиливаться ночью и уменьшаться в течение дня. Ночной зуд часто нарушает сон и приводит к усилению усталости. Причина развития зуда на сегодняшний день остается неясной.
Люди, страдающие от первичного билиарного цирроза (особенно при наличии желтухи), могут испытывать боли в спине (часто в грудном или поясничном отделе позвоночника), по ходу ребер. Эта боль может быть обусловлена развитием одного из двух метаболических заболеваний костей - остеопороза (иногда именуемого «истончением» костей) или остеомаляции («размягчение» кости). Причиной развития поражения костей в случае ПБЦ является длительный хронический холестаз.
Примерно у 25% больных ПБЦ на момент постановки диагноза выявляют ксантомы. Появлению ксантом предшествует длительное (более 3 месяцев) повышение уровня холестерина в крови более 11.7 мкмоль/л.
Разновидность ксантом — ксантелазмы — плоские или слегка возвышающиеся мягкие безболезненный образования желтого цвета, обычно располагающиеся вокруг глаз. Но ксантомы могут так же наблюдаться в ладонных складках, под молочными железами, на шее груди или спине. Они исчезают при разрешении (исчезновении) холестаза и нормализации уровня холестерина, а так же при развитии конечной стадии заболевания (печеночной недостаточности) в связи с нарушением синтеза холестерина в поврежденной печени.
Так же при хроническом холестазе ПБЦ (в связи с нарушенным выделением желчи) развивается нарушение всасывания жиров и жирорастворимых витаминов (A, D, Е и К), что может привести к диарее, потере веса и недостатку данных витаминов.
Дефицит витамина А вызывает снижение зрения в темноте. Дефицит витамина Е может проявляться неприятными ощущениями на коже или мышечной слабостью. Дефицит витамина D способствует прогрессированию костных изменений (остеомаляции, остеопороза). Дефицит витамина К приводит к снижению синтеза печенью белков свертывающей системы и, следовательно, к склонности к кровотечениям.
Желтуха, как правило, первый «заметный» признак болезни - пожелтение белков глаз и кожи. Она отражает повышение уровня билирубина в крови. Легкий оттенок желтушности можно обнаружить только при солнечном свете, а не при искусственном освещении.
Хроническое нарушение оттока желчи повышает синтез темного пигмента - меланина, который содержится в коже. Потемнение кожи называется гиперпигментация. Она может выглядеть как загар кожи, но выявляется даже на закрытых участках тела. Кроме того, при зуде и на месте «хронических» царапин более выражена пигментация, что придает коже пестрый вид
Диагностика ПБЦ
- Общеклинические анализы крови - оценка работы печени, напряженности иммунитета, а так же определение показаний к лечению.
- Исключение других заболеваний печени, протекающих с хроническим холестазом — в том числе инструментальными методами (УЗИ, МРХПГ, эндоскопическая ультрасонография и т.д.).
- Анализ крови на аутоантитела (АМА и другие).
- Фибротест — анализ крови, назначающийся при подозрении на билиарный цирроз, позволяющий оценить степень воспалительных и фибротических изменений в ткани печени.
- Инструментальные методы диагностики (УЗИ органов брюшной полости, ФГДС и т.д.) - для оценки состояния гепатобилиарной системы и выявления возможных осложнений (в том числе признаков цирроза).
- При необходимости - биопсия печени с гистологическим исследованием —для исключения синдромов перекреста с другими заболеваниями печени, подтверждения диагноза, определения стадии заболевания и степени повреждения печени (в том числе наличие цирроза).
При отсутствии типичных для первичного билиарного цирроза аутоантител (АМА), наличии типичной клинической сипмтоматики и типичных для первичного билиарного цирроза изменений печени по данным биопсии — диагностируют АМА-негативный ПБЦ или так называемый Аутоиммунный холангит.
Лечение
- Урсодезоксихолевая кислота (УДХК) – доказанное эффективное лечение ПБЦ. При отсутствии ответа на УДХК к терапии добавляют иммуносупрессоры.
- Для уменьшения кожного зуда пациентам рекомендуется не носить синтетическую одежду (используйте хлопок, лен), избегать горячих ванн и перегревания, всегда держать ногти коротко остриженными. Можно использовать прохладные ванны с содой (чайная чашка на ванну) по горло 20 минут, ножные ванны с содой. Из препаратов, способных уменьшит зуд, используют холестирамин, рифампицин, при их неэффективности - пероральные антагонисты опиатов и сертралин. Так же в ряде случаев положительный эффект на зуд может оказать плазмаферез.
- Профилактика дефицита жирорастворимых витаминов заключается в полноценном питании и компенсации стеатореи (потери жира с калом) ферментативными препаратами.
- С целью профилактики развития остеопороза врач может назначить препараты, содержащие кальций и витамин D.
- Трансплантация печени остается единственным методом лечения при декомпенсации цирроза, при инвалидизирующем зуде и выраженном остеопорозе - 10-летняя выживаемость при ПБЦ после трансплантации составляет около 70 %.
Прогноз
Течение первичного билиарного цирроза при отсутствии симптомов непредсказуемо, в отдельных случаях симптомы не развиваются вообще, в других отмечается прогрессирующее ухудшение с развитием цирротической стадии. Часто причиной смерти при циррозе является кровотечение из варикозно-расширенных вен пищевода и желудка.
А в терминальной стадии пациенты погибают от развития печеночной недостаточности.
Исходом хронического холестаза и воспаления в печени, является цирроз печени.
При условии эффективности и соблюдения лечения большинство людей с первичным билиарным циррозом имеют нормальную продолжительность жизни.
Читайте также:
