Пневмоцистоз. Возбудитель пневмоцистоза.
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
ВПС — врожденный порок сердца
ЛЖ — левый желудочек
НРИФ — непрямая реакция иммунофлюоресценции
ООО — открытое овальное окно
ОАП — открытый артериальный проток
ПЦП — пневмоцистная пневмония
Пневмоцистоз — оппортунистическая инфекция, в настоящее время наиболее часто диагностируемая у больных ВИЧ-инфекцией и у лиц с другими иммунодефицитными состояниями. До «эры СПИДа» она была актуальна в послевоенные годы, когда пневмоцистную пневмонию (ПЦП) часто выявляли у ослабленных и недоношенных детей, а также в 60—70-е годы прошлого века, когда ряд отечественных и зарубежных специалистов изучали внутрибольничные вспышки пневмоцистоза. Передача возбудителя осуществляется воздушно-капельным путем, но в ряде источников указывается и на возможность его трансплацентарной передачи. Несмотря на все большее число публикаций, посвященных проблеме пневмоцистоза в педиатрии, эта болезнь остается малознакомой врачам. Представляем собственное наблюдение семейной вспышки пневмоцистоза с доказательствами внутриутробного заражения.
18 октября 2014 г. в реанимационное отделение Морозовской детской больницы бригадой скорой помощи госпитализирован мальчик Д. в возрасте 1 мес 3 нед в тяжелом состоянии. При осмотре ребенок был в сознании, температура тела 37,5 °С, выраженная бледность, мраморность и желтушность кожи; симптом рекапилляризации 5—7 с. Большой родничок 1,5×1,5 см не напряжен. Дыхание самостоятельное с подачей увлажненного кислорода через носовую канюлю, кислородная зависимость. Выраженная одышка с втяжением уступчивых мест грудной клетки. Частота дыханий 65 в минуту. Перкуторно определяется легочной звук, с притуплением на верхушке правого легкого; аускультативно дыхание жесткое, крепитирующие хрипы сзади справа. Тоны сердца ритмичные, громкие, грубый систолический шум на верхушке, проводится во все отделы сердца. Пульс 150 уд/мин, артериальное давление 78/55 мм рт.ст. Живот мягкий, печень выступает из-под реберной дуги на 2 см. Стул на момент осмотра желто-коричневый, кашицеобразный. Очаговые и менингеальные симптомы отсутствуют. Зрачки узкие, реакция на свет вялая. Со слов родителей, ребенок заболел утром, когда его положили на живот, он начал кричать, кашлять, стал «тяжело дышать», побледнел, срыгнул створоженным молоком. На машине скорой медицинской помощи госпитализирован.
Ребенок состоит на учете у невролога и кардиолога с диагнозом врожденного порока сердца (ВПС): открытое овальное окно (ООО) 3 мм, открытый артериальный проток (ОАП). С 29.09.014 по 8.10.14 ребенка лечили в стационаре дневного пребывания с диагнозом: конъюгационная желтуха. Дискинезия желчевыводящих путей по гипомоторному типу. Железодефицитная анемия легкой степени. Родители ребенка — молодая супружеская пара (возраст до 30 лет). Ребенок от 1-й беременности. Мать получала антибактериальную терапию на 30-й и 32-й неделях беременности по поводу бессимптомной бактериурии. Роды на 41-й неделе оперативные в связи со слабой сердечной деятельностью плода и подозрением на ВПС. Масса тела при рождении 3 кг 310 г, рост 51 см, оценка по шкале Апгар 8/8 баллов.
Описание рентгенологической картины при поступлении: в верхних отделах обоих легочных полей выявлены неоднородные затемнения в прикорневых отделах. Справа на фоне тени нижнего угла лопатки нельзя исключить формирование очага инфильтрации. Легочный рисунок в паракордиальных отделах правого легочного поля деформирован по крупнопетлистому типу с признаками локального вздутия легочной паренхимы — буллы? Бронхолегочная дисплазия? (рис. 1). В крови гемоглобин 105 г/л, лейкоциты 10,9·10 9 /л; п.я. 8%, с.я. 29%, лимф. 55%; СОЭ 25 мм/ч; в биохимическом анализе отмечена гипербилирубинемия за счет непрямой фракции; уровень прокальцитонина выше 10 нг/мл (норма 0—0,5 нг/мл). КЩС от 18.12: рH 7,27, рСО2 41,3 мм рт.ст., рО2 53,5 мм рт.ст., т. е. имелся респираторный ацидоз.
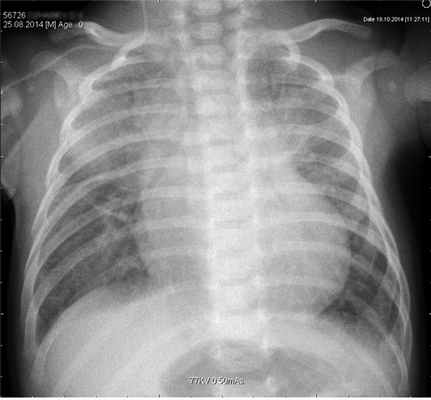
Рис. 1.РентгенограммаоргановгруднойклеткиребенкаД.
С учетом данных осмотра, анамнеза и результатов лабораторного обследования установлен предварительный диагноз: правосторонняя верхнедолевая аспирационная пневмония. Дыхательная недостаточность II степени. Последствия перенесенной перинатальной гипоксии центральной нервной системы. ВПС: ООО 3 мм, ОАП. Недостаточность кровообращения 2А степени. Гиперволемия малого круга кровообращения. Гипербилирубинемия. Тяжесть состояния обусловлена дыхательной недостаточностью II степени, недостаточностью кровообращения 2А степени, которая обусловлена пневмонией и ВПС. Назначены: антибактериальная терапия (меропинем); пентаглобин; инфузионная терапия, кардиотонические средства, гемотрансфузия (эритроцитная масса, свежезамороженная плазма); увлажненный кислород.
При обследовании маркеры вируса простого герпеса 1, 2 и 6-го типов, цитомегаловирусной инфекции, микоплазменной пневмонии, ВИЧ-инфекции не обнаружены. Данные электрокардиографии: синусовая тахикардия. Нормальное положение электрической оси сердца. Перегрузка обоих предсердий и левого желудочка (ЛЖ) с нарушением кровообращения в нем. Неполная блокада правой ножки пучка Гиса; эхокардиография: критическая суб- или юкстрадуктальная коарктация с диаметром перешейка до 2 мм и пиковым градиентом давления до 104 мм рт.ст., резидуальный артериальный проток диаметром до 2 мм со слабовыраженным левоправым сбросом. Значительная левая кардиомегалия (конечный диастолический размер ЛЖ до 30 мм, левое предсердие диаметром до 28 мм). Смешанная легочная гипертония с умеренно выраженной артериальной гипертонией (расчетное давление 55—60/20 при норме до 30/10 мм рт.ст.) и, по-видимому, со значительной венозной легочной гипертонией (выраженная левая кардиомегалия). Патологической сепарации перикарда нет. ОАП диаметром менее 2 мм. ООО до 3 мм.
19 октября состояние ребенка оставалось тяжелым, а 20 октября ухудшилось, температура тела повысилась до 39 °C, усилилась одышка, отмечено развитие метаболического лактоацидоза (рН 7,0, лактат 11,8 ммоль/л). На фоне нарастания признаков дыхательной недостаточности и нарушения кровообращения произведена интубация, начата искусственная вентиляция легких. Несмотря на проводимые интенсивные мероприятия, ребенок умер.
В аутопсийном материале легких обнаружены свойственные ПЦП выраженные очаговые ателектазы и гиалиновые мембраны, а также ДНК Pneumocystis jiroveci. Патолого-анатомический диагноз: ПЦП. Фоновое заболевание: врожденный порок развития аорты — постдуктальная коартация аорты (Q25.1) с резидуальным артериальным протоком диаметром 2,0 мм; фиброэластоз эндокарда ЛЖ и левого предсердия сердца, гипертрофия миокарда ЛЖ сердца. Осложнения: венозное полнокровие внутренних органов. Петехиальные субарахноидальные, субэпикардиальные, субплевральные кровоизлияния. Двусторонний гидроторакс. Отек и набухание вещества головного мозга.
Патологоанатомы высказали предположение о врожденном происхождении ПЦП. Возраст ребенка (1 мес 3 нед) свидетельствовал скорее о прижизненном заражении, так как внутриутробное инфицирование обычно проявляется в первые дни жизни. Для решения вопроса о времени заражения и способах передачи инфекции у этого ребенка, мы провели исследование аутопсийного материала и плаценты, а также обследовали родителей мальчика для выявления специфических маркеров пневмоцистоза. Использовали иммунологические методы, выявляющие специфические антитела классов IgM и IgG с помощью иммуноферментного анализа (набор реагентов ПневмоцистоСтрип) и непрямой реакции иммунофлюоресценции (НРИФ) для выявления различных форм P. jiroveci (набор ПневмоцистоФлюоАГдиагностика); оба набора реагентов выпускает «МЕДГАМАЛ» филиал ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи Минздрава России. При исследовании аутопсийного материала (легкие, селезенка, печень, головной мозг, кости, сердце, почка, толстая кишка, тонкая кишка, поджелудочная железа, околоушная слюнная железа, надпочечники) пневмоцисты обнаружены во всех тканях (см. рис. 2). Все стадии развития P. jiroveciобнаружены и в плаценте (см. рис. 3). Таким образом, диагностирован внутриутробный пневмоцистоз, протекавший как генерализованный процесс с поражением практически всех органов.
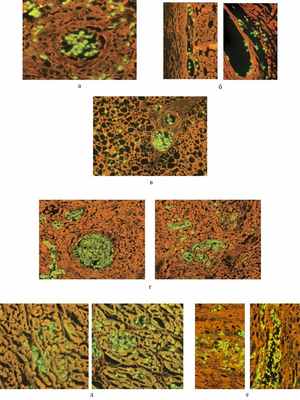
Рис. 2. Пневмоцисты в аутопсийном материале. а — костная ткань; б — легкие; в — надпочечник; г — слюнная железа; д — миокард; е — почка (метод НРИФ, с использованием конъюгата, окрашенного ФИТЦ; ув. 400).
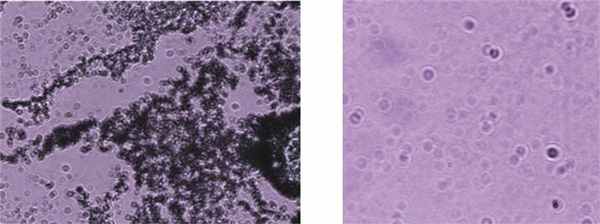
Рис. 3. Ткань плаценты (прецисты и трофозоиты P. jiroveci). Окраска по Романовскому—Гимзе, ув. 1000.
У родителей ребенка в сыворотке крови обнаружены специфические антитела к P. jiroveci(рис. 4). У матери выявлены антитела класса IgM в титре 1:2650, которые при динамическом исследовании снизились до 1:1320 и в дальнейшем до 1:370; при этом антитела класса IgG не выявлены. У отца антитела IgM в незначительном титре (1:210) определены в начале исследования и позже исчезли, в то же время зафиксированы в диагностическом титре IgG, которые через 18 дней снизились до 1:400 и позже (через 2 нед) не определялись. Эти результаты свидетельствуют о затухании инфекционного процесса у отца ребенка и позволяют предположить, что он был источником инфекции для жены, вероятно, во второй половине беременности, и заражение плода произошло трансплацентарно.
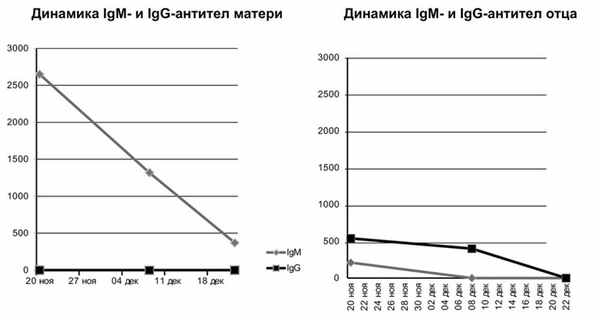
Рис. 4.Результатыобследованияматери (а) иотца (б) ребенкадлявыявленияспецифических маркеров пневмоцистоза.
Таким образом, обнаружение пневмоцист в плаценте и аутопсийном материале умершего ребенка, высокие титры антител класса IgM к P. jiroveci у матери подтверждают диагноз врожденного пневмоцистоза, который протекал в виде генерализованного процесса и не был при жизни распознан клиницистами. При этом основное проявление болезни — дыхательная недостаточность расценена как результат аспирационной пневмонии на фоне ВПС.
Пневмоцистоз
Пневмоцистоз – широко распространенная оппортунистическая инфекция, вызываемая внеклеточным паразитическим дрожжеподобным грибом Pneumocystis jirovecii (старое название – Pneumocystis carinii, Pneumocystis carinii forma especialis Spanish hominis). P.jirovecii (carinii), обладает выраженным тропизмом к легочной ткани, поражая при этом пневмоциты первого и второго порядков. Цикл развития представлен двумя фазами: половой и бесполой. Различают три основные морфологические формы P.jirovecii (carinii): трофозоит, циста, спорозоит.
Инкубационный период заболевания составляет от 8–10 дней до 2–5 недель, в ряде случаев определить его невозможно, т.к. при иммунодефицитных состояниях оно развивается при реактивации латентной инфекции (человек может быть заражен еще в раннем детстве). Инфекция, вызванная Р.jirovecii, при дефиците гуморального и клеточного иммунитета характеризуется манифестным течением. Рецидивы пневмоцистной пневмонии отмечаются у 10% детей и взрослых с иммунодефицитами, при СПИДе – у 25–30% при отсутствии вторичной профилактики. Пневмоцистоз – ведущая опппортунистическая инфекция. Пневмоцистная пневмония является частым осложнением у больных гемобластозами (49,0%), реже у больных солидными опухолями (4,0%). Применение иммуносупрессивной терапии у реципиентов при трансплантации органов также может привести к развитию пневмоцитоза.
У здоровых людей пневмоцистоз – достаточно редкое заболевание. У детей раннего возраста болезнь протекает как классическая интерстициальная пневмония с четким соответствием стадиям патологического процесса. Пневмоцистоз у детей может протекать также под маской острого ларингита, обструктивного бронхита или бронхиолита. На фоне грубого нарушения клеточного иммунитета пневмоцистоз может проявляться не только поражением легких, но и надпочечников, щитовидной железы, печени, селезенки, ЖКТ, сердца, кожи, а также могут развиться отиты, мастоидиты и гаймориты пневмоцистной этиологии.
Патогномоничных симптомов при пневмоцистной пневмонии нет, но триада клинических симптомов – сухой кашель, субфебрильная температура и постепенно нарастающая одышка при физической нагрузке – характерна особенно при развитии болезни у ослабленных детей. У детей до года заболевание может протекать не только как интерстициальная пневмония, но и в виде ларингита, обструктивного бронхита или бронхиолита, у детей старше года – как астматический бронхит. При развитии отека легких возможен летальный исход заболевания в результате острой дыхательной недостаточности, связанной с резким нарушением вентиляции легких и газообмена. При длительном рецидивирующем течении (при неадекватной терапии) у больных с выраженным иммунодефицитным состоянием возможно развитие полостей в легких. Любые диагностические и лечебные манипуляции в разгар болезни (получение индуцированной мокроты, бронхоскопия, установка подключичного катетера и пр.) и даже изменение положения тела больного могут привести к спонтанному пневмотораксу. Никогда не бывает плеврита (за исключением сочетания пневмоцистоза с туберкулезным процессом). В большинстве случаев при пневмоцистозе рентгенологическая картина не имеет характерных особенностей и характеризуется как двустороннее симметричное поражение интерстиция легких (описана как «завуалированные», «ватные» легкие»). Достаточно часто у больных ВИЧ-инфекцией при физикальном и рентгенологическом обследовании не выявляют никаких изменений, несмотря на прогрессирующую легочную недостаточность.
Показания к обследованию. Наличие выраженной легочной патологии у лиц следующих категорий:
- пациенты с иммунодефицитом различной природы;
- дети: недоношенные, ослабленные новорожденные, раннего возраста с гипогаммаглобулинемией, гипотрофией и рахитом;
- дети из домов ребенка;
- пожилые люди из домов престарелых;
- больные лейкозом, онкологические больные, реципиенты органов, получающие иммунодепрессанты;
- больные туберкулезом;
- больные ЦМВИ;
- больные ВИЧ-инфекцией на поздних стадиях болезни, имеющие признаки дыхательной недостаточности;
- больные, длительно получающие стероидную терапию;
- пациенты с лучевой болезнью.
Дифференциальная диагностика. В случае интерстециальных изменений в легких: туберкулез, микоплазменная инфекция, ЦМВИ, токсоплазмоз, гистоплазмоз, криптоспоридиоз (с поражением легких), фиброзирующий альвеолит.
Материал для исследования
- Мокрота, индуцированная мокрота, БАЛ, биоптаты легочной ткани, аспираты из трахеи, смывы и мазки из ротоглотки – микроскопические исследования, выявление ДНК, выявление АГ;
- сыворотка крови – определение АТ.
Этиологическая лабораторная диагностика включает визуальное выявление возбудителя при использовании микроскопии, обнаружение его АГ или ДНК, определение специфических АТ к P.jirovecii (carinii).
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований и интерпретация их результатов. Наиболее часто используемым в рутинной лабораторной диагностике пневмоцистной пневмонии является микроскопическое исследование окрашенных мазков, мазков-отпечатков препаратов различного биологического материала: мокрота, индуцированная мокрота, БАЛ, биоптаты, у детей раннего возраста – аспираты из трахеи, смывы и мазки из ротоглотки. Выбор метода окрашивания и типа исследуемого биологического материала во многом влияет на достоверность результатов анализа.
При окрашивании соответствующих препаратов с целью выявления P.jirovecii (carinii) используют классические методы, подразделяемые на две группы. Первая группа методов позволяет дифференцировать внутреннюю структуру клетки без окрашивания оболочки (окраска по Романовскому, по Граму и др.). Такое окрашивание предназначено для проведения скринингового исследования, требующего дополнительной верификации. При использовании второй группы методов (импрегнация метенамин-серебряным нитратом по Гомори, окраска толуидиновым синим и др.) визуализируется клеточная стенка возбудителя без определения внутренней структуры. Наиболее универсальным способом окрашивания препаратов биологического материала, позволяющим выявлять все морфологические формы пневмоцист, является окраска по Романовскому–Гимзе.
Диагностическая чувствительность микроскопического исследования индуцированной мокроты составляет (в зависимости от способа окрашивания) 80–90%. К несомненным достоинствам процедуры получения образца относятся: отсутствие необходимости проведения инвазивных медицинских манипуляций, легкость выполнения и низкая себестоимость. Однако при выборе данного вида биологического материала следует учитывать, что эффективность выявления P.jirovecii (carinii) в индуцированной мокроте у больных, неинфицированных ВИЧ, значительнее ниже, чем у пациентов с ВИЧ–инфекцией. При отрицательном результате тестирования препаратов индуцированной мокроты рекомендуют исследование БАЛ, диагностическая чувствительность возрастает при исследовании двустороннего БАЛ по сравнению с односторонним. Комплексное исследование трансбронхиального биоптата и БАЛ позволяет обнаружить пневмоцисты практически в 100% случаев. При исследовании трансбронхиального биоптата (содержащего не менее 25 неповрежденных альвеол), полученного при проведении фибробронхоскопии, диагностическая чувствительность составляет 66–98%. У пациентов, которым противопоказано проведение трансбронхиальной биопсии при прогрессирующем течении заболевания, возможно получение исследуемого материала с помощью чрезкожной интраторакальной аспирации. Метод открытой биопсии легкого дает наилучшие (100%) результаты, но применяется в крайне редких случаях, когда невозможно установить диагноз другим способом.
Выявление АГ P.jirovecii (carinii) с использованием метода РИФ (РНИФ) проводят в мазках различного биологического материала: мокрота, индуцированная мокрота, БАЛ, биоптаты; у детей раннего возраста – аспираты из ротоглотки и трахеи, смывы и мазки из ротоглотки.
Диагностическая чувствительность выявления ДНК P.jirovecii (carinii) методом ПЦР при исследовании образцов индуцированной мокроты у пациентов с лабораторно подтвержденной пневмоцистной пневмонией составляет 100%. Однако обнаружение ДНК возбудителя в мокроте и даже в БАЛ не является однозначным доказательством болезни, а может свидетельствовать о носительстве. Наиболее перспективным при диагностике пневмоцистоза представляется определение концентрации ДНК P.jirovecii (carinii) в образцах мокроты, индуцированной мокроты, БАЛ, биоптатах, аспиратах из трахеи, смывах и мазках из ротоглотки.
Выявление специфических АТ IgG и IgM к P.jirovecii (carinii) в крови играет значительную роль в диагностике пневмоцистоза, особенно при эпидемиологических исследованиях, оценке течения латентной инфекции или невозможности проведения лабораторных исследований других видов биологического материала. Для определения АТ IgG и IgM к P.jirovecii (carinii) используют методы РНИФ и ИФА. Определение АТ необходимо проводить в динамике, для исследования отбирают образцы крови, взятые с интервалом 14 дней. У больных с иммунодефицитами определение АТ не информативно.
Особенности интерпретации результатов лабораторных исследований. Результаты лабораторных исследований должны быть сопоставлены с клиническими данными. При выраженных клинических проявлениях легочной патологии обнаружение P.jirovecii (carinii) ее АГ или ДНК в биологическом материале из респираторного тракта (БАЛ, мокрота, индуцированная мокрота, аспират трахеи, биоптаты легочной ткани) является лабораторным подтверждением диагноза “пневмоцистоз”.
Выявление 4-х кратного нарастания титра/уровня АТ IgG и/или выявление АТ IgM к Pneumocysti sjiroveci говорит об остром инфекционном процессе, вызванном этим возбудителем. Обнаружение только АТ IgG без увеличения уровня во втором образце указывает на наличие анамнестических АТ. Следует учитывать, что АТ IgG к АГ пневмоцисты среди здорового населения выявляют в 60–80%.
30.6. Возбудитель пневмоцистоза
Возбудителем пневмоцистоза является гриб Pneumocystis carinii. Этот вид относится к порядку Pneumocystidales отдела Ascomycota. Ранее его относили к простейшим.
Экология и эпидемиология. Заболевание распространено повсеместно. В развитых странах инфицирована большая часть взрослого населения, а сероконверсия (появление антител к P. carinii) происходит, в среднем, в возрасте не старше 4 лет. Механизм заражения респираторный, возможна передача от человека к человеку. В этом случае источником инфекции является больной пневмоцистной пневмонией. Помимо человека, P. carinii выявляется у разных млекопитающих, прежде всего – крыс и мышей, а также других грызунов, разных домашних животных и мелкого рогатого скота. Тем не менее, природный источник и возможный резервуар инфекции до сих пор не установлен.
Морфология и физиология. Морфологические описания P. carinii сохранили терминологию того периода, когда этот микроорганизм относили к простейшим. Выделяют 3 основные стадии жизненного цикла P. carinii: трофическую, прецистную и цистную. В трофической форме возбудитель имеет наименьший размер (1,5–5,0 мкм), окружен двухслойной оболочкой. Самые маленькие по размеру трофические формы (трофозоиты), по-видимому, представляют собой споры, высвобождающиеся из цист. Более крупные трофозоиты являются вегетативной формой P. carinii. Они имеют овальную форму, крупное ядро, больше внутриклеточных включений и так называемые «трубчатые расширения» на поверхности – волокна, предположительно служащие для адгезии.
Прецистная стадия, или спороцит, считается промежуточным звеном полового цикла развития P. carinii перед образованием цисты. После образования зиготы и мейоза образовавшиеся 4 ядра дополнительно делятся пополам. В этой стадии спороцит окружен трехслойной оболочкой, имеет округлую форму, внутри его начинается процесс образования спор.
Стадия цисты завершает процесс спорообразования. Цисты P. carinii округлые, окружены трехслойной оболочкой, имеют размер от 5 до 8 мкм. Внутри цисты находится 8 спор, каждая из которых окружена двухслойной оболочкой.
Патогенез и иммунитет. Жизненный цикл возбудителя в легких при пневмоцистной пневмонии включает бесполую стадию в виде гаплоидных вегетативных трофических форм, и заканчивается образованием цист. Считается, что инфекционной частицей при пневмоцистозе являются споры P. carinii, в связи с их наименьшим размером, необходимым для проникновения в мелкие бронхи и альвеолы. Для прикрепления к клеткам альвеолярного эпителия P. carinii (в частности, для связи с фибронектином и маннозосвязывающими рецепторами) использует волокна своей внешней оболочки.
Основным звеном иммунитета при защите от пневмоцистоза является клеточный. Этим обусловлен тот факт, что пневмоцистоз развивается на фоне ВИЧ-инфекции и является СПИД-индикаторным заболеванием. Кроме того, заболевание развивается на фоне ятрогенной иммуносупрессии при химиотерапии опухолей и трансплантации, при гипогаммаглобулинемии. При пневмоцистозе образуются антитела классов G, M и А к ряду антигенов P. carinii, однако их защитное значение и роль в патогенезе представляются неясными.
Основным проявлением пневмоцистоза является интерстициальная пневмония, на фоне иммунодефицита быстро приводящая к дыхательной недостаточности. При СПИД наблюдаются и внелегочные формы с поражением лимфатических узлов, селезенки, печени, желез внутренней секреции и многих других внутренних органов.
Лабораторная диагностика. Возбудитель обнаруживается в мокроте при достаточном ее количестве, в промывной жидкости бронхов, биопсийном материале. Препараты окрашивают по Романовскому-Гимза или серебрением по Гроккоту-Гомори, что позволяет выявить оболочку цисты гриба. Для обнаружения возбудителя в патологическом материале разработана методика прямой иммунофлюоресценции с моноклональными антителами против поверхностных антигенов цистной и трофической форм P. carinii. Культивировать возбудителя до настоящего времени не удается. Методика ПЦР находится в стадии разработки.
Иммунологическая диагностика. В связи с распространенностью возбудителя и частой инфицированностью населения серологическая диагностика при пневмоцистозе малоэффективна. Кроме того, больные пневмоцистозом на фоне иммунодефицита отличаются пониженным антителообразованием. Для серодиагностики применяются иммуноферментная методика и иммуноблотинг.
Профилактика и лечение. Специфическая профилактика пневмоцистоза не разработана. В лечении наиболее широко используются пентамидин и комбинация триметоприма и сульфаметоксазола (котримоксазол, бактрим, бисептол).
Пневмоцистоз, особенности, диагностика
Под пневмоцистозом понимают оппортунистическую инвазию, обусловленную возбудителем грибковой природы, способным вызывать бронхо-легочную патологию, в том числе и пневмонию у иммунокомпроментированных лиц, в отдельных случаях с летальным исходом.
До недавнего времени возбудитель пневмоцистоза - Pneumocystiscarinii относили к простейшим, однако, биохимический анализ нуклеиновых кислот показал его таксономическую принадлежность к дрожжевым грибам–споровикам, аскомицетам.
Несмотря на последние изменения в его систематике согласно международной классификации болезней десятого пересмотра (МКБ-10, ICD-10) пневмоцистоз до сих пор отнесен в I класс – некоторые инфекционные и паразитарные болезни в подкласс протозойные болезни под шифром В-59.
С 1994 года название пневмоцистной пневмонии - Pneumocystiscarinii изменено на Pneumocystisjirovecii в честь чешского ученого – паразитолога Отто Йировеца впервые описавшего этот микроорганизм как причину заболевания у человека.
Современные представления о эпидемиологии возбудителя сводятся к следующему:
- источником инфекции является человек больной пневмоцистозом или носитель.
Как больной человек может являться источником инфекции понятно, а что касается носителей: считается, что у 1 - 10% здоровых людей можно обнаружить пневмоцисты. И так как пневмоцисты передаются воздушно-капельным путем, то передачу возбудителя от источника с бессимптомным течением инвазии к восприимчивому организму реализуют патологические акты (кашель, чиханье), обусловленные суперинфекцией. Дальнейшее развитие процесса может протекать по двум сценариям. Если произошло проникновение возбудителя в организм здорового человека, то инвазия протекает бессимптомно. Если в организм иммунокомпроментированного – возникает заболевание.
- основной механизм передачи возбудителя аэрозольный.
Главное место локализации патологического процесса при пневмоцистозе – органы дыхания, весь свой жизненный цикл они осуществляют в просвете альвеол. При кашле образуется мелкодисперсный аэрозоль. Его частицы не оседают, а находятся во взвешенном состоянии. Заражение пневмоцистами происходит при вдыхании воздуха, контаминированного возбудителем, при этом основным фактором передачи является воздух, а путь передачи воздушно-капельный.
Пневмоцисты имеют широкое распространение среди домашних, диких и лабораторных животных. Но при этом надо заметить, что пневмоцисты видоспецифичны и от животного к человеку не передаются.
В отличие от гриппа и ОРВИ с зимне-весенним подъемом заболеваемости пневмоцистоз не имеет такой ярко выраженной сезонности.Исследования по изучению сезонных колебаний пневмоцистной инфекции у детей показывают, что наибольшее число заболеваний приходится на август и сентябрь (41,4% и 39,6%; t=2,45 и t=2,52). Это можно связать с возвращением детей после каникул в организованные детские коллективы, что способствует усилению циркуляции возбудителя пневмоцистной инфекции, обусловленной продолжительным совместным пребыванием детей в закрытых помещениях. Однако изучение сезонных колебаний пневмоцистной инфекции среди взрослого населения показывают практически равномерное распределение случаев заболеваний в течение года. Прежде всего, это связано с тем, что у взрослых пневмоцистоз преимущественно развивается среди лиц с иммунодефицитными состояниями и протекает как оппортунистическая инфекция.
В большинстве случаев преобладает спорадическая заболеваемость пневмоцистозом, как в случае эндогенной инвазии, при активации собственных пневмоцист в результате возникшего иммунодефицита, так и при экзогенной.
Но встречается и очаговость. Приведем два наиболее часто распространенных очага это внутрисемейный и внутрибольничный. В семейных очагах родители чаще всего являются носителями пневмоцист. Их ослабленные дети подвергаются инфицированию и заболевают пневмоцистозом. Широко описаны внутрибольничные заражения пациентов от медицинского персонала, являющегося носителями пневмоцист, в отделениях недоношенных новорожденных, в стационарах для детей раннего возраста, туберкулезных стационарах, в онкологических и гематологических центрах.
Непосредственно нами (лаборатория эпидемиологии оппортунистических инфекций) было проведено исследование группового заболевания пневмоцистозом в крупном онкологическом стационаре. Мы выяснили, что источником инфекции являлась медсестра. У которой под маской ОРЗ скрывалась пневмоцистная инфекция, и которая активно выделяла возбудитель в окружающую среду, тем самым инфицируя пациентов.
Рассмотрим группы риска в отношении пневмоцистной инфекции.
Первой группой риска в отношении пневмоцистоза стали дети домов ребенка. Также к группам риска относят недоношенных и ослабленных новорожденных, детей раннего возраста (1-3-х лет) с врожденным иммунодефицитом.
Основными группами риска в отношении развития пневмоцистоза взрослых являются иммунокомпроментированные лица, это гематологические и онкологические больные, реципиенты трансплантированных органов, больные туберкулезом и герпесвирусными инфекциями. Повышенная заболеваемость среди больных с различными злокачественными заболеваниями крови объясняется длительностью применения кортикостероидов и других иммунодепрессивных препаратов.
Пневмоцистная пневмония занимает одно из первых мест среди оппортунистических заболеваний у ВИЧ – инфицированных.
Также группой риска в отношении пневмоцистоза является медицинский персонал.
Большое значение среди факторов, снижающих резистентность и провоцирующих пневмоцистоз, в стационарных условиях имеют иммуносупрессивные препараты, цитостатики, лучевая терапия, антибиотики.
Необходимо отметить возможность развития пневмоцистной пневмонии у больных алкоголизмом, наркоманией, злостных курильщиков.
Выраженная клиническая картина при пневмоцистозе характерна для недоношенных и ослабленных детей до 6 мес. возраста и протекает у них как классическая интерстициальная пневмония с продолжительностью инкубационного периода в среднем 20-25 дней и с четкими стадиями патологического процесса.
Отечная стадия начинается постепенно: появляются слабость, вялость, субфебрилитет, затем покашливание и лишь в конце этого периода - сухой кашель и одышка при физической нагрузке. У грудных детей возникает цианоз носогубного треугольника, ребенок плохо сосет, не прибавляет в массе тела, нередко отказывается от грудного вскармливания.
Ателектатическая стадия. В этот период лихорадка становится фебрильной. Кашель усиливается, делается навязчивым, коклюшеподобным, появляется сначала вязкая, а затем характерная пенистая мокрота. Постепенно нарастает одышка, которая возникает при малейшем движении. При осмотре больных определяется бледность кожных покровов.
У выживших больных развивается эмфизематозная стадия болезни, характеризующаяся признаками эмфиземы легких, значительным снижением функциональных показателей дыхания, симптомами «легочного сердца».
Эмфизема легких характеризуется расширением альвеол с последующим разрушением их стенок и в дальнейшем повышением воздушности легочной ткани.
Лёгочное сердце — увеличение и расширение правых отделов сердца в результате повышения артериального давления в малом круге кровообращения, развившееся вследствие заболеваний бронхов и лёгких.
У детей старшего возраста и взрослых заболевание не имеет четкой стадийности и протекает как бронхо-легочное заболевание или атипичная пневмония. Наиболее важным клиническим симптомом у лиц с иммунодефицитами различного генеза, со слов наших клиницистов, является синюшность носогубного треугольника и одышка.
Рентгенологическая картина при пневмоцистной пневмонии также развивается постепенно:
I стадия – обнаруживаются мелкоочаговые тени в обоих легких, напоминающие крылья бабочки;
II стадия – в легких появляются обильные очаговые тени, местами сливающиеся в крупные участки уплотнения, перемежающиеся участками вздутия. Структура легкого становится «ватной», т.е. по рисунку напоминает тонкий слой ваты с более или менее плотными участками;
III стадия – лобулярные вздутия, расположенные субплеврально, что может привести к их разрыву с образованием серповидного пневмоторакса.
Теперь о лабораторной диагностике.
Многочисленные попытки культивировать этот возбудитель наразличного рода питательных средах не увенчались успехом. Для лабораторной диагностики пневмоцистной инфекции используются:
- паразитологические;
- иммунобиологические;
- молекулярно-генетические методы.
Паразитологические методы – это самые ранние методы и в настоящее время используются в основном патологоанатомами. Они основаны на прямом морфологическом выявлении пневмоцист в биологическом материале.
Правильно собранный материал – залог правильной диагностики.
Для патологоанатомического исследования в течение первых суток после гибели больного производят взятие фрагментов легочной ткани, включающей альвеолы, в стерильные флаконы стерильными инструментами. Из полученных материалов приготавливают мазки-отпечатки легкого или мазки из пенистого содержимого альвеол.
Для прижизненного выявления пневмоцист исследуют свободно отделяемую мокроту, индуцированную мокроту, бронхоальвеолярныйлаваж, трахеальный аспират, трансбронхиальный биоптат.
Если мокрота легко отделяется, ее надо собирать несколько раз в течение суток в одну посуду, сохраняя до исследования при t +4 °С.
Если свободно отделяемой мокроты нет, то применяют различные методы:
Наиболее простым методом получения материала для выделения пневмоцист является взятие индуцированной мокроты (ИМ). Через ультразвуковой распылитель делается ингаляция 3%-ным раствором хлорида натрия. Мокрота собирается в стерильную чашку.
Для получения бронхоальвеолярного лаважа (БАЛ) через бронхоскоп введенный в периферический бронх дробно (по 20-30 мл) вводится 100-250 стерильного физиологического раствора. После введения каждой порции содержимое аспирируется.
Для получения материала от детей раннего возраста можно использовать метод воспроизведения кашлевого рефлекса путем надавливания на корень языка. Слизь при этом забирается тампоном.
Легочную ткань при жизни получают при проведении трансбронхиальной биопсии, что позволяет выявить пневмоцисты в 66-98%, однако, этот метод взятия материала показан далеко не всем больным. Другой способ получения материала возможен при открытой биопсии легкого или с помощью трансторокальной биопсии легких. Метод открытой биопсии легкого дает наилучшие (100%) результаты, при этом получается достаточно большой объем материала для исследования и ложноотрицательный результат полностью исключается.
Некоторые виды материала подвергают специальной обработке.
Мокроту для разжижения обрабатывают муколитическим раствором дитиотреитола (ДТТ), затем нейтрализуют фосфатным буфером, инкубируя 3 минуты.
Все материалы (мокрота, слизь) разводят физиологическим раствором, центрифугируют при 1,5 тыс. об/мин. Осадок опять разводят физ. раствором до нужной концентрации и готовят мазки для дальнейшего исследования.
Лаважную жидкость центрифугируют при 1,5 тыс. об/мин, затем из осадка готовят мазки.
Полученные мазки, окрашивают различными методами: серебрение по Го'мори, окраска толуидиновым синим, окраска по Грамму, окраска реактивом Шиффа. Этими методами можно выявить лишь цисты, но только по методу Романовского – Гимза можно выявить все формы пневмоцист (циста, трофозоит, спорозоит). При этом это и наиболее простой, и быстрый способ.
Метод ИФА позволяет выявлять в сыворотке крови антитела класса IgM и IgG.
Методами непрямой и прямой иммунофлюоресценцииможно определять антигены пневмоцисты в различном биологическом материале.
Для диагностики ПП может применяться метод ПЦР. Он основан на обнаружении фрагмента генома возбудителя. Однако надо учитывать тот факт, что 10% населения являются пневмоцистоносителями, поэтому необходимо использовать количественный метод, т.к. применение только качественного метода ПЦР не является диагностическим, поскольку он выявляет все формы заболевания, включая и латентные, как правило, не требующие специфического лечения. На российском рынке лидером по производству Наборов реагентов для выявления ДНК возбудителя является ИнтерЛабСервис.
Для точной диагностики пневмоцистоза необходимо использовать все предложенные методы в комплексе, т.к. не у всех иммунокомпроментированных лиц вырабатываются специфические противопневмоцистные антитела, которые диагностируются методом ИФА, а также не у всех пациентов можно получить биологический материал для использования его в НРИФ и ПЦР.
Необходимо отметить важность быстрого обследования при пневмонии у иммунокомпроментированных лиц, поскольку зачастую у взрослых течение инфекции бывает молниеносным и просто не успевают назначить терапию и пациенты погибают.
Использование комплекса современных методов лабораторной диагностики пневмоцистной инфекций позволяет выявлять различные стадии заболевания.
Такие как: встреча возбудителя в прошлом (присутствуют только анамнестические титры антител класса IgG до 1:200), носительство (в соскобном материале из зева, слюне или мокроте определяют только антигены и ДНК пневмоцист). По совокупности обнаруженных маркеров можно установить начало, разгар и конец острого периода заболевания, а также выявить стадию реконвалесценции/выздоровления (высокие титры антител класса IgG>1:800 при отсутствии других маркеров инфекции). Диагностировать хроническую пневмоцистную инфекцию, ее латентную форму, или стадию реактивации.
Несмотря на широкое распространение и большую значимость пневмоцистоза в бронхолегочной патологии, как детей, так и взрослых в нашей стране проблема с качественной диагностикой этой инфекцией. Существующие зарубежные тест-системы дороги и недоступны широкому кругу потребителей и прежде всего практическому здравоохранению нашей страны.
В настоящее время в России уже выпускаются коммерческие иммуноферментные и иммунофлюоресцентные Наборы реагентов.
Это Набор реагентов «ПневмоцистоСтрип» для иммуноферментного выявления иммуноглобулинов класса M и G к пневмоцисте и Набор реагентов «ПневмоцистоФлюоАГдиагностика» для проведения непрямой реакции флюоресценции для детекции специфических антигенов пневмоцисты.
На основании ранее сказанного был выработан алгоритм диагностики пневмоцистной инфекции.
Обследованию подлежат иммунокомпетентные лица, как дети, так и взрослые, с подозрением на пневмоцистоз, лица с иммунодефицитами различной природы, как дети, так и взрослые с ВИЧ-инфекцией, гематологические и онкологические больные.
Группы риска: прежде всего это недоношенные новорожденные и ослабленные дети первых лет жизни.
Несмотря на то, что пневмоциста относится к дрожжеподобным грибам, известные противогрибковые средства на нее не действуют.
Наиболее часто назначают Триметоприм-сульфаметоксазол, в народе Бисептол, при его непереносимости – Пентамидин, также применяют Дапсон. При нетяжелых формах, у пациентов с аллергиями или при непереносимости Бисептола назначают Атовакон. Атовакон не вызывает у пациентов миелосупрессии (уменьшение количества образующихся в костном мозге клеток (эритроциты, лейкоциты, тромбоциты) крови, после курса химиотерапии, в результате анемии, инфекции, аномального кровотечения)
В дополнение к основной терапии рекомендуется использовать различные иммуномодуляторы.
Профилактика пневмоцистоза делится на первичную и вторичную:
- первичная профилактика служит для предотвращения первого эпизода заболевания. Основным критерием для начала профилактики считается снижение числа CD4+ лимфоцитов ниже 200;
- вторичная профилактика подразумевает постоянный прием противопневмоцистного препарата после первичного эпизода пневмоцистной инфекции. Показаниями к проведению химиопрофилактики пневмоцистоза является уровень CD4-лимфоцитов менее 0,2x109/л, а также лихорадка неясного генеза продолжительностью не менее 2-х недель.
Для профилактики пневмоцистной инфекции назначают Триметоприм-сульфаметоксазол и Пентамидин.
Профилактика пневмоцистной инфекции назначается ВИЧ-инфицированным лицам, пациентам после трансплантации органов.
В заключение хотелось бы отметить, что распространение иммунодефицитов среди населения предписывает обращать особое внимание на возбудителей оппортунистических инфекций, в частности, на пневмоцистоз.
XIII Международная студенческая научная конференция Студенческий научный форум - 2021

Аннотация. Пневмоцистоз относится к оппортунистическим инфекциям. Данная патология сопровождается поражением тканей лёгких, которое развивается на фоне состояния иммунодефицита. Пневмоцистоз поражает лёгкие у детей и взрослых. Пневмоцистозная пневмония развивается у пациентов с угнетённым клеточным иммунитетом и нарушенным гуморальным иммунитетом. Установить точный диагноз сложно в связи с отсутствием специфической клинической картины, что обусловлено отсутствием патогномических симптомов. В связи с этим обязательным является использование разнообразных лабораторных методов диагностики: паразитологических, иммунологических, молекулярных.
В данной статье приводятся обзорные данные относительно особенностей распространения данной инфекции, её значения в развитии патологических состояний у различных групп пациентов, история открытия и систематики заболевания. В качестве материалов использовалась научная литература и статьи из различных журналов. Весь собранный материал был подвергнут методам анализа и обобщения.
Ключевые слова: пневмоцистоз, пневмоцистозная пневмония, ВИЧ-инфекция, pneumocystis carinii .
Annotation. Pneumocystosis refers to opportunistic infections. This pathology is accompanied by lung tissue damage, which develops against the background of a state of immunodeficiency. Pneumocystosis affects the lungs in children and adults. Pneumocystis pneumonia develops in patients with suppressed cellular immunity and impaired humoral immunity. It is difficult to establish an accurate diagnosis due to the lack of a specific clinical picture, which is due to the absence of pathognomic symptoms. In this regard, it is mandatory to use a variety of laboratory diagnostic methods: parasitological, immunological, molecular.
This article provides an overview of the features of the spread of this infection, its significance in the development of pathological conditions in various groups of patients , history of the discovery and taxonomy of diseases . Scientific literature and articles from various journals were used as materials. All the collected material was subjected to methods of analysis and generalization.
Key words: pneumocystosis, pneumocystic pneumonia, HIV infection, pneumocystis carinii .
Введение. Пневмоцистоз — это оппортунистическая инфекция, которая вызывает атипичное поражение лёгких. Возбудители являются почкующимся дрожжеподобными грибами с внеклеточным развитием.
История открытия данного микроорганизма берёт своё начало с 1909 года, бразильский врач Карлус Шагас извлёк его из лёгких гвинейских свинок и отнёс к одной из форм трипапаносомы. Далее в 1912 году Ф. Деланое и другие соавторы обнаружили цисты пневмоцисты в лёгочных тканях крыс и отнесли его в отдельный род Pneumocystis , вид С arinii . Наименование возбудителя пневмоцистоза у человека в 1999 году было изменено на Pneumocystis jiroveci hominis в честь чешского ученого — паразитолога Отто Йировица, который описал пневмоцисту как источник заболевания пневмонией у человека. Ввиду генетической и в немногочисленных случаях фенотипической неоднородности вида Pneumocystis carinii таксономическое положение достаточно сложное. В 1976 году Френкель доказал, что возбудитель у человека — Pneumocystis jiroveci — схож морфологически с Pneumocystis carinii — возбудитель заболевания у животных. Единственное отличие — это антигенная структура. К тому же, разные генотипы Pneumocystis carinii были обнаружены у различных больных пневмоцистозной пневмонией, а также у одного и того же больного при повторных случаях пневмоцистной инфекции. В 1994 году исходя из такого положения была введена триноминальная номенклатура, которая включала как род и вид, так и носителя на латинском языке: как пример, если носитель человек — Pneumocystis carinii f . sp . hominis , а если хозяином является крыса — Pneumocystis carinii f . sp . carinii . До 1988 году были споры на тему принадлежности Pneumocystis carinii к спорообразующим простейшим или грибам. Данный возбудитель был отнесен к царству грибов — Blastomycetes , на основании новых генетических критериев. Этот возбудитель имеет в наружном слое трофической формы β -1,3 гликан, точно такой же содержится в клеточных стенках дрожжеподобных грибов. Трофическая форма похожа на вегетативную форму дрожжевых грибов и обладают способностью образовывать цисту, в которых находятся споры. Ещё пневмоциста обладает ламеллярной ультраструктурой митохондрий, что свойственно грибам, а у простейших они тубулярные. В 1989 году на Международной конференции в Женеве по десятому пересмотру Международной классификации болезней [1,2].
Жизненный цикл. Состоит из 4 стадий: трофозоит, прециста, циста, спорозоит. Выделяют 2 фазы: сексуальную и асексуальную. Трофозоит прикрепляется к альвеолоцитам 1 типа, затем происходит пролиферация трофозоита, далее образуется ранняя прециста, потом поздняя прециста, позднее циста, в заключении спорозоит. Сексуальная фаза протекает в последовательности: спорозоиты, трофозоит, прециста, циста. Асексуальная фаза протекает в последовательности: трофозоиты, циста [ 2].
Методы исследования. При паразитарных заболеваниях лёгких лучевая семиотика является разнообразной. При лучевом методе исследования паразитарных заболеваниях лёгких чаще всего находят патологические изменения макроструктуры, которые позволяют предположить о природе заболевания (как например цистицеркоз, эхинококкоз и аскоридоз), или сделать предположение о паразитическом характере изменений (как например парагонимоз, альвеококкоз и токсоплазмоз). Мультиспиральная компьютерная томография (МСКТ) грудной клетки является ведущим методом в обнаружении паразитарных заболеваниях лёгких. Применение ультрозвукового исследования (УЗИ) ультрозвукового окна (прилежание области изменений к грудной стенке, диафрагме) используют, при условиях недостатка данных рентгенографии. Магнитно-резонансная томография (МРТ) используется для уточнения жидкостного характера образования или наличия жидкостных включений (альвеококкоз). МСКТ используется для основного анализа лёгких пациента, МРТ и УЗИ дополняют и расширяют обследование при наличии жидкостного характера изменений [3].
Прогнозы. Статистическое прогнозирование показывает, что без специфического лечения от ПЦП летальность детей раннего возраста составляет 50 %, 40 % детей старшего возраста, 70 % больных ВИЧ-инфекцией, встречались показатели равные 90-100%, в этап вспышки заболевания показатель летальности равен 20-27%, при ранних методах лечения у ВИЧ-инфицированных составлял 75-80%. Исчезновение патологии наблюдается у 43 % (при рентгенологическом исследовании). В диапазоне 10-40 % возникают рецидивы, частота которых от 5 до 7 раз в течение жизни. Даже с условием эффективного лечения, срок жизни пациентов с ПЦП и ВИЧ составляет примерно 9 месяцев, летальный исход наблюдается чаще всего в течение 21 месяца [4,5,6].
По данным В. С. Боровицкого есть определённые критерии, оказывающие влияние на летальность. Первый критерий — артериальное давление (меньше или ровно 110 мм рт. ст.), второй критерий — парциальное давление O 2 (меньше или равен 60 мм рт. ст.), третий критерий — лимфоциты в крови (меньше или равны 10 %). При проявлении одного показателя смертность равна 14 %, при сочетании двух показателей - 47 %, а всех трёх - 75 % [4].
Симптомы. Пневмоцистоз, чаще всего, протекает в виде острого респираторного заболевания, ларингита, обструктивного бронхита, обострения хронических бронхолёгочных заболеваний, а также по типу пневмонии с нарушениями газообменных процессов. Особенность фатальных случаев заключается в том, что пневмоцистная пневмония практически не выходит за границы лёгких, что вызвано крайне низким уровнем вирулентности возбудителя. Однако на фоне нарушения клеточного иммунитета, возможно проявление пневмоцистоза в виде внелёгочного поражения (распространение процесса на щитовидную железу, надпочечники, печень, желудочно-кишечный тракт, кожу, сердце, селезёнку). Возможна прогрессия отита, мастоидита и гайморита пневмоцистозной этиологии, что происходит крайне редко. Патогенез внелёгочной диссеминации до конца не ясен, приводятся тезисы о лимфогенном и гематогенном распространении возбудителя. Особенностью антител, образующихся у больных, является отсутствие их протективного действий. В литературных источниках имеются данные о том, что роль антител в патогенезе пневмоцистозной пневмонии незначительна [1]. Однако некоторые авторы утверждают, что одним из важнейших звеньев в защите от инфекции являляется гуморальный иммунитет [1,2]. Одной из проблем недоношенных детей с белковой недостаточностью является нарушение синтеза специфического иммуноглобулина, в следствии этого возможно развитие пневмоцистозной пневмнии. Зачастую с 6-месячного возраста у таких детей, в результате нарушение выработки антител, развивается острый инфекционный процесс, связанный с исчезновением из кровяного русла ребёнка материнских иммуногобулинов. Таким образом, роль гуморального иммунитета в патогенезе пневмоцистоза имеет значение [1].
Летальный исход у пациентов с ВИЧ-инфекцией на фоне пневмоцистной пневмонии. У ВИЧ-инфицированных наблюдается 20 % случай летальности вследствие пневмоцистоза, однако в большинство случаев этиология пневмонии не выясняется. Почти у всех людей (98 %) со СПИДом диагностируют туберкулёз лёгких, пневмонию, гепатит С. Летальность по причине пневмоцистоза среди ВИЧ-инфицированных занимает третье место. Одним из новых способов лечения больных СПИДом, является использование высокоактивной антиретровирусной терапии (ВААРТ), но показатель летальных исходов возрастает из-за несвоевременной диагностики и не соблюдения режима лечения. Тяжесть поражения нижних дыхательных путей у больных ВИЧ-инфекцией напрямую зависит от количества CD 4+ лимфоцитов в крови. В условиях поддержки количества лимфоцитов в крови более 500 клеток/мкл чаще всего в 88,2 % случаях встречается бактериальная пневмония и бронхиты. При уменьшении концентрации от 500 до 200 лимфоцитов в 1 мкл, бактериальная пневмония наблюдается в 67,1 %, и туберкулёз лёгких - в 28, 1 % случаях. При понижении до 200 клеток на 1 мкл может развиваться пневмоцистоз (в 7,2 % случаев) [4].
Восприимчивость населения к ПЦП. Частота встречаемости ПЦП среди пациентов без ВИЧ-инфекции составляет: недоношенные новорождённые дети - 68,1 %, пациенты с лейкозам - 12,3 %, люди с онкологическими заболеваниями - 7,3 %, пациенты после трансплантации органов - 3,6 %, при первичной иммунной недостаточности - 2,0 %, коллагеноз 0,6 %, нарушение питания 0,3 %, множественные миеломы 0,2%, пациенты с неуточнённым сопутствующим диагнозом - 4,5 % [3].
Заключение. Проведя анализ литературных данных, можно сказать, что пневмоцистоз относится к оппортунистическим инфекциям. Данная патология наносит значительный ущерб здоровью недоношенных детей, а также людям с сопутствующими заболеваниями, приводящими к снижению иммунного статуса. Наибольшее количество заражённых людей регистрируется среди пациентов позитивных по ВИЧ.
1. Каражас Н.В. ПНЕВМОЦИСТОЗ. СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ//Альманах клинической медицины. 2010. № 23. С. 49-55.
2. Боровицкий В.С. Пневмоцистная пневмония. Этиология, патогенез, клиника, дифференциальная диагностика, лечение (лекция)//Проблемы медицинской микологии. 2012. Т. 14. № 1. С. 13-20.
3. Котляров П.М. ЛУЧЕВАЯ ДИАГНОСТИКА ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ ЛЕГКИХ.//Вестник Российского научного центра рентгенорадиологии. 2015. Т. 15. № 4. С. 51-63.
4. Пузырева Л.В., Сафонов А.Д., Мордык А.В. ОСОБЕННОСТИ ПНЕВМОЦИСТНОЙ ПНЕВМОНИИ У ВИЧ-ИНФИЦИРОВАННЫХ ЛИЦ//
Медицинский вестник Северного Кавказа. 2016. Т. 11. № 3. С. 489-495.
6. Шкарин В.В., Саперкин Н.В.ЭПИДЕМИОЛОГИЯ ОППОРТУНИСТИЧЕСКИХ МИКОЗОВ//Вестник дерматологии и венерологии. 2017. № 3. С. 21-31.
Читайте также:
