Подготовка к трансплантации стволовых клеток (миелотрансплантации)
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Алексей Масчан провел свою первую трансплантацию костного мозга в 1992 году. Спустя 26 лет клиника имени Дмитрия Рогачева, где работает Алексей Александрович, является крупнейшим центром ТКМ в мире.
В клинике проводится 180 пересадок костного мозга в год. И до сих пор каждый день Алексей Александрович приходит в отделение как врач и продолжает вести пациентов. Как изменился за прошедшие годы подход к трансплантации, когда и при каких диагнозах эта процедура необходима и какие технологии позволяют снизить риск побочных эффектов.
Алексей Масчан, директор Института гематологии, иммунологии и клеточных технологий
За последние 11-15 лет произошли кардинальные изменения в использовании ТКМ для лечения онкологических и тяжелых гематологических заболеваний. Расскажите, пожалуйста, с чего все начиналось.
Когда я пришел работать в трансплантологию, пересадки (если отбросить в сторону аутологичные трансплантации), то есть переливание собственных клеток пациента) выполнялись практически исключительно от родственных доноров — генетически совместимых братьев и сестер. Тогда мы часто говорили родителям пациентов с хроническими заболеваниями, требующими ТКМ: вы можете попробовать родить еще одного ребенка, и вероятность того, что он сможет стать донором, 25%. И действительно, были такие случаи, что родители решались на очередного ребенка, он оказывался подходящим донором, и мы использовали для пересадки, например, пуповинную кровь.
Конечно, когда мы разговаривали с родителями, мы объясняли: вы рожаете не донора, у вас появится еще один ребенок, который точно так же будет нуждаться в любви и заботе. Только он еще может спасти своего брата или сестру. И все же это было очень сложным решением для родителей. К счастью, технологии пересадок за последние 20 лет развились настолько, что сейчас нет необходимости подбирать полностью совместимого родственного донора. А значит, и все этические дилеммы, с этим связанные, остались в прошлом.
Первая неродственная пересадка была сделана в России в 1997 году. Трансплантация прошла успешно, сейчас Антон — студент третьего курса в Орловском мединституте. Мы поддерживаем с ним связь и ждем к нам в ординатуру через пару лет. С 1997 по 2013 годы технология трансплантации от неродственных доноров пережила расцвет, результаты этих пересадок резко улучшились. Благодаря поддержке фонда «Подари жизнь» мы смогли развернуть программу неродственных трансплантаций сначала на базе Российской детской клинической больницы, затем в Центре гематологии имени Димы Рогачева. Огромные усилия прилагались к тому, чтобы оплатить поиск доноров, их активацию и транспортировку трансплантационного материала — костного мозга или гемопоэтических стволовых клеток.
Сейчас в Центре детской гематологии активно развивается программа пересадок гемопоэтических стволовых клеток от не полностью совместимых родственных доноров — гаплотрансплантаций. Но еще несколько лет назад такие трансплантации проводились только в крайних случаях. Расскажите об основных изменениях, которые произошли в подходе к трансплантации гемопоэтических стволовых клеток.
Да, гаплотрансплантация — это трансплантация от родственного донора, который не полностью совместим с пациентом. Например, ровно наполовину, как мама или папа. Мы начали разрабатывать эту программу под руководством моего брата Михаила Александровича Масчана и стали использовать в ней современные технологические новшества. В последние несколько лет ученые проникли в саму суть сложного биологического процесса пересадки костного мозга. Сегодня пересадки от гаплоидентичных доноров и от совместимых неродственных доноров дают практически одинаковые результаты. Более того: оказалось, что при миелоидных лейкозах пересадки от гаплоидентичного донора дают результаты лучше, чем при использовании неродственного донора. Именно с этим было связано наше решение о полном переходе на гаплоидентичные пересадки у больных миелолейкозами, и шире — у больных лейкозами.
Теперь во многих случаях мы даже не приступаем к поиску совместимого неродственного донора, а сразу планируем гаплоидентичную пересадку. Процедура дает результаты не хуже, при этом нам не нужно заниматься сложной логистикой подбора донора: пересылкой образца крови пациента в зарубежные регистры, дорогостоящим типированием, перевозкой трансплантационного материала. То есть гаплотрансплантация оказывается гораздо проще и дешевле. Кроме того, как уже было сказано, в случаях некоторых заболеваний эффективность гаплоидентичной трансплантации может быть и выше, поскольку при ней присутствует ряд эффектов, которые трансплантация от совместимого донора дать не может. Об этом врачи догадывались давно, только этого никто не мог доказать. Сегодня, кажется, мы наконец видим, что это действительно так.
Кто из родственников пациентов лучше всего подходит для гаплоидентичной трансплантации?
Лучше всего подходят доноры, которые могут подвергнуться процедуре мобилизации (то есть вывода нужных клеток в кровь) и последующего забора материала (то есть собственно взятия этих клеток). Для этого донор должен быть здоров и в то же время должен уже иметь опыт контакта с теми вирусами, которые могут активироваться после пересадки. Поэтому для гаплоидентичной трансплантации мы редко приглашаем стать донорами детей младше 14 лет. Обычно доноры — это родители, и мы не можем сказать, что папа лучше, чем мама, или наоборот. Это многомерная, многопараметрическая история.
Развитию гаплоидентичной трансплантации помогло возникновение новых технологий очистки трансплантационного материала — клеток, взятых из крови. Расскажите, пожалуйста, об этом подробнее.
Совершенно верно. Эта технологическая платформа была усовершенствована компанией Milteniy Biotec. Такая совершенно частная компания, основанная гением. Штефан Милтени создал высокотехнологичный медицинский бизнес с оборотом уже, наверное, в сотни миллионов. Мы с ним знакомы, и он производит впечатление совершенно невероятное. Это капиталист и при этом скромный и доступный человек, он ходит пешком, ест гамбургеры, абсолютно бескорыстен. Всю прибыль от продаж технологий Милтени вкладывает в новые разработки. К исследованиям он привлек уникальную команду ученых, в маленьком городке под Франкфуртом работает целый научный институт.
На ваш взгляд, какие условия необходимы, чтобы технология, разработанная компанией Miltenyi, была использована правильно и лечение дало ожидаемый результат? Насколько важна команда врачей, их опыт?
Сейчас процедура пересадки гемопоэтических стволовых клеток стала гораздо безопасней, мы можем справляться с подавляющим большинством осложнений. Но по-прежнему это очень сложная и рискованная процедура. Она не заработает, как утюг, в руках любого. Для этого нужна команда, которая способна на всех этапах обеспечивать ее безупречное функционирование. Именно благодаря тому, что у нас есть эта команда врачей и технология пересадок отработана за многие годы, сейчас эта процедура сопряжена с гораздо меньшим количеством осложнений.
Поэтому мы смогли увеличить количество пересадок, проводимых в Центре детской гематологии. Для сравнения: когда мы работали на нашей предыдущей базе в РДКБ, мы делали 70 пересадок в год. Это было очень хорошо, это был один из крупнейших европейских центров ТКМ. Сейчас в Центре Димы Рогачева мы делаем не меньше 180 пересадок в год. И это делает нас, наверное, самым крупным центром в мире.
Каких осложнений, которые раньше часто возникали при трансплантациях, сейчас получается избежать?
Во время трансплантации гемопоэтических стволовых клеток полностью перезапускаются кроветворная и иммунная системы пациента. Самое главное осложнение любой пересадки — это реакция «трансплантат против хозяина» (РТПХ), в ходе которой иммунные клетки трансплантата атакуют множество органов и тканей пациента. В прежние годы смертность от этого осложнения составляла 20-25%. И еще 20% пациентов оставались инвалидами в результате долгосрочных последствий РТПХ. Сейчас картина изменилась, осложнения возникают в три раза реже.
Это произошло благодаря тому, что мы используем современную технологию очистки трансплантата — парциальную Т-клеточную деплецию. Во время очистки мы убираем не все иммунные клетки, а только те, которые ответственны за развитие осложнений после трансплантации, за РТПХ. Риск осложнений уменьшился, но он, к сожалению, не нулевой. Трансплантация костного мозга никогда не будет элементарной процедурой, поскольку мы вмешиваемся в самую основу функционирования иммунной системы.
Решение о трансплантации костного мозга всегда непростое, и его должен принять родитель пациента. Каждый раз вы разговариваете с родителями и объясняете все риски. Чего родители боятся больше всего?
Конечно, больше всего родители боятся осложнений. Потому что перед трансплантацией они лежат в отделении, через которое проходит большое количество пациентов с осложнениями после пересадок. И получается, что родители и пациенты не видят удачных случаев — видят только своих соседей по отделению, которые возвращаются в Центр с РТПХ, отторжением трансплантата или с рецидивом. Поэтому возникает естественный страх, что именно это случится и с их ребенком.
С другой стороны, мы не можем гарантировать родителям, что все будет в порядке. Ведь речь идет об очень непростой процедуре. Мы всегда предупреждаем об осложнениях, которые могут возникнуть. За годы работы я понял, что в разговоре с родителями надо быть максимально откровенным, ни в коем случае не запугивать, а стараться дать наиболее полную информацию.
Вам удалось в три раза увеличить число трансплантаций в Центре детской гематологии имени Димы Рогачева. Получают ли сейчас трансплантацию костного мозга все российские дети, которые в них нуждаются?
Мы посчитали, что в России ежегодная потребность в ТКМ у детей составляет примерно 850-900 пересадок, а проводится около 500-550. Сейчас увеличить число пересадок можно только при условии строительства новых центров в регионах и адекватного обеспечения этих центров необходимым оборудованием и лекарствами. Также нужны, безусловно, квалифицированные специалисты, умеющие работать с современными технологиями и оборудованием. Но даже самая выдающаяся команда врачей не сможет лечить, если у нее не будет того, чем лечить: нормальных расходников, нормальных антибиотиков и так далее.
Какова сейчас роль фонда «Подари жизнь» в развитии программы ТКМ в Центре детской гематологии? Почему наша помощь по-прежнему нужна?
Первое, в чем нужна помощь фонда и в чем она всегда будет нужна, — это оплата поиска и активации неродственных доноров. Мы сократили применение неродственных трансплантаций, но все равно очень широко ими пользуемся. Государство не оплачивает поиск и активацию неродственного донора в зарубежных регистрах.
Третье — и, пожалуй, с этого и надо было начать — стоимость самой процедуры трансплантации. То есть не процедуры, а препаратов, необходимых для ее успешного проведения. Сейчас существенная ее часть, она колеблется от пациента к пациенту, оплачивается благотворителями. Существующее государственное финансирование обеспечивает процедуру трансплантации костного мозга в лучшем случае на 50%.
Квота составляет немногим более трех миллионов рублей, а истинная стоимость трансплантации — 6,5-7 миллионов, иногда доходит и до десяти миллионов. В квоту укладывается только процесс лечения, а истинные затраты могут быть в три раза выше, чем это декларировано на бумаге. И вот эта разница между тем, что дают, и тем, что нужно врачам, в большой мере финансируется благотворителями фонда «Подари жизнь».
Кроме того, не будем забывать, что, когда мы выписываем больных по месту жительства, они уезжают с большим списком лекарств, зачастую дорогостоящих, которых им по месту жительства никто не даст. И фонд помогает с этим тоже. Так что программа трансплантации костного мозга в Центре Димы Рогачева не могла бы существовать и развиваться без «Подари жизнь».
В каких случаях пациентам все же необходима неродственная трансплантация костного мозга?
Неродственных пересадок мы по-прежнему делаем много, не меньше 30 в год. Неродственные трансплантации мы резервируем для некоторых иммунодефицитов и иногда для лимфобластных лейкозов — диагнозов, для которых положительные эффекты гаплоидентичной трансплантации выражены в меньшей степени. Также неродственная трансплантация необходима детям-сиротам, у которых нет биологических родственников. У меня в практике были такие случаи были. К счастью, нам удавалось найти неродственных доноров для сирот.
Насколько часты случаи отказов среди родственных доноров?
Большинство детей и взрослых родственников, которые могут стать донорами, страстно хотят этого. У детей отказов от донорства практически не бывает, среди взрослых родственников это иногда случается. Кандидаты боятся или просто не ощущают никакого родства.
Неродственному донору обеспечивают полную анонимность в течение двух лет для того, чтобы снизить риск психологической травмы в случае неудачи лечения. Но родственные доноры моментально узнают, если что-то идет не так.
Вы абсолютно правы. Если пациент не выживает, особенно если это происходит из-за реакции «трансплантат против хозяина», то донор может ощущать чувство вины из-за того, что не спас, из-за того, что причинил страдания.
Насколько сложно подготовить донора к трансплантации?
Гораздо проще, чем подготовить космонавта. В процедуре есть ряд неприятных моментов, но в целом это не больно. Если берется костный мозг, то он берется под наркозом, небольшая боль развивается только после процедуры. Эти боли не интенсивные, мы даем обезболивание. Если речь идет о гемопоэтических стволовых клетках, взятых из периферической крови, то у донора возникает недомогание, когда мы вводим вещества, которые выгоняют костномозговые клетки в кровь. Может развиться ломота в костях, иногда поднимается температура. Но это все переносимо, и с помощью очень простых лекарств осложнения сводятся к минимуму.
Считается, что после трансплантации костного мозга донор и реципиент становятся похожи. Правда ли это?
У пациента меняется группа крови на группу крови донора. И это, пожалуй, все сходство. Байка пошла с репортажа Валеры Панюшкина, который посетил вместе с нами первую встречу доноров и реципиентов в Биркенфельде. Тогда Валера написал, что, когда доноры и реципиенты встречаются, они оказываются очень похожими друг на друга. На самом деле это не совсем так – после трансплантации схожести не появляется. Но поскольку мы трансплантируем от доноров, которые генетически близки нашим пациентам, какое-то сходство быть может. Степень этой похожести зависит от впечатлительности наблюдателя.
Почему неродственных доноров для российских пациентов часто находят в немецких регистрах доноров костного мозга?
Возможно, это происходит из-за того, что в прошлом происходило много смешений популяций. В России немцы живут со времен Петра I, некоторые из них могли возвращаться в Германию. Но главным образом это, конечно, Вторая мировая война, когда сначала пол-России было занято немцами, а потом наоборот. Смешение кровей огромное, уже во втором и в третьем поколении получаются люди, которые генетически похожи друг на друга. Хотя надо сказать, что вероятность нахождения неродственного донора в современном российском регистре тоже достаточно высока, хотя регистр сейчас еще очень маленький.
Пока точную цифру сложно назвать, поскольку больших популяционных исследований не проводилось. Но, по-моему, каждая пятая неродственная пересадка уже производится от доноров из российского регистра. Однако, к сожалению, даже с увеличением российских регистров вероятность нахождения донора для представителей национальных меньшинств не увеличивается. В России живет много народов-изолятов, особенно на Севере: ненцы, долганы. Для них практически невозможно найти неродственного донора. В этом случае пациента может спасти только гаплотрансплантация.
Как проходит трансплантация стволовых клеток
Заведующая онкологическим отделением в клинике Ихилов.
Процесс пересадки стволовых клеток состоит из нескольких этапов. Сущность и последовательность этапов практически не зависят от того, какой тип трансплантации вам назначили.
Обследование и подготовка к трансплантации
Вначале вас обследуют для того, чтобы выяснить, нет ли у вас противопоказаний к трансплантации стволовых клеток. Эта процедура – настоящее испытание для организма. Несмотря на то, что многим людям она помогает победить болезнь, проблемы в ходе процедуры могут привести к тяжелым осложнениям и даже к летальному исходу. Перед началом лечения необходимо взвесить все плюсы и минусы пересадки стволовых клеток.
Трансплантация тяжело переносится и в психологическом плане. Пациенту приходится лежать в больнице в изоляции. Кроме того, вероятность возникновения побочных эффектов очень высока. И, хотя многие из таких побочных эффектов вскоре проходят, некоторые сохраняются на несколько лет. Это значит, что людям приходится менять привычный образ жизни. Иногда такие изменения носят временный характер. В ряде случаев, впрочем, они сохраняются на всю оставшуюся жизнь.
Перед трансплантацией необходимо обсудить весь процесс и все потенциальные побочные эффекты с лечащим врачом. Возможно, вы также захотите пообщаться с теми пациентами, кто уже перенес процедуру по пересадке стволовых клеток. Эффект трансплантации может проявиться спустя недели и месяцы после процедуры. Тяжело жить, не зная о том, как на вас в итоге подействует пройденное лечение. Ожидание отнимает у пациента, его близких и лиц, осуществляющих уход, время и эмоциональные ресурсы. Важно получать поддержку от близких людей. К примеру, вам понадобится помощь ответственного взрослого человека, готового следить за графиком приема лекарств, проверять, не появились ли у вас осложнения, и оставаться на связи со специалистами даже после вашей выписки. Специалисты расскажут вам и человеку, осуществляющему уход за вами, обо всех нюансах лечения и выздоровления. Они также помогут вам преодолеть все трудности и препятствия, возникающие как во время подготовки к лечению, так и во время трансплантации.
Вам назначат различные диагностические процедуры. Врач также задаст вам ряд вопросов для того, чтобы определить, сможете ли вы перенести трансплантацию стволовых клеток. Процесс подготовки обычно состоит из следующих этапов:
- HLA-типирование, включая типирование с высоким разрешением;
- полноценный анализ истории болезней и физический осмотр;
- изучение психологических и эмоциональных особенностей;
- выбор человека, который будет отвечать за уход в процессе лечения;
- биопсия костного мозга;
- КТ (компьютерная томография) или МРТ (магнитно-резонансная томография);
- исследование сердца – например, ЭКГ (электрокардиография) или эхокардиография;
- исследование легких – например, рентгенография грудной клетки и легочные функциональные тесты;
- консультации с другими специалистами трансплантационной бригады, включая стоматолога, диетолога и соцработника;
- анализы крови, включая общий анализ крови, биохимический анализ крови и скрининг на такие вирусные инфекции, как гепатит B, цитомегаловирусная инфекция и ВИЧ.
Возможно, вам поставят центральный венозный катетер (ЦВК). Он устанавливается в крупную вену в грудной клетке. Катетер ставят в ходе амбулаторной операции, под местной анестезией (врач обезболивает только тот участок, куда вводят катетер). Медсестры используют катетер для того, чтобы брать образцы крови и вводить лекарственные препараты. Если вам предстоит аутологичная трансплантация, вам поставят особый катетер, предназначенный для забора стволовых клеток (афереза). ЦВК остается на месте до тех пор, пока пересаженные стволовые клетки не приживутся, а уровни форменных элементов крови не начнут стабильно подниматься до нормы.
Пригодность к трансплантации
Лучше всего трансплантацию стволовых клеток переносят люди более молодого возраста и пациенты, едва начавшие лечиться. Некоторые трансплантационные центры устанавливают возрастные лимиты. К примеру, традиционную аллогенную трансплантацию (есть несколько видов этой процедуры) нередко предлагают только пациентам младше 50 лет, а аутологичную – пациентам младше 65 лет. Трансплантация стволовых клеток может быть противопоказана при тяжелых заболеваниях сердца, легких, печени или почек. Некоторым из таких пациентов назначают так называемую мини-трансплантацию.
Госпитализация или амбулаторное лечение
Специалисты определят, где вам предстоит лечиться – в стационарном отделении или в амбулаторном центре. Возможно, вам посоветуют ложиться в стационар только на определенные процедуры. Если нужно лечь в стационарное отделение, в больницу следует прийти за день до назначенной трансплантации. Перед так называемым кондиционированием (см. ниже) бригада специалистов должна убедиться в том, что вы и ваши близкие понимаете процесс лечения и согласны на все рекомендуемые процедуры.
Если трансплантация полностью или частично проводится на амбулаторной основе, необходимо подыскать жилье рядом с трансплантационным центром на весь начальный период лечения. Вам потребуется помощь родственника или близкого человека, имеющего возможность круглосуточно находиться рядом с вами. Кроме того, вам обоим понадобится надежный транспорт для того, чтобы посещать клинику. Специалисты трансплантационной бригады будут внимательно следить за вашим состоянием и проверять, не возникли ли у вас осложнения. Соответственно, вам придется посещать клинику каждый день на протяжении нескольких недель. Возможно, вас все-таки положат в стационар в том случае, если ситуация изменится или если у вас возникнут осложнения.
Чтобы снизить риск инфицирования во время лечения, стационарных пациентов кладут в одноместные палаты с особыми воздушными фильтрами. Некоторые палаты оборудованы защитными барьерами, отделяющими их от остальных палат и коридоров. Специальные системы очистки препятствуют проникновению в помещение загрязненного воздуха. Если вы планируете лечиться на амбулаторной основе, вам подробно расскажут о том, как защититься от инфекций.
Опыт, связанный с трансплантацией стволовых клеток, может стать тяжелым переживанием. Специалисты помогут вам подготовиться к лечению как физически, так и эмоционально. Они предпримут все меры для того, чтобы учесть ваши потребности и ответить на все интересующие вас вопросы. Вам и вашим близким объяснят, как проходит процесс пересадки стволовых клеток.
Вы и ваши близкие должны понимать, чего следует ожидать от лечения. Дело в том, что как только начнется кондиционирование, пути назад не будет. Прерывание трансплантации на любом из ее этапов грозит серьезными осложнениями.
Кондиционирование (химио- и/или лучевая терапия)
Кондиционирование, также известное под названием “подготовка костного мозга” или “миелоабляция”, – это лечение высокими дозами химиотерапевтических препаратов или радиации. Это первый этап трансплантации, который обычно длится 1-2 недели. Кондиционирование преследует одну или несколько целей:
- освободить место в костном мозге для трансплантируемых стволовых клеток;
- подавить иммунную систему пациента с тем, чтобы приживление трансплантата прошло без осложнений;
- уничтожить раковые клетки, которые остались в организме пациента.
Особенности кондиционирования зависят от ситуации. При планировании лечения специалисты учитывают, каким онкологическим заболеванием вы страдаете, какая трансплантация вам предстоит и какими методами (химиотерапия, облучение) вы лечились в прошлом.
Если план лечения включает химиотерапию, препараты выдадут в форме таблеток и/или введут через центральный венозный катетер. Если планируется лучевая терапия, это значит, что облучать будут все тело (тотальное облучение тела, или ТОТ). ТОТ проводится либо в виде единственной процедуры, либо в виде нескольких сеансов, назначенных на разные дни.
Эта фаза трансплантации сопряжена с существенным дискомфортом, так как в лечении используются очень высокие дозы химиотерапевтических препаратов и/или радиации. Химиотерапия и облучение вызывают разнообразные побочные эффекты, способные сильно ухудшить самочувствие пациента.
Некоторые побочные эффекты проходят лишь спустя несколько месяцев после начала лечения. Многие пациенты жалуются на то, что у них появились ранки в ротовой полости. При таких побочных эффектах принимают мощные обезболивающие препараты. Некоторые люди также жалуются на тошноту, рвоту, неспособность принимать пищу, выпадение волос и проблемы с легкими или дыханием.
У женщин кондиционирование может вызвать преждевременную менопаузу. Кроме того, многие женщины и мужчины после такого лечения становятся бесплодными (теряют способность иметь детей).
Важнейший день: инфузия стволовых клеток
Пациенту, перенесшему кондиционирование, дают несколько дней на отдых. После этого производится пересадка стволовых клеток. Клетки вводят через центральный венозный катетер. Процедура во многом напоминает переливание крови. Если стволовые клетки замораживались, вам вначале введут дополнительные лекарственные препараты. Эти препараты снизят риск нежелательной реакции вашего организма на консерванты, используемые при заморозке клеток.
Замороженные стволовые клетки вначале размораживают в теплой воде, а затем сразу же вводят в вену пациента. Иногда используют более одного пакета стволовых клеток. В ходе аллогенной или изогенной трансплантации забор донорских клеток производится в операционной, а обработка – в лаборатории сразу же после их извлечения. Стволовые клетки, прошедшие обработку, сразу же вводят в вену пациента – их не замораживают. Длительность пересадки зависит от объема жидкости, в которой находятся стволовые клетки.
Во время процедуры пациент пребывает в сознании. Анестезия не требуется. Это большой шаг, имеющий огромное значение для реципиентов и их близких. Многие люди воспринимают эту процедуру как перерождение или получение шанса на новую жизнь. Иногда день пересадки стволовых клеток празднуют как второй день рождения.
Побочные эффекты инфузии
Известны и другие побочные эффекты, которые появляются у некоторых пациентов как во время, так и сразу после трансплантации стволовых клеток. К таким побочным эффектам относятся:
- лихорадка или озноб;
- нехватка дыхания;
- крапивница;
- чувство стянутости в груди;
- низкое артериальное давление;
- кашель;
- боль в грудной клетке;
- уменьшение объема мочи;
- слабость.
И снова: вышеперечисленные побочные эффекты наблюдаются редко и носят незначительный характер. При появлении любых побочных эффектов пациенту назначают соответствующее лечение. Инфузия стволовых клеток в любом случае должна быть доведена до конца.
Выздоровление после инфузии стволовых клеток
Этап выздоровления начинается сразу же после инфузии стволовых клеток. В этот период пациент и его близкие ждут, пока клетки приживутся. После приживления стволовые клетки начинают делиться и вырабатывать новые кровяные тельца. Длительность периода между трансплантацией и началом стабильного повышения уровней форменных элементов крови зависит от индивидуальных особенностей организма и вида процедуры. Чаще всего, впрочем, пациенты и врачи начинают отмечать изменения через 2-6 недель после пересадки стволовых клеток. Пациенту предстоит либо провести это время в больнице, либо ежедневно посещать трансплантационный центр.

В течение первых двух недель после трансплантации уровни эритроцитов, лейкоцитов и тромбоцитов остаются низкими. Сразу же после процедуры (когда уровни форменных элементов крови достигают крайне низких отметок) пациенту колют антибиотики в целях предотвращения инфекций. Такая антибактериальная терапия называется профилактической. Возможно, вам назначат комбинацию антибактериальных, противогрибковых и антивирусных препаратов. Лекарства следует принимать до тех пор, пока уровень белых кровяных телец не достигнет определенной отметки. Тем не менее, даже несмотря на терапию, у вас могут возникнуть такие осложнения, как инфекция в результате нейтропении (недостатка лейкоцитов) или кровотечение вследствие тромбоцитопении (нехватки тромбоцитов). У многих пациентов сильно повышается температура тела. При тяжелых инфекциях назначают капельницы с антибиотиками. Пока костный мозг не начал функционировать, а пересаженные клетки – вырабатывать новые кровяные тельца, пациентам делают переливания эритроцитов и тромбоцитов.
Не считая болезни “трансплантат против хозяина”, характерной только для аллогенной трансплантации, побочные эффекты аутологичной, аллогенной и изогенной трансплантаций можно считать приблизительно одинаковыми. В число потенциальных проблем входят нарушения со стороны желудка, сердца, легких, печени и почек. Пациенты переживают душевные потрясения, тревогу, уныние, радость и гнев. Людям приходится тяжело не только в физическом, но и в эмоциональном плане, ведь они долгое время чувствуют себя плохо и общаются с минимальным кругом лиц.
Выписка из больницы
Подготовка к возвращению домой
Процесс выписки по факту начинается за несколько недель до пересадки стволовых клеток. Вначале специалисты рассказывают пациенту и лицу, осуществляющему уход, о следующих нюансах:
- необходимые меры предосторожности;
- назначение лица, осуществляющего уход за пациентом; требования, предъявляемые к такому лицу; выбор замещающего опекуна, который будет отвечать за уход за пациентом в случае болезни первого опекуна;
- подготовка жилища;
- правила ухода за центральным венозным катетером;
- правила ухода за ротовой полостью и зубами;
- какие продукты можно употреблять в пищу, а какие – нет;
- разрешенные и запрещенные виды деятельности;
- в каких случаях следует звонить врачам из трансплантационной бригады или другим специалистам.
Какие существуют критерии выписки из больницы
В большинстве случаев трансплантационные центры не выписывают пациентов домой до тех пор, пока они не будут отвечать следующим критериям:
- нормальная температура тела в течение последних 48 часов;
- способность принимать таблетки и другие препараты без рвоты, сохраняющаяся в течение последних 48 часов;
- возможность контролировать тошноту, рвоту и диарею средствами медикаментозной терапии;
- уровень нейтрофилов (абсолютное число нейтрофилов, или АЧН) не менее 500-1000/мм3;
- гематокрит не менее 25-30%;
- уровень тромбоцитов не менее 15000-20000/мм3;
- наличие помощника в доме, поддержка родственников и безопасная домашняя среда.
Если вы не отвечаете всем этим требованиям, но при этом также не нуждаетесь в интенсивной терапии в отделении трансплантологии, вас переведут в онкологическое отделение. После выписки необходимо немного пожить рядом с трансплантационным центром для того, чтобы своевременно получить квалифицированную помощь в случае осложнений.
Реабилитация
Процесс трансплантации стволовых клеток не заканчивается на вашей выписке. Многие пациенты жалуются на чувство усталости. Некоторым людям в период реабилитации приходится решать проблемы, связанные с физическим или психическим здоровьем. В связи с этим пациенты по-прежнему принимают много лекарств. После выписки все потребности больного должны удовлетворяться дома, поэтому поддержка со стороны опекуна и друзей/родственников в этот период приобретает особое значение.
Врачи продолжают тщательно следить за состоянием пациентов, перенесших трансплантацию стволовых клеток, даже после их выписки из больницы. Вероятно, вам назначат ежедневные или еженедельные обследования со сдачей анализов крови. Некоторым пациентам требуются дополнительные диагностические процедуры. В начале реабилитации вам, возможно, потребуется переливание крови и тромбоцитов, терапия антибиотиками или лечение иными средствами. Ежедневные посещения специалистов постепенно сменятся более редкими визитами в клинику. Может пройти 6-12 месяцев перед тем, как уровни форменных элементов крови приблизятся к норме, а иммунная система заработает как положено. В этот период врачи все еще будут следить за вашим состоянием.
Некоторые проблемы возникают примерно через год после инфузии стволовых клеток (и даже позже). К таким проблемам относятся:
- болезнь “трансплантат против хозяина” (после аллогенной трансплантации);
- инфекции;
- нарушения со стороны легких, включая пневмонию – воспаление, мешающее нормально дышать;
- нарушения со стороны почек, печени или сердца;
- недостаточная функция щитовидной железы;
- сильная усталость (упадок сил);
- плохая переносимость физической нагрузки;
- задержка роста и развития (у детей);
- катаракта;
- нарушения репродуктивной или половой функции, включая бесплодие, преждевременную менопаузу, боль или дискомфорт во время полового акта и потерю интереса к сексу;
- новые онкологические заболевания, вызванные трансплантатом.
К прочим потенциальным проблемам относятся:
- потеря памяти, нарушения концентрации внимания;
- психологический стресс, депрессия, изменения в ощущении своего тела, тревожность;
- социальная изоляция;
- изменения в отношениях с людьми;
- изменения в понимании смысла жизни;
- ощущение себя в долгу перед другими людьми;
- дискриминация в вопросах работы и страхования.
Трансплантация костного мозга/кроветворных стволовых клеток
Трансплантация костного мозга/кроветворных стволовых клеток — эффективный метод лечения заболеваний системы крови, врожденных и приобретенных иммунодефицитов, аутоиммунных заболеваний нервной системы и соединительной ткани, а также отдельных форм злокачественных новообразований у детей и взрослых. Ежегодно в мире выполняется более 50000 трансплантаций костного мозга. Для многих пациентов трансплантация подарила шанс на избавление от страшного недуга. Трансплантация позволяет не только получить длительные и устойчивые ремиссии заболевания, когда традиционное лечение является бессильным, но при ряде заболеваний полностью излечиться от тяжелой болезни.
Технология и виды трансплантации
Технология проведения трансплантации костного мозга или кроветворных стволовых клеток периферической крови предполагает внутривенное введение в организм пациента предварительно забранной у донора или самого пациента и, специально обработанной суспензии костного мозга или стволовых кроветворных клеток периферической крови. Значительно реже, в основном у детей, применяются кроветворные стволовые клетки пуповинной крови. Как правило, проведению трансплантации предшествует интенсивная химиотерапия, основной целью которой является максимальная редукция опухолевых клеток и клеток иммунной системы.
В зависимости от источника трансплантируемых клеток выделяют:
- Аллогенную трансплантацию костного мозга/стволовых кроветворных клеток периферической крови. При этом типе трансплантации источником кроветворных клеток является здоровый человек (донор) имеющий генетическое сходство с пациентом (реципиентом) по определенным генетическим параметрам. Донор может быть родственным (брат, сестра, родители) или неродственным.
- Аутологичную трансплантацию костного мозга/стволовых кроветворных клеток периферической крови — источником стволовых клеток или костного мозга является сам пациент.
- Сингенную трансплантацию костного мозга/стволовых кроветворных клеток периферической крови, которая является видом аллогенной трансплантации. Донором при сингенной трансплантации является монозиготный (генетически сходный) близнец пациента.
Аутологичная трансплантация — это вид трансплантации, при котором пересаживают собственные кроветворные клетки пациента, содержащиеся в костном мозге, периферической или пуповинной крови. С середины годов XX века костный мозг для трансплантации применяется все реже, что обусловлено появлением специальной аппаратуры для получения стволовых клеток из периферической крови (сепараторы стволовых клеток). Сепараторы клеток крови позволили сделать процедуру получения кроветворных стволовых клеток значительно более эффективной и безопасной. Полученный продукт кроветворных стволовых клеток (костный мозг, периферическая кровь, пуповинная кровь), замораживается и хранится необходимое время в среде жидкого азота при -197°С. Размороженные клетки возвращаются (трансплантируются) пациенту путем внутривенной инфузии. Как правило, перед трансплантацией проводится интенсивная химиотерапия, позволяющая максимально удалить опухолевые клетки из организма и преодолеть их лекарственную устойчивость к химиопрепаратам.
Успех трансплантации зависит от активности самого заболевания (состояние ремиссии) и физического состояние пациента (возраст, сопутствующие заболевания, функциональное состояние основных органов и систем).
Показаниями для проведения аутологичной трансплантации являются:
- Лимфома Ходжкина (лимфогранулематоз), неходжкинские лимфомы — трансплантация проводится при неэффективности стандартной терапии или рецидиве (возврате) заболевания.
- Множественная миелома — проводится как один из основных этапов лечения большинству из впервые выявленных пациентов.
- Острые лейкозы — рассматриваются как противопоказание для аутологичной трансплантации за исключением острого промиелоцитарного лейкоза или в рамках исследовательских протоколов.
- Злокачественные опухоли некроветворной системы — рак яичка, некоторые виды сарком (в частности, саркома Юинга), глиобластома у детей.
- Аутоиммунные заболевания — рассеянный склероз, другие аутоиммунные заболевания нервной системы, системная склеродермия, тимома.
Аллогенная трансплантация — вид трансплантации при котором пересаживают донорские кроветворные клетки (костный мозг, кроветворные стволовые клетки периферической крови, кроветворные клетки пуповинной крови), полностью или частично совместимые по генетическому признаку. Вероятность генетического совпадения схожести кроветворной ткани родственников составляет не более 25%. Поэтому в последнее время все чаще используется частично совместимые кроветворные клетки доноров не родственников. Поиск неродственного донора осуществляется в регистре доноров костного мозга, в котором подбирается совместимый с пациентом донор. Совместимость определяется после проведения лабораторных тестов, которые определяют генетический профиль тканей донора и пациента, это исследование называется HLA-типирование — антигены тканевой совместимости (human leucocyte antigens). Для исследования достаточно крови донора и реципиента. В Российской федерации имеются два регистра костного мозга: ФГБУ НМИЦ гематологии Минздрава России, г. Москва и ФГБУ Кировский научно-исследовательский институт гематологии и переливания крови ФМБА России, г. Киров.
Показанием для этого вида трансплантации являются:
- Острые лейкозы и отдельные формы хронических лейкозов — в первую и последующие ремиссии.
- Тяжелая апластическая анемия — при отсутствии эффекта от иммуносупрессивной терапии или рецидив после ее проведения.
- Врожденные иммунодефицитные состояния у детей.
- Рецидивы лимфомы после аутологичной трансплантации.
В клинике гематологии и клеточной терапии им. А.А. Максимова ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России выполняется более 200 различных видов трансплантаций кроветворных стволовых клеток. Коллектив клиники, ежедневно заботясь о здоровье пациентов, искренне верит, что трансплантация периферических стволовых кроветворных клеток — это путь к Вашему выздоровлению.
© 2022 ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. Использование материалов сайта полностью или частично без письменного разрешения строго запрещено.
Трансплантация костного мозга и стволовых клеток
Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
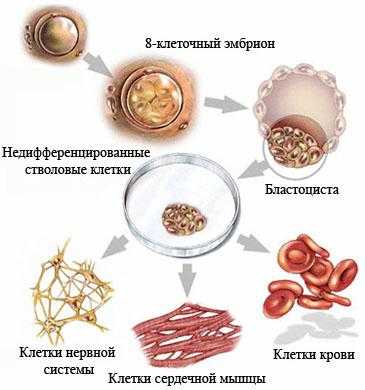
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
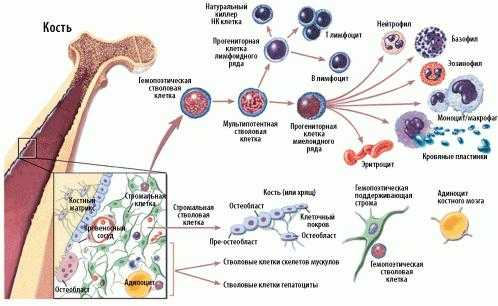
Схема кроветворения и дифференцировки стволовых клеток
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 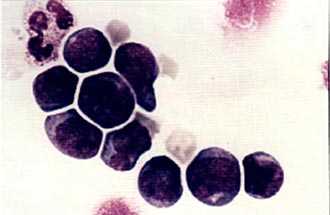 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
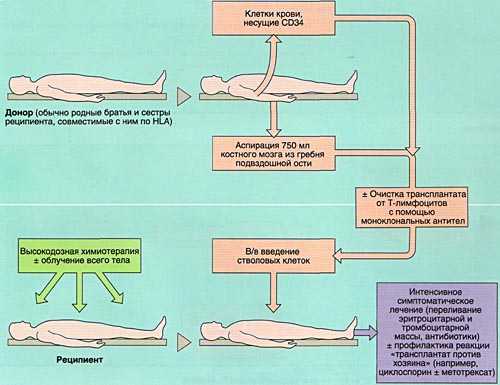
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
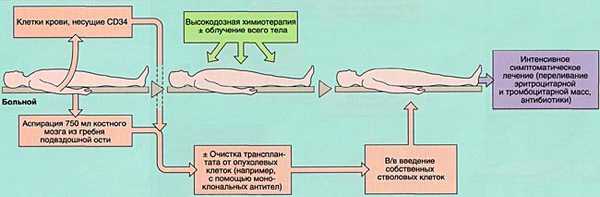
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Сепаратор клеток крови
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
 А) |  Б) |
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.

Инфузия костного мозга пациенту
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
«Родная кровь»: ликбез по ТКМ
Чаще всего словосочетание «трансплантация костного мозга» (точнее, трансплантация гемопоэтических, или кроветворных, стволовых клеток) встречается в связи со сбором средств на поиск и активацию неродственного донора этих клеток.
Наш фонд также собирает деньги на лекарства, которые нужны до или после трансплантации, на наборы для очистки трансплантата или системы для фотофереза.
В общем, хоть сама процедура трансплантации и оплачивается государством, некоторые ее части — то, без чего она не могла бы состояться или была бы связана с риском тяжелых осложнений, — не входят в стоимость квоты. Кроме того, постоянно появляются новые трансплантационные технологии и новые лекарства. А включить что-нибудь новое «в счет» государству — дело по определению небыстрое. Поэтому практически ни одна пересадка не обходится без благотворительной помощи. И если вы хотите разобраться, на что же именно идут пожертвования с назначением «на проект ТКМ», наш ликбез «Родная кровь» — для вас.
Существует два вида трансплантаций гемопоэтических стволовых клеток — аутологичная и аллогенная. При аутологичной у пациента берут его собственные клетки, замораживают, дают больному высокие дозы химиотерапии и затем возвращают клетки обратно. «Аутологичная пересадка с точки зрения трансплантолога — вообще не трансплантация, — говорит Михаил Масчан, врач-гематолог, зам. директора НМИЦ ДГОИ им. Дмитрия Рогачёва. — Потому что там нет никаких иммунологических реакций, никакого донора там нет. Весь смысл аутопересадки в том, что клетки костного мозга очень чувствительны к химиотерапии, и есть такие дозы химиотерапии, которые можно дать, только защитив клетки костного мозга. Мы их и защищаем — в холодильнике. А потом возвращаем пациенту. Есть опухоли, при которых эта добавка в дозе химиотерапии увеличивает шансы на выздоровление». С точки зрения сбора средств ауто-ТКМ тоже обычно не представляет интереса, так как практически все связанные с ней расходы оплачиваются государством.
Второй вид трансплантации — аллогенная, при которой клетки берут у донора и пересаживают пациенту. «Аллогенная пересадка — это всегда вопрос спасения жизни, — продолжает Михаил Масчан. — Это очень дорогая процедура с большими рисками для пациента, и без абсолютной уверенности, что это необходимо, ее не делают. Лечебный эффект аллогенных ТКМ складывается из двух вещей: это высокие дозы химиотерапии и иммунологическая реакция, которая появляется в результате замены костного мозга пациента на донорский».
Именно аллогенные пересадки имеются в виду, когда мы говорим о «трансплантации костного мозга» и о сборе средств на нее. ТКМ применяются при двух больших группах болезней — это опухоли, такие как лейкозы, и это врожденные болезни крови и первичные иммунодефициты, такие, например, как тяжелая комбинированная иммунная недостаточность.
Как проходит трансплантация костного мозга? «Сначала, примерно за семь дней перед пересадкой, проводится химиотерапия, — рассказывает Михаил Масчан. — Она называется кондиционированием. Потом день, когда мы переливаем собственно клетки донора, это похоже на обычное переливание крови. Потом проходит примерно три недели до того момента, когда приживаются донорские клетки, появляются лейкоциты, и мы говорим: да, трансплантат прижился. Потом проходит еще примерно 4-12 месяцев, за которые иммунная система восстанавливается.
Гемопоэтические стволовые клетки (ГСК)
Дело в том, что после пересадки вся иммунная система заменяется на донорскую целиком. И вот замена иммунной системы — это долгий и постепенный процесс. И когда мы говорим «мы сделаем пересадку», мы имеем в виду не сам этот день пересадки, и даже не тот кусочек, когда прижился костный мозг, а вот это все — этот период от четырех месяцев до года, после которого иммунная система восстановилась и мы фактически считаем, что пациент может возвращаться к обычной жизни. Делать заново прививки от детских инфекций, идти в школу, на работу».
В зависимости от того, кто становится донором, аллогенные трансплантации бывают трех видов: от совместимого родственного, от совместимого неродственного и от не полностью совместимого родственного донора. История ТКМ и в мире, и в России началась с пересадок от совместимых родственных доноров.
Этап 1. Пересадки от совместимых родственных доноров
Трансплантации костного мозга стали проводиться в России еще в 90-е годы XX века. Первые трансплантации были проведены в Российской детской клинической больнице в Москве и в Санкт-Петербургском ГМУ им. Павлова четверть века назад, и тогда же появились первые дети, спасенные с их помощью. При этом в те годы донорами чаще всего становились братья и сестры больных детей.
Почему? Дело в том, что ТКМ связана с риском серьезных осложнений. И одно из самых грозных — реакция «трансплантат против хозяина» (РТПХ), конфликт между донорскими иммунными клетками и организмом больного. Ведь при трансплантации пациент получает иммунную систему донора, для которой его собственные клетки являются чужими.
Тяжелые формы РТПХ часто приводят к гибели больного или к тяжелой инвалидности. Чтобы снизить риск осложнений, донора подбирают по принципу так называемой тканевой совместимости: белки и гены, отвечающие за узнавание клеток иммунной системой, у донора и больного должны быть одинаковыми или почти одинаковыми.
Вероятность такого совпадения со «случайно взятым» посторонним человеком очень низка, буквально доли процента, поэтому подбор донора становится серьезной проблемой. А вот для родных братьев и сестер вероятность гораздо выше: согласно законам генетики, каждый родной брат или сестра с вероятностью 25% может оказаться полностью совместимым донором для больного ребенка.
Действительно, многие из таких пересадок проходили удачно. Но получалось, что шанс на пересадку имело, по оценкам врачей, лишь 15% детей: в большинстве российских семей всего 1-2 ребенка, и наличие совместимого донора в семье было большой и редкой удачей…
Этап 2. Пересадки от совместимых неродственных доноров
Поэтому на рубеже девяностых и нулевых годов внимание российских врачей привлекла другая возможность: если в семье нет подходящего донора, можно провести пересадку от **совместимого неродственного донора** В самом деле, если у нас есть данные о многих сотнях тысяч людей, готовых стать донорами костного мозга (гемопоэтических стволовых клеток), среди этих людей с достаточно высокой вероятностью можно выбрать генетически подходящего. Для этого создаются специальные базы данных — регистры потенциальных доноров.
Первая неродственная пересадка была произведена в России в 1997 году и оказалась успешной. Но лишь через несколько лет удалось поставить их «на поток». Ведь в России не было своего регистра доноров костного мозга, и приходилось обращаться в зарубежные, такие как регистр фонда Штефана Морша в Германии. И хотя сам донор отдает свои клетки бесплатно — единственной наградой для него является возможность спасти чужую жизнь, — затраты все равно весьма значительны. Денег стоит и поиск в зарубежном регистре, и углубленные анализы, и обследование донора, и оплата его поездки в клинику, и страховка, и сама процедура взятия клеток, и их транспортировка — словом, всё то, что мы имеем в виду под словами «расходы на поиск и активацию донора». Государство не берет на себя расходы, связанные с зарубежными регистрами, и поэтому пересадки от неродственных доноров и в начале «нулевых» годов, и сейчас зависят в первую очередь от благотворительной поддержки.
В боксе отделения ТКМ
Прошли годы. Пересадки от неродственных доноров стали в России гораздо доступней: они проводятся (по-прежнему при поддержке благотворительных фондов) уже в большем числе клиник. Понемногу формируется и российский донорский регистр: в нем уже десятки тысяч потенциальных доноров — и расходы на их поиск и активацию куда меньше, чем при обращении в зарубежные регистры. Однако с неродственными трансплантациями связаны и существенные ограничения.
Во-первых, это фактор времени. Поиск и активация неродственного донора происходят небыстро, обычно речь идет о нескольких месяцах. Но если у ребенка агрессивный лейкоз и трансплантация нужна срочно, этих нескольких месяцев может просто не быть в запасе. Во-вторых, не всегда удается найти совместимого неродственного донора. Особенно часто это случается, если больной принадлежит к редкой этнической группе — скажем, к одному из народов Кавказа или Крайнего Севера. Но и в других случаях, увы, полной гарантии нет. В-третьих, даже при трансплантации от полностью совместимого неродственного донора риск тяжелых форм РТПХ все же довольно высок. Врачи могут вспомнить немало трагических историй, когда они теряли пациентов именно из-за этого осложнения…
И хотя неродственные пересадки и сейчас играют немалую роль, в детской трансплантологии в последние годы происходит частичный переход к другому подходу — к пересадкам от частично совместимого родственного донора. Они также называются гаплоидентичными трансплантациями или просто гаплотрансплантациями.
Этап 3. Гаплоидентичные трансплантации
Ребенок получает половину генов от отца, а половину — от матери. Это значит, что каждый родитель на 50% генетически совместим со своим ребенком. Казалось бы, этого мало для успешной трансплантации — всегда считалось, что шанс избежать тяжелой РТПХ есть только в случаях, когда степень совместимости близка к 100%. Но в последние годы во многих мировых клиниках разработаны и внедрены технологии, позволяющие производить успешные пересадки даже при половинной совместимости.
Одна из этих технологий с 2012 года используется в Центре детской гематологии имени Дмитрия Рогачева, а сейчас и еще в нескольких отечественных центрах. Это так называемая очистка трансплантата. Суть ее заключается в том, что из клеток, взятых у донора (а это всегда смесь многих разных видов клеток), удаляются именно те, которые и являются главной причиной РТПХ. И только после этого «очищенная» смесь клеток вводится больному.
Долгое время врачи волновались, насколько эффективной будет эта технология. Не приведет ли ее использование, например, к росту числа рецидивов лейкоза после пересадки? Или к другим проблемам?
К счастью, опасения не оправдались. При остром лимфобластном лейкозе число рецидивов не увеличилось, а при пересадках пациентов с острым миелоидным лейкозом даже заметно уменьшилось! С инфекционными осложнениями тоже научились бороться. Есть и другие преимущества: сократилось среднее время приживления трансплантата. Но главное – что тяжелые формы РТПХ действительно стали встречаться намного реже.
Применение гаплоидентичных трансплантаций позволило решить две важнейшие проблемы: доступности донора и срочности пересадки. В самом деле, почти у каждого пациента кто-то из родителей может быть донором. Или если не родители, то другие родственники, наполовину совместимые с ним: братья и сестры (здесь вероятность половинного совпадения — 50%), иногда дяди и тети. Родители всегда рядом и всегда готовы поделиться клетками, чтобы спасти сына или дочь. Не надо тратить драгоценные месяцы на поиск другого донора. И сейчас, например, в Центре детской гематологии при острых лейкозах проводятся почти исключительно гаплоидентичные трансплантации, если, конечно, в семье нет полностью совместимого донора.
Тем не менее неродственные трансплантации по-прежнему сохраняют свою значимость, и не только у взрослых (для которых гаплотрансплантация часто является не лучшим вариантом из-за слишком медленного восстановления иммунитета), но и у детей, в том числе в Центре детской гематологии. Во-первых, они широко применяются при незлокачественных заболеваниях, таких, например, как первичные иммунодефициты. Во-вторых, иногда бывает так, что подходящих родственных доноров у ребенка нет — например, если он сирота.
Куда уходят деньги
Значительная часть расходов на трансплантацию покрывается за счет государственной квоты. Но, к сожалению, не все. В этом смысле дешевле всего в качестве доноров обходятся совместимые братья и сестры. Строго говоря, при наличии квот на ТКМ (а если точнее, финансирования по госзаданию) активация совместимых родственных доноров не стоит благотворителям ничего. Правда, квоты в российских больницах имеют тенденцию заканчиваться, и тогда активация обходится в сумму от 150 до 400 тысяч рублей.
При неродственных трансплантациях необходимо оплачивать поиск и активацию донора в зарубежных регистрах — ведь в российском регистре пока удается найти доноров лишь небольшому числу пациентов. Получается очень значительная сумма: от 1,6 (в обычных случаях) до 3 миллионов рублей (если донор, например, найден не в Европе, а в Америке или Японии).
При гаплоидентичных трансплантациях расходов на поиск и активацию нет, но есть другие — на очистку трансплантата. Разделение смеси клеток – сложная процедура, требующая не только специального оборудования, но и использования дорогостоящих реактивов и расходных материалов. С учетом расходов на их покупку процедура очистки может стоить от 800 тысяч до 1 млн 400 тысяч рублей. Это, безусловно, тоже немало, но все же в два раза меньше, чем затраты на неродственные ТКМ. Другой, не менее важный фактор (в том числе и с финансовой точки зрения) — пациенты после таких трансплантаций быстрее восстанавливаются, им нужно меньше переливаний крови, они быстрее выписываются из больницы и гораздо реже, чем когда-то, возвращаются туда с тяжелыми осложнениями, требующими многомесячной терапии. Но главное — гаплоидентичные трансплантации с применением очистки ежегодно дарят здоровье и благополучие десяткам детей, и это не измеришь никакими деньгами.
Читайте также:
- Детренированность при длительном действии невесомости. Глубоководные погружения
- Классификация недержания кала. Ночной энкомпрез.
- Колоноскопия у беременных и кормящих матерей. Показания
- Влияние операций на желудке, кровотечений из язвы на синтез стероидов, уропепсиногена
- Перикоронит: причины, симптомы и лечение
