Погружения с применением гелиево-кислородных смесей. Декомпрессия при применении гелиево-кислородных смесей
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Реферат
КЛЮЧЕВЫЕ СЛОВА: пневмония, гелий, гелиокс, сатурация, SpO2, кашель, взрослые, метаанализ, систематический обзор
Поступила: 16.02.2022
Принята к печати: 11.03.2022
Дата онлайн-публикации: 29.04.2022
Читать статью в PDF
Введение
Гелий является инертным газом с меньшей плотностью, чем воздух, поэтому поток гелия через дыхательные пути менее турбулентный. Это приводит к снижению сопротивления, позволяя газу лучше проникать через суженные бронхи, а также по каналам Ламберта и порам Кона к плохо вентилируемым альвеолам [1–3]. Кислородно-гелиевая смесь (КГС) в эксперименте улучшала транспорт кислорода через альвеолокапиллярную мембрану, а высокий коэффициент диффузии углекислого газа (СО2) способствовал его элиминации [2, 4]. Подогреваемая КГС, достигая респираторной части легких, вызывает длительную гиперемию альвеолярной ткани с увеличением диаметра капилляров в 3–10 раз, что обеспечивает поддержание газообмена [2, 5]. Систематический обзор Beurskens et al. (2015) показал, что и в педиатрических, и во взрослых группах КГС улучшала газообмен, позволяя проводить менее инвазивную вентиляцию в широком спектре моделей, использующих ее различные режимы. Клинические исследования показали снижение работы дыхания при вентиляции КГС с соответствующим повышением рН и снижением уровня PaCO2 по сравнению с вентиляцией кислородно-воздушной смесью [6].
Чаще всего гелий используется для снижения работы дыхания во время обострений бронхиальной астмы, хронической обструктивной болезни легких (ХОБЛ) [7–10]. В литературе большая часть данных о действии КГС была собрана в этих группах пациентов. При остром респираторном дистресс-синдроме (ОРДС) большинство данных о гелиевой вентиляции также получены у педиатрических пациентов, что может быть связано с повышенным сопротивлением дыхательных путей у новорожденных и младенцев по сравнению со взрослыми [11, 12]. Лечение дыхательной недостаточности при пневмонии, вызванной новой коронавирусной инфекцией COVID-19, — пока еще нерешенная проблема, требующая комплексного подхода и разработки новых методов, расширяющих диапазон возможностей современной терапии. Благодаря своим физическим свойствам КГС может улучшить оксигенацию, работу дыхания и, возможно, избежать необходимости интубации и ИВЛ у пациентов с дыхательной недостаточностью [2, 6, 13]. Следует отметить, что проблема использования КГС при лечении взрослых пациентов с вирусной и бактериальной пневмонией освещена недостаточно. Учитывая необходимость ограничения применения ИВЛ, мы изучали, обладает ли КГС терапевтическим потенциалом при пневмониях, обобщив результаты клинических исследований по ее применению у взрослых.
Цель исследования. Для проведения этого систематического обзора был разработан следующий вопрос: «Оказывает ли КГС клинически значимый эффект у взрослых пациентов при пневмониях в качестве адъюванта к традиционной терапии?»
Материалы и методы
Стратегия поиска и критерии отбора
Этот систематический обзор и метаанализ были проведены в соответствии с требованиями отчетности для систематических обзоров и метаанализов (PRISMA — Preferred ReportingItems for Systematic Reviews and Meta-Analyses). Языковое ограничение не устанавливалось.
Критерии включения были предварительно определены с использованием стратегии PICOS (patient, population or problem [P]; intervention [I]; comparison [C]; outcomes [O] and study design [S]), оптимизированной для разработки всех этапов интервенционного систематического обзора и метаанализа (табл. 1). Выработка критериев включения/исключения осуществлялась совместно всеми авторами до начала поиска соответствующих публикаций. Разногласия были разрешены консенсусом.
Таблица 1. Критерии включения в систематический обзор и метаанализ (PICOS)
Table 1. Criteria for inclusion in a systematic review and meta-analysis (PICOS)
PICOS
Критерии включения в систематический обзор и метаанализ
Взрослые пациенты (возраст пациентов ≥ 18 лет) с подтвержденным или предполагаемым диагнозом «пневмония»
Ингаляция КГС, добавленная к традиционной терапии
Сравнение пациентов, которые получали традиционное лечение, с пациентами, которым добавляли ингаляцию КГС к традиционному лечению
Эффективность лечения пневмонии, дыхательной недостаточности, уровень острофазовых ферментов, летальность, длительность нахождения в ОРИТ, стационаре
Проспективное рандомизированное клиническое исследование или проспективное/ретроспективное нерандомизированное клиническое исследование
В систематический обзор и метаанализ включали исследования, в которых были адекватно представлены бинарные и непрерывные данные (наличие среднего значения/медианы; интерквартильного размаха, стандартного отклонения и/или 95%-го доверительного интервала [95% ДИ] для среднего значения). Данные извлекали только из опубликованных работ, связи с авторами не проводилось. С целью увеличения статистической мощности в метаанализ также были включены исследования, рассматривающие использование КГС для лечения ХОБЛ. Это допущение было сделано для тех исследований, в которых исследовались пациенты с обострением ХОБЛ, развитием пневмонии и дыхательной недостаточности. Педиатрические популяции были исключены для минимизации неоднородности.
К критериям исключения были отнесены: низкодоказательный дизайн исследования (тезисы конференций, протоколы заседаний, клинические случаи и серии случаев, технические статьи, рекомендации); исследования на животных. Следует отметить, что количество включенных в исследования пациентов не являлось определяющим фактором отбора.
Поисковый запрос в базе данных PubMed: (helium) OR (heliox) OR (helium-oxygen mixture)) AND ((pneumonia) OR (lung inflammation)).
Для поиска в базе данных Google Scholar использовали запрос: helium, heliox, helium-oxygen mixture, pneumonia, lung inflammation.
Последний поиск производился 23 января 2022 г.
Извлечение данных и оценка качества
Все найденные цитаты были импортированы в базу данных, удаление дубликатов статей было выполнено вручную. После исключения дубликатов названия и тезисы были проанализированы на предмет соответствия цели систематического анализа. После исключения публикаций, не соответствующих цели исследования, были отобраны 37 статей. Для них производили поиск и анализ полного текста на соответствие установленным критериям включения и исключения. После поиска литературы по вышеописанной методике были отобраны 10 публикаций, соответствующие критериям включения. Из исследований были извлечены основные данные, включая информацию о стране, годе, характеристиках участников (размер выборки и возраст), используемой КГС, проведенном лечении, результатах и статистическом анализе.
Оценка методологического качества отобранных рандомизированных исследований проводилась с использованием критериев руководства Кокрейновского сообщества с помощью программного обеспечения Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020). Согласно вышеупомянутым критериям, рандомизированные клинические исследования (РКИ) изучались помощью контрольного списка из 5 ключевых пунктов (RoB 2 (Risk-Of-Bias 2)): 1) предвзятость, возникающая в результате процесса рандомизации; 2) предвзятость из-за отклонений от запланированных вмешательств; 3) предвзятость из-за отсутствия данных о результатах; 4) предвзятость в оценке результата; 5) предвзятость в отчетности. Для нерандомизированного клинического исследования (неРКИ) контрольный список состоял из 7 ключевых пунктов (ROBINS-I (Risk Of Bias In Non-randomized Studies I)): 1) предвзятость конфаундинга; 2) ошибка отбора участников исследования; 3) ошибка классификации воздействий; 4) предвзятость, связанная с отклонением от намеченного вмешательства; 5) ошибка пропуска данных; 6) предвзятость из-за ошибки измерения результатов; 7) предвзятость в представлении результатов [14]. Для каждого исследования оценивали риск предвзятости; общая оценка определялась как высокий, низкий или неопределенный риск для всех включенных исследований.
В метаанализ были включены исследования, которые рассматривались как имеющие «низкий» или «неопределенный» риск предвзятости. Исследования, которые имели высокий риск предвзятости на основании вышеупомянутых критериев и/или не имели достаточного данных для количественного анализа, были исключены из метаанализа.
Все оценки, включая поиск, отбор исследований, извлечение и оценку качества данных, были выполнены независимо двумя авторами и проверены третьим автором в случае разногласий. Разногласия были разрешены консенсусом.
Первичной конечной точкой стала летальность за период стационарного лечения. Вторичными конечными точками явились влияние КГС на уровень SpO2, скорость восстановления SpO2, частота перевода на ИВЛ, длительность нахождения в ОРИТ, длительность госпитализации, длительность кашля, уровень С-реактивного белка (СРБ), ферритина, D-димеров.
Размеры эффектов
Для каждой метааналитической модели мы использовали d-критерий Коэна (Cohen’s d) и его стандартную ошибку (SD). Эффекты были взвешены по обратной дисперсии ошибок внутри Cohen’s d для каждого исследования. Размеры эффекта d ~ 0,20; ~ 0,50 и ~ 0,80 рассматривались как малые, средние и большие эффекты соответственно [15].
Достоверность доказательств эффектов, обнаруженных в метаанализе, была оценена с использованием подхода GRADE (Grading of Recommendations Assessment, Development and Evaluation) — системы классификации, оценки, разработки и экспертизы рекомендаций [16]. Качество оценивалось как high (высокое), moderate (умеренное), low (низкое) или very low (очень низкое) в соответствии с критериями GRADE. Сводная таблица результатов была построена с использованием онлайн-программы GRADEpro GDT.
Статистический анализ
Статистическая обработка данных выполнялась в программе Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020).
Метаанализ бинарных данных производился на основании разности эффектов в виде отношения шансов (ОШ) с 95% ДИ. Метаанализ непрерывных данных выполнялся на основании разности средних значений показателей (MD, mean difference) в исследуемой и контрольной группах. Он проводился с использованием средних значений, стандартных отклонений и числа исследуемых. В случае неизвестного стандартного отклонения его расчет выполнялся с помощью инструментов программы RevMan 5.4.1 по известным среднему значению и 95% ДИ. Метаанализ непрерывных данных, представленных в различных единицах измерения, выполнялся на основании стандартизированной разности средних (SMD, standardized mean difference).
Результаты метаанализа представлялись в виде листовидного графика (forest plot). Оценка статистической гетерогенности выполнялась с использованием критерия хи-квадрат Пирсона (χ 2 ) и индекса гетерогенности I 2 . Метаанализ проводился с использованием следующих моделей: модели случайных эффектов (Random (Rnd)) в случае обнаружения статистически значимой гетерогенности в исследованиях (I 2 > 40) и модели фиксированного эффекта (Fixed) при отсутствии статистически значимой гетерогенности (р ≥ 0,10 в тесте χ 2 и I 2 ≤ 40). В случае если р ≥ 0,10, но I 2 > 40, то при выборе математической модели метаанализа принимались во внимание результаты оценки статистической гетерогенности согласно тесту χ 2 [метод обратной дисперсии (IV, inverse variance)].
Результаты исследования
Результаты поиска и характеристики исследований
Рис. 1. Блок-схема отбора литературы в соответствии с принципами PRISMA
Fig. 1. Flowchart of literature selection according to PRISMA principles
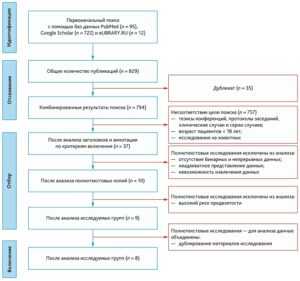
Причиной развития пневмонии в 6 исследованиях явилась коронавирусная инфекция [17–22], в работе Красновского А.Л. и соавт. авторы исследовали внебольничную пневмонию [5], а в работах Jolliet Р. (2003, 2017) [23, 24] и Мaggiore S. [25] пневмония и дыхательная недостаточность были осложнением ХОБЛ.
Респираторная поддержка при включении пациентов в отобранные исследования была различной. В работах Соколовой О.П. и соавт. (2021) [22], Лахина Р.Е. и соавт. (2021) [20], Мануйлова В.М. и соавт. (2021) [19], Красновского А.Л. и соавт. (2013) [5], Варфоломеева С.Д. и соавт. (2021) [19], Петрикова С.С. и соавт. (2020) [17], Шогеновой Л.В. и соавт. (2020) [18] пациенты находились на самостоятельном дыхании. В исследованиях Jolliet Р. et al. (2003, 2017) [23, 24], Мaggiore S. et al. [25] пациентам проводили неинвазивную вентиляцию легких.
Оборудование и методика использования КГС отличались. В работе Jolliet Р. et al. (2003) газовую смесь (78 % гелий, 22 % кислород) вводили путем подсоединения 50-литрового баллона, содержащего смесь под давлением 150 бар, подаваемую через регулятор давления 6 бар непосредственно во входное отверстие вентилятора, обычно используемое для подачи воздуха. Вентиляцию легких пациентов в этом исследовании проводили с помощью Veolar FT (Hamilton Medical, Rhäzuns, Switzerland) и Servo 300 (Siemens-Elema, Solna, Sweden). Длительность ингаляции КГС составляла 30 мин [23]. В исследовании Jolliet Р. et al. (2017) газовую смесь (78 % гелий, 22 % кислород) вводили через ороназальную маску для неинвазивной вентиляции аппаратом искусственной вентиляции легких Hamilton-G5 с опцией Heliox (Hamilton Medical AG, Bonaduz, Switzerland). Если неинвазивная вентиляция не проводилась, то ингаляцию КГС проводили с помощью лицевой маски ручным аппаратом (Pulmanex Hi-OX80; Cardinal Health, Dublin, Ohio), используя специально разработанный смеситель (SentryHe/O2; Cardinal Health). Длительность ингаляции КГС составляла 30 мин [24]. В работе Maggiore S. et al. пациентов вентилировали с помощью PB760 (Tyco Health care, Puritan Bennett, Pleasanton) газовой смесью (65 % гелий, 35 % кислород), которую подводили путем подсоединения 50-литрового баллона, содержащего смесь под давлением 150 бар, непосредственно во входное отверстие вентилятора, обычно используемое для подачи воздуха. Каждый сеанс ингаляции КГС длился от 30 мин до 3 ч в зависимости от клинической реакции, параметров газов крови и переносимости пациентом [25]. В публикации Красновского А.Л. и соавт. (2013) ингаляцию газовой смеси (77 % гелий, 23 % кислород) проводили на аппарате «Ингалит-В» (ЗАО «Специализированное конструкторское бюро экспериментального оборудования при Институте медико-биологических проблем Российской академии наук», РФ) трехинтервальной методикой (5 мин ингаляции, 5 мин отдыха); 1 процедура в день в течение 7 дней [5]. В исследованиях Соколовой О.П. и соавт. (2021) [22], Лахина Р.Е. и соавт. (2021) [20], Мануйлова В.М. и соавт. (2021) [21] ингаляции на самостоятельном дыхании проводили с помощью ингалятора «Ингалит-В2-01» (ЗАО «Специализированное конструкторское бюро экспериментального оборудования при Институте медико-биологических проблем Российской академии наук», РФ) подогретой КГС (70 % гелий, 30 % кислород). Продолжительность курса в работе Соколовой О.П. и соавт. (2021) [20] составила 7 дней, частота ингаляций — 3 раза/сут по 10 мин; в публикации Лахина Р.Е. и соавт. (2021) [18] — по 10 мин 4 раза/сут в течение 7 дней; в исследовании Мануйлова В.М. и соавт. (2021) [21] ингаляцию КГС проводили трехинтервальной методикой (5 мин ингаляции, 5 мин отдыха); время ингаляции могло увеличиваться до 10 мин с сохранением 5-минутных интервалов отдыха, частота ингаляций — до 4 раз/сут. В работе Варфоломеева С.Д. и соавт. (2021) методика ингаляции не указана, есть только название аппарата «Гелиокс Экстрим» (ООО «Медтехинновации») [19]. В работах Петрикова С.С. и соавт. (2020) [17], Шогеновой Л.В. и соавт. (2020) [18] ингаляцию газовой смесью выполняли на аппарате «Гелиокс Экстрим» (ООО «Медтехинновации»), куда раздельно подавались кислород и гелий. В аппарате происходило смешивание этих газов, затем КГС подавалась через термистор аппарата, к которому были подсоединены клапан выдоха и лицевая маска. Длительность однократной ингаляции — не менее 7–10 мин в зависимости от состояния пациента, общая длительность всех ингаляций — до 60 мин в сутки в течение 10 дней. Концентрация гелия и кислорода подбиралась индивидуально каждому пациенту в пределах 50–79 % (гелий) и 21–50 % (кислород) для поддержания SpO2 в пределах 97–99 %.
Температурный режим ингаляции был описан почти во всех исследованиях. В работах Петрикова С.С. и соавт. (2020) [17], Шогеновой Л.В. и соавт. (2020) [18] указано, что выбор температурного режима также осуществлялся индивидуально в пределах 75–100 °С. В работе Лахина Р.Е. и соавт. (2021) [20] нагрев смеси производился до 80 °С. В статье Красновского А.Л. и соавт. (2013) [5] указано, что нагретая газовая смесь подавалась через маску; температура смеси составляла 40 °С. В исследовании Мануйлова В.М. и соавт. (2021) [21] газовую смесь нагревали до 95 °С. В публикации Варфоломеева С.Д. и соавт. (2021) [19] сказано, что подавалась высокотемпературная газовая смесь. В остальных публикациях температурный регламент не указывался. Общая характеристика исследований представлена в табл. 2.
Погружения с применением гелиево-кислородных смесей. Декомпрессия при применении гелиево-кислородных смесей
Терапия болезни декомпрессии после кратковременного погружения. Лечение болезни декомпрессии после экскурсионного погружения
Приведенные ниже лечебные режимы основаны на рекомендациях Европейского общества специалистов по подводной биомедицине и Британской ассоциации водолазных котрагентов и постоянно находятся под надзором Британского консультативного комитета по подводной медицине.
Если болезнь декомпрессии началась при нахождении на поверхности, то пострадавший должен дышать кислородом, начиная с момента пребывания на поверхности и на протяжении компрессии до глубины 18 м. В том случае, если к 10 мин пребывания под давлением, эквивалентным глубине 18 м, он полностью выздоровел или его состояние стало лучше, может быть использован обычный режим 6 ВМС США (режим 62 ВМС Великобритании). Если состояние не улучшается, то следует продолжить компрессию с использованием гелиево-кислородной смеси до давления, на котором наступит облегчение.
Если состояние водолаза во время нахождения на поверхности тяжелое, то в целях обеспечения условий для дыхания на глубине рекомендуют компрессию до 18 м проводить сжатым воздухом, а затем до давления, на котором произойдет облегчение состояния, продолжать чистым гелием. При этом парциальное давление кислорода в барокамере следует все время поддерживать около 0,4 кгс/см2.
В случае возникновения болезни декомпрессии во время все еще продолжающейся декомпрессии водолаза после кратковременного подводного погружения с дыханием гелиево-кислородной смесью рекомпрессию пострадавшего проводят до давления, снимающего симптомы; если состояние не облегчается, то до давления, по меньшей мере соответствующего глубине первоначального погружения. Затем водолаза следует выдержать под этим давлением в течение 2 ч или несколько дольше, с последующей декомпрессией в состоянии насыщения.

Лечение болезни декомпрессии после экскурсионного погружения
Приведенные ниже лечебные режимы тоже основаны на рекомендациях Европейского общества специалистов по подводной биомедицине и Британской ассоциации водолазных контрагентов, принятых на встрече в 1976 г., которая в значительной мере была представлена военными и промышленными водолазными врачами из Северной Америки и Европы.
При возникновении болевых симптомов в конечностях во время насыщенной декомпрессии рекомендованное лечение состоит в применении компрессии со скоростью 2 м/мин до глубины, существенно облегчающей боль, но не ниже, чем на 20 м той же глубины, на которой возникли симптомы. Для случаев тяжелой степени болезни декомпрессии, например с вестибулярными нарушениями, Farmer (1977) рекомендует быструю рекомпрессию по крайней мере на 30 м глубже того уровня, на котором появились симптомы.
Для симптоматического облегчения головокружения можно применить диазепам, но только после того, как будет достигнуто максимальное давление рекомпрессии, поскольку в противном случае ориентир в лечении и признаки рецидива могут быть скрыты. На глубине, оказывающей лечебный эффект, можно подать для дыхания богатые кислородом смеси (Ро2 =1,5—2,5 кгс/см2) в виде/6 циклов, продолжительностью по 20 мин каждый.
На этой глубине больного следует выдержать в течение 2—6 ч, а затем провести насыщенную декомпрессию, но без начальной экскурсии вверх.
При лечении болезни декомпрессии, возникающей после экскурсии в условиях насыщенного погружения, Spaur (1979) рекомендует рекомпрессию со скоростью 10 м/мин до глубины,. оказывающей положительный эффект, причем в случае болевых. симптомов в конечностях по крайней мере до 30 м или до глубины экскурсии при наличии тяжелых проявлений заболевания.
Далее рекомендовано выдержать на этом давлении как минимум 12 ч при тяжелых проявлениях заболевания и 2 ч или более (если необходимо достичь полного излечения) при болевых симптомах в конечностях. Как и в изложенных выше ситуациях следует обеспечить для дыхания обогащенные кислородом смеси. С глубины, оказывающей лечебный эффект, не следует проводить начальную экскурсию вверх и лечить симптомы во время декомпрессии с этой глубины.
Лечение проявлений декомпрессионного заболевания, возникающих во время декомпрессии из состояния насыщенного погружения, проводимого на азотно-кислородной смеси, совершенно идентично рассмотренному выше.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Погружения с применением гелиево-кислородных смесей являются несомненно самым распространенным при выполнении промышленных водолазных работ. Однако схемы декомпрессии и их эффективность представляют собой закрытую информацию и редко подвергаются анализу. Как правило, в начальной стадии своего развития, в 60-х годах, режимы декомпрессии при использовании гелия или одновременно у нескольких нейтральных газов были короткими и предусматривали подачу кислорода в больших количествах.
Но в последние годы продолжительность режимов декомпрессии увеличили, а количество кислорода уменьшили, тем самым подчеркнув, что в промышленной отрасли водолазного дела стали больше уделять внимание не скорости декомпрессии, а ее безопасности.
Широко используемым приемом в промышленных водолазных работах является переключение на дыхание с гелиево-кислородной смеси на воздух на глубинах 30—60 м. Такое переключение имеет преимущества, так как способствует экономии гелия, улучшению речевой связи, предотвращает переохлаждение водолаза и ускоряет процесс декомпрессии.
Вместе с тем переключение на дыхание воздухом может вызвать декомпрессионное заболевание внутреннего уха, если его производят на слишком большой глубине или слишком быстро. Momsen в 1942 г. указывал, что непосредственную замену гелиево-кислородной смеси воздухом нельзя проводить на глубине более 49,5 м вследствие развития «неблагоприятных» эффектов; в этих ситуациях допускается постепенная замена газов.

Ряд случаев декомпрессионного заболевания внутреннего уха был описан Hamilton (1976). Самый «мелководный» из них возник после переключения на воздух на глубине 33 м.
Причины данного декомпрессионного заболевания не ясны, так как исследователи, занимающиеся изучением контрдиффузии нейтральных газов, указывали, что переключение дыхания с гелия на азот должно быть скорее благоприятным, чем вредным. Однако после быстрого переключения на дыхание воздухом азот может поступить в кровь и ткани внутреннего уха быстрее, чем гелий покинет газовую полость среднего уха. Поскольку гелий диффундирует быстрее, чем азот, он, вероятно, скорее поступит в ткани внутреннего уха, чем азот успеет диффундировать из него.
В результате ткани внутреннего уха могут стать перенасыщенными газами.
Промышленные водолазные режимы предусматривают как применение подводного колокола, так и декомпрессию после подъема на поверхность и, по-видимому, имеют продолжительность такую же или несколько выше, чем режимы ВМС США, учитывающие парциальное давление газов. Для подводных спусков водолаза на глубины более 120—180 м или с продолжительностью нахождения на грунте более 1—2 ч, как правило, применяют методы насыщения тканей нейтральным газом, поскольку водолазные режимы для менее длительных погружений редко когда удовлетворяют предъявляемым требованиям.
Вероятно, лучше всего состояние проблемы в области методов декомпрессии с использованием искусственных (гелиево-кислородных) дыхательных смесей отражено в докладе на симпозиуме Общества специалистов по подводной медицине «Развитие методов декомпрессии для погружений на глубины, превышающие 120 м» В этой публикации обсуждаются различные используемые методы расчета и показаны различия режимов декомпрессии, рассчитанных на основе этих методов, для погружения водолаза на 150 м с экспозицией на грунте 30 мин.
Азотно-кислородные дыхательные смеси. Гелиево-кислородные дыхательные смеси
В водолазных справочниках ВМС Великобритании и США для использования в автономных подводных дыхательных аппаратах с полузакрытым циклом дыхания предлагаются три азотно-кислородные смеси: 40% N2/60% 02; 60% N2/40%O2 и 67,5% N2/32,5% О2. Однако рабочие характеристики данного снаряжения требуют самостоятельного определения фракционного содержания кислорода во вдыхаемой смеси до того, как. смогут быть применены методы декомпрессии на основе ЭГВ.
В водолазном справочнике Национального управления по-океану и атмосфере США приведены методы декомпрессии на основе ЭГВ для азотно-кислородной дыхательной смеси: (68% N2/32% 02) в автономных подводных дыхательных аппаратах с открытым циклом дыхания. Пределы пребывания под. водой для безостановочной декомпрессии при использовании этой смеси были успешно проверены Dunford и соавт. (1979) в небольших сериях экспериментов.
В справочнике водолаза СССР приведена таблица для азотно-кислородной смеси (60% N2/40% О2) и таблица, в соответствии с которой эту смесь применяют во время нахождения на грунте, а декомпрессию проводят с использованием воздуха. Сравнение этих водолазных таблиц между собой показало, что применение указанной газовой смеси на протяжении всего погружения на 20% укорачивает продолжительность декомпрессии.
Некоторые коммерческие водолазные компании сообщаюг об использовании обогащенного кислородом воздуха, что также значительно сокращает продолжительность декомпрессии, однако широкому кругу специалистов доступны лишь немногие подробности об этих режимах.
Современная разработка автономных подводных дыхательных аппаратов с закрытым циклом дыхания вызвала появление новой формы погружения — погружения с поддержанием постоянного парциального давления кислорода в газовой смеси. Новое снаряжение имеет электронную систему регулирования, обеспечивающую постоянное парциальное давление кислорода,, близкое к предопределенной установочной величине и независимое от глубины.
Режимы декомпрессии водолазов в данном снаряжении были проверены при установочных величинах давления кислорода 0,7 и 1,4 кгс/см2.

Гелиево-кислородные дыхательные смеси
Впервые гелий был применен в 20-х годах нашего столетия во время экспериментальных погружений, проводимых специалистами ВМС США и Великобритании. Эти эксперименты привели во многих случаях к развитию болезни декомпрессии, потому что при расчете режимов декомпрессии полагали, что гелий и азот вызывают образование газовых пузырьков независимо. друг от друга. Эксперименты были прекращены, так как создалось впечатление, что гелий не может быть приемлемым газом в водолазной практике.
Эксперименты с гелием были возобновлены в 30-х годах, когда End в 1938 г. продемонстрировал осуществимость погружений водолазов с использованием гелиево-кислородной смеси на глубины до 120 м, и когда в ВМС США была разработана первая водолазная таблица, в которой учитывались парциальные давления гелия. Указанный в таблице режим декомпрессии начинался с дыхания кислородом на глубине 18 м с окончательной декомпрессионной остановкой на уровне 15 м перед подъемом на поверхность. Декомпрессия могла быть проведена в воде, в подводной барокамере или после подъема на поверхность.
В водолазном справочнике ВМС США представлены также таблицы, предназначенные для погружений с автономными подводными дыхательными аппаратами, имеющими полузакрытый цикл дыхания. Эти таблицы, приводящие кислородный режим и режимы для повторных погружений, существенно короче, чем таблица, учитывающая парциальные давления гелия. При их разработке было замечено, что использование гелиево-кислородной смеси требует более глубоководной первой декомпрессионной остановки, чем это необходимо, согласно режимам декомпрессии с дыханием воздухом.
В ранних водолазных режимах ВМС Великобритании при использовании гелиево-кислородных смесей предусматривали переключение дыхания на воздух на первой декомпрессионной остановке, происходившей на глубине 60 м в подводной декомпрессионной барокамере. Кислород подавали на глубине 18 м. В более поздних режимах воздух не применяли, а глубину, на которой давали кислород, уменьшили. Некоторые из указанных режимов вполне удовлетворяли погружениям с короткой продолжительностью пребывания на «грунте», проводимым в барокамерах.
Вместе с тем Hempleman, Trotter, проводя в 1967 г. исследования, не выразили удовлетворения результатами применения вышеупомянутых режимов в длительных погружениях в барокамерах, а также при проведении экспериментов в открытом море.
- Вернуться в оглавление раздела "Физиология человека."
Гелиево-кислородные смеси в терапии декомпрессионной болезни. Режимы декомпрессии после насыщения нейтральными газами
Развитие на протяжении этих же десятилетий в военно-морском флоте и промышленной сфере глубоководных погружений с применением гелиево-кислородных смесей было связано с появлением отдельных больных с декомпрессионными нарушениями, у которых обычное лечение с относительно неглубокой (до 50 м) рекомпрессией являлось неадекватным.
Как правило, незамедлительная рекомпрессия сжатым воздухом при появлении симптомов на поверхности после глубоководного кратковременного погружения с использованием гелия была эффективной. Вместе с тем бывали исключения не только в виде стойких неврологических симптомов, но и, правда очень редко, случаи парадоксального ухудшения состояния пострадавшего по мере лечебного погружения.
Одним из объяснений такого явления считали высвобождение из сосудов легких газовых пузырьков, сжавшихся под давлением. Другое объяснение может быть дано на основе относительной динамики контрдиффузии азота и гелия.
Однако быстрая и глубоководная рекомпрессия при использовании гелиево-кислородной смеси являлась эффективной и была на самом деле единственным выходом из создавшегося положения у тех пострадавших, у которых симптомы начинали появляться на глубине более 50 м. При этом обычный лечебный режим был непригоден. После достижения глубины, на которой наступало облегчение, и соответствующей остановки на ней единственная проблема состояла в поиске безопасного пути возвращения на поверхность.
Методом проб и ошибок, наблюдая за отсутствием рецидивов или ухудшением состояния пострадавших, Barnard в 1967 г. предложил практическое решение проблемы. С того времени на основании приобретенного опыта были разработаны режимы декомпрессии после подводных погружений методом насыщения тканей организма нейтральным газом и доказана также их достаточная степень пригодности для использования при возвращении пострадавшего в атмосфере сжатого воздуха к условиям нормального давления: например, режим 72 ВМС Великобритании.

В связи с тем что лечение компрессией было таким успешным и выдержало испытание временем, проверочные исследования и эксперименты с участием испытуемых фактически не проводились. Подобно наглядности эффективности прямого приложения давления в случае кровотечения из артерии терапевтическая ценность рекомпрессии настолько очевидна, что не требует дополнительного доказательства своей эффективности.
Поэтому исследования, которые были проведены, в основном заключались в поиске наилучших методов рекомпрессии и были направлены на: установление максимального давления, которое следует применять; определение продолжительности нахождения под максимальным давлением; выбор дыхательной газовой смеси во время проведения лечения; целесообразность применения вспомогательной инфузионной и фармацевтической терапии; определение режима безопасной декомпрессии водолаза до атмосферного давления после завершения пребывания на «терапевтической» глубине.
Эта декомпрессия не является составной частью лечения, но она неизбежна. Приведенные статистические данные теперь хорошо знакомы каждому врачу — специалисту по подводной медицине. Незамедлительное лечение в соответствии с любым из регламентированных и применяемых во всем мире методов, как правило, дает хороший результат. Промедление между началом появления жалоб или объективных признаков заболевания и назначением компрессионной терапии — грозный фактор, уменьшающий вероятность полного излечения.
Также совершенно ясно, что механизмы болезни декомпрессии и газовой эмболии артерий гораздо более сложны, чем первоначально полагали. Например, проведенные исследования поверхностной активности внутрисосудистых газовых пузырьков, спинномозговой формы болезни декомпрессии, перфузии тканей и гемодинамики дали дополнительную информацию в отношении лечения болезни декомпрессии.
С клинических позиций следует признать, что с образованием в кровеносной системе газа на границе между поверхностью пузырька и кровью происходит активация механизмов коагуляции. Гипоксия, возникающая в результате нарушения функции капилляров, за короткий промежуток времени приводит к явлениям отека в ЦНС. Следовательно, заболевание, начавшееся с появления в крови газа и которое следовало бы немедленно лечить, становиться: очень тяжелым и трудноизлечимым в результате несвоевременного оказания помощи.
Но несмотря на это, даже после задержки лечения на много часов около 80% пострадавших с болевыми симптомами в конечностях, неврологической или респираторной формами болезни декомпрессии еще положительно реагируют на рекомпрессию и увеличенное парциальное давление кислорода во вдыхаемой газовой смеси, в сочетании с дополнительными лечебными мерами.
Читайте также:
