Показания для ограниченного артродеза при болезни Мюллера-Вайсса
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
а) Положение пациента:
- Пациент укладывается в положение на спине с валиком под тазобедренным суставом на стороне операции
- На бедро накладывается турникет
б) Техника операции:

Рисунок 4
1 этап:
- Операция выполняется в условиях общей анестезии и регионарного подколенного блока
- На протяжении всей операции используется С-дуга
- Очень эффективно использование налобной лупы
- Разморозьте свежезамороженный трикортикальный костный аллотрансплантат
- Выполните тыльный доступ к таранно-ладьевидному и ладьевидно-клиновидным суставам (рис. 4)
- Выделите и защитите ветви поверхностного малоберцового нерва
- Доступ к суставам осуществляется между сухожилиями передней большеберцовой мышцы и длинного разгибателя первого пальца. Кожный разрез должен быть достаточно протяженным, чтобы обеспечивать доступ к дистальной части шейки таранной кости и межклиновидному суставу между первой и второй клиновидными костями. Глубокий малоберцовый нерв и тыльная артерия стопы отводятся латерально
- Флюороскопический контроль ладьевидной кости с введенной в ее тело спицей Киршнера поможет более точно локализовать интересующие суставы
2 этап:
- Все заинтересованные суставы, в т.ч. ладьевидно-клиновидные и таранно-ладьевидный, обрабатываются для артродезирования
- Суставной хрящ полностью удаляется с помощью костной ложки. С помощью низкоскоростного бора при постоянном орошении холодной водой до кровоточивости обрабатывается субхондральная кость. Альтернативой бору является тонкое сверло, с помощью которого формируются множественные перфорации суставных поверхностей
- Небольшие некротизированные фрагменты ладьевидной кости можно удалить, однако при аккуратном дебридменте большую часть тела ладьевидной кости обычно удается сохранить, даже если оно фрагментировано
Рисунок 5
3 этап:
- С помощью сагиттальной пилы при постоянном орошении холодной водой формируется паз для костного трансплантата (рис. 5)
- Любая имеющаяся деформация должна быть устранена, а длина медиальной колонны сохранена
- Формируемый паз должен иметь ширину, достаточную для того, чтобы вместить трикортикальный костный трансплантат
- Паз должен на 0,5 см заходить в головку таранной кости и на 0,5 см в первый межклиновидный сустав
- В глубину паз должен достигать подошвенной поверхности ладьевидной кости, при этом ее подошвенная кортикальная пластинка должна оставаться интактной
Нюансы 3 этапа операции:
• Подумайте о такой операции, как таранно-клиновидный артродез. Фрагментированная ладьевидная кость в таком случае выступает как промежуточный трансплантат, а длина медиальной колонны определяется длиной аллотрансплантата
Спорные моменты 3 этапа операции:
• Возможно использование аутотрансплантата из гребня подвздошной кости, однако преимуществ его перед свежезамороженным аллотрансплантатом не выявлено
• В данной методике описывается использование свежезамороженного трансплантата из гребня подвздошной кости, однако возможны и другие варианты
Рисунок 6 Рисунок 7 Рисунок 8 Рисунок 9
4 этап:
- Ширину свежезамороженного трансплантата можно уменьшить с помощью Сагиттальной пилы, опять же при постоянном орошении холодной водой. Стенки трансплантата для стимуляции прорастания сюда костной ткани перфорируются сверлом (рис. 6)
- Другим вариантом может быть рассечение трансплантата на две части и установка его спонгиозными поверхностями наружу (рис. 7)
- С помощью молотка и импактора установите трансплантат в подготовленный для него паз (рис. 8)
- Выполните забор аутотрансплантата из проксимальной части большеберцовой, кости пациента
- Полученную губчатую костную крошку уложите вокруг аллотрансплантата и заполните его внутренние и наружные отделы таранно-ладьевидного и ладьевидно-клиновидных суставов (рис. 9)
Нюансы 4 этапа операции:
• Трансплантат из гребня подвздошной кости должен иметь достаточную длину и устанавливаться в подготовленный для него паз пресс-фит
• Коррекция имеющейся деформации и сохранение длины медиальной колонны стопы обязательны
• При установке трансплантата старайтесь сохранить достигнутую коррекцию
Ошибки 4 этапа операции:
• Укорочение медиальной колонны
• Недостаточность или отсутствие коррекции сагиттального коллапса медиальной колонны
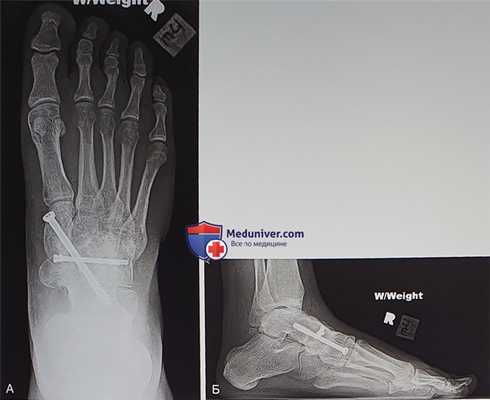
Рисунок 10
5 этап:
- Существует несколько вариантов фиксации трансплантата. Несколько 4,0 мм винтов, проведенных в поперечном направлении, позволят сжать трансплантат между медиальной и латеральной порциями ладьевидной кости и послужат профилактикой продольного расщепления трансплантата. Если ладьевидная кость уже расколота, винты обеспечат ригидную фиксацию ее латеральной и медиальной порций
- Со стороны медиальной клиновидной кости в таранную кость вводится длинный канюлированный винт, обеспечивающий значительную стабильность и компрессию (рис. 10)
- Еще одним вариантом фиксации является использование нескольких небольших винтов и/или пластин. Тыльные пластинки, однако, будут ощущаться под кожей и после формирования костного блока нуждаются в удалении
Нюансы 5 этапа операции:
- При введении винтов удерживайте стопу в положении коррекции. Для сохранения достигнутого положения возможна временная фиксация спицами
- Не выполняйте компрессию во время введения винтов. Длина медиальной колонны должна быть сохранена
Показания для ограниченного артродеза при болезни Мюллера-Вайсса
а) Показания:
- Крайняя стадия болезни Мюллера-Вайсса (рис. 1), характеризующаяся:
• Клинически выраженными дегенеративными изменениями
• Прогрессирующей дестабилизацией стопы
- Вторичная перитаранная боль и боль в среднем отделе стопы, связанная с дестабилизацией таранной кости
- Утрата нейтрального положения стопы, которую нельзя компенсировать модификацией используемой обуви
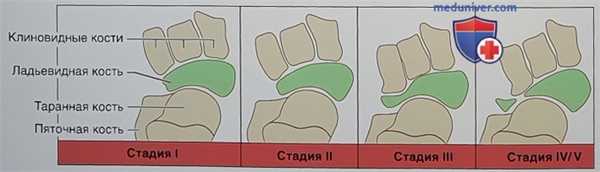
Рисунок 1
Ошибки при выборе показаний:
• Нейроартропатия Шарко
• Артродез таранно-ладьевидного сустава в неправильном положении
Спорные моменты:
• Залогом успешного результата операции, т.е. формирования опорной и стабильной стопы, являются:
• Оптимальное позиционирование таранной кости относительно пяточной, т.е. коррекции варусной установки заднего отдела стопы
• Восстановление положения таранно-ладьевидного сустава в сагиттальной и горизонтальной плоскостях и тем самым - восстановление анатомии ладьевидно-клиновидных и предплюсне-плюсневых суставов
• В большинстве случаев для этого достаточно изолированного таранно-ладьевидного артродеза
б) Обследование и лучевая диагностика:
1. Клиническое обследование:
- Тщательный и полноценный сбор анамнеза и жалоб пациента::
• Проблемы в повседневной жизни и при занятиях спортом
• Боль
• Эффективность ранее проводимых консервативных мероприятий
- Тщательное клиническое обследование:
• Ось заднего Отдела стопы в положении стоя (осмотр сзади, рис. 2, А)
• Ось голеностопного сустава, среднего огдела стопы и переднего отдела стопы (осмотр спереди, рис. 2, Б)
• Болезненный псевдсэкзсстоз на тыльно-латеральной поверхности шопарова сустава
• Объем движений в голеностопном и подтаранном суставах (оценивается в положении сидя)
• Стабильность голеностопного сусава (оценивается в положении сидя со свободно свешенной стопой)
• Выраженность болевых ощущений по визуально-аналоговой шкале от 0 до 10
- Боль обычно локализуется в области наружной части ладьевидной кости (псевдоэкзостоз)
- Перитаранные движения:
• Эверсия/пронация обычно ограничена
• Инверсия/супинация обычно сохранена
Рисунок 2 Рисунок 3 Рисунок 4 Рисунок 5
2. Лучевая диагностика:
- Рентгенограммы обеих стоп и голеностопных суставов в положении стоя в прямой, боковой и осевой проекциях, по которым оцениваются следующие параметры:
• Конфигурация и целостность подтаранного и таранно-ладьевидного суставов
• Коллапс латеральной части ладьевидной кости и наклон остальной ее части медиально (рис. 3)
• Угловая девиация таранной кости во всех горизонтальных плоскостях (например, наружная ротация)
• Наличие дегенеративных изменений голеностопного и подтаранного суставов
- Компьютерная томография, по возможности с нагрузкой, назначается для:
• Оценки конфигурации голеностопного, подтаранного и таранно-ладьевидного с суставов
• Оценки коллапса, дегенеративных изменений и фрагментации латеральной части ладьевидной кости
• Диагностики других костных изменений (рис. 4):
- Магнитно-резонансная томография может назначаться с целью:
• Определения активности аваскулярного некроза латеральной части ладьевидной кости, например, путем оценки наличия и выраженности перифокального отека
• Оценки состояния окружающих мягких тканей:
- Однофотонная эмиссионная компьютерная томография в сочетании с радиоизотопным сканированием может назначаться для:
• Визуализации морфологических изменений и оценки активности процесса в области этих изменений (рис. 5)
в) Варианты лечения:
- Изолированный таранно-ладьевидный артродез
- Трехсуставной артродез
- Расширенный трехсуставной артродез, включающий ладьевидно-клиновидные суставы
г) Хирургическая анатомия:
- При использовании медиального и тыльно-латерального доступов необходимо защитить следующие анатомические структуры:
• Сухожилие задней большеберцовой мышцы, проходящее над медиальным отделом таранно-ладьевидного сустава до своего прикрепления к бугристости ладьевидной кости
• Сухожилие передней большеберцовой мышцы, расположенное над дорзомедиальной частью таранно-ладьевидного сустава и прикрепляющееся к медиальной клиновидной кости
• Сухожилия разгибателей, идущие над тыльной поверхностью таранно-ладьевидного сустава к первому и остальным пальцам стопы
• Сосудисто-нервный пучок, следующий между сухожилием длинного разгибателя первого пальца и сухожилиями длинного общего разгибателя пальцев
- Особенности костной анатомии:
• Ладьевидная кость образует с таранной костью шаровидный сустав, отличающийся высокой конгруэнтностью суставных поверхностей
• При болезни Мюллера-Вайсса наступают типичные структурные изменения в виде медиального наклона ладьевидной кости, приводящего к ее подвывиху относительно головки таранной кости
• Латеральная часть ладьевидной кости может фрагментироваться, что приводит к формированию псевдоэкзостоза на тыльно-латеральной поверхности стопы
- Особенности строения связочного аппарата:
• Таранно-ладьевидная связка располагается на тыле сустава и следует в косом направлении от головки таранной кости к ладьевидной кости. На последних стадиях болезни Мюллера-Вайсса она обычно отделяется от ладьевидной кости в связи с фрагментацией последней
• Раздвоенная связка начинается на тыльной поверхности переднего отростка пяточной кости и прикрепляется к наружной поверхности ладьевидной кости. На последних стадиях болезни Мюллера-Вайсса она также обычно отделяется от ладьевидной кости в связи с фрагментацией последней
а) Положение пациента:
- Таранно-ладьевидный артродез выполняется в положении на спине
- На верхнюю треть бедра накладывается турникет
- Также обрабатывается и отграничивается стерильным бельем на случай необходимости гребень подвздошной кости
Нюансы укладки пациента:
• Использование рентген-прозрачного операционного стола упростит интраоперационный флюороскопический контроль
• Голень оставляется свободной, чтобы стопе во время операции можно было придавать любое требуемое положение

Рисунок 6
б) Порты и доступы:
- Первым этапом выполняется медиальный доступ к таранно-ладьевидному суставу:
• Разрез длиной 4-6 см выполняется примерно на 1 см к тылу и параллельно сухожилию задней большеберцовой мышцы
• Капсульная часть сухожилия мобилизуется и выполняется артротомия (рис. 6)
- Вторым этапом выполняется дорзолатеральный доступ к таранно-ладьевидному суставу:
• Над головкой таранной кости выполнятся разрез кожи длиной 3-4 см
• Мягкие ткани аккуратно мобилизуются кнаружи от сухожилия длинного разгибателя пятого пальца
• Обнажается латеральная часть ладьевидной кости и ее фрагментированный участок
• Артротомия латерального отдела таранно-ладьевидного сустава (рис. 6, А)
Спорные моменты:
• Возможна артротомия таранно-ладьевидного сустава с использованием одного доступа, однако дебридмент и фиксация наружного отдела сустава в таком случае потребует сильной ретракции мягкотканных структур
в) Техника операции:
Рисунок 7
1 этап: дебридмент медиального отдела таранно-ладьевидного сустава:
- Одна 2,5-мм спица Киршнера вводится медиально в головку таранной кости, а вторая — в ладьевидную кость с учетом расхождения, соответствующего степени углового наклона ладьевидной кости
- С помощью этих спиц и дистрактора Хинтерманна сустав растягивается и одновременно корригируется наклон ладьевидной кости (рис. 7, А)
- Суставные поверхности таранной и ладьевидной костей с помощью долота и ложки освобождаются от суставного хряща (рис. 7, Б-В)
- Суставные поверхности костей перфорируются небольшим долотом или 2,5-мм сверлом для формирования хорошо кровоточащей поверхности (рис. 7, Г)
Нюансы 1 этапа операции:
• Контрактура сухожилия задней большеберцовой мышцы обычно преодолевается с помощью дистрактора Хинтерманна, поэтому отдельный его релиз не нужен
Инструментарий и импланты 1 этапа операции:
• Острое долото
• Костная ложка
Рисунок 8
2 этап: дебридмент латерального отдела таранно-ладьевидного сустава:
- В случае фрагментации латеральной части ладьевидной кости костные фрагменты со стороны тыльной поверхности удаляются
- Нижний основной фрагмент оставляется
- При дистракции медиального отдела таранно-ладьевидного сустава латерально в головку таранной кости вводится 2,5-мм спица, вторая спица вводится параллельно первой в ладьевидную кость
- С помощью второго дистрактора Хинтерманна выполняется дистракция сустава (рис. 8, А)
- Суставные поверхности таранной и ладьевидной кости с помощью долота и ложки освобождаются от суставного хряща (рис. 8, Б)
- Суставные поверхности костей перфорируются небольшим долотом или 2,5-мм сверлом для формирования хорошо кровоточащей поверхности (рис. 8, В)
Нюансы 2 этапа операции:
• Нередко латеральный отдел сустава удается нормально растянуть только за счет дистракции с медиальной стороны, поэтому дополнительная его дистракция не требуется
Рисунок 9 Рисунок 10 Рисунок 11 Рисунок 12 Рисунок 13 Рисунок 14 Рисунок 15
3 этап: репозиция ладьевидной кости относительно таранной и внутренняя фиксация:
- При максимальной дистракции с внутренней стороны ладьевидная кость вручную максимально удавливается в латеральном направлении (рис. 9)
- При этом маневре дополнительно можно воспользоваться репозиционным зажимом, одна бранша которого устанавливается на медиальную поверхность ладьевидной кости, а другая — на латеральную часть головки таранной кости, либо компрессирующим зажимом, фиксированным к спицам с латеральной стороны сустава (рис. 10)
- По достижении удовлетворительного положения ладьевидной кости выполняется предварительная ее фиксация спицей
- Пластинка Uni-CP (Integra, Plainsboro, NJ, USA) сначала фиксируется винтом к латеральной части ладьевидной кости, а затем вторым винтом — к латеральной поверхности головки таранной кости (рис. 11)
- С помощью специального зажима выполняется компрессия (рис. 12)
- При удалении медиального дистрактора и всех трансфиксирующих спиц в медиальном отделе таранно-ладьевидного сустава происходит компрессия за счет тяги сухожилия задней большеберцовой мышцы. Можно добиться компрессии и с помощью компрессирующего зажима, фиксируемого к спицам (рис. 13)
- Оставшиеся 2,5-мм спицы используются как джойстики для коррекции положения переднего отдела стопы во фронтальной плоскости с тем, чтоб добиться, например, строго нейтрального его положения
- Со стороны медиально-подошвенной поверхности ладьевидной кости в головку таранной кости вводится 1,6-мм спица (рис. 14), а по ней—5,5-мм канюлированный винт (рис. 15)
- Точно так же более дорзально и латерально вводится второй винт
Нюансы 3 этапа операции:
• Во время репозиции головка таранной кости ротируется медиально, а ладьевидная кость возвращается в нормальное положение относительно головки таранной кости, пяточная кость-при этом, принимает нейтральное или несколько вальгусное положение
• Для заполнения возможных костных дефектов в зоне артродеза можно использовать костный матрикс
Ошибки 3 этапа операции:
• Недостаточная репозиция таранно-ладьевидного сустава приведет к сохранению патологической установки стопы, например, варусной установки заднего отдела и отведения переднего отдела
Инструментарий и импланты 3 этапа операции:
• С-дуга
Спорные моменты 3 этапа операции:
• Некоторые авторы рекомендуют одновременно выполнять артродез ладьевидно-клиновидных суставов и подтаранного сустава, однако, согласно нашему опыту, адекватная репозиция таранно-ладьевидного сустава позволяет добиться репозиции и в этих суставах, которые в результате будут нормально функционировать. Мы на самом деле ни разу не отмечали дегенеративных изменений в этих суставах, которые бы потребовали последующего лечения
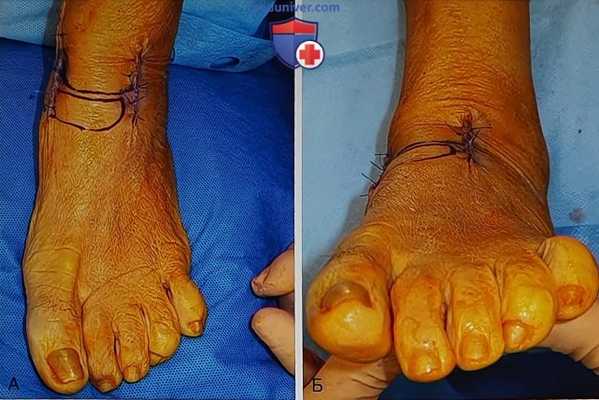
Рисунок 16
4 этап: закрытие раны:
- Раны последовательно ушиваются, кожа ушивается отдельными узловыми швами с использованием шовного материала 3-0 (рис. 16):
• Ушитая рана закрывается компрессирующей повязкой
• Стопа фиксируется в нейтральном положении
Спорные моменты 4 этапа операции:
• Мы не используем дренажи во избежание удаления из зоны артродеза продуктов крови и пластического материала
Синдром Элерса - Данлоса
Синдром Элерса-Данлоса – наследственная системная соединительнотканная дисплазия, обусловленная недостаточным развитием коллагеновых структур. В зависимости от клинического типа синдром Элерса-Данлоса может проявляться гипермобильностью суставов, необычайной ранимостью и растяжимостью кожи, склонностью к кровоизлияниям и кровотечениям, деформациями позвоночника и грудной клетки, миопией, косоглазием, птозом внутренних органов и пр. При диагностике синдрома Элерса-Данлоса учитываются клинические данные, результаты биопсии кожи и генотипирования; возможна пренатальная диагностика патологии. Лечение синдрома Элерса-Данлоса сводится к соблюдению щадящего режима, белковой диеты, симптоматической терапии.

Общие сведения
Синдром Элерса-Данлоса (несовершенный десмогенез, гиперэластическая кожа), наряду с несовершенным остеогенезом, синдромом Марфана и другими заболеваниями, относится к наследственным коллагенопатиям. Синдром Элерса-Данлоса неоднороден и включает в себя гетерогенную группу наследственных поражений соединительной ткани (соединительнотканных дисплазий), связанных с нарушением биосинтеза белка коллагена. Проявления синдрома Элерса-Данлоса носят системный характер и затрагивают опорно-двигательный аппарат, кожу, сердечно-сосудистую, зрительную, зубочелюстную и другие системы. Поэтому синдром Элерса-Данлоса представляет практический интерес не только для генетики, но и травматологии и ортопедии, дерматологии, кардиологии, офтальмологии, стоматологии.
Сложность верификации и наличие легких форм затрудняет получение точных сведений об истинной распространенности синдрома Элерса-Данлоса; частота диагностированных среднетяжелых случаев составляет 1:5 000 новорожденным, тяжелых форм - 1:100 000.

Причины синдрома Элерса-Данлоса
Различные варианты синдрома Элерса-Данлоса различаются по типу наследования, первичным молекулярным и биохимическим дефектам. Однако в основе всех клинических форм лежат мутации генов, обусловливающие количественную или структурную патологию коллагена. На сегодняшний день молекулярные механизмы синдрома Элерса-Данлоса установлены не для всех форм заболевания.
Так, известно, что I тип синдрома характеризуется снижением активности фибробластов, усилением синтеза протеогликанов, отсутствием ферментов, отвечающих за нормальный биосинтез коллагена. Синдром Элерса-Данлоса IV типа связан с недостаточностью продукции коллагена III типа; при VI типе заболевания имеет место недостаточность фермента лизилгидроксилазы, участвующего в гидроксилировании лизина в молекулах проколлагена. VII тип обусловлен нарушением превращения проколлагена I типа в коллаген; X тип - патологией плазменного фибронектина, участвующего в организации межклеточного матрикса и т. п.
Патоморфологическая картина при различных типах синдрома Элерса-Данлоса характеризуется истончением дермы, нарушением ориентации и потерей компактности коллагеновых волокон, разрастанием эластических волокон, увеличением числа сосудов и расширением их просвета.
Классификация синдрома Элерса-Данлоса
Всего выделяют 10 типов синдрома Элерса-Данлоса, различающихся по генетическому дефекту, характеру наследования и клиническим проявлениям. Рассмотрим основные из них:
I тип синдрома Элерса-Данлоса (классический тяжелого течения) – наиболее частый вариант заболевания (43% случаев) с аутосомно-доминантным типом наследования. Ведущим симптомом является гиперэластичность кожи, растяжимость которой по сравнению с нормой увеличена в 2-2,5 раза. Характерна гипермобильность суставов, носящая генерализованный характер, деформации скелета, повышенная ранимость кожи, склонность к наружным кровотечениям, образованию рубцов, плохому заживлению ран. У части больных выявляется наличие моллюскоподобных псевдоопухолей и варикозного расширения вен нижних конечностей. Беременность у женщин с I типом синдрома Элерса-Данлоса часто осложняется преждевременными родами.
II тип синдрома Элерса-Данлоса (классический мягкого течения) – характеризуется вышеописанными признаками, но выраженными в меньшей степени. Растяжимость кожи превосходит нормальную лишь на 30%; гипермобильность отмечается преимущественно в суставах стоп и кистей; кровоточивость и наклонность к рубцеванию незначительны.
III тип синдрома Элерса-Данлоса – имеет аутосомно-доминантное наследование, доброкачественное течение. Клинические проявления включают генерализованную повышенную подвижность суставов, скелетно-мышечные деформации. Остальные проявления (гиперэластичность и рубцевание кожи, геморрагии) минимальны.
IV тип синдрома Элерса-Данлоса – встречается редко, протекает тяжело; может наследоваться различными путями (доминантно или рецессивно). Гиперэластичность кожи незначительна, отмечается повышенная подвижность только суставов пальцев рук. Ведущим проявлением данного типа заболевания является геморрагический синдром: склонность к образованию экхимозов, спонтанных гематом (в т. ч. во внутренних органах), разрывам полых органов и сосудов (в т. ч. аорты). Сопровождается высокой летальностью.
V тип синдрома Элерса-Данлоса – имеет Х-сцепленное рецессивное наследование. Характеризуется повышенной растяжимостью кожи, умеренно выраженными гипермобильностью суставов, кровоточивостью и ранимостью кожи.
VI тип синдрома Элерса-Данлоса - наследуется по аутосомно-рецессивному типу. Кроме гиперэластичности кожи, наклонности к кровотечениям, повышенной подвижности суставов, имеются мышечная гипотония, тяжелый кифосколиоз, косолапость. Характерной чертой синдрома Элерса-Данлоса VI типа является глазной синдром, проявляющийся близорукостью, кератоконусом, косоглазием, глаукомой, отслойкой сетчатки и т. д.
VII тип синдрома Элерса-Данлоса (артроклазия) - наследуется как аутосомно-доминантно, так и аутосомно-рецессивно. Клиническую картину определяет низкий рост пациентов и гиперподвижность суставов, приводящая к частым привычным вывихам.
VIII тип синдрома Элерса-Данлоса – преимущественно наследуется аутосомно-доминантно. Ведущую роль в клинике играет хрупкость кожи, выраженный периодонтит, приводящий к ранней потере зубов.
X тип синдрома Элерса-Данлоса – характеризуется аутосомно-рецессивным наследованием; умеренной гиперэластичностью кожи и гипермобильностью суставов, стриями (полосовидной атрофией кожи), нарушением агрегации тромбоцитов.
XI тип синдрома Элерса-Данлоса – имеет аутосомно-доминантный тип наследования. У больных отмечаются рецидивирующие вывихи плечевых суставов, вывихи надколенника, встречается врожденный вывих бедра.
IX тип (Х-спепленный вариант вялой кожи) в настоящее время исключен из классификации синдрома Элерса-Данлоса. В современном варианте классификации синдрома Элерса-Данлоса рассматривается 7 основных типов заболевания:
- классический (типы I и II)
- гипермобильный (тип III)
- сосудистый (тип IV)
- кифосколиоз (тип VI)
- артроклазия (тип VIIB)
- дермоспараксис (тип VIIC)
- недостаток тенасцина-X
Симптомы синдрома Элерса-Данлоса
Ввиду того, что подробная характеристика различных типов синдрома Элерса-Данлоса дана выше, в настоящем разделе обобщим основные проявления заболевания. Поскольку соединительная ткань присутствует практически во всех органах, проявления синдрома Элерса-Данлоса носят системный, генерализованный характер.
Ведущим в клинической картине является кожный синдром: гиперэластичность кожи, которая легко собирается в складку и оттягивается. На ощупь кожа бархатистая, нежная, слабо фиксированная с подлежащими тканями, морщинистая на ладонных и подошвенных поверхностях. Гиперэластичность кожи при синдроме Элерса-Данлоса отмечается с рождения или дошкольного возраста, с годами имеет тенденцию к снижению.
Кроме, гиперрастяжимости, характерна повышенная ранимость, хрупкость кожи, обнаруживающаяся в возрасте старше 2-3-х лет. Минимальная травматизация приводит к образованию длительно не заживающих ран, на месте которых спустя время формируются атрофичные или келоидные рубцы, псевдоопухоли.
Суставные проявления синдрома Элерса-Данлоса представлены гипермобильностью (разболтанностью) суставов, которая может носить локальный (например, переразгибание межфаланговых суставов) или генерализованный характер. Суставной синдром проявляется с началом ходьбы ребенка, что приводит к повторным подвывихам и вывихам. С возрастом гипермобильность суставов обычно уменьшается.
Со стороны сердечно-сосудистой системы у детей с синдромом Элерса-Данлоса нередко выявляются врожденные пороки сердца, пролапс митрального клапана, аневризмы сосудов головного мозга, варикоз. Отмечается склонность к кровотечениям - экхимозам, гематомам различной локализации, носовым, десневым, маточным, желудочно-кишечным кровотечениям.
Глазные проявления синдрома Элерса-Данлоса могут включать гиперэластичность кожи век, миопию, птоз, косоглазие, разрывы роговицы и глазного яблока при минимальных механических повреждениях, спонтанную отслойку сетчатки.
Изменения скелета при синдроме Элерса-Данлоса характеризуются воронкообразной или килевидной деформацией грудной клетки, сколиозом, кифозом, косолапостью, неправильным прикусом, частичной адентией. Висцеральные нарушения представлены птозом внутренних органов, пупочными, паховыми, диафрагмальными грыжами, рецидивирующим спонтанным пневмотораксом, дивертикулезом кишечника и др. Умственное развитие детей с синдромом Элерса-Данлоса обычно соответствует возрасту.
Диагностика синдрома Элерса-Данлоса
Диагностика синдром Элерса-Данлоса проводится медицинским генетиком на основании генеалогических данных, анамнеза, клинического анализа, молекулярно-генетических исследований. Предварительно синдром Элерса-Данлоса может быть заподозрен при наличии больших диагностических критериев (гипермобильности суставов, гиперэластичности кожи, склонности к кровотечениям) и дополнительных малых (хрупкости кожи, патологии сердца, сосудов, глаз и т. д.).
Некоторые формы заболевания требуют проведения биопсии кожи для гистологического, гистохимического, электронно-микроскопического исследования.
Наличие в семье больных синдромом Элерса-Данлоса является показанием к медико-генетическому консультировании и проведению инвазивной пренатальной диагностики.
Больные с различными типами синдром Элерса-Данлоса могут нуждаться в наблюдении и обследовании детским травматологом-ортопедом, детским кардиологом, детским офтальмологом, детским стоматологом, сосудистым хирургом.
Лечение синдрома Элерса-Данлоса
Эффективная специфическая терапия синдрома Элерса-Данлоса не разработана. Детям требуется создание щадящего режима, исключающего излишнюю травматизацию суставов и кожи; ограничение физических нагрузок; соблюдение белковой диеты с включением в рацион костных бульонов, заливных блюд, студня. Обязательны регулярные курсы массажа, лечебной физкультуры, физиотерапии (магнитотерапии, электрофореза, лазеропунктуры).
Медикаментозная терапия синдрома Элерса-Данлоса включает применение аминокислот (карнитина), витаминов (С, Е, D, группы В), хондроитина сульфата, глюкозамина, минеральных комплексов (препаратов кальция и магния), метаболических препаратов (рибоксин, АТФ, коэнзим Q10) повторными курсами до1-1,5 мес. 2-3 раза в год.
При синдроме Элерса-Данлоса может быть показано хирургическое лечение: реконструкция грудной стенки, удаление псевдоопухолей, коррекция ВПС и пр.
Прогноз синдрома Элерса-Данлоса
На качество и продолжительность жизни больных синдромом Элерса-Данлоса влияет тип заболевания. Наиболее серьезный прогноз имеет IV тип синдрома Элерса-Данлоса – летальный исход может наступить вследствие разрывов сосудов, внутренних органов и кровотечений. Наличие синдрома I типа существенно ограничивает качество жизни. Относительно благоприятно протекание II—III типов болезни.
В целом, наличие синдрома Элерса-Данлоса сопряжено со множеством социальных трудностей, ограничивает полноценную физическую активность и выбор профессии.
Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
Синдром Меллори-Вейса — линейные разрывы слизистой кардиоэзофагеальной зоны, возникшие на фоне рвоты, позывов на рвоту, икоты. Проявляется наличием крови в рвотных массах, эпигастральными или загрудинными болями, артериальной гипотензией, тахикардией. Диагностируется с помощью эзофагогастроскопии, обзорной рентгенографии брюшной полости. Для лечения применяется гемостатическая, кровезаместительная терапия, противорвотные препараты, сердечные аналептики, ингибиторы протонной помпы, Н2-гистаминоблокаторы, антациды. При необходимости выполняется эндоскопический гемостаз, терапевтическая эмболизация, гастротомия для ушивания повреждений.
МКБ-10

Впервые клиника разрывно-геморрагического синдрома была описана в 1929 году американскими патологами Дж.К. Меллори и С. Вейсом. В настоящее время заболевание является одной из ведущих причин неязвенных кровотечений из верхних отделов пищеварительного тракта. Распространенность патологии достигает 5-10%. Болезнь Меллори-Вейса выявляется преимущественно у 45-60-летних пациентов, злоупотребляющих спиртными напитками. У мужчин разрывы желудочной и пищеводной слизистой возникают в 7 раз чаще, чем у женщин. У 79-80% больных поражается эзофагогастральный переход, у 16-17% — стенка пищевода, у 3-5% — кардиальная оболочка. Длина разрывов обычно составляет 0,4-4,5 см. В 77-78% случаев повреждения являются единичными, в 22-23% — множественными.

Причины
Продольные разрывы слизистой в области пищеводно-желудочного перехода возникают при локальном повышении давления у пациентов со сниженной резистентностью эпителиального слоя. Предпосылками к развитию разрывно-геморрагического гастроэзофагеального синдрома служат патологические процессы, при которых повреждаются эпителиоциты или наблюдается повышенное кровенаполнение сосудов верхних отдела ЖКТ: асептическое воспаление слизистой при частом употреблении спиртных напитков, воспалительные заболевания ЖКТ (эзофагиты, гастриты), длительный прием НПВС, кортикостероидов, скользящая грыжа пищеводного отверстия диафрагмы, расширение пищеводных вен при портальной гипертензии у больных с гепатитами, жировым гепатозом, фиброзом, циррозом печени. Непосредственными причинами болезни Меллори-Вейса являются:
- Рвота, неукротимая икота. У 80-85% пациентов развитие рвоты связано с алкогольным опьянением. Провоцирующими факторами также становятся рвота беременных, диспепсические расстройства при патологии пищеварительного тракта (язвенной болезни, панкреатите, холецистите), отравления, уремия.
- Длительный интенсивный кашель. В редких случаях разрывно-геморрагический синдром провоцируется острыми и хроническими респираторными заболеваниями. Линейное повреждение слизистой пищевода, верхних отделов желудка может осложнить коклюш, ОРВИ, хронический бронхит, бронхиальную астму.
- Ятрогенные воздействия. Повреждение стенки пищевода, желудка возможно при грубом выполнении эндоскопических манипуляций (гастроскопии, эзофагогастродуоденоскопии), введении желудочного зонда. Иногда разрывы слизистой возникают при проведении сердечно-легочной реанимации.
В спорадических случаях повышение давления, приводящее к разрыву эпителиального слоя, вызывается другими факторами — подъемом тяжестей, интенсивными физическими нагрузками с резким напряжением мышц брюшного пресса, тупой травмой живота. Крайне редко заболевание осложняет течение судорожного синдрома при эпилепсии, опухолях головного мозга, энцефалопатиях, менингите, энцефалите, эклампсии.
Патогенез
Пусковым моментом разрыва пищеводно-желудочной слизистой обычно становится многократная рвота, резкое повышение абдоминального давления при переполненном желудке или кардиоэзофагеальном спазме, реже — прямые механические воздействия. Возникновение избыточного давления в кардиальном отделе желудка способствует перерастяжению стенки органа. При морфологической несостоятельности эпителия, вызванной воспалительными процессами, растянутая слизистая желудка, пищевода разрывается в наиболее истонченном или патологически измененном участке. Обычно разрыв распространяется не глубже эпителиального и подслизистого слоя. В тяжелых случаях повреждается мышечная, серозная желудочная либо адвентициальная пищеводная оболочки с выходом агрессивного содержимого в средостение или брюшную полость.
Классификация
- I стадия. Повреждение слизистой желудочно-пищеводного перехода и дистальной трети пищевода. Встречается у 36-37% пациентов. В большинстве случаев кровотечение прекращается спонтанно.
- II стадия. Дефекты расположены в той же зоне, однако их глубина достигает подслизистого слоя. Выявляется у 52-53% больных. Обычно проводится консервативная гемостатическая терапия.
- III стадия. Глубокие зияющие разрывы с вовлечением мышечной оболочки и интенсивным кровотечением. Наблюдаются в 9-11% случаев. Необходим эндоскопический или хирургический гемостаз.
- IV стадия. Редко диагностируемое тяжелое повреждение с разрушением всех оболочек гастроэзофагеального участка ЖКТ. Осложняется медиастинитом, перитонитом, пневмотораксом.
Симптомы синдрома Меллори-Вейса
Клинические проявления заболевания обычно развиваются на фоне многократной рвоты. Основным признаком синдрома является выделение ярко-красной крови с рвотными массами (гематемезис), которое может иметь различную интенсивность – от нескольких капель до профузного кровотечения. Возникает резкая боль в эпигастральной области или за грудиной. Вследствие кровопотери у больного формируется острый анемический синдром, для которого характерны головокружение, бледность кожных покровов, мелькание «мушек» перед глазами, падение артериального давления, значительное учащение сердцебиения. При массивном кровотечении возможна потеря сознания.
Осложнения
Острая кровопотеря при симптомокомплексе Меллори-Вейса может привести к развитию геморрагического шока с тяжелыми нарушениями микроциркуляции, изменениями реологических свойств крови, прогрессирующей гипоксией. При отсутствии лечения шок переходит в декомпенсированную стадию, сопровождающуюся полиорганной недостаточностью. Наиболее тяжелым осложнением синдрома является тотальный разрыв стенки брюшного отдела пищевода, распространяющийся выше уровня диафрагмы. При этом у пациента возникает приступ одышки, цианоз кожи, сильнейшие боли в грудной клетке. Такое осложнение, известное как синдром Бурхаве, в 20-40% случаев заканчивается летальным исходом. Попадание содержимого желудка в средостение, полость брюшины провоцирует развитие медиастинита, перитонита.
Диагностика
Постановка диагноза при синдроме Мэллори-Вейса может быть затруднена, что обусловлено стремительным нарастанием клинической картины и необходимостью оказания пациенту экстренной медицинской помощи. Диагностика заболевания предполагает комплексное инструментальное обследование пищеварительного тракта для выявления первопричины кровавой рвоты. Наиболее информативными являются:
- Эзофагогастроскопия. Введение гибкого эндоскопа через ротовую полость позволяет оценить состояние эпителиальной оболочки верхних отделов ЖКТ и обнаружить линейные разрывы, которые обычно локализованы в области перехода пищевода в желудок. С помощью визуального осмотра удается установить глубину поражения стенки пищевода или желудка.
- Обзорная рентгенография брюшной полости. Проведение рентгенологического исследования информативно при подозрении на разрыв полого органа. Основной признак перфорации – наличие свободного газа в полости брюшины (симптом «серпа»). На рентгенограмме также можно обнаружить другие болезни ЖКТ, которые являются первопричиной патологии Меллори-Вейса.
В клиническом анализе крови определяются изменения, характерные для анемического синдрома — уменьшения содержания эритроцитов и гемоглобина, снижение показателя гематокрита. Для исключения хронического кишечного кровотечения проводится реакция Грегерсена, позволяющая обнаружить скрытую кровь в кале. При выраженном диспепсическом синдроме может выполняться бактериологический посев кала для выявления патогенных микроорганизмов.
Дифференциальная диагностика синдрома осуществляется с легочным кровотечением, отеком легких, сердечной астмой, кровотечением из язвы желудка, варикозным расширением пищеводных вен, острым гастроэнтеритом, кишечными инфекциями, распадом опухоли желудка или пищевода, синдромом Рандю-Ослера. Кроме осмотра хирурга и гастроэнтеролога пациенту могут потребоваться консультации гематолога, инфекциониста, пульмонолога, кардиолога, гематолога, гепатолога.
Лечение синдрома Меллори-Вейса
Пациент подлежит неотложной госпитализации в хирургический стационар. На начальном этапе больному обеспечивается покой, холод на область желудка, при позывах на рвоту применяются блокаторы дофаминовых и серотониновых рецепторов с противорвотным эффектом. Назначается консервативное лечение и малоинвазивные манипуляции, направленные на остановку кровотечения, восполнение объема циркулирующей крови. При резком падении АД терапию дополняют введением средств для поддержания гемодинамики. Пациентам с болезнью Меллори-Вейса показаны:
- Инфузионная терапия. При умеренной кровопотере проводятся внутривенные вливания коллоидных и кристаллоидных растворов. При массивном кровотечении переливается эритроцитарная масса или взвесь, нативная и свежезамороженная плазма, реже — донорская кровь.
- Гемостатические препараты. Для медикаментозного гемостаза используют стимуляторы свертывающей системы крови. Эффективность кровоостанавливающей терапии повышается при парентеральном введении препаратов кальция, синтетических аналогов витамина К.
- Эндоскопический гемостаз. При продолжающемся кровотечении с помощью эндоскопа обкалывают место повреждения средствами с сосудосуживающим эффектом, вводят склерозанты, лигируют или клипируют сосуды. Возможно выполнение аргоноплазменной или электрокоагуляции.
- Терапевтическая эмболизация. Для прекращения кровотечения из поврежденных сосудов в них под контролем ангиографии вводят смесь эмболов с физиологическим раствором. Альтернативным методом является редко применяемое внутриартериальное вливание жировых суспензий.
Баллонная зондовая тампонада используется ограниченно из-за возможного усугубления разрывов. Важным условием быстрого восстановления поврежденной стенки является угнетение желудочной секреции при помощи ингибиторов протонной помпы, блокаторов Н2-гистаминорецепторов. Прием секретолитиков дополняют назначением невсасывающихся антацидов, препаратов коллоидного висмута. Хирургические методы лечения геморрагического разрывного синдрома показаны при неостанавливающихся или рецидивирующих кровотечениях, глубоких дефектах, полном разрыве пищеводной или желудочной стенки. Рекомендованным вмешательством является гастротомия с прошиванием надрывов, кровоточащих сосудов, ушиванием дефектов, иногда — перевязкой левой желудочной артерии.
Прогноз и профилактика
Исход патологического состояния зависит от величины кровопотери и тяжести основного заболевания пациента. В 90% случаев кровотечение останавливается самопроизвольно или консервативными способами. Прогноз синдрома относительно неблагоприятный при потере больше 10% ОЦК и наличии сопутствующей патологии. Меры профилактики при заболевании Меллори-Вейса заключаются в отказе от злоупотребления алкоголем, своевременном устранении провоцирующих факторов, выявлении и лечении болезней желудочно-кишечного тракта, соблюдении техники проведения инвазивных медицинских манипуляций на пищеводе, желудке.
2. Лечение разрывно-геморрагического синдрома (синдрома Маллори-Вейсса) в специализированном Центре: автореферат диссертации/ Чередников Е.Е. – 2011.
Читайте также:
