Показания к алло-трансплантации гемопоэтических стволовых клеток (алло-ТГСК)
Добавил пользователь Дмитрий К. Обновлено: 17.01.2026
К сожалению, у большинства пациентов (60 - 70%), у которых достигнута ПР ОМЛ, в течение 3 лет развивается рецидив заболевания. В целом прогноз у пациентов при развитии рецидива неблагоприятен и терапевтических подходов крайне мало. Долгосрочная выживаемость зависит от возможности достижения повторной ремиссии и выполнения ТГСК в качестве консолидации. Пациенты с очень ранним рецидивом (длительностью ремиссии менее полугода), неблагоприятными цитогенетическими аномалиями и старшего возраста имеют плохой прогноз [1, 7]. Из-за неблагоприятного прогноза пациентов в рецидиве необходимо оценивать, насколько терапия может быть выполнена у конкретного пациента. Оценка перспективы долгосрочной выживаемости может быть сделана на основе прогностического индекса рецидива [72](Приложение Г5). Прогностический индекс можно использовать при определении лечебной тактики у конкретного пациента: 1) проведение терапии, направленной на "излечение" с использованием ТГСК; 2) включение в клиническое исследование по применению новых лекарственных препаратов; 3) паллиативная терапия.
В рекомендациях NCCN, которых придерживаются и российские эксперты, используется более простой принцип определения прогноза ОМЛ после развития рецидива: если рецидив ранний (продолжительность ПР менее 12 месяцев) - прогноз неблагоприятный, поздний (продолжительность ПР 12 месяцев и более) - прогноз более благоприятный [8]. Оба подхода (прогностический индекс и деление рецидивов на ранние и поздние) к классификации рецидива ОМЛ используются в российских исследовательских центрах.
- Рекомендуется пациентам при констатации первичной резистентности ОМЛ проведение терапии по программам лечения рефрактерных форм и рецидивов ОМЛ [73].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: терапия цитарабином** в высоких дозах (если его не применяли в 1-й линии индукции) в сочетании с антрациклинами может рассматриваться в качестве индукции ремиссии перед алло-ТГСК. Для улучшения результатов ТГСК у пациентов с рефрактерными ОМЛ используют режимы кондиционирования - последовательное применение интенсивной ХТ и через 3 дня - режим кондиционирования пониженной интенсивности с последующей алло-ТГСК (так называемый протокол FLAMSA-RIC) и в дальнейшем - профилактическое использование трансфузий донорских лимфоцитов и/или терапия азацитидином**.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: повторение индукционного курса ХТ целесообразно при отсутствии, в сравнении с исходными показателями, нарастания числа бластных клеток в миелограмме. В случае прогрессирования заболевания (увеличение процента бластных клеток, появление ранее не выявляемых экстрамедуллярных очагов) в качестве 2-го индукционного курса целесообразно выполнение курса ХТ цитарабином** в высоких дозах в сочетании с новыми антрациклиновыми антибиотиками (см. Приложение А3.2).
- Не рекомендуется выполнение ТГСК пациентам, у которых не достигнута ремиссия после нескольких линий индукционной терапии [74].
Комментарий: эти пациенты являются кандидатами на включение в клинические исследования по изучению новых лекарственных препаратов.
- Рекомендуется у пациентов при констатации позднего рецидива ОМЛ (продолжительность 1-й ПР более 1 года) в выборе терапевтической тактики руководствоваться информацией о ранее проведенной ХТ, на которой была получена 1-я ПР [1, 7, 8].
Комментарий: классическим выбором является повторение 1-й индукционной программы (см. Приложение А3.2). Также может быть использовано сочетание цитарабина** в стандартных дозах (100 мг/м2 2 раза в день или 200 мг/м2 в день непрерывно в 1 - 7-й дни) и идарубицина** (12 мг/м2 1 раз в день в 1 - 3-й дни). Шансы достижения 2-й ПР достаточно высокие ( 70%).
- Рекомендуется пациентам при развитии раннего рецидива ОМЛ (продолжительность 1-й ПР менее 1 года) в качестве 2-й линии терапии использовать цитарабин** в средней (1 г/м2) или высокой (3 г/м2) дозе либо сочетание цитарабина** в высоких дозах с антрациклинами [73, 75, 76].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Рекомендуется пациентам при достижении очередной ремиссии ОМЛ в качестве консолидирующей терапии выполнение алло-ТГСК [77].
Комментарий: если выполнение алло-ТГСК невозможно (например, из-за отсутствия подходящего донора), ауто-ТГСК может рассматриваться в качестве 2-й линии терапии, но ее эффективность четко не определена.
- Рекомендуется у пациентов с тяжелым соматическим статусом, особенно в возрасте старше 45 - 50 лет, длительными периодами цитопении на индукционных курсах, а также при наличии неблагоприятных хромосомных аномалий проведение программы низкодозного воздействия с гипометилирующим праймингом (децитабин/азацитидин**, идарубицин**, цитарабин**) (см. Приложение А3.2) [78].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: выполняют 2 индукционных курса и, если получена ПР, еще 2 консолидирующих. В дальнейшем осуществляют постоянную поддерживающую терапию в течение 3 лет аналогичными курсами без идарубицина**.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарий: в случае развития осложнений препараты временно отменяются и через 2 - 3 недели прием возобновляют в сниженной дозировке с последующим постепенным возвращением к лечебной дозе.
- Рекомендуется у пациентов с ОМЛ с мутациями гена c-kit или высокой экспрессией на бластных клетках CD117 рассмотреть возможность назначения ингибитора протеинкиназ дазатиниба** (140 мг/сутки постоянно) [80].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Рекомендуется у пациентов с ОМЛ из группы благоприятного цитогенетического прогноза рассмотреть возможность назначения дазатиниба** (140 мг/сутки 14 дней с момента окончания курса ХТ) [80].
- Рекомендуются пациентам при развитии рецидива ОМЛ после алло-ТГСК прекращение иммуносупрессивной терапии и проведение реиндукционного курса "7 + 3" с выполнением в период аплазии на 7-й день после курса трансфузий лимфоцитов донора [81].
Комментарий: пациентам с поздним рецидивом (более 1 года после алло-ТГСК) может быть выполнена 2-я алло-ТГСК после достижения повторной ремиссии.
Показания к алло-трансплантации гемопоэтических стволовых клеток (алло-ТГСК)
Показания к аутологичной трансплантации гемопоэтических стволовых клеток (ауто-ТГСК)
Наиболее часто ауто-трансплантации гемопоэтических стволовых клеток используется при следующих вариантах злокачественных заболеваний системы крови: НХЛ, ЛХ, ММ, ОМЛ, ОЛЛ. В настоящее время этот метод все чаще применяют при ХЛЛ и ХМЛ.
Применение ауто-трансплантаций гемопоэтических стволовых клеток ограничено при ряде заболеваний системы крови. Так, выполнение ауто-трансплантаций гемопоэтических стволовых клеток при ХМЛ и ХЛЛ возможно, однако в связи с низкой вероятностью достижения состояния полной клинико-гематологической ремиссии на фоне их лечения до последнего времени производилось редко.
Проведение ауто-трансплантаций гемопоэтических стволовых клеток при ХМЛ и ХЛЛ требовало использования различных методов «очистки» трансплантата от примеси злокачественных клеток как in vivo (интенсивная химиотерапия, циторедуктивная терапия), так и ex vivo (цитостатики, моноклональные антитела, длительное культивирование).
В последние годы прогресс в этой области связан с эффективным применением аналогов пуриновых оснований (флударабин, 2-CDA) при ХЛЛ и ингибиторов тирозинкиназы (гливек) при ХМЛ. Высокая частота ремиссий (гематологических, цитогенетических, молекулярно-биологических) при ХЛЛ и ХМЛ на фоне современной терапии создает условия для использования ауто-трансплантаций гемопоэтических стволовых клеток у данной категории больных.
При ХИМФ проведение ауто-трансплантаций гемопоэтических стволовых клеток затруднено ввиду сложности получения аутологичного трансплантата адекватного качества на фоне развития фиброзных изменений костного мозга.
На результаты ауто-трансплантаций гемопоэтических стволовых клеток при острых лейкозах большое влияние оказывает выбор оптимального времени получения гемопоэтических стволовых клеток после достижения ремиссии. Длительность полной ремиссии перед эксфузией (аферезом) гемопоэтических стволовых клеток, рассматриваемая как наиболее благоприятная, составляет более 6 мес. При получении гемопоэтических стволовых клеток и проведении ауто-трансплантаций гемопоэтических стволовых клеток у больных с неходжкиновскими лимфомами и множественной миеломой определяющее значение имеет степень инфильтрации костного мозга злокачественными клетками.
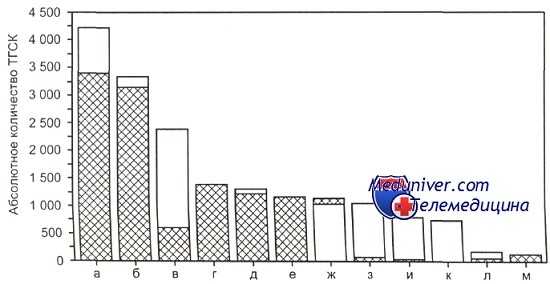
Основные показания к проведению ТГСК в США.
а — неходжкинские лимфомы; б — множественная миелома; в —ОМЛ; г — рак молочной железы; д — болезнь Ходжкина; е —другие опухоли; ж —ХМЛ; з — ОЛЛ; и — МДС/другие лейкемии; к — незлокачественные заболевания; л — ХЛЛ; м — рак яичников. Светлая часть столбиков - алло-ТГСК (n = 6700), заштрихованная — ауто-ТГСК (n= 11 000).
Необходимо отметить, что при попытке сравнения химиотерапии и различных видов трансплантации гемопоэтических стволовых клеток у больных со злокачественными заболеваниями системы крови достаточно сложно выделить сопоставимые данные. Так, например, при острых лейкозах в первой или второй ремиссии эффективность ауто-трансплантаций гемопоэтических стволовых клеток или алло-трансплантаций гемопоэтических стволовых клеток часто анализируют совместно с трансплантацией гемопоэтических стволовых клеток у детей, подростков и взрослых (например, данные CIBMTR) либо без учета прогностических факторов.
Включение в одно исследование пациентов, которым трансплантация гемопоэтических стволовых клеток была выполнена от десятков до нескольких лет назад, может не отражать реальной ситуации. В связи с совершенствованием методов
HLA-типирования, сопроводительной терапии, профилактики токсических, инфекционных и иммунологических осложнений за последние годы показатели выживаемости больных после родственной и неродственной алло-трансплантацией гемопоэтических стволовых клеток и ауто-трансплантацией гемопоэтических стволовых клеток значительно улучшились по сравнению с данными, которые были получены на начальных этапах внедрения трансплантации гемопоэтических стволовых клеток как метода лечения. Это позволяет некоторым авторам рассматривать результаты трансплантации гемопоэтических стволовых клеток, исходя из различных исторических периодов.
При оценке отдаленных результатов трансплантации гемопоэтических стволовых клеток фактор отбора больных оказывает решающее значение. До настоящего времени не получено данных об эффективности трансплантации гемопоэтических стволовых клеток при заболеваниях системы крови из рандомизированных исследований, выполненных на основании анализа современных прогностических критериев.
При использовании алло-трансплантации гемопоэтических стволовых клеток проведение рандомизированных исследований в принципе невозможно, поскольку, как правило, в этом случае имеет место «биологическая» рандомизация пациентов, связанная с наличием родственного или неродственного донора гемопоэтических стволовых клеток. В подобных случаях чем позднее ставится вопрос о выполнении алло-трансплантации гемопоэтических стволовых клеток, тем больше вероятность развития у больного различных осложнений в раннем и позднем периодах после трансплантации.
Факт предшествовавшего рецидива острого лейкоза и высокий уровень «минимальной остаточной болезни» перед трансплантацией гемопоэтических стволовых клеток увеличивают риск возникновения рецидива, в том числе после алло-трансплантации гемопоэтических стволовых клеток.
Необходимо отметить, что не существует экстренных показаний для выполнения того или иного вида трансплантации гемопоэтических стволовых клеток, которая всегда требует подготовки, особенно психологической, реципиента и его родственников.
При выборе программ лечения больных со злокачественными заболеваниями постоянно возникает дилемма между использованием методов терапии, приводящих к полному излечению больного, но в то же время более опасных, особенно на ранних этапах применения (условно к этой группе можно отнести трансплантацию гемопоэтических стволовых клеток), и терапии менее интенсивной и безопасной, но менее эффективной по результатам долгосрочного прогноза. По результатам лечения этих групп больных кривые выживаемости имеют «перекрещивающийся» характер.
При наличии проблемы «перекрещивающихся» кривых выживаемости окончательный выбор метода лечения остается за больным и его родственниками.
Таким образом, одним из основных вопросов, от ответа на который зависит будущее применение трансплантации гемопоэтических стволовых клеток, является более детальное выяснение роли и места различных видов трансплантации гемопоэтических стволовых клеток в лечении онкологических заболеваний.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантация гемопоэтических стволовых клеток (ТГСК) при хроническом миелолейкозе (ХМЛ) - показания, эффективность
В лечении больных хроническим миелолейкозом (ХМЛ) за последние годы произошли радикальные изменения. Внедрение метода алло-трансплантации гемопоэтических стволовых клеток увеличило 5-летнюю общую выживаемость больных хроническим миелолейкозом после родственной алло-трансплантации гемопоэтических стволовых клеток до 67 %, 5-летнюю безрецидивную выживаемость — до 45 %, 5-летнюю текущую безрецидивную выживаемость (current LFS) до 55 %. Эти же показатели после неродственной алло-трансплантации гемопоэтических стволовых клеток составили 52, 24 и 40 % соответственно. В других исследованиях 10-летняя общая выживаемость больных после родственной алло-трансплантации гемопоэтических стволовых клеток равна 65 %, 10-летняя безрецидивная выживаемость — 52 %.
Приведенные факты являются подтверждением возможности полного излечения больных хроническим миелолейкозом после алло-трансплантации гемопоэтических стволовых клеток.
В настоящее время, несмотря на эти успехи, хронический миелолейкоз из категории заболеваний с абсолютными показаниями к алло-трансплантации гемопоэтических стволовых клеток перешел в более сложную группу состояний для принятия решения об ее выполнении. Это связано с хорошими результатами консервативной терапии хронического миелолейкоза с помощью ингибитора тирозинкиназы (гливек). Предварительные результаты лечения больных хроническим миелолейкозом гливеком свидетельствуют о высокой вероятности достижения гематологической, цитогенетической и молекулярно-биологической ремиссий.
Однако убедительные данные об эффективности этого препарата являются преждевременными в отношении долгосрочного прогноза из-за недостаточного срока наблюдения за больными.
Роль алло-трансплантации гемопоэтических стволовых клеток при хроническом миелолейкозе у детей и взрослых в настоящее время оценена достаточно широко. Как правило, анализ результатов выполняется с учетом следующих параметров: источника ГСК (родственный, неродственный донор), возраста больного, пол донора и реципиента, стадия заболевания, время с момента постановки диагноза до проведения алло-трансплантации гемопоэтических стволовых клеток, степень расхождения пары донор — реципиент по HLA-системе, инфицирование донора и реципиента ЦМВ, а также на основании индексов Sokol, European (Hasford) и current LFS, ответа на терапию а-интерфероном.
По данным CIBMTR, 3-летняя общая выживаемость больных хроническим миелолейкозом в хронической стадии в зависимости от срока выполнения алло-трансплантации гемопоэтических стволовых клеток и источника ГСК (родственный, неродственный донор) составила при родственной алло-трансплантации гемопоэтических стволовых клеток, выполненной в течение 1 года с момента постановки диагноза, 69 %, после 2 лет — 57 %. Те же показатели при алло-трансплантации гемопоэтических стволовых клеток от неродственного донора были 54 и 46 % соответственно.
Несмотря на имеющиеся расхождения в результатах алло-трансплантации гемопоэтических стволовых клеток от родственного и неродственного донора при хроническом миелолейкозе, выполненной в хронической стадии болезни, эти различия не являются существенными. Их характер не может повлиять на окончательное решение о целесообразности применения одного из видов алло-трансплантации гемопоэтических стволовых клеток.
По данным других исследований, 5-летняя общая выживаемость после родственной и неродственной алло-трансплантации гемопоэтических стволовых клеток составила 67 и 52 % соответственно. Выявлена зависимость эффективности алло-трансплантации гемопоэтических стволовых клеток от возраста реципиента: 5-летняя безрецидивная выживаемость при родственной и неродственной алло-трансплантации гемопоэтических стволовых клеток у больных моложе 30 лет равна 68 и 61 %, у больных 30—40 лет — 67 и 57 %, у больных старше 40 лет — 57 и 46 % соответственно.
Прогностическое значение возраста реципиента подтверждено данными NMDP при сравнении эффективности алло-трансплантации гемопоэтических стволовых клеток от полностью совместимого по HLA-системе неродственного донора у пациентов с начальной стадией хронического миелолейкоза. В этом исследовании 5-летняя общая выживаемость больных моложе 20 лет составила 63,2 %, в возрасте от 20 до 35 лет — 67,2 %, старше 35 лет - 47 %.
При сравнении родственной и неродственной алло-трансплантации гемопоэтических стволовых клеток при хроническом миелолейкозе у детей 3-летняя общая выживаемость была 75 и 65 %, безрецидивная выживаемость — 63 и 56 % соответственно. Вероятность ранней смерти после неродственной алло-трансплантации гемопоэтических стволовых клеток была выше по сравнению с родственной алло-трансплантации гемопоэтических стволовых клеток — 35 и 20 % соответственно.
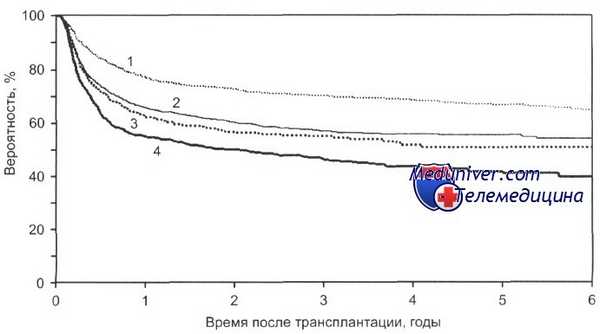
При алло-трансплантации гемопоэтических стволовых клеток у больных хроническим миелолейкозом показано значение стадии болезни и сроков проведения алло-трансплантации гемопоэтических стволовых клеток. Так, при алло-трансплантации гемопоэтических стволовых клеток, выполненной в первый год с момента постановки диагноза хронического миелолейкоза, 5-летняя общая выживаемость составила 54 %, в течение двух лет — 39 %, в последующие годы — 33 %. В зависимости от стадии заболевания при выполнении родственной алло-трансплантации гемопоэтических стволовых клеток 5-летняя безрецидивная выживаемость была равна при хронической стадии 60—80 %, в стадии акселерации 40—50 %, при бластном кризе 10—20 %.
При неродственной алло-трансплантации гемопоэтических стволовых клеток в зависимости от стадии хронического миелолейкоза получены следующие результаты: 5-летняя безрецидивная выживаемость при хронической стадии составила 43 %, в стадии акселерации — 18 %, при бластном кризе — 7 %.
До сих пор не установлено влияние источника гемопоэтических стволовых клеток (костный мозг (КМ) или периферических стволовых клеток крови (ПСКК)) на эффективность и характер осложнений после алло-трансплантации гемопоэтических стволовых клеток от родственного или неродственного донора у больных хроническим миелолейкозом. Однако получены данные, свидетельствующие о том, что результаты алло-трансплантации гемопоэтических стволовых клеток могут зависеть от источника гемопоэтических стволовых клеток, при этом установлено, что аллогенной трансплантации периферических стволовых клеток крови (алло-ТПСКК) имеет определенные преимущества.
Так, при сравнении алло-ТКМ и алло-ТПСКК от неродственного донора 3-летняя безрецидивная выживаемость составила 64 и 91 % соответственно. Смертность, связанная с трансплантацией, и безрецидивная выживаемость были 30 и 64 % после алло-ТКМ, 5 и 91 % — после алло-ТПСКК соответственно. Общая выживаемость в течение 1000 дней после аллоТКМ составила 66%, после алло-ТПСКК - 94 %. При многофакторном анализе установлено, что основным показателем, снижающим общую выживаемость после алло-ТГСК у больных ХМЛ, является развитие острой РТПХ тяжелой степени (III-IV стадия).
Степень расхождения по HLA-системе может существенно влиять на общую выживаемость больных хроническим миелолейкозом после алло-трансплантации гемопоэтических стволовых клеток от родственного и неродственного донора. При неродственной алло-трансплантации гемопоэтических стволовых клеток без/с расхождением по HLA-системе 5-летняя общая выживаемость составила 58 и 34 % соответственно.
При выполнении алло-трансплантации гемопоэтических стволовых клеток у больных хроническим миелолейкозом не доказано преимущество определенного режима кондиционирования реципиента перед трансплантацией. Полученные ранее данные свидетельствовали о большей эффективности использования режима кондиционирования с включением тотального облучения тела (ТОТ), в последующем эти результаты не были подтверждены. Сравнение двух режимов кондиционирования: тотальное облучение тела (ТОТ) + циклофосфан и бусульфан + циклофосфан — при хроническом миелолейкозе выявило 10-летнюю общую выживаемость, равную 65 и 63 %, 10-летнюю безрецидивную выживаемость — 52 и 46 % соответственно.
Таким образом, при хроническом миелолейкозе показана высокая эффективность двух альтернативных методов терапии: с помощью ингибитора тирозинкиназы (гливека) и алло-ТГСК от родственного и неродственного доноров. Выбор в пользу алло-трансплантации гемопоэтических стволовых клеток неоднозначен ввиду большой вероятности развития после трансплантации тяжелых, вплоть до летальных, осложнений. Для снижения вероятности их развития особое внимание уделяется оценке применения при ХМЛ алло-трансплантации гемопоэтических стволовых клеток с «немиелоаблативными» режимами кондиционирования.
Все имеющиеся в настоящее время данные свидетельствуют о перспективности внедрения при хроническом миелолейкозе алло-ТГСК с «немиелоаблативными» режимами кондиционирования, 5-летняя безрецидивная выживаемость при этом достигает 85 %. Аргументом в пользу более широкого внедрения этого вида алло-трансплантации гемопоэтических стволовых клеток при хроническом миелолейкозе (ХМЛ) является доказанная эффективность адоптивной иммунотерапии при данном заболевании. Так, вероятность достижения повторной гематологической, цитогенетической и молекулярнобиологической ремиссии у больных с рецидивом ХМЛ после алло-трансплантации гемопоэтических стволовых клеток при введении донорских лимфоцитов (DLI — donor lymphocyte infusion) без/с последующим применением ИЛ-2 составляет 60 %.
Применение алло-трансплантации гемопоэтических стволовых клеток с режимами кондиционирования с уменьшенной дозой, комбинируя цитостатический и иммунологический эффекты, позволяет расширить возрастной диапазон использования алло-трансплантации гемопоэтических стволовых клеток и существенно уменьшает токсические последствия высокодозной химиотерапии. Последнее обстоятельство может быть актуально не только для больных старшей возрастной группы (старше 50 лет), но и для пациентов молодого возраста, поскольку для многих из них предоставит возможность избежать осложнений позднего периода, в том числе потерю фертильной функции.
Попытки внедрения ауто-трансплантации гемопоэтических стволовых клеток как метода лечения больных хроническим миелолейкозом до сих пор не получили широкого распространения. Это связано со сложностью в достижении приемлемой для получения аутологичного трансплантата эрадикации злокачественного клона клеток из костного мозга с помощью ранее известных протоколов терапии (гидроксимочевина, IСЕ-протокол, интерферон). В настоящее время достижение полной ремиссии, в том числе молекулярно-биологической, у больных хроническим миелолейкозом (ХМЛ) на фоне использования гливека создает условия для выделения аутологичных гемопоэтических стволовых клеток из нормального клона клеток, что в свою очередь повысит интерес к применению ауто-трансплантации гемопоэтических стволовых клеток у данной категории пациентов.
Таким образом, алло-трансплантации гемопоэтических стволовых клеток у взрослых больных ХМЛ до настоящего времени остается одним из основных методов лечения. Определение суммы прогностических параметров (индексы Sokol, European) позволяет принять решение о сроках проведения алло-трансплантации гемопоэтических стволовых клеток у конкретного больного. Необходимо учитывать, что наилучшие результаты после алло-трансплантации гемопоэтических стволовых клеток при ХМЛ наблюдаются при ее выполнении в первый год с момента постановки диагноза; кроме того, имеется зависимость общей выживаемости от стадии ХМЛ (хроническая стадия, стадия акселерации, властный криз). Только алло-ТГСК позволяет достичь состояния полной ремиссии болезни, включая молекулярно-биологическую, у подавляющего большинства пациентов на протяжении многих лет, что свидетельствует о полном излечении.
Большая вероятность развития тяжелых осложнений при выполнении алло-трансплантации гемопоэтических стволовых клеток, сопровождающихся высокой летальностью, а также наличие высокоэффективного и безопасного препарата — ингибитора тирозинкиназы ограничивают перспективу применения алло-ТГСК при ХМЛ. Алло-трансплантациф гемопоэтических стволовых клеток может быть отложена до окончательного определения роли гливека в лечении конкретного больного ХМЛ и рассматриваться как вторая линия терапии при отсутствии эффекта. Эти рекомендации будут изменены только в случае появления новых данных, свидетельствующих о высокой частоте рецидивов и ранних сроках развития резистентности к гливеку у больных ХМЛ при оценке отдаленных результатов (5 и 10 лет наблюдения).
При наличии родственного донора ГСК сроки проведения алло-трансплантации гемопоэтических стволовых клеток при хроническом миелолейкозе могут быть определены на основании стратегии работы центра трансплантации и согласия больного при полной информированности о преимуществах и недостатках возможных методов терапии.
В качестве первой линии терапии применение алло-трансплантации гемопоэтических стволовых клеток от родственного и неродственного донора при ХМЛ обосновано у больных с отрицательными прогностическими факторами в момент постановки диагноза (в соответствии с индексами Sokol, European).
Абсолютные показания к алло-трансплантации гемопоэтических стволовых клеток имеются при наличии признаков прогрессии хронического миелолейкоза, при этом скорость ее выполнения зависит от возможности быстрого получения аллогенного трансплантата. Это обстоятельство делает целесообразным осуществление HLA-типирования пациента и членов его семьи в момент постановки диагноза ХМЛ для выявления родственного донора ГСК. В случае его отсутствия как можно раньше желательно выполнить предварительный поиск неродственного донора в Международном регистре. В последующем эти мероприятия позволят сократить время для поиска реального неродственного донора ГСК при изменении течения болезни.
В течение многих лет отмечался значительный рост числа трансплантаций гемопоэтических стволовых клеток. За последние годы общее количество трансплантаций гемопоэтических стволовых клеток в мире не увеличивается и находится на плато на уровне 15 000 для алло-трансплантации гемопоэтических стволовых клеток с тенденцией к снижению до 25 000—30 000 для ауто-трансплантации гемопоэтических стволовых клеток в год.
Эти данные не связаны с уменьшением общей потребности в трансплантации гемопоэтических стволовых клеток, а являются отражением сложившейся в мире ситуации. Высокоиндустриальные страны достигли порога интенсивности в применении метода: количество трансплантаций гемопоэтических стволовых клеток в год колеблется от 200 до 500 на 10 млн населения.
В других странах внедрение трансплантации гемопоэтических стволовых клеток сопряжено с внутренними экономическими проблемами. Число ауто-трансплантаций гемопоэтических стволовых клеток имеет тенденцию к снижению также за счет пересмотра при ряде заболеваний показаний к ее проведению (например, острые лейкозы, рак молочной железы).
По данным Европейской группы по трансплантации (ЕВМТ — European Group for Blood and Marrow Transplantation), ежегодно в Европе выполняется около 8000 алло-ТГСК (из них 3300 от неродственного донора) и около 13 000 ауто-трансплантаций гемопоэтических стволовых клеток. Распределение выполненных ауто-трансплантаций гемопоэтических стволовых клеток по заболеваниям следующее: ОМЛ - 9,2 %, МДС - 0,3 %, ОЛЛ - 4,2 %, ХМЛ-2,2%, ХЛЛ-1%, НХЛ-26,6%, ЛХ-10,2%, ММ-18,3%.
Из общего количества алло-трансплантаций гемопоэтических стволовых клеток в год, по данным ЕВМТ, распределение по нозологическим формам представлено следующими заболеваниями: ОМЛ - 24,9 %, МДС - 6,1 %, ОЛЛ - 20 %, ХМЛ - 23,9%, ХЛЛ-0,9%, НХЛ-4,8%, ЛХ-0,7%, ММ-3,3 %.
Эти данные в основном отражают общую тенденцию в мире при определении показаний к трансплантации гемопоэтических стволовых клеток у взрослых с учетом результатов стандартной химиотерапии.
Необходимо отметить, что показания к трансплантации гемопоэтических стволовых клеток до сих пор являются предметом дискуссии, что связано с отсутствием в ряде случаев явных преимуществ алло-трансплантации гемопоэтических стволовых клеток и особенно ауто-трансплантации гемопоэтических стволовых клеток по сравнению со стандартными методами цитостатической терапии. До настоящего времени нет однозначного мнения о сроках выполнения трансплантации гемопоэтических стволовых клеток при ОЛЛ, ОМЛ, ХМЛ, некоторых вариантах НХЛ.
Центры, специализирующиеся в области трансплантации гемопоэтических стволовых клеток, проводят лечение как по собственным протоколам с применением новейших цитостатических препаратов и учетом различных прогностических факторов (в первую очередь молекулярно-биологических), так и в рамках многоцентровых исследований.
Показания к алло-трансплантации гемопоэтических стволовых клеток при наличии совместимого донора могут быть определены на одном из этапов лечения больных с любым вариантом лейкоза или лимфомы. Основанием для применения этого метода является анализ следующих факторов: возраст больного, гистологический (морфологический) вариант болезни, стадия, количество лейкоцитов в момент постановки диагноза, характер цитогенетических изменений, ответ на предшествующие курсы химиотерапии, наличие молекулярно-биологических признаков «минимальной остаточной болезни» после первичного и последующих курсов цитостатической терапии.
Алло-трансплантация гемопоэтических стволовых клеток является эффективным методом терапии больных с острым миелобластным лейкозом (ОМЛ); острым лимфобластным лейкозом (ОЛЛ); миелодиспластическими синдромами (МДС); хроническим миелолейкозом (ХМЛ: хроническая стадия, прогрессирующая стадия, бластный криз); неходжкинской лимфомой (НХЛ); множественной миеломой (ММ); хроническим лимфолейкозом (ХЛЛ); лимфомой Ходжкина (ЛХ); хроническим идиопатическим миелофиброзом (ХИМФ).
Трансплантация гемопоэтических стволовых клеток у детей.
Что такое Трансплантация костного мозга?
Трансплантация костного мозга (ТКМ) - на данный момент чаще называется трансплантацией гемопоэтических стволовых клеток (ТГСК), поскольку в качестве источников стволовых клеток в настоящий момент могут также использоваться периферическая и пуповинная кровь.
У детей трансплантация костного мозга используется в качестве метода лечения при многих заболеваниях, включая онкогематологические заболевания, лимфопролиферативные гемобластозы, иммунодефициты, недостаточность костного мозга и врожденные метаболические заболевания.
ТГСК может быть одним из компонентов протокола лечения некоторых заболеваний или единственный куративным методом при других.
Есть два основных типа ТГСК:
Аутологичная ТГСК (ауто-ТГСК) когда пациенту вводят его собственные гемопоэтичексие клетки
Аллогенная ТГСК (алло-ТГСК) когда пациенту вводят гемопоэтические клетки донора. Донор может быть родственным (член семьи) или неродственным.
Первая аллогенная трансплантация стволовых клеток была проведена в 1957 году Э.Д. Томасом. Первые успешные трансплантации стволовых клеток в истории начались в 1968 году с пациентов, у которых был диагностирован тяжелый комбинированный иммунодефицит и синдром Вискотта-Олдрича. Первая успешная трансплантация от неродственного донора была выполнена в 1973 году 5-летнему ребенку с диагнозом тяжелый комбинированный иммунодефицит. Определение антигенов лейкоцитов человека (HLA) обеспечило совместимость тканей между пациентом и донором, и это открытие стало наиболее важным шагом к успешной трансплантации. Шансы найти подходящих неродственных доноров увеличились в результате развития банка данных доноров клеток костного мозга и пуповинной крови.
Режимы подготовки (кондиционирования).
Целью режима кондиционирования при ТГСК является подготовка пациента к трансплантации, и она состоит из трех различных компонентов: «обеспечение места в костном мозге», «иммуносупрессия» и «устранение заболевания».
Обеспечение пространства в костном мозге необходимо для того, чтобы стволовые клетки донора достигли «ниши» и «приживления».
Отторжение трансплантата иммунными клетками реципиента (человека с заболеванием, которому делают пересадку) может быть предотвращено с помощью иммуносупрессии.
Поскольку долгосрочный прогноз связан с контролем заболевания при злокачественных новообразованиях, основной целью режима кондиционирования является борьба с основнм заболеванием.
Комбинация цитостатических препаратов и лучевого воздействия (тотальное облучение тела) применяется с целью создания в организме реципиента состояния иммунологической толерантности для обеспечения приживления ГСК донора при алло-ТГСК. При выборе оптимального режима для конкретного больного учитываются многие факторы, среди которых наиболее важными являются возраст, общее состояние пациента и имеющиеся осложнения, характер и стадия заболевания, особенности донора, профилактика РТПХ
Тот факт, что побочные эффекты режима подготовки (кондиционирования), как правило, переносятся лучше у детей по сравнению со взрослыми, позволяет применять у них более высокие дозы химиопрепаратов. С другой стороны, режимы, в которых выполняется полное облучение организма, у детей могут привести к поздним осложнениям, включая задержку роста, пубертатную недостаточность или задержку полового созревания, которые более важны для детей.
Во многих исследованиях, сравнивающих режимы на основе общего облучения тела с протоколами, содержащими только химиотерапию, не было продемонстрировано никакой разницы с точки зрения прогноза.
Наиболее часто используемые режимы у детей - это режимы, в которых циклофосфамид и бусульфан используются вместе. Различные химиотерапевтические препараты также могут быть добавлены в зависимости от основного заболевания, особенно при врожденных генетических заболеваниях.
Режимы пониженной интенсивности в настоящий момент вышли на передний план, чтобы уменьшить побочные эффекты режимов кондиционирования. Однако опыт работы с детьми в этой области ограничен. В протоколах пониженной интенсивности наиболее часто используемым препаратом является флударабин.
Читайте также:
- Принципы операций при врожденной и травматической катаракте. Тактика
- Помрачение сознания. Делирий. Делириозный синдром. Эпидемиология делирия. Симптомы делирия. Симптомы делириозного состояния.
- Липосаркома глазницы: признаки, гистология, лечение, прогноз
- Субъективная оценка слуха тональной аудиометрией
- Рентгенография, КТ при язве желудка
