Положение больного, анестезия при лапароскопии. Наложение пневмоперитонеума
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Видеолапароскопические манипуляции имеют ряд неоспоримых преимуществ перед лапаротомическими операциями по поводу бесплодия: минимальная травматичность, уменьшение риска возникновения спаек в области хирургического вмешательства, лучший косметический эффект благодаря отсутствию послеоперационного рубца, снижение дозы анестетиков при проведении общего обезболивания и анальгетиков в интра- и послеоперационный периоды, сокращение в 2-3 раза времени пребывания больных в стационаре, более быстрая послеоперационная реабилитация и возвращение к трудовой деятельности, уменьшение стоимости лечения. Накопленный нами опыт показывает, что успех этих операций в значительной мере определяется адекватностью их анестезиологического обеспечения.
Анестезиологическое пособие при лапароскопических операциях имеет ряд особенностей. Пациентки, страдающие бесплодием, как правило, эмоционально чрезвычайно лабильны, боятся предстоящей операции и тревожатся за ее исход. Тяжелые психоэмоциональные переживания обусловливают возникновение неврозов и психопатий, поэтому у больных нередко выявляется не всегда объяснимая непереносимость к лекарственным препаратам, в том числе и применяемым для общей анестезии. В этой связи накануне и в день операции они нуждаются в премедикации с использованием бензодиазепинов.
Лапароскопические операции на органах малого таза требуют соблюдения ряда условий, главными из которых являются положение Тренделенбурга и наложение пневмоперитонеума, при котором внутрибрюшное давление достигает 20-40 мм рт. ст. [7]. Эти обстоятельства сопровождаются существенными нарушениями легочной вентиляции, газообмена и гемодинамики. Наблюдается снижение растяжимости легочной ткани (на 47%), уменьшение ФОЕ (в среднем на 500 мл), повышение пикового давления (на 50%) и давления плато (на 81%), что обусловливает у ряда больных выраженную гиперкапнию и ацидоз. Положение Тренделенбурга обеспечивает увеличение венозного возврата крови к сердцу и способствует поддержанию должных параметров сердечного выброса, однако наложение пневмоперитонеума с повышением внутрибрюшного давления свыше 30 мм рт. ст. приводит к повышению внутрисосудистого сопротивления, снижению преднагрузки и сердечного выброса, что проявляется тахикардией, артериальной гипотензией, снижением центрального венозного давления. Наложение пневмоперитонеума углекислым газом обеспечивает профилактику газовой эмболии. С другой стороны, абсорбция инсуффлированного в брюшную полость углекислого газа вызывает умеренный ацидоз и гиперкапнию, что оказывает негативное влияние па гемодинамику и фармакокинетику используемых препаратов [1,4,6].
Проведение лапароскопических операции требует достаточного обзора всей зоны малого таза, что достижимо только в условиях хорошей мышечной релаксации. Манипуляции в области обширных рефлексогенных зон малого таза, крупных сосудов и забрюшинного пространства предусматривают в процессе анестезии обеспечение адекватной анальгезии и нейровегетативной защиты. При положении Тренделенбурга необходима свободная проходимость дыхательных путей. Все вышеуказанное свидетельствует, что методом выбора при лапароскопических операциях в гинекологии является анестезия с управляемым дыханием. Профилактика расстройств газообмена и постуральных гемодинамических реакций в определенной степени достигается выбором рационального режима ИВЛ и методом анестезии, что и явилось предметом представленного исследования.
Материалы и методы исследования
Проведено ретроспективное исследование историй болезни 200 женщин в возрасте от 19 до 35 лет, поступивших в клинику по поводу бесплодия. Ни у одной из них не было серьезной экстрагенитальной патологии, риск анестезии относился к 1 степени по классификации ASA. Всем пациенткам были выполнены одинаковые по травматичности и продолжительности операции. В зависимости от метода анестезии больные были разделены на 4 группы (по 50 пациенток в каждой). В 1-й группе применена кетамин-седуксеновая анестезия, во 2-й в качестве базисного компонента использовали дормикум, в 3-й применена нейролептанальгезия (НЛА), в 4-й — упреждающая анальгезия кеторолом на фоне анестезии диприваном.
В процессе операций осуществляли мониторный контроль витальных функций с помощью пульсоксиметрии, регистрации ЭКГ, артериального давления и капнометрии аппаратом «9100 Multigas» фирмы «BCI International». Центральную гемодинамику оценивали методом тетраполярной реографии. Определяли уровень катехоламинемии на травматичных этапах операции (методика ИФА, тест-система CetCombi/Adrenalin/Noradrenalin), показатели газообмена и КОС (рО2, SpO2, pCO2, pH, BE, SB), часовой диурез. Различия между показателями считали статистически достоверными при р
Результаты исследования и их обсуждение
Больные 1-й группы (седуксен-кетаминовая анестезия) вечером накануне операции получали таблетированную премедикацию, включающую диазепам и антигистаминные препараты. За 30 мин до операции внутримышечно вводили атропин (0,1% 0,5 мл), димедрол (1% 1,0 мл), фентанил (0,005% 2 мл), седуксен (5% 2,0 мл). Индукцию анестезии проводили кетамином (2 мг/кг). Для мышечной релаксации вводили листенон. После интубации трахеи анестезию поддерживали фракционным введением кетамина (6 мг/кг-ч) и седуксена (0,2 мг/кг-ч), мышечную релаксацию тракриумом.
У больных 3-й группы таблетированная премедикация включала феназепам и димедрол. За 30 мин до операции внутримышечно вводили препараты, аналогичные примененным в 1-й группе. Индукция анестезии — тиопентал-натрий (5-7 мг/кг), поддержание фентанил (3 мкг/кг-ч) и дроперидол (150 мкг/кгч) с ингаляцией закисно-кислородной смесью в соотношении 2:1, миоплегия - тракриум. Показатели центральной гемодинамики на всех этапах операции не претерпевали существенных изменений по сравнению с исходными величинами. Отмечалось лишь некоторое снижение общего периферического сопротивления без особых сдвигов параметров сердечного выброса и артериального давления. Самостоятельное дыхание восстановилось через 15±2,3 мин, необходимость в продленной ИВЛ отмечена у 6 (12%) пациенток, пробуждение наступило через 20±2,2 мин. У 4 (8%) возникли ПОТР. В послеоперационном обезболивании нуждались 20 (40%) больных.
Профилактика ПОТР является актуальной проблемой современной анестезиологии. В настоящее время она наряду с медицинскими аспектами приобретает социально-экономический характер. Даже при успешной операции ПОТР формирует у пациента негативное отношение к качеству работы персонала, вызывает необходимость дополнительного наблюдения за пациентками в послеоперационной палате, увеличивает время пребывания в клинике и стоимость лечения самой ПОТР и связанных с ней осложнений, которые могут быть и смертельными. По ряду прогностических признаков (женский иол, молодой возраст, продолжительность анестезии, высокое внутрибрюшное давление, ПОТР в анамнезе, постуральные реакции и др.) исследуемые больные входят в группу высокого риска данного осложнения [6]. Изучая возможность профилактики ПОТР с помощью высокоселективного антагониста серотониновых 5НТз-рецепторов зофрана (ондансетрон), мы убедились, что 8 мг препарата, введенные внутривенно перед операцией, позволяют полностью контролировать ПОТР в условиях использованных методов анестезии [8]. Однако применение зофрана приводит к значительному удорожанию анестезиологического пособия.
У пациентов 4-й группы была применена упреждающая анальгезия кеторолом (кеторолак трометамин). Из большого числа современных нестероидных противовоспалительных препаратов (НПВП) мы предпочли кеторол, так как он известен как средство с выраженным анальгетическим эффектом, поскольку из всех НПВП является самым мощным ингибитором циклооксигеназы [2, 5]. Кеторол вводили за 30 мин до операции в дозе 60 мг внутримышечно в составе премедикации: атропин (0,1% 0,6 мл) и димедрол (1% 1,0 мл). Индукция анестезии достигалась пропофолом (2,5 мг/кг) и фентанилом (1,7 мкг/кг). Поддержание анестезии осуществляли инфузией пропофола (6-8 мг/кг-ч), а миорелаксацию введением тракриума. Данный вариант анестезии характеризовался умеренной гипотонией (систолическое давление снижалось в среднем на 10,0±0,8%) за счет уменьшения общего периферического сопротивления, при этом не происходило существенного изменения сердечного выброса. Самостоятельное дыхание восстанавливалось через 3,0±1,2 мин, ни в одном случае не требовалось продленной ИВЛ. Пробуждение наступало через 4±1,4 мин. Послеоперационной тошноты не отмечалось ни у одной больной. Никому не потребовалось послеоперационное обезболивание, поскольку анальгетический эффект кеторола сохраняется до 6 ч. Никаких осложнений, свойственных НПВП (ульцерогенный эффект, нарушения гемостаза, увеличение риска артериальной гипертензии, ослабление эффектов гипотензивной терапии, задержка жидкости и обострение хронической сердечной недостаточности [2, 3], мы не наблюдали, что, по-видимому, связано с однократным введением препарата.
Для оценки адекватности четырех вариантов примененной анестезии были выполнены специальные исследования. В них использовали критерии, предложенные Ф.Ф. Белоярцевым [1]. Оказалось, что у больных всех групп во время операции увеличение диастолического давления и объемного содержания кислорода венозной крови не превышало 20%, диурез не снижался
Таким образом, проведенные исследования показали, что каждый из 4 вариантов анестезии при манипуляционных лапароскопических гинекологических операциях по поводу бесплодия обеспечивает ее адекватность. Несмотря на негативное влияние на сердечно-сосудистую систему пневмоперитонеума и положение Тренделенбурга, ни в одной группе не диагностировано грубых расстройств гемодинамики. Исключение составили лишь 6 больных 1-й группы, у которых на введение кетамина отмечена выраженная активация симпатоадреналовой системы, обусловившая сдвиги гемодинамических показателей.
Основные недостатки и достоинства примененных технологий проявились в раннем послеоперационном периоде. Для их детального анализа проведена сравнительная оценка течения послеоперационного периода в четырех группах больных (табл.)
Таблица
Течение раннего послеоперационного периода у больных, перенесших
гинекологические лапароскопические операции по поводу бесплодия
| Показатели (М±m) | Группы | |||
| 1 | 2 | 3 | 4 | |
| Восстановление спонтанного дыхания, мин | 16,0 ±2,2 | 17,0 ±1,9 | 15,0 ±2,3 | 3,0 ± 1,2* |
| Пробуждение, мин | 24,0 ±2,1 | 22,0 ± 2,3 | 20,0 ± 2,2 | 4,0 ± 1,4* |
| Число больных, нуждавшихся в ИВЛ, % | 8,0 ± 3,8 | 10,0 ±4,2 | 12,0 ±4,6 | - |
| Число больных, нуждавшихся в послеоперационном обезболивании, % | 36,0 ± 6,8 | 29,0 ± 6,3 | 40,0 ± 6,9 | - |
| Число больных с ПОТР, % | 6,0 ± 3,3 | 8,0 ± 3,8 | 8,0 ± 3,8 | - |
| * - р | ||||
Проведенные исследования показали, что упреждающая анальгезия кеторолом на фоне дипривановой анестезии имеет неоспоримые преимущества перед другими способами анестезиологического обеспечения и в современных условиях может являться методом выбора при лапароскопических гинекологических операциях по поводу бесплодия. Как уже указывалось выше, положение Тренделенбурга и пневмоперитонеум обусловливают высокое стояние диафрагмы. ИВЛ с использованием большого дыхательного объема ведет к значительному повышению внутрилегочного давления, что усиливает неравномерность вентиляции и перфузии в легких, уменьшает легочный кровоток, повышает внутрилегочное шунтирование венозной крови. Чтобы избежать указанных нежелательных эффектов ИВЛ, адекватный режим вентиляции достигался дыхательным объемом, не превышающим 300-500 мл, и увеличением частоты дыхания до 25-30 в мин. Такой режим вентиляции не сопровождался существенными изменениями параметров пульсоксиметрии, капнометрии и газового состава крови. Чтобы избежать негативных явлений, обусловленных абсорбцией инсуффлированного в брюшную полость углекислого газа, наложение пневмоперитонеума проводили теплым стерильным воздухом с автоматическим контролем внутрибрюшного давления (инсуффлятор Schtorz). Никаких осложнений, связанных с использованием воздуха, не возникало.
- Упреждающая анальгезия кеторолом в комплексе с диприваном обеспечивает адекватную анестезию при проведении лапароскопических гинекологических операций по поводу бесплодия.
- При проведении данной анестезии достигается быстрое пробуждение и восстановление спонтанного дыхания, не требуется продленной ИВЛ в послеоперационном периоде.
- Использование этого метода анестезии не сопровождалось возникновением послеоперационной тошноты и рвоты, не требовало послеоперационной анальгезии.
Материал опубликован в журнале «Клиническая анестезиология и реаниматология» 2005. Т. 2. №1
Положение больного, анестезия при лапароскопии. Наложение пневмоперитонеума
Методика проведения лапароскопии.
Ниже представлена методика лапароскопии:
1. Лапароскопию проводят под эндотрахеальным наркозом с применением миорелаксантов и искусственной вентиляции легких в горизонтальном положении больного на спине на многофункциональном операционном столе. Операционное после широко обрабатывают антисептиками (хлоргексидин, подо нат).
2. Двумя операционными цапками поперечно с обеих сторон от пупка захватывают и приподнимают переднюю брюшную стенку. В точке, расположенной по средней линии живота на 2—3 см выше пупка, в брюшную полость под углом 90° вводят иглу Вереша или троакар диаметром 10 мм (после надсече-ния кожи и апоневроза) для создания карбоксиперитонеума. Внутрнбрюшное давление доводят до 8—10 мм рт. ст. При наличии рубцов на передней брюшной стенке необходимо учитывать опасность повреждения подпаявшихся к этому участку петель кишечника и вводить иглу Вереша на максимальном удалении от рубцов, чаще всего в левой подвздошной или мезогастральной области.
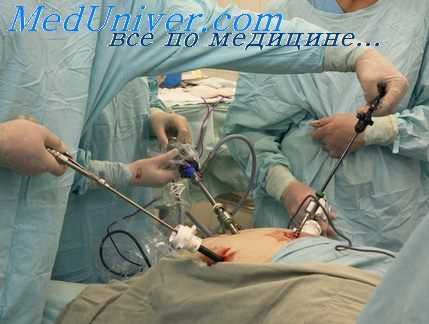
3. После наложения пневмоперитонеума в брюшную полость через троакар диаметром 10 мм вводят рабочий лапароскоп с присоединенной к окуляру насадкой видеокамеры, передающей изображение на монитор. Внутрнбрюшное давление к этому моменту доводят до 14—15 мм рт. ст. Монитор располагают на противоположной от оператора стороне. Хирург и операционная сестра, как правило, находятся слева от больного а ассистент — справа.
4. Выполняют предварительную ревизию брюшной полости. Признаками перитонита являются мутный выпот в отлогих местах брюшной полости, налет фибрина на брюшине, гиперемия, вздутие петель кишечника. При выявлении гемоперитоне-ума определяют места наибольшего скопления крови и его объем. Обнаружение в брюшной полости желчи или мочи считают признаками повреждения органов билиопанкреатодуоденаль-ной области или мочевого пузыря.
5. При отсутствии явных признаков повреждений, являющихся показанием к лапаротомии, проводят общую комплексную ревизию органов брюшной полости, включающую осмотр обеих долей печени, желчного пузыря, диафрагмы, передней стенки желудка, селезенки, органов малого таза, всех отделов толстой и тонкой кишки, париетальной брюшины. Осмотр органов брюшной полости облегчается использованием лапароскопических манипуляторов, вводимых в брюшную полость через дополнительный доступ (доступы) в мезогастральной области.
6. При отсутствии показаний к лапаротомии исследование завершают дренированием брюшной полости через порт лапароскопа или манипулятора. Дренажи из брюшной полости удаляют через 2-3 дня при отсутствии поступления по ним патологического отделяемого.
7. Завершающий этап исследования включает удаление из брюшной полости троакаров с инструментами, оптики, десуфляции газа, ушивании ран передней брюшной стенки
В наших наблюдениях у 11 из 120 больных (9,2 %) неправильная интерпретация данных лапароскопии (поверхностные разрывы печени и брыжейки с гемоперитонеумом менее 200 мл при остановившемся кровотечении, просачивание крови из забрюшинной гематомы) привела к выполнению диагностических лапаротомий.
- Вернуться в оглавление раздела "Неотложная хирургия."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Введение лапароскопа. Осмотр органов брюшной полости при лапароскопии
Введение лапароскопа. Выбор места введения лапароскопа в брюшную полость зависит от цели исследования. Наиболее удобная точка расположена на 1,5-2 см влево от срединной линии и на 1 см выше пупка. В детской практике эта точка является универсальной, так как относительно малые размеры брюшной полости и достаточная рабочая длина лапароскопа при изменении положения тела больного позволяют осмотреть из этой точки органы верхнего этажа брюшной полости, а также органы нижнего этажа и малого таза. В месте, выбранном для введения лапароскопа, накладывают П-образный шелковый шов с захватом апоневроза. После разреза кожи длиной 0,5-1 см максимально поднимают брюшную стенку за концы лигатуры и противоположную петлю шва.
Осмотр органов брюшной полости. При лапароскопии рекомендуют придерживаться строгой системы визуального наблюдения.
При нахождении оператора слева осматривают следующие отделы брюшной полости: 1) правый верхний квадрант - правый купол диафрагмы, правую долю печени, желчный пузырь, круглую и серповидную связку печени; 2) левый верхний квадрант - круглую и серповидную связки печени слева, левый купол диафрагмы, левую долю печени, переднюю стенку желудка, селезенку (если она доступна осмотру); 3) мезогастральную область - большой сальник, петли тонкой кишки, ее брыжейку и видимые части поперечной ободочной кишки; 4) правый фланг брюшной полости - правую половину толстой кишки с червеобразным отростком, правую подвздошную ямку, правую половину таза.
Затем оператор переходит на правую сторону и осматривает: 1) левый фланг - нисходящую, сигмовидную кишки, левое поддиафрагмальное пространство, левую подздошную ямку; 2) полость таза с тазовыми органами.
После общего осмотра брюшной полости тщательно изучают характер изменений патологического очага, производят все манипуляции: биопсию, пальпацию, пункцию. В зависимости от цели во время исследования больному придают различные положения.
В положении Тренделенбурга осматривают органы нижнего этажа брюшной полости: матку с придатками, прямую кишку и нижнюю половину сигмовидной, мочевой пузырь.
В положении Фовлера, т. е. с приподнятым головным концом, хорошо видны вся верхняя поверхность печени, желчный пузырь, диафрагма, большой сальник, серповидная и круглая связки печени, желудок, петля тонкого кишечника, увеличенная селезенка.
В положении больного на левом боку создаются условия для осмотра правой половины полости: латерального канала, париетальной брюшины правой половины живота, червеобразного отростка со слепой кишкой, восходящей кишки, печеночного угла, толстой кишки, правой доли печени.
В положении ребенка на правом боку можно осмотреть левый боковой канал, париетальную брюшину левой половины брюшной стенки, сигмовидную и часть прямой кишки, нисходящий отдел и селезеночный угол толстой кишки, увеличенную селезенку, левую половину печени. При необходимости через второй прокол вводят зонд-манипулятор, которым можно сместить прикрывающий органы сальник, приподнять печень для осмотра ее нижней поверхности, отодвинуть желудок для осмотра поджелудочной железы. Используя такой манипулятор, можно производить инструментальную пальпацию, определяя консистенцию органа, участки уплотнения и т. д.
Анестезиологическое обеспечение лапароскопических операций в гинекологии
Изучено влияние различных видов анестезии на основные параметры жизненно важных функций организма у 243 пациенток при выполнении оперативных лапароскопий. Установлено, что оптимальные условия для нормального функционирования сердечнососудистой системы и мозгового кровообращения создаются при эпидуральной и комбинированной анестезии. Внутривенный наркоз может применяться только для обезболивания кратковременных плановых операций у молодых женщин без экстрагенитальной патологии. Эндотрахеальный наркоз, длительная эпидуральная анестезия и комбинированная анестезия достаточно адекватны и эффективны, могут быть использованы для обезболивания лапароскопических гинекологических операций любого объема. В.В. Щепатов, Ю.В. Земсков, Н.М. Мазурская, А.А. Попов
Московский областной НИИ акушерства и гинекологии Минздрава России (директор института - член-корр. РАМН, проф. В.И. Краснопольский).
В связи с этим целью работы явились разработка и научное обоснование схемы адекватного анестезиологического пособия при различном объеме хирургического лапароскопического вмешательства у больных с различной степенью анестезиологического риска.
Нами изучено влияние различных видов анестезии на основные параметры жизненно важных функций организма у 243 пациенток при выполнении оперативных лапароскопии. Для обезболивания применялись различные виды наркоза: внутривенная анестезия (1-я группа, 120 пациенток), эндотрахеальный наркоз (2-я группа, 75 пациенток), длительная эпидуральная анестезия (3-я группа, 26 пациенток) и комбинированная анестезия - сочетание длительной эпидуральной анестезии и эндотрахеального наркоза (4-я группа, 22 пациентки).
Внутривенную анестезию проводили на основе кетамина. За 30-40 мин до операции проводилась премедикация внутримышечным введением дропери-дола в дозе 0,1 мг/кг и диазепама 0,15 мг/кг. Начальная доза кетамина (0,7-2 мг/кг) вводилась внутривенно медленно. При повторном введении препарата применяли 1/2-1/3 первоначальной дозы. Средняя доза составила 1,8+/-0,026 мг/кг/ч. Средняя продолжительность наркоза составила 54+/-2,56 мин.
При эндотрахеальном наркозе премедикация выполнялась за 30-40 мин до операции атропином в дозе 0,01-0,015 мг/кг. При вводном наркозе кетамином в комплекс премедикации включались дроперидол в дозе 0,2 мг/кг и диазепам (седуксен) 0,15 мг/кг. При использовании гексенала в комплексе премедикации применялись димедрол в средней дозе 0,15 мг/кг и диазепам (0,15 мг/кг). Базис-наркоз включал в себя использование недеполяризующих миорелаксантов: ардуана (0,07-0,08 мг/кг/ч) или тубокурарина (0,3-0,4 мг/кг). Средняя продолжительность эндотрахеального наркоза составила 98+/-3,16 мин.
Длительная перидуральная анестезия предусматривала проведение премедикации внутримышечным введением промедола (0,3 мг/кг), димедрола (0,15 мг/кг) и диазепама (0,15 мг/кг) за 30-40 мин до анестезии. Проведение длительной эпидуральной анестезии при гинекологической лапароскопии имеет свои особенности, связанные с длительным нахождением больной в положении Трендсленбурга, поэтому анестезия выполнялась в модификации, позволяющей использовать данный метод. Пункцию эпидурального пространства выполняли не в типичном для анестезии органов малого таза месте ТhXII-LI, а на одну-две позиции ниже - LI-LII, LIII, учитывая распространение анестетика краниально. В асептических условиях пунктировали, а затем катетеризировали эпидуральное пространство. Катетер вводили в каудальном направлении на 1-1,5 см, что обеспечивало его срединное положение. После введения пробной дозы (2 мл 2% раствора лидокаина, в положении пациентки на боку, медленно в течение 6-8 мин вводили основную дозу (в положении пациентки на спине). Основная доза составила от 6 до 20 мг, средняя - 14+/-0,69 мм 2% растворалидокаина. Экспозиция после введения основной дозы составила 20-25 мин.
Нами было использовано положение Тренделенбурга, максимально выгодное для проведения данного вида анестезии: таз и живот больной находились под максимальным углом 20-30°, а грудь и голова - под углом 10-15°. В отсутствие гипотензии голова больной к томуже находилась на небольшом подголовнике. Для выключения сознания анестезию дополняли введением малых доз кетамина (в среднем 25+/-0,27 мг, или 0,35 мг/ кг/ч) и седуксена в стандартной дозе 10 мг. По окончании операции для обеспечения адекватного обезболивания в течение ближайших 24 ч в эпидуральное пространство вводили 2-3 мг морфина. Длительность операции составила от 30 до 127 мин (экстирпация матки), длительность анестезии соответственно 70 и 167 мин.
При комбинированной анестезии пациентке выполнялась эпидуральная анестезия, затем проводилось общее обезболивание. В среднем было использовано 18+/-0,22 мл 2% раствора лидокаина, доза миорелаксантов была в 1,5 раза меньше, чем при эндотрахеальном наркозе. Средняя доза фентанила составила 0,0014 мг/кг/ч. Длительность операции составила от 35 до 150 мин, длительность анестезии - от 70 до 180 мин.
Подавляющее большинство пациенток (88%) находились в возрасте от 28 до 45 лет. Преобладающей гинекологической патологией был наружный генитальный эндометриоз II-IV степени распространения (в сочетании с миомой матки почти у 1/3 больных), а также хронические воспалительные заболевания придатков матки. У остальных женщин показанием к оперативной лапароскопии явились доброкачественные опухоли яичников и матки. Таким образом, исследования проводились преимущественно при больших объемах лапароскопических вмешательств: операция на придатках и матке в условиях обширного спаечного процесса. У 60% пациенток была отмечена экстрагенитальная патология: нарушение жирового обмена I-III степени, вегетососудистая дистония и гипертоническая болезнь I стадии, причем если в 1-й группе практически здоровыми были 65% женщин, то в 4-й группе все больные имели экстрагенитальные заболевания.
Анализ показателей центральной гемодинамики у больных всех четырех групп до начала анестезии выявил умеренное увеличение ОПС, СДД и ЧСС, отражающие явления вазоконстрикции в результате психоэмоционального напряжения перед операцией. При внутривенном наркозе был выявлен гиперкинетический тип кровообращения, связанный с положительным инотропным действием кетамина. УО снижался в среднем на 6%, сохранение и некоторое увеличение МОК происходило за счет увеличения ЧСС, что обеспечивало стабильную гемодинамику. В условиях эндотрахеального наркоза стабильность МОК обеспечивалась только компенсаторным увеличением ЧСС. Ударный объем сердца снижался в среднем на 10%. Это хотя и явилось адекватным и обеспечивающим безопасное проведение наркоза, однако не оптимальным для работы сердечно-сосудистой системы. В 3-й группе больных после проведения эпиблокады наблюдалось достоверное увеличение УО в среднем на 10% и соответственно увеличение МОК при стабильной ЧСС. На заключительном этапе исследования произошло улучшение показателей гемодинамики даже по сравнению с начальными параметрами: так, ЧСС снизилась в среднем на 11 уд/мин, СДД - на 10 мм рт. ст. Таким образом, прирост МОК у больных при использовании длительной эпидуральной анестезии осуществлялся за счет увеличения УО, а не учащения ЧСС, что свидетельствовало о более экономной, чем при других видах анестезии работе сердца. В 4-й группе в условиях комбинированной анестезии происходила стабилизация и улучшение показателей гемодинамики уже на II этапе исследования: происходило увеличение УО на 12% и МОК на 15% при стабильной ЧСС. На III этапе МОК и УО сохранялись на исходном уровне. Только на заключительном этапе исследования происходило умеренное увеличение ЧСС. Таким образом, в 4-й группе (комбинированная анестезия) прирост МОК на протяжении всей операции осуществлялся за счет увеличения сердечного выброса, как и у больных с длительной эпидуральной анестезией, что характеризовало работу сердца как экономную, и лишь к концу операции наряду с увеличением сердечного выброса происходило компенсаторное увеличение ЧСС. Показатели ОПС и СДД отражают, в свою очередь, наличие сосудистого спазма и его степень. В 1-й и 3-й группах (длительная эпидуральная и внутривенная анестезия) уже на II этапе исследования практически ликвидировались явления ангиоспазма, сохранявшиеся у больных при эндотрахеальном и комбинированном наркозах. При комбинированной анестезии ОПС снизилось на III этапе исследования, полная ликвидация сосудистого спазма наблюдалась к концу операции. Во 2-й группе (эндотрахеальный наркоз) ОПС оставалось на стабильно повышенном уровне на всех этапах операции, что отражало длительный сосудистый спазм. Изменения СДД у всех больных на этапах операции выявили тенденции, аналогичные таковым при исследовании ОПС: благоприятные при длительной эпидуральной, внутривенной и комбинированной анестезии и допустимые, но не оптимальные во 2-й группе (эндотрахеальный наркоз).
Исследования сократительной функции миокарда при различных видах анестезии свидетельствовали о достаточной функциональной способности миокарда левого желудочка у всех больных, несмотря на возникающие достоверные изменения в пределах допустимых значений, т.е. показали адекватность анестезии и эффективность каждого вида обезболивания.
При выполнении лапароскопии в условиях внутривенной анестезии на протяжении всей операции сохранялось увеличение кровенаполнения сосудов головного мозга, наиболее выраженное на II этапе исследования: увеличение объемной скорости мозгового кровотика более чем на 60% и умеренное на остальных этапах операции (увеличение Км на 44% в травматичные моменты и на 18% по окончании операции). Во 2-й группе (эндотрахеальный наркоз) также отмечалось достоверное увеличение Км. По сравнению с 1-й группой (внутривенный наркоз) интенсивность мозгового кровотока к середине операции во 2-й группе была увеличена в меньшей степени (соответственно на 12 и 14%), т.е. наблюдалось умеренное увеличение кровенаполнения сосудов головного мозга, однако в конце операции Км достигала максимального значения среди больных всех групп. В 3-й группе (длительная эпидуральная анестезия) показатели мозгового кровотока были исключительно стабильными на протяжении всех этапов исследования. У больных с комбинированной анестезией изучаемые параметры оставались в пределах допустимых значений на протяжении всей лапароскопии.
Таким образом, результаты исследований показали, что оптимальные условия для поддержания нормального уровня мозгового кровотока были в 3-й и 4-й группах (длительная эпидуральная анестезия и комбинированная анестезия), тогда как изменения уровня мозгового кровотока при внутривенной анестезии (1-я группа) и эндотрахеальном наркозе (2-я группа) свидетельствовали о напряжении компенсаторно-приспособительных механизмов мозгового кровообращения. Полученные данные полностью согласуются с изменениями показателей центральной гемодинамики при тех же способах анестезии и позволяют считать, что длительная эпидуральная и комбинированная анестезия способствуют созданию оптимальных условий для функционирования сердечно-сосудистой системы и мозгового кровообращения.
У пациенток 2-й, 3-й и 4-й групп (эндотрахеальный наркоз, длительная эпидуральная анестезия и комбинированная анестезия) на всех этапах исследований показатели насыщения крови кислородом были стабильными, не выходящими за пределы нормальных, что отражало абсолютно адекватную легочную вентиляцию.
Анализ осложнений показал, что при проведении 243 оперативных лапароскопии длительностью до 3 ч ни в одном случае не было тяжелых осложнений, связанных как с особенностями проведения операций в положении Тренделенбурга, так и осложнений, связанных с техникой проведения наркоза. Угнетение дыхания легкой степени при внутривенной анестезии в 6 случаях при своевременном распознавании купировались дополнительной масочной вентиляцией, в 2 эпизодах при появлении признаков регургитации (у подготовленных больных) пациентки были немедленно интубированы, что позволило избежать тяжелых осложнений. У 2 пациенток (по одной в 3-й и 4-й группах) отмечалась умеренная гипотензия при введении основной дозы анестетика. В положении Тренделенбурга гипотензия не наблюдалась. Из особенностей течения послеоперационного периода следует отметить, что при длительной эпидуральной и комбинированной анестезии пациенток не беспокоили боли, которые наблюдались при проведении внутривенной анестезии и эн-дотрахеального наркоза. Мы расценили это как результат адекватного послеоперационного обезболивания.
Таким образом, анализ полученных данных позволяет сделать следующие выводы.
- Обезболивание лапароскопических операций в гинекологии даже у молодых и соматически здоровых пациенток относится к разряду видов анестезии среднего и высокого риска ввиду возможности развития при срыве адаптационных механизмов острых нарушений мозгового кровообращения, сердечно-сосудистой недостаточности и дыхательных нарушений.
- Внутривенный наркоз может применяться только для обезболивания кратковременных плановых операций (диагностическая лапароскопия, стерилизация, программированная санация брюшной полости) у молодых женщин без экстрагенитальной патологии. При расширении объема операции в процессе лапароскопии тактика анестезиолога должна меняться в пользу выбора эндотрахеального наркоза.
- Эндотрахеальный наркоз, длительная эпидуральная анестезия и комбинированная анестезия достаточно адекватны и эффективны, они могут быть использованы для обезболивания при лапароскопических гинекологических операциях любого объема при условии точного соблюдения методик и достаточной квалификации анестезиолога.
- Длительную эпидуральную и комбинированную анестезию можно рассматривать как альтернативу эндотрахеальному наркозу в связи с возможностью создания оптимальных условий для работы сердечно-сосудистой системы и мозгового кровообращения, особенно у пациенток с экстрагенитальной патологией.
ЛИТЕРАТУРА
1. Галингер Ю.И., Тимошин А.Д. Лапароскопическая холецистактомия. М., 1992. 211 с.
2. Кождан ЕЛ., Максимов Б.И. Состояние центральной гемодинамики во время лапароскопии у больных с заболеваниями печени и желчных путей. М., 1977. 175 с.
3. Пашкова И.Л. Выбор метода анестезии при лапароскопических вмешательствах: Автореф. дисс. . канд. мед. наук. М., 1995. 25 с.
4. Прошина И.В., Сологорский С.В., Лехова О.В. и др. // Вестн. Росс. ассоц. акуш.-гин. 1995. N 3. С. 76-80.
5. Синелукова Н.А. Проблемы нарушения гемодинамики на этапах диагностических лапароскопии и транслапароскопических операций по восстановлению репродуктивной функции у женщин: Автореф. дисс. . канд. мед. наук. М., 1991. 24 с.
6. Стрижаков А.Н., Давыдов А.И. Оперативная лапароскопия в гинекологии: М. Медицина. 1995. С. 37-44.
7. Aho М., Lehtinen А.М., Loatiraiken Т., Kortila К. // Anesthesiology. 1990. Vol. 72. N5. P. 797-802.
8. Luiz I., Huber Т., Hartung H. // Anaesthesist. 1992. Bd. 41. S. 520-526.
Положение больного на столе. Подготовка операционного поля. Ребенка укладывают на операционный стол лицом вверх, ремнями фиксируя к столу. Операционное поле обрабатывают антисептическими растворами, как при обычном хирургическом вмещательстве. Затем среднее поле, где намечены пункции, обкладывают стерильными пеленками и простыней.
Анестезия. Лапароскопию у детей рекомендуют проводить только под общим обезболиванием [Окулов А. Б., 1969; Cadranel S. et al., 1977; Burdelski M., 1979].
В зависимости от опыта анестезиолога, характера предстоящей лапароскопии и длительности вмешательства можно использовать интубационный или масочный наркоз. Применяют различные комбинации наркотических средств (фторотан с закисью азота и с кислородом), нейролептаналгезию в сочетании с закисью азота, внутривенный наркоз в комбинации с закисью азота. При использовании масочного наркоза на отдельных этапах лапароскопии требуется создание искусственного апноэ, что достигается введением миорелаксантов. Для этого больного переводят на принудительную вентиляцию через маску до окончания действия миорелаксантов.
Наложение пневмоперитонеума. Точку для наложения пневмопери-тонеума выбирают с учетом топографического расположения органов брюшной полости и анатомических особенностей передней брюшной стенки. Точка для первого прокола должна быть наименее опасной в плане возможного повреждения иглой органов брюшной полости. Обезопасить пункцию помогает метод, предложенный А.Б. Окуловым (1969). Он состоит в том, что толстой шелковой лигатурой прошивают кожу передней брюшной стенки вместе с апоневрозом в области пупочного кольца, слева и справа от него. Концы лигатуры захватывают зажимом Кохера и брюшную стенку с апоневрозом максимально поднимают кверху (рис. 166).
Затем по срединной линии на 1 см ниже пупка остроконечным скальпелем на коже делают насечку длиной 0,2-0,3 см. Через насечку в живот под углом 45-65° при максимально поднятой кверху брюшной стенке вводят иглу Вереша до ощущения «проваливания в пустоту». В предлагаемом для введения иглы Вереша месте находится наименьшее количество сосудов, что сводит к минимуму риск их ранения. Конец иглы должен свободно перемещаться в брюшной полости. Для подтверждения нахождения иглы в брюшной полости к ней присоединяют 10-граммовый шприц «Рекорд» со свободно скользящим поршнем, запотягивании поршня на себя в шприце появляется кровь, воздух, кишечное содержимое, то можно предположить, что игла либо в сосуде, либо в кишке.
Уточнить местоположение иглы помогает и проба с новокаином. Если под давлением поршня новокаин свободно поступает в брюшную полость, а при освобождении иглы от шприца в ее канале сохраняется вогнутый мениск жидкости, то игла находится в брюшной полости. Если острие иглы упирается в клетчатку или в стенку органа, то новокаин по каплям будет вытекать из иглы наружу.
Некоторые авторы рекомендуют избирать местом прокола у грудных детей медиальный край левой прямой мышцы живота на уровне пупка. Это обусловлено тем, что при тонкой и слабой брюшной стенке через прокол по срединной линии воздух просачивается наружу и трудно поддерживать необходимое давление в брюшной полости.
При наличии выраженной гепатомегалии, спленомегалии или большой опухоли брюшной полости первый прокол брюшной стенки целесообразно делать на границе наружной и средней трети линии, соединяющей пупок и верхнюю переднюю ость левой подвздошной кости. В принципе прокол должен осуществляться вдали от ожидаемой локализации патологического процесса.
Вначале вводят 20-30 мл. При отсутствии изменений в состоянии больного продолжают введение газа в течение 2-3 мин. После введения 300-400 мл газа печеночная тупость исчезает. Более правильно учитывать не общее количество введенного газа, а то давление, которое он создает в брюшной полости [Manegold В., Ioppich J., 1979]. У наркотизированного и релаксированного ребенка оптимальное давление равно 1,33-2,67 кПа (10-20 мм рт.ст.), а скорость введения газа не должна превышать 1 л/мин. Недостаточное давление не обеспечивает необходимых для визуального наблюдения условий. Значительное повышение давления создает угрозу компрессии полой вены.
Имея определенный навык и личный опыт, врач может установить необходимую степень пневмоперитонеума путем пальпации и перкуссии брюшной стенки и соответственно определить возможность дальнейшего этапа лапароскопии - введения троакара.
Читайте также:
