Пороги стимуляции и чувствительности кардиостимулятора - оценка, регуляция
Добавил пользователь Alex Обновлено: 28.01.2026
Annotation
To assess the potentialities of use of the Russia-invented pacing electrode ELBI 211-321 with the function of automated determination of the stimulation threshold and control of the stimulus amplitude using the criterion of R-wave detection, 28 patients were examined.
Номера и рубрики
ВА-N41 от 18/01/2006, стр. 17-20
Развитие систем электрокардиостимуляции идет по разным направлениям, при этом одним из основных является уменьшение потребляемой электрокардиостимулятором (ЭКС) энергии. На это, в частности, направлена работа функций автоматического измерения порога стимуляции и автоматического регулирования амплитуды стимулирующего импульса, которые снижают уровень потребляемой энергии, продлевая срок службы ЭКС. Изучение работы отечественных электродов по параметру детекции R-волны, при включении данных функций поможет врачу в выборе оптимальной тактики в клинических случаях, связанных со сменой ЭКС, имплантацией новых антиаритмических устройств, а также при решении вопроса о применении данной функции при дальнейшем наблюдении пациентов.
Цель исследования - оценка возможности использования отечественных электродов ЭЛБИ 211-321 для ЭКС, имеющих функцию автоматического измерения порога стимуляции и автоматического регулирования амплитуды стимулирующего импульса по критерию детекции R-волны.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
С 2002 по 2005 год в исследование включены 72 пациента с постоянной формой фибрилляции предсердий (сидром тахикардии-брадикардии) возрасте от 54 до 78 лет, которым были имплантированы ЭКС Affinity SR производства фирмы St. Jude Medical Inc. Исследуемая группа состояла из 28 пациентов с электродами ЭЛБИ 211-321 производства НПФ «Элестим-кардио» (13 мужчин и 15 женщин). Контрольная группа включала 44 пациента (19 мужчин и 25 женщин). с электродами Membrane 1450 (St. Jude Medical). Исследование включало не менее чем трехкратное интраоперационное измерение амплитуды R-волны измерительным прибором ERA-200 (Biotronik) и спустя не более чем два часа после завершения операции с использованием предусмотренных при этом специальных тестов, выполняемых с помощью программатора APS 111 (модель 3500 St. Jude Medical). Динамическое наблюдение включало стандартные проверки и не менее чем трехкратное тестирование R-волны в биполярном режиме (используется для детекции при включенной функции «AutoCapture»). Первые три месяца выполнение данных тестов производилось не менее чем трехкратно (не считая дня операции) спустя семь дней после оперативного вмешательства, 1 месяц и 3 месяца, соответственно. В дальнейшем интервал наблюдения был не менее 1 раза в три месяца на первом году наблюдения и 1 раза в полгода - на втором.
Также анализировались, в том числе и на адекватную детекцию амплитуды R-волны, все электрокардиограммы и данные холтеровского мониторирования полученные за период наблюдения. Тестирование амплитуды R-волны начиная с недельного срока после имплантации ЭКС производилось (при отсутствии противопоказаний) при активированной функции «AutoCapture»
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Во всех наблюдаемых случаях было возможно измерение амплитуды R-волны на всем протяжении наблюдения. Значения данного параметра колебались от минимальных 2 мВ до максимальных 17 мВ. Среднее значение составило 9,4 мВ. Следует однако отметить, что вследствие наличия верхнего предела чувствительности в 12,5 мВ у ЭКС Affinity SR, точное измерение указанного параметра не всегда было возможно. В тех случаях когда амплитуда R-волны превышала имеющейся порог, точное значение данного параметра достоверно определить не представлялось возможным. Таких пациентов было 9 (37%), из них у 3 (12%) амплитуда R-волны превышала указанную границу на всех измерениях производимых нами в процессе исследования. Это свидетельствует как о эффективности работы системы стимуляции по данному параметру, так и о значимой заниженности полученного нами среднего значения. по сравнению с реальными показателями. Этот момент имеет практическое значение, вследствие того что ряд моделей ЭКС не имеет подобного ограничения и измеряет амплитуду R-волны на значениях существенно превышающих 12,5 мВ.
Все данные показатели превышали критический порог (1 мВ), при котором создаются необходимые запасы для работы активированной функции «AutoCapture». На всех снятых нами электрокардиограммах а также представленных ЭКГ и данных холтеровского мониторирования из других учреждении, каких либо признаков позволяющих при детальном анализе предположить нарушение чувствительности системы стимуляции выявлено не было. Предположения о возможной неисправности в том числе и вследствие нарушения чувствительности системы стимуляции возникали при осмотре врачами кардиологами в поликлиниках дважды за период нашего исследования. В одном случае за нарушение детекции R-волны было принято псевдосливное сокращение (нанесение пейсмекером стимула на спонтанную электрическую систолу миокарда) - см. рис. 1.
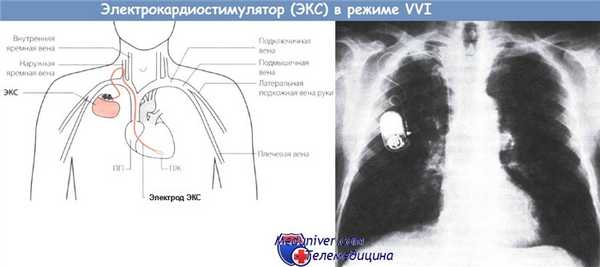
Рис. 1. Работа ЭКС в режиме VVI с включенной функцией "AutoCapture": а - ингибирование системы стимуляции спонтанными электрическими систолами, б - два псевдосливных комплекса QRS, в - два навязанных пейсмейкером комплекса QRS г - сливной комплекс QRS показывает эффективную работу активированной функции нанесения эффективного высокоамплитудного страховочного стимула через 100 мс после отсутствия ожидаемого ответа миокарда на базовый экономный стимул
Это на самом деле не является нарушением системы стимуляции, а отражает нормальную работу ЭКС и в ряде случаев может быть лишь поводом к изменению программы его функционирования [1>. При этом рекомендуется активация функции гистерезиса. Нормальная работа данной функции, как раз и послужила поводом к внеочередной проверке системы стимуляции, у другого пациента. При анализе ЭКГ расстояние между двумя стимулами и между стимулом и спонтанной R-волной имело разную продолжительность (857 мс между артефактами стимула и 1000 мс между зубцом R и стимулом ЭКС) - см. рис. 2.
Рис. 2. Нормальная работа функции гистерезиса: интервал между стимулами составляет 857 мс, между спонтанными сокращениями - 920 мс (т.е. не более запрограммированного значения 1000 мс), между спонтанным и стимулом - 1000 мс.
Подобная ситуация может возникнуть и при нарушении чувствительности по типу «oversensing», хотя для нее, как правило, не характерна столь равномерная и стабильная разница в интервалах. Чаще всего такая электрокардиографическая картина обусловлена активированной функцией гистерезиса, как было и данном случае, когда базовая частота составляла 70 имп/мин, а при срабатывании и гистерезиса - 60 имп/мин. Нормальные результаты тестов и исчезновение подобных электрокардиографических проявлений после выключения данной функции окончательно сняли все сомнения. Получаемая при активации функции гистерезиса ситуация, при которой кардиостимулятор выдает стимулы с частотой 70 имп/мин, но только при снижении частоты собственного ритма менее 60 ударов в минуту, сама по себе снижает потребление энергии системой стимуляции. Не менее важным является, как правило, более высокая гемодинамическая эффективность спонтанных сокращений по сравнению с навязанными от ЭКС при подобном различии в частотах. [2].
Следует отметить что при включении функции «AutoCapture» у однокамерных ЭКС или у двухкамерных ЭКС, работающих в однокамерном режиме, программатор рекомендует активацию функции гистерезиса. Возможна работа и без её включения, но значительный риск возникновения первой описанной нами ситуации ведет как к перерасходу энергии, так и к нарушению диагностической ценности графиков порогов стимуляции [5]. Существуют, однако, ситуации при которой могут возникнуть аналогичные проблемы даже при всех выполненных рекомендациях.
Связаны они с особенностями работы алгоритма детекции эффективности стимула ЭКС функции «AutoCapture». Практически же важно то обстоятельство что применение предложенного нами несложного алгоритма программирования параметров стимуляторов позволяет избегать подобных проблем. Энергосберегающие функции типа «AutoCapture» в улучшенных модификациях, появившихся относительно недавно, («AutoCapture» St. Jude Medical, АКЗ Biotronik и т.п.) [4] способны отслеживать эффективность нанесенного стимула, применяя специальные алгоритмы, что позволяет повысить безопасность применяемых функций, в первую очередь, за счет нанесения дополнительного страховочного импульса при неэффективном стимуле, динамически измерять порог стимуляции подстраивая амплитуду стимулирующего импульса при его изменении. Работа этой функции способна при правильном применении значительно продлить срок службы ЭКС.
В случае функции «AutoCapture» примененной в нашем исследовании, возможность оценки эффективности нанесенного стимула реализована за счет детекции ER сигнала (Evoked Response - ожидаемый ответ). Смысл работы данной функции заключается в анализе потенциала действия кардиомиоцитов спустя 15 мс после нанесенного стимула, а данная зона, как известно, обычно закрыта от детекции рефрактерным или слепым периодом. (рис. 3).
Рис. 3. Принципы работы электрокардиостимулятора при подтверждении эффективности стимула (составная часть функции "AutoCapture")
Появление окна где происходит оценка разности потенциалов и делается возможным определение эффективности стимулов, позволило обеспечить безопасность энергосберегающих функций в частности за счет нанесения дополнительного высокоамплитудного страховочного импульса. Следует отметить что функции энергосбережения в разных ЭКС, хотя и работают по принципиально сходным алгоритмам, все же имеют существенные различия. Так, например, если «AutoCapture» St. Jude Medical и АКЗ Biotronik отслеживают эффективность каждого стимула, то у некоторых ЭКС это делается лишь при измерении порога стимуляции (частота измерений по времени, как правило, регулируется врачом). Таким образом, функции «AutoCapture» и АКЗ обеспечивают кроме нанесения страховочного высокоамплитудного стимула при каждом неэффективном импульсе ЭКС, при необходимости, еще и измерение порога стимуляции вне установленного графика.[5]
Следует особо отметить что работа подобных функций, как правило, возможна лишь при низкой поляризации электродов что чаще всего напрямую зависит от фрактальности последних. Хотя данная тема и очень важна для правильного представления при активаций функций подобного уровня, ограничимся литературной ссылкой [3], и указанием на то что хотя и отечественные электроды ЭЛБИ 211-321 и имеют достаточно низкий уровень поляризации, возможность включения функции «AutoCapture» у них по данному параметру, по сравнению, с электродами специально разработанными фирмой производителем для работы с данной функцией (Membrane 1450 St. Jude Medical) на 3-4 % ниже. Сравнивать, к сожалению, приходилось только с зарубежными электродами, так как оценки возможности применения других отечественных электродов по данному критерию на настоящий момент в клинической практике не проводились.
Практически важным оказалось то обстоятельство, что амплитуда ER сигнала может превышать амплитуду R волны более чем в два раза. При этом программатор в автоматическом режиме рекомендует значение чувствительности к ER сигналу, превышающую амплитуду R волны. А учитывая нерегулярность спонтанного ритма при мерцательной аритмии, оказалось практически возможным появления спонтанной R волны в окне ER детектора c нанесением страховочного стимула на сливное или псевдосливное сокращение в ситуации когда значение чувствительности к ER сигналу выше амплитуды спонтанной R волны (рис. 4).
Рис. 4. Электрокардиографический пример отсутствия детекции спонтанной R волны в окне детектора ER сигнала при неоптимизированной чувствительности, стрелкой отмечен страховочный импульс.
Если же значение чувствительности ER детектора в ручном режиме скорректировать с тем чтобы его значение не превышало хотя бы 3/4 значения (в оптимальном случае 2-3 кратный запас) спонтанной R волны то нанесения страховочного стимула, и как следствие, ненужного перерасхода энергии удается избежать (рис. 5.).
Рис. 5. Эффективная детекция спонтанной R волны в окне детектора ER сигнала при коррекции чувствительности с учетом аиплитуды R волны.
Таким образом предложенный нами алгоритм программирования заключается в следующем: при фибрилляции предсердий с частотами спонтанного ритма близкими к частоте стимуляции значение чувствительности к ER сигналу целесообразно выставлять ориентируясь как на амплитуду ER волны, так и на амплитуду спонтанной R волны, создавая необходимые запасы по обоим параметрам, несмотря на то что автоматический алгоритм ориентирован только на один из показателей. Конечно, данные рекомендации должны быть применены исходя из конкретной клинической ситуации, с учетом всех других данных. Так, например, постановка ЭКС с одновременным выполнением радиочастотной аблации пучка Гиса делает данные рекомендации не актуальными, вследствие снижения частоты или полного отсутствия спонтанного ритма.
Пороги стимуляции и чувствительности кардиостимулятора - оценка, регуляция
Возможности современных электрокардиостимуляторов (ЭКС)
1. Возможности программирования электрокардиостимулятора
В программируемых электрокардиостимуляторов (ЭКС) неинвазивным методом с помощью радиочастотных сигналов, генерируемых внешним программирующим устройством (программатором), можно отрегулировать как одну функцию, так и несколько.
Возможности программирования позволяют оптимизировать работу электрокардиостимулятора (ЭКС) с учетом индивидуальных особенностей пациента и, кроме того, могут быть использованы для диагностики и лечения некоторых осложнений, связанных с работой электрокардиостимуляторов (ЭКС).
Регулированию доступен широкий круг параметров, примеры которых вместе с типичным диапазоном значений приведены ниже:
1. Нижний предел частоты стимуляции (30-150 уд./мин).
2. Амплитуда импульса (2,5-7,5 В).
3. Продолжительность импульса (0,1-1,0 мс).
4. Чувствительность (0,25-8 мВ).
5. Режим стимуляции (например, AAI, VVI, DDD, частотная адаптация, переключение режимов).
6. Рефрактерный период (200-500 мс).
7. Полярность стимуляции (уни- или биполярная).
8. Верхний предел частоты стимуляции - для двухкамерных и частотно-адаптивных электрокардиостимуляторов (ЭКС) (100-180 уд./мин).
9. АВ-задержка - для двухкамерных стимуляторов (0-300 мс).
10. Максимальная частота сокращений предсердий, при которой с такой же частотой будут стимулироваться желудочки.
11. Максимальная частота стимуляции, разрешенная по команде сенсора физической активности.
12. Величина гистерезиса.
13. Сохранение в памяти регистрируемых электрограмм (предсердной, желудочковой или обеих).
Стимуляторы имеют возможность программирования гистерезиса, т.е. величины запаздывания, перед нанесением первого стимула после спонтанного комплекса. Другими словами, так называемый выскальзывающий интервал (т.е. интервал между спонтанным комплексом и нанесением очередного стимула) может быть больше, чем интервал стимуляции.
Например, ЭКС можно запрограммировать на стимуляцию желудочка с частотой 70 имп./мин, которая включится лишь в том случае, если частота спонтанного ритма сердца снизится ниже 40 уд./мин. Это позволяет избежать возможных проблем, связанных с утратой АВ-синхронии.
В то время как для многих пациентов с электрокардиостимуляторами (ЭКС) низкая ЧСС в покое может быть вполне оптимальна, она неприемлема для больных с эпизодом острой сердечной недостаточности или массивной кровопотерей. Часто упускается из вида, что в подобных случаях электрокардиостимуляторы (ЭКС) можно временно перепрограммировать на стимуляцию сердца с более высокой частотой, что способствует лечению.
2. Автоматический контроль эффективности стимуляции кардиостимулятором и ее коррекция
В некоторых ЭКС имеется возможность верификации эффективности каждого нанесенного стимула, т.е. анализа того, привел ли стимул к активации миокарда. Эта возможность обеспечивает работу алгоритмов, позволяющих достичь эффективной стимуляции миокарда импульсами, величина которых чуть выше пороговой.
Если нанесенный стимул не вызвал активации миокарда, то ЭКС немедленно генерирует повторный импульс более высокой амплитуды. Таким образом, функция автоматического анализа и коррекции стимуляции продлевает срок жизни источника питания и представляет собой безопасное средство, позволяющее стимулятору самому адаптироваться к изменившемуся порогу стимуляции.
3. Телеметрические данные с электрокардиостимулятора (ЭКС)
В наиболее современных кардиостимуляторах имеется возможность телеметрической передачи электрограмм - как регистрируемых в режиме реального времени, так и сохраненных в памяти устройства.
Другие телеметрически передаваемые данные содержат информацию о том, как стимулятор был запрограммирован, каковы импеданс электрода, импеданс и состояние источника питания, процентное соотношение времени стимуляции и ингибирования, границы диапазона частоты стимуляции и спонтанного ритма сердца.
Последние данные могут оказаться полезными при программировании частотно-адаптивных устройств, поскольку позволяют убедиться в том, что сенсор обеспечивает адекватный хронотропный ответ на нагрузку.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Установка кардиостимулятора - имплантация искусственного водителя ритма сердца
Для имплантации искусственного водителя ритма (ИВР) должны быть обеспечены возможности рентгеноскопии, контроля ЭКГ и проведения сердечно-легочной реанимации. Обычно процедура выполняется под местной анестезией и занимает менее 45 мин. Часто применяется седативная подготовка. Обязательно строгое соблюдение правил асептики. Необходима тщательная обработка рук, так как хирургические перчатки не обеспечивают надежного барьера для инфекции.
Установка кардиостимулятора через подключичный доступ
Этот доступ широко используется. Электроды искусственного водителя ритма (ИВР) вводятся через подключичную вену путем ее пункции и подсоединяются к генератору, который имплантируется в подкожный карман, формируемый над большой грудной мышцей.
Обычно используется левая подключичная вена. Однако в отдельных случаях имеется функционирующая левая верхняя полая вена, дренирующаяся непосредственно в коронарный синус, через который в таких случаях приходится вводить предсердный и/или желудочковый электрод. Обычно это выполнимо, однако технически сложно.
Функционирующая левая верхняя полая вена чаще всего встречается у лиц с врожденными пороками сердца, особенно с дефектом межпредсердной перегородки. Если известно, что у пациента имеется врожденный порок сердца, предпочтительнее использовать правый подключичный доступ.
Разрез кожи выполняется на 2 см ниже границы внутренней и средней третей ключицы и расширяется в нижнелатеральном направлении примерно до 6 см. Путем тупой отслойки тканей формируется подкожный карман, достаточный для имплантации генератора. Осуществить пункцию подключичной вены намного проще, если она расширена: этому способствует придание кровати положения со слегка опущенным изголовьем.
В качестве альтернативы больному следует слегка приподнять ноги. Дегидратация приводит к значительному снижению венозного давления и, следовательно, затрудняет пункцию. Следует избегать дегидратации или заранее корригировать ее.
Иглу вводят в точку, расположенную сразу под нижним краем ключицы на границе внутренней и средней ее третей по направлению к грудино-ключичному сочленению так, чтобы она прошла позади задней поверхности ключицы. При проколе вены венозная кровь легко аспирируется шприцем. Появление в шприце только тонкой струйки крови заставляет предположить, что кончик иглы не в вене.
Аспирация воздуха или появление яркой пульсирующей струйки крови указывает на пункцию плевры или подключичной артерии соответственно. Если пациент имеет «глубокую» грудную клетку и особенно если ключицы изогнуты кпереди, следует вводить иглу латеральнее и направлять ее слегка кзади.
Затем производится канюляция вены. Для этого через иглу вводят гибкий направляющий проводник с J-образным концом. Если по мере его продвижения появляется ощущение сопротивления, это означает, что проводник находится не в вене. Проводник вводят в верхнюю полую вену и контролируют его положение с помощью рентгеноскопии. (Если проводник визуализируется по центру грудной клетки, это может указывать на то, что пунктирована не вена, а подключичная артерия, и кончик проводника находится в аорте.).
Затем иглу удаляют, а в вену по проводнику устанавливают интродьюсер со вставленным в него сосудистым дилататором. После этого дилататор и проводник удаляют, а через интродьюсер вводят электрод.
Если планируется установить второй или третий электрод, то через интродьюсер в вену вводят соответствующее количество проводников. Затем интродьюсер удаляют и по каждому из проводников последовательно вводят отдельный интродьюсер с дилататором. Применяются разрывные (peel-away) интродьюсеры, удалению которых не мешает коннектор, находящийся на проксимальном конце электрода.
Электроды, проведенные в ушко правого предсердия (ПП), в область выносящего тракта и верхушки правого желудочка (ПЖ)
(так называемая бифокальная стимуляция) через персистирующую левую верхнюю полую вену.
Установка кардиостимулятора через латеральную подкожную вену руки
Альтернативой пункции подключичной вены является рассечение латеральной подкожной вены руки в дельтопекторальной борозде. Этот доступ позволяет избежать рисков, связанных с пункцией подключичной вены, однако иногда эта вена недостаточно велика, в связи с чем в ряде случаев возникают сложности проведения электрода из латеральной подкожной вены руки в подключичную.
Однако применение проводника с гидрофильным покрытием, по которому затем вводится интродьюсер, значительно облегчает преодоление изгибов по ходу латеральной подкожной вены руки.
Установка желудочкового электрода
Чтобы обеспечить манипулирование очень гибким электродом для постоянной стимуляции, в его внутренний просвет вводится направляющий стилет. Формирование легкого изгиба дистальной части стилета или его небольшое вытягивание из электрода облегчает установку.
Электрод проводится в правое предсердие (ПП). Затем иногда сразу удается продвинуть его через трехстворчатый клапан прямо в правый желудочек (ПЖ). Однако чаще для этого необходимо сначала сформировать петлю в предсердии, для чего кончик электрода следует упереть в стенку предсердия, а затем продвинуть электрод чуть вперед. После этого, вращая электрод вокруг оси, можно приблизить его кончик к трехстворчатому клапану. Легкое вытягивание электрода назад позволяет его кончику «провалиться» через клапан в желудочек.
Прохождение электрода через клапан всегда провоцирует желудочковую эктопическую активность. Если желудочковая эктопическая активность не возникает, то трехстворчатый клапан, скорее всего, не преодолен, а электрод, вероятно, находится в коронарном синусе.
Нахождение электрода в желудочке можно подтвердить, продвинув его в легочную артерию. С помощью вращательных и поступательных движений кончик электрода, уже введенного в правый желудочек (ПЖ), устанавливают в области его верхушки или выносящего тракта. Необходимо убедиться в стабильности положения электрода, подтвердив отсутствие значительного смещения его кончика и устойчивость стимуляции при глубоком дыхании и кашле.
Дополнительным приемом, позволяющим оценить стабильность положения электрода, является попытка частичного извлечения его (так, чтобы его люфт был минимальным) и затем - попытка избыточного продвижения вперед (так, чтобы его люфт оказался избыточным).
Как только положение электрода признано удовлетворительным как с точки зрения стабильности позиции, так и с учетом измерения параметров, важно зафиксировать его с помощью короткой муфты, разместив ее вблизи точки входа в вену и подшив к подлежащей мышце с помощью нерассасывающегося шовного материала. Важно убедиться, что электрод внутри муфты надежно зафиксирован. В противном случае может произойти его смещение.
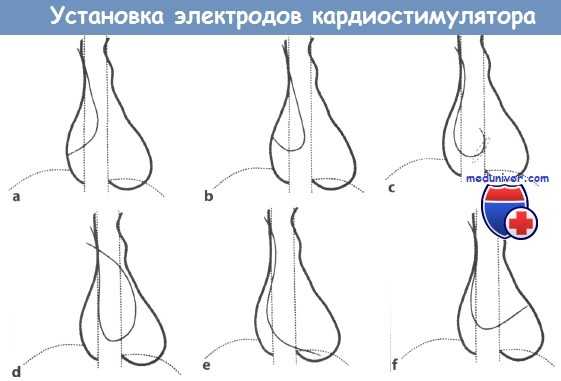
Установка трансвенозного электрода для электрокардиостимулятора (ЭКС):
a, b -в правое предсердие (ПП) формируется петля;
с - петля продвигается к трехстворчатому клапану (пунктирный овал);
d - убедиться в том, что электрод действительно находится в ПЖ, можно, продвинув его в легочную артерию; е - затем электрод устанавливается в области верхушки правого желудочка (ПЖ);
f - характерная картина нахождения электрода в коронарном синусе.
Установка предсердного электрода
Обычным местом стимуляции предсердий является ушко правого предсердия (ПП). При необходимости стимуляцию можно осуществлять с помощью «ввинчивающегося» электрода, располагаемого в межпредсердной перегородке или в свободной стенке ПП. Чтобы установить электрод в ушке ПП, необходимо с помощью прямого стилета продвинуть его кончик в область трехстворчатого клапана. Затем прямой стилет извлекают, а установку электрода в ушке производят при помощи другого стилета, дистальные 5 см которого имеют J-образный загиб.
Если электрод слегка оттянуть от трехстворчатого клапана, его кончик «проваливается» в ушко предсердия.
Правильность позиции подтверждается тем, что при каждой систоле предсердий кончик электрода движется из стороны в сторону. При рентгеноскопии в боковой проекции электрод направлен вперед. Стабильность положения электрода необходимо подтвердить путем его вращения на 45° в обоих направлениях. При этом кончик не должен поворачиваться. Важно правильно отрегулировать люфт электрода. Во время вдоха угол между двумя коленами J-образного электрода не должен превышать 80°.
Формирование кармана для кардиостимулятора
Может показаться, что создание кармана для кардиостимулятора является наименее сложной частью процедуры имплантации. Однако если он сформирован неправильно, вероятно развитие раневых осложнений. Нередко они развиваются спустя несколько месяцев после имплантации.
Подкожный карман для кардиостимулятора обычно формируется путем тупого отслоения тканей. Необходимо тщательно инфильтрировать ткани местным анестетиком. Даже в этом случае некоторые пациенты ощущают дискомфорт в течение 1-2 мин, которые требуются для создания кармана. Важно, чтобы рана была достаточно глубокой для размещения стимулятора на поверхности грудной мышцы.
Частой ошибкой является формирование кармана вплотную к ключице, где подкожная ткань развита слабо. Это увеличивает риск изъязвления кожи в области ИВР. Карман необходимо формировать ниже, что позволит укрыть его более толстым слоем тканей.
В кармане, который слишком велик, возможны повторные повороты стимулятора (как спонтанные, так и в результате внешних воздействий), что может привести к смещению или перелому электрода. При слишком маленьком кармане кожа над стимулятором окажется натянутой, что увеличивает риск ее изъязвления (развития пролежня стимулятора).
Очень худым пациентам или озабоченным тем, чтобы генератор был минимально заметным, устройство можно имплантировать позади грудной мышцы.
Учебное видео катетеризации подключичной вены
Для надежной длительной кардиостимуляции принципиально важно, чтобы пороги стимуляции и чувствительности были низкими. Высокие значения порогов указывают на то, что катод не находится в тесном контакте с возбудимой тканью. После имплантации ИВР пороги возрастают, обычно достигая максимальных значений в период от 3 нед. до 3 мес. после вмешательства. Если они становятся высокими, то могут превысить возможности генератора осуществления функций стимуляции и восприятия спонтанных электрических сигналов сердца. Пороги измеряются с помощью анализатора ИВР.
Порог стимуляции кардиостимулятора
Под порогом стимуляции понимают наименьшую амплитуду электрического стимула (наносимого через катод и не совпадающего по времени с желудочковым эффективным и относительным рефрактерными периодами), которая устойчиво вызывает активацию миокарда.
Для оценки порога стимуляции на анализаторе обычно устанавливается частота импульсов, превышающая частоту спонтанного ритма на 10-20 уд./мин, при такой же продолжительности импульсов, как и в имплантируемом ИВР (обычно 0,5 мс), и при начальной амплитуде стимула 5 В. Для установления величины порога амплитуда стимулов прогрессивно уменьшается до тех пор, пока ритм не перестанет навязываться. Если у пациента отсутствует спонтанный ритм сердца, то после этого амплитуду стимулов следует быстро увеличить, чтобы предотвратить асистолию.
Важно знать, что при увеличении амплитуды стимула от подпороговой величины порог стимуляции окажется существенно выше. Это явление известно под названием феномена Введенского. Таким образом, как только в ходе определения порога стимуляции ритм перестанет навязываться, амплитуду стимулов следует сразу же увеличить по меньшей мере на 2 В.
При продолжительности стимула 0,5 мс порог стимуляции величиной менее 1 В считается удовлетворительным. Нередко порог оказывается ниже 0,5 В. Необходимо заметить, что при использовании ввинчивающихся электродов порог стимуляции первоначально оказывается довольно высоким, однако снижается через 3-4 мин после фиксации.
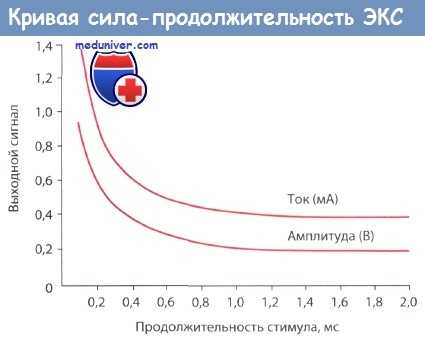
Типичная кривая «сила-продолжительность».
Порог стимуляции измеряется при различной продолжительности импульса.
При увеличении продолжительности импульса более 1,0 мс порог стимуляции перестает снижаться.
Важно, чтобы дистальный и проксимальный полюсы биполярного электрода были правильно подсоединены к катоду (-) и аноду (+) стимулятора соответственно. Если полюсы поменять местами, то измеряемый порог стимуляции будет значительно выше. Чем продолжительнее стимул, тем больше энергии выделяется и, таким образом, тем ниже порог стимуляции. Однако эта зависимость нелинейная: с точки зрения расхода энергии оптимальная продолжительность импульса варьирует от 0,25 до 1,0 мс.
Амплитуду импульса, при которой увеличение его длительности не снижает порог стимуляции, называют реобазой. Наименьшая продолжительность электрического импульса с амплитудой, равной удвоенной величине реобазы, вызывающего активацию, именуется хронаксией.
Для измерения порога стимуляции посредством униполярного электрода его дистальный полюс подсоединяется к катоду стимулятора (-), а проксимальным электродом, подсоединяемым к аноду (+), служит помещенный в рану металлический объект (например, самоудерживающийся ретрактор, помещенный в рану). При этом важно, чтобы площадь поверхности анода примерно соответствовала площади поверхности корпуса кардиостимулятора, иначе порог стимуляции будет ошибочно завышен.
Феномен Введенского.
Порог стимуляции определяется путем прогрессивного снижения (с шагом 0,1 В) амплитуды наносимых на желудочек стимулов до тех пор, пока после второго навязанного комплекса ритм перестает навязываться.
Затем амплитуда стимулов увеличивалась с шагом 0,1 В. Видно, что только после 10 шагов увеличения амплитуды возобновляется эффективная стимуляция желудочков.
Если бы у пациента в это время не было спонтанного ритма сердца, развился бы весьма неприятный эпизод асистолии с вероятной симптоматикой.
Сразу после определения порога стимуляции амплитуду стимулов следует немедленно увеличить по меньшей мере на 2 В.
Порог чувствительности кардиостимулятора
Для надежного восприятия электрической активности сердца важно, чтобы амплитуда внутрисердечной электрограммы, формирующейся в результате спонтанной активности стимулируемой камеры сердца, была достаточной. Обычно амплитуду измеряют с помощью того же анализатора. Амплитуда электрограммы желудочков и предсердий должна быть выше 4 и 2 мВ, соответственно. При пограничных величинах имеет значение скорость нарастания сигнала (т.е. скорость изменения вольтажа). Низкая скорость нарастания может привести к потере чувствительности.
Импеданс электрода кардиостимулятора
С помощью анализатора можно также измерить импеданс электрода, т.е. его электрическое сопротивление. Оно различается у разных электродов, однако обычно составляет порядка 400-1000 Ом.
Низкий импеданс позволяет предположить нарушения изоляции электрода и наличие утечки тока, тогда как высокий импеданс указывает на перелом электрода.
Электрограмма навязанных желудочковых комплексов
При стимуляции верхушки правого желудочка (ПЖ) желудочковые комплексы на ЭКГ будут иметь конфигурацию блокады ЛНПГ с отклонением ЭОС влево. Стимуляция области выносящего тракта ПЖ приводит к отклонению ЭОС вправо с конфигурацией комплексов в виде блокады ЛНПГ, как это бывает при ЖТ, источник которой располагается в области выносящего тракта ПЖ. При случайной стимуляции ЛЖ (в результате попадания электрода в ЛЖ через незаращенное овальное окно) ЭКГ имеет конфигурацию, как при блокаде ПНПГ.
Бивентрикулярная стимуляция, выполняемая с целью ресинхрон изирующей терапии, приводит к формированию относительно узких комплексов.
Стимуляция верхушки правого желудочка (ПЖ): отклонение ЭОС влево в сочетании с картиной блокады ЛНПГ. Электроды для бивентрикулярной стимуляции: на рентгенограмме видны электроды, располагающиеся в ушке ПП (RAA), верхушке ПЖ (RV) и в латеральной ветви коронарного синуса (LV) (а).
Бивентрикулярная стимуляция, при которой продолжительность комплексов QRS меньше, чем при стимуляции одним электродом (б).
Рекомендации больным с имплантированным кардиостимулятором
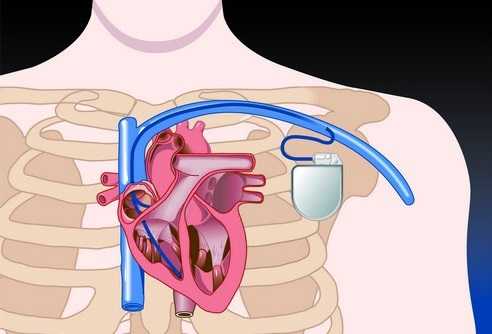
Кардиостимулятор – это медицинский прибор, который поддерживает ритм сердца в нормальном режиме. Операция по установке кардиостимулятора показана тем, у кого наблюдается слишком медленный ритм сердца или присутствует блокада между предсердиями и желудочками (антриовентикулярная блокада).
Операция по имплантации кардиостимулятора является малоинвазивной и может выполняться в условиях операционной, оснащенной рентгеновским аппаратом для мониторинга всех действий кардиохирурга. Для обезболивания применяется местная анестезия.
1. Врач пунктирует подключичную вену и закрепляет в ней интродьюсер, через который продвигает в просвет верхней полой вены электрод.
2. Далее под контролем рентгеноборудования электрод продвигается в правое предсердие или правый желудочек и закрепляется на стенке сердечной камеры. Если имплантируемый кардиостимулятор двух- или трехкамерный, то таким же образом выполняется и имплантация других электродов.
3. После фиксации электродов врач выполняет несколько проб для измерения порога возбудимости, на которые сердце отвечает сокращениями.
4. После получения хорошего графика ЭКГ, полученного с установленных электродов прибора, электроды фиксируются окончательно, и под кожей в подключичной области или под грудной мышцей выполняется «карман» для имплантации корпуса кардиостимулятора.
5. После введения прибора в «карман» и подключения к нему электродов ткани зашиваются.
В общей сложности такая методика операции по имплантации кардиостимулятора занимает не более одного часа.
Некоторое время после имплантации кардиостимулятора пациент может ощущать незначительное неудобство и болезненные ощущения в месте установки прибора. Также на месте введения прибора может образовываться гематома. У некоторых больных возможно повышение температуры тела. Все эти неприятные ощущения устраняются или самостоятельно, или при помощи симптоматической терапии. Как правило, больным после имплантации кардиостимулятора назначается профилактический курс приема антибиотиков. Уже в первый же день после операции большинство больных могут вставать с постели, а через неделю – возвращаются к привычному ритму жизни. Приступать к работе разрешается через 2 недели.
После установки кардиостимулятора больной в целом может вести привычный образ жизни. Большинство разнообразных приборов, оборудования и устройств, окружающих нас дома или на рабочем месте, не влияет на работу кардиостимулятора и может использоваться с минимальными мерами предосторожности или без них. Современные кардиостимуляторы достаточно хорошо защищены от внешних магнитных, электрических и электромагнитных воздействий, встречающихся в повседневной жизни.
Ограничений по питанию у пациентов с кардиостимуляторами нет. Необходимо следовать рекомендациям врача исходя из состояния здоровья и возможной диеты. Вождение транспорта также возможно без ограничений. Однако, необходимо соблюдать правила безопасности и не касаться высоковольтных проводов или проводов электрической системы автомобиля.
В первые три месяца после имплантации желательно ограничить движения рукой со стороны имплантации, избегая резких подъемов выше горизонтальной линии и резких отведений в сторону.
Пациенты с кардиостимуляторами могут заниматься любыми видами спорта, если нет ограничений по состоянию здоровья. Однако есть виды спорта, которых необходимо избегать:
• Контактные виды спорта (такие, как каратэ или футбол). При этих видах спорта есть угроза вызвать удар по области имплантированного кардиостимулятора. Удар, как правило, не может причинить вреда Вашему устройству, но может повредить ткани над кардиостимулятором.
• Стрельба из ружья или винтовки. Не стоит прикладывать приклад ружья в область плеча, где имплантирован кардиостимулятор. Отдача выстрела может привести к травме поверхностных тканей над кардиостимулятором.
• От подводного плавания, ныряния на любую глубину, дайвинга также желательно воздержаться. Разрешается заниматься обычным плаванием.
В любом случае, во время занятий физическими упражнениями необходимо ориентироваться на собственное самочувствие, и прекращать занятия сразу же, как возникнут тревожные симптомы или усталость.
Имплантируемый кардиостимулятор, как правило, не мешает обычной трудовой деятельности пациента. Можно работать по дому или на участке, использовать инструмент, в том числе электроинструмент, при условии его исправности (чтобы не было поражения электрическим током). Следует ограничить применение перфораторов и электродрелей, а также газонокосилок.
Существуют некоторые ограничения по использованию кардиостимуляторов и сотовых телефонов. Рекомендуется располагать телефон на расстоянии не менее 30 см от стимулятора и держать его у уха, противоположного стороне, на которой находится кардиостимулятор. На себе носить сотовый телефон не рекомендуется.
Кардиостимулятор не ограничивает человека в передвижении, и возможно планировать свои поездки на длительный период времени. Средства контроля в магазинах и аэропортах («рамки») испортить стимулятор не могут, однако желательно сократить пребывание в зоне их действия до минимума, так как магнитное поле оказывает влияние только непосредственно в момент прохода через «рамку». Необходимо будет предъявить свое удостоверение (карта пациента) на контрольно-пропускных пунктах в аэропортах, вокзалах, чтобы при необходимости выполнили ручной досмотр.
Однако во избежание сбоев в работе прибора следует соблюдать некоторые важные правила:
- запрещается выполнять магнитно-резонансную томографию (МРТ)
- запрещается использовать бо́льшую часть методов физиотерапии (прогревания, магнитотерапию и т. д.)
- необходимо избегать контакта с сильными электромагнитными источниками: линиями высоковольтных передач, телевизионными вышками, ретрансляторами.
Проверка ЭКС
Первая проверка проводится через 1,5-3 месяца после операции. За это время формируется хронический порог стимуляции, то есть становится возможной окончательная регулировка энергетических параметров стимуляции и можно проводить коррекцию параметров частотной адаптации. В течение первого года желательно провести проверки через 6 и 12 месяцев после операции. Это позволит убедиться в правильности подбора параметров стимуляции и лечебных функций. Далее, при отсутствии жалоб, больной может проходить контрольные осмотры один или два раза в год.
По мере приближения к окончанию срока службы аппарата (7-8 лет), который определен временем разрядки батареи, интервалы между проверками должны укорачиваться, особенно в тех случаях, когда больной «стимуляторзависимый» (собственный ритм сокращений сердца менее 30 в минуту). Важно не пропустить время рекомендуемой замены ЭКС. Обычная проверка ЭКС в кабинете врача включает: регистрацию электрокардиограммы и определение параметров стимуляции с помощью специальных приборов. После проверки может потребоваться перепрограммирование ЭКС, для того чтобы стимуляционная терапия соответствовала состоянию пациента.
Досрочный визит к врачу должен состояться при появлении таких жалоб:
- снижение частоты пульса
- признаки воспаления в области имплантации прибора: покраснение, отек, боль
- появление новых приступов головокружения или обморока.
Таким образом, после установки кардиостимулятора больной в целом может вести привычный образ жизни, однако во избежание сбоев в работе прибора следует соблюдать некоторые правила и проходить регулярное медицинское обследование.
Читайте также:
- Психоневропатии при беременности. Влияние беременности на психику
- Воротниковое пространство плода. Значение воротникового пространства
- КТ, МРТ при отосифилисе
- Диагностика острой сердечной недостаточности. Лечение острой сердечной недостаточности.
- Клиника ранений груди - пневмоторакс, гемоторакс, кровохарканье, тампонада сердца
