Преимущества локальной гипотермии. Эффективность гемостаза при гипотермии
Добавил пользователь Евгений Кузнецов Обновлено: 09.01.2026
Умеренная терапевтическая гипотермия – контролируемое индуцируемое снижение центральной температуры тела у больного до 32 —34°С, с целью снижению риска ишемического повреждения тканей головного мозга после периода нарушения кровообращения [1]
Доказано, что гипотермия оказывает выраженный нейропротективный эффект. В настоящий момент терапевтическая гипотермия рассматривается как основной физический метод нейропротекторной защиты головного мозга, поскольку не существует ни одного, с позиций доказательной медицины, метода фармакологической нейропротекции. Терапевтическая гипотермия входит в стандарты лечения: Международного Комитета Взаимодействия по Реанимации (ILCOR), Американской Ассоциации Кардиологов (AHA), а также клинические рекомендательные протоколы: Ассоциации Нейрохирургов России.
Применение умеренной терапевтическая гипотермии, для снижения рисков возникновения необратимых изменений в мозге, рекомендуется при следующих патологических состояниях:
• Травмы головного мозга с нейрогенной лихорадкой
Пользователи протокола: неонатологи, анестезиологи-реаниматологи (детский) педиатры, врачи общей практики

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Терапевтическая гипотермия проводится детям с гестационным возрастом более 35 недель и массой тела более 1800 г.
Терапевтическая гипотермия снижает смертность и частоту неврологических нарушений у детей с гипоксически-ишемическим поражением головного мозга [1, 2]
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: нет.
Температура тела больного снижается до 32-34°С градусов и поддерживается на таком уровне 24 часа. Врачи должны избегать уменьшения температуры ниже целевого значения. Принятые медицинские стандарты устанавливают, что температура пациента не должна падать ниже порога в 32°C.
Затем температуру тела постепенно поднимают до нормального уровня в течение 12 часов, под контролем компьютера блока управления системы охлаждения/согревания. Согревание пациента должно происходить со скоростью не менее 0,2-0,3°С в час, чтобы избежать осложнений, а именно: аритмии, снижения порога коагуляции, повышения риска инфекции и увеличения риска нарушения баланса электролитов.
Охлаждение осуществляют через катетер, введенный в бедренную вену. Жидкость, циркулирующая в катетере, выводит тепло наружу, не попадая в пациента. Метод позволяет контролировать скорость охлаждения, устанавливать температуру тела в пределах 1°C от целевого значения.
Основным недостатком методики являются серьезные осложнения - кровотечения, тромбоз глубоких вен, инфекции, коагулопатия.
Для неинвазивного метода терапевтической гипотермии сегодня используются специализированные аппараты, состоящие из блока системы охлаждения / согревания на водной основе и теплообменного одеяла. Вода циркулирует через специальное теплообменное одеяло или облегающий жилет на торсе с аппликаторами на ноги. Для снижения температуры с оптимальной скоростью необходимо покрыть теплообменными одеялами не менее 70 % площади поверхности тела пациента. Для локального снижения температуры мозга используют специальный шлем.
Современные системы охлаждения / согревания с микропроцессорным контролем и обратной связью с пациентом, обеспечивают создание управляемой терапевтической гипо/ гипертермии. Прибор контролирует температуру тела пациента с помощью датчика внутренней температуры и корригирует ее, в зависимости от заданных целевых значений, изменяя температуру воды в системе.
Принцип обратной связи с пациентом обеспечивает высокую точность достижения и контроля температуры в первую очередь тела пациента, как во время охлаждения, так и во время последующего согревания. Это важно для минимизации побочных эффектов, связанных с гипотермией.
Нельзя проводить терапевтическую гипотермию новорожденных без инструмента для продолжительного динамического анализа мозговой активности, эффективно дополняющий систему мониторинга жизненных показателей.
Динамика изменения мозговой активности новорожденного, которую невозможно отследить при кратковременном ЭЭГ-исследовании, наглядно представляется при длительном мониторировании ЭЭГ с представлением на экране трендов амплитудно-интегрированной ЭЭГ (аЭЭГ), сжатого спектра и других количественных показателей ЦНС, а также исходного сигнала ЭЭГ по малому количеству отведений ЭЭГ (от 3 до 5).
Паттерны аЭЭГ имеют характерный вид, соответствующий различным нормальным и патологическим состояниям головного мозга.
Тренды аЭЭГ отображают динамику изменения амплитуды ЭЭГ при многочасовых исследованиях в сжатом виде (1 - 100 см/час) и позволяют оценить выраженность гипоксически-ишемических нарушений, характер сна, выявить судорожную активность и дать прогноз неврологического исхода, а также отслеживать изменения аЭЭГ при состояниях, приводящих к гипоксии мозга у новорожденных и наблюдать динамику состояния пациента при лечебных воздействиях.
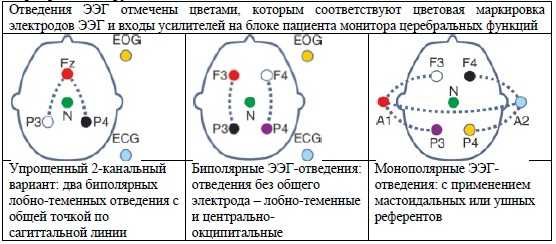
Таблица 1. Типовые варианты схем отведений ЭЭГ при мониторинге церебральных функций
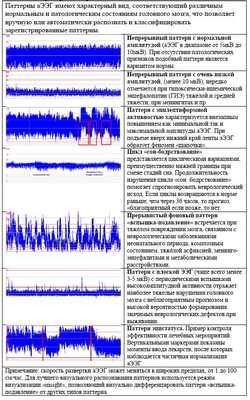
Таблица 2. Примеры паттернов аЭЭГ
Консультация детского невропатолога с целью оценки динамики состояния новорожденного до и после терапевтической гипотермии.
Преимущества локальной гипотермии. Эффективность гемостаза при гипотермии
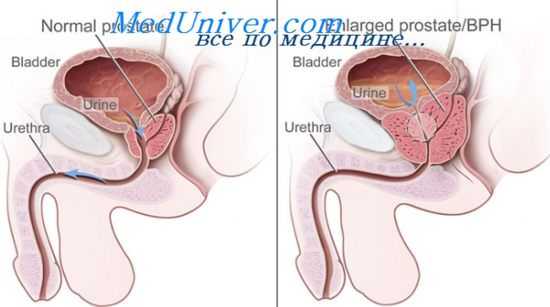
Оценка кровоснабжения при аденоме простаты. Изменения кровотока аденомы при гипотермии
Анализируя реограммы, записанные после вскрытия мочевого пузыря, автор обнаружил, что кровоснабжение исследуемой области ухудшается прямо пропорционально размерам аденомы. У 19 больных, составивших I группу, у которых масса удаленных узлов не превышала 60 г, реографические кривые отличались хорошо выраженной основной волной с хорошей амплитудой.
Восходящая часть крутая, хорошо прослеживается точка быстрого притока крови и точка быстрого наполнения органа кровью. Выражен максимальный пик дифференциальной кривой, характеризующей максимальную скорость наполнения. Однако верхушка слишком закруглена, нисходящая часть имеет несколько увеличенный овал, на некоторых реограммах он напоминает горб, находящийся на уровне верхушки основной волны.
Прямая линия, характерная для межсистолического промежутка, имеет волнообразную форму. Изменения на реограммах свидетельствуют о незначительном нарушении притока крови к органу и выраженном затруднении венозного оттока. У больных с выраженной тахикардией и гипертензией (II группа) реограмма имеет вид зубчатой кривой, анакротическая фаза по длительности становится равной катакротической, линия межсистолического промежутка делается волнообразной.
У 16 больных с массой аденоматозных узлов 61— 80 г отмечалось выраженное снижение амплитуды. Верхушка кривой сглажена, восходящая волна имеет пологий подъем, а нисходящая удлинена, волнообразна, иногда двугорбая. Линия межпульсового промежутка волнистая.
У 4 больных с массой удаленных узлов выше 80 г (III группа) были резко выражены нарушения венозного оттока. Это проявлялось кровотечением из варикозно расширенных вен. На реограммах, записанных после инфильтрации парапростатического пространства охлажденным раствором новокаина, не прослеживалась зависимость от размеров аденоматозных узлов. Реограммы у всех больных имели вид извилистой или прямой линии.
На них нельзя было отметить даже пульсовых колебаний. Это свидетельствует о почти полном стазе крови в сосудах охлажденной области. После удаления аденомы увеличивались амплитуда реографической кривой и реографический индекс. У больных I группы длительность анакротической и катакротической фаз практически не изменилась.
У больных II группы реограммы приобретают волнистую форму, приподнятую над основанием синхронно с пульсовой волной при очень медленном подъеме и крайне низкой амплитуде. У больных III группы систолическая волна реограмм становится более четкой, сглаживается ее двугорбость, возрастает амплитуда.
Восходящий отрезок кривой, характеризующий приток крови к органу, становится более крутым.
Таким образом, степень нарушения кровоснабжения предстательной железы прямо пропорциональна размерам аденомы. В первую очередь страдает венозный отток, но с ростом узлов сдавливаются и артериальные сосуды, в связи с чем уменьшается приток крови к железе. Рано возникающее нарушение венозного оттока ведет к варикозному расширению вен, кровотечению из них, в запущенных случаях — к некрозу тканей.
Инфильтрация тканей, окружающих аденоматозные узлы, охлажденным до +5°С 0,25% раствором новокаина значительно уменьшает кровоток в органе (вплоть до стаза крови в сосудах) на весь период операции. После удаления аденоматозных узлов кровоток постепенно восстанавливается, но до окончания операции остается значительно замедленным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
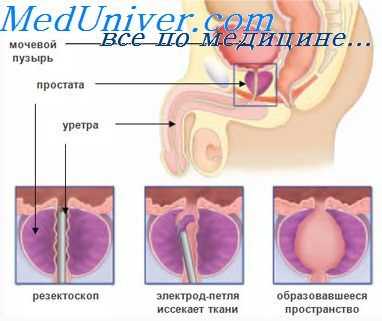
Техника одномоментной чреспузырной аденомэктомии. Местная гипотермия при аденомэктомии
Техника одномоментной чреспузырной аденомэктомии с применением местной гипотермии заключается в следующем.
При одномоментной аденомэктомии пользовались дугообразным виебрюшинным разрезом К. Г. Овнаганяна (1951), который позволяет создать широкую операционную рану,/хорошо осмотреть треугольник пузыря, создает удобства для манипулирования в шейке, наложения гемостатических швов.
У 14 больных с ранее наложенным надлобковым свищом мочевой пузырь вскрывали после» иссечения рубцов разрезом книзу. Рану мочевого пузыря расширяли под контролем глаза. После ревизии мочевого пузыря полупроводниковым электротермометром измеряли температуру в eгo полости. Затем инфильтрировали аденоматозные узлы и подкапсулярное пространство охлажденным до 4-5 °С стерильным 0,25% раствором новокаина.
В начале работы мы использовали шприц с возвратной пружиной, соединенной с емкостью, содержащей охлаждающий раствор.
В процессе работы выявили следующие недостатки этого способа: охлажденная жидкость нагревается в сосуде и особенно в шприце от рук хирурга; трудно создать необходимое давление при нагнетании; неудобно манипулировать в глубине раны длинной иглой, насаженной на шприц. Учитывая это, Б. И. Хлыстун (1981) создал приспособление, состоящее из двуполостного цилиндра.
Наружная полость с двумя штуцерами заполняется охладителем (охлажденным глицерином). Внутренняя полость, в которой движется поршень, заполняется охлажденным 0,25 % раствором новокаина.
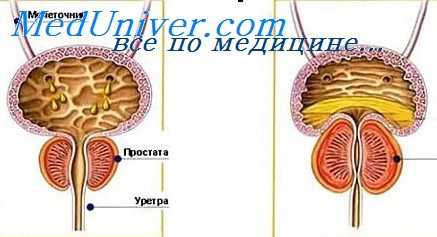
Для контроля создаваемого в цилиндре давления в ручку поршня вмонтирован манометр. Градуировка на штоке поршня позволяет следить за количеством введенной жидкости. Соединение инъекционной иглы со шприцем при помощи гибкого шланга облегчает манипуляции в глубине раны при инфильтрирований тканей. Набор инъекционных игл позволяет подобрать иглу индивидуально по длине и диаметру в зависимости от конституции больного, величины и плотности аденоматозных узлов.
Этот «шприц» не только дает возможность инфильтрировать плотные аденоматозные узлы жидкостью с заданной температурой, давлением и скоростью, но может быть использован в послеоперационный период в качестве капельницы для орошения полости пузыря охлажденным бактериостатическим раствором. Теплоизоляционный слой предохраняет жидкость от согревания вне мочевого пузыря.
Инфильтрация узлов и подкапсулярного пространства проводится следующим образом. Инъекционной иглой, насаженной на гибкую двухстеночную трубку «шприца-манометра», прокалывают слизистую оболочку над одним из аденоматозных узлов и вводят охлажденный раствор под давлением 68,6—98 кПа в зависимости от плотности узла. Конец иглы продвигают в ткань опухоли.
Плотная тяжистая ткань аденомы очень плохо инфильтрируется и практически поршень остается без движения. Продвигая иглу от центра узла к периферии и одновременно поддерживая повышенное давление, замечают момент выхода кончика иглы к капсуле узла по началу движения поршня и падению стрелки манометра обычно до 29,4—39,2 кПа. Оставив в этом положении иглу, продолжают вводить охлажденный стерильный раствор (30—50 мл). Затем, возвратив кончик иглы к центру узла, меняют ее направление и вновь продвигают к периферии. Таким образом каждый пальпируемый узел инфильтруют со всех сторон. Инфильтрацию начинают с задней группы узлов, так как здесь процесс гидравлической отпрепаровки опухоли от капсулы хорошо контролируется пальцем, поднимающим железу со стороны прямой кишки.
При этом чувствуется своеобразное неравномерное наполнение тканей раствором с ощущением похрустывания. Сюда вводят наибольшее количество раствора — от 80 до 100 мл. Так как раствор распространяется вокруг узла во все стороны, начать отслойку целесообразней именно с этого места.
Затем инфильтрируют узел с наружной стороны, где контроль инфильтрации возможен только по скорости продвижения поршня и падению давления в манометре. При инфильтрации стенки узла со стороны опухоли, выступающей в просвет пузыря, дополнительно контроль производят пальцем, введенным в мочевой пузырь. Нагнетая раствор и постепенно вынимая иглу из узла, ощущаем набухание и отслойку тканей. Расслоение тканей быстро распространяется от иглы до перехода на сторону, прилегающую к мочеиспускательному каналу, где слизистая оболочка легко прорывается и раствор изливается в просвет пузыря.
Это обусловлено истончением и рыхлостью слизистой оболочки со стороны мочеиспускательного канала, ее сращением с узлами. Ткани здесь практически лишены крупных сосудов, так как мочеиспускательный канал удлиняется в процессе роста аденоматозных узлов иногда на 7 см и более. Избыток слизистой оболочки удаляют общепринятым способом вместе с аденоматозными узлами. Но если по каким-либо причинам слизистая оболочка со стороны мочеиспускательного канала остается, необходимо ее иссечь, так как она может некротизироваться и стать источником инфекции или образовать клапан, нарушающий мочеиспускание.
Предложенный способ локальной гипотермии имеет свои преимущества: гипотермия резко ограничена по площади, эпицентром ее являются аденоматозные узлы и окружающие их ткани, гипотермический эффект развивается в течение 3—5 мин, что способствует уменьшению длительности операции.
Инфильтрация субкапсулярного пространства значительно облегчает вылущивание аденомы. Изливающаяся из ложа при вылущивании аденомы жидкость разбавляет и вымывает протеолитические ферменты, поступающие из предстательной железы и опухолевых узлов.
После тщательной инфильтрации тканей приступают к вылущиванию узлов аденомы. Проникнув пальцем между хирургической капсулой и аденоматознои тканью, ощущают холод от изливающегося в полость пузыря холодного раствора новокаина. Разница температур между тканями создает дополнительный контроль при выделении узлов.
При неосложненных формах опухоли, когда хорошо дифференцируется строма, в которой преобладает железистая ткань и имеется соединительнотканная капсула, наиболее эффективна гидравлическая отпрепаровка узлов. В отдельных случаях опухоль оказывается почти полностью отслоена от капсулы и держится на слизистой оболочке мочеиспускательного канала и мочевого пузыря.
Поэтому выделение ее не представляет особых трудностей, и кровотечения из ложа практически не бывает. Процесс вылущивания и удаления аденоматозных узлов занимает от 0,5 до 5 мин.
Длительность этого этапа в значительной степени зависит от гистологического строения аденомы, длительности заболевания и предшествующего лечения. С наибольшими трудностями мы встретились при удалении небольших плотных узлов, интимно сросшихся с окружающими тканями, у 16 больных. Они длительное время болели простатитом. При гистологическом исследовании у них были обнаружены аденоматозные узлы с преобладанием соединительной ткани (склеротическая форма аденомы). У некоторых пациентов было хроническое воспаление.
У 97,3 % больных гемостатический эффект гипотермии был хорошим, кровопотеря была незначительной и дополнительных мероприятий для гемостаза не потребовалось. У 2,7 % больных в послеоперационный период продолжалось умеренное кровотечение. Для профилактики кровопотери наложили временный гемостатический шов на ложе желеаы и дренировали полость мочевого пузыря (с постоянным орошением охлажденными бактерицидными растворами).
За основу наложения гемостатического шва был принят метод И. Жувара (1969), согласно которому временный шов на ложе удаленных аденоматозных узлов накладывается с выводом концов нитей по введенной в полость пузыря через надлобковый свищ трубке.
Нити при необходимости можно затягивать и расслаблять. Через мочеиспускательный канал в мочевой пузырь вводят дренажную трубку, на проксимальном конце которой имеется два больших отверстия для оттока мочи. На расстояний 4—5 см от края трубки сделано дополнительное отверстие для вывода в просвет трубки концов нитей после наложения кисетного шва на ложе удаленных узлов.
Дистальней этого отверстия имеются дополнительные 2—3 отверстия побольше (для оттока содержимого из ложа аденомы после затягивания концов гемостатического шва).
После наложения кисетного шва на края слизистой оболочки мочевого пузыря вокруг ложа аденомы при помощи заранее введенного в просвет трубки проводника (длинной нити) через маленькое отверстие в дренажной трубке протягивают оба конца нити наружу, натягивают их и завязывают на дренажной трубке. Параллельно с толстой трубкой в мочевой пузырь вводят ниппельную для капельной ирригации полости мочевого пузыря раствором фурацилина в послеоперационный период.
Регулируя натяжение нитей гемостатического шва, можно при необходимости создавать благоприятные условия для оттока раневого содержимого из ложа аденомы в полость мочевого пузыря (Б. И. Хлистун, 1981).
Терапевтическая гипотермия у новорожденных детей
Гипоксически-ишемическая энцефалопатия (ГИЭ), возникающая вследствие перенесенной асфиксии при рождении, остается одной из самых актуальных проблем неонатологии ввиду высокого риска развития тяжелых неврологических нарушений и летального исхода. По данным мировой статистики, частота тяжелой ГИЭ в популяции новорожденных составляет от 0,37 до 3 на 1000 родившихся живыми [1, 2].
В патогенезе ГИЭ выделяют фазы первичного и вторичного повреждения нервной ткани. Первичное повреждение развивается в момент воздействия асфиксии и характеризуется необратимой гибелью клеток головного мозга, объем которой зависит от глубины и длительности гипоксии. Вторичное повреждение активизируется в фазу реоксигенации – реперфузии спустя 2-12 часов после первичного повреждения. Вторичное повреждение вызывается активизацией ряда патогенетических механизмов: глутаматного и кальциевого стресса, свободнорадикального повреждения, асептического воспалительного процесса, активацией апоптоза, приводящих к увеличению объема нейронального повреждения и ухудшению прогноза для жизни и здоровья [3]. В настоящее время в мировой практике не известен ни один лекарственный препарат, нейропротективные свойства которого могли бы существенно уменьшить повреждающее действие указанных патогенетических механизмов, а его эффективность была бы подтверждена в клинических исследованиях высокого уровня [3, 4].
Одной из перспективных методик, позволяющих снизить неблагоприятные последствия поражения центральной нервной системы (ЦНС), является терапевтическая гипотермия, которая признана наиболее эффективным и безопасным методом нейропротекции у детей, перенесших тяжелую асфиксию при рождении. В многочисленных экспериментальных работах было показано, что гипотермия способствует снижению метаболических потребностей организма [5, 6], уменьшению вторичного энергодефицита клеток [7], блокированию высвобождения глутамата [8], блокированию синтеза свободнорадикальных частиц [9], ингибированию воспаления [10] и апоптоза [3, 11].
В настоящее время в мировой практике применяются такие методы аппаратной терапевтической гипотермии, как селективная (краниоцеребральная) и общая. Проведенные клинические исследования демонстрируют снижение частоты развития детского церебрального паралича и других тяжелых психоневрологических нарушений [27], а также отсутствие достоверных различий в побочных эффектах между этими методами [19]. В то же время в ряде работ указывается на большую эффективность общей гипотермии [19, 28], поэтому в некоторых странах данная методика наиболее приоритетна.
В Кохрановском систематическом обзоре 2013 года было показано статистически значимое снижение летальности у новорожденных с гипоксически- ишемической энцефалопатией, получавших общую гипотермию. В то же время достоверного снижения летальности у новорожденных, которым проводилась селективная гипотермия, выявлено не было [19].
В литературе также обсуждается применение неаппаратной, так называемой пассивной терапевтической гипотермии, и терапевтической гипотермии с использованием охлаждающих термоэлементов, в том случае, если отсутствует возможность проведения аппаратной терапевтической гипотермии. В доступных публикациях демонстрируется улучшение неврологических исходов, но, в т о ж е в ремя предупреждается о высоком риске развития тяжелой гипотермии, приводящей к неблагоприятным эффектам (уровень доказательности 2В) [29, 30, 31]. Ограничением для использования данного метода в рутинной практике являются значительные сложности с прогнозированием скорости снижения температуры у ребенка после начала применения физических методов охлаждения. В исследовании Dahm L.S. и соавт. (1972) показано, что у здорового ребенка при отключении лучистого тепла ректальная температура снижается с 37,5˚С до 36,0˚С через 30 минут после рождения [32]. В 2015 году опубликованы результаты систематического обзора и мета-анализ эффективности терапевтической гипотермии, проводимой при использовании низко-технологичных методик. Результаты анализа показали, что применение данного метода достоверно снижает смертность и неврологическую заболеваемость у новорожденных [63]. Однако все исследователи указывают на высокие риски чрезмерной гипотермии или недопустимых колебаний температуры у детей. Использование пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов должно сопровождаться строгим температурным контролем с целью предотвращения умеренной и тяжелой гипотермии.
Шифры международной классификации болезней 10 пересмотра (МКБ-10), применяемые у детей, нуждающихся в терапевтической гипотермии:
Р91.6 Гипоксически-ишемическая энцефалопатия новорожденного
Тяжелая асфиксия при рождении – это состояние, характеризующееся низкой оценкой по шкале Апгар и комплексом клинико-лабораторных признаков нарушения состояния ребенка [36, 51]. Шифр диагноза по МКБ-10 - Р21.0.
Гипоксически-ишемическая энцефалопатия развивается в первые часы жизни и характеризуется комплексом неврологических нарушений различной степени тяжести, наступивших в результате асфиксии при рождении [36]. Степень тяжести ГИЭ определяется по модифицированной шкале Sarnat Н., Sarnat М. (1976) в модификации Stoll B., Kliegman R. (2004) (приложение 1). Шифр диагноза по МКБ-10 - Р91.6 [50].
Следует отметить, что сама по себе низкая оценка шкале Апгар может быть следствием медикаментозной депрессии плода или других факторов, приводящих к угнетению дыхания, и не всегда является самостоятельным критерием, определяющим наличие гипоксического поражения ЦНС у новорождённого. Лишь комплекс как клинических, так и лабораторных маркеров, включая низкую оценку по шкале Апгар, может говорить об асфиксии в родах, которая, в свою очередь, приводит к ГИЭ различной степени тяжести [36, 51]. ГИЭ средней и тяжелой степени тяжести является показанием для терапевтической гипотермии. При ГИЭ легкой степени терапевтическая гипотермия не показана.
Церебральная ишемия – это состояние, которое возникает в результате широкого спектра причин, приводящих к ишемии мозга, таких, как сепсис, шок, ГИЭ, респираторный дистресс-синдром и прочее. В соответствии с «Классификацией перинатальных поражений нервной системы у новорожденных» (приложение 2) степень церебральной ишемии определяется выраженностью неврологических нарушений, а также характером и распространенностью структурно- морфологических изменений вещества головного мозга.
Диагноз «Церебральная ишемия» выставляется по истечении раннего неонатального периода после уточнения характера и выраженности структурного поражения головного мозга с помощью методов нейровизуализации. Шифр диагноза по МКБ-10 - 91.0.
Читайте также:
- Внезапная сердечная смерть спортсмена
- Как происходит судебное установление отцовства?
- Йод и мерказолил в лечении диффузного токсического зоба. Перхлорат калия при базедовой болезни
- Мышечный кровоток. Гипертрофия сердца при тренировках
- Побочные эффекты лечения флударабином, пентостатином, кладрибином волосатоклеточного лейкоза
