Йод и мерказолил в лечении диффузного токсического зоба. Перхлорат калия при базедовой болезни
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Йод и мерказолил в лечении диффузного токсического зоба. Перхлорат калия при базедовой болезни
Микродозы йода оказывают довольно слабый тиреостатический эффект и поэтому применяются в виде курсового лечения по 20 дней с перерывом в 10 дней главным образом при лепкой форме токсического зоба в качестве предоперационной подготовки в сочетании с мерказолилом. При средней и тяжелой форме токсического зоба применяется более сильный препарат — мерказолил (активно тормозящий биосинтез тиреоидных гормонов).
Лечение мерказолилом требует постоянного применения препарата, начиная с 60—40 мг в убывающих дозах до достижения эутиреоидного эффекта, после чего назначают поддерживающие дозы на срок пс менее 6 месяцев — 1 пода после достижения эутиреоидного состояния для предотвращения рецидива заболевания. Легкие признаки гипотиреоза служат показанием для временной отмены или уменьшения дозы мерказолила. Следует заметить, что на практике редко наблюдается так называемый зобогенный эффект и щитовидная железа постепенно уменьшается до нормального размера.
Лечение мерказолилом применяется и в тех случаях, когда токсический зоб сопровождается тяжелой дистрофией печени с выраженной желтухой, хотя сравнительно недавно лечение мерказолилом в подобных случаях не проводилось ввиду возможного токсического воздействия мерказолила на функции печени. В настоящее время лечение мерказолилом является единственно возможным при этом осложнении.
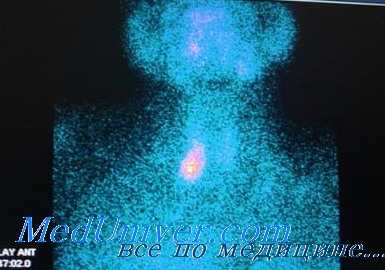
Кроме микродоз йода и мерказолила в лечении токсического зоба используется перхлорат калия в дозах, не превышающих 1 г в сутки. При лечении больных перхлоратом калия нельзя применять йодистые препараты, так как они, увеличивая концентрацию йода в крови, блокируют терапевтический эффект перхлората калия. В настоящее время метод лечения больных перхлоратом калия не получил широкого распространения ввиду трудности подбора необходимой терапевтической дозы (необходим контроль поглощения I131 щитовидной железой) и отсутствия значительных преимуществ перед мерказолилом.
Эффект антитиреоидных препаратов, используемых в лечении токсического зоба, значительно усиливается при комбинированном их применении с резерпином или другими препаратами раувольфии, влияющими на обмен серотонина, а также барбитуратами, тормозящими продукцию ТТГ.
Антитиреоидные препараты обладают некоторым побочным действием, выражающимся в аллергических реакциях и токсических проявлениях. Микродозы йода нередко вызывают явления «йодизма» (насморк, кожные высыпания, зуд). Мерказолил и перхлорат калия могут вызывать повышение температуры, кишечные расстройства, кожные высыпания, а также лейкопению, гипогранулоцитоз, который является серьезным осложнением, требующим постоянного контроля картины крови. Обычно анализы крови повторяются один раз в 1—2 недели.
При наличии лейкопении мерказолил и перхлорат калия необходимо отменить и назначить стимулирующее лейкопоэз лечение (тезан, нуклеиновокислый натрий, лейкоген, метилурацил) в сочетании с предпизолопом. При тяжелой форме токсического зоба, когда нельзя обойтись без Применения тиреостатических средств, лечение проводится в комбинации с указанными выше препаратами под контролем анализов крови. В некоторых случаях уменьшение дозы мерказолила способствует нормализации картины белой крови.
Лечение диффузного токсического зоба. Лекарства для терапии болезни Грейвса
Лечение диффузного токсического зоба в настоящее время осуществляется тремя методами: медикаментозным, хирургическим или радиохирургическим с помощью радионуклида йода. Целью лечения является ликвидация тиреотоксикоза и его проявлений, как клинических, так и лабораторных.
В медикаментозной терапии применяют тиреостатические препараты, соединения йода, карбонат лития, перхлорат калия, бета-блокаторы. Выбор препарата зависит от возраста больного, степени выраженности клинических симптомов, тяжести заболевания, степени увеличения щитовидной железы, наличия других сопутствующих заболеваний и функционального состояния внутренних органов.
Широкое распространение в лечении диффузного токсического зоба получил тиреостатик мерказолил или его аналоги — метимазол, карбимазол, тиамазол. Мерказолил ускоряет выведение из щитовидной железы йодидов, угнетает активность ферментных систем, участвующих в окислении йодидов в йод, что приводит к прекращению йодирования тиреоглобулина и синтеза тиреоидного гормона тироксина. Применяют мерказолил при любом течении диффузного токсического зоба. Препарат назначают внутрь после еды: при заболевании легкой и средней тяжести по 0,005 г 3—4 раза в день, при тяжелом течении — по 0,01 г 3—4 раза в день. Поддерживающую суточную дозу мерказолила принимают в течение нескольких месяцев.
Йодиды — одни из первых лекарственных веществ, которые стали использовать для лечения тиреотоксикоза много десятков лет назад. В настоящее время установлено, что большие дозы йодидов (более чем 0,1 мг на 1 мг массы тела) угнетают транспорт йода и биосинтез тиронинов в тироцитах, а также снижают скорость поступления тиреоидных гормонов из щитовидной железы в кровоток, что вызывает быстрое снижение концентрации тиреоидных гормонов в сыворотке крови. Йодиды применяют при предоперационной подготовке больных с диффузным токсическим зобом, а также вместе с антитиреоидными препаратами при лечении тиреотоксического криза [Балаболкин М.И.]. С этой целью используют раствор Люголя (смесь 5 % йода и 10 % йодида калия). Эффективными являются дозы 2—4 мг йода на 1 кг массы тела в сутки.
Положительное влияние терапевтических доз йодидов (180—200 мг/сут) проявляется уже через 2—3 нед: снижается концентрация тироксина (Т4) и трийодтиронина (Т3) в сыворотке крови, повышается реакция тиреотропного гормона на введение тиролиберина. Одновременно ингибируется биосинтез тиреоидных гормонов в результате нарушения способности щитовидной железы поглощать из крови неорганический йод и снижается скорость секреции Т4 и Т3. Кроме того, уменьшается чувствительность самой железы к стимулирующему действию тиреотропного гормона, а при диффузном токсическом зобе — и к влиянию тиреоидстимулирующих антител. Клинический эффект приема йодидов заключается не только в снижении интенсивности проявлений тиреотоксикоза, но и в уменьшении размеров, плотности и угнетении кровоснабжения щитовидной железы. У больных, ранее лечившихся радионуклидом йода или подвергшихся хирургическому вмешательству, в результате описанной выше терапии могут развиться явления гипотиреоза.
Меньшее распространение для лечения диффузного токсического зоба в настоящее время получили калия перхлорат и лития карбонат. Однако М.И.Балаболкин сообщает о положительных результатах использования карбоната лития в лечении диффузного токсического зоба. Препарат назначали при лечении легкого тиреотоксикоза у больных с диффузным токсическим зобом в суточных дозах 900—1200 мг; при среднетяжелом течении — 1200—1500 мг, при тяжелом течении — 1500—1800 мг. Лечение проводилось в течение 3—4 мес. У этих больных, помимо содержания тиреоидных гормонов в крови, в динамике изучали показатели Т-системы иммунитета, а также показатели активности вилочковой железы.
Под влиянием лечения отмечались снижение концентрации Т4 и Т3 в сыворотке крови. У больных с диффузным токсическим зобом средние показатели Т-системы иммунитета до лечения были значительно ниже по сравнению с таковыми у здоровых лиц. Через 3—4 нед щитовидная железа «ускользала» из-под блокирующего влияния карбоната лития, и отмечался рецидив заболевания, в связи с чем больные были переведены на лечение тиреостатиками.
Бета-адреноблокаторы применяются при диффузном токсическом зобе для снятия гиперактивности симпатической нервной системы и выраженных адренергических симптомов (сердцебиение, раздражительность, тремор, потливость и др.). С этой целью используют неселективные антагонисты: пропранолол (анаприлин, обзидан), надолол, тимолол, пиндолол, лабеталол и бета-селективные антагонисты (метопролол, атенолол, эсмолол, ацебутолол). Кроме неселективных бета-адреноблокаторов, применяют в комплексном лечении диффузного токсического зоба бета-адреноблокатор лопрезор в зависимости от тяжести заболевания в дозах 50—150 мг/сут. При этом у всех больных отмечается положительный эффект: нормализуется масса тела, уменьшаются тремор, потливость, раздражительность, в покое появляется нормосистолия.
Следует, однако, иметь в виду, что бета-адреноблокаторы и другие симпатолитики не являются средством этиотропного лечения диффузного токсического зоба и должны использоваться как средства дополнительной патогенетической терапии. Кроме того, бета-адреноблокаторы следует с осторожностью применять у больных сахарным диабетом, у которых они снижают толерантность к глюкозе и маскируют клинические симптомы гипогликемии. Следует помнить, что бета-адреноблокаторы могут провоцировать проявления синдрома Рейно, усиливать течение бронхиальной астмы и хронических обструктивных заболеваний легких, а также утяжелять сердечно-сосудистую недостаточность, приводить к брадикардии и гипотонии. Поэтому бета-адреноблокаторы потенциально опасны для больных с аритмиями и сердечно-сосудистой недостаточностью.
Неотложная помощь при тиреотоксическом кризе заключается во внутривенном введении 10 мл 10 % раствора йодистого натрия через каждые 8 ч. В случае отсутствия ощутимого эффекта от введения препарата йода его длительное применение нецелесообразно. Спустя 1 ч после первой инъекции йодистого натрия или других препаратов йода (иногда используют внутривенно раствор Люголя: 5—10 мл в 50—100 мл 5 % раствора глюкозы), некоторые авторы предлагают через желудочный зонд вводить 60—100 мг мерказолила (по другим данным, 100— 200 мг).
С целью уменьшения надпочечниковой недостаточности назначают препараты глюкокортикоидов — гидрокортизон внутримышечно с начальной дозы 0,075—0,10 г. Дозу увеличивают в зависимости от тяжести криза. Суточная доза гидрокортизона достигает 0,8—1,0 г. Наиболее эффективным средством, снижающим активность адренергической системы, являются бета-адреноблокаторы. В зависимости от тяжести криза их вводят внутривенно (1—5 мг 1 % раствора индерала) или перорально по 0,02—0,04 г 3—4 раза в день под контролем частоты пульса. Потерю жидкости купируют внутривенным введением изотонического раствора натрия хлорида с 5 % раствором глюкозы, альбумина в общей дозе до 3 л в сутки, при сердечно-сосудистой недостаточности — до 1,5 л. При нарушении кровообращения назначают сердечные гликозиды. При повышении температуры тела, гипоксии, нарушениях со стороны нервной системы используют жаропонижающие, антигистаминные препараты, седативные средства, кислород.
Если комплексная терапия в течение суток не приводит к улучшению состояния больного, применяют перитонеальный или экстракорпоральный диализ, обменную гемотрансфузию или плазмаферез.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение токсического зоба радиоактивным йодом и ее эффективность
Лечение I131 основано на повреждающем щитовидную железу действии бета-излучения и является таким образом методом «бескровной операции». Показаниями для применения I131 являются: диффузный токсический зоб средней и тяжелой формы, особенно при отсутствии терапевтического эффекта (консервативного лечения. В последнее время отечественные и зарубежные авторы сообщают о хорошем терапевтическом эффекте I131 при смешанных и узловых формах токсического зоба.
Противопоказанием служит форма токсического зоба, узловые формы токсического зоба (относительное противопоказание), возраст моложе 40 лет (опасность воздействия на наследственность), период беременности и лактации, Обострение язвенной болезни. Относительным противопоказанием является и загрудинная форма зоба, хотя имеются литературные данные о положительном результате лучевой терапии в подобных случаях.
Для определения необходимой терапевтической дозы I131 применяются несколько методов, в том числе клинические, клинико-физические и физико-математические. Все они направлены на выявление минимальной, необходимой для излечения больного дозы I131, однако все методы не учитывают индивидуальной биологической чувствительности тканей щитовидной железы к лучевой терапии.
В настоящее время используется дробный метод введения I131, позволяющий значительно уменьшить число гипотиреозов, обусловленных передозировкой I131.
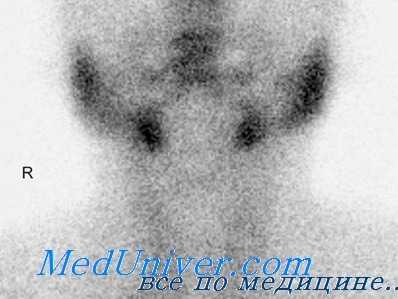
Необходимым условием лечения изотопом I131 является предшествующая ему отмена препаратов стабильного йода не менее чем за 1—2 месяца. Естественно, что при таком длительном перерыве в проведении антитиреоидной терапии возникает ухудшение течения токсического зоба. Поэтому в настоящее время проводится лечение мерказолилом, предшествующее введению I131. Следует отметить, что указанное лечение мерказолилом необходимо проводить особенно в тяжелых случаях заболевания для предупреждения обострения тиреотоксических признаков после применения I131.
Лечение мерказолилом прекращают за 5—7 дней до приема I131. С целью предупреждения тиреотоксического криза в результате усиленного выделения в кровь тиреоидиых гормонов в ответ на повреждающее щитовидную железу действие лучевой терапии через 3 дня возобновляется прием мерказолила из течение 2—3 педель.
В последнее время предложен метод комбинированного лечения I131 и мерказолилом, заключающийся в длительном применении мерказолила на фоне I131. Для оценки функции щитовидной железы необходимо делать перерывы в лечении мерказолилом. Данный метод позволяет несколько уменьшить необходимую для излечения дозу I131 при дробном методе лечения.
Примененииe I131 в терапии токсического зй'ба дает высокий процент излечения, достигающий 75—92 в зависимости от формы зоба (диффузная, смешанная). Однако несмотря на высокую эффективность данного метода лечения, он не лишен некоторых недостатков, а именно наблюдаются такие осложнения, паи гипотиреоз (в 1,6—3% случаев), тиреотокспческпй криз, который может возникать при лечении только I131 без (комбинации с мерказолилом (в 6—10% случаев), усиление экзофтальма и появление радиойодтиреоидитов. Последний вид осложнений наблюдается довольно редко.
Тиреотоксикоз с токсическим многоузловым зобом (E05.2)
Тиреотоксикоз у больных с многоузловым эутиреоидным зобом провоцируется приемом больших количеств препаратов, содержащих йод, включая амиодарон, который содержит 37% йода.
Многоузловой токсический зоб часто выявляется в йододефицитных регионах (эндемичные по зобу районы), и гиперфункция таких узлов связана с повышением потребления йода. Это относится к случаям, когда йод поступал в организм с лекарственными веществами или с пищей (при повышенном потреблении йодированной соли).
Клинически гипертиреоз раньше называли "йод-базедов", а в настоящее время - "гипертиреоз, вызванный йодом".

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
При радионуклидном сканировании определяют 3 формы многоузлового токсического зоба, протекающих на фоне чрезмерной активности щитовидной железы:
1. Многоузловой зоб с гиперфункционирующими узлами и нефункционирующей экстранодулярной паренхимой (60-80% случаев).
2. Многоузловой зоб с нефункционирующими узлами и гиперфункционирующей экстранодулярной паренхимой (10-20%).
3. Многоузловой зоб с одновременно гиперфункционирующими узлами и экстранодулярной паренхимой (3-5%).
Этиология и патогенез
Многоузловой токсический зоб развивается при длительном хроническом недостатке йода в пище и является одним из последовательных патологических состояний щитовидной железы (ЩЖ), формирующихся в условиях йодного дефицита легкой и средней степени тяжести.
Диффузный нетоксический (эутиреоидный) зоб переходит в узловой (многоузловой) нетоксический зоб, затем развивается функциональная автономия ЩЖ, являющаяся патофизиологической основой многоузлового токсического зоба. В условиях йодного дефицита ЩЖ подвергается стимулирующему воздействию ТТГ и местных ростовых факторов, вызывающих гипертрофию и гиперплазию фолликулярных клеток ЩЖ, что приводит к формированию струмы Струма - 1) Зоб - патологически увеличенная щитовидная железа; 2) (устар.) Аденоматозные разрастания, развивающиеся в некоторых органах при их атрофии и склерозе, например почках, яичниках, гипофизе, надпочечниках
. Основой для развития узлов в ЩЖ является микрогетерогенность тиреоцитов - различная функциональная и пролиферативная активность клеток ЩЖ.
Если йодный дефицит сохраняется на протяжении многих лет, то стимуляция ЩЖ, становясь хронической, вызывает гиперплазию и гипертрофию в тиреоцитах, обладающих наиболее выраженной пролиферативной активностью. Со временем это приводит к возникновению очаговых скоплений тиреоцитов с высокой чувствительностью к стимулирующим воздействиям.
В условиях продолжающейся хронической гиперстимуляции активное деление тиреоцитов и запаздывание на этом фоне репаративных процессов ведет к развитию активирующих мутаций в генетическом аппарате тиреоцитов (мутация рецептора ТТГ), приводящих к их автономному функционированию.
Со временем деятельность автономных тиреоцитов приводит к снижению уровня ТТГ и повышению содержания Т3 и Т4 (фаза клинически явного тиреотоксикоза). Так как процесс формирования функциональной автономии ЩЖ растянут во времени, йодиндуцированный тиреотоксикоз проявляется в старших возрастных группах (после 50 лет).
Эпидемиология
Частота встречаемости многоузлового токсического зоба составляет от 5 до 25% всех причин синдрома тиреотоксикоза и конкурирует по распространенности с диффузным токсическим зобом.
Наибольшее количество случаев заболевания регистрируется в йододефицитных районах, у больных многоузловым эутиреоидным (нетоксическим) зобом, чаще в возрасте 50-60 лет, преимущественно у женщин.
Факторы и группы риска
Группы риска:
1. Пациенты, длительно наблюдающиеся по поводу многоузлового нетоксичсекого зоба (эутиреоидного); преимущественно женщины пожилого возраста (50-60 лет) в йододефицитных районах.
2. Пациенты, принимающие содержащие йод препараты (кордарон, амиодарон, йодид калия, витамины и биологически активные добавки, содержащие йод, и т.д.) и имеющие в анамнезе многоузловой нетоксический зоб.
Клиническая картина
Cимптомы, течение
Клинике многоузлового токсического зоба предшествует длительный период наличия узлового зоба, при котором содержание тиреоидных гормонов в сыворотке крови находится в пределах нормы, а концентрация ТТГ ТТГ - тиреотропный гормон (вырабатывается гипофизом и стимулирует образование гормонов щитовидной железы)
в сыворотке крови незначительно снижена.
Частые проявления:
- сердечная недостаточность, резистентная к обычной медикаментозной терапии;
- мерцательная предсердная аритмия постоянной или периодической формы с эпизодами предсердной аритмии;
- резкая мышечная слабость (больному трудно вставать, подниматься по лестнице, ходить пешком);
- депрессия, периодические судороги, раздражительность или неустойчивость эмоционального состояния (некоторые врачи расценивают данное состояние как "климактерический синдром", поскольку большая часть случаев этих состояний приходится на соответствующий возраст).
В случае кровоизлияния в "горячий" узел наступает самоизлечение, и в дальнейшем такой узел трансформируется в кисту. В некоторых случаях симптомы тиреотоксикоза протекают по типу субклинического с возможным переходом в явный тиреотоксикоз.
Диагностика
1. УЗИ ЩЖ: множественные узловые образования, снижение эхогенности ткани ЩЖ.
Лабораторная диагностика
Лабораторные методы (определение гормонов ЩЖ) позволяют диагностировать два варианта тиреотоксикоза, которые очень часто являются стадиями одного процесса:
1. Субклинический тиреотоксикоз: снижение уровня ТТГ в сочетании с нормальными уровнями свободного T4 и свободного T3.
2. Манифестный (явный) тиреотоксикоз: снижение уровня ТТГ и повышение уровня свободного T4 и свободного T3.
Дифференциальный диагноз
Наиболее часто возникает необходимость в дифференциальной диагностике многоузлового токсического зоба и диффузного токсического зоба (ДТЗ), так как заболевания, протекающие с деструктивным тиреотоксикозом, достаточно несложно отличить по данным сцинтиграфии ЩЖ.
Принципы дифференциальной диагностики многоузлового токсического зоба и ДТЗ представлены в таблице, приведенной ниже.
Диффузный токсический зоб (базедова болезнь) - Обзор информации
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Диффузный токсический зоб (базедова болезнь, базедов зоб, болезнь Грейвса) - наиболее распространенное заболевание щитовидной железы, возникающее вследствие повышенной продукции тиреоидных гормонов. При этом, как правило, отмечается диффузное увеличение ее размеров Заболевание чаще встречается среди городского населения в возрасте от 20 до 50 лет, в основном у женщин.
Код по МКБ-10
Причина диффузного токсического зоба
В настоящее время диффузный токсический зоб (ДТЗ) рассматривается как органоспецифическое аутоиммунное заболевание. Его наследственный характер подтверждается тем, что наблюдаются семейные случаи зоба, выявляются тиреоидные антитела в крови родственников больных, отмечаются высокая частота других аутоиммунных заболеваний среди членов семьи (сахарный диабет I типа, болезнь Аддисона, пернициозная анемия, myastenia gravis) и наличие специфических HLA-антигенов (HLA B8, DR3). Развитие заболевания нередко провоцирует и эмоциональное напряжение.
Патогенез диффузного токсического зоба (базедовой болезни) обусловлен наследственным дефектом, по-видимому, дефицитом супрессоров Т-лимфоцитов, что ведет к мутации запрещенных клонов хелперов Т-лимфоцитов. Иммунокомпетентные Т-лимфоциты, реагируя с аутоантигенами щитовидной железы, стимулируют образование аутоантител. Особенность иммунных процессов при диффузном токсическом зобе состоит в том, что аутоантитела оказывают стимулирующее действие на клетки, ведут к гиперфункции и гипертрофии железы, тогда как при других аутоиммунных заболеваниях аутоантитела оказывают блокирующее действие, либо связывают антиген.
Симптомы Базедовой болезни
Патогенез клинических симптомов обусловлен влиянием избытка тиреоидных гормонов на различные органы и системы организма. Сложность и многочисленность факторов, участвующих в развитии патологии щитовидной железы, обусловливают и разнообразие клинических проявлений заболевания.
Помимо кардинальных симптомов, таких как зоб, пучеглазие, тремор и тахикардия, у больных, с одной стороны, отмечаются повышенная нервная возбудимость, плаксивость, суетливость, чрезмерная потливость, чувство жара, небольшие колебания температуры, неустойчивый стул, припухлость верхних век, повышение рефлексов. Они становятся неуживчивыми, мнительными, избыточно деятельными, страдают нарушением сна. С другой стороны, часто наблюдаются адинамия, внезапные приступы мышечной слабости.
Что беспокоит?
Диагностика диффузного токсического зоба
При достаточной выраженности клинических симптомов диагноз не вызывает сомнений. Правильной и своевременной диагностике помогают лабораторные исследования. Для диффузного токсического зоба характерно повышение базального уровня тиреоидных гормонов и снижение ТТГ. Обычно базальный уровень Т3 повышен в большей степени, чем уровень Т4. Иногда встречаются формы заболевания, когда Т3 выше, а тироксин, общий и свободный, в пределах нормальных колебаний.
В сомнительных случаях, когда Т3 и Т4 повышены незначительно и имеются подозрения на тиреотоксикоз, полезно провести тест с рифатироином (ТРГ). Отсутствие повышения ТТГ при введении ТРГ подтверждает диагноз диффузного токсического зоба.
Читайте также:
- Лучевые признаки подковообразной почки у плода
- Пример лимфогранулематоза средостения. Лимфосаркома средостения
- Комбинированные оральные контрацептивы. Побочные эффекты стероидных контрацептивов
- Психогенный дерматоз - нейродермит. Причины и диагностика
- Глубокая доброкачественная фиброзная гистиоцитома - лучевая диагностика
