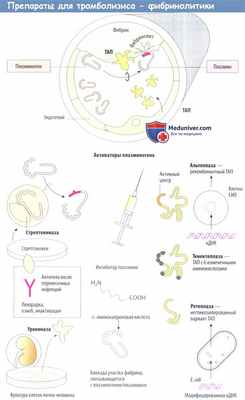
Препараты для тромболизиса - фибринолитики
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Фибринолизин (Fibrinolysin human) - протеолитический фермент, выделенный из плазмы донора или крупного рогатого скота. Выпускается препарат в виде порошка во флаконах, содержащих по 10, 20, 30 и 40 тысяч ЕД, глазных пленок. Как протеолитический фермент он расщепляет фибрин, действуя на поверхности тромба и ликвидируя лишь фибринные тромбы в течение первых дней их образования, растворяя свежие нити фибрина в венах, приводя к реканализации сосудов. Продукты деградации фибрина обладают антикоагулянтными свойствами, так как ингибируют полимеризацию мономеров фибрина и образование тромбопластина.
Используется в рассасывающих глазных пленках и для очищения раневых поверхностей.(5,10)
Фибринолитики с непрямым механизмом действия
Действуют только in vivo (они, являясь активаторами плазминогена, усиливают образование плазмина из эндогенного плазминогена).
Плазмин разрушает сгустки фибрина, приводит к деградации фибриногена и других белков плазмы крови. После окончания инфузии фибринолитический эффект данных препаратов наблюдается только в течение нескольких часов, однако удлинение тромбинового времени может сохраняться до 24 часов вследствие одновременного снижения уровня фибриногена и увеличения числа циркулирующих продуктов деградации фибрина и фибриногена. Препараты имеют особую фармакокинетику - у пациентов с почечной недостаточностью (клиренс их не изменяется), у больных с заболеваниями печени их клиренс замедляется.
Побочные эффекты их можно подразделить на: аллергические реакции ( покраснение кожи, крапивницу, бронхоспазм, озноб, боли в спине, снижение
АД, редко анафилактический шок), нарушения гемостаза (кровотечения из мест инъекций, желудочно-кишечные кровотечения, кровотечения из печени, кровоизлияния в мозг, в перикард), разрыв миокарда, аритмии, отек легкого.
Не следует назначать данные препараты: при тромбозе глубоких вен с давностью 14 дней и более, при инфаркте миокарда с давностью 24 часа и более, при окклюзионных поражениях центральных артерий сетчатки с давностью 6-8 часов и более и вен с давностью 10 дней и более, при хронических окклюзионных заболеваний артерий в связи с отсутствием ожидаемого эффекта.
Следует оценить потенциальную пользу и возможный вред от применения их пациентам с недавно перенесенными тяжелыми желудочно-кишечными кровотечениями, оперативными вмешательствами, травмами, биопсией, при трудно контролируемой артериальной гипертензии, аритмиях, а также при изменении сосудов глазного дна 3-4 степени, септическом тромбозе, тяжелых атеросклеротических поражениях сосудов, тяжелом сахарном диабете, выраженных нарушениях печени и почек, поджелудочной железы. Беременным женщинам и при кормлении грудью в первые 18 недель после родов препараты назначаются только по жизненным показаниям.(5,10)
Для проведения тромболизиса из значительного числа фибринолитиков используются следующие:
Первое поколение фибринолитиков непрямого действия.
Стрептокиназа (Streptokinase)- ферментный белок из культуры различных штамов Streptococcus haemoliticus. Выпускается препарат во флаконах с лиофилизированным порошком для инъекций по 100000, 250000, 500000,
750000 и 1500000 МЕ . Стрептокиназа способна проникать внутрь тромба
(активируя в нем фибринолиз), что выгодно отличает ее от фибринолизина. Она наиболее эффективна при действии на тромб, который образовался не более семи дней назад. При внутривенном введении препарата уровень плазменного фибриногена снижается за 24-36 часов, максимальный эффект наступает через 45 минут, сохраняется 24 часа.
Для проведения тромболизиса 1 500 000 ЕД ее вводится в 100 мл физиологического раствора в/венно в течение 30-60 минут с предварительным введением 90-120 мг преднизолона или 75-150 мг гидрокортизона для снижения риска развития аллергических реакций. Это необходимо потому, что стрептокиназа является антигеном стрептококка, на который у человека (особенно у больных ИБС) имеется достаточно высокий титр антител. В крови любого человека циркулируют антитела против стрептокиназы, что обусловлено большой распространенностью стрептококковых инфекций в популяции. Аллергические реакции возникают даже при первом введении стрептокиназы. В дальнейшем титр антител постепенно нарастает и через несколько недель достигает пика, превышающего исходный уровень в 1000 раз. У части больных титр антител возвращается к норме через 6 мес, однако во многих случаях он остается увеличенным в течение 2 — 4 лет. Противострептокиназные антитела становятся причиной не только аллергических реакций, но и толерантности к стрептокиназе. Эффективность тромболитической терапии зависит от титра антител.
Для необходимого тромболитического эффекта суммарная доза
стрептокиназы должна составлять не менее 1,5 млн ЕД, так как 0,5 млн ЕД может связываться с антителами и элиминироваться из кровотока.
С точки зрения возможности образования антител, стрептокиназу не следует вводить лицам, ранее ее получавшим (лучше ввести ретеплазу или тенектоплазу). Тромболитическая терапия (ТЛТ) в данном случае должна сопровождаться приемом препарата ацетилсалициловой кислоты для уменьшения роста адгезии и агрегации тромбоцитов. Применять гепарин при тромболизисе стрептокиназой не обязательно.
Стрептокиназа пока еще является основным средством для проведения тромболизиса.
Стрептокиназа по сравнению с алтеплазой вызывает меньше
внутримозговых кровоизлияний (0,5% против 0,7%), поэтому при высоком их риске некоторые кардиологи предпочитают стрептокиназу (например, у пожилых пациентов с инсультами в анамнезе и тяжелой артериальной гипертонией).
Урокиназа (Urokinase) - препарат, получаемый из культур клеток почек эмбриона человека, из мочи или методом генной инженерии. Выпускается он во флаконах по 5000, 25 000, 100 000, 250 000, 500 000, 1 000 000 ME
Урокиназа более селективно, чем стрептокиназа, активирует плазминоген, связанный с фибрином тромбов, лизирует преимущественно фибрин, а не факторы свертывания крови. Однако при ее применении не исключены кровотечения. Урокиназа как фермент человека не стимулирует продукцию антител и редко вызывает аллергические побочные эффекты. Период полуэлиминации урокиназы — 15 — 20 мин. После парентерального введения препарата гипокоагуляционные сдвиги отмечаются через 3-6 часов. Выводится он с мочой, период полувыведения составляет не более 20 минут. Эффективность урокиназы повышается при повторном введении в комбинации с небольшими дозами гепарина (внутривенно капельно гепарин по 5000-10000 ЕД каждые 12 часов под контролем АЧТВ).
В случае истощения плазминогена (тяжелый атеросклероз, рецидивирующая тромбоэмболия, инфаркт миокарда, ожирение, гиперлипидемия) рекомендовано введение больших доз препарата длительным курсом в комбинации со свежезамороженной плазмой и препаратами плазминогена. Урокиназа может применяться для проведения внутрикоронарного тромболизиса. При ОИМ проводят инфузию урокиназы в коронарную артерию - 6000 МЕ\мин продолжительностью до 2 час или осуществляют внутривенное капельное введение в дозе 2-3 млн. МЕ в течение 45-90 мин.
При тромбозе периферических артерий препарат вводят внутриартериально (в тромб) 4000 МЕ\мин длительно.
Анистреплаза(Аnistreplase)-АПСАК-ацетилированный плазминоген стрептокиназный комплекс представляет собой неактивный комплекс стрептокиназы и плазминогена человека, в котором к активному центру молекулы плазминогена ковалентно присоединена ацетильная группа. АПСАК не взаимодействует с плазминогеном до тех пор, пока в результате спонтанного деацетилирования в крови не будет восстановлена его ферментативная активность. T1/2 АПСАК составляет 70–120 мин, что значительно больше, чем у стрепто или урокиназы. Благодаря более длительному T1/2 АПСАК можно назначать в виде однократного болюса. В большинстве сравнительных исследований частота 90минутной проходимости инфарктсвязанной коронарной артерии при лечении АПСАК была выше, чем при применении стрептокиназы. Pекомендуемая доза АПСАК для лечения ОИМ составляет 30 мг (или 30 ЕД), которые вводят в виде внутривенного болюса в течение 2–5 мин.
Второе поколение фибринолитиков непрямого действия.
Рекомбинантные и генноинженерные препараты могут быть использованы в случаях, когда противопоказана стрептокиназа (при стрептококковой инфекции, аллергии).
Альтеплаза (Alteplase). Выпускается препарат во флаконах с порошком по 0,02 и 0,05г. Рекомбинантный человеческий тканевой активатор плазминогена (ТАП) выделяют из ткани матки человека и культуры клеток человеческой меланомы. В последние годы для клинического применения ТАП получают ДНКрекомбинантным методом, это гликопротеин (содержит 527 аминокислот). Алтеплаза считается избирательным тромболитиком, поскольку воздействует в основном на плазминоген, связанный с фибрином.
Значимый период полувыведения (T 1/2) составляет 4-5 минут, таким образом, через 20 минут в плазме остается менее 10% от исходного количества препарата, а для оставшегося количества препарата T 1/2 составляет около 40 минут. Альтеплаза остается относительно неактивной в системе циркуляции, активируется связываясь с фибрином сгустка, способна растворять тромбы, устойчивые к другим тромболитикам, не вызывает образования антител, реже провоцирует развитие гипотензии или шока. Однако алтеплаза существенно дороже стрептокиназы (2200 против 300 долларов США).
Применение ТАП наиболее целесообразно при аллергических реакциях на СК в анамнезе или при недавнем (до 6 месяцев) ее введении, у больных молодого возраста и при исходной артериальной гипотензии.
На догоспитальном этапе оказания помощи первые 10 мг препарата вводят болюсом, затем 50 мг капельно в течение часа и 40 мг в течение 2 часов. ТАП рекомендован к применению в первые 180 мин после развития ИМ, обусловленного окклюзией артерии среднего и крупного диаметра, при отсутствии геморрагического компонента в очаге ишемии и зоны обширной гиподенсивности на КТ/МРТ головного мозга, превышающей 1/3 области средней мозговой артерии, при значениях системного артериального давления не выше 180/110 мм рт. ст. Следует использовать дозу 0,9 мкг/кг, максимально — 90 мг/сут. (10 % дозы вводится внутривенно струйно, оставшиеся 90% — внутривенно капельно в течение 60 мин.). (7,8)
Препараты для тромболизиса - фибринолитики
Препараты для тромболизиса - фибринолитики
Сетчатую структуру фибрина в тромбах способен гидролизовать плазмин. Как протеаза плазмин способен расщеплять не только фибрин, но и фибриноген и другие белки. Плазмин образуется из неактивного предшественника плазминогена, присутствующего в крови.В физиологическихусловияхспецифичность действия по отношению к фибрину обусловлена тем, что активация плазмина происходит на фибриновом сгустке.
Тканевый активатор плазминогена (ТАП) выделяется из эндотелиальных клеток при застое крови. Наряду со своим каталитическим центром эта протеаза обладает и другими функциональными доменами, включая участки для связывания с фибрином. При контакте с фибрином интенсивность превращения плазминогена в плазмин в несколько раз выше, чем в токе крови. У плазминогена также есть область для связывания с фибрином.
Доступные для использования в терапевтических целях активаторы плазминогена называются фибринолитиками; их вводят в/в при инфаркте миокарда, инсульте, тромбозе глубоких вен нижних конечностей, тромбоэмболии легочной артерии и других тромботических окклюзиях сосудов. Чем раньше после образования тромба будет начата терапия, тем больше шансов на успешное восстановление проходимости закупоренного сосуда.
Достижение желаемого результата таит в себе риск кровотечения (наиболее серьезный побочный эффект), т. к. помимо внутрисосудистого сгустка фибрина, формирующего тромб, также растворяется фибрин, закрывающий дефект в стенке сосуда при его повреждении. Кроме того, использование фибринолитиков несете собой опасность расщепления фибриногена и других факторов свертывания, циркулирующих в крови (системный фибринолиз).
Первым фибринолитиком была стрептокиназа. Сама по себе она не обладает ферментативной активностью, и только после связывания с молекулой плазминогена образуется комплекс, активирующий плазминоген. Стрептокиназу продуцируют стрептококки. В результате перенесенных ранее стрептококковых инфекций в крови могут присутствовать антитела к стрептокиназе, что вызывает реакции несовместимости.
Анизострептаза представляет собой искусственный плазминоген-стрептокиназный комплекс, который характеризуется более длительным действием
Урокиназа — эндогенный активатор плазминогена, который встречается в различных органах. Урокиназу, используемую в терапевтических целях, получают из культур клеток почки человека. В ответ на ее применение появление циркулирующих антител не предполагается. Это вещество стоит дороже стрептокиназы. Его действие не зависит от фибрина.
Альтеплаза — рекомбинантный ТАП. Поскольку этот активатор плазминогена продуцируется эукариотическими клетками яичника китайского хомячка (СНО), в нем присутствуют углеводные остатки, как в нативном веществе. При использовании в терапевтических дозах альтеплаза теряет свою «фибриновую зависимость» и тем самым также активирует циркулирующий плазминоген. При свежем инфаркте миокарде альтеплаза эффективнее стрептокиназы.
Тенектеплаза представляет собой разновидность альтеплазы, ген которой изменен шестью точечными мутациями, в результате чего произошло значительное увеличение периода ее полувыведения (t1/2 тенектеплазы 20 мин, t1/2 альтеплазы 3-4 мин) Дозировку тенектеплазы подбирают в соответствии с массой тела и вводят в/в струйно.
Ретеплаза — вариант ТАП, в котором вследствие делеции отсутствуют и фибринсвязывающие участки, и олигосахаридные боковые цепи (продуцируется прокариотами Е. coli). Она выводится медленнее, чем альтеплаза. В то время как альтеплазу вводят инфузионно, ретеплазу можно вводить в виде двух в/в струйных инъекций с интервалом 30 мин.
Ингибиторы плазмина. ε-аминокапроновая, а также транексамовая и парааминометилбензойная кислоты ингибируют плазмин и могут быть полезны при геморрагических осложнениях. Они занимают участки плазминогена или плазмина, предназначенные для связывания с фибрином, что обусловливает их ингибирующее действие.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Препараты для тромболизиса - фибринолитики
Фибринолитические препараты (активаторы плазминогена) переводят содержащийся в крови неактивный белок плазминоген в активный фермент плазмин, вызывающий лизис фибрина и разрушение тромба (тромболизис).
Механизм действия
Одним из широко применяемых фибринолитических средств является соединение белковой структуры стрептокиназа (стрептаза, стрептолиаза) — непрямой активатор плазминогена, получаемый из культуры β- гемолитического стрептококка. Сначала молекула стрептокиназы образует соединение с молекулой плазминогена, которая приобретает способность активировать другие молекулы плазминогена, как связанные с тромбом, так и циркулирующие в крови.
В результате из-за возникновения системной плазминемии снижаются уровни фибриногена, плазминогена, факторов свертывания крови V и VIII и возникает гипокоагуляция, сохраняющаяся некоторое время после прекращения введения препарата. После однократного введения стрептокиназы через 3—4 сут в крови могут появиться антитела, способные сохраняться не менее 10 лет.
Анистреплаза (эминаза) – нековалентный комплекс стрептокиназы с модифицированным профибринолизином (лизин-профибринолизином). Является пролекарством; в организме происходит его деацетилирование, что сопровождается активацией содержащегося в препарате профибринолизина. При этом стимулируется переход профибринолизина в фибринолизин. t1/2 по фибринолитической активности равно 70-120 мин. Вводят препарат внутривенно; дозируется в ЕД. Может вызывать кровотечения, аллергические реакции и преходящую гипотензию.
Тканевый активатор плазминогена — сериновая протеаза, идентичная человеческому активатору плазминогена, синтезируемому эндотелием сосудов. В настоящее время используется преимущественно одноцепочечная рекомбинантная молекула тканевого активатора плазминогена альтеплаза, которую получают методом генной инженерии. Рекомбинантный человеческий активатор плазминогена, входящий в состав препарата, представляет собой гликопротеин, который после системного введения находится в плазме в неактивной форме до момента связывания с фибрином. Альтеплаза обладает повышенным сродством к фибрину. На его поверхности она становится значительно более активной и избирательно воздействует на находящий рядом связанный с фибрином плазминоген, превращая его в плазмин. Ее действие направлено преимущественно на профибринолизин, связанный с фибрином тромба, и поэтому образование фибринолизина и его действие в основном ограничиваются тромбом. При этом системную активацию профибринолизина препарат вызывает в значительно меньшей степени, чем стрептокиназа и урокиназа.
Ретеплаза — мутантная форма альтеплазы, созданная за счет отщепления части исходной молекулы. Т1/2 ретеплазы примерно в 2 раза больше, чем у альтеплазы, но она обладает меньшей фибринспецифичностью.
Тенектеплаза — мутантная форма альтеплазы, созданная с помощью генной инженерии за счет замены аминокислотных остатков в трех участках исходной молекулы. Это привело к увеличению Т1/2 в плазме крови, более выраженной фибринспецифичности и появлению устойчивости к влиянию ингибитора активатора плазминогена 1-го типа.
Урокиназа — природный прямой активатор плазминогена. фермент, образующийся в почках. По направленности действия аналогична стрептокиназе, но редко вызывает аллергические реакции. Лихорадка возникает у 2-3% больных. t1/2 = 15-20 мин. Раньше урокиназу выделяли из мочи. В настоящее время препарат производят методом генной инженерии или получают из культуры эмбриональных клеток почек человека. В результате превращения циркулирующего в крови профибринолизина в фибринолизин урокиназа, как и стрептокиназа, может вызвать системный фибринолиз. Последний обусловлен тем, что фибринолизин является неизбирательно действующей протеазой, способной метаболизировать многие белковые соединения, находящиеся в плазме крови. Это приводит к снижению в плазме уровня фибриногена, а2-антифибринолизина, ряда факторов свертывания крови (V, VIII). Естественно, что при этом содержание в крови продуктов распада фибрина и фибриногена нарастает.
Проурокиназа — рекомбинантный одноцепочечный предшественник урокиназы, обладающий небольшой ферментативной активностью. Имеет очень короткий Т1/2 и по фибринспецифичности аналогична тканевому активатору плазминогена. Циркулирует в комплексе с ингибитором, который диссоциирует в присутствии фибрина, что позволяет фибринолитику проявить активность.
Стафилокиназа (из Staphylococcus aureus) и ее рекомбинантные варианты, обладающие высокой специфичностью к фибрину. Создано рекомбинантное производное естественного тканевого активатора профибринолизина тенектеплаза - более стойкое соединение (t1/2 циркуляции в крови ~ 20 мин), а также более специфичное к фибрину. Из яда особого вида змеи выделена алфимепраза, которая в отличие от всех приведенных выше препаратов оказывает прямое фибринолитическое действие.
Особенности дозирования зависят от показаний и используемого препарата. Специфического коагулологического контроля обычно не требуется. Введение фибринолитиков может сочетаться с применением ацетилсалициловой кислоты и/или внутривенной инфузией НФГ (зависит от показания и лекарственного средства). Наиболее часто проводится системная тромболитическая терапия с внутривенным введением фибринолитика. В отдельных случаях препарат подводится непосредственно к тромбу.
Фармакокинетика
При внутривенном введении стрептокиназа снижает артериальное давление (АД) и общее периферическое сопротивление (ОПСС) с последующим уменьшением минутного объема крови. У больных с хронической сердечной недостаточностью улучшает функцию левого желудочка. Снижает частоту летальных исходов при инфаркте миокарда. Улучшает функциональные показатели сердца. Уменьшает число тромботических осложнений при заболеваниях сердечно-сосудистой системы и смертельных исходов от тромбоэмболии легочной артерии. Максимальный эффект наблюдается через 45 мин. После окончания инфузии фибринолитический эффект наблюдается в течение нескольких часов, удлинение тромбинового времени сохраняется до 24 ч вследствие одновременного снижения фибриногена и увеличения числа циркулирующих продуктов деградации фибрина и фибриногена. Как было сказано ранее, активирует не только тканевой фибринолиз (действие направлено на растворение тромба - тромболиз), но и системный фибринолиз (расщепление фибриногена крови), в связи с этим может развиться кровотечение (вследствие гипофибриногенемии). Начальный T1/2 составляет 13-23 мин, конечный - 83 мин. Стрептокиназа не метаболизируется. Наиболее эффективна при свежих сгустках фибрина (до ретракции), при свежих тромбах (примерно до 3 сут). Чем раньше начато лечение, тем благоприятнее результат. Так, при остром инфаркте миокарда, вызванном тромбозом коронарных артерий, лучший результат дает применение препарата в первые 1-3 ч. Венозные тромбы лизируются лучше, чем артериальные. Особенно хорошо рассасываются тромбы, содержащие большие количества профибринолизина. Дозируют стрептокиназу в единицах действия (ЕД), вводят обычно внутривенно (капельно). Побочные эффекты: кровотечения, гипотензия, пирогенная и аллергические реакции.
Длительное (не менее, чем в течение 10 лет) сохранение антител к стрептокиназе может уменьшить эффективность последующего лечения и стать причиной аллергических реакций, поэтому ее не рекомендуют использовать повторно, если после первоначального введения прошло более 4 сут. Однако в большинстве случаев повторное введение препарата не вызывает тяжелых аллергических реакций.
Тканевый активатор профибринолизина обладает высокой терапевтической эффективностью и при своевременном применении способствует реканализации тромбированных сосудов. Быстро метаболизируется в печени, через 20 мин в плазме находится 10% препарата. Т1/2 — фаза а — 4-5 мин. Т1/2 — фаза (3 — около 40 мин. Вводят препарат внутривенно, дозируют в ЕД. Антигенностью не обладает. Системное влияние фибринолитика намного менее выражено. Кроме того, по сравнению со стрептокиназой альтеплаза способна разрушать фибрин с более выраженными перекрестными связями, входящий в состав дольше существующих тромбов. Действию альтеплазы препятствуют ингибиторы активатора плазминогена.
Тканевый активатор профибринолизина (ТАП, t-PA) является серинпротеазой. Образуется он в основном в клетках эндотелия, откуда высвобождается в циркулирующую кровь. В плазме крови находится недолго (t1/2 = 5-8 мин), так как очень быстро инактивируется специальным ингибитором (ингибитор активатора профибринолизина - ИАП-1, PAI-1). Если образуется тромб, значительная часть тканевого активатора связывается с фибрином и становится неуязвимой для действия ингибитора. Здесь и происходит активация профибринолизина (который также связывается с фибрином) с образованием фибринолизина. Следует отметить, что скорость активации тканевого профибринолизина во много раз выше, чем профибринолизина, циркулирующего в крови. Поэтому образование фибринолизина в основном и происходит в тромбе. Циркулирующий в крови фибринолизин в обычных условиях быстро ингибируется α2-антиплазмином. Фибринолизин, связанный с фибрином (образованный в результате активации профибринолизина, локализованного в тромбе), не ингибируется а2-антиплазмином и поэтому вызывает тромболитический эффект.
Алгоритм антитромботической терапии у пациентов с ишемическим инсультом после системного тромболизиса
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

М.А. ДОМАШЕНКО, к.м.н., М.Ю. МАКСИМОВА, д.м.н., профессор, М.М. ТАНАШЯН, д.м.н., профессор, Научный центр неврологии Российской академии медицинских наук
Работа поддержана Грантом Президента Российской Федерации по государственной поддержке ведущих научных школ РФ НШ-6088.2014.7
Системная тромболитическая терапия пациентов с ишемическим инсультом является эффективным методом лечения у определенной категории больных в течение первых 4,5 ч после появления первых симптомов заболевания. Вместе с тем, согласно протоколу ее проведения, назначение любых антитромботических препаратов в течение первых суток после тромболизиса противопоказано. С другой стороны, по истечении 24 ч после проведения тромболизиса остается необходимость назначения антитромботических препаратов с целью вторичной профилактики инсульта. Нами продемонстрирован собственный опыт применения тромбоцитарных антиагрегантов у больных с ишемическим инсультом после тромболитической терапии.
Стратегическими направлениями лечения ишемического инсульта (ИИ) являются нейропротекция и реперфузия. Под нейропротекцией подразумевают назначение ЛС, способствующих сохранению жизнеспособности нейронов. Несмотря на большое количество экспериментальных работ по поиску и изучению препаратов с нейропротекторной активностью, в настоящее время убедительной доказательной базы в отношении этого подхода к лечению пациентов с ИИ не существует [1]. Вместе с тем второе стратегическое направление терапии острых ишемических нарушений мозгового кровообращения (НМК) – реперфузия, т. е. назначение препаратов, вызывающих растворение тромба, вызвавшего закупорку сосудов головного мозга, или направленных на профилактику повторного тромбообразования, – является не только патогенетически обоснованным, но и подкрепленным доказательной базой рандомизированных контролируемых исследований. Из всего многообразия препаратов, обладающих антитромботическими свойствами, два класса – фибринолитики (альтеплаза) и антиагреганты (ацетилсалициловая кислота) имеют самый высокий уровень доказательности при их назначении в острейшем периоде ишемических НМК.
Внутривенное введение альтеплазы (рекомбинантного тканевого активатора плазминогена, rt-PA) в дозе 0,9 мг/кг в первые 4,5 ч от начала ИИ получило самый высокий уровень доказательности (класс I, уровень А) и рекомендовано к применению как в европейских (ESO, 2008/2009) [1], так и североамериканских (AHA-ASA, 2013) [2] руководствах по ведению пациентов с острым ИИ. Наиболее важным преимуществом данного вида лечения ИИ является улучшение функционального исхода: так, по данным анализа лечения 23 942 пациентов из регистра SITS-MOST, уровень функциональной независимости составил соответственно 57% и 60% для пациентов, которым была проведена терапия rt-PA соответственно в первые 3 ч и в интервале 3–4,5 ч от развития первых симптомов заболевания [3].
Ацетилсалициловая кислота (АСК) является единственным антиагрегантным препаратом, эффективность которого при назначении в остром периоде ИИ подкреплена данными доказательной медицины. Следует отметить, что первый в мировой клинической практике опыт использования малых доз АСК (1 мг на 1 кг веса в сутки) у больных с острой цереброваскулярной патологией, осуществленный в НИИ неврологии РАМН, показал быстрое и стойкое устранение гиперагрегабельности тромбоцитов вследствие почти 3-кратного снижения концентрации тромбоксана А2 в крови вне зависимости от пола больных и вида ишемического НМК [4]. Оценке эффективности терапии АСК при ее назначении в первые 48 ч ИИ посвящено два крупных исследования: IST [5] и CAST [6]. Сопоставление результатов этих двух исследований позволило рекомендовать как можно более раннее назначение АСК при ИИ [1, 2].
Широко применяемые с целью вторичной профилактики атеротромботического инсульта тромбоцитарные антиагреганты клопидогрел и Агренокс (комбинация АСК и дипиридамола замедленного высвобождения) не нашли доказательств своей эффективности в лечении пациентов в острейшем периоде ИИ. Также распространенные в кардиологии подходы лечения острого коронарного синдрома с применением «нагрузочных» доз антиагрегантов, комбинации клопидогрела и АСК в остром периоде ИИ сопряжены с большим риском геморрагических осложнений и не рекомендованы к повседневному применению.
Следует иметь в виду, что при прочих равных условиях применение антиагрегантов (АСК) в остром периоде ИИ не является альтернативой тромболитической терапии. Также не рекомендовано применение АСК в первые 24 ч после проведения тромболизиса [1, 2].
Вместе с тем следует подчеркнуть, что несмотря на доказанную эффективность, тромболизис по своей сути является симптоматической терапией, поскольку субстратом для его назначения является лишь тромб/эмбол, вызвавший окклюзию экстра- или интрацеребральной артерии, в то время как причина тромбообразования (атеросклероз брахиоцефальных артерий с наличием стенозирующей просвет бляшки, кардиальная патология с развитием внутрикамерного или клапанного тромбообразования, протромботическое состояние крови и др.) не устраняется [7]. С этим связана довольно высокая частота развития реокклюзии/ретромбоза экстра- или интрацеребральных артерий в первые сутки после успешно проведенной тромболитической терапии, регистрируемая в среднем у трети пациентов, достигших полного восстановления кровотока (реканализации) на фоне применения rt-PA [8], поскольку, как было сказано выше, назначение как АСК, так и иных антитромботических препаратов в течение первых 24 ч противопоказано.
Следует отметить, что спустя сутки после проведения системного тромболизиса пациентам с ИИ абсолютно показана антитромботическая терапия, прежде всего с позиций вторичной профилактики инсульта. По данным исследования EXPRESS, риск повторного ИИ составляет до 10% в течение первой недели после перенесенного острого ишемического церебрального эпизода. При этом раннее назначение препаратов, направленных на профилактику ИИ, позволяет уменьшить риск повторного инсульта на 80% [9].
Нами обобщен собственный опыт антитромботической терапии у пациентов с ИИ после внутривенной тромболитической терапии rt-PA. В клинике ФГБУ «Научный центр неврологии» РАМН наблюдалось 60 пациентов (18 женщин, 42 мужчины) с острым ИИ, которым, согласно международным рекомендациям [1, 2], была произведена внутривенная тромболитическая терапия препаратом альтеплаза (rt-PA, Актилизе®). Средний возраст обследованных пациентов составил 61 (55, 67) год. Среднее время от момента развития симптоматики до поступления пациентов в стационар (time-to-door) составило 150 (118, 170,5) минут. Среднее время от поступления до начала тромболитической терапии (door-to-needle time) составило 40,5 (30, 60) минут. Средняя оценка выраженности неврологической симптоматики при поступлении составила 14 (10, 17) баллов по шкале NIHSS. Распределение пациентов в соответствии с подтипами ИИ представлено на рисунке 1.
Как видно из рисунка 1, в 41,7% случаев тромболизис был проведен пациентам с кардиоэмболическим ИИ, в 28,3% – с атеротромботическим ИИ, а у 21,7% больных атеротромбоз и кардиогенная тромбоэмболия были двумя установленными этиопатогенетическими факторами развития инсульта.
Исходы инсульта на фоне тромболитической терапии нами оценивались по модифицированной шкале Рэнкина (mRS) спустя 3 мес. после возникновения неврологических нарушений. Благоприятным исходом инсульта считали достижение пациентом оценки 2 и менее баллов по mRS. Подобного результата удалось добиться у 53,3% пациентов (рис. 2). В целом исходы после проведенной тромболитической терапии в группе наблюдавшихся пациентов соответствуют данным международных плацебо-контролируемых исследований, а также данным международного регистра SITS [3, 10, 11].
Реканализация оценивалась нами у всех пациентов с помощью проведения КТ- или МР-ангиографии до и сразу после проведения тромболизиса. Полное восстановление кровотока, по данным ангионейровизуализации, отмечалось у 31 пациента (51,7%).
В течение первых суток после ТЛТ антитромботическая терапия не назначалась, как того требуют отечественные и международные рекомендации по проведению тромболизиса. Учитывая необходимость назначения антитромботической терапии спустя 24 ч после тромболизиса, нами производилась оценка состояния системы гемостаза, включавшая исследование агрегации тромбоцитов и коагулограммы. Исследование агрегации тромбоцитов (под воздействием индукторов – адреналина и АДФ) проводилось по методу G. Born, 1962 [12], усовершенствованному J. O’Brien, 1964 [13], при воздействии АДФ в конечной концентрации 1,2 х 10-6 мМ [АТ-АДФ] и адреналина в концентрации 6,2 х 10-6 мМ [АТ-Адр] на агрегометре Алат 2 (Biola Ltd., Россия). Основные гемостатические показатели исследовались с помощью автоматического коагулометра ACL 9000 (Instrumentation Laboratory, США).
Показатели АДФ-индуцированной агрегации тромбоцитов и адреналин-индуцированной агрегации тромбоцитов спустя сутки после тромболизиса составили соответственно 41 (27, 52)% и 42 (23, 63)%, что статистически достоверно превышало соответствующие показатели группы сравнения (60 пациентов с ИИ спустя 24 ч после развития симптоматики, которым не была проведена тромболитическая терапия, сопоставимые по основным демографическим и клиническим характеристикам: средний возраст 64 (57, 73) года, 21 женщина (35%), 39 мужчин (65%), оценка по NIHSS 10,5 (6,5, 14,25) баллов), где агрегация тромбоцитов под влиянием АДФ составила 29 (22, 41)%, под влиянием адреналина – 28,5 (21, 43)% (p < 0,05). Показатели коагулограммы (фибриноген, гематокрит, протромбиновое время, международное нормализованное отношение, протромбиновый индекс, активированное частичное тромбопластиновое время) статистически не отличались у пациентов, которым производился тромболизис, и пациентов группы сравнения.
Учитывая полученные данные агрегации тромбоцитов, по истечении 24 ч ИИ всем пациентам, которым был произведен системный тромболизис, назначался прием препаратов АСК в дозе 1 мг/кг массы тела, а в дальнейшем, по результатам клинико-инструментального обследования, тактика антитромботической терапии менялась в зависимости от подтипа ИИ (рис. 3). Всем пациентам с некардиоэмболическим инсультом (включая атеротромботический ИИ, лакунарный ИИ, неуточненный ИИ и инсульт неясной этиологии) назначались антиагреганты: 27 пациентам была назначена монотерапия препаратами АСК, пяти больным – монотерапия клопидогрелом, двум – комбинация дипиридамола медленного высвобождения (дипиридамола МВ) и АСК. 19 пациентам с кардиоэмболическим ИИ на фоне хронической фибрилляции предсердий были назначены оральные антикоагулянты (16 из них – варфарин), в одном случае – комбинация варфарина и АСК.
Выбор антитромботического препарата для вторичной профилактики ИИ носил индивидуализированный и персонифицированный характер. В первую очередь определялись показатели агрегации тромбоцитов под воздействием индукторов агрегации (адреналина и АДФ). Указанная методика [12, 13] позволяет не только оценивать показания к назначению тромбоцитарных антиагрегантов, но и производить мониторинг их эффективности. Не менее важным в выборе средств рациональной антитромботической терапии и вторичной профилактики ИИ является спектр побочных эффектов используемых ЛС. Так, для антиагрегантных препаратов учитывалась относительно высокая частота развития гастроинтестинальных кровотечений на фоне их приема, что обуславливало выбор современных препаратов АСК с минимизированными ульцерогенными свойствами (например, комбинация АСК и окиси магния, кишечно-растворимые формы препаратов АСК), клопидогрела. Не менее важным аспектом выбора антиагреганта является спектр сопутствующей соматической патологии, поражение одного или нескольких сосудистых бассейнов. К сожалению, также немаловажным фактором выбора препарата, обусловливающим комплаентность его длительного приема, являлась и социально-экономическая сторона (стоимость препаратов). При выборе препаратов для вторичной профилактики кардиоэмболического инсульта также принимался во внимание характер кардиальной патологии (например, при фибрилляции предсердий назначались оральные антикоагулянты, при постинфарктном кардиосклерозе – тромбоцитарные антиагреганты), спектр сопутствующей патологии, а также социально-экономические аспекты длительного приема тех или иных препаратов (включая возможность регулярного контроля международного нормализованного отношения при назначении варфарина и др.).
Следует отметить, что подобный персонифицированный подход позволил добиться отсутствия повторных сердечно-сосудистых катастроф (ИИ, инфаркт миокарда, сосудистая смерть) в течение года наблюдения за пациентами, пережившими острейший период ИИ.
Таким образом, алгоритм антитромботической терапии у пациентов с ИИ после проведенной системной тромболитической терапии заключается в назначении препаратов АСК, начиная со вторых суток инсульта, с последующей индивидуализацией терапии в зависимости от патогенетического подтипа инсульта, лабораторных данных (прежде всего агрегации тромбоцитов), спектра побочных эффектов препаратов и сопутствующей патологии.
Препараты для тромболизиса - фибринолитики

Разработка способов высокоселективного тромболизиса на
основе плазмин-содержащих протеиновых наночастиц
Абстракт: Несмотря на существенный прогресс, достигнутый в лечении многих заболеваний за последние 70 лет, некоторые подходы и методы остались почти неизменными. Так, основой тромболитической терапии с момента открытия фермента стрептокиназы является активация профермента плазминогена и перевод его в плазмин, который разрушает фибриновые нити тромба. Фактически, тромболитики активируют фибринолитические возможности организма. Существенным недостатком такого метода терапии является отсутствие специфичности в активации плазминогена, что приводит к его активации по всему организму с последующими серьезными побочными геморрагическими эффектами, включающими внутренние кровотечения, а также аллергические реакции, рвоту, снижение артериального давления и т.д. Важным ограничением является и узкое терапевтическое окно, которое составляет максимум 3-5 часов с момента проявления симптомов тромбоэмболии. Таким образом, применение тромболитиков сильно ограничено и должно учитывать многочисленные риски. Немаловажным является и крайне высокая стоимость данных препаратов.
Целью данного проекта является разработка комплексного подхода в создании высокоселективного лекарственного средства для тромболизиса, основанного на применении непосредственно плазмина, энтрапированного в альбуминовую матрицу. Плазмин является идеальным кандидатом для таргетной доставки по нескольким причинам. Традиционные тромболитики нуждаются в образование плазминоген-фибринового комплекса для активации плазминогена, однако данный комплекс существует только несколько часов после возникновения тромба. Это обуславливает узкое терапевтическое окно существующих тромболитических препаратов. Необходимость сначала в формировании плазминоген-фибринового комплекса, а затем активации плазминогена замедляет наступления терапевтического эффекта; на каждом из этапов как активатор плазминогена, так и плазмин могут быть ингибированы. Адресно доставленный плазмин оказывает прямое воздействие на фибрин в тромбе вне зависимости от времени его образования, а создаваемая локально высокая концентрация в месте образования тромба нивелирует действие ингибиторов и ускоряет тромболизис. Предлагаемый нами метод энтрапирования плазмина для таргетной доставки будет разработан впервые. Энтрапирование, в отличие от инкапсулирования, представляет собой полную иммобилизацию плазмина внутри протеиновой матрицы и его защиту от действия ингибиторов плазмина с сохранением ферментативной активности.
Конкретными задачами проекта являются: (1) разработка протоколов синтеза альбуминовых наночастиц с контролируемыми параметрами размера и структуры; (2) разработка способов энтрапирования плазмина в протеиновую и керамическую матрицы; (3) функционализация поверхности наночастиц таргетными молекулами (антителами к специфичным участкам фибрина); (4) разработка методик применения полученных конъюгатов на моделях тромбов, а также на тромбах ex vivo; (5) оценка биосовместимости и цитотоксичности полученных наночастиц на моделях животных клеток.
Результаты: 1) Впервые были получены сложносоставные протеиновые наноконтейнеры с инкорпорированными магнетитовыми наночастицами, стабилизированные оболочкой полиэтиленгликоля, и обладающие способностью контролируемо высвобождать малые молекулы. На основе данных наноконтейнеров впервые был создан прототип гемостатического таргетного препарата с аминокапроновой кислотой.
2) Были созданы и протестированы тромболитические наночастицы на основе плазмин нагруженных наночастиц карбоната кальция (ватерита) с инкорпорированными наночастицами магнетита. Подход по таргетной доставке плазмина пористыми наночастицами описан впервые. Эффективность данных наночастиц не уступает чистому плазмину и в некоторых аспектах выигрывает за счет особенностей носителя (локальное повышение pH до оптимальных значений и увеличение локальной концентрации плазмина с дополнительной пенетрацией тромба).
3) Были синтезированы оболочки диоксида кремния, загруженные урокиназой, полученные темплатным путем за счет вытравливания матрицы карбоната кальция. Данный метод позволил получить простую систему с постепенным релизом белка, которая показала себя эффективнее, чем только урокиназа и обеспечивала более равномерный и пролонгированный лизис модельных тромбов. В рамках работы также были продолжены исследования протеиновых наноконтейнеров и установлена сложная природа их образования в зависимости от загруженного вещества. Было установлено, что незначительные концентрации протеаз могут значительно ускорять релиз из таких контейнеров. Также было изучено поведение наноразмерных частиц ватерита с размерами меньше 300 нм. Было установлено, что при таком размере система становится крайне нестабильной и подвержена крайне быстрой перекристаллизации, что снижает её терапевтические возможности.
Читайте также:
