Пример сакрэктомии при хордоме крестца
Добавил пользователь Cypher Обновлено: 25.01.2026
ООО Клиника спинальной нейрохирургии «Аксис»;
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
Первый МГМУ им. И.М. Сеченова, Москва
ФГБНУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко", РАМН, Москва
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Осложнения хирургического лечения опухолей крестцовой локализации
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2019;83(1): 67‑74
Опухоли крестца — группа новообразований, неоднородных по гистологическому типу, степени злокачественности и характеру роста, которые объединяет только локализация. Хирургическое лечение таких опухолей связано с риском больших и малых осложнений как во время вмешательства, так и после операции. Как правило, любое вмешательство, направленное на удаление опухоли крестца или крестцовой области, сопряжено с необходимостью реконструкции костей и/или мягких тканей для создания условий нормального заживления раны и возможности активизации пациента. Цель исследования — анализ осложнений, возникающих при хирургическом лечении опухолей крестца. Материал и методы. Исследование основано на опыте хирургического лечения 57 пациентов с диагнозом опухоли крестца. Им выполнено 60 хирургических вмешательств, связанных с лечением основной патологии и осложнений хирургического лечения. Большие и малые осложнения наблюдались у 37 (68%) оперированных пациентов. Всего было зафиксировано 47 различных осложнений. У 6 пациентов осложнения раннего послеоперационного периода потребовали дополнительной операции. Выводы. Хирургическое лечение опухолей крестца сопряжено с высоким риском осложнений. Несмотря на потенциальный риск больших осложнений, сакрэктомия при первичной, или потенциально агрессивной, или злокачественной нейрогенной опухоли крестца необходима для улучшения локального контроля и выживаемости пациентов.
Первичные опухоли крестца составляют 2—4% от всех опухолей костей и 1—7% всех первичных опухолей позвоночника. Они представлены врожденными образованиями (хордомой, тератомой), первичными костными опухолями (хондросаркомой, гигантоклеточной опухолью, остеобластомой, аневризмальной костной кистой, остеомой, хондромой), различными саркомами мягких тканей. Отдельно выделяют нейрогенные опухоли: эктопические эпендимомы, невриномы, нейрофибромы, злокачественные опухоли периферических нервов (ЗОПН), периферические нейроэктодермальные опухоли (pPNET) [1, 2]. Клиническая картина при этих новообразованиях различна и зависит от размеров опухоли, направления роста, распространенности и степени инвазии опухолевой ткани, однако первым симптомом чаще всего является локальная боль, усиливающаяся в ночное время [3]. Хирургическое лечение опухолей крестца сопряжено с развитием различных по тяжести осложнений, а прогноз неоднозначен и чаще обусловлен биологией опухоли [4, 5]. Несмотря на 60-летнюю историю изучения проблем, связанных с лечением опухолей крестцовой локализации, и технические преимущества современных диагностических и операционных методов, прогноз исхода заболевания в большинстве случаев по-прежнему остается неясным. До сих пор нет четких рекомендаций относительно необходимости стабилизации после ампутации крестца ниже позвонка S1. Также отсутствуют четкие рекомендации по пластическому закрытию дефекта после удаления крестца.
Цель исследования — проведение анализа осложнений и последствий хирургического лечения опухолей крестцовой локализации.
Материал и методы
Проведен ретроспективный анализ результатов хирургического лечения 57 пациентов с различными опухолями крестцовой области в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко Минздрава России в период с 2001 по 2015 г.
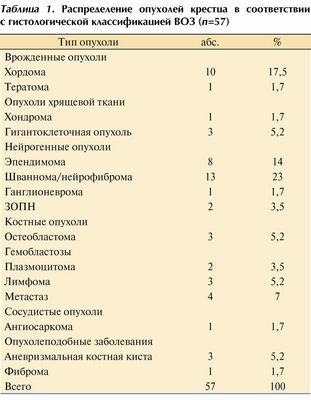
Гистологическая характеристика опухолей представлена в табл. 1. Таблица 1. Распределение опухолей крестца в соответствии с гистологической классификацией ВОЗ (n=57)
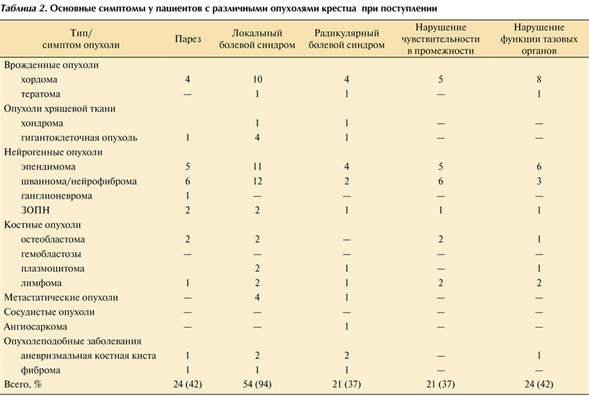
Основные клинические симптомы, выявляемые при поступлении в стационар, приведены в табл. 2. Таблица 2. Основные симптомы у пациентов с различными опухолями крестца при поступлении
Самым частым симптомом была локальная боль. Нарушение функции тазовых органов наблюдалось у 42% пациентов, столько же пациентов имели слабость в нижних конечностях, у 37% пациентов наблюдались нарушения чувствительности и корешковая боль.
Следует отметить, что основной целью лечения пациентов с опухолью крестца являются уменьшение/купирование болевого синдрома, контроль функции тазовых органов, локальный контроль опухоли, а для пациентов с первичными злокачественными опухолями — увеличение продолжительности жизни. По данным разных авторов, наиболее эффективным методом лечения является резекция опухоли единым блоком [6, 7], поэтому большая часть пациентов подвергаются инвалидизирующей операции, что оправдано с точки зрения онкологического прогноза, но сомнительно с точки зрения динамики неврологических симптомов и качества жизни после операции.

Классификация симптомов после N-блок-резекции крестца, предложенная Biagini и соавт. в 1997 г., представлена в табл. 3. Таблица 3. Классификация нарушений после сакрэктомии по Biagini и соавт. (1997)
В серии наших наблюдений N-блок-резекция опухоли крестца была выполнена 10 пациентам (6 пациентов с хордомой, 2 с гигантской шванномой, 1 с ганглионевромой, 1 с солитарным метастазом рака почки). У всех пациентов исходно наблюдался выраженный локальный болевой синдром (в среднем 7 баллов по визуально-аналоговой шкале, ВАШ), у 6 пациентов (с хордомой и шванномами) отмечено нарушение функции тазовых органов в виде запора и нарушения мочеиспускания, у 2 была анестезия аногенитальной области.
Всем 6 пациентам с хордомой была выполнена резекция крестца: 3 пациентам — высокая ампутация крестца, 1 — тотальная сакрэктомия, 2 — средняя сакрэктомия. После операции у всех пациентов отмечено снижение интенсивности боли до 1—2 баллов по ВАШ, однако наблюдалось ухудшение функции тазовых органов. В 3 случаях оно было транзиторным, в 3 других наступило стойкое ухудшение, при этом у 2 пациентов возникло недержание мочи и кала, в 1 случае развилась неполная задержка мочи.
Осложнения сакрэктомии
При анализе результатов сакрэктомии необходимо уточнение понятий последствий и осложнений операции.
Последствиями сакрэктомии принято считать нарушения, связанные с пересечением нервных структур в ходе выделения опухоли, нарушение целостности тазового дна и появление полости в области крестца. Таким образом, к последствиям операции можно отнести нарушение чувствительности в аногенитальной области и в ногах, нарушение движений в ногах, нарушение сексуальной функции, мочеиспускания, дефекации.
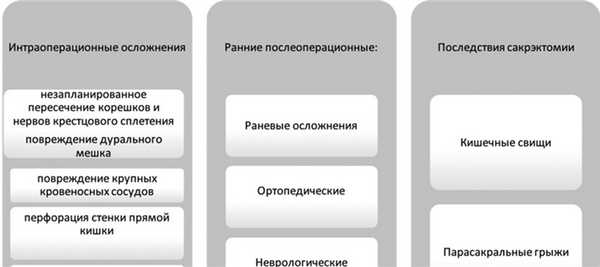
Осложнения сакрэктомии разделяют по времени возникновения на интраоперационные и осложнения раннего и отдаленного послеоперационного периода (рис. 1). Рис. 1. Классификация осложнений сакрэктомии.
Всего в исследуемой группе осложнения были зафиксированы у 37 (68%) пациентов. У 6 пациентов наблюдались интраоперационные осложнения, у всех 37 были осложнения в раннем послеоперационном периоде. Осложнений в отдаленном периоде не наблюдалось. Общее число осложнений составило 47.
Интраоперационные осложнения
К интраоперационным осложнениям принято относить повреждение крупных сосудов, интраоперационную кровопотерю, перфорацию стенки полого органа, незапланированное пересечение спинальных корешков.
Из этих осложнений в исследуемой группе отмечена только кровопотеря. Она не была связана с повреждением крупных сосудов, источником кровотечения служили пресакральные вены, венозное сплетение прямой кишки. В среднем объем кровопотери составил 3,2 л (от 1,6 до 17). Для профилактики последствий кровопотери были использованы аппарат для реинфузии с лейкоцитарной мембраной, гиперволемическая гемодилюция с одномоментным забором собственных эритроцитов, предоперационная заготовка собственной плазмы крови и донорских эритроцитов и плазмы крови. В одном случае на фоне большой кровопотери и переливания донорских эритроцитов развились шоковая почка и макрогематурия. Данное осложнение было купировано в раннем послеоперационном периоде.
Осложнения раннего послеоперационного периода
К осложнениям раннего послеоперационного периода относятся раневые осложнения, которые, по данным литературы, составляют 25—46% от всех осложнений. Среди них преобладают инфекционные осложнения в виде поверхностного и глубокого нагноения. К глубоким нагноениям относят ишиоректальные абсцессы, эмпиему, формирование натечников и эпидуритов с последующим менингитом. Эти осложнения, как правило, сопровождают повреждение прямой кишки с последующим попаданием бактерий в раневую полость и нагноением.
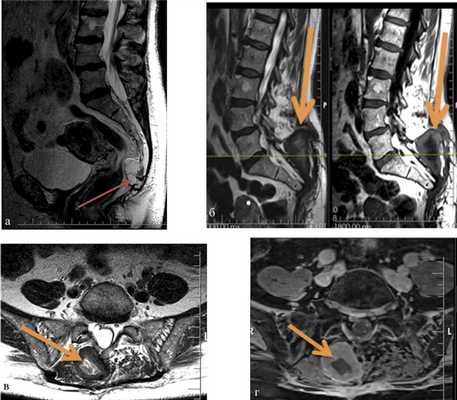
В нашей серии гнойные осложнения наблюдались у 10 (27%) пациентов, из них у 6 было глубокое нагноение раны. В случаях подтвержденного глубокого нагноения проводилась ревизия операционной раны с последующим дренированием и установкой приточно-отточной системы. В 1 случае потребовалось открытое ведение раны с аспирационной повязкой. У 1 пациентки наблюдалось нагноение межмышечной гематомы (рис. 2). Рис. 2. МРТ крестца и таза у пациентки с хордомой крестца. а — до операции, сагиттальная проекция, опухоль указана стрелкой; б—г — после операции, сагиттальная (б) и аксиальная проекции (в, г). Нагноившаяся гематома указана стрелкой.
У 1 пациента в раннем послеоперационном периоде наблюдалась серома в зоне операции. Это частое явление, как правило, встречающееся у пациентов после резекции части креста при удалении костной опухоли, редко приводит к каким-либо последствиям.
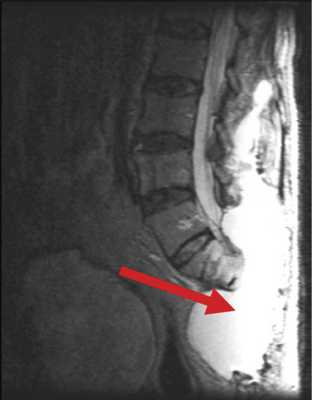
В случае пациента Б., 78 лет, после высокой ампутации крестца, в блок опухоли вошла часть m. erector spinae. Для пластики дефекта были использованы большие ягодичные мышцы, левый лоскут был частично развернут. У пациента наблюдался дефицит массы тела, развившийся на фоне выраженного болевого синдрома, который, в частности, сопровождал акт дефекации. В связи с этим пациент старался меньше есть, за счет чего масса тела снизилась с 86 до 65 кг за 1 мес. Нарушение репаративной функции привело к отсутствию сращения мягких тканей, сформировалась полость, заполненная серозной жидкостью, общим объемом около 5 л (рис. 3). Рис. 3. Гигантская серозная полость как осложнение сакрэктомии (указана стрелкой).
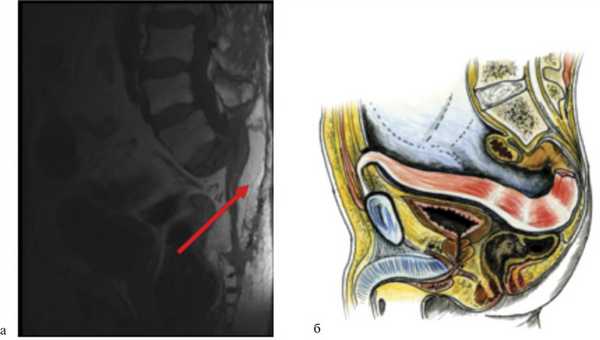
Для лечения подобных осложнений используется метод транспозиции ректоабдоминального лоскута в пресакральную область ректоабдоминальным доступом (рис. 4). Рис. 4. Пример использования метода транспозиции ректоабдоминального лоскута на питательной ножке. а — МРТ больного после операции, сагиттальная проекция. Перемещенный дедерматизированный ректоабдоминальный лоскут указан стрелкой; б — схематическое изображение перемещения лоскута.
Несмотря на продолженный рост и метастазирование опухоли (хондроид-хордома GIII), серозная полость регрессировала, рана зажила первичным натяжением в течение 10 сут.
Нарушение функции мочевого пузыря наблюдалось у 15 пациентов, из них только у 3 оно было следствием резекции крестца, в то время как у остальных нарушение функции тазовых органов было связано с интраоперационным повреждением или иным воздействием на корешки крестцового сплетения. Нарушение функции тазовых органов выражалось полной задержкой мочи у 12 пациентов и требовало периодической катетеризации у 11 пациентов и установки постоянного катетера у 1 пациента, в связи с нарушением подвижности. В 1 случае наблюдался острый пиелонефрит на фоне полной задержки мочи. В 3 случаях развилось недержание мочи: у 2 пациентов была парадоксальная ишурия и у 1 пациента — полное недержание. Двое пациентов также отмечали отсутствие позывов к дефекации, нарушение процесса дефекации и связанные с этим боли в животе. Одному пациенту наложена колостома.
Нарушения мочеиспускания, зафиксированные у 13 пациентов, регрессировали до нормы либо до неполной задержки с минимальной остаточной мочой в мочевом пузыре (до 150 мл). В 1 случае с пересечением дурального мешка на уровне L5—S1 нарушение функции тазовых органов не регрессировало, и пациенту была наложена эпицистостома. У 1 пациентки в связи с недержанием мочи был имплантирован бандаж на шейку мочевого пузыря.
У 6 пациентов в раннем послеоперационном периоде наблюдалась ликворея. Все пациенты имели распространенные нейрогенные опухоли: 5 — миксопапиллярные эпендимомы и 1 — интра-экстрадуральную шванному. Удаление этих опухолей было сопряжено с пластикой твердой мозговой оболочки. Всем пациентам был установлен люмбальный дренаж на время заживления раны. Ни в одном из представленных случаев не было зафиксировано инфекции, ликворея не потребовала ревизии или пластики мягких тканей.
Болевой синдром в связи с пересечением/повреждением корешков крестцового сплетения может осложниться формированием хронического нейропатического болевого синдрома, резистентного к терапии. В нашей группе хронический нейропатический болевой синдром и гиперпатия в зоне иннервации S2—S5 были у 4 пациентов. В 3 случаях в течение 3 мес болевой синдром регрессировал, однако в 1 случае потребовался длительный прием прегабалина.
В 4 случаях был отмечен стресс-перелом крестца в раннем периоде после высокой ампутации крестца. В литературе стресс-перелом крестца после сакрэктомии описывается как редкое осложнение в связи с большой практикой применения металлоостеосинтеза. В нашей серии во всех случаях перелом был обусловлен частичной резекцией крестца и сопутствующим остеопорозом у больных старше 40 лет (3 женщины и 1 мужчина) (рис. 5). Рис. 5. Стресс-перелом крестца после высокой ампутации крестца у пациентки 54 лет на фоне активизации. а, б — 3D-реконструкция СКТ таза после операции, вид спереди (а) и вид сзади (б); в — СКТ на уровне перелома в аксиальной проекции. Стрелками указана линия перелома. В 3 случаях это осложнение наблюдалось после удаления хордомы, в 1 случае — шванномы S1 корешка после частичной резекции покрышки крестца и расширения первого крестцового отверстия (рис. 6). Рис. 6. СКТ костей таза. а — фронтальная и сагиттальная проекции; б, в — 3D-реконструкция, вид спереди и сзади. Линия перелома указана стрелками. Во всех случаях это осложнение сопровождалось локальным болевым синдромом, нарушением походки. В первых 3 случаях проводилась хирургическая коррекция с имплантацией металлоконструкции для пояснично-тазовой стабилизации (рис. 7), Рис. 7. Пояснично-тазовая стабилизация после стресс-перелома крестца на фоне сакрэктомии. а — СКТ до операции; б, в — метод после операции стабилизации. линия перелома указана стрелками. в 1 случае наблюдался регресс болевого синдрома на фоне приема бисфосфонатов.
Техника сакрэктомии является сложной и часто сопряжена с большим количеством осложнений. Выбор стратегии лечения должен основываться на индивидуальных особенностях каждого пациента. Необходимо оценивать функциональный статус и способность пациента перенести лечение, соотносить цели лечения с последствиями и возможными осложнениями, а также учитывать биологические свойства конкретной опухоли.
Оптимальной тактикой лечения раневых и ортопедических осложнений является проведение одномоментной транспозиции ректоабдоминального лоскута и одномоментной пояснично-тазовой стабилизации.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Статьявыполнена в классическом стиле. Дан анализ хирургических осложнений лечения 57 случаев новообразований крестца.
Осложнения хирургического лечения опухолей крестца — по-настоящему важная для рассмотрения проблема, широко обсуждаемая в англоязычной периодике. Актуальность проблемы хирургического лечения опухолей крестца безусловна, так как более трети пациентов испытывают нарушение качества жизни и нуждаются в повторной операции после перенесенной парциальной или тотальной сакрэктомии, выполненной для лечения опухолей крестца.
Представленная авторами группа пациентов весьма разнородная, пациентов объединяет лишь локализация новообразований, разумеется, объем хирургического вмешательства зависел от морфологического строения опухоли. В статье подчеркнута зависимость тех или иных осложнений от вида и объема хирургического лечения, в частности от степени резекции нервных структур.
Ввиду редкости описываемой патологии статья представляет интерес для читателей журнала.
Пример сакрэктомии при хордоме крестца
Техника операции при опухоли крестца - резекция крестца, удаление крестца (сакрэктомия)
Большинство опухолей крестца являются доброкачественными образованиями с местно-агрессивным ростом — аневризмальные костные кисты, остеобластомы и гигантоклеточные опухоли, либо злокачественными образованиями низкой степени злокачественности, например, хордомы или хондросаркомы. Внутриочаговая резекция образований в виде их кюретажа является исчерпывающим методом лечения при доброкачественных опухолях. Тогда как для радикального избавления от злокачественных образований показаны уже гораздо более обширные вмешательства. Хирургические вмешательства по поводу опухолей крестца в зависимости от распространенности поражения и уровня планируемой резекции можно подразделить на 4 типа.
1. Тип I — низкая ампутация крестца, или сакрэктомия ниже уровня S2
2. Тип II — высокая ампутация крестца, или сакрэктомия на уровне S1 или S1-S2 сегмента
3. Тип III — тотальная сакрэктомия, или сакрэктомия на уровне L5-S1
4. Тип IV — расширенная сакрэктомия, или тотальная сакрэктомия в сочетании с резекциями смежных отделов подвздошных костей, позвонков или органов таза
При низкорасположенных опухолях крестца, т.е. опухолях, располагающихся ниже уровня S2, резекция выполняется из заднего доступа, тогда как при высоких опухолях, расположенных на уровне S1 и S2 позвонков, используется комбинированный передний и задний доступ.
а) Опухоли, расположенные на уровне S3 и ниже. Описанный ниже доступ может использоваться при низкорасположенных опухолях крестца, верхняя граница которых может быть пропальпирована при пальцевом исследовании прямой кишки. Вокруг наружного отверстия анального канала накладывается кисетный шов, пациента укладывают в коленно-локтевое положение и выполняют срединный разрез кожи. Кожно-подкожные лоскуты мобилизуются и отводятся в стороны, открывая доступ к крестцу, при этом такие образования, как крестцово-подвздошная связка, зона прикрепления большой ягодичной мышцы, медиальная точка прикрепления крестцово-бугорной связки и надкостница крестца должны остаться интактными.
Эти связки и мышцы отсекаются с обеих сторон от крестца в непосредственной близости к точкам их прикрепления. Большая ягодичная мышца рассекается в зоне своего прикрепления до крестцово-подвздошного сочленения. Этим обеспечивается доступ к нижним корешкам седалищного нерва, грушевидной мышце и задним границам тазовой части опухоли.
В глубине доступа идентифицируют и рассекают грушевидную мышцу, а затем крестцово-остистую и копчиково-анальную связки. Прямая кишка осторожно мобилизуется от пресакральной фасции и поверхности опухоли, всегда растущей в вентральном направлении. Верхний уровень резекции крестца определяется исходя из данных лучевых методов исследования. На выбранном уровне мягкие ткани, расположенные кпереди от крестца, аккуратно мобилизуют пальцем через большие седалищные отверстия с обеих сторон. Даже крупные опухоли обычно растут поднадкостнично, поэтому аккуратная мобилизация тканей пальцем позволяет предотвратить такое весьма неприятное осложнение, как повреждение ягодичных сосудов.
Выходящие из большого седалищного отверстия и входящие затем в малое седалищное отверстие половые нервы следует идентифицировать, мобилизовать и защитить, исключение составляют лишь те случаи, когда эти нервы оказываются очень интимно спаянными с опухолью и сохранить их невозможно.
Нижние крестцовые корешки, в т.ч. S3, удаляются единым блоком вместе с опухолью. Удаленный массив тканей таким образом будет состоять из крестца, копчика, нижних крестцовых корешков и окружающих мягких тканей. Остеотомия крестца выполняется между задними крестцовыми отверстиями S2 и S3.
Опухоль освобождается от всех окружающих мягких тканей и удаляется единым блоком. Кровотечение из культи крестца останавливают с помощью воска, кроме этого довольно значительное кровотечение может наблюдаться из пресакральных мягких тканей. Основными источниками кровотечения здесь обычно являются срединные и латеральные крестцовые сосуды. При подобного рода резекциях в реконструктивных вмешательствах необходимости нет, поскольку крестцово-подвздошные сочленения остаются интактными. При небольшого объема образованиях средней и дистальной части крестца в резекции крестцово-подвздошных сочленений нет необходимости.3 При закрытии операционной раны также обычно не требуется ротации кожных лоскутов или каких-либо других реконструктивно-пластических вмешательств.
Задний доступ не обеспечивает возможности безопасной мобилизации тканей в верхней части пресакраль-ного пространства. Использование заднего доступа при вмешательствах в области верхней части крестца сопряжено с высоким риском повреждения крупных сосудов или прямой кишки, а также повреждения капсулы образования при остеотомии вентральной кортикальной пластинки крестца и крестцово-подвздошных сочленений сзади. Избежать подобных осложнений позволяет использование комбинированного переднего и заднего доступа, который считается наиболее оптимальным при образованиях, требующих ампутации крестца на уровне крестцово-подвздошных сочленений.
Варианты резекций при опухолях крестца. Низкая опухоль крестца. а - Низкая резекция крестца, вид сзади.
б - После отсечения ягодичных мышц в ране становятся видны грушевидная мышца и седалищный нерв.
б) Опухоли проксимального отдела крестца (комбинированный передний и задний доступ):
1. Вентральный этап сакрэктомии. В положении пациента на спине вдоль края прямой мышцы живота через все слои передней брюшной стенки, за исключением брюшины, выполняется передний вертикальный срединный доступ к вентральной поверхности крестца. Внутренние подвздошные артерии вместе со срединными и латеральными крестцовыми сосудами лигируются и пересекаются с обеих сторон. Лигирование внутренних подвздошных вен может привести к депонированию крови в органах таза и венах эпидурального венозного сплетения. В настоящее время лигированию внутренних подвздошных вен предпочитают перевязку по мере обнажения вентральной поверхности крестца сегментарных крестцовых вен в месте их входа в крестцовые отверстия.
Пресакральная фасция не рассекается. Выполняют стандартную дискэктомию L5-S1, сосуды и подвздошно-поясничные мышцы мобилизуют и разводят в стороны, после чего идентифицирует корешок L5 и подвздошно-поясничный ствол. Внутренняя кортикальная стенка крыла подвздошной кости с обеих сторон рассекается долотом в 1 см латеральней крестцово-подвздошных сочленений, ограничивая тем самым зону резекции. Стволы пояснично-крестцового сплетения, берущие начало от L4-L5 корешков, необходимо сохранить. S1-S4 корешки пересекаются по обе стороны от опухоли. Прямая кишка тупо мобилизуется от крестца в пределах пресакрального пространства.
2. Задний этап сакрэктомии. Пациента поворачивают в положение на животе. Выполняется разрез кожи в виде трезубца, пояснично-крестцовые кожно-подкожные лоскуты мобилизуются и отводятся краниально. С обеих сторон обнажают задние отделы гребней подвздошных костей, большие седалищные отверстия и седалищные нервы, а также остистые отростки, дугоотростчатые суставы и поперечные отростки L3-L5 позвонков. После ляминэктомии L3-L5 позвонков пересекают крестцовые корешки спинного мозга. Дуральный мешок пересекается дистальней отхождения L5 корешков и перевязывается нерассасывающейся нитью. Из заднего доступа выполняется завершающий этап дискэктомии L5-S1. Выполняется резекция дутоотростчатых суставов L5-S1.
В поперечном направлении пересекаются крестцово-остистые мышцы, а затем большие ягодичные и грушевидные мышцы. Задняя крестцово-подвздошная, крестцово-бугорная и крестцово-остистая связки отделяются поднадкостнично или пересекаются. Верхние ягодичные сосуды и нервы, нижние ягодичные сосуды и нервы, седалищные нервы, половые нервы и задние кожные нервы бедра необходимо сохранить.
В ходе заднего этапа сакрэктомии задние отделы крыльев подвздошных костей или крестцово-подвздошные сочленения рассекаются долотом или бором уже со стороны их задней поверхности. Линии остеотомии со стороны задней поверхности должны соединиться с ранее выполненными остеотомиями со стороны вентральной поверхности. Для упрощения этого этапа операции можно воспользоваться проволочной пилой. При наличии показаний объем резекции можно расширить, включив сюда необходимый участок подвздошных костей. Объем резекции определяется данными компьютерной (КТ) или магнитно-резонансной (МРТ) томографии. Перед этим граница предстоящей резекции намечается с помощью долота, которым на поверхности крыла подвздошной кости кнаружи от крестцово-подвздошного сочленения формируется неглубокая бороздка.
Если планируется резекция подвздошной кости, то подвздошные сосуды необходимо мобилизовать еще во время вентрального этапа вмешательства.
а - Доступ для вентрального этапа сакрэктомии.
б - Вентральный этап сакрэктомии. а - Доступ для заднего этапа сакрэктомии.
б - Мобилизация мышц в ходе заднего этапа сакрэктомии. а - Остеотомия в ходе заднего этапа сакрэктомии.
б - Объем резекции подвздошной кости может варьировать от 1 до 4.
в) Реконструкция крестца. Удаление более половины объема крестцово-подвздошного сочленения приводит к нестабильности таза, поэтому для восстановления непрерывности позвоночника и тазового кольца показано реконструктивное вмешательство. Многочисленные методики реконструкции, используемые после тотальной сакрэктомии, включают использование крестцовых балок, соединяющих между собой пластины, вертикальных стержней Галвестон, соединенных поперечными коннекторами с продольными стержнями транспедикулярного фиксатора, резьбовых трансподвздошных стержней или изготовление индивидуального протеза крестца.
1. Модифицированная техника Галвестон. Первым этапом выполняется двусторонняя транспедикулярная стабилизация L3-L5 сегментов. Точкой для введения стержня в подвздошную кость служит задняя верхняя подвздошная ость (ЗВПО), которая располагается сразу латеральней задних отверстий второго крестцового позвонка. ЗВПО удаляется с помощью костных кусачек до формирования костной поверхности, располагающейся на одном уровне с поверхностью крестца. В образованное костное ложе вводится педикулярный зонд и направляется на 1,5 см выше седалищной вырезки в толщу подвздошной кости между ее наружной и внутренней кортикальными стенками, зонд погружается аккуратными ударами молотка на глубину 6-9 см.
Пальпация пальцем наружной кортикальной стенки подвздошной кости и седалищной вырезки позволяет сформировать канал в наиболее мощном надвертлужном костном массиве подвздошной кости. В плотные участки кости зонд погружается вращательными движениями. Угол введения зонда обычно составляет 20° латерально от срединной линии в поперечной плоскости и 30-35° каудально по отношению к горизонтальной плоскости. После того как канал будет сформирован, в него вводится гибкий стержень-шаблон (проволока), используемый в последующем для моделирования стержня.
Моделирование стержня. Стержень Галвестон состоит из трех сегментов: позвоночного, крестцового и подвздошного. С помощью трубчатого изгибателя на границе позвоночного и крестцового сегментов формируется изгиб 90°. Второй изгиб формируется на уровне крестцово-подвздошного сочленения в поперечной плоскости, ориентация его зависит от того, правый это стержень или левый, от направления канала в подвздошной кости и степени изгиба позвоночного сегмента стержня в сагиттальной плоскости. По предварительно отмоделированному шаблонному стержню соответствующим образом моделируют титановый стержень диаметром 6 мм. Стержень вводится в подвздошную кость на глубину 4-5 см и фиксируется в головках педикулярных винтов, установленных в поясничные позвонки, правый и левый стержни соединяются поперечными коннекторами.
2. Двойная стабилизация подвздошной кости винтами в сочетании с сегментарной стабилизацией позвоночника. Точки ввода подвздошных винтов формируют путем резекции с помощью изогнутого остеотома задних верхних подвздошных остей. Задняя часть гребня подвздошной кости должна располагаться на одном уровне с поверхностью крестца, что позволяет разместить базу на подвздошной кости относительно вентрально и оптимизирует ее укрытие мягкими тканями при ушивании раны. Резекция задней верхней подвздошной кости приводит к образованию овальной формы площадки, которая является зоной для установки обоих — верхнего и нижнего — подвздошных винтов.
Хирург помещает кончик пальца одной руки в верхний отдел седалищной вырезки, а другой рукой погружает зонд в нижнюю часть овальной зоны введения, продвигая его вглубь между внутренней и наружной кортикальными стенками подвздошной кости. Зонд, таким образом, будет располагаться между двумя кортикальными стенками подвздошной кости сразу выше седалищной вырезки. После формирования канала в нем нарезается резьба и устанавливается нижний подвздошный винт. Длина этого винта, учитывая приходящуюся на него нагрузку, должна составлять 70-75 мм.
Второй винт вводится в верхней части овальной зоны. Здесь точно так же сначала устанавливается зонд, траектория введения которого выбирается несколько краниально. Зонд аналогичным образом погружается в толщу подвздошной кости, в сформированном зондом канале нарезается резьба и устанавливается верхний подвздошный винт.
3. Реконструкция с использованием треугольной рамы. После транспедикулярной стабилизации L3-L5 сегментов позвоночный столб смещается каудально и L5 позвонок с обеих сторон фиксируется к подвздошным костям, это достигается за счет крестцовых стержней и любых других позвоночных фиксаторов, позволяющих стабилизировать позвоночник и таз. После стабилизации позвоночника и таза выполняется массивная костная реконструкция с использованием аллотрансплантатов из малоберцовых костей и костных чипсов или губчатой аллокости.
4. Введение чресподвздошных стержней. Техника введения чресподвздошных стержней предполагает выполнение доступа к наружным кортикальным пластинкам обеих подвздошных костей. Для этого грудопоясничная фасция рассекается вдоль задней части подвздошного гребня и над задней верхней подвздошной остью. Большая ягодичная мышца отсекается от наиболее медиальных участков задней верхней подвздошной кости и вместе с грудопоясничной фасцией отводится латерально. Точка ввода стержня выбирается примерно в 2 см латеральней вершины ЗВПО в наиболее широкой части подвздошной кости и в 2 см выше большой седалищной вырезки. С помощью ручной рукояти подвздошная балка проводится через оба крыла подвздошной кости, проведение балки необходимо контролировать визуально — балка постоянно должна располагаться кзади по отношению к крестцовым отверстиям. Эта методика предполагает использование двух массивных подвздошных стержней.
Верхний должен располагаться на уровне сочленения L5 и S1 позвонков, а нижний — на уровне S2 позвонка. В качестве таких стержней чаще всего используются резьбовые крестцовые балки из системы Херрингтона, имеющие диаметр 6,3 мм. После проведения обоих стержней со стороны наружных кортикальных пластинок подвздошных костей они фиксируются гайками с шайбами, концы стержней при необходимости обрезаются.
5. Задняя крестцово-подвздошная стабилизация пластиной. Стабилизация пластиной осуществляется с использованием такого же доступа, как и при установке чресподвздошных стержней. В качестве фиксатора используется прямая реконструктивная 3,5- или 4,5-мм пластина на 10-12 отверстий. Пластина фиксируется к каждому из крыльев подвздошных костей винтами, при этом наиболее медиальный винт вводится в косом направлении между наружной и внутренней кортикальными стенками подвздошной кости. Наиболее прочную фиксацию здесь обеспечивает использование 6,5-мм кортикального винта длиной 80 мм и более. С каждой стороны пластина дополнительно фиксируется к подвздошной кости еще двумя винтами.
Винты с каждой из сторон сначала вводятся не на полную глубину и только после введения всех винтов они последовательно затягиваются. Пластина моделируется соответственно задней поверхности крестца и за счет фиксации к обеим подвздошным костям выполняет роль стягивающей пластины. Оптимальным уровнем расположения пластины считается ее расположение сразу же ниже задней верхней подвздошной кости и выше большой седалищной вырезки. Реконструктивная пластина позволяет выполнить ее моделирование непосредственно in situ после первичной фиксации. Пластина может использоваться в качестве дополнения и опоры для чресподвздошных стержней.
а - Точка введения подвздошного стержня.
б - Угол введения подвздошного стержня. а - Метод введения стержня путем его вращения.
б - Схематичное изображение траектории введения подвздошного стержня, вид сверху. Моделирование стержня Галвестон. а - Двойная стабилизация подвздошных костей винтами.
б - Треугольная рама. а - Мобилизация тканей для установки чресподвздошных стержней.
б - Схема расположения чресподвздошных стержней. То же, вид сверху. а - Задняя крестцово-подвздошная стабилизация пластиной, вид сзади.
б - То же, вид сверху.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Тактика лечения нейрогенных опухолей крестца и крестцовой области
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(6): 53‑58
Опухоли крестца редко встречаются в рутинной практике. Ввиду отсутствия патогномоничных симптомов диагноз часто становится очевидным на поздних этапах развития заболевания. При этом тактика лечения зависит от степени злокачественности новообразования, характера роста, взаимоотношения опухоли с нервными структурами, магистральными сосудами, костями таза. Цель исследования — анализ общей и безрецидивной выживаемости пациентов с нейрогенными опухолями крестца различной степени злокачественности. Материал и методы. В статье проведен анализ результатов лечения 27 пациентов с нейрогенными опухолями крестцовой локализации, получивших хирургическое лечение на базе НМИЦ нейрохирургии. Результаты. Медиана выживаемости пациентов с нейрогенными опухолями составила 72 мес, наименьшая средняя продолжительность жизни наблюдалась в группе нейрогенных сарком — 30 мес. Злокачественные опухоли периферических нервов в 100% случаев рецидивировали. Выводы. Общая выживаемость и безрецидивная выживаемость у пациентов с нейрогенными опухолями крестца напрямую зависят от степени злокачественности опухоли и от радикальности ее удаления. В группе пациентов с первично доброкачественными опухолями безрецидивный период зависел от степени радикальности удаления опухоли. Хирургическое лечение нейрогенных опухолей крестца приводит к снижению интенсивности боли, однако не ведет к регрессу неврологических симптомов, обусловленных компрессией корешков крестцового сплетения. Пациентам со злокачественными опухолями крестца необходимо выполнять частичную или полную сакрэктомию. При этом выбор стратегии лечения должен учитывать функциональный статус, гистологическую природу опухоли, а также соматические особенности пациента.
Опухоли крестца редко встречаются в рутинной практике. Учитывая отсутствие патогномоничных симптомов опухоли, расположенной в области крестца, и отсутствие клинико-рентгенологической дифференцировки различных видов опухолей, встречающихся в крестцовой области, диагноз часто становится очевидным только в стадии прогрессии опухолевого процесса или после биопсии [1, 2]. Как правило, дебютом заболевания является усиливающийся ночью болевой синдром, не купируемый нестероидными противовоспалительными препаратами [3, 4]. Тактика лечения зависит от степени злокачественности новообразования, характера и локализации роста, взаимоотношений опухоли с нервными структурами, магистральными сосудами, костями таза [5, 6].
Нейрогенные опухоли крестцовой локализации составляют 7% всех первичных опухолей позвоночника и представлены эктопической эпендимомой, невриномой, нейрофибромой, злокачественной опухолью периферических нервов (ЗОПН), периферической нейроэктодермальной опухолью [1, 7].
Большие размеры опухолей требуют, как правило, выполнения комбинированных переднезадних доступов для адекватной резекции опухоли. Частота встречаемости ЗОПН в популяции пациентов с нейрогенными опухолями, а также частота малигнизации этих образований, мало изучены в силу редкости этих опухолей. Важнейшими этиологическими факторами возникновения ЗОПН является нейрофиброматоз 1-го типа и радиологическое лечение в анамнезе по поводу других онкологических заболеваний. В 8—13% случаев у пациентов с нейрофиброматозом 1-го типа в течение жизни развивается ЗОПН. Связь с облучением нейрофибромы отмечена в 10% случаев ЗОПН. По данным различных наблюдений [8], малигнизация нейрофибромы возникает примерно через 15 лет после ее выявления.
Цель данного исследования — проведение анализа общей выживаемости и безрецидивной выживаемости пациентов с нейрогенными опухолями крестцовой области, изучение случаев злокачественной трансформации опухоли после нерадикального хирургического лечения, оценка возможности тотального удаления в случаях выявления злокачественной нейрогенной опухоли.

Проведен ретроспективный анализ результатов лечения 27 пациентов с нейрогенными опухолями крестцовой локализации, которым выполнено хирургическое лечение в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко в период с 2001 по 2015 г. Гистологическая характеристика опухолей представлена в табл. 1. Таблица 1. Распределение пациентов по гистологической принадлежности опухолей крестцовой области в соответствии с гистологической классификацией ВОЗ
Основным клиническим симптомом у пациентов с нейрогенными опухолями крестцовой области является локальная ночная боль, которая не поддается коррекции лекарственными препаратами. Именно этот симптом встречается чаще всего и является основной причиной обращения к врачу. По данным наших наблюдений, локальная боль встречалась у 94% пациентов. Диагностика опухоли на этапе появления боли наиболее актуальна, нередко болевой синдром свидетельствует о прогрессирующем росте образования. Однако часто пациенты в течение месяцев, а иногда многих лет получают лечение по поводу дегенеративных заболеваний позвоночника без надлежащей диагностики.
В табл. 2 представлены Таблица 2. Основные симптомы у пациентов с нейрогенными опухолями крестца на момент поступления в стационар основные симптомы нейрогенных опухолей крестцовой области.
Задачами лечения пациентов с нейрогенными опухолями крестца были: локальный контроль объема опухоли, устранение основных симптомов, для пациентов с первично злокачественными опухолями — увеличение продолжительности жизни и предотвращение распространения процесса.
В зависимости от характера объемного образования, его размеров, степени вовлечения соседних анатомических структур и результатов срочного морфологического исследования пациентам выполнялась тотальная en-bloc-сакрэктомия, краевая сакрэктомия или интракапсулярная субтотальная резекция объемного образования. Наиболее эффективным методом хирургического лечения нейрогенных опухолей крестца и крестцовой области является краевая либо en-bloc-резекция. Это оправдано с точки зрения онкологического прогноза для пациентов с первично злокачественными нейрогенными опухолями, но сомнительно для пациентов с доброкачественными опухолями, если принять во внимание динамику неврологических симптомов пациентов и качество их жизни после операции.

Болевой синдром оценивали по визуально-аналоговой шкале (ВАШ). Для оценки неврологических исходов хирургического лечения опухолей крестца использовали шкалу Biagini, которую мы считаем оптимальной для клинической работы [9]. Данная классификация адаптирована для оценки неврологических симптомов пациентов, перенесших операцию в области крестца, и является единственной шкалой оценивающей только функцию корешков от S1 до S5 (табл. 3). Таблица 3. Классификация нарушений после сакрэктомии по R. Biagini, P. Ruggieri, M. Mercuri и соавт., 1997

Таблица 4. Распределение пациентов в зависимости от характера роста опухоли
Для оценки общей выживаемости пациенты были разделены на две группы: с локально агрессивными и неагрессивными опухолями. Разделение проводилось на основании результатов морфологического исследования биоптатов, полученных в ходе оперативного вмешательства, и нейровизуализационных данных. К агрессивным были отнесены объемные образования, проявляющие свойства злокачественности: инфильтративный рост с признаками ангиогенеза, наличие рецидивов после тотального удаления, метастазирование, быстрый рост. В эту группу вошли пациенты с ЗОПН, ксантоматозной нейрофибромой, ганглионевромой и анапластической эпендимомой. В неагрессивной группе преобладали эпендимомы I и II степени злокачественности, пациенты с простой шванномой, прочие пациенты с солитарными нейрофибромами.
Динамика безрецидивного периода оценивалась на основании рутинных неврологических и нейровизуализационных методов исследования (МРТ пояснично-крестцового отдела и таза с контрастным усилением), проводимых каждые 3 мес в течение 1-го года после оперативного вмешательства, а затем каждые 6 мес. С целью максимальной объективизации рутинный контроль проводился одной и той же бригадой врачей. Все контрольные нейровизуализационные исследования проводились на аппаратах МРТ с силой магнитного поля не менее 1,5 Тл и срезом 5 мм.
Хордома
Хордома – это редко встречающееся новообразование, предположительно происходящее из остатков хорды. В настоящее время чаще рассматривается как злокачественное. Возникает вблизи позвоночника, может располагаться на любом уровне, от копчика до основания черепа. Обычно развивается в крестцово-копчиковом отделе или затылочно-базилярной части черепа. Симптомы хордомы определяются локализацией опухоли и степенью поражения различных нервов. Возможны боли, парезы, нарушения чувствительности и расстройства функций тазовых органов. Диагноз выставляют с учетом данных неврологического осмотра, рентгенографии, КТ, МРТ и биопсии. Лечение – операция, лучевая терапия.
МКБ-10
Общие сведения
Хордома – опухоль различной степени злокачественности, предположительно возникающая из эмбрионального предшественника позвоночника. Всегда располагается рядом с позвоночным столбом. Обычно локализуется в области крестца или основания черепа, но может поражать и другие отделы. Может встречаться в любом возрасте. Хордомы в области основания черепа чаще диагностируются в возрасте 20-40 лет, опухоли крестцового отдела – в возрасте 40-60 лет. Мужчины страдают вдвое чаще женщин. Распространенность заболевания – 1-3 новых случая хордомы в год на 1 млн. населения. Лечение проводят специалисты в области онкологии, неврологии и вертебрологии.
Причины хордомы
Причины и предрасполагающие факторы, влияющие на вероятность развития онкологического процесса, пока остаются невыясненными. Предполагается, что факторами риска являются клеточный иммунодефицит, контакты с радиоактивными и химическими канцерогенами в анамнезе.
Патанатомия
Вопрос злокачественности новообразования остается дискутабельным. Одни исследователи выделяют доброкачественные и злокачественные формы хордом, другие расценивают такие опухоли как относительно доброкачественные из-за их медленного роста и редкого метастазирования. Вместе с тем, из-за высокой склонности к рецидивированию и большого количества неблагоприятных исходов современные специалисты склонны рассматривать хордому как злокачественный процесс.
Хордома представляет собой мягкий одиночный узел, покрытый хорошо выраженной капсулой. При злокачественном течении инкапсуляция просматривается слабо. Новообразование имеет дольчатое строение, на разрезе хордома полупрозрачная, светло-серая, в ткани видны участки некроза. При микроскопии выявляется полиморфизм клеток. Клеточные ядра мелкие, гиперхромные. В клетках видны крупные вакуоли. В злокачественных хордомах выявляются клеточная анаплазия и атипичные фигуры митоза.
Симптомы хордомы
Симптомы зависят от локализации, размеров и направления роста опухоли. На первый план в клинической картине обычно выходят признаки поражения тех или иных нервов. Хордомы, расположенные в зоне основания черепа, могут распространяться в область турецкого седла, расти вглубь черепа, в направлении носоглотки или орбиты. При сдавлении гипофиза могут возникать гормональные нарушения. Характерны бульбарные расстройства, возникающие в результате поражения блуждающего, подъязычного и языкоглоточного нерва.
У пациентов, страдающих хордомой основания черепа, могут выявляться дизартрия, нарушения глотания и изменения голоса (слабость, гнусавость) вплоть до афонии. При распространенных хордомах наблюдаются нарушения ритма дыхания и сердечной деятельности, обусловленные вовлечением дыхательного и сердечно-сосудистого центров, расположенных в продолговатом мозге. Возможны нарушения зрения вследствие сдавления зрительного нерва. При распространении процесса может наблюдаться прорастание орбиты или носоглотки.
Хордомы крестца могут распространяться как поверхностно, так и в направлении брюшной полости или малого таза. При сдавлении спинного мозга и нервных корешков возникают боли, слабость нижних конечностей, расстройства чувствительности и движений, парезы и нарушения деятельности тазовых органов. При расположении хордомы в нетипичном месте (в области шейного, грудного или поясничного отдела позвоночника) наблюдаются боли и неврологические расстройства, соответствующие уровню поражения.
Осложнения
При злокачественном течении отмечается быстрый рост новообразования. Хордома прорастает позвонки или кости черепа, дает метастазы в регионарные лимфоузлы, печень и легкие. На поздних стадиях выявляется картина раковой интоксикации. Больные хордомой теряют вес и аппетит, чувствуют постоянную слабость. Наблюдаются колебания настроения, депрессивные расстройства, анемия и гипертермия. При метастазах в легкие возникают одышка и кашель с кровью, при метастазах в печень – гепатомегалия, желтуха и асцит.
Диагностика
Диагноз выставляют с учетом анамнеза, жалоб больного, данных общего и неврологического осмотра и результатов обследования. Необходимые исследования:
- Рентгенография. Пациентам с подозрением на хордому назначают рентгенографию черепа или рентгенографию крестцово-копчикового отдела позвоночника (в зависимости от локализации новообразования). На рентгенограммах обнаруживаются крупные участки разрушения костной ткани. Иногда в области костного дефекта просматриваются тонкие перегородки, разделяющие полость на несколько камер. При расположении хордомы в крестцовом отделе выявляется увеличение переднезаднего размера крестца. При локализации опухоли в области черепа отмечается рассасывание клиновидной кости. Для определения вовлеченности сосудов проводят ангиографию.
- Томографическая диагностика. Для более точного определения размера, структуры и распространенности хордомы назначают КТ головного мозга, МРТ головного мозга, КТ позвоночника и МРТ позвоночника.
- Биопсия опухоли. Окончательный диагноз хордомы устанавливают на основании биопсии и последующего гистологического исследования образца тканей. Забор материала производят под рентген-контролем. Состояние регионарных лимфоузлов оценивают с учетом данных УЗИ пораженной области.
Для выявления метастазов в легких проводят рентгенографию грудной клетки и КТ легких, для обнаружения вторичных очагов в печени – КТ органов брюшной полости и МРТ печени. Для оценки общего состояния организма пациентам, страдающим хордомой, назначают общий анализ крови, общий анализ мочи и биохимический анализ крови. В ходе предоперационной подготовки определяют группу крови и резус-фактор. При наличии соматической патологии больного направляют на консультацию к врачам соответствующего профиля (кардиологу, гастроэнтерологу, эндокринологу и т. д.).
Дифференциальную диагностику хордомы осуществляют с новообразованиями спинного и головного мозга, хондросаркомой крестца, а также опухолями женских половых органов и раком толстого кишечника, распространяющимися на область позвоночника.
Лечение хордомы
Основным методом лечения хордомы является хирургическое вмешательство. Из-за особенностей расположения и роста опухоли радикальное удаление возможно только у незначительной части пациентов. При возможности радикального оперативного вмешательства осуществляют полную резекцию хордомы вместе с капсулой. В остальных случаях проводят паллиативные операции. Частичное иссечение хордомы позволяет уменьшить сдавление нервных структур и существенно улучшить качество жизни пациентов.
Лучевая терапия при хордомах малоэффективна, однако из-за больших технических затруднений при проведении оперативного вмешательства этот метод нередко приобретает существенное значение в процессе паллиативной терапии. Радиотерапия обеспечивает снижение интенсивности болевого синдрома и некоторое уменьшение размеров хордомы. Облучение проводят, используя рентгеновский аппарат или гамма-установку.
Наряду с традиционными методами лучевой терапии применяют стереотаксическую хирургию, в ходе которой осуществляется прицельное воздействие тонкими пучками гамма-лучей на область хордомы. Химиотерапия в лечении данной патологии не применяется из-за устойчивости опухоли к действию химиопрепаратов. Из-за частого рецидивирования многим больным требуются повторные операции и курсы лучевой терапии.
Прогноз
Прогноз при хордомах определяется уровнем злокачественности новообразования, распространенностью онкологического процесса и успешностью первого хирургического вмешательства. Средняя пятилетняя выживаемость при злокачественных формах хордомы составляет около 30% Средняя продолжительность жизни пациентов, страдающих данной патологией, колеблется от 5 до 10 лет. Рецидив хордомы рассматривается как прогностически неблагоприятный признак.
Читайте также:
- Случай патогенетического лечения левосторонних врожденных диафрагмальных грыж
- Рентгенограмма, КТ, МРТ при остеоартрозе тазобедренного сустава
- Синтез иммуноглобулинов. Образование антител
- КТ, МРТ, ангиограмма при травматической артериовенозной фистуле позвоночника
- Синдром Тричера Коллинза - лучевая диагностика
