Синтез иммуноглобулинов. Образование антител
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Установлено, что антитела вырабатываются плазматически-ми клетками, находящимися в селезенке, лимфатических узлах, костном мозге, пейеровых бляшках. Плазматические клетки про-исходят из предшественников В-клеток, подвергшихся контакту с антигеном. В-клетки и их потомки функционируют по клональ-ному принципу: по мере развития иммунного ответа они диффе-ренцируются, пролиферируют и созревают. Механизм синтеза антител не отличается от синтеза других белков. Легкие и тяже-лые цепи, из которых состоит молекула антител, синтезируются раздельно, затем соединяются на полирибосомах, и окончатель-ная сборка происходит в пластинчатом комплексе.
Биосинтез иммуноглобулинов осуществляется путем сбора молекул на мембранно-связанных рибосомах и транслициру-ются через мембрану помощью N-концевого сигнального пеп-тида, который впоследствии удаляется. К образующимся по-липептидным цепям присоединяются каркасные сахара. По мере передвижения полипептида из цистерн ЭПР в АГ углеводы процессируются. Терминальные углеводы, связанные с поверхностными и секре-тирующими Ig, различаются по содержанию сиаловой кисло-ты. В итоге иммуноглобулины попадают на поверхность мемб-раны посредством обратного пиноцитоза.
Динамика продукции антител, как и химическая структура их молекул, детерминирована генетически. Каждому виду жи-вотных свойственна характерная динамика образования антител. Она зависит также от особенностей и доз антигена, путей проникновения его в организм, состояния реактивности м.оор-ма.
В образовании антител различают четыре фазы:
1. Фаза покоя (лаг-фаза, фаза индукции): – с момента поступления антигена в организм до появления антител. Ее продолжительность – от нескольких дней до одного месяца, в зависимости от свойств антигена, его дозы, способа введения в организм, возраста животного и др. В этот период происхо-дит пролиферация и дифференцировка лимфоидных клеток в направлении синтеза иммуноглобулина класса М.
2. Фаза нарастания титров антител (лог–фаза,продуктивная фаза) – от появления антител до момента достижения их максимального количества. Ее длительность – 2-15дней. В этой фазе антитела освобождаются из плазмоцитов и поступают в кровяное русло. Уменьшается число клеток, синтезирующих IgM, нарастает продукция IgG. Впоследствии появляются IgA, а также IgE, IgD.
3. Фаза стабилизации, в которой уровень антител (титр) остается неизменным обычно в течение нескольких дней или недель. Ее длительность зависит от вида животного, характера антигенов и класса продуцируемых антител (иммуноглобулины имеют разный период полураспада).
4. Фаза снижения продукции антител. Продолжительность этой фазы различна и зависит от сохранения антигена в тканях, который является индуктором образования антител. Этому способствует, например, введение антигена с адъютантом, который создает депо, из которого АГ медленно поступает в организм, обеспечивая длительную антигенную стимуляцию. Итоговое снижение титра антител начинается спустя несколько недель или месяцев.
Синтез иммуноглобулинов. Образование антител
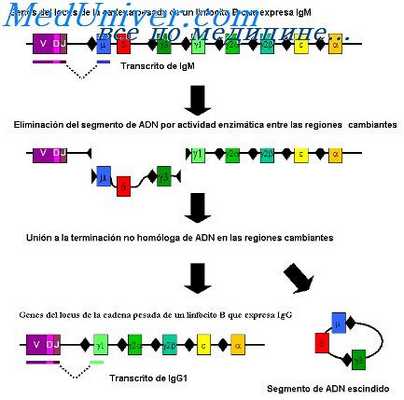
Формирование VC-гена иммуноглобулинов. Механизмы объединения V- и С-генов антител
Каким же образом происходит в пределах транслокона объединение раздельных V- и С-генов в единый VC-ген? По этому вопросу отсутствуют какие-либо экспериментальные данные, имеются только более или менее правдоподобные умозрительные предложения. Согласно одному из них предполагается, что на одном конце транслокона сгруппированы тандемно расположенные V-гены, а на другом конце транслокона сгруппированы С-гены (Gaily, Edelman, 1972).
Предполагается также, что любой V-ген в пределах транслокон а может объединиться с любым С-геном этого же транслокона. Гипотетические механизмы объединения V- и С-генов состоят в том, что V-ген как бы «вырезается» из соответствующего участка ДНК и интегрируется в новый участок, находящийся в непосредственной близости с одним из С-генов. Такая интеграция может произойти или в результате внутритранслоконного кроссинговера или же с помощью процесса, напоминающего интеграцию эписомыв бактериальную ДНК.
Косвенным подтверждением подобного механизма объединения V- и С-генов являются некоторые особенности первичной структуры тяжелых и легких цепей. Оказалось, что последовательность трех последних остатков вариабельной области и двух первых остатков постоянной области тяжелых цепей (т. е. последовательность пограничного участка между V и С) весьма сходна у тяжелых цепей разных классов и подклассов, так же как и у различных вариабельных подгрупп тяжелых цепей.

Эта последовательность охватывает остатки 113—117 у гамма-цепей и остатки 122—126 у мю-цепей. Альфа-цепи имеют аналогичную последовательность. Легкие цепи иммуноглобулинов также имеют в «пограничном» участке сходную последовательность вне зависимости от типа легкой цепи и вариабельной подгруппы.
Подобная идентичная последовательность нуклеотидов у разных V-и С-генов может служить в качестве той сигнальной последовательности, которая распознается соответствующими ферментами (или ферментом), участвующими в «изъятии» V-генов из одного участка ДНК и интеграции в пределах данного транслокона в другой участок ДНК, где локализованы С-гены.
Сигнальными последовательностями для ферментов типа рестрикционных эндонуклеаз (рестриктаз) являются короткие двуспиральные последовательности ДНК, обладающие поворотной симметрией («палиндромы»). Анализ аминокислотной последовательности пограничных VC-участков тяжелых и легких цепей и экстраполяция этой последовательности на уровень последовательности ДНК с учетом вырожденности генетического кода и неопределенности третьего основания в кодоне показали, что для иммуноглобулиновых генов действительно существуют последовательности типа палиндромов.
Объединение V- и С-генов в единый VC-ген, осуществляемое с помощью рестриктаз, может идти не только по пути объединения генов с сохранением генетического материала в пределах транслокона. но может произойти благодаря делеции всего генетического материала, который разделяет объединяемые V- и С-гены. И, наконец, вполне возможно, что происходит амплификация одного из V-генов транслокона и затем уже экстракопии этого гена встраиваются и объединяются с тем или иным С-геном.
В последнем случае экстракопии одного и того же гена могут объединиться с разными С-генами в пределах транслокона.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Антитела организма. Места образования антител
По своей молекулярной структуре гамма-глобулинов различные классы антител в принципе подобны друг другу [Cohen, Porter, 1964]. Каждый мономер состоит из двух длинных (тяжелых) и двух коротких (легких) пептидных цепей, связанных рядом дисульфидных связей. Ферментативное расщепление молекул в различных участках дало возможность проанализировать характеристики различных участков молекул.
Последовательность аминокислот в Fc-фрагмепте (кристаллизующийся фрагмент тяжелых цепей) характерна для данного класса антител [u(IgM), Y(IgG), a (IgA) и e(IgE)]. Структура легких цепей одинакова во всех классах антител и может принадлежать к одному из двух типов: u или X.
Фрагмент Fc ответствен за биологические свойства молекулы, включая ее способность прилипать к поверхности клеток (цитофильное свойство) или способность взаимодействовать с комплементом. Компонент Fab (фрагмент, связывающий антитела) содержит терминальные последовательности аминокислот, допускающие специфическое взаимодействие с антигеном. Именно эта терминальная последовательность взаимодействует с гаптенами.
IgG, IgE и IgD присутствуют в циркулирующей крови в виде мономеров (т. е. отдельных молекулярных единиц), IgM является полимером пяти основных молекул, связанных дисульфидными связями. IgA в сыворотке крови человека встречается главным образом в виде мономера, но в бронхиальных выделениях присутствует в виде димера, связанного в фрагменте Fc с секреторным участком и Т-цепями [Halpern, Koshland, 1970].
Места образования антител
IgG и IgM продуцируются в клетках зародышевых фолликулов и в плазматических клетках ретикулоэндотелиальной системы, особенно лимфатических узлов. Стимулированные узлы содержат большие зародышевые фолликулы в корковой части узла, активно образующей антитела наряду с плазматическими клетками, которые особенно скапливаются в мозговом слое.
IgA образуются в лимфатических узлах, но продуцируются также плазматическими клетками, выстилающими кишечник и слизистую оболочку дыхательных путей, особенно вблизи бронхиальных желез. Предполагалось, что до 80% сывороточного IgA у некоторых видов животных происходит из кишечника [Chodirker, Tomasi, 1963]. IgE продуцируются главным образом лимфоидной тканью в верхних отделах дыхательных путей, особенно в миндалинах [Ishizaka, lshizaka, 1970].
Образование антител. Co временем в зависимости от иолупериода жизни каждого иммуноглобулина уровень его в сыворотке падает до минимума в возрасте около 12—14 нед. Этим объясняется тяжелое течение многих инфекций у маленьких грудных детей, но не у новорожденных, которые более или менее защищены. Скорость созревания зависит от класса иммуноглобулинов. IgG достигает уровня, характерного для взрослых, к 3 годам, IgM — к 6 мес, IgE и IgA — только к 10-летнему возрасту [Hobbs, 1970; Kjellmao et. al., 1976].
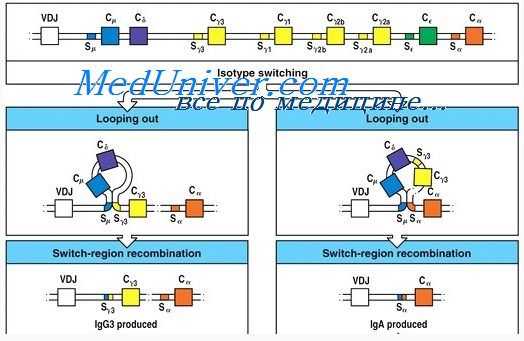
Изучение молекулярных механизмов синтеза иммуноглобулинов представляет принципиальный интерес с самых разных точек зрения. Синтез иммуноглобулинов — хорошая модель для изучения процессов развития; переключение биосинтеза с IgM на IgA и IgG — интереснейший пример изменения экспрессии генов в процессе днфференцировки одной клетки. Молекулярные механизмы, лежащие в основе этих процессов, пока совершенно не изучены. Не исследованы и процессы, приводящие к образованию полипептидных цепей, разные участки которых кодируются разными генами. Многоцепочная структура иммуноглобулинов делает их удобной моделью и для изучения биосинтеза сложных белковых молекул и выяснения механизмов сборки и секреции таких молекул из клетки.
Весьма удобную модель представляют собой антитела. Это специфические белки, образование которых протекает в строго детерминированные сроки. Поэтому ткани иммунизированных животных широко используются для изучения процессов, связанных с образованием иммуноглобулинов. Было показано, что иммунизация животных приводит к интенсификации синтеза ДНК (Moav е. а., 1973), РНК (Mach, Vassalli, 1965) и белка (Учитель, Хасман, 1967). Часть этих явлений, по-видимому, прямо связана с синтезом антител или иммуноглобулинов. Указанием на это служат данные об изменении под действием антигена картины репликации ДНК (Souleil, Panijel, 1970), увеличении количества транскрибируемых последовательностей ДНК (Moav е. а., 1976) и появлении новых видов РНК (Cohen, 1967b), хотя последнее рядом исследователей ставится под сомнение.
Образование антител представляет собой уникальный процесс, важнейшим компонентом которого является клеточная пролиферация (а не просто интенсификация синтеза белка в уже имеющихся клетках). Поэтому приходится считаться с тем, что большая часть биохимических изменений в лимфоидной ткани при иммунизации относится не к образованию иммуноглобулинов, а к процессам, обусловленным клеточной дифференцировкой и пролиферацией, маскирующими изменения, связанные непосредственно с синтезом иммуноглобулинов.
Сильно осложняет задачу изучения механизмов биосинтеза иммуноглобулинов и гетерогенность нормальных лимфоидных тканей. Выделение из них продуцентов иммуноглобулинов до сих пор не разработано, так как существующие методы разделения клеточных популяций основаны главным образом на избирательной сорбции клеток, несущих поверхностные иммуноглобулины, а основные продуценты антител (иммуноглобулинов) их практически лишены (Askonas, 1975).
Для ряда исследований чрезвычайно удобной моделью оказались плазматические опухоли мышей. В течение долгого времени считалось, что спонтанные опухоли этого типа у мышей крайне редки. Первый случай трансплантируемой плазмоцитомы был описан в 1951 г. Но уже к 1960—1962 г. Поттер и другие исследователи разработали относительно простую методику индукции плазмоцитом у мышей (см. Potter, 1972), позволившую в короткие сроки получить набор трансплантируемых миелом, продуцирующих различные классы иммуноглобулинов.
Часть этих белков обладает антительной активностью, часть лишена ее и, по-видимому, представляет собой неспецифические иммуноглобулины. Продукция иммуноглобулинов в плазматических опухолях составляет в среднем 5—40% от всех синтезируемых клетками белков (Ваumal, Scharff, 1973). Для изучения механизмов биосинтеза иммуноглобулинов эта система обладает рядом преимуществ перед нормальными лимфоидными тканями, которые мы опишим в следующей статье.
Научная электронная библиотека

Антитела (иммуноглобулины, ИГ, Ig) – это особый класс гликопротеинов (т.е. белков с присоединенных к ним углеводными остатками), присутствующих в сыворотке крови, тканевой жидкости или на клеточной мембране, которые распознают и связывают антигены. Иммуноглобулины синтезируются В-лимфоцитами (плазматическими клетками) в ответ на вещества определенной структуры – антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных и нежелательных эндогенных объектов – например, бактерий и вирусов, опухолевых клеток и др. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом – характерным фрагментом антигена.
Антитела являются относительно крупными (~150 кДа для IgG) гликопротеинами, имеющими сложное строение. Антитела состоят из двух идентичных тяжелых цепей и из двух идентичных лёгких цепей, т.е.
фрагментов с меньшим и большим молекулярным весом (рис. 3). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding – антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable – фрагмент, способный к кристаллизации). Fab фрагменты называются также вариабельной областью антител, т.к. именно их строение определяет связывающую функцию Ат и варьируется в зависимости от структуры антигена. Fc фрагмент называется константной областью Ат, т.к. у особей данного вида для всех молекул Ат этот фрагмент является идентичным.
Рис. 5. Структура антител
В зависимости от выполняемых функций антитела могут существовать как в различных формах (классы иммуноглобулинов): мономерной (IgG, IgD, IgE, сывороточный IgA) или в олигомерной форме (димер-секреторный IgA, пентамер – IgM). Схематичное строение
Иммуноглобулины класса G (IgG) – основной иммуноглобулин сыворотки здорового человека, составляет 70–75 % всей фракции иммуноглобулинов. IgG наиболее активны во вторичном иммунном ответе и антитоксическом иммунитете. Являются единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивают иммунитет плода и новорожденного. IgG являются самыми небольшими молекулами по сравнению с другими классами Ig (молекулярная масса М = 146 кДа).
Иммуноглобулины класса А (IgA) содержатся в сыворотке (15–20 %
всей фракции Ig), в секреторном компоненте: слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой
и респираторной системы. IgA представлены в виде мономеров (80 % в сыворотке), димеров (в секрете), и тримеров. Средняя молекулярная масса IgA М = 500 кДа.
Иммуноглобулины класса М (IgM) являются пентамерами IgG и составляют до 10 % фракции иммуноглобулинов. Появляются IgM при первичном иммунном ответе B-лимфоцитами на неизвестный антиген. IgM встроены в плазматическую мембрану B-лимфоцитов и выполняют роль антиген распознающего рецептора. Средняя молекулярная масса IgМ М = 970 кДа.
Иммуноглобулины класса Е (IgE) – мономеры. Их функция заключается в связывании с поверхностью базофилов и тучных клеток, с последующим присоединением к ним антигена, при этом происходит дегрануляцию и выброс в кровь гистамина и серотонина – медиаторов воспаления. IgE участвуют в защите от паразитарных инфекций, обуславливают многие аллергические реакции. М = 200 кДа.
Рис. 6. Классы иммуноглобулинов
Антитела также классифицируют по типу антигена и, соответственно, по выполняемым Ат функциям. По этому принципу можно выжделить несколько основных классов антител:
● Антиинфекционные или антипаразитарные антитела, вызывающие гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита.
● Антитоксические антитела, не вызывающие гибели самого возбудителя или паразита, но обезвреживающие вырабатываемые им токсины, либо другие экзогенные токсические вещества.
● «Антитела-свидетели заболевания», наличие которых в организме сигнализирует о знакомстве иммунной системы с данным антигеном (возбудителем) в прошлом или о текущем присутствии этого антигена (возбудителя), но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
● Естественные антитела – антитела к эндогенным соединениям, присутствующие в здоровом организме и выполняющие регулятор-
ные функции;
● Аутоагрессивные антитела, или аутологичные антитела, аутоантитела – антитела, способные образовываться из естественных антител и вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний.
● Аллореактивные антитела, или гомологичные антитела, аллоантитела – антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки, печени, костного мозга, и в реакциях на переливание несовместимой крови.
● Гетерологичные антитела, или изоантитела – антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку). К изоантителам относятся также вторичные (антивидовые) антитела, используемые в различных видах ИХМ.
● Антиидиотипические антитела – антитела против антител, вырабатываемых самим же организмом. Этот вид антител специфичен
к вариабельному участку антител, так называемому идиотипу. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело (рис. 5). И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т.д.
Читайте также:
