Примеры увеальной эффузии, симулирующей цилиохориоидальную меланому
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Неопухолевые болезни симулирующие меланому заднего отдела сосудистой оболочки глаза
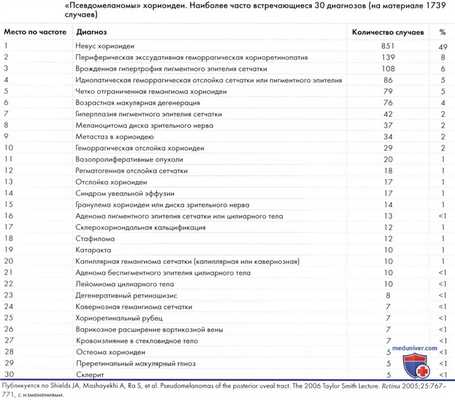
Некоторые состояния клинически могут симулировать меланому заднего отдела сосудистой оболочки (1-40). В недавно опубликованном обзоре онкологической службы Wills Eye Hospital приведен перечень различных псевдомеланом и указана их частота (1,5). Другие опухоли, которые могут напоминать меланому, обсуждаются в соответствующих статьях на сайте.
Почти каждая опухоль глазного дна, описанная в настоящем справочнике, в тех или иных случаях может иметь общие признаки с меланомой цилиарного тела или хориоидеи. В статьях на сайте рассматриваются отдельные неспецифические состояния, симулирующие опухоли, не обсуждаемые в других частях настоящего руководства. В отдельных статьях коротко описаны и проиллюстрированы некоторые из этих псевдомеланом, встречающихся в практике онкоофтальмолога.
А. Сосудистая патология и кровоизлияния:
1. Возрастная макулярная дегенерация (ВМД, центральная экссудативная геморрагическая хориоретинопатия - CEHCR)
2. Периферическая экссудативная геморрагическая хориоретинопатия (peripheral exudative hemorrhagic chorioretinopathy - PEHCR)
3. Геморрагическая макроаневризма сетчатки
4. Локальное кровоизлияние в хориоидею
5. Варикозное расширение вортикозной вены
6. Различные субретинальные и интраретинальные кровоизлияния
7. Идиопатическая хориоидальная неоваскулярная мембрана
B. Воспалительная и инфекционная патология:
1. Задний узелковый склерит
2. Увеальная эффузия
3. Гранулемы (саркоидоз, туберкулез, солитарный идиопатический хориоидит)
4. Солитарные инфекционные поражения
C. Другие состояния:
1. Двусторонняя диффузная увеальная меланоцитарная пролиферация (bilateral diffuse uveal melanocytic proliferation - BDUMP)
2. Склерохориоидальная кальцификация
3. Регматогенная отслойка сетчатки
4. Склеральные пломбы после оперативного лечения отслойки сетчатки
5. Буллезный дегенеративный ретиношизис
6. Цилиохориоидальная отслойка
7. Подвывих хрусталика
8. Сдавление глазного яблока опухолью глазницы
9. Стафилома
10. Послеоперационный пролапс радужки
Показанные ниже клинические случаи, направленные на консультацию к специалисту в связи с подозрением на меланому хориоидеи: склерохориоидальная кальцификация (36-39), регматогенная отслойка сетчатки, склеральная пломба после хирургического лечения отслойки сетчатки, буллезный дегенеративный ретиношизис и цилиохориоидальная отслойка после интраокулярного оперативного вмешательства.
Склерохориоидальная кальцификация: на глазном дне правого глаза вдоль верхневисочной аркады определяются три желто-белых образования. Правый глаз другого пациента. Крупный солитарный очаг склерохориоидальной кальцификации вдоль верхневисочной аркады. Регматогенная отслойка сетчатки. Так как разрывы сетчатки выявляются с трудом, пациента направили к специалисту с подозрением на меланому хориоидеи. Складки на поверхности и разрыв сетчатки помогают дифференцировать это состояние и меланому. Высоко выступающая в стекловидную полость склеральная пломба после оперативного лечения отслойки сетчатки была ошибочно принята за меланому. Буллезный ретиношизис, симулирующий меланому хориоидеи. В отличие от меланомы сквозь образование виден плоский сосудистый рисунок хориоидеи. Иногда меланому симулируют отложения пигмента вокруг разрывов наружного слоя. Цилиохориоидальная отслойка, появившаяся вскоре после оперативного лечения катаракты, симулирующая цилиохориоидальную меланому. Ora serrata, видимая через расширенный зрачок, также свидетельствует в пользу данного диагноза. В отличие от меланомы, при диафаноскопии цилиохориоидальная отслойка хорошо пропускает свет. Интракапсулярная экстракция и секторальная иридэктомия по поводу катаракты выполнены много лет назад.
Другие неопухолевые состояния, которые могут симулировать меланому, включают в себя подвывих мутного хрусталика, кисту цилиарного тела после операции экстракции катаракты, сдавление глазного яблока опухолью глазницы, стафилому склеры и постоперационный пролапс сосудистой оболочки.
Зрелая катаракта, подвывих хрусталика. Картина напоминает меланому цилиарного тела. Киста цилиарного тела после экстракции катаракты, симулирующая меланому. Сдавливание глазного яблока новообразованием глазницы, создающее картину внутриглазной опухоли. Обратите внимание на заметный подъем нижней части глазного дна от центральной ямки до нижних квадрантов экватора. Аксиальная КТ пациента, показанного на рисунке выше: видна кавернозная гемангиома глазницы, сдавливающая глазное яблоко и вызывающая вдавление глазного дна. Стафилома склеры, симулирующая прорастающую за пределы глазного яблока меланому цилиарного тела. Пролапс сосудистой оболочки после операции по поводу катаракты, симулирующий экстраокулярное распространение меланомы сосудистой оболочки.
Клинические примеры неопухолевых болезней симулирующих меланому заднего отдела сосудистой оболочки глаза:
Редактор: Искандер Милевски. Дата публикации: 9.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Примеры увеальной эффузии, симулирующей цилиохориоидальную меланому
Ю.А. БЕЛЫЙ, А.В. ТЕРЕЩЕНКО, М.А. ПЛАХОТНИЙ, Ю.А. ЮДИНА
Калужский филиал «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», 248007, г. Калуга, ул. им. Святослава Федорова, д. 5
Описано 2 клинических случая синдрома увеальной эффузии. Обоим пациентам выполнена задняя трепанация склеры. Проведение у больных склерэктомии с использованием роговичного трепана является технически простой процедурой и позволило сформировать пути оттока супрахориоидальной жидкости в субтеноново пространство.
Ключевые слова: синдром увеальной эффузии, задняя склерэктомия, роговичный трепан.
Yu.A. BELIY, A.V. TERESHCHENKO, M.A. PLAKHOTNIY, Yu.A. YUDINA
Kaluga branch of «Inter-sectoral Scientific-Technical Complex «Eye microsurgery» named after Academician S.N. Fedorov», 5 Svyatoslav Fyodorov St., Kaluga, Russian Federation, 248007
Uveal effusion syndrome. Tactics of treatment
Two clinical cases of uveal effusion syndrome are described. Both patients underwent posterior sclerotomy. The sclerotomy with corneal trepan is a simple technique, which allowed to form the canals for supra-choroidal fluid outflow into the subtenon space.
Key words: uveal effusion syndrome, posterior sclerectomy, corneal trepan.
Синдром увеальной эффузии — редкое идиопатическое состояние, которое встречается преимущественно у мужчин среднего возраста с гиперметропией и характеризуется цилиохориоидальной отслойкой с последующей экссудативной отслойкой сетчатки [1]. Впервые заболевание было описано у пациентов с врожденным нанофтальмом [2, 3]. Вследствие редкости данной патологии и отсутствия патогномоничных признаков диагностика данного заболевания зачастую представляет определенные трудности.
Среди пациентов с нормальными размерами глазного яблока данным заболеванием чаще всего страдают мужчины старше 60 лет с гиперметропией. В большинстве случаев заболевание носит двусторонний характер, но манифестация клинических признаков заболевания на парных глазах может происходить с интервалом в несколько лет [4].
Характерными клиническими признаками синдрома увеальной эффузии являются: высокая пузыревидная отслойка сосудистой оболочки (ОСО) в сочетании с отслойкой сетчатки, нормальная глубина передней камеры, нормальное внутриглазное давление (ВГД), расширение эписклеральных сосудов, возможно наличие крови в шлеммовом канале; при хроническом течении заболевания на глазном дне происходит перераспределение ретинального пигмента в виде «леопардовых пятен», в стекловидном теле возможно наличие нежной взвеси клеточных элементов [5]. Важными диагностическими методиками, необходимыми для правильной постановки диагноза, являются ультразвуковое В-сканирование и в некоторых случаях МРТ, которые позволяют провести дифференциальную диагностику с эписклеритом и внутриглазным новообразованием.
Для лечения синдрома увеальной эффузии предложено множество методик, но большинство авторов отмечают высокую эффективность задней склерэктомии.
Под наблюдением находились два пациента
Пациент 1. Мужчина, 61 год, обратился в Калужский филиал МНТК «Микрохирургия глаза» в апреле 2013 г. с жалобами на слепоту правого глаза и прогрессирующее снижение зрения левого глаза. При осмотре: острота зрения: OD — движение руки у лица; OS — 0,1-cyl 0,75 на 81 град = 0,2. ВГД: OD 18 мм рт.ст., OS 20 мм рт.ст. В обоих глазах отмечались выраженные помутнения в ядре хрусталиков, осмотр глазного дна был несколько затруднен. При офтальмоскопии отмечалось побледнение дисков зрительных нервов, отслойка сосудистой оболочки в виде пузырей во всех сегментах глазного дна, на средней периферии, больше выраженная справа. Сетчатка отслоена справа в виде открытой воронки, слева визуализировалась плоская тотальная отслойка сетчатки (рис. 1). Проведение флюоресцентной ангиографии (ФАГ) было затруднено в связи с непрозрачностью оптических сред.
Электрическая чувствительность: OD — 340 мкА; OS — 260 мкА — грубые изменения. Электрическая лабильность: OD — 21 Гц; OS — 24 Гц — значительное снижение. При ультразвуковом исследовании на правом глазу была выявлена высокая воронкообразная отслойка сетчатки высотой до 11,1 мм, пузыревидная тотальная ОСО (рис. 2).
Рисунок 2. В-скан OD пациента 1 до операции: отслойка сетчатки и высокая отслойка сетчатки высотой до 11,1 мм
На левом глазу — циркулярная периферическая ОСО высотой до 4,8 мм, отслойка сетчатки с 3 до 7 часов высотой до 4,8 мм. При исследовании в режиме цветового допплеровского картирования (ЦДК) выявлено диффузное обеднение сосудистой сети в проекции хориоидеи. Кровоток по ЦАС равномерно и незначительно снижен. Достоверных данных за объемное образование хориоидеи не выявлено. ПЗО правого глаза 23,2 мм, левого глаза 23,0 мм.
На основании данных проведенных обследований установлен диагноз: Синдром увеальной эффузии, отслойка сосудистой оболочки, экссудативная отслойка сетчатки, осложненная катаракта обоих глаз.
Пациент 2. Мужчина, 62 года, обратился в Калужский филиал МНТК «Микрохирургия глаза» с жалобами на низкое зрение правого глаза и слепоту левого глаза. Из анамнеза: пациент был прооперирован в 2010 г. по поводу отслойки сетчатки левого глаза, выполнена витрэктомия с тампонадой витреальной полости силиконовым маслом. После операции зрение продолжало ухудшаться, неоднократно проходил консервативное лечение по поводу обострения вялотекущего увеита левого глаза. В последние два года левый глаз не беспокоит. Снижение зрения на правый глаз происходило постепенно.
При осмотре: острота зрения OD — 0,01 н/к; OS — ноль. ВГД OD — 18 мм рт.ст., OS — 18 мм рт.ст. ПЗО правого глаза 21,8 мм. Правый глаз спокоен, роговица прозрачная, передняя камера средней глубины, медикаментозный мидриаз до 4,5 мм, начальные помутнения в ядре хрусталика. Состояние глазного дна: диск зрительного нерва бледный, тотальная отслойка сетчатки в виде открытой воронки, отслойка сосудистой оболочки в виде пузырей во всех сегментах глазного дна, на средней периферии. Проведение флюоресцентной ангиографии было затруднено в связи с непрозрачностью оптических сред.
Левый глаз спокоен, субатрофичен, уменьшен в размере, роговица прозрачная, передняя камера средней глубины, зрачок 4,0 мм, выраженная дистрофия зрачкового края радужки, задние синехии, выраженные помутнения во всех слоях хрусталика, глазное дно не офтальмоскопировалось.
Электрическая чувствительность: OD: 300 мкА — грубые изменения; OS — отсутствует. Электрическая лабильность: OD: 22 Гц — значительное снижение; OS — отсутствует. При ультразвуковом исследовании на правом глазу выявлена воронкообразная отслойка сетчатки высотой до 14,0 мм, циркулярная ОСО до 2,6 мм. Обследование левого глаза было затруднено в связи с наличием в витреальной полости силиконового масла. При исследовании в режиме ЦДК выявлено диффузное обеднение сосудистой сети в проекции хориоидеи. Кровоток по ЦАС равномерно и незначительно снижен. Глазная артерия — типичный кровоток. Достоверных данных за объемное внутриглазное новообразование не выявлено.
УБМ: правый глаз — угол передней камеры открыт, циркулярная отслойка сосудистой оболочки. Отек и утолщение цилиарного тела — до 0,9-1,0 мм. В нижнем сегменте выявлена зона отека склеры до 1,0 мм, в аналогичной зоне верхнего сегмента толщина склеры 0,6-0,7 мм.
На основании проведенного обследования установлен диагноз: Синдром увеальной эффузии, отслойка сосудистой оболочки, экссудативная отслойка сетчатки, начальная осложненная катаракта правого глаза. Субатрофия, оперированная отслойка сетчатки, осложненная катаракта, силикон в витреальной полости левого глаза.
В послеоперационном периоде пациенты получали местно в инстилляциях мидриатики, антибактериальные капли, нестероидные противовоспалительные средства и кортикостероиды.
Результаты
Пациент 1. В первые дни после операции состояние глазного дна правого глаза оставалось без существенной динамики. Сохранялась высокая тотальная отслойка сетчатки, хориоидея прилежала, воздух в витреальной полости полностью резорбировался на третьи сутки наблюдения. Послеоперационное течение без особенностей, швы сняты с конъюнктивы через 10 дней. Острота зрения: OD — 0,01-0,03 н/к; OS — 0,1-1,5-cyl 0.75 на 81 град = 0.2. ВГД OD — 16 мм рт.ст.; ВГД OS — 18 мм рт.ст. В-scan: OD — сохраняется воронкообразная отслойка сетчатки, хориоидея прилежит; OS — циркулярная периферическая ОСО высотой до 3,0 мм, отслойка сетчатки сохраняется с 3 до 7 часов без динамики. Произведена ЗТС склеры левого глаза по аналогичной методике. При выписке острота зрения сохранялась на прежнем уровне: OD — 0,01 с + 5,0 д = 0,03; OS — 0,03-3,0-cyl 1,0 на 72 град = 0,1. Офтальмотонус сохранялся на нормальном уровне: ВГД OD — 18 мм рт.ст.; ВГД OS — 18 мм рт.ст. По данным ультразвукового исследования на обоих глазах сохранялась плоская отслойка сетчатки высотой до 1,3 мм в нижних отделах, сосудистая оболочка прилежала, сохранялся отек сосудистой оболочки.
Через два месяца пациент отметил постепенное улучшение остроты зрения на правом глазу — до 0,1 с коррекцией, на левом глазу — до 0,2 с коррекцией. ВГД OD — 18 мм рт.ст.; ВГД OS — 18 мм рт.ст. При осмотре в зоне склеротомий отмечалась рубцовая деформация конъюнктивы, через нее просматривались участки оголенной хориоидеи в виде очагов сизого цвета диаметром менее 1,0 мм. В обоих глазах отмечались выраженные помутнения в ядре хрусталика, осмотр глазного дна был затруднен. При офтальмоскопии отмечалось небольшое побледнение дисков зрительного нерва, прилежание сетчатки и сосудистой оболочки в зонах доступных осмотру, по всему глазному дну визуализировались пигментированные дистрофические хориоретинальные очаги в виде «пятен леопарда», в макуле рефлексы не офтальмоскопировались. По данным ультразвукового В-сканирования сетчатка прилежала во всех отделах, сохранялся отек сосудистой оболочки (рис. 3).
Рисунок 3. В-скан OD пациента 1 через 2 месяца после операции: сетчатка прилежит во всех отделах сохраняется отек сосудистой оболочки
В дальнейшем с интервалом 3 месяца на обоих глазах была произведена факоэмульсификация катаракты с имплантацией ИОЛ. Операция и послеоперационный период протекали без особенностей.
На момент последнего осмотра в пациент отмечал существенное улучшение зрения на оба глаза. При проверке острота зрения с коррекцией составила: OD — 0,2; OS — 0,3. Внутриглазное давление было нормальным, отмечалось улучшение электрической чувствительности и лабильности. По данным ультразвукового исследования сетчатка прилежала, сохранялся умеренный отек сосудистой оболочки. Офтальмоскопическая картина была без существенной динамики (рис. 4).
Рисунок 4. Фотография глазного дна OD пациента 1 через 3 месяца после операции: небольшое побледнение дисков зрительного нерва, прилежание сетчатки и сосудистой оболочки, пигментированные дистрофические хориоретинальные очаги в виде «пятен леопарда»
Пациент 2. Операция выполнена без осложнений, послеоперационный период протекали без особенностей (рис. 5).
Рисунок 5. Фотография глазного дна OD пациента 2 на первые сутки после операции: диск зрительного нерва бледный, отслойка сетчатки
При выписке острота зрения сохранялась на прежнем уровне: OD — 0,01 н/к; OS — ноль. ВГД OD — 16 мм рт.ст.; OS — 17 мм рт.ст. При данным ультразвукового исследования но правом глазу сохранялась тотальная отслойка сетчатки, сосудистая оболочка прилежала полностью. Через 1 месяц пациент отметил постепенное улучшение остроты зрения, частично восстановилась ориентация дома в привычной обстановке. Острота зрения: OD — до 0,04 н/к; OS — ноль. ВГД: OD — 16 мм рт.ст.; OS — 18 мм рт.ст. Помутнение в хрусталике правого глаза без динамики, осмотр глазного дна затруднен. При офтальмоскопии правого глаза отмечалось небольшое побледнение диска зрительного нерва, сетчатка отслоена в нижних отделах, макула частично отслоена. При осмотре в положении лежа субретинальная жидкость легко перемещалась, отслаивая макулу, сосудистая оболочка прилежала. В зонах, доступных осмотру, отмечались пигментированные дистрофические хориоретинальные очаги — «пятна леопарда». По данным ультразвукового В-сканирования сохранялась субтотальная отслойка сетчатки, а также отек сосудистой оболочки. При осмотре через два месяца после операции пациент отмечал дальнейшее улучшение остроты зрения. При офтальмоскопии и ультразвуковом В-сканировании наблюдалась слабо положительная динамика, высота и площадь отслойки сетчатки незначительно уменьшились.
На момент последнего осмотра, через 4 месяца после операции (рис. 6), острота зрения составила 0,1 с + 3,0 Д.
Рисунок 6. Фотография глазного дна OD пациента 2 через 4 месяца после операции
По данным ультразвукового В-сканирования правого глаза, отслойка сетчатки уменьшилась до 3,8 мм, сохранялся умеренный отек сосудистой оболочки. По данным ОСТ отмечалась отслойка нейроэпителия в макуле до 60 мкм. При проведении ультразвуковой биомикроскопии отмечена циркулярная цилиохориоидальная отслойка до 0,15 мм.
Заключение
На примере описанных клинических случаев подтверждена возможность практически полного излечения пациентов с синдромом увеальной эффузии. Проведение склерэктомии с использованием роговичного трепана является технически простой процедурой и позволяет сформировать пути оттока супрахориоидальной жидкости в субтеноново пространство. В то же время медленная резорбция субретинальной жидкости и неполное прилегание отслойки цилиарного тела у второго пациента, вероятнее всего, потребует проведения повторной склерэктомии.
В.А. ЯРОВАЯ 1 , А.А. ЯРОВОЙ 1 , А.Р. ЗАРЕЦКИЙ 2,3 , Л.В. ДЕМИДОВ 4 , В.В. НАЗАРОВА 4 , С.С. КЛЕЯНКИНА 1 , А.И. СЕНДЕРОВИЧ 4
1 МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова МЗ РФ, 127486, г. Москва, Бескудниковский бульвар, д. 59а
2 ООО «Евроген», 117997, г. Москва, ул. Миклухо-Маклая, д. 16/10
3 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, 117513, г. Москва, ул. Островитянова, д. 1
4 Росийский онкологический научный центр им. Н.Н. Блохина, 115230, г. Москва, Каширское шоссе, д. 23
Цель работы ― представить первый отечественный опыт проведения биопсии увеальной меланомы (УМ) с прогностической целью («прогностической» биопсии) при органосохраняющем лечении.
Материал и методы. Проведено 60 «прогностических» биопсий УМ при проведении органосохраняющего лечения: брахитерапии и стереотаксического облучения на установке «Гамма-нож» (методом получения опухолевой ткани была тонкоигольная аспирационная биопсия (n=49)), эндорезекции опухоли (n=9) и транссклерального удаления опухоли (n=2).
После проведения цитологического исследования выполняли анализ моносомии 3 хромосомы, уровень экспрессии белка BAP1, а также исследовали мутации в генах GNAQ, GNA11, EIF1AX, SF3B1 и TERT в ДНК. Кроме того, методом FISH определяли амплификацию гена MYC и делецию гена PPARG.
Результаты и обсуждение. Во всех случаях полученного материала было достаточно для проведения тестирования. Единственным осложнением при проведении ТИАБ было витреальное кровоизлияние, занимающее оптическую ось, у 1 пациента.
Заключение. Биопсия УМ при проведении органосохраняющего лечения позволяет получить информативный материал опухоли для последующего цитологического и развернутого молекулярно-генетического анализа с прогностической целью.
Ключевые слова: увеальная меланома, молекулярно-генетическое тестирование, цитогенетическое тестирование.
V.A. YAROVAYA 1 , A.A. YAROVOY 1 , A.R. ZARETSKY 2,3 , L.V. DEMIDOV 4 , V.V. NAZAROVA 4 , S.S. KLEYANKINA 1 , A.V. SENDEROVICH 4
1 S. Fyodorov Eye Microsurgery Federal State Institution, 59a Beskudnikovsky Blvd., Moscow, Russian Federation, 127486
2 Evrogen Laboratory LLC, 16/10 Miklukho-Maklaya Str., Moscow, Russian Federation, 117997
3 Pirogov Russian National Research Medical University, 1 Ostrovityanov Str., Moscow, Russian Federation, 117513
4 N.N. Blokhin National Medical Oncology Center, 23 Kashirskoye shosse, Moscow, Russian Federation, 115230
Molecular genetic testing of uveal melanoma in eye saving treatment
Objective ― to evaluate the clinical and laboratory results of the first Russian prognostic biopsy of uveal melanoma (UM) in eye-saving treatment (EST).
Material and methods. EST was performed in 60 patients aged from 10 to 84 years (mean ― 52 years) with UM and included Ru-106 brachytherapy (47), gamma-knife radiosurgery (2), transscleral resection (2) and endoresection (9). After cytological research analysis of chromosome 3 was performed. Molecular testing was done in 45 cases and included detection of activating GNAQ and GNA11 hotspot mutations, EIF1AX and SF3B1 genes mutations in exons 1, 2, 6 and exons 14, 15 respectively, gene MYC and PPARG mutations and BAP1 inactivation.
Results and discussion. In all cases the obtained material was sufficient for the research. The only complication of FNAB was vitreous hemorrhage obscuring macula in one patient.
Conclusion. Our modified FNAB technique provided excellent tissue samples of UM for prognostic purposes suitable for all kinds of laboratory testing including cytology, cytogenetic, molecular analysis with wide spectrum of genetic features.
Key words: uveal melanoma, molecular genetic testing, cytogenetic testing.
Введение
Увеальная меланома (УМ) ― меланоцитарная внутриглазная опухоль, у 50% пациентов дающая отдаленные метастазы в течение 10 лет независимо от выбранного метода лечения [1]. Риск развития метастазов при УМ индивидуален и зависит от ряда факторов, таких как: локализация опухоли, размеры очага, наличие экстрабульбарного распространения [2], а также морфологические признаки ― клеточный тип и степень дифференцировки [1]. В последнее десятилетие особое значение придается молекулярно-генетическому анализу УМ, проведение которого основано на исследовании как хромосомных аномалий, так и мутации в генах [3].
Диагностика молекулярно-генетических изменений и оценка их корреляции с вероятностью развития метастазов при УМ успешно проводится на энуклеированных глазах 6. В настоящее время лечение УМ, в том числе и больших размеров [7], имеет органосохраняющую направленность. Проведение молекулярно-генетических тестов с прогностической целью требует получения материала опухоли в достаточном количестве, что является определенной проблемой при сохранении глаза с УМ. Получение ткани опухоли возможно при хирургическом удалении УМ, а также, в основном, методом тонкоигольной аспирационной биопсии (ТИАБ) с последующей лучевой терапией [8]. В последние годы ТИАБ УМ используется в ряде клиник, приводятся доказательства безопасности и информативности ТИАБ [9, 10]. Сведений о проведении молекулярно-генетических исследований УМ при органосохраняющем лечении в отечественной практике нет.
Цель ― представить первый отечественный опыт проведения молекулярно-генетических исследований УМ при органосохраняющем лечении.
Материал и методы
«Прогностическая» биопсия УМ была проведена у 60 пациента: у 47 выполнялась ТИАБ перед брахитерапией (БТ), у 2 ― перед стереотаксическим облучением на установке «Гамма-нож», у 9 материал получали при эдорезекции (ЭР) опухоли, у 2 ― при транссклеральном удалении опухоли.
Средний возраст пациентов при проведении органосохраняющего лечения составил 52 года (от 10 до 84 лет). При этом мужчин было 25 (41%), женщин ― 35 (59%). Высота опухоли варьировалась от 2,6 до 10,3 мм (средняя ― 6,7 мм), протяженность составила 12,5 мм (от 7,6 до 18 мм). Трансвитреальную биопсию через parsplana с использованием длинных игл 25G (n=23) и 27G (n=21) проводили при опухолях, имеющих постэкваториальную локализацию (n=44). При преэкваториальном расположении опухолей (n=5) выполняли забор опухолевой ткани транссклерально с использованием короткой иглы 30G. Техника выполнения ТИАБ различными доступами была описана нами ранее [8].
При ЭРУМ материал удаленной опухоли забирался и обрабатывался отдельно по описанной нами ранее технике [11]. Опухоли, удаленные транссклерально, проходили гистологическую обработку.
Забранный материал помещали в специализированный консервант для его сохранения и транспортировки в лабораторию.
После проведения цитологического исследования проводили FISH-реакцию на мазке отпечатке для определения моносомии 3 хромосомы. Использовали флуоресцентную пробу Uro Vysion Bladder Cancer Kit (Abbot Molecular, USA). Оценку результатов проводили на флуоресцентном микроскопе Axioscop2 Plus. Кроме того, методом FISH определяли амплификацию региона 8q24.21 (MYC) и делецию региона 3p25.2 (PPARG).
Поиск мутаций в генах GNAQ (экзон 5), GNA11 (экзон 5), EIF1AX (экзоны 1, 2 и 6), SF3B1 (экзоны 14 и 15) и TERT (промоторная область) в ДНК, выделенной из цитологического или гистологического материала, проводили методом ПЦР с последующим секвенированием продуктов ПЦР. Кроме того, уровень экспрессии белка BAP1 оценивали иммуноцитохимическим или иммуногистохимическим методом с использованием моноклонального антитела C-4 (Santa Cruz Biotechnology, США).
Результат и обсуждение
При проведении ТИАБ во всех случаях объем материала был достаточен для выполнения цитологического анализа как при пункции опухоли иглами размером как 25G, так и иглами меньшего диаметра ― 27G и 30G.
После забора материала УМ 60 пациентам было проведено как цитологическое, так и молекулярно-генетическое исследование. Еще в 9 случаях было выполнено лишь цитологическое исследование, т.к. на начальном этапе отработки технология сохранения материала условия его хранения были нарушены, и был получен поврежденный материал УМ, что не позволило выполнить молекулярно-генетический анализ.
У 15 пациентов на основании цитологического материала методом FISH определяли потерю одной копии 3 хромосомы, что является неблагоприятным прогностическим признаком [12]. У 3 пациентов (20%) обнаружили клетки УМ с нормальным набором хромосом. Моносомия 3 хромосомы была представлена у 7 пациентов (47%). Кроме того, у 5 (33%) пациентов при проведении флуоресцентной гибридизации было выявлено увеличении 3 хромосомы до 3-4 копий на ядро, что требует дальнейшего анализа.
Мутации генов, которые, по данным литературы, имеют особое значение в развитии и поведении УМ, определяли у 45 пациентов. Мутация белка G генов GNAQ и GNA11 является триггерным для развития УМ в 85%, но не влияет на риск диссеминации опухоли [13]. Мутация гена GNAQ была выявлена у 20 (44%) человек (в том числе «экзотические» мутации ― у 2 человек), а GNA11 ― у 15 (33%). Мутация гена EIF1AX, наличие которой резко снижает риск развития метастатического процесса [13], имела место у 9 (20%) пациентов. Мутация гена SF3B1, выявленная в 10 (22%) случаях, может свидетельствовать о способности УМ метастазировать в печень и легкие в равных соотношениях в сроки свыше 10 лет [13]. Отсутствие экспрессии белка ВАР1 было обнаружено у 5 (11%) пациентов. Инактивация белка BAP1 говорит о высоком риске раннего развития метастатического процесса [13]. Ни в одном случае не была отмечена мутация гена TERT. Таким образом, показана пригодность материала ТИАБ для метода FISH, ПЦР-анализа и для иммуноцитохимического исследования.
Robertson [14] было предложено разделение УМ на 4 прогностических класса с учетом результатов молекулярно-генетического тестирования: хороший, средний, плохой и очень плохой. 1 класс («хороший» прогноз), при котором риск возникновения метастазов крайне низок, предполагает наличие в опухоли мутации гена EIF1AX при условии отсутствия моносомии 3 хромосомы, инактивации белка ВАР1, амплификации 8q и мутации SF3B1. 2 класс («средний» прогноз), при котором метастазирования УМ следует ожидать в 30%, имеет место при наличии амплификация 8q и/или мутации SF3B1 и при отсутствии моносомии 3 и инактивации BAP1. Опухоли 3 класса («плохой» прогноз) должны иметь моносомию 3 и/или инактивацию белка BAP1, при этом увеличения количества копий длинного плеча 8 хромосомы и мутации гена SF3B1 быть не должно. 3 класс характеризует УМ как опухоль, способную к метастазированию в 80%. «Очень плохой» прогноз (4 класс) устанавливается при выявлении моносомии 3 и/или инактивации белка BAP1, а так же при увеличении количества копий длинного плеча 8 хромосомы и/или мутации гена SF3B1. На основании полученных нами результатов молекулярно-генетического тестирования планируется их оценка и соотнесение с предложенной классификацией.
С учетом результатов молекулярно-генетического тестирования проводится уточнение имеющейся схемы наблюдения [15] и разработка дифференцированных подходов к ведению пациентов с УМ после проведенного лечения.
Среди осложнений при выполнении ТИАБ нами было отмечено занимающее оптическую ось витреальное кровоизлияние (n=1,2%), которое потребовало выполнения витрэктомии для улучшения зрительных функций пациента. По предварительным наблюдениям, вероятность возникновения кровоизлияния увеличивается при опухолях большего размера. Shields C.L. [10] отмечают наличие геморрагий в 46% случаев, что, однако, включает все виды кровоизлияний при проведении ТИАБ, в том числе и транзиторные. Претуморальные витреальные кровоизлияния, самостоятельно рассасывающиеся в течение 14 дней, были расценены нами как «ожидаемые» последствия ТИАБ и не были включены в группу осложнений. Описанные рядом авторов более редкие осложнения ТИАБ, такие как отслойка сетчатки, эндофтальмит, диссеминация опухоли в стекловидное тело и прогрессия опухоли [16] нами отмечены не были.
Mashayekhi [17] был описан случай распространения опухоли по каналу ТИАБ спустя 18 месяцев после проведения манипуляции, что в свою очередь, составило 0,2% от общего числа выполненных биопсий. Нами видимых признаков имплантации опухоли в склеральный канал и/или признаков экстрабульбарного роста отмечено не было, однако стоит учитывать малые сроки наблюдения пациентов (от 3 до 19 мес.).
Примеры кровоизлияния, симулирующей меланому хориоидеи
Артериальная макроаневризма сетчатки — хорошо известная сосудистая аномалия, встречающаяся чаще всего у пациентов с системной гипертензией. Она является солитарным образованием, не сопровождающимся какими-либо осложнениями, или осложняется экссудацией или кровоизлиянием. При кровоизлиянии формируется темное образование, которое можно ошибочно принять за меланому хориоидеи.
Субретинальное и преретинальное кровоизлияние у пациентки 60 лет, источником которого стала интраретинальная артериальная макроаневризма. Пациентка была направлена на консультацию с диагнозом грибовидная меланома. Образование, показанное на рисунке выше: три месяца спустя наблюдается резорбция кровоизлияния. Макроаневризма также регрессировала. Кровоизлияние из макроаневризмы нижневисочной ветви артерии сетчатки, в результате которого сформировалась образование темного цвета. Светлый очаг на фоне излившейся крови - собственно макроаневризма, которую следует дифференцировать от меланомы, проросшей через разрыв мембраны Бруха. Атипичная ретинальная макроаневризма - источник кровоизлияния, распространившегося вверх в область центральной ямки. Очевидно, происходит резорбция кровоизлияния: серозно-геморрагическая жидкость скапливается вверху, тогда как более плотная кровь оседает вниз. Обратите внимание на хорошо заметную макроаневризму и желтый экссудат с нижневисочной стороны. Артериальная макроаневризма сетчатки в зоне папилломакулярного пучка, ставшая источником кровоизлияния в субретинальное пространство, сенсорную сетчатку и стекловидное тело. Гомогенное ретинальное кровоизлияние вдоль нижневисочной сосудистой аркады. Вероятно, источником кровоизлияния стала макроаневризма, скрытая излившейся кровью.
РАЗЛИЧНЫЕ СУБРЕТИНАЛЬНЫЕ И ИНТРАРЕТИНАЛЬНЫЕ КРОВОИЗЛИЯНИЯ, СИМУЛИРУЮЩИЕ МЕЛАНОМУ ХОРИОИДЕИ
В некоторых случаях субретинальные или интраретинальные кровоизлияния развиваются спонтанно, без какой-либо видимой причины и ошибочно принимаются за пигментированную меланому хориоидеи. Возможные этиологические факторы включают в себя незамеченную травму, скрытую хориоидальную неоваскуляризацию, физическое напряжение, кашель, системную гипертензию и прием антикоагулянтов, например, аспирина или дикумарола, и пробу Вальсальвы. Со временем такие кровоизлияния обычно резорбируются, и на их месте формируется типичная фиброзная рубцовая ткань.
Преретинальное и субретинальное кровоизлияние в макулярной зоне. Флюоресцентная ангиограмма, фаза рециркуляции: наблюдается гипофлюоресценция образования, показанного на рисунке выше. Плотное ретинальное кровоизлияние в макулярной зоне. Кровоизлияние и экссудация неясной этиологии в макулярной зоне. Ни хориоидальная неоваскуляризация, ни макроаневризма не выявлены. Резорбирующееся кровоизлияние с носовой стороны от диска зрительного нерва. Хотя этиология кровоизлияния осталась невыясненной, оно могло быть связано с глубоко лежащей друзой диска зрительного нерва. Объемное идиопатическое кровоизлияние в сетчатку с верхневисочной стороны от макулярной зоны правого глаза.
Список использованной литературы:
1. Shields JA, Mashayekhi A, Ra S, et al. Pseudomelanomas of the posterior uveal tract. The 2006 Taylor Smith Lecture. Retina 2005;25:767-771.
2. Shields CL, Manalac J, Das С, et al. Choroidal melanoma. Clinical features, classification, and top ten pseudomelanomas. Curr Opin 2014;25:177-185.
Примеры двусторонней диффузной увеальной меланоцитарной пролиферации, симулирующей меланому хориоидеи
Двусторонняя диффузная увеальная меланоцитарная пролиферация - любопытный паранеопластический синдром, развивающийся у пациентов с системными злокачественными заболеваниями, особенно часто у больных раком яичников, мелкоклеточной карциномой легких и некоторыми другими новообразованиями. Средний возраст на момент постановки диагноза составляет 63 года. В отличие от меланомы хориоидеи поражение обычно двустороннее и выглядит как диффузное неправильной формы утолщение сосудистой оболочки с множественными пигментированными образованиями различного размера по всей поверхности хориоидеи, а иногда и цилиарного тела и радужки. Клинически, при флюоресцентной ангиографии и при исследовании аутофлюоресценции наблюдается деструкция пигментного эпителия сетчатки и характерная пятнистость; иногда эту картину называют глазным дном по типу «шкуры жирафа». На пораженном глазу обычно наблюдаются симптомы вялотекущего воспаления, отмечается быстрое развитие и прогресс катаракты. Патогенез этого состояния неизвестен, лечение кортикостероидами и лучевая терапия оказались неэффективны. Недавно было продемонстрирован положительный эффект плазмафереза при лечении этих больных. Ниже проиллюстрирован случай двусторонней диффузной увеальной меланоцитарной пролиферации у женщины 66 лет, страдающей раком яичников.
На схеме глазного дна правого глаза изображены многочисленные пигментные узлы и отслойка сетчатки в нижних квадрантах. Схема глазного дна левого глаза, изображены многочисленные пигментные узлы, отслойка сетчатки отсутствует. Макулярная зона правого глаза: наблюдается отслойка сетчатки и минимальные изменения пигментного эпителия сетчатки. Фото глазного дна левого глаза, область выше диска зрительного нерва: отмечается типичная диффузная пигментация сосудистой оболочки. Катаракта и пигментная опухоль радужки правого глаза той же пациентки. Поздняя фаза флюоресцентной ангиографии правого глаза: наблюдается типичная пятнистая гиперфлюоресценция - проявление двусторонней диффузной увеальной меланоцитарной пролиферации.
Кроме пигментных изменений глаз, у таких больных может развиваться пигментация кожи и слизистых оболочек экстраокулярных областей.
Двусторонняя диффузная увеальная меланоцитарная пролиферация с обильными отложениями липофусцина (оранжевого пигмента) в макулярной зоне правого глаза. Аналогичные изменения левого глаза. Исследование аутофлюоресценции глазного дна при двусторонней диффузной увеальной меланоцитарной пролиферации. На правом глазу наблюдается гипераутофлюоресценция липофусцинового пигмента. Аналогичная картина наблюдается и на левом глазу. Приобретенная пигментация губы у пациента с двусторонней диффузной увеальной меланоцитарной пролиферацией. Приобретенная пигментация полового члена у того же пациента, что и на рисунке выше.
Список использованной литературы:
1. Rahimy Е, Coffee RE, McCannel ТА. Bilateral diffuse uveal melanocytic proliferation as a precursor to multiple systemic malignancies. Semin Ophthalmol 2013.
Читайте также:
- Лучевая диагностика ресничной кишечной кисты печени
- Лучевая диагностика портальной гипертензии и варикозного расширения вен
- Поражения и болезни зрительного нерва. Центральная скотома
- Дифференциальная диагностика глубокой депрессии. Трициклические антидепрессанты
- Влияние расовых и этнических различий на лекарственную терапию. Фармакогенетика
