Принципы лечения бактериальной инфекции
Добавил пользователь Валентин П. Обновлено: 30.01.2026
С.В. ЯКОВЛЕВ, кандидат медицинских наук, старший научный сотрудник кафедры внутренних болезней № 4 лечебного факультета. ЭТИОЛОГИЯ, КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ И ПОДХОДЫ К АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
Инфекции являются наиболее частым осложнением у пациентов, находящихся в отделениях интенсивной терапии (ОИТ) и ведущей причиной летальности у этих больных. Частота развития инфекционных осложнений существенно возрастает при увеличении сроков пребывания больного в ОИТ. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов, результаты лечения инфекций остаются неудовлетворительными.
Сложности лечения бактериальных инфекций в ОИТ определяются многими факторами, среди которых следует отметить тяжесть состояния больных, как правило полимикробный характер инфекции, частое выделение так называемых проблемных микроорганизмов, высокий уровень резистентности микробов к традиционным антибиотикам, быстрое развитие устойчивости микробов в процессе лечения, частые рецидивы инфекции во время и после окончания антибактериальной терапии. Кроме того, необоснованное, бессистемное применение антибактериальных препаратов ведет к быстрой селекции и распространению по больнице устойчивых штаммов микроорганизмов.
В связи с тяжестью состояния больных и опасностью для них инфекционных осложнений антибактериальную терапию следует начинать неотложно при первых признаках инфекции, не дожидаясь результатов бактериологического исследования, так как промедление с назначением антибиотика у этих больных может иметь фатальные последствия. В таких случаях обычно назначают комбинацию двух или более антибактериальных средств, чтобы охватить максимально возможный спектр потенциальных возбудителей.
Среди факторов, способствующих развитию инфекции у больных в ОИТ, следует выделить:
основное заболевание
тяжесть состояния больного (АРАСНЕ II > 20)
возраст старше 60 лет
диагностические и лечебные инвазивные процедуры (интубация, ИВЛ, катетеризация мочевого пузыря, катетеризация центральных и периферических вен)
использование антацидов и Н2-блокаторов
длительность нахождения в ОИТ
бессистемное или широкое профилактическое использование антибиотиков.
Источником инфекции является либо сам пациент (эндогенная инфекция в результате орофарингеальной колонизации или аспирации), либо экзогенный источник (дыхательная аппаратура, катетеры, медицинский персонал, другие больные).
Распределение инфекций в ОИТ отличается от других отделений. В отделениях общего профиля превалируют инфекции мочевыводящих путей и раневая инфекция, в то время как в ОИТ наиболее частой является инфекция нижних дыхательных путей (45%), и прежде всего пневмония (около 30%). Сходные данные о преобладании в ОИТ инфекций нижних дыхательных путей получены 29 апреля 1992 года в ходе многоцентрового исследования, проведенного в 1417 отделениях интенсивной терапии в 17 странах Европы - EPIC Study (Evropean Prevalence of Infection in Intensive Care). Примерно с одинаковой частотой (10-15%) в ОИТ встречаются инфекции других локализаций (мочевыводящих путей, интраабдоминальная, кожи и мягких тканей).
Наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам.
Наиболее частыми возбудителями инфекций в реанимации, по данным EPIC Study, являются различные стафилококки (Staphylococcus aureus - 30%, Staphylococcus spp. - 19%) и P. aeruginosa (29%). Частыми патогенами являются также другие грамотрицательные бактерии, прежде всего Escherichia coli (13%), Acinetobacter spp. (9%), Klebsiella spp. (8%), Enterobacter spp. (7%), Proteus spp. (6%). Среди грамположительных микроорганизмов большое значение имеют также Enterococcus spp. (12%) и Streptococcus spp. (7%). Возбудители различных инфекций в отделениях общего профиля и в отделениях реанимации во многих случаях существенно различаются. В ОИТ преобладают так называемые проблемные микроорганизмы, к которым относятся прежде всего S. aureus и коагулазонегативные стафилококки, энтерококки, некоторые грамотрицательные энтеробактерии (Enterobacter cloaceae, Serratia spp., Proteus vulgaris, Klebsiella spp.), неферментирующие грамотрицательные палочки (P. aeruginosa и Pseuctomonas spp., Acinetobacter spp., Stenotrophomonas, maltophilia), а также некоторые анаэробы (Bacteroides fragilis). Эти микроорганизмы, как правило, характеризуются устойчивостью ко многим антибактериальным средствам.
Большинство штаммов S. aureus (85-95%) продуцирует пенициллиназу и устойчиво к бензилпенициллину и пенициллинам широкого спектра, но чувствительно к оксациллину и цефалоспоринам. Частота метициллинрезистентных штаммов S. aureus варьирует в различных регионах и в ОИТ в среднем составляет от 10 до 30%. Эти штаммы стафилококка характеризуются устойчивостью к оксациллину и другим бета-лактамным антибиотикам, а также в большинстве случаев к антибактериальным средствам других классов (макролидам, аминогликозидам, фторхинолонам). Гликопептидные антибиотики (ванкомицин, тейкопланин) являются единственными средствами, сохраняющими высокую активность в отношении этих микроорганизмов.
Коагулазонегативные стафилококки (S. epiderminis, S. haemolyticus, S. hominis) в последние годы стали значительно чаще выделяться у больных в ОИТ в связи с широким использованием внутрисосудистых катетеров. Для этих стафилококков характерна продукция пенициллиназ и более частое, чем у S. aureus, развитие резистентности к метициллину.
P. aeruginosa, второй по частоте микроорганизм, вызывающий инфекции в ОИТ, характеризуется множественной резистентностью. Многие штаммы продуцируют хромосомальные цефалоспориназы, гидролизующие цефалоспорины 3-го поколения, в том числе цефтазидим. Кроме того, Р. aeruginosa может продуцировать бета-лактамазы класса ТЕМ-1, разрушающие антисинегнойные пенициллины, и плазмидные бета-лактамазы, определяющие устойчивость микроорганизма к большинству пенициллинов и цефалоспоринов.
Acinetobacter spp., как правило, проявляет устойчивость к большинству бета-лактамов, аминогликозидам и фторхинолонам. Xanthomonas maltophilia продуцирует металлоэнзимы, разрушающие все бета-лактамы, в том числе карбапенемы. Таким образом, наиболее частые возбудители инфекций в ОИТ характеризуются множественной устойчивостью к традиционным антибактериальным средствам, что определяет сложности лечения этих больных.
Принципы антибактериальной терапии
Учитывая указанные сложности лечения инфекций у больных в ОИТ (тяжесть состояния пациентов, полимикробный характер инфекции, частое выделение возбудителей с множественной устойчивостью к антибактериальным средствам), для проведения адекватной и эффективной антибактериальной терапии необходимо соблюдать следующие положения:
лечение следует начинать неотложно при первых признаках инфекции или наличии лихорадки выше 38°С;
лечение должно быть обязательно программируемым и стандартизованным;
лечение, как правило, эмпирическое, по крайней мере на начальном этапе;
первичная оценка эффективности антибактериальной терапии проводится в течение 48 часов после начала лечения по уменьшению выраженности лихорадки и интоксикации;
лечение должно проводиться под строгим бактериологическим контролем (мокрота, кровь, моча);
на первом этапе предпочтительна монотерапия.
Преимущества монотерапии перед комбинированным использованием антибактериальных средств:
уменьшение риска неадекватного взаимодействия антибактериальных средств;
уменьшение риска нежелательных взаимодействий с другими лекарственными средствами;
уменьшение риска развития токсических явлений;
уменьшение времени введения лекарств;
облегчение работы медперсонала;
уменьшение использования антибиотиков и их попадания в окружающую среду;
уменьшение стоимости лечения.
Как правило, лечение больных, находящихся в ОИТ, имеет эмпирический характер, т.к. должно начинаться неотложно при первых признаках инфекции. До настоящего времени общепринятым подходом к лечению этих больных было назначение бета-лактамного антибиотика (уреидопенициллин или цефалоспорин 2-3-го поколения) в комбинации с аминогликозидом. В последние годы в клиническую практику внедрены новые антибактериальные средства с широким спектром антимикробной активности, позволяющие проводить монотерапию и избегать использования высокотоксичных аминогликозидных антибиотиков. К таким препаратам относятся некоторые цефалоспорины 3-го поколения (цефтазидим) и 4-го поколения (цефепим, цефпиром), фторхинолоны (ципрофлоксацин), защищенные пенициллины широкого спектра с антисинегнойной активностью (пиперациллин/тазобактам, тикарциллин/ клавулановая кислота) и карбапенемовые антибиотики - меропенем и имипенем.
Антибактериальный препарат, назначаемый в режиме монотерапии, должен удовлетворять определенным требованиям:
широкий спектр бактерицидного действия, включающий Staphilococcus spp., P.aeruginosa, Enterobacteriaceae;
стабильность к бета-лактамазам;
невысокий уровень резистентности бактерий, выделяемых у больных в ОИТ;
благоприятная фармакокинетика, хорошее проникновение в ткани;
удобство дозирования и применения;
хорошая переносимость в больших дозах;
хорошее соотношение стоимость-эффективность;
доказанная эффективность в контролируемых клинических исследованиях.
Программа эмпирической антибактериальной терапии инфекций в ОИТ
В кратком обзоре нет возможности подробно рассмотреть все инфекции, встречающиеся в ОИТ. Поэтому представляется целесообразным привести рекомендации по антибактериальной терапии наиболее частых и тяжелых инфекций - пневмонии и интраабдоминальных инфекций.
1. Внебольничная пневмония. Наиболее частыми возбудителями внебольничной пневмонии тяжелого течения у больных, госпитализированных в ОИТ, являются S. pneumoniae, Legionella pneumoniae, Enterobacteriaceae, реже наблюдаются S. aureus и Mycoplasma pneumoniae. Эта пневмония характеризуется быстропрогрессирующим течением и высокой летальностью: по данным British Thoracic Society, летальность может достигать 50-75%. К сожалению, на основании анамнестических данных и клинической картины не представляется возможным установить этиологию пневмонии. В то же время для уточнение возбудителя заболевания или требуется несколько дней, или необходимы специальные и дорогостоящие серологические исследования. В связи с этим выбор схем антибактериальной терапии внебольничной пневмонии тяжелого течения основан на эмпирическом подходе с учетом наиболее вероятных возбудителей.
В настоящее время стандартной схемой начальной эмпирической терапии внебольничной пневмонии в ОИТ является комбинированное применение парентерального цефалоспорина 3-го поколения (высокоактивного в отношении пневмококка и грамотрицательных энтеробактерий) и парентерального макролидного антибиотика (активного в отношении легионеллы и микоплазмы). Среди цефалоспоринов 3-го поколения предпочтительны цефтриаксон (1 г с интервалом 24 ч) или цефотаксим (1-2 г с интервалом 8 ч); к парентеральным макролидам относятся эритромицин (1 г с интервалом 6 ч), спирамицин (1,5 млн ME с интервалом 8 ч) и кларитромицин (0,5 г с интервалом 12 ч). В качестве альтернативы цефалоспоринам 3-го поколения могут быть использованы фторхинолоны (ципрофлоксацин 0,2 г с интервалом 12 ч или офлоксацин 0,2 г с интервалом 12 ч) или цефалоспорины 4-го поколения (цефепим 1 г с интервалом 12 ч или цефпиром 1 г с интервалом 12 ч). При установленной легионеллезной этиологии пневмонии к лечению добавляют рифампицин в/в 0,5 г с интервалом 12 ч.
2. Госпитальная пневмония. Является наиболее частым инфекционным осложнением в ОИТ, особенно у больных, находящихся на ИВЛ. Риск развития вентилятор-ассоциированной пневмонии (ВАЛ) значительно увеличивается при продолжительности ИВЛ более 48 ч. Наиболее важньми факторами для прогнозирования этиологии ВАП являются предшествующая антибактериальная терапия и продолжительность механической вентиляции. У больных с ранней ВАП (к ней относятся случаи пневмонии, развившейся при искусственной вентиляции менее 7 дней), не получавших предшествующей антибактериальной терапии, ведущими этиологическими агентами являются микроорганизмы, обычно колонизирующие верхние дыхательные пути и верхние отделы ЖКТ, такие, как S. pneumoniae, Н. influenzae, S. aureus, Enterobacteriaceae. Для этих микроорганизмов характерен естественный уровень антибиотикочувствительности. В этиологии поздних ВАП (развитие пневмонии при продолжительности ИВЛ свыше 7 суток) ведущую роль играют P. aeruginosa, Acinetobacter spp., S. aureus (в том числе метициллинрезистентные штаммы), Enterobacteriaceae (см. табл. 1). Практически все возбудители поздних ВАП характеризуются множественной резистентностью к антибактериальным препаратам, поскольку такие пневмонии, как правило, развиваются на фоне длительной антибактериальной терапии или профилактики.
Таблица 1
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ГОСПИТАЛЬНОЙ ПНЕВМОНИИ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Раннее начало | ||
| Enterobacteriaceae S.pneumoniae Н.influenzae S.aureus | Цефалоспорин III 1) Фторхинолон | Цефалоспорин II 2) + аминогликозид Ко-амоксиклав + аминогликозид Оксациллин + аминогликозид АСПен 3) + аминогликозид |
| 2. Позднее начало | ||
| S.pneumoniae S.aureus Enterobacteriaceae | Цефтазидим Цефалоспорин IV 4) Ципрофлоксацин Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III + аминогликозид АСПен 3) + аминогликозид Фторхинолон + аминогликозид Ванкомицин + амикацин |
2)цефуроксим, цефамандол
3)тикарциллин, пиперациллин, азлоциллин
4)цефепим, цефпиром
Начальная антибактериальная терапия ВАП основана на эмпирическом подходе, однако до назначения антибактериального препарата обязательным является забор мокроты (желательно получение материала инвазивными методами с количественной оценкой результатов) и крови для микробиологического исследования.
В качестве начальной терапии ранней ВАП может быть использована монотерапия цефалоспоринами 3-го поколения (цефтриаксон 2 г с интервалом 24 ч или цефотаксим 2 г с интервалом 6-8 ч) или фторхинолонами (ципрофлоксацин 0,2-0,4 г с интервалом 12 ч или офлоксацин 0,2-0,4 г с интервалом 12 ч). В качестве альтернативных режимов терапии применяют комбинацию аминогликозидного антибиотика с цефалоспоринами 2-го поколения, ко-амоксиклавом или антисинегнойными пенициллинами. При назначении аминогликозидов следует учитывать высокую частоту устойчивых штаммов бактерий к гентамицину; предпочтительнее использовать амикацин 7,5 мг/кг с интервалом 12 ч или нетилмицин в суточной дозе 4-6 мг/кг (в 2-3 введения).
3. Интраабдоминальные инфекции. Являются одной из наиболее частых причин сепсиса в ОИТ и характеризуются неудовлетворительным прогнозом: частота летального исхода при абдоминальном сепсисе составляет 30-60%. Фактором, определяющим тяжесть течения абдоминального сепсиса, является количественная оценка по АРАСНЕ II: при количестве баллов до начала антибактериальной терапии 20 летальность составила
Возбудителями первичного перитонита, как правило, являются грамотрицательные энтеробактерии. Наиболее часто в ОИТ наблюдается вторичный перитонит, имеющий смешанную аэробно-анаэробную этиологию (см. табл. 2).
Таблица 2
ЭМПИРИЧЕСКАЯ ТЕРАПИЯ ИНТРААБДОМИНАЛЬНЫХ ИНФЕКЦИЙ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ
| Микроорганизмы | Режим монотерапии | Режим комбинированной терапии |
| 1. Перитонит первичный | ||
| Е. coli Klebsiella spp. Proteus spp. Enterobacter spp. S. pneumoniae Enterococcus spp. | Цефалоспорин III 1) Цефалоспорин IV 2) Фторхинолон Пиперациллин/тазобактам Тикарциллин/клавуланат | АСПен 3) + аминогликозид АМП/СБ + аминогликозид Цефалоспорин II 4) + аминогликозид Цефокситин + аминогликозид |
| 2. Перитонит вторичный | ||
| Как правило, полимикробной этиологии: Enterobacteriaceae P. aeruginosa Enterococcus spp. Анаэробы | Пиперациллин/тазобактам Тикарциллин/клавуланат Имипенем Меропенем | Цефалоспорин III 1) + клиндамицин Цефалоспорин IV 2) + клиндамицин Фторхинолон + метронидазол Аминогликозид + клиндамицин АСПен 3) + аминогликозид АМП/СБ + аминогликозид |
2)Цефепим, цефпиром
3)Тикарциллин, пиперациплин, азлоциллин
4)Цефуроксим, цефамандол
5)АМП/СБ - ампициллин/сульбактам
В качестве стандартной схемы начальной эмпирической терапии перитонита обычно используют комбинацию аминогликозидного антибиотика (гентамицин, тобрамицин, нетилмицин или амикацин) и препарата с антианаэробной активностью (метронидазол или клиндамицин). В качестве альтернативы могут применяться цефалоспорины 3-го поколения (цефотаксим, цефтриаксон, цефтазидим или цефоперазон) или фторхинолоны (ципрофлоксацин, офлоксацин, пефлоксацин) в сочетании с антианаэробными средствами.
В последние годы в клинической практике появились антибактериальные средства, обладающие широким спектром в отношении аэробных грамположительных и грамотрицательных бактерий в сочетании с высокой антианаэробной активностью. К ним относятся защищенные антисинегнойные пенициллины (пиперациллин/тазобактам и тикарциллин/клавуланат) и карбапенемы (имипенем, меропенем). Наличие у этих препаратов аэробной и анаэробной активности позволяет применять их в режиме монотерапии при лечении тяжелых интраабдоминальных инфекций в ОИТ, в том числе при абдоминальном сепсисе. В многочисленных контролируемых исследованиях показано, что монотерапия указанными препаратами не уступает по эффективности стандартным схемам комбинированной терапии.
Полученные в зарубежных и отечественных исследованиях данные свидетельствуют о возможности проведения монотерапии тяжелых интраабдоминальных инфекций в ОИТ.
Приведенные рекомендации по антибактериальной терапии наиболее тяжелых инфекций позволяют оптимизировать лечение и улучшить прогноз больных в ОИТ. В то же время следует подчеркнуть, что представленные схемы терапии являются наиболее общими рекомендациями. Программа эмпирической антибактериальной терапии инфекций в ОИТ в конкретном медицинском учреждении должна разрабатываться и корректироваться на основании локальных данных о возбудителях и их чувствительности к антибиотикам.
Бактериальная и вирусная инфекции: в чем отличие?

Если обратиться к статистике, то инфекции – самая частая причина обращения за медицинской помощью. Спровоцировать их могут различные патогены: вирусы, бактерии, грибки и др. Вирусы и бактерии могут стать причиной клинически схожих инфекций, но ситуации требуют разного лечения. Чем бактериальная и вирусная инфекция отличаются?
Основы микробиологии
Бактерии – одноклеточные микроорганизмы, поражающие разнообразием. Они имеют множество форм и особенностей, некоторые из них способны выживать в немыслимых условиях.
Человеческий микробиом насчитывает сотни видов бактерий и каждый выполняет определенные функции, например, сдерживают рост патогенных микроорганизмов, поддерживают обменные процессы и многое другое. Известно, что лишь 1% бактерий вызывают болезни.
Вирусы – еще меньше чем бактерии, для нормальной жизнедеятельности нуждаются в клетках хозяина, где они могут жить и развиваться. Некоторые вирусы могут уничтожать клетки, где они развиваются.
Способы передачи
В путях передачи инфекций много общего. Основной путь передачи — от человека к человеку при близком контакте, например, при поцелуях.
Контакт с биологическими жидкостями человека, например, во время полового акта, при кашле и чихании. Так передаются не только вирусные инфекции, например, ВИЧ, ОРВИ и новая коронавирусная инфекция, но и бактериальные. Некоторые вирусы и бактерии передаются при соприкосновении с зараженными поверхностями, где вирусы и бактерии живут в биологических средах. Еще один возможный путь передачи — при укусах животных и насекомых.
Клиническая картина
Вирусы и бактерии вызывают схожие болезни по симптомам: лихорадка, насморк, кашель, головная боль, слабость и снижение работоспособности. Но при детальном рассмотрении и изучении найдется и масса отличий, которые заметит только врач.
Вирусные инфекции распространены в большей степени, поэтому, при появлении симптомов, часто предполагают именно ее. Дифференцировать одно от другого помогают следующие отличия и критерии:
- Инкубационный период у вирусов более короткий, в сравнении с бактериями. Например, у бактериальных инфекций – симптомы появляются спустя 7-10-14 дней после заражения, а иногда и больше. Вирусные инфекции проявляются через 1-5 дней после заражения.
- Клиническая картина вирусных инфекций более четкая, все характерные симптомы проявляются буквально сразу или между их появлением короткий промежуток времени. Если говорить о бактериальной инфекции, то они развиваются медленнее, но с полным набором симптомов.
Вирусные инфекции могут поражать здорового человека, а вот бактериальные развиваются на фоне ослабленного иммунитета или же являются осложнением перенесенного заболевания.
Конечно, главное отличие – способы и методы специфического лечения. Антибиотики никак не действуют на вирусы, а противовирусные на бактерии.
Особенности диагностики
В медицине существует такое понятие, как дифференциальный диагноз – методы диагностики, которые помогут отличить одно заболевание от другого со схожей клинической картиной. Бактериальные и вирусные инфекции способны вызывать респираторные заболевания, и чтобы определить причину, проводят дифференциальный диагноз – анализ симптомов.
Например, выделения из носа при вирусных инфекциях жидкие, прозрачные, часто носят серозный характер. А вот при бактериальных – густые, могут иметь желтый или зеленый оттенок, что говорит о наличии гнойного процесса.
Естественной реакцией организма на проникновение вируса или бактерии является повышение температуры тела. При вирусной инфекции температура повышается резко и быстро,может держаться несколько дней. При бактериальной инфекции — постепенно и начало болезни сложно проследить.
При вирусных инфекциях сложно определить область поражения. Пациенты отмечают, что болит сразу все: горло, грудь, мышцы, голова. Однако при бактериальной инфекции легко определить область поражения: болит горло при ангине, боль в груди при бронхите, боль при мочеиспускании при циститах и др.
Длительность болезни также варьируется. Например, при вирусной инфекции улучшение наступает на 5-7 день болезни, а вот бактериальные инфекции протекают длительнее.
В большинстве случаев, поставить предварительный диагноз удается на основе жалоб, внешнего и инструментального осмотра. Некоторые вирусные и бактериальные инфекции имеют весьма специфичные симптомы. При постановке диагноза учитывают еще и данные об эпидемиологической обстановке.
Но все же чаще при бактериальных инфекциях требуются дополнительные методы обследования, в том числе и лабораторные. В соответствии с этим, врач обязательно назначает следующие анализы:
- общий анализ крови;
- изучение слизи, выделяемой мокроты, других выделений и мазков;
- анализ мочи, стула;
- соскоб кожи;
- изучение спинномозговой жидкости при тяжелом течении болезни.
При бактериальных инфекциях такие исследования проводятся с целью определения вида возбудителя, а также его антибиотикочувствительности.
Особенности лечения
Вирусные и бактериальные инфекции – совершенно разные диагнозы, имеющие особенности клинического течения, а также лечения. И, в случае ошибки при назначении лечения, повышается вероятность осложнений, развития основного заболевания. Иногда это представляет угрозу для здоровья и жизни.
Лечение бактериальных инфекций
Антибиотики – группа лекарств, назначаемых исключительно при лечении бактериальных инфекций. Существует разные виды антибиотиков, которые направленно действуют на бактерии определенного класса или же широкого спектра. При формировании острых заболеваний с серьезным и быстрым течением могут назначаться антибиотики широкого спектра действия, а после, когда результаты по определению антибиотикочувствительности дадут результат, могут назначаться узкоспециализированные лекарства.
Неконтролируемый, необоснованный прием антибиотиков, когда пациент бросает их пить раньше срока, это может привести к формированию антибиотикоустойчивой флоры и в дальнейшем лечение окажется неэффективным.
Лечение вирусных инфекций
Для многих вирусных инфекций нет специфического лечения. Обычно разрабатывается симптоматическое, направленное на устранение симптомов, снижения температуры. Но все же лечение определяется конкретным вирусом и болезнью, которое он спровоцировал.
При вирусных инфекциях врач назначает противовирусные препараты, которые подавляют жизненный цикл некоторых вирусов.
Ну и главное, стоит помнить, что некоторые серьезные бактериальные и вирусные инфекции можно предотвратить при помощи вакцинации.
Диагностика и лечение бактериальных инфекций кожи
Как наилучшим образом вести пациента со стафилококковой инфекцией кожи? Как врач общей практики может диагностировать и лечить рожистое воспаление? Какое лечение эффективно при эритразме? B норме кожа человека заселена огромным
Как наилучшим образом вести пациента со стафилококковой инфекцией кожи?
Как врач общей практики может диагностировать и лечить рожистое воспаление?
Какое лечение эффективно при эритразме?
B норме кожа человека заселена огромным количеством бактерий, мирно сосуществующих на ее поверхности или в волосяных фолликулах.
Однако кожа обладает определенными свойствами, защищающими ее от инфицирования патогенами. К ним относятся плотный и сухой ороговевающий слой, практически непроницаемый для микроорганизмов, и клейкое межклеточное вещество — сложная смесь липидов, плотно соединяющая клетки мальпигиевого слоя и также защищающая кожу, закупоривая вход в волосяные фолликулы.
Другие факторы, останавливающие проникновение патогенных микроорганизмов, включают постоянное обновление клеток кожи, кислое значение pH, наличие иммуноглобулинов в составе пота и различные виды кожной флоры.
Кожные инфекции, как правило, развиваются только тогда, когда травма, избыточная гидратация или воспалительные заболевания кожи нарушают эти защитные свойства. Организмы, вызывающие кожные инфекции, могут быть частью постоянной кожной флоры или ближайших слизистых оболочек или происходить из внешних источников, таких как другой человек, окружающая среда или зараженные объекты.
Импетиго — наиболее поверхностная кожная инфекция, вызываемая S. aulreuls и S. pyogenes. Различают два основных клинических варианта: буллезное импетиго, считающееся стафилокковым заболеванием, и небуллезное импетиго, вызываемое S. aulreuls или S. pyogenes либо обоими организмами.
Заболевание встречается у детей гораздо чаще, чем у взрослых, развиваясь на открытых частях тела, лице и конечностях, в местах царапин, ссадин и укусов насекомых.
Вначале появляются красные пятна, которые превращаются в пузырьки и гнойнички, легко вскрывающиеся и образующие толстые, слипшиеся желтовато-коричневые чешуйки на эритематозном основании (см. рис. 1). Они часто многочисленны, могут вызывать зуд, но, как правило, безболезненны.
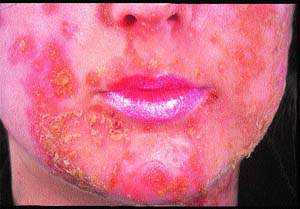 |
| Рисунок 1. Толстые желтые корки в основании эритемы и поверхностных эрозий у пациента со стрептококковым импетиго |
При буллезной форме могут развиваться большие пузырьки и волдыри диаметром 1-2 см. Они вскрываются медленнее и сохраняются в течение двух-трех дней. Возбудители, как правило, определяются культивированием, но в клинически очевидных случаях в этом нет необходимости.
Наиболее серьезным осложнением импетиго является постстрептококковый острый гломерулонефрит, общая заболеваемость которым в последние годы снизилась.
Буллезное импетиго обусловлено исключительно S. aulreuls, который выделяет токсин эксфолиатин, вызывающий расщепление межклеточного вещества в поверхностных слоях эпидермиса. Абсорбируясь в большом количестве в кровоток, этот токсин вызывает стафилококковый синдром обожженной кожи, который в 5% случаев заканчивается летально.
При инфекциях средней тяжести и локализованных формах используют местный антибиотик, например мупироцин или фузидовую кислоту, эффективно также местное применение неомицина и бацитрацина. Очень действенно использование ликацин-геля.
При тяжелых и распространенных формах назначают системный антибиотик. Обычно достаточно эритромицина или цефалоспорина первого поколения, например цефалексина.
Эктима относится к инфекциям, напоминающим импетиго, но затрагивающим более глубокие слои кожи. Она характеризуется формированием толстых слипшихся чешуек (см. рис. 2), покрывающих области изъязвлений кожи, которым предшествует образование гнойничков и пузырьков. Чаще всего поражаются ягодицы, бедра и ноги. Заболевание распространено в тропиках, где его развитию способствуют плохие гигиенические условия и недостаточное питание. Возбудителями могут быть S aulreuls или S pyogenes либо оба микроорганизма, но вызываемые ими изъязвления достигают дермы и заживают рубцеванием, что не свойственно импетиго. Лечение — системные антибиотики, воздействующие на S. aulreuls и S. pyogenes.
Поверхностный фолликулит, фурункулы и карбункулы. Фолликулит (воспаление эпителия волосяных фолликулов) — распространенное дерматологическое заболевание, не всегда первично только инфекционной природы. Физическая или химическая травма, а также связанное с профессиональным занятием воздействие продуктов смолы, применяемых также в лечебных целях, — все это вызывает фолликулит.
При проникновении стафилококков в более глубокие слои волосяных фолликулов воспаление захватывает дерму, вызывая образование фурункулов и карбункулов. Развивается воспалительный пузырек с гнойной головкой (фурункул) или инфекция охватывает несколько близлежащих волосяных фолликулов и образуется воспалительный конгломерат, из которого высвобождается гной (карбункул).
Фурункулы чаще всего встречаются на лице и ногах, а типичная локализация карбункулов — задняя часть шеи; как правило, они сопутствуют сахарному диабету. Крупные фурункулы и карбункулы вскрывают и дренируют, назначая пенициллиназо-устойчивый антибиотик.
Рецидивирующие стафилококковые инфекции кожи. Некоторые пациенты подвержены рецидивам стафилококковых инфекций кожи.
Предрасполагающими факторами здесь служат сахарный диабет, хроническая почечная недостаточность и некоторые иммуннодефицитные состояния, но у большинства пациентов перечисленные выше заболевания отсутствуют: вероятно, эти больные являются хроническими носителями стафилококков, и при мельчайшей травме кожи патогены вызывают инфекцию.
Рецидивы таких инфекций пытаются предотвратить различными способами: путем омывания кожи различными антисептиками, лечения других членов семьи антистафилококковыми антибиотиками и пролонгированной терапии другими местными или системными антибактериальными препаратами. Все эти методы направлены на уничтожение стафилококкового “шлейфа”.
К сожалению, эти меры, как правило, неспецифичны и малоэффективны, так как бактерии появляются вновь вскоре после отмены антимикробного препарата. Поэтому предпочтительнее длительное использование местных антисептиков.
Рожа и целлюлит — это острые, быстро распространяющиеся инфекции кожи и подлежащих тканей.
Отличительной чертой рожистого воспаления является четко очерченный, приподнятый край, отражающий вовлечение более поверхностных (дермальных) слоев (см. рис. 3). Однако целлюлит может располагаться поверхностно, а рожа глубже, так что во многих случаях эти два процесса сосуществуют и различить их практически невозможно.
Считается, что рожистое воспаление вызывается стрептококками, как правило, группы A и иногда — группами G и C. При целлюлите высевается либо только S. aulreuls, либо совместно со стрептококком. H. influlenzae типа b — важный этиологический фактор лицевого целлюлита у детей младше двух лет.
Рожа, в типичном случае поражающая лицо, — болезнь пожилых, развивающаяся без видимых причин или иногда после травмы лица.
Целлюлит поражает нижние конечности, в особенности область икр. Ему часто предшествует травма, язва или другое повреждение кожи, откуда и исходит инфекция.
Как и при рожистом воспалении, целлюлит может сопровождаться или предваряться лихорадкой и ознобом, но у многих пациентов температура не повышается, и они не выглядят серьезно больными.
Кожа красная, горячая и отечная, края воспаленного участка неровные, на поверхности могут развиваться пузырьки и волдыри (см. рис. 4). В редких случаях обнаруживается лимфангит и региональный лимфаденит.
Без лечения могут развиваться такие осложнения, как фасциит, миозит, подкожный абсцесс и септикопиемия. Периорбитальный целлюлит, вызванный обычно травмой, может осложняться тромбозом пещеристого синуса, формированием орбитального, субпериостального или церебрального абсцессов или менингитом.
Пациентов с этими состояниями необходимо госпитализировать.
Описанные здесь стафилококковые и стрептококковые пиодермии составляют большую часть кожных бактериальных инфекций. Нужно уметь различать инфекционные процессы, присущие трем клиническим ситуациям:
- инфекция не укладывается в рамки типичной клинической картины пиодермии или не поддается полностью стандартной терапии;
- организм пациента ослаблен и не может выдержать борьбу с инфекцией;
- в эпидемиологическом анамнезе есть возможность контакта с необычными кожными патогенными микроорганизмами.
- Инфекции, вызываемые резидентными коринебактериями
Для эритразмы характерны красно-коричневые шелушащиеся участки кожи, расположенные в паху, в подмышечных впадинах и межпальцевых промежутках (см. рис. 5).
Corynebacteriulm minultissimulm считается этиологическим фактором этого заболевания, протекающего бессимптомно и развивающегося, как правило, у диабетиков, тучных и пожилых людей, а также у тех, кто проживает в тропическом климате.
Благодаря тому что данные микроорганизмы продуцируют порфирины, в ультрафиолетовом свете лампы Вуда пораженные участки флюоресцируют от кораллово-розового до оранжево-красного оттенка, что подтверждает диагноз. Как правило, культивирования не требуется.
Иногда для излечения достаточно интенсивного мытья с мылом. Другой подход — местное лечение эритромицином и клиндамицином или местными азолями, например клотримазолом, которые активны в отношении некоторых грам-положительных бактерий и грибов. При обширных поражениях наиболее эффективен, вероятно, эритромицин.
Оспенный кератолиз — это поверхностная кожная инфекция, очевидно вызываемая штаммами Corynebacteriulm и характеризующаяся наличием оспинок диаметром 1-7 мм на подошвах стоп. Оспинки, сливаясь, могут образовывать поверхностные эрозии.
Заболевание обычно протекает бессимптомно, но иногда пациенты жалуются на зудящую, как от ожога, боль или сырный запах.
Похоже, оспенный кератолиз связан с избыточным увлажнением ног из-за тесной обуви, частых контактов с водой или повышенной потливости.
Лечение гипергидроза вкупе с методами, описанными для эритразмы, как правило, эффективно.
Подмышечный трихомикоз проявляется восковыми узелками, формирующимися в волосах подмышки. Желтые, красные или черные, они образуются большими колониями коринеформных бактерий, покрывающих кутикулу волоса.
Прежде всего заболевание поражает пациентов, которые мало внимания уделяют личной гигиене и страдают избыточным потоотделением.
Для успешного лечения, как правило, достаточно брить волосы и пользоваться дезодорантами для подмышек. Эффективно также местное применение эритромицина и клиндамицина.
Литература
1. Noble W. C. Microbal Skin Disease: its Epidemiology. Arnold, London, 1983.
2. Hoor E. W., Hooton T. M., Horton C. A. et al. Mircroscopic evalulation of cultaneouls cellulitis in adults // Arch. Intern. Med. 1986; 146: 295-297.
Принципы лечения бактериальной инфекции
Бактериальная инфекция развивается после преодоления бактериями кожных и слизистых барьеров и проникновения в ткани организма. Зачастую организм успешно справляется с возбудителями без внешних признаков заболевания за счет иммунного ответа. Тем не менее у некоторых возбудителей появилась сложная защитная система.
Несмотря на захват клетками хозяина в результате обычного фагоцитоза, они способны предотвратить слияние фагосомы с лизосомой и в результате избегают разрушения. Поскольку стенка защитной вакуоли проницаема для питательных веществ (аминокислоты, углеводы), бактерии растут и делятся до тех пор, пока не погибнет клетка, а выделяющиеся возбудители инфицируют новые клетки хозяина.
Данная тактика используется, например, видами Chlamydia и Salmonella, Mycobacterium tuberculosis, Legionella pneumophila, Toxoplasma gondii и Leishmania. Легко понять, что целенаправленная фармакотерапия особенно затруднена в этих случаях, т. к. препарату для достижения возбудителя необходимо пройти через клеточную мембрану и затем через мембрану вакуоли.
Если бактерии размножаются быстрее, чем защитные силы организма уничтожают их, развивается инфекционное заболеваниес признаками воспаления, например гнойная раневая инфекция и инфекция мочевых путей. Лечебными свойствами обладают вещества, которые повреждают бактерии, что останавливает их дальнейшее размножение без повреждения клеток организма хозяина.
Изолированное повреждение бактерий возможно в случае, когда вещество нарушает метаболизм бактериальных клеток, а не клеток организма хозяина. Таким свойством, очевидно, обладают ингибиторы синтеза клеточной стенки, т. к. в клетках человека или животных отсутствует такая стенка. Точки воздействия антибактериальных препаратов проиллюстрированы с помощью упрощенной схемы строения бактериальной клетки
Действие антибактериальных препаратов можно наблюдать in vitro. Бактерии размножаются в питательной среде в контролируемых условиях. Если среда содержит антибактериальный препарат, то можно ожидать два результата:
а) бактерии уничтожаются — бактерицидный эффект;
б) бактерии выживают, но не размножаются — бактериостатический эффект. Несмотря на то что в организме эффекты могут быть разными, различные классы разделяют по основному механизму действия.
N!B! Просьба раз и навсегда запомнить, что бактериоцидные антибиотики не сочетают с бактериостатическими, так как получается что антибиотики будут действовать на разные фазы роста бактерий - одни во время роста, другие после завершения роста! Можно сочетать только бактериостические с бактериостиатическими, а бактериоцидные с бактериоцидными.
Если антибактериальный препарат не влияет на рост бактерий, то это говорит о бактериальной резистентности. Она может быть вызвана наличием определенных метаболических особенностей, которые обусловливают нечувствительность к препарату у конкретного штамма бактерий (естественная резистентность). В зависимости то того, поражает ли препарат лишь несколько или множество типов бактерий выделяют антибиотики с узким (бензилпенициллин) или широким спектром (тетрациклин).
Штаммы бактерий с естественной чувствительностью могут трансформироваться под влиянием антибактериальных препаратов в резистентные штаммы (приобретенная резистентность) при случайном изменении гена (мутация). Под влиянием препарата чувствительные бактерии погибают, а мутировавшие продолжают размножаться. Чем чаще вводится один и тот же препарат, тем вероятнее появление резистентных штаммов (госпитальные штаммы с множественной резистентностью)!
Резистентность в некоторых случаях приобретается, когда ДНК, ответственная за нечувствительность (так называемые плазмиды резистентности), передается от других резистентных бактерий путем конъюгации или трансдукции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Выбор антибиотика при инфекциях. Рекомендации, критерии
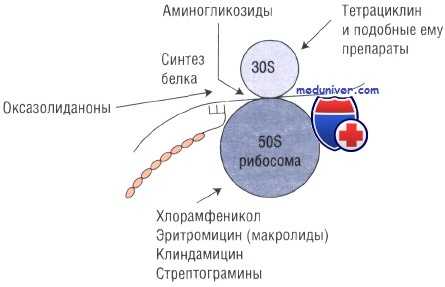
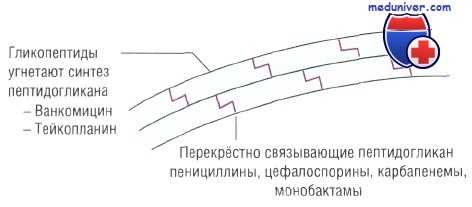
Основные принципы антибактериальной терапии — избирательная токсичность в отношении патогенного микроорганизма и относительная безопасность для организма человека. Для их выполнения большое значение имеет использование в качестве мишеней для лекарственных препаратов тех компонентов бактериальной клетки, которые отсутствуют у человека.
Примером такого компонента может быть клеточная стенка, воздействие на которую оказывает слабое влияние на макроорганизм и в то же время губительно для бактерии. Правильно подобранная антибиотикотерапия всегда эффективна и достаточно безопасна.
Несмотря на то, что почти все антибиотики обладают рядом побочных эффектов, серьёзные нарушения возникают достаточно редко. Кроме того, препараты этой группы имеют достаточно высокий терапевтический индекс, а потому побочные эффекты манифестируют только при назначении доз, намного превышающих терапевтическую. Важное исключение — аминогликозиды, наблюдение за концентрацией которых в сыворотке крови имеет первостепенное значение.
Выбор антибиотика
Выбор антибиотика зависит от локализации очага инфекции, чувствительности микроорганизмов, тяжести заболевания и аллергического анамнеза, вероятности возникновения побочных эффектов, стоимость препарата рассматривают в последнюю очередь. Рациональный выбор терапии зависит от знания локализации возбудителя и профиля его чувствительности к антибиотикам.
Локализация очага инфекции. Способность проникать в ткани (костную, суставную) или спинномозговую жидкость у всех антибактериальных препаратов различна. При абсцессах, а также в тканях с низким кровотоком достаточно трудно достичь высокого уровня антимикробной активности. Кроме того, эффект некоторых антибиотиков (например, аминогликозидов) снижается при низких значениях рН. В связи с этим абсцесс, возникающий внутри костной ткани или в спинномозговом канале, очень тяжело поддаётся лечению.
Чувствительность микроорганизмов. Streptococcus pyogenes высокочувствителен к действию бензилпенициллина, но другие бактерии, например, рода Acinetobacter и Pseudomonas. не восприимчивы к действию большинства антибиотиков, а потому подобрать эффективный препарат бывает достаточно сложно.
Вероятность возникновения аллергических реакций или побочных эффектов. Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину). В таких случаях обычно назначают альтернативное лечение. Возникновение аллергии — основное противопоказание не только к применению препарата, вызвавшего её, но и к назначению других родственных лекарств этой группы.
Противопоказание к использованию аминогликозидов — нарушение функции почек. Применение препаратов цефалоспоринового ряда ограничивается возрастом пациента, так как эти лекарственные средства повышают риск развития суперинфекции (например, в случае С. difficile).
Методы введения антибиотиков в организм при инфекциях
В настоящее время наиболее распространён приём препаратов внутрь (как при амбулаторном, так и при стационарном лечении). Кроме того, антибиотики можно применять местно (при кожных инфекциях), ректально (метронидазол для профилактики осложнений после хирургических операций) или вагинально (в виде пессариев). При тяжёлых инфекционных заболеваниях (септицемия и др.) для обеспечения терапевтического эффекта рекомендовано внутривенное введение антибактериальных препаратов.
Этот метод также показан пациентам, которые не могут принимать лекарства внутрь (например, при повторной рвоте). В педиатрии следует также учитывать вкусовые свойства антибиотиков. Кроме того, для многих пациентов большую роль играет кратность приёма и сложность режима лечения.
Многие пациенты имеют в анамнезе наличие аллергических реакций к одному или более антибиотикам (наиболее чаще к пенициллину).
Контроль антибактериальной терапии инфекции
Для контроля достижения и поддержания терапевтической дозы препарата, а также для снижения риска возникновения токсического эффекта при лечении антибиотиками необходимо наблюдение за состоянием пациентов. Это особенно важно в случаях, когда терапевтическая и токсическая дозы антибиотика отличаются незначительно. Перед внутривенным введением ванкомицина и аминогликозидов, а также по истечении часа после их введения необходимо измерять концентрацию препаратов в сыворотке крови.
Для обеспечения терапевтического эффекта и снижения риска интоксикации полученные результаты анализов должны соответствовать установленным нормам. Например, если концентрация высока, то дозу необходимо уменьшить. Кроме того, понизить уровень препарата в крови помогает снижение частоты его приёма. При приёме пролонгированных форм (когда для обеспечения терапевтического эффекта достаточно однократного приёма в сутки) анализы интерпретируют при помощи нормограммм и сравнивают результаты с общепринятыми нормами.
При лечении инфекций, вызванных частично устойчивыми микроорганизмами, также необходимо измерять концентрацию препаратов в сыворотке крови. Если рост бактерий ингибирует высокая концентрация антибиотика, то важно поддерживать её в сыворотке на постоянном уровне. Если инфекция возникает в труднодоступных местах (например, менингит, вызванный штаммами Pseudomonas), то содержание препарата можно измерить в спинномозговой жидкости.
Побочные эффекты антибиотиков
Наиболее распространённый побочный эффект при приёме антибиотиков — незначительные желудочно-кишечные расстройства. В исключительных случаях наблюдают тяжёлые аллергические реакции, приводящие к анафилактическому шоку или сывороточной болезни.
Желудочно-кишечный тракт при антибактериальной терапии. Антибактериальные препараты (особенно бета-лактамы) нарушают баланс нормальной микрофлоры кишечника, вызывая активный рост условно-патогенных микроорганизмов, таких, как род Candida. Таким образом, антибактериальная терапия может привести к острой диарее или более серьёзному осложнению — пневдомембранозному колиту.
Кожа при антибактериальной терапии. Кожные реакции могут быть различны: от лёгкой крапивницы или пятнисто-папулёзной эритематозной сыпи до мультиформной эритемы и крайне опасного синдрома Стивенса— Джонсона. В большинстве своём они не носят угрожающего характера и исчезают при отмене препарата.
Система кроветворения при антибактериальной терапии. У пациентов, принимающих хлорамфеникол или ингибиторы фолиевой кислоты, наблюдают дозозависимое угнетение функции костного мозга. При тяжёлых осложнениях вследствие лечения хлорамфениколом возникает апластическая анемия. Высокие дозы р-лактамных препаратов вызывают гранулоцитопению. Иногда при приёме антибиотиков развивается гемолитическая анемия. Большинство антибактериальных препаратов вызывают обратимую тромбоцитопению или угнетение функции костного мозга.
Мочевыводящая система при антибактериальной терапии. Нефротоксичность аминогликозидов обусловлена их способностью повреждать клетки проксимальных извитых канальцев почек. В группу риска входят пожилые пациенты, лица с заболеваниями почек, а также пациенты, принимающие помимо аминогликозидов другие нефротоксичные препараты (например, антибиотики тетрациклинового ряда).
Печень при антибактериальной терапии. Изониазид и рифампицин могут быть причиной развития гепатита, особенно если у пациентов ещё до приёма этих препаратов были заболевания печени. Другие препараты, связанные с развитием гепатита, — тетрациклины, эритромицин, пиразинамид, этионамид и реже ампициллин или фторхинолоны. Кроме того, при приёме тетрациклинов или высоких доз фузидовой кислоты возникает холестатическая желтуха.
Читайте также:
- Признаки воспаления слухового прохода. Лечения различного воспаления слухового прохода
- МРТ тазобедренного сустава в продольной проекции в норме
- Скорость гибели опухолевых клеток при химиотерапии
- Острая надпочечниковая недостаточность ( адреналовый криз ). Причины ( этиология ) надпочечниковой недостаточности. Патогенез адреналового криза.
- Последствия мутации генов кератинов
