Скорость гибели опухолевых клеток при химиотерапии
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Причины устойчивости опухолевых клеток к химиотерапии
На эффективность препарата большое влияние оказывает скорость его превращения в активную форму и скорость выведения из организма. Различия в этих ферментативных процессах отчасти имеют конституционный характер, являясь результатом генетических особенностей индивидуума. Для опухолей, помимо конституционных факторов, существуют механизмы, свойственные самой опухоли.
К их числу относится усиление или подавление метаболических процессов в клетках опухоли, которое может происходить за счет соматических мутаций, а также различная активность процессов, ответственных за доставку препарата в клетки опухоли, которые определяются степенью ее васкуляризации.
Таким образом, некоторые механизмы устойчивости опухолей к химиотерапевтическим средствам отражают особенности метаболизма и лекарственной устойчивости организма, в то время как другие связаны с самой опухолью.
Особенности метаболизма как причина устойчивости к химиотерапии
Индивидуальная чувствительность к лекарственным средствам зависит от конституционных факторов, ответственных за поступление лекарства, распределение его в организме и метаболические изменения до момента его попадания в опухоль. Эффективность этих процессов определяется генети-чески-детерминированными различиями среди индивидуумов.
Эти различия определяют структуру белков, принимающих участие в процессах метаболизма лекарственных препаратов. В основе таких наследственных вариаций в характере метаболизма лекарств лежит фармакогенетика. Для некоторых противоопухолевых препаратов понятны причины их различной эффективности, и генетически-детерминированные различия метаболизма определяют их такие важные характеристики, как противоопухолевая активность или токсичность. Они определяются различными генетическими факторами
За счет мутаций может происходить изменение активности или полная инактивация ферментов, отвечающих за метаболизм лекарства, в результате которого оно превращается в активную форму или распадается. В качестве примера можно привести изменения в метаболизме тамоксифена, при которых полиморфизм фермента CYP2D6, участвующего в обмене цитохрома Р450 в печени, изменяет вероятность развития побочных эффектов и лекарственного взаимодействия.
Часто наблюдается полиморфизм генетических структур, например изменение какого-либо нуклеотида в ДНК, или аминокислоты в белке. Обычно при этом функция меняется незначительно, хотя иногда наступающие изменения важны для клиники.
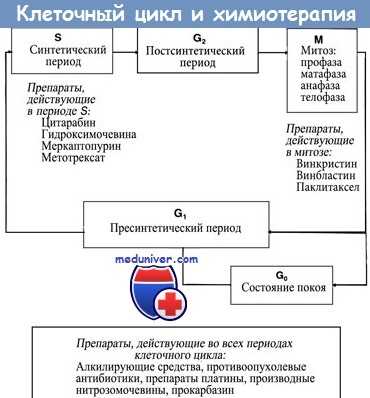
Примеры:
1. Меркаптопурин превращается в неактивную форму при участии фермента ТРМТ (тиопурин метилтрансферазы). Десять процентов населения гетерозиготны по мутантному аллелю, в то время как 0,3% гомозиготны. Мутантный аллель вызывает утрату способности клетки разрушать меркаптопурин (особенно это проявляется у гомозиготных организмов).
В результате возрастает токсичность препарата, однако усиливается его противоопухолевая эффективность.
2. Иринотекан представляет собой ингибитор топоизомеразы I. При участии СУР3А (цитохрома печени) он превращается в неактивную форму, а фермент СЕ (карбоксиэстераза) переводит его в активную форму, которая носит название SN38. Последняя инактивируется в печени под действием глюкоуронилтрансферазы (UGT1).
Полиморфизм промоторного участка UGT1 приводит к снижению метаболизма препарата и к увеличению его токсичности. Аналогичный эффект наблюдается при снижении активности СУР3А.
Приведенные примеры иллюстрируют возможности использования этого подхода в лечении рака. При помощи простых методов генотипирования можно обнаружить полиморфизм, который обусловливает такие результаты лечения цитотоксическими препаратами, как эффективность лечения, чувствительность к острой токсичности препаратов или проявление осложнений после продолжительного лечения (например, развитие вторичных опухолей).
Конечная цель состоит в разработке более индивидуального подхода к лечению больных, чем это удается делать до сих пор.

Устойчивость опухоли к лекарственным препаратам
До начала лечения клетки солидных опухолей проявляют различную чувствительность к лекарственным препаратам. Развивающаяся по мере роста опухоли генетическая нестабильность и образование соматических мутаций обусловливают проявление гетерогенности клеток по их устойчивости к действию химиотерапевтических препаратов. Это частично объясняет лекарственную устойчивость клеток больших опухолей, в которых такие процессы прогрессируют.
По мере роста опухоли частота возникновения устойчивых клеток увеличивается, и таким образом в больших опухолях их содержится много. Эта устойчивость обусловлена существованием одного или нескольких механизмов, перечисленных в таблице, которые рассматриваются ниже. Причиной является генетическая нестабильность, которая приводит к изменениям количества и функций внутриклеточных ферментов или транспортных белков.
Защитные механизмы организма и цитотоксические препараты оказывают на клетки селекционное давление, тем самым способствуя выживаемости устойчивых клеток, которые растут и делятся.
Наряду с перечисленным типом клеточной устойчивости, важную роль играют, по крайней мере, еще два других механизма. Один из них — понижение степени васкуляризации участков опухоли по мере ее роста. Это приводит к гипоксии и к снижению проникновения препарата в опухолевую ткань. Есть основания предполагать, что так же, как при радиотерапии, клеточная гипоксия может определять чувствительность опухоли к цитотоксическим препаратам.
Второй механизм связан с тем, что лишь небольшое количество клеток находится в цикле. Это дает дополнительное время для протекания репарации повреждений до момента вступления клетки в деление.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как понять, что химиотерапия работает?
Онкология — одна из самых сложных сфер медицины. В настоящее время многие злокачественные опухоли хорошо изучены, о них имеется много данных. Но зачастую эти данные сложны для понимания. Человеку без медицинского образования очень непросто увязать их в общую стройную картину.
Медицина — не математика. То, что в ней происходит, нельзя четко разделить на «черное» и «белое». Организм человека можно сравнить со сложным уравнением, в котором тысячи неизвестных. Решая его, зачастую нельзя получить точный однозначный ответ. В медицине дважды два не равно четырем. Врач скажет, что получается примерно четыре с вероятностью 90% плюс-минус 0,051.
Все это бывает очень сложно объяснить пациентам. А там, где человек не до конца понимает ситуацию, возникает масса сомнений и вопросов. Действительно ли медицина может помочь? Врач понимает, что со мной происходит, и как меня лечить? Работает ли курс химиотерапии, который мне назначили?
В этой статье мы постараемся ответить — максимально подробно и понятно.
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы. Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
В настоящее время существует огромное количество разновидностей химиопрепаратов и других противоопухолевых средств: таргетных препаратов, иммунопрепаратов, гормональных препаратов. Как понять, какие именно и в каких комбинациях помогут в вашем случае? Ни один онколог не сможет на 100% правильно ответить на этот вопрос, руководствуясь лишь собственным опытом. Но этого и не требуется.
Каждый лицензированный химиопрепарат хорошо изучен. Проведены многочисленные клинические исследования с участием тысяч пациентов. Это очень серьезный, сложный и дорогостоящий процесс.

Например, для того чтобы создать и протестировать новый препарат, современным фармкомпаниям в среднем нужно потратить 12 лет и миллиард евро.
Если какой-либо препарат помог или не помог одному пациенту, это еще ни о чем не говорит. Не существует двух людей с полностью одинаковыми организмами, как и двух совершенно одинаковых по своим свойствам злокачественных опухолей. Но когда лекарство проверено на тысячах людей, ученые получают результаты, которым можно доверять, и на которые можно ориентироваться.
На основании проведенных исследований составлены протоколы химиотерапии. Ориентируясь на них, онколог может назначить лечение, которое с очень высокой вероятностью поможет. Конечно же, предварительно нужно провести тщательное обследование, разобраться во всех характеристиках конкретной злокачественной опухоли.
Но даже в рамках протоколов каждый пациент индивидуален. Например, два немелкоклеточных рака легких могут иметь очень разные молекулярно-генетические свойства, и против них будут эффективно работать разные комбинации препаратов. Нужен персонализированный подход, и современные технологии предоставляют такую возможность. В клиниках сети «Евроонко» можно провести специальный анализ и составить «молекулярный портрет» опухолевых клеток. Вместе с результатом анализа лаборатория выдает списки комбинаций химиопрепаратов, которые будут наиболее эффективны в конкретном случае.
Что такое ремиссия?
«Доктор, сможете ли вы избавить меня от рака?» Если онколог отвечает на этот вопрос однозначное «да», то он в некоторой степени кривит душой.
Что подразумевает пациент под словом «выздоровление»? Скорее всего, что в его организме не останется ни одной раковой клетки. Проблема в том, что это нельзя проверить ни одним самым современным методом диагностики. Раковые клетки крайне малы и могут находиться в организме где угодно. Они могут годами «спать», а потом начать быстро размножаться и образовать метастазы.
Вместо слова «выздоровление» в онкологии применяют специальный термин «ремиссия»: с помощью доступных на данный момент методов диагностики в организме пациента не обнаруживаются признаки злокачественной опухоли. Это не означает, что в будущем рак не может вернуться. Иногда рецидивирует прежнее онкологическое заболевание или возникает новое. Врачи применяют разные методы профилактического лечения, чтобы этого не произошло. Но полностью застраховаться нельзя, можно лишь снизить риски.
Для того чтобы вовремя выявить возможный рецидив, после наступления ремиссии пациент должен периодически проходить обследования.

В зависимости от того, как пациент отвечает на химиотерапию, онкологи описывают результат лечения разными терминами:
- Полный ответ (полная ремиссия): опухоль исчезла и больше не обнаруживается.
- Частичный ответ (частичная ремиссия): опухоль осталась, но уменьшилась на определенный процент.
- Стабильное состояние: опухоль не уменьшается, но и не растет, не увеличивается количество очагов, не вовлекаются новые органы.
- Прогрессирование: опухоль растет, несмотря на лечение.
Опухолевые клетки коварны. Со временем в них происходят новые мутации. Начинается самый настоящий естественный отбор, как в теории эволюции: слабейшие быстро погибают под действием химиопрепарата, но сильнейшие выживают и обзаводятся новыми механизмами защиты. Поэтому все противоопухолевые средства помогают лишь в течение некоторого времени. Потом развивается резистентность (устойчивость), и вновь начинается прогрессирование. В таком случае врач назначит новые комбинации препаратов.
Как контролируют эффективность химиотерапии в процессе лечения?
Химиотерапию проводят циклами. Это означает, что пациенту вводят препараты, а потом дают время на «передышку». Продолжительность цикла кратна неделе и составляет 7, 14, 21 день. Обычно для того чтобы оценить ответ на лечение, требуется 2–3 цикла. Для контроля используют те же методы, что и для диагностики рака:
- Инструментальные исследования: КТ, УЗИ, МРТ и др.
- Анализы крови на онкомаркеры.
- Исследование функции пораженных органов.
- Осмотр врача, беседа. Доктор оценивает состояние пациента, спрашивает о симптомах, общем самочувствии.
Если рак отвечает на химиотерапию, лечение продолжают в прежнем режиме. Если начинается прогрессирование, нужно менять тактику.
Одновременно контролируют побочные эффекты. При их возникновении назначают поддерживающую терапию, меняют состав и дозировки химиопрепаратов. В клиниках «Евроонко» этому моменту уделяется особое внимание. Мы считаем, что пациенты должны переносить курсы химиотерапии максимально комфортно и без лишних рисков.
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи «Евроонко» всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.
Химиотерапия при метастазах
Особенностью большинства злокачественных опухолей является их склонность к лимфогенному и гематогенному метастазированию — отсеву опухолевых очагов с током лимфы или крови. Одни новообразования делают это раньше, другие позже. Некоторые виды рака, например, папиллярный рак щитовидной железы крайне редко дают метастазы, другие, например, саркомы или рак яичников, метастазируют очень быстро.
Основным методом лечения солидных опухолей является хирургическая операция, которая направлена на радикальное удаление новообразования. Однако при наличии метастазов этого недостаточно, даже если их можно удалить хирургическим путем, поскольку в организме с большой долей вероятности присутствуют другие, скрытые микрометастазы, которые пока не определяются имеющимися методами диагностики. Для борьбы с ними необходимо системное воздействие, которое оказывает химиотерапия.
Показания к химиотерапии
- Лечение высокочувствительных к химиотерапии опухолей. В этом случае хорошие результаты достигаются даже при 4 стадии заболевания с метастазами в отдаленных органах, когда можно уменьшить объем опухоли и вернуть ее в состояние, при котором эффективно другое лечение. Например, при некоторых видах рака молочной железы эффективно гормональное лечение, но со временем опухоль вырабатывает к нему резистентность и начинает прогрессировать. Несколько курсов химиотерапии могут вернуть ее в состояние, когда она опять станет чувствительна к гормонам. Это не радикальное лечение, но в определенных ситуациях оно вполне эффективно.
- Проведение комбинированного лечения. В ряде случаев химиотерапия назначается на дооперационном этапе для лечения местно распространенных или метастатических новообразований. ХТ позволит уменьшить объем опухоли и метастазов и в последствии провести его радикальное хирургическое удаление, тем самым улучшив качество лечения и прогнозы течения болезни.
- Паллиативное лечение. Паллиативная химиотерапия призвана улучшить качество жизни больных, уменьшив проявления действия опухоли. Ее назначают для уменьшения болевого синдрома, при лечении асцита и некоторых других осложнений. [1,2]
Противопоказания к химиотерапии
- Беременность. Большинство химиотерапевтических препаратов обладают тератогенным и токсическим действием на плод, поэтому их нельзя использовать во время беременности, но есть препараты, которые не проникают через плацентарный барьер. Их применяют при лечении некоторых видов рака у беременных.
- Тяжелая, декомпенсированная недостаточность внутренних органов — сердца, легких, печени и почек.
- Тяжелые анемии, лейкопении и тромбоцитопении. Химиотерапевтические препараты губительно действуют на костный мозг, вызывая угнетение всех ростков кроветворения. Те или иные препараты действуют на него в разной степени, соответственно показатели крови, при которых нужно отменять лечение, будут определяться индивидуально с учетом используемой схемы ХТ.
- Химиотерапия не назначается, если конкретная опухоль нечувствительна к данному виду лечения. [1]
Эффективность химиотерапии при метастазах
Существует множество групп химиопрепаратов. Все они различаются механизмами действия, но в общем их можно свести к двум аспектам:
- Цитотоксическое действие — разрушение опухолевых клеток.
- Цитостатическое действие — блокировка процессов размножения опухолевых клеток. Они перестают размножаться и со временем погибают. [1]
Эффективность химиотерапии определяется несколькими моментами:
- Тип опухоли и ее молекулярно-генетический профиль.
- Стадия заболевания.
- Применяемые виды лечения. Большинство опухолей вырабатывают резистентность к химиотерапии первой линии, поэтому при прогрессировании или развитии рецидива, схему лечения необходимо менять.
- Возраст и общее состояние больного. Например, ослабленным больным невозможно проведение высокодозной химиотерапии, которая могла бы преодолеть химиотерапевтическую резистентность рака и добиться лучших результатов лечения. [3]
Виды химиотерапии при метастазах
При метастазах могут использоваться все известные методы химиотерапии:
- Неоадъювантная. Применяется перед облучением или операцией. Позволяет уменьшить объем опухоли и метастазов и провести их радикальное удаление.
- Адъювантная. Она применяется после операции, для уничтожения оставшихся опухолевых клеток. Обязательно проводится при обнаружении метастазов в регионарных лимфатических узлах.
- В рамках монотерапии используется для лечения высокочувствительных опухолей.
- Локальная химиотерапия. Хорошо зарекомендовала себя при лечении метастазов в печени, головном мозге, серозных полостях и других органах.
- Паллиативная ХТ, она проводится для облегчения состояния больного. [2]
Подготовка к лечению
Подготовка к химиотерапии заключается в проведении комплексного обследования, которое, во-первых, позволит подобрать необходимую схему лечения, а во-вторых, выявить наличие противопоказаний к нему.
Для подбора химиотерапии необходимо морфологическое, иммуногистохимическое и, в ряде случаев, молекулярно-генетическое исследование злокачественного новообразования. Дело в том, что рак одного и того же органа может быть представлен совершенно разными видами опухолей, которые по-разному реагируют на лечение. Более того, один и тот же вид рака может иметь разный молекулярный профиль, что также влияет на его чувствительность к химиотерапии и другим видам лекарственного лечения. Определить эти особенности помогают вышеперечисленные методы лабораторной диагностики.
Для выявления противопоказаний к лечению, проводится комплексное обследование, включающее лабораторные анализы, отражающие работу «заинтересованных» органов и систем, а также функциональные методы диагностики. Минимальный объем обследования включает общий анализ крови, общий анализ мочи, ЭКГ и биохимический анализ крови.
Процесс восстановления после лечения
Осложнения
Основная проблема химиотерапии заключается в ее токсическом действии не только на злокачественные клетки основной опухоли и ее метастазов, но и на весь организм, что приводит к развитию целого комплекса осложнений. Их можно разделить на несколько групп.
Осложнения, которые развиваются из-за цитотоксического действия препаратов
- Местнотоксическое действие. Сюда относят дерматиты, циститы, ректиты, плевриты, перитониты, некрозы подкожной клетчатки и др.
- Системные осложнения, которые вызваны неспецифическим действием химиотерапии, которое направлено на подавление жизнедеятельности быстро размножающихся клеток. Сюда относят угнетение кроветворения (анемии, иммунодефициты, тромбоцитопении), диспепсические явления (тошнота, рвота, диареи из-за нарушения эпителиального покрова ЖКТ), поражение кожи и слизистых (алопеция, стоматиты, вульвовагиниты и др), нарушение репродуктивной функции (бесплодие, химическая кастрация, климакс). [5]
- Относительно специфические побочные реакции. Они связаны с токсическим действием на отдельные органы и системы: нервную систему, печень, поджелудочную железу, сердце [6] , почки и др. Также химиотерапия может приводить к хромосомным и генетическим поломкам, что может спровоцировать образование вторичной опухоли.
Осложнения, связанные с нарушением иммунитета
- Иммунодефициты, на фоне которых развиваются тяжелые грибковые, бактериальные и паразитарные инфекции, или происходит активация хронических инфекционных процессов.
- Аллергические реакции — анафилаксии, токсические дерматиты, пульмониты и др.
- Аутоиммунные реакции — васкулиты. [7]
В настоящее время разработаны эффективные методы профилактики и борьбы с данными осложнениями. Например, для устранения изнуряющей рвоты, применяют эметики. Они действуют непосредственно на мозговой центр, отвечающий за данное ощущение.
Для компенсации миелодепрессивного действия, применяют колониестимулирующие факторы роста, которые активируют гемопоэтические стволовые клетки и восполняют кроветворение. Для предотвращения инфекционных осложнений, применяются антибиотики, противогрибковые и антипаразитарные препараты. [8,9]
Мощный арсенал современных методов во многих случаях позволяет проводить эффективную химиотерапию при метастазах и добиваться удовлетворительных результатов лечения.
Скорость гибели опухолевых клеток при химиотерапии
В экспериментальных исследованиях установлено, что некоторая доза цитотоксического препарата вызывает гибель определенной части клеточной популяции, а не определенного количества клеток. Рисунок схематически иллюстрирует эту гипотезу гибели фракции клеток. Например, введение однократной дозы препарата может привести к гибели 99% клеточной популяции, причем эта же доля клеток погибнет независимо от общего их количества: оно может быть, например, 10 12 (тогда останется 10 10 клеток) или 10 4 (останется 10 клеток).
Если это положение справедливо для солидных опухолей человека, то приходим к выводу о том, что для небольших опухолей более эффективной оказывается схема с применением меньшего количества циклов лечения, чем для более крупных опухолей. Поскольку в этом случае препарат назначается ограниченное количество раз, вероятность развития к нему лекарственной устойчивости снижается. Прием препарата может быть спланирован таким образом, чтобы обеспечить максимальный цитотоксический эффект.
Последний зависит от скорости репопуляции клеток опухоли и восстановления тканей здоровых органов, наиболее сильно поврежденных цитотоксическим препаратом. У человека обычно к этим органам относятся кишечник и костный мозг. По сравнению с большинством опухолей, они быстро регенерируют. По этой причине химиотерапевтические препараты назначают в ритмическом режиме через определенные интервалы, необходимые для протекания восстановительных процессов.
Такой подход имеет некоторые теоретические и практические ограничения.
Справедливость гипотезы гибели фракции клеток оценивалась на экспериментальной модели гомогенных быстрорастущих опухолей, и экстраполяция ее положений на медленнорастущие опухоли человека выявляет очевидные недостатки.
Предполагается, что для экспериментальных опухолей, растущих в виде асцита или развивающихся в жидкой среде организма (например, лейкозы), противоопухолевые препараты распределяются равномерно. Очевидно, что этого не происходит в случаях плохо васкуляризованных солидных опухолей, и кинетика гибели клеток при этом описывается гораздо более сложной функцией, чем уравнение первого порядка, справедливое для экспериментальных систем.
Доля резистентных опухолевых клеток может являться функцией размера опухоли (см. «Лекарственная устойчивость при химиотерапии рака» ниже) и возрастать с ее увеличением.
При повторных курсах химиотерапии скорость репопуляции опухоли может изменяться. Хотя для экспериментальных асцитных моделей этого не наблюдается, в случае солидных опухолей ситуация меняется.
Степень восстановления здоровых тканей, например, если судить по данным анализа крови, может оказаться полной после первых нескольких циклов лечения. Однако, по мере продолжения лечения, восстановление замедляется, что накладывает ограничения на дозы препарата, назначаемые в последующих циклах.
Существует крайне ограниченный клинический материал о характере зависимости доза-эффект для конкретных цитотоксических агентов и определенного типа опухолей. Клиническая фармакология химиотерапевтических препаратов крайне сложна и отличается от препарата к препарату. Существуют клинические данные, согласно которым противоопухолевый эффект препарата проявляется только при его назначении в максимальной дозе, и на практике различие между неэффективной и максимально-переносимой дозой может быть незначительным.
Тем не менее, несмотря на высказанные соображения, в химиотерапии широко используется ритмический режим назначения препаратов через определенные интервалы времени. Этот режим был разработан на основании экспериментальных исследований и клинических испытаний.
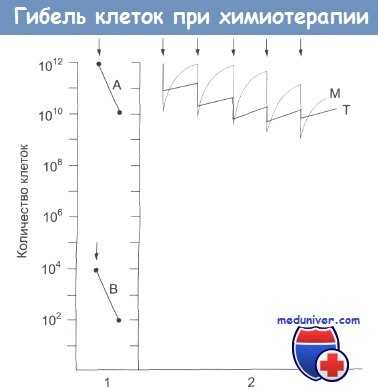
Фракционированная гибель клеток.
В первой части рисунка обозначена определенная доза препарата, вызывающая гибель 99% клеток как в случае А, так и в случае В.
В случае А количество клеток в опухоли снижается с 10 12 до 10 10 , а в случаев с 10 4 до 10 2 . Во второй части рисунка кривая Т иллюстрирует эффект повторных введений препарата (показаны стрелкой) на рост опухоли.
С введением каждой повторной дозы препарата гибель клеток снижается, что указывает на развитие у них устойчивости к препарату.
Кривая М иллюстрирует действие препарата на клетки-предшественницы в костном мозге. Эти клетки быстро восстанавливаются, однако по мере введения повторных доз препарата темпы восстановления снижаются и появляются клинические признаки подавления миелопоэза.
Гибель опухолевых клеток при применении комбинации химиотерапевтических препаратов
Даже в случаях таких чувствительных опухолей, как болезнь Ходжкина, назначение одного препарата редко приводит к излечению. Поэтому логично попытаться увеличить эффективность лекарственных средств и продолжительность их действия, одновременно назначая несколько препаратов. Цель применения рецептур заключается в попытке преодолеть возможно больше механизмов, ответственных за устойчивость опухоли к цитотоксическим агентам. Очень скоро такой подход оказался эффективным в лечении детских лейкозов и лимфом у взрослых, а также стал применяться для лечения больных с другими опухолями.
При разработке режима комбинированной химиотерапии необходимо соблюдать следующие общие принципы.
• Следует назначать только те препараты, которые оказываются эффективными при изолированном применении.
• По возможности необходимо назначать препараты, токсичность которых не перекрывается.
• Следует применять ритмический режим назначения препаратов с тем, чтобы обеспечить протекание восстановительных процессов в кишечнике и костном мозге.
• В идеале, каждое лекарственное средство должно назначаться в оптимальной дозе и по оптимальной схеме.
• По возможности, следует назначать препараты, характеризующиеся синергическим действием (правда, на практике такие агенты неизвестны).
• Если возможно, необходимо применять препараты, влияющие на различные фазы клеточного цикла.
• Большинство схем лечения разработаны эмпирически с учетом опыта врача.
Повышение эффективности, которое достигается при использовании рецептур, объясняется несколькими причинами.
• Опухоль подвергается воздействию нескольких препаратов, и вероятность развития лекарственной устойчивости снижается.
• Максимальный цитотоксический эффект достигается без увеличения токсичности.
• Существует меньшая возможность раннего появления популяции клеток, устойчивых к препаратам.
Что такое химиотерапия: первый сеанс
Как проходит первая химиотерапия — один из самых частых вопросов пациентов и их близких. Химиотерапия (ХТ) пугает не меньше самого злокачественного процесса и добавляет негатива восприятию своего заболевания. Боятся осложнений, но главное — в неизвестности непосредственной реакции и отдалённого результата — вдруг мучения окажутся напрасными.
Как проходит химиотерапия?
Химиотерапия предполагает использование цитостатиков, но на практике так называют любое противоопухолевое лекарственное лечение, в том числе использование таргетных и иммуно-онкологических препаратов. Что логично, поскольку они объединяются в схемы с цитостатиками, дополняют курсы химиотерапии и приходят на смену цитостатическим средствам при неэффективности.

Выбор схемы и входящих в неё лекарств обусловлен локализацией злокачественного процесса, так по-разному лечат рак молочной железы и карциному желудка. Лекарства подбираются по морфологической структуре опухоли, то есть плоскоклеточный рак и аденокарцинома легкого неодинаково чувствительны к лекарственным препаратам.
Способы проведения курса химиотерапии многообразны:
- внутривенные инфузии — обычно их называют «укол в вену», когда препарат шприцем вводится в вену в небольшом разведении;
- внутриартериальные инфузии от внутривенных отличаются не только сосудом, но и большей технической сложностью введения в артерию с высоким давлением, как правило, таким способом в определенную анатомическую область доставляются очень высокие дозы химиопрепарата;
- внутривенные капельные вливания предполагают введение препарата в кровеносное русло в хорошем разведении и с небольшой скоростью, один из современных вариантов — многочасовое и даже многосуточное впрыскивание лекарственного средства специальной помпой — инфузоматом;
- внутриполостная химиотерапия — впрыскивание цитостатика внутрь плевральной и брюшной полости, в том числе длительное орошение полости во время операции на фоне гипертермии;
- внутрипузырные инстилляции — вариант внутриполостной ХТ, когда лекарство вводится в мочевой пузырь;
- подкожное и внутримышечное введения применяются очень редко из-за местного раздражающего действия, присущего большинству цитостатиков;
- локальная аппликация — цитостатик в виде мази;
- пероральная химиотерапия — идеальный способ лечения, когда принимаются таблетки или капсулы, к сожалению, основная масса химиопрепаратов выпускается в порошках для растворения или готовыми растворами.
Подготовка к химиотерапии
Обязательное условие для начала любой химиотерапии у любого больного — морфологическая верификация злокачественного процесса, то есть полученный при биопсии или во время операции кусочек опухоли изучен под микроскопом, заболевание классифицировано и доказано, что это точно злокачественный процесс. В сомнительных случаях, когда нет 100% уверенности, что это рак, саркома, меланома, лейкоз и так далее, химиотерапию проводить нельзя.
К первому курсу химиотерапии пациент подходит полностью обследованным, если планируется предоперационная или неоадъювантная ХТ, или уже получившим на первом этапе радикальное лечение в виде операции, по необходимости дополняемой профилактической или адъювантной ХТ.
Обследованным пациент будет считаться, когда:
- определены все зоны локализации опухолевого процесса и размеры узлов;
- выяснено состояние сердечно-сосудистой и дыхательной систем, ЦНС и ЖКТ — есть понимание объективного состояния организма, объем функций и ограничений со стороны других органов позволяет провести терапию определенной комбинации и длительности;
- в биохимическом и клиническом анализах крови, анализе мочи все показатели в норме, то есть нет доказательств недостаточности функциональных возможностей и скрыто протекающих патологических состояний;
- при некоторых злокачественных процессах необходима информация о концентрации опухолевых маркёров, что в дальнейшем позволит оценить эффективность терапии.
Поскольку многие цитостатики негативно влияют на кроветворение, анализ крови на лейкоциты и тромбоциты должен быть «первой свежести» — не позже недели.
Режим и время приема препаратов
Каждое лекарственное средство имеет собственный профиль фармакологического действия, требует определенного способа введения в кровь больного и оптимальную дозу на введение.
Разовая дозировка рассчитывается на килограмм веса больного или на кожную поверхность. Для набора достаточной цикловой дозы какое-то лекарство необходимо принимать несколько недель каждый день, что-то требуется вводить раз в неделю, а что-то можно ввести один раз на целых три недели.
Продолжительность введения химиопрепарата обусловлена непосредственными токсическими реакциями или лучшим результатом воздействия на злокачественные клетки. Например, трёхчасовая капельница с производным платины «смягчает» повреждение почек, а часовое введение гемцитабина показало максимальную эффективность в сравнении с инъекцией шприцем.

Длительность курса химиотерапии
Курс ХТ состоит их нескольких циклов, где цикл предполагает введение определенной комбинации препаратов — схемы в определенной дозе и с определенными интервалами, если необходим набор суммарной дозы. Так циклом считается 14-дневный пероральный прием капецитабина, пять введений раз в неделю винорельбина или введение за один день сразу двух препаратов — паклитаксела и доксорубицина.
Несколько таких циклов составляют курс или одну линию химиотерапии. Оптимальная длительность курса с числом циклов определяется в клинических исследованиях, где учитывается не только процент наилучших результатов, но и накопление токсичности — кумулятивный эффект.
Количество курсов химиотерапии и побочные эффекты
Курсы проводятся пока можно надеяться на уменьшение злокачественной опухоли. Как уменьшение опухоли, стабилизация ракового процесса тоже свидетельствует о пользе лечения и говорит об уничтожении популяции чувствительных к цитостатикам клеток. Прогрессирование процесса на фоне лечения свидетельство неэффективности ХТ и необходимости смены комбинации лекарств.
Стандартная комбинация, предлагаемая для первого применения, самая результативная при данной структуре рака и не самая агрессивная. Второй рекомендуется менее эффективная схема лечения, третьей — ещё менее полезная. Для большинства злокачественных процессов разработано три линии лечения, то есть с той или иной пользой можно провести три курса ХТ из нескольких циклов, дальнейшая терапия малоперспективна и точно обещает побочные эффекты, но не позитивный результат.
Когда на первых циклах при нескольких линиях химиотерапии опухоль уменьшалась, а потом возобновляла рост, клетки можно считать чувствительными и есть основания для использования четвёртой-пятой линий.
Ограничить непрерывную смену линий могут побочные эффекты и истощение ресурсов организма по восстановлению химиотерапевтических повреждений. Так с каждым циклом ХТ всё дольше восстанавливается кроветворение, всё выраженнее повреждение почек и периферических нервов, всё труднее печени бороться с интоксикацией.
Только всех пугающая тошнота и рвота сегодня вполне предотвратимый побочный эффект, с которым успешно справляются специалисты нашей клиники, потому что применяют не только сильные противорвотные, но и целую программу подготовки и сопровождения химиотерапии.
Можно ли прерывать курс?
Прерывать курс нежелательно, для лучшего результата необходимо соблюдать разовые и суммарную дозы и интервалы между введениями. Тем не менее, приходится прекращать лечение при опасных для жизни осложнениях, в том числе снижении ниже критического уровня лейкоцитов и тромбоцитов, развитии стоматита и проявляющегося поносами лекарственного колита.
Перерыв между курсами химиотерапии
Перерыв между курсами зависит от достигнутого результата — ремиссии заболевания. Частичная ремиссия — когда клетки опухоли находятся в спящем режиме, полная — полностью уничтожены все проявления болезни. Свободный от проявлений злокачественной опухоли интервал может занять месяцы и годы, период ремиссии очень индивидуален и предсказать его длительность невозможно.
1-й курс химиотерапии
Первый курс обязательно завершится, и совершенно точно, что пройдет он не так, как предполагал пациент. Химиопрепараты убивают не только раковые клетки, но и нормальные, поэтому невозможно предугадать переносимость, гораздо важнее достигнутый в результате лечения результат. Переносимость следующего цикла будет отличаться от предыдущего, потому что на спектре и частоте осложнений сказывается состояние здоровья и настроение, погода и качество препаратов, время года и состояние пищеварения, и ещё много чего.
Клинические исследования выявили оптимальный курс для начала лечения, но это не означает, что у конкретного пациента первая химиотерапия будет самой эффективной, вполне возможно, что второй или даже третий курс дадут лучшие результаты.
Чувствительность злокачественных клеток к лекарствам очень индивидуальна, предсказать её помогает анализ, который выполняют в «Евроонко». Известна вероятность развития осложнений, но какими они будут и будут ли вообще, сказать невозможно. Тем не менее, в «Евроонко» для каждого пациента рассчитывается индивидуальная программа сопровождения химиотерапии, помогающая перенести лечение с наименьшими потерями для здоровья при максимально возможном результате.
Читайте также:
- Методы профилактики
- Клиника и диагностика атаксии-телеангиэктазии
- Лечение туберкулеза. Методы лечения туберкулеза. Профилактика туберкулеза. Методы профилактики туберкулеза.
- Внутриклеточные рецепторы гормонов. Механизмы вторичных посредников
- Клиника диссимуляции паранояльной шизофрении. Течение диссимуляции при шизофрении
