Последствия мутации генов кератинов
Добавил пользователь Skiper Обновлено: 17.01.2026
- Если у вас есть вопросы:
- 8 (495) 215-15-14
Что такое фолатный цикл?
Это сложная цепочка превращений, целью которой является синтез из фолиевой кислоты, или витамина В9, её производных — фолатов. Этот процесс сопряжен с образованием незаменимой аминокислоты метионина из гомоцистеина. Фолиевая кислота содержится в некоторых пищевых продуктах (например, в авокадо, чечевице, кресс-салате и шпинате), а также доступна в виде биологически активной добавки к пище, отдельно или в составе комплексных витаминов. Метаболизм фолатов определяют гены фолатного цикла.
При состояниях, связанных с дефицитом самой фолиевой кислоты или её производных, могут происходить нарушения фолатного цикла. Фолаты являются важным звеном в фолатном цикле и их недостаток является фактором риска развития ряда патологических состояний как у взрослых, так и у детей.
Генетика фолатного цикла
У людей могут наблюдаться дефекты генов, влияющих на метаболизм фолатов. Основных генов, которые кодируют важные для реакций цикла ферменты, три. Первый фермент – это метилентетрагидрофолатредуктаза (MTHFR). Он необходим для восстановления фолатов и присоединения метильной группы. Далее метильная группа переносится на витамин В12, который отдает ее гомоцистеину, образуя метионин с помощью фермента метионинсинтазы (MTR). Для поддержания активности последнего фермента необходимо восстановительное метилирование с помощью метионинсинтазаредуктазы (MTRR).
Таким образом, роль фолатов состоит в доставке метильной группы к гомоцистеину, благодаря чему он превращается в метионин и обезвреживается. Полиморфизм генов, кодирующих эти три фермента, могут приводить к снижению их активности во время обмена фолатов и вызывать нарушение фолатного цикла. Это, в свою очередь, может влиять на здоровье носителей таких вариантов генов, наступление и протекание беременности (в случае наличия нарушений у женщин).
К чему приводят нарушения метаболизма фолатов?
Нарушения происходят, если есть генетические дефекты ферментов фолатного цикла, влияющие на метаболизм: MTHFR, MTR и MTRR. Мутации генов приводят к тому, что гомоцистеин не превращается в метионин, накапливается в клетках и его уровень также повышается в плазме крови. Повышенный уровень этой серосодержащей аминокислоты оказывает токсическое действие: начинает "атаковать" внутреннюю стенку артерий, в результате чего образуются повреждения. Высокий уровень гомоцистеина способствует развитию тромбофилии и атеросклероза. При тромбофилии у человека повышена склонность к образованию тромбов в кровеносных сосудах, которые прпятствуют свободному току крови. При атеросклерозе в просвете сосудов происходит отложение холестерина, что приводит к сужению сосуда и нарушению кровоснабжения тканей и органов. При беременности гомоцистеин способен вызывать нарушения кровообращения между матерью и плодом, которые могут приводить к осложнениям беременности и дефектам развития плода.
Также нарушение обмена фолатов может приводить к подавлению метилирования ДНК. Метилированием называют присоединение метильной группы, которое является способом регулировать работу генов. Гены с присоединенной метильной группой переходят в неактивное состояние.
Мутация гена появляется спонтанно и при наличии её во всех клетках организма, включая половые, или только в половых клетках, она может передаваться потомству. Человек может быть носителем полиморфизма, нарушающего обмен фолатов, в одной (гетерозиготность) или в двух (гомозиготность) хромосомах. Степень нарушения работы ферментов обычно больше при гомозиготном носительстве, чем при гетерозиготном.
Как выявляют нарушения обмена фолатов?
Полиморфизм генов фолатного цикла встречается с разной частотой в разных популяциях. Есть несколько распространенных вариантов генов MTHFR, MTR и MTRR, которые в гомозиготной форме (когда обе хромосомы в паре содержат определенный вариант гена) приводят к значительному (в несколько раз) снижению работы соответствующего фермента, а в гетерозиготной форме (когда только одна хромосома из пары содержит определенный вариант гена) – к небольшому снижению.
Генетический анализ позволяет выявить мутации фолатного цикла у взрослого и у ребенка. Заказать такой анализ вы можете в Genotek. При выявлении генетического полиморфизма, нарушающего обмен фолатов, диагноз не ставится. Этот результат лишь указывает, что у человека есть генетическая предрасположенность к развитию патологических состояний, связанных с нарушениями фолатного цикла. Выявление таких вариантов генов особенно актуально при планировании беременности. Потому что генетические дефекты фолатного цикла могут быть причиной осложнений беременности, невынашивания и пороков развития ребенка. Поэтому после генетического исследования врач-генетик на консультации расскажет о мерах, которые могут помочь избежать таких состояний.
Однако большое значение для превращений фолиевой кислоты имеет также диета, прием определенных препаратов, образ жизни и ряд показателей обмена веществ. Например, недостаток витамина В9 (а также некоторых других витаминов группы В) приводит также к нарушению реакций синтеза метионина. Поэтому после прохождения генетического анализа необходима расшифровка результатов анализа и получение рекомендаций врача, которые будут учитывать все факторы и помогут начать профилактику или лечение. Например, при наличии дефектов работы описанных ферментов бесконтрольный приём фолиевой кислоты может быть также опасен.
Последствия мутации генов кератинов
Промежуточные филаменты хрусталика
• Хрусталик глаза содержит два специфических белка промежуточных филаментов, СР49 и филензин, которые входят в VI группу гомологичных последовательностей
• Эти специфические белки промежуточных филаментов сохранили свою структуру в процессе эволюции позвоночных
Клеткам хрусталика глаза позвоночных свойственны крайне жесткие критерии программы дифференцировки, что необходимо для последующего правильного функционирования ткани. Клетки должны:
• Обладать достаточной упругостью и в то же время эластичностью, которая допускает аккомодацию хрусталика.
• Сохранять полную прозрачность для того, чтобы не затемнять хрусталик.
• Сохранять перечисленные качества на протяжении всей жизни организма.
В клетках хрусталика содержатся два специфических белка, которые образуют «филаменты типа бус». Такое название они получили за характерный профиль поверхности, видимый в электронном микроскопе (остальные промежуточные филаменты имеют гладкую поверхность).
Эти белки называются СР49 (или факинин) и филензин. Они относятся к белкам VI типа. Оба белка имеют структурные характеристики, свойственные другим типам белков, однако их последовательности не гомологичны ни одной последовательности среди белков остальных групп.
Одним из наиболее существенных различий является наличие у них «знаковой» последовательности, свойственной белкам промежуточных филаментов, а именно последовательности на конце спирального участка. У CP49 на конце стержнеобразного домена находится последовательность Tyr-His-Gly-Ile-Leu-Asp-Gly-Glu, в то время как у других белков промежуточных филаментов на этом месте присутствует консервативная последовательность Tyr-Arg-Lys-Leu-Leu-Glu-Gly-Glu.
Гены, кодирующие СР49 и филензин, сильно отличаются от генов, кодирующих другие белки промежуточных филаментов. Такое своеобразие этих генов дает им селективное преимущество перед соответствующими генами других клеток, поскольку высоко гомологичные белки хрусталика сохраняются у всех позвоночных.
Последовательность, соответствующая CP49/факинину, обнаружена в геноме сростночелюстной рыбы Fugu ribripes, позвоночного организма, эволюционно очень далеко отстоящего от млекопитающих. Консервативность структуры проявляется даже у специфической последовательности, находящейся на конце спирального участка СР49/факинина.
Белки клеток хрусталика проявляют особые свойства в силу ряда причин. Во-первых, они обеспечивают развитие максимально прозрачного хрусталика. Во-вторых, поскольку хрусталик должен функционировать в течение всей жизни организма, его полимерные структуры должны обладать исключительной биохимической устойчивостью с тем чтобы не допустить деградации белков и изменений их структуры, которые могут привести к нарушению его физических или оптических характеристик и к утрате функции.
Считается, что специфические последовательности и морфологические особенности CP49 и филензина каким-то образом способствуют поддержанию свойств этих белков. В экспериментах на животных с измененным характером экспрессии белков филаментов хрусталика показано развитие последовательных нарушений функционирования хрусталика глаза. Также показано, что доминантные мутации в CP49 являются причиной развития ранней семейной катаракты у человека.
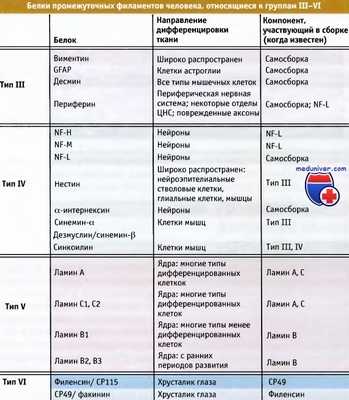
Белки промежуточных филаментов человека, объединенные в типы III—IV по принципу гомологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Генетика и онкология: главные вопросы
Что такое онкоген? Как возникают мутации в ДНК? Какие мутации провоцируют рак? Кому и чем могут помочь молекулярно-генетические исследования?
На эти и другие вопросы во Всемирный день ДНК отвечает Александр Олегович Иванцов – доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.

Александр Олегович Иванцов, доктор медицинских наук
— Александр Олегович, что такое мутация? Как возникают «поломки» в молекулах ДНК?
— Организм человека состоит из большого числа специализированных клеток, ядра которых содержат нуклеиновые кислоты: ДНК и РНК. Совокупность этих молекул содержит биологическую информацию, необходимую для построения и поддержания клеток, органов и систем органов в целом. Весь наследственный материал, заключённый в клетке, получил название – геном. У человека он представлен 23 парами хромосом (22 пары аутосом и пара половых хромосом), находящихся в ядре. ДНК является длинной полимерной молекулой, она хранит биологическую информацию в виде генетического кода, состоящего из последовательности повторяющихся блоков — нуклеотидов. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, которые необходимы для последующего биосинтеза важнейших белков. Открытие структуры ДНК в 1953 году стало поворотным моментом в развитии биологии, а исследователям Фрэнсису Крику, Джеймсу Уотсону и Морису Уилкинсу была присуждена Нобелевская премия в 1962 году. Стойкое изменение генома получило название – мутация. Эти изменения могут касаться структуры отдельных генов, хромосом и генома в целом. То есть изменение последовательности нуклеотидов приводит к нарушениям в кодировании информации – в итоге к аномалиям на уровне качества или количества соответствующих белков.
— Почему некоторые мутации приводят к развитию рака? Как устроен этот механизм? Как ученые определяют, какие именно «поломки» в ДНК приводят к развитию злокачественных опухолей?
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?
— Да, конечно, можно. Спектр генетических повреждений в опухолях характеризуется удивительным многообразием. Например: амплификации (увеличение копийности генов), делеции, инсерции, транслокации, микромутации (точковые замены, микроделеции, микроинсерции) и так далее. Кроме того, в опухоли изменяются уровни экспрессии генов в результате аномального метилирования их промоторов.
Существует много методов, используемых для выявления мутаций в опухолевой ткани, и достаточно много ситуаций, когда это требуется. Выявление определённых мутаций иногда помогает поставить диагноз, определить лечебную тактику, прогноз и так далее. Наиболее часто для молекулярного тестирования используются технологии полимеразной цепной реакции (ПЦР) и секвенирования нового поколения (NGS, next generation sequencing). Обе технологии универсальны и используются для анализа любой генетической последовательности, а также многократно превосходят все другие технологии по своей чувствительности, специфичности и не сопряжены с риском получения «промежуточных», неинтерпретируемых результатов. Секвенирование экзома позволяет выявить все мутации в кодирующих последовательностях генома в каждой конкретной опухоли. Именно полногеномное секвенирование значительно расширяет возможности персонализированного подбора препаратов, предназначенных для специфического поражения мутированных онкобелков.

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
— Вообще, бывают наследственные и ненаследственные опухоли. Наследственные опухолевые синдромы составляют незначительную долю от общего числа новообразований (около 1%), хотя для определённых локализаций (молочная железа, яичник, толстая кишка) их удельный вклад достигает более высоких показателей (5-20 %). Носительство наследуемой «раковой» мутации является причиной подобного заболевания. В этих случаях, в каждой клетке организма человека есть повреждение, которое передалось ему по наследству. Лица, имеющие такой генетический дефект, остаются практически здоровыми до определенного момента. В то же время они обладают фатально высоким риском возникновения опухолей (85-100%).
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— Какие исследования, связанные с мутациями ДНК, сейчас проводятся в научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»?
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
Кому следует проходить генетическое тестирование на наследственный рак
В 5-10% случаев развитие опухолей связано с наследственной предрасположенностью. Но даже наличие злокачественных опухолей у нескольких родственников далеко не всегда говорит о семейных генетических мутациях. Когда имеет смысл проходить генетическое тестирование?
Рассказывают научные сотрудники лаборатории молекулярной онкологии НМИЦ онкологии им. Н. Н. Петрова Светлана Николаевна Алексахина и Григорий Аркадьевич Янус.
Прежде всего, нужно сказать, что все случаи злокачественных опухолей связаны с мутациями (изменениями) генов, контролирующих рост и деление клеток. Но очень важно, что в большинстве случаев все эти мутации соматические, то есть возникают они в клетках человека после рождения, последовательно, в течение долгого времени, случайно или под действием канцерогенов окружающей среды. Но у некоторых людей первый шаг к возникновению опухоли уже был сделан до их рождения: первая мутация в этой цепочке – наследственная. Это значит, что она передалась от одного из родителей (как правило), или от обоих родителей (редкая ситуация), а может быть, впервые возникла в одной из двух половых клеток, соединившихся при зачатии человека («мутация de novo»). Как правило, человек с такой наследственной мутацией ничем не отличается по внешним признакам от людей без подобных мутаций. Единственное отличие – резко повышенный, иногда даже неизбежный риск заболеть раком какой-то одной или нескольких разновидностей.

Довольно часто к нам обращаются «онкологически здоровые» пациенты: у их родственников были диагностированы злокачественные опухоли, и они обеспокоены возможностью развития онкологического заболевания у себя. В лаборатории такие люди хотят пройти обследование на наследственную предрасположенность к онкологическим заболеваниям.
Мы рекомендуем проходить генетическое обследование на наследственный рак, в первую очередь, не здоровым родственникам, а самим онкологическим пациентам. В случае, если заболевание возникло из-за наследственной мутации, вероятность найти его у уже заболевшего члена семьи выше. Если в семье уже обнаружена наследственная мутация, то родственникам рекомендуется выполнять исследование только одного ранее обнаруженного патогенного генетического варианта.

Известно около сотни различных наследственных опухолевых синдромов, каждый из которых связан со своим геном или несколькими генами, и для каждого из которых характерно повышение риска «своих» разновидностей рака. Поэтому молекулярно-генетическое исследование на определение наследственной предрасположенности рекомендовано пациентам, соответствующим определенным критериям. Приведем несколько примеров:
Рак молочной железы
Гены: BRCA1, BRCA2, PALB2, ATM, CHEK2, TP53
Критерии:
- Возраст начала заболевания – менее 45 лет;
- Билатеральное (развитие опухолей двух молочных железах) или первично-множественное* (в данном случае, опухоль молочной железы и яичников) заболевание;
- Хотя бы один родственник первой степени родства с диагностированным раком молочной железы или раком яичников или как минимум два родственника второй степени родства с диагностированным раком молочной железы или раком яичников;
- Трижды негативный рецепторный статус опухоли.
! Соответствие как минимум одному критерию
* Первично-множественный рак – это независимое возникновение и развитие у одного пациента двух или более новообразований. При этом пораженными могут быть не только разные органы, но и парные (молочные железы, легкие и др.), а также возможно мультицентрическое поражение одного органа
Рак яичников
Гены: BRCA1, BRCA2, BRIP1
- Диагноз «серозная или эндометриоидная карцинома яичников» (вне зависимости от возраста и семейного анамнеза)
Рак предстательной железы
Гены: BRCA2, ATM
- Возраст начала заболевания – менее 55 лет;
- Хотя бы один родственник первой степени родства с диагностированным раком предстательной железы, раком молочной железы или раком яичников.
Рак желудка
Гены: CDH1, PALB2, BRCA1, BRCA2
- Возраст начала заболевания – до 40 лет;
- Наличие отягощенного семейного анамнеза в первой линии родства;
Рак поджелудочной железы
Гены: BRCA2, PALB2, CDKN2A, STK11, ATM, TP53, MSH2, MLH1, PRSS1
- Рак поджелудочной железы у родственника первой линии родства;
- Более двух случаев рака поджелудочной железы в семье;
- Семейная и личная история согласуется с а) наследственным раком молочной железы и яичников, б) синдромом Линча, в) синдромом Пейтца-Йегерса, г) синдромом множественных диспластичных невусов и меланомы.
Колоректальные опухоли
Существует 12 разновидностей наследственного рака толстой кишки. Самые частые – синдром Линча (рак толстой кишки или эндометрия развивается на фоне отсутствия выраженного полипоза), семейный аденоматозный полипоз (рак развивается на фоне сотен или тысяч полипов толстой кишки — полипоза), MUTYH-ассоциированный полипоз (рак развивается на фоне десятков, реже – сотен полипов, быстрее обычного превращающихся в злокачественные опухоли)
Синдром Линча
Гены: MLH1, MSH2, MSH6, PMS2, EPCAM
В настоящее время всем больным раком толстой кишки и тела матки (эндометрия) проводят одно из двух сопоставимых исследований:
- Генетический тест на изобилие в опухолевых клетках однотипных мутаций, так называемый феномен «микросателлитной нестабильности»;
- Иммуногистохимический тест на потерю опухолевыми клетками белков MLH1, MSH2, MSH6 или PMS2.
Наличие микросателлитной нестабильности и/или потеря белкового продукта генов MLH1, MSH2, MSH6 или PMS2 а) дает онкологу основание назначить иммунотерапию, б) может произойти у пациентов, страдающих синдромом Линча. Часто у таких лиц:
- реализация онкологического риска происходит до 50 лет;
- есть семейная история опухолей, относящихся к спектру синдрома Линча (рак тела матки, рак почечной лоханки, рак мочевого пузыря, рак мочеточника, рак тонкой кишки, рак желудка);
- первично-множественные опухоли различных отделов кишки и/или тела матки.
Семейный аденоматозный полипоз
Гены: APC, MUTYH
Наличие десятков, сотен или тысяч полипов толстой (и иногда тонкой) кишки (обычно выявляются с подросткового возраста).
- APC-негативный полипоз толстой кишки;
- Наличие в опухоли кишки определенной редкой соматической мутации в гене KRAS: c.34G>T (p.G12C)*.
Этот раковый синдром наследуется по рецессивному типу, то есть для развития болезни человек должен унаследовать дефектные гены от обоих родителей. У родителей при этом обычно наблюдается одна мутантная копия гена MUTYH, дающая крайне незначительное, но все же наблюдаемое повышение шанса заболеть опухолью кишки.
Меланома
Гены: CDKN2A, редко CDK4, BAP1, POT1 и TERT
- Первично-множественные меланомы и/или рак поджелудочной железы (2 у пациентов младше 40 лет, 3 у прочих);
- Хотя бы один родственник первой степени родства с меланомой и/или раком поджелудочной железы младше 40 лет;
- Два и более родственника первой степени родства с меланомой и/или раком поджелудочной железы
Рак щитовидной железы
Гены: RET
- Гистологический диагноз «медуллярная карцинома щитовидной железы»
- Часто заболевание сочетается с аденомами паращитовидных желез и опухолями надпочечников (феохромоцитомами), или с множественными невриномами ЖКТ.
Какие генетические тесты необходимо выполнить?
Нередко клиническая картина дает возможность выполнить исследование на один-два наиболее вероятных и значимых гена. Например, для пациентов с диагнозом рак молочной железы, рак яичников или рак предстательной железы рекомендовано выполнять анализ полной последовательности генов BRCA1 и BRCA2. Сейчас при соответствии клиническим критериям наследственных опухолей исследования последовательности генов BRCA1 и BRCA2 для пациентов с опухолями молочной железы и опухолями яичников может быть выполнено в рамках программы ОМС.

Мутации в генах BRCA1 и BRCA2 также могут быть причиной развития опухолей поджелудочной железы и желудка.
Другой пример: пациентам с аденоматозным полипозом толстой кишки рекомендуется выполнять исследование на мутации в гене APC. Если тест оказывается отрицательным, следует выполнить исследование на мутации в гене MUTYH (эти исследования в программу ОМС не входит, выполняются за счет средств пациента).
При подозрении на наследственный опухолевый синдром, ассоциированный с большим числом генов, или наличием подозрения на различные опухолевые синдромы выполняется исследование крови пациента методом секвенирования нового поколения (NGS). В лаборатории молекулярной онкологии НМИЦ онкологии им. Н. Н. Петрова анализируются сразу 70 генов, ассоциированных с опухолевыми синдромами, в том числе очень редкими.
Что делать, если генетическая мутация обнаружена?
В некоторых случаях обнаружение наследственной мутации дает возможность подобрать более эффективную терапию. Так, за счет механизмов генетических нарушений для BRCA-ассоциированных опухолей показана высокая чувствительность к препаратам платины, а также PARP-ингибиторам.
При обнаружении наследственной мутации рекомендуется генетическое обследование родственников – в этом случае проверяется уже наличие конкретной мутации. Вероятность передачи мутации от родителя ребенку – 50%.
Клинически здоровым родственникам с выявленной патогенной мутацией практически всегда можно предложить программу обследования или профилактических медицинских вмешательств, снижающих или устраняющих риск развития рака.
При обследовании родственников возможен «ступенчатый подход», сначала обследование проходят ближайшие родственники, если у кого-то обнаружена мутация, анализы уже сдают его родственники первой линии.
Обследование здоровых людей может быть выполнено по их желанию. Однако стоит учесть, что отсутствие наследственных мутаций не исключает возможности развития опухолей в течение жизни, так как чаще всего рак развивается спорадически (случайно) или в связи с наличием неизвестных нам пока наследственных факторов.
Как проводится генетическое исследование?
Наследственная мутация обнаруживается во всех клетках организма. Поэтому наиболее оптимальным образцом для исследования является венозная кровь. Для выполнения исследования достаточно 3-5 мл крови. ДНК для исследования получают из лимфоцитов крови.
Индивидуальный набор мутаций человека не меняется в течение его жизни, поэтому кровь для анализа можно сдавать вне зависимости от приемов пищи и лекарственных средств.
Разумеется, это значит, что достаточно однократного выполнения анализа, однако в некоторых ситуациях, когда наличие или отсутствие мутации критически значимо для планирования лечения, существует практика перепроверки результата, чтобы полностью исключить и без того очень низкую вероятность технической ошибки.


Авторская публикация:
Григорий Аркадьевич Янус, к.м.н., научный сотрудник лаборатории молекулярной онкологии

Авторская публикация:
Светлана Николаевна Алексахина, к.б.н., старший научный сотрудник лаборатории молекулярной онкологии
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Анализ генов BRCA1 и BRCA2 для выявления синдрома наследственного рака молочной железы и яичника
Одним из самых частых видов семейных опухолей является наследственный рак молочной железы (РМЖ), он составляет 5-10% от всех случаев злокачественного поражения молочных желез. Часто наследственный РМЖ связан с высоким риском развития рака яичника (РЯ). Как правило, в научной и медицинской литературе используют единый термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome). Причем, при опухолевых заболеваниях яичника доля наследственного рака даже выше, чем при РМЖ: 10-20% случаев РЯ обусловлены присутствием наследственного генетического дефекта.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Гены BRCA1 и BRCA2 играют ключевую роль в поддержании целостности генома, в частности в процессах репарации (восстановления) ДНК. Мутации, затрагивающие эти гены, как правило приводят к синтезу укороченного, неправильного белка. Такой белок не может правильно выполнять свои функции – «следить» за стабильностью всего генетического материала клетки.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
С марта 2020 г. лаборатория молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова, возглавляемая членом-корреспондентом РАН, профессором Евгением Наумовичем Имянитовым, включена в систему ОМС (обязательного медицинского страхования).
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
Однако для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
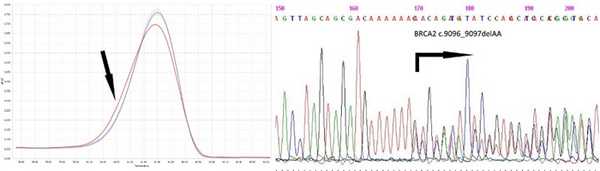
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.
Учеными было доказано, что для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
И, в заключение, наглядная инфографика «Синдром наследственного рака молочной железы и яичников». Автор — Кулигина Екатерина Шотовна, к.б.н., старший научный сотрудник Научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.



Авторская публикация:
АЛЕКСАХИНА СВЕТЛАНА НИКОЛАЕВНА,
лаборант-исследователь научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Читайте также:
