Признаки и клиника инфаркта миокарда у новорожденного.
Добавил пользователь Skiper Обновлено: 23.01.2026
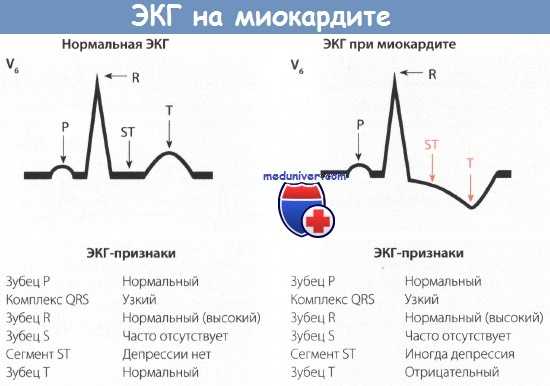
Клиника и признаки миокардита у детей. Диагностика миокардита у детей.
• При раннем и позднем антенатальном кардите симптомы заболевания появляются сразу после рождения. Наблюдается прогрессирующая тахикардия, тахипноэ, бледность кожи, западение межреберных промежутков и «сопение» на фоне отсутствия симптомов поражения легких. При позднем антенатальном кардите диагностируются сердечные аритмии.
• Постнатальный кардит манифестирует спустя несколько дней жизни и к 5—7-му дню от начала заболевания у детей развивается острая сердечная недостаточность. Острый постнатальный кардит у новорожденных часто носит бурный характер и протекает злокачественно. У большей части младенцев на фоне острой сердечной недостаточности имеются клинические признаки респираторной вирусной инфекции. Часто начало острое, с выраженными симптомами интоксикации, вегето-висцеральными расстройствами, иногда в сочетании с коротким энтеральным синдромом. Нередко присоединяются нарушения ритма сердца, которые могут быть причиной резких и повторяющихся ухудшений состояния ребенка, проявляющихся изменениями со стороны ЦНС в виде приступов резкого беспокойства, потерями сознания, судорожным синдромом. Нередко присоединяется перикардит. Размеры сердца увеличиваются преимущественно за счет дилатации ЛЖ. В этом случае быстро развивается циркуляторный коллапс, увеличивается тахикардия, постепенно нарастает бледность Рентгенологически при раннем антенатальном кардите легочный рисунок чаще нормальный или незначительно усилен по венозному руслу, выявляется значительная кардиомегалия шаровидной или овоидной формы, а также тень сердца может иметь трапециевидную форму с вытянутым ЛЖ, которая отмечается у младенцев с более благоприятным течением заболевания.
При постнатальном кардите типичная рентгенологическая картина складывается из увеличения тени сердца с кардиоторакальным индексом, превышающим 0,60.
Диагностике миокардита у детей помогает определение активности кардиоспецифических ферментов в сыворотке крови (миокардиальная фракция креатинфосфокиназы МВ-КФК, ЛДГ-1, ЛДГ-2).
Выделение культуры вирусов и серологическое исследование часто не позволяют выделить истинного возбудителя поражений сердца.
Для уточнения диагноза миокардита применяется биопсия эндомиокарда в области правого желудочка, которая выполняется спустя несколько недель от начала заболевания и далеко не во всех случаях может подтвердить или опровергнуть диагноз. У детей с аритмиями диагностическая ценность биопсии низкая.
Лечение миокардита у детей.
Лечение миокардитов у новорожденных детей прежде всего направлено на купирование нарушения кровообращения. Наряду с этим проводится противовоспалительная терапия. С целью предупреждения развития бактериальной инфекции могут применяться антибактериальные препараты.
Терапия сердечной недостаточности складывается из назначения дигоксина в сочетании с диуретиками, ингибиторами АПФ, антикоагулянтами, при необходимости с бета-симпатомиметиками. При легкой форме кардитов у новорожденных проводится длительная дигитализация и оксигенотерапия. Используют низкие дозы насыщения дигоксином (0,02—0,03 мг/кг) в течение 36—48 ч на фоне ЭКГ-контроля. При правожелудочковой недостаточности добавляют мочегонные средства (лазикс из расчета 0,5 мг/кг массы тела 2 раза в сутки).
В качестве средств, купирующих воспалительный процесс при легкой и средней тяжести течения заболевания и в начальных стадиях сердечной недостаточности применяют нестероидные противовоспалительные средства курсом от 2 до 4 нед, преимущественно внутрь.
При выраженных стадиях сердечной недостаточности или нарушениях ритма сердца и проводимости вместо этих препаратов с успехом используют кортикостероиды в дозе 3—5 мг/кг, которые назначаются внутримышечно равными долями в течение дня без учета суточного ритма их экскреции в организме ребенка. Продолжительность курса лечения кортикостероидами определяется быстротой наступления клинико-лабораторной ремиссии — в среднем 3—4 нед. Снижение дозы кортикостероидов происходит постепенно, каждые 2—3 дня.
Контрольными тестами, кроме клинического улучшения и исчезновения сердечной недостаточности, являются нормализация показателей систолической функции левого желудочка, фазы реполяризации на ЭКГ, исчезновение нарушений ритма и проводимости и нормализация активности кардиоспецифического изофермента креатинфосфокиназы в сыворотке крови. Снижение терапевтической дозы кортикостероидов начинается после появления положительных контрольных тестов.
Тяжелая форма миокардита с выраженной сердечной недостаточностью и падением АД лечится более активно. В этом случае подключается инотропная терапия, которая начинается с инфузии допамина (5—8 мкг/кг-мин) или добутамина (5—10 мкг/кг-мин) и только после стабилизации гемодинамики через 2—3 сут переходят к дигитализации.
При болезни Кавасаки рекомендуется терапия иммуноглобулином для уменьшения коронарных последствий.
Обычно кардиты у новорожденных протекают в течение от 2 до 6 мес и длительность течения зависит от активности воспалительного процесса и качества проводимой терапии.
Прогноз при миокардите у детей. Прогноз при легких формах миокардитов благоприятный. При тяжелых формах заболевания летальность у большинства детей наступает в первые 5—7 дней и достигает 80%. Неблагоприятным симптомом считается развитие эмбриокардии, брадикардии, асистолии. У новорожденных с поздним антенатальным миокардитом отмечается высокая ранняя смертность, достигающая 40%, часто связанная с внезапными нарушениями ритма сердца.
Признаки и клиника инфаркта миокарда у новорожденного.
Брегель Л.В., Субботин В.М., Белозеров Ю.М.
Институт усовершенствования врачей (г.Иркутск), НИИ педиатрии и детской хирургии МЗ РФ (г.Москва)
Ранний врожденный кардит у детей – редкое и тяжелое заболевание, резко омрачающее прогноз жизни ребенка. Еще реже врожденный кардит осложняется инфарктом миокарда (ИМ). Принято считать, что в детстве ИМ практически не встречается, поэтому об его особенностях плохо осведомлены педиатры. Проявления острой сердечной недостаточности вследствие ИМ нередко приводят к смерти, хотя истолковываются чаще в пользу других, более известных сердечных заболеваний, тем более что нередко миокардиальный инфаркт у детей развивается на фоне врожденных пороков сердца и кардиомиопатий и при патоморфологическом исследовании далеко не всегда тщательно исследуются признаки острой либо давней ишемии миокарда и состояние коронарного русла.
В исследовании R.Franciosi, W.Blanc [4] еще в 1960г. было показано, что при аутопсии детей, умерших от ВПС, в 75% случаев присутствуют признаки перенесенного ИМ, не диагностированного при жизни, хотя по ретроспективному анализу данных ЭКГ он мог быть заподозрен у половины из этих детей. Сведений о частоте секционных находок свежих и старых инфарктов миокарда у детей, погибших от врожденного кардита, в доступной литературе мы не встретили. Непосредственной причиной острой коронарной недостаточности при врожденных пороках сердца является несоответствие возможностей обычного венечного кровоснабжения чрезмерно гипертрофированной массе миокарда. При раннем врожденном кардите, вероятно, причина ИМ та же ввиду гипертрофии в первую очередь левого желудочка, и дополнительно возможны такие структурные изменения коронарных артерий, как дисплазия, изменения эндотелия вследствие текущего либо законченного воспаления, что сопровождается нарушением кровоснабжения миокарда и/или повышенной склонностью к тромбообразованию.
Развитие инфаркта миокарда у детей раннего возраста сопровождается клиникой острой сердечной недостаточности и неспецифическими симптомами в первую очередь нервной системы и желудочно-кишечного тракта [1, 2, 3].
Приводим пример клинического наблюдения и данных аутопсии девочки 3,5 мес., поражение сердца у которой протекало с признаками раннего врожденного кардита, острого инфаркта миокарда и тяжелой митральной недостаточности.
На 7-й неделе жизни при пеленании у девочки внезапно развился приступ резкой бледности с акроцианозом в течение 2-х минут (купировался самостоятельно), одышка, в течение нескольких часов стала вялой и сонливой, перестала держать голову, отказалась от груди, был жидкий стул 3-4 р за день температура тела 37,2 на протяжении двух дней.
Через сутки госпитализирована в детское отделение по месту жительства в крайне тяжелом состоянии с диагнозом: эндомиокардиальный фиброэластоз, острая легочно-сердечная недостаточность, не исключен врожденный порок сердца. Приступы цианоза и внезапного плача повторялись по несколько раз в день, наблюдалось тахипноэ, жесткое дыхание в легких, расширение границ сердца, грубый систолический шум в т.Боткина с иррадиацией в аксиллярную и межлопаточную область, ЧСС 160/мин. Cтул сохранялся 4-5 р в сутки, желтый, плохо переваренный, со слизью, эпизодически мелена. Рентгенологически легочные поля повышенной прозрачности, без очаговых и инфильтративных теней, расширение границ сердца в поперечнике, КТИ 70%, сглажена сердечная талия, выбухание дуги легочной артерии. ОАК – Эр 3,24*10/л Hb 108 /л Fi 0,9 Л 15,5*10/л э2 п3 с50 л34 м11 СОЭ 3 мм/час. Общий анализ мочи – удельный вес 1010, белка нет Л 1-2 в п/зрения. Бактериологические анализы на кишечную группу и стафилококк были отрицательными. Проводили лечение преднизолоном, диуретиками, коргликоном в/в, антибиотиками, анальгетиками в/м, инфузионная терапия глюкозой и реополиглюкином. Явления острой сердечной недостаточности нарастали – участились приступы внезапной бледности с плачем, акроцианозом, сохранялась тахикардия 190/мин, одышка 70-80/мин, появилась гепатомегалия до +5 см, умеренные периферические отеки.
В возрасте 8 недель переведена в областное отделение патологии новорожденных. При поступлении состояние очень тяжелое, масса тела 5 796, температура тела 36,5 С, лицо амимичное, взгляд “застывший”, реакция зрачков на свет сохранена. Большой родничок 3,0х3,0 см, не выбухает, слабо выражена ригидность затылочных мышц. На губах обильно стекающая изо рта пена. Слизистые полости рта розовые, влажные. Дыхание шумное, в легких диффузные сухие и влажные хрипы по задней поверхности. Границы сердца перкуторно не расширены; тоны приглушены, шум грубый систолический над областью сердца с проведением на верхушкe и в межлопаточное пространство. Живот безболезненный, мягкий, печень +5,0 см, селезенка + 1,0 см. Поставлен диагноз -- пневмония, врожденный порок сердца, энтероколит неясной этиологии. В общем анализе крови – Эр 4,1*10/л Hb 124 г/л Fi 0,9 Л 7,6*10/л п1 с58 л39 м2 СОЭ 1 мм/час, увеличение числа Тр до 418*10/л. Ликвор – белок 0,132 г/л цитоз 70/3 (лимфоцитов 60, нейтрофилов 10). Общий анализ мочи – удельный вес 1012, Л 3-5, эритроциты единичные в п/зрения. Данные биохимических и бактериологических исследований без отклонений от нормы. Нейросонография – признаки симметричной вентрикуломегалии, расширение субарахноидальных пространств (до 6 мм в лобных отделах). Признаки эпендиматита (утолщение и резкая гиперэхогенная плотность эпендимальных сплетений с обеих сторон). Повышена эхо-плотность мозговой паренхимы. На Эхо-КГ - резкая дилатация левого предсердия (31 мм при верхнем допустимом значении 19), утолщение створок митрального клапана (МК) до 1,4 мм, дискордантные движения и систолическая сепарация створок, митральная регургитация 3 степени, дилатация левого желудочка до 33 мм (при верхнем допустимом значении 25), гипертрофия стенок левого желудочка. Фракция изгнания 67%, правильное отхождение главных коронарных артерий. Заключение – митральная недостаточность 3 ст. На ЭКГ – синусовая тахикардия 180/мин, вертикальное положение эл/оси, признаки гипертрофии левого предсердия и левого желудочка, высокий остроконечный з.Т в V5-6, депрессия сегмента ST до -4 мм в I, aVL, V4-6. Заключение – признаки субэндокардиального инфаркта миокарда преимущественно боковой стенки левого желудочка (острая стадия); гипертрофия левых отделов сердца.
Однако ЭКГ-признаки острой ишемии миокарда левого желудочка во внимание приняты не были и продолжалось лечение застойной сердечной недостаточности диуретиками, капотеном, по поводу “пневмонии” -- антибиотикотерапия и инфузии реополигюкина и глюкозы в качестве дезинтоксикационных препаратов. Через сутки развился кардиогенный шок, переведена в отделение реанимации. Начата ИВЛ и инотропная поддержка добутамином 10 мкг/кг/мин, стандартная плановая терапия гепарином. В связи с быстрой положительной динамикой через 2 суток начата дигитализация, т.к. явления сердечной недостаточности трактовались исключительно как следствие раннего врожденного кардита и митральной недостаточности неясного генеза. Дополнительно в лечении использовались диуретики, антибиотики, индометацин. На ЭКГ через 7 суток ST-депрессия исчезла в I стандартном и aVL отведениях, уменьшилась ее степень (до –2 мм в V4-6). Сохранялись признаки резкой гипертрофии левых отделов сердца. После ликвидации явлений кардиогенного шока снята с ИВЛ. Состояние было стабильным -- ЧСС 120/мин, ЧД 40/мин, отсутствие гепатомегалии и периферических отеков, полное энтеральное питание, электрокардиографически – ST-депрессия –0,5 мм в V6, изоэлектричный з.Т в V6, уплощенный в отведениях I, V4-6. Отменены препараты острой инотропной поддержки и гепарин. Через 4 дня развилась клиника левосторонней полисегментарной пневмонии, возросла степень митральной регургитации и левожелудочковой недостаточности с альвеолярным отеком легких. При прогрессировании тяжелой застойной сердечной недостаточности, в возрасте 13 недель, ребенок погиб.
При патоморфологическом исследовании – кардиомегалия (масса сердца 77 г при норме 28), резкая дилатация левого предсердия и желудочка, правые сердечные полости не расширены. Эндокард левого желудочка значительно утолщен, серого цвета, с матовым блеском. Митральный клапан имеет периметр 63 мм (в норме 36), на створках – округлые, до 2 мм, плотные сероватые образования. Миокард левого желудочка выглядит “вареным”, дряблый, разрыхлен и разволокнен, особенно в субэндокардиальных отделах. Отек головного мозга, эктазия желудочков мозга, диффузный субэпендимарный глиоз. 2-х-сторонняя крупно-очагово-сливная пневмония. Гистологически – разрастание эластических и коллагеновых волокон в эндокарде, распространенный очагово-диффузный миокардиосклероз, больше в субэндокардиальных отделах, здесь же гипертрофия и выраженная дистрофия кардиомиоцитов, участки вакуолизации и фрагментации кардиомиоцитов, поля миолиза в области папиллярных мышц и нервных волокон атриовентрикулярного узла. Выраженный периваскулярный фиброз, значительное сужение просвета коронарных сосудов.
Причиной инфаркта миокарда у данного ребенка, согласно секционным данным, следует считать стенозирование просвета коронарных артерий, вследствие раннего врожденного кардита и/ или коронарного васкулита на фоне внутриутробной инфекции. Не исключается хроническая коронарная недостаточность, начавшаяся антенатально с продолжением в постнатальной жизни. Хотя по данным ЭКГ, ИМ был субэндокардиальным, патоморфологически обнаружены распространенные диффузные поля миокардиосклероза, более выраженные в субэндокардиальных отделах. Несомненный вклад в развитие острой сердечной декомпенсации внесла и тяжелая митральная регургитация. Грубый систолический шум был впервые отмечен при клинических симптомах острой ишемии миокарда с катастрофическим ухудшением состояния, что указывает на роль дисфункции папиллярных мышц в генезе митральной регургитации, в том числе в связи с отсутствием прижизненных признаков гипертрофии правых отделов сердца и хронической легочной гипертензии при ярких свидетельствах стремительно нараставшего с 6-ти недельного возраста увеличения левых отделов сердца. Это подтверждено и на аутопсии (макроскопически картина “вареного” миокарда левого желудочка наряду с сужением просвета коронарных артерий, гистологически поля миолиза в области папиллярных мышц МК, дилатация митрального кольца, резкая гипертрофия левых сердечных камер при нешироких правых).
Таким образом, к тяжелым осложнениям раннего врожденного кардита относится поражение коронарных артерий с сужением их просвета и инфаркт миокарда, при котором возможно ишемическое повреждение сосочковых мышц с развитием тяжелой недостаточности митрального клапана.
К характерным симптомам острой миокардиальной ишемии в первые месяцы жизни относятся приступы внезапного беспокойства и бледности с акроцианозом, вновь появившийся либо резко усилившийся грубый систолический шум митральной регургитации, диспептические расстройства, субфебрильная температура, умеренный лейкоцитоз, симптомы острой сердечной недостаточности либо кардиогенного шока, а также типичная электрокардиографическая динамика инфаркта миокарда. Ошибочная тактика лечения в связи с гиподиагностикой ИМ у младенцев значительно утяжеляет прогноз.
Инфаркт миокарда у новорожденных. Причины инфаркта у детей.
Инфаркт миокарда (ИМ) у новорожденных детей — редкая патология.
Этиопатогенез. Чаще всего ИМ у новорожденных обусловлен врожденными пороками сердца и коронарных сосудов. Однако имеется целый ряд других причин, не связанных с врожденными анатомическими дефектами сердца. За последние десятилетия в литературе описаны несколько сотен случаев этой патологии, причем наблюдения проводились преимущественно за новорожденными, тяжесть состояния которых определялась острой сердечной недостаточностью.
Н. Kilbride et al. представлена схема развития неонатальных инфарктов миокарда. Описываются два основных патогенетических механизма формирования инфарктов миокарда.
• Первый механизм обусловлен закупоркой одной из коронарных артерий или ее крупной ветви. Закупорка коронарной артерии происходит в результате тромбоэмболии, тромбоза коронарной артерии или ее воспаления.
• Второй механизм связан с достаточно длительной гипоперфузией крови по одной из ветвей коронарной артерии. Гипоперфузия возникает в результате гемодинамической перегрузки миокарда одного из желудочков и феномена «обкрадывания», который приводит к несоответствию величины коронарного кровотока необходимым функциональным потребностям работающего миокарда.
• Эмболы в коронарных сосудах обычно появляются из тромба, локализующегося в венозном протоке или пупочной вене, и достигают коронарных сосудов через функционирующие фетальные пути. Эмболия коронарных артерий может происходить непосредственно в интранатальный период. В отдельных случаях эмбол может иметь происхождение из катетеризованной пупочной вены, в частности при операции заменного переливания крови. Тромб может образовываться непосредственно внутри ветви коронарной артерии, а также при воспалении коронарных сосудов при вирусной инфекции, вызванной вирусом Коксаки В4.

• Аномальное отхождение коронарной артерии также является причиной развития ИМ. S. Sanders et al. выделяют следующие варианты коронарной диспозиции у новорожденных детей:
— аномальное отхождение коронарной артерии от легочного ствола;
— аномальное отхождение коронарной артерии от легочной артерии;
— отхождение коронарной артерии от ЛЖ;
— отхождение коронарной артерии от ПЖ.
Врожденное аномальное отхождение коронарных артерий от легочного ствола носит название синдрома Бланда— Уайта—Гарланда. Различают несколько вариантов этой аномалии. Наибольший клинический интерес представляет аномальное отхождение левой коронарной артерии. После рождения такого ребенка к миокарду ЛЖ поступает венозная кровь. Гипоксия миокарда вызывает его поражение в виде ишемии, инфарктов с последующим некрозом тканей, рубцеванием и возможной кальцификацией, истончением стенки Л Ж и ослаблением сократительной функции.
• Гипоплазия левой коронарной артерии и ее ветвей также может быть причиной развития очаговой ишемии и инфарктов миокарда. В этом случае миокард ЛЖ кровоснабжается из коллатеральных сосудов компенсаторно расширенной правой коронарной артерии. Развитие ИМ у таких детей наблюдается в первые сутки жизни, особенно в первые 36 ч после рождения. Кроме изолированной гипоплазии левой коронарной артерии, встречается гипоплазия обоих коронарных артерий.
• У части новорожденных детей ИМ развивается в результате перенесенной тяжелой перинатальной гипоксии, тяжелых родов и асфиксии при нормальном строении камер и коронарных артерий сердца. Иногда мелкоочаговые интрамуральные ИМ возникают у детей, перенесших тяжелую гипоксию в родах, в результате диссеминированного внутрисосудистого свертывания крови.
Инфаркты миокарда, непосредственно не связанные с окклюзией коронарной артерии, у новорожденных детей обнаруживаются преимущественно в субэндокардиальной зоне миокарда желудочков и папиллярных мышцах. При первичном осмотре сердца умерших от асфиксии новорожденных диагностируются инфаркты папиллярных мышц, которые располагаются в дистальной трети мышцы и выглядят как фиброзная ткань, вытянутая вверх и переходящая на хорду. Инфаркты чаще возникают в правой передней, реже в правой задней и в единичных случаях в левой задней папиллярной мышце. Хорды изменены, выглядят короткими, утолщенными и плотными с нодулярными узелками на краях.
Инфаркты миокарда, произошедшие вследствие окклюзии коронарных артерий или ее крупной ветви, располагаются в зоне миокарда, питающейся из этой артерии. При окклюзии ветвей левой коронарной артерии ИМ возникает в области верхушки ЛЖ, межжелудочковой перегородки или задней стенки ЛЖ. Локализация ИМ у детей с врожденными пороками сердца зависит от местоположения дефекта.
Микроскопически острый инфаркт миокарда проявляется как зона коагуляционного некроза с нейтрофильной инфильтрацией и краевой вазодилатацией. В стадии заживления поврежденный миокард заменяется на хорошо васкуляризированную фиброзную ткань с редкими гипертрофированными мышечными волокнами. Наряду с формированием на месте некроза фиброзной ткани, вокруг нее появляются зоны гипертрофированных мышечных волокон, обеспечивающих необходимую сократимость сердечной мышцы. Неонатальные инфаркты иногда заканчиваются миокардиальной кальцификацией, которая отчетливо определяется на рентгенограмме грудной клетки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В клинической картине неонатального инфаркта миокарда на первый план выступают такие симптомы, как бледность кожи, тахикардия, тахипноэ, увеличение печени. Нехарактерны для ИМ сердечные шумы и периферические отеки.
Выраженность клинических симптомов определяется площадью поражения сердечной мышцы и степенью нарушения сократительной способности миокарда желудочков.
Начало обширного инфаркта миокарда сопровождается резким беспокойством ребенка, раздражительным криком, стоном, а затем слабостью, отсутствием крика. Появляется мертвенно-бледный цвет кожи. При тяжелых ИМ лицо ребенка приобретает «умирающий вид». Иногда на фоне бледности кожи отмечается цианоз конечностей. В некоторых случаях бледность кожи, акроцианоз или тотальный цианоз могут возникать периодически, появляясь несколько раз в течение суток. Сосание слабое или совсем отсутствует. Физиологические рефлексы угнетены или отсутствуют.
Почти всегда определяется тахикардия до 160—200 сокращений в минуту. Периферический пульс слабый, иногда не пальпируется совсем. У некоторых больных регистрируются нарушения ритма сердца в виде экстрасистолии или пароксизмальной тахикардии.
Дыхание становится частым и поверхностным, с открытым ртом или типа «гаспс», достигая 90 и более в минуту. В ряде случаев частота дыхания не превышает возрастную норму или находится на верхней границе нормы.
Печень выступает на 3—4 см из-под края реберной дуги. При быстротечном ИМ и летальном исходе печень не успевает увеличиваться и во время осмотра пальпируется у края реберной дуги.
Описаны случаи инфаркта миокарда, при которых, наряду с признаками сердечной недостаточности, отмечается повышение температуры тела.
Диагностика инфаркта миокарда осуществляется с помощью функциональных методов исследования, среди которых электрокардиография является ведущей.
При интрамуральной локализации инфаркта миокарда на ЭКГ наблюдается снижение амплитуды основных зубцов комплекса QRS как результат снижения общей сократительной способности миокарда желудочков или появление патологического зубца Q продолжительностью более 0,02" и амплитудой, превышающей 1/4 амплитуды зубца R в этом отведении.
При глубоком повреждении сердечной мышцы в нескольких грудных отведениях появляется комплекс типа QS или типа Q с отсутствием зубца R, который указывает на трансмуральное повреждение с выключением части мышечной стенки из процесса активного сокращения. Иногда регистрируется феномен «выключения», когда в одном или нескольких грудных отведениях амплитуда основных зубцов комплекса QRS, по сравнению с рядом расположенными желудочковыми комплексами, существенно снижена. В этом случае морфология желудочкового комплекса сохранена.
Электрокардиографическая динамика неонатальных инфаркта миокарда во многом сходна с таковой у взрослых:
— в первые сутки от начала ИМ у новорожденного ребенка на ЭКГ регистрируется подъем сегмента ST выше изолинии и снижается зубец R в грудных отведениях;
— через 36 ч наряду с этими изменениями на краю зоны ишемии появляются желудочковые комплексы QRS типа qr, а в центре очага повреждения желудочковый комплекс имеет форму QS;
— через 3 сут от начала ИМ наблюдается возвращение сегмента ST на изолинию при сохраненной форме желудочкового комплекса типа QS в центре очага повреждения;
— через 1 мес в отведениях, отражающих зону повреждения, регистрируется изоэлектричное положение сегмента ST, желудочковый комплекс приобретает форму типа rS, зубцы Т положительные, низкоамплитудные.
При ультразвуковом исследовании определяется снижение контрактильности в отдельных участках сердечной мышцы в виде ее гипокинезии, дискинезии или асинергии движения.
На рентгенограмме грудной клетки при инфаркта миокарда левого желудочка определяется кардиомегалия с переполнением сосудистого ложа в результате снижения его сократимости уже через несколько часов после поражения. При пра-вожелудочковой локализации ИМ обнаруживается гипо-перфузия сосудов легких из-за снижения выброса ПЖ.
Инфаркт миокарда сопровождается многократным повышением активности миокардиального изофермента креатинфосфокиназы в сыворотке крови. При ИМ, не связанных с перенесенной перинатальной гипоксией, у новорожденных детей имеет диагностическое значение и определение активности сывороточных аспартат- и аланинаминотрасфераз. Изучение активности фракций лактатдегидрогеназы (ЛДГ-1, ЛДГ-2) является хорошим дополнением к результатам других исследований. Активность ЛДГ-1 и ЛДГ-2 повышается в несколько раз через 48—72 ч от момента повреждения сердечной мышцы, постепенно возвращается к исходному уровню в течение недели и может служить тестом для ретроспективной оценки ИМ.
Прогноз. У новорожденных детей имеется ограниченная информация о постинфарктных желудочковых аритмиях. C.L. Johnsrude et al. дают описание нескольких случаев желудочковых тахикардии и фибрилляций желудочка после ИМ у пациентов в возрасте от 1 дня жизни. Инфаркты миокарда произошли у них на фоне врожденных пороков сердца, врожденных кардиомиопатий, приобретенных кардиопатий. Желудочковая тахикардия или фибрилляция желудочков возникала у 28% детей с острым ИМ и в 84% случаев на 2-й день после постановки этого диагноза.
Постнатальная летальность младенцев с острым ИМ высокая, достигает 60% и не зависит от типа патологии сердца. Постинфарктная желудочковая тахикардия или фибрилляция сочетается с высокой смертностью, приближающейся к 80%.
У переживших пациентов в последующие годы жизни, как правило, не наблюдается повторных приступов желудочковых аритмий. В некоторых случаях после ИМ левого желудочка с вовлечением заднемедиальной папиллярной мышцы развивается вторичная митральная регургитация вследствие фиброза поврежденной мышцы с последующей сердечной недостаточностью, протекающей в течение нескольких месяцев жизни. S. Kaminer (1996) описал случай аномального отхождения левой коронарной артерии от легочной артерии с развитием ИМ, который сопровождался геморрагическим перикардиальным выпотом и последующей тампонадой сердца.
Инфаркт миокарда: клиника, диагностика, лечение
Острый инфаркт миокарда (ИМ) — клинический синдром, возникающий в результате повреждения сердечной мышцы при несоответствии между потребностью миокарда в кислороде и возможностью его доставки. При этом возникает некроз кардиомиоцитов в зоне поврежде
Острый инфаркт миокарда (ИМ) — клинический синдром, возникающий в результате повреждения сердечной мышцы при несоответствии между потребностью миокарда в кислороде и возможностью его доставки. При этом возникает некроз кардиомиоцитов в зоне повреждения одновременно, что отличает данный процесс от других форм миокардиального повреждения.
Этилогия и патофизиология. Факторами риска являются гиперхолестеринемия, сахарный диабет, артериальная гипертензия, малоподвижный образ жизни, семейный анамнез, табакокурение и другие.
Основным в процессе принято считать атеросклероз коронарных артерий, включающий в себя разрыв или деэндотелизацию атеросклеротической бляшки, тромбоз, вазоконстрикцию, часто на фоне воспаления. Важную роль также играет нарушение свертываемости крови, уменьшение коронарного кровотока и недостаточная его компенсация коллатеральным кровообращением, нарушение обмена простагландинов, функции калликреин-кининовой системы, иммунологические нарушения. Независимо от причины, ИМ характеризуется наступлением необратимой гибели клеток миокарда. Зона инфаркта, которая изначально охватывает субэндокардиальный слой миокарда, начинает распространяться на более глубокие слои, направляясь к эпикарду. Даже при тотальной окклюзии коронарного сосуда, снабжающего зону инфаркта, наблюдается некоторый антеградный кровоток, что может позволить сохраниться в зоне поражения жизнеспособным кардиомиоцитам, поэтому считается, что существует временной период до 6–12 часов, когда возможно повлиять на размер зоны некроза путем увеличения кровотока в поврежденном участке.
У более 50% больных тотальная коронарная окклюзия развивается в области ранее существующей атеросклеротической бляшки. Тотальная окклюзия чаще развивается в проксимальных сегментах крупных артерий, что впоследствии на ЭКГ проявляется патологическими зубцами Q. При отсутствии тотальной тромботической окклюзии коронарного сосуда чаще возникает Q-необразующий ИМ (по ЭКГ).
Развитие ИМ сопровождается нарушением систолической и диастолической функции и ремоделированием левого желудочка (ЛЖ). Нарушение систолической функции обусловлено тем, что некротизированный участок миокарда не участвует в сокращении сердца, тогда как в неповрежденной ближайшей зоне имеется компенсаторная гиперкинезия. Диастолическая дисфункция связана со снижением эластичности и растяжимости миокарда. В результате диастола ЛЖ неполноценна, миокард недостаточно релаксируется, повышается конечное диастолическое давление. Данные нарушения возникают при поражении менее 10% массы миокарда левого желудочка. Ремоделирование ЛЖ обусловлено истончением миокарда и снижением тонуса миокарда в области некроза, компенсаторным расширением полости ЛЖ, развитием состояния гибернации в периинфарктной зоне, активизацией циркулирующей и местной ренин-ангиотензиновой и симпатоадреналовой системы, гиперпродукцией эндотелина. Ремоделирование сердца после ИМ может носить адаптивный и дезадаптивный характер. Адаптивный характер проявляется в уменьшении размеров ЛЖ, поддержании удовлетворительной сократительной способности ЛЖ, стабилизации миокардиального стресса. Сохраняется гемодинамически выгодная форма ЛЖ, поддерживается удовлетворительная сократительная способность ЛЖ и стабилизация миокардиального стресса. Дезадаптивный характер процесса ремоделирования ЛЖ заключается в прогрессированной дилатации ЛЖ с переходом к гемодинамически невыгодной сферической форме сердца, что приводит к развитию рестриктивного типа диастолического наполнения ЛЖ. Этот тип дисфункции является мощным предиктором сердечно-сосудистой смертности.
Клиническая картина. Проявления ИМ имеют множество вариантов. От бессимптомного течения и эпизодического дискомфорта в области сердца до развернутого болевого приступа с различными нарушениями ритма и проводимости. Чаще описываются ощущения «давления», «тяжести» и «жжения» в центральной части грудной клетки с иррадиацией в плечевой пояс, руку, челюсть, эпигастральную область. Больной беспокоен, прикладывает руку к грудине (симптом Левайна). Для пожилого больного с множественной сопутствующей патологией ИМ часто проявляется в признаках сердечной недостаточности (нарастание одышки, отеков, появление сердцебиения, атипичность стенокардитической боли).
Физикальные исследования варьируют от полной нормы до выраженных отклонений (расширение верхушечного толчка, появление 3 и 4 тона, ослабление тонов, появление влажных хрипов в легких и др.). Ни один из этих признаков не подтверждает, но и не исключает наличие ИМ. Диагностика ИМ основана на выявлении маркеров повреждения сердечной мышцы.
Маркеры повреждения кардиомиоцитов. В настоящее время наиболее убедительным маркером является тропонин. Он имеет более высокую чувствительность к ИМ, чем МВ-фракции креатинфосфокиназы (МВ-КФК). Современные методы анализа позволяют наделять тропонин практически абсолютной кардиоспецифичностью, но, учитывая это качество, тропонин может быть повышен и при неишемическом повреждении миокарда. Поэтому только комплексный подход (клинические данные, эхокардиографические и др.) позволяют доказать острую ишемию миокарда и развитие ИМ. Уровень тропонина повышается в первые 4–6 часов и держится повышенным в пределах 8–12 дней. Длительность выявления маркера позволяет диагностировать ИМ в поздние сроки, без исследования лактатдегидрогеназы (ЛДГ). Для более точного ориентирования в сроках ИМ целесообразно исследовать «короткоживущие» маркеры некроза. «Ранним» маркером некроза миокарда является повышение активности МВ-КФК. Активность МВ-КФК повышается в первые часы повреждения миокарда и превышает нормальные показатели между 6–12 часами болезни, достигая пика к 18–24 часу заболевания, а к 48 часу показатели маркера возвращаются к нормальным. Необходимо помнить о других причинах повышения МВ-КФК: повреждение скелетной мускулатуры, хронические миопатии, почечная недостаточность, гипотиреоз за счет снижения клиренса, а также то, что соотношение МВ-КФК и общей КФК не считается критерием диагностики ИМ.
Электрокардиография. Наиболее значимыми признаками ИМ являются изменения сегмента ST (подъем с выпуклостью вверх). При нижней локализации ИМ следует фиксировать ЭКГ на правой половине грудной клетки в отведениях V3R или V4R. Для огибающей окклюзии характерны изменения в так называемых задних отведениях (V7–V9), чаще в виде появления патологического зубца Q. При этом вышеуказанные признаки нельзя считать 100% обязательными. В большинстве случаев типичные изменения ЭКГ отсутствуют, что может быть обусловлено наличием нарушения внутрижелудочковой проводимости или изолированной депрессией сегмента ST.
Эхокардиография (ЭхоКГ). Диагностическая точность ЭхоКГ зависит от качества получаемого изображения. Отсутствие патологии при ЭхоКГ не может служить основанием для исключения ишемической болезни сердца или некроза сердечной мышцы. ЭхоКГ не позволяет отличить свежий очаг асинергии от зоны постинфарктного кардиосклероза. Исследование незаменимо для исключения осложнений ИМ и сопутствующей патологии.
Лечение. Для достижения максимального положительного результата лечение должно начинаться как можно раньше, начиная с первого часа заболевания, что позволит иметь значительно лучший прогноз. Как можно раньше должна быть проведена реперфузионная терапия путем тромболизиса или первичной ангиопластики. Доказано, что рано начатое лечение приводит к существенному снижению смертности при всех формах ИМ. Первичная ангиопластика на инфаркт-ассоциированной артерии в первый час заболевания позволяет восстановить естественную перфузию миокарда в зоне повреждения Чем позже проведена реперфузия, тем выше смертность. В настоящее время доступность ангиопластики остается невысокой.
В 1996 году Европейским обществом кардиологов и Американской коллегией предложены рекомендации по лечению больных острым инфарктом миокарда, состоящие из ряда принципиальных позиций.
1. Болевой синдром имеет важнейшее значение для течения ИМ. Чем выраженнее и продолжительнее болевой синдром, тем больше опасность развития тяжелых осложнений. При отсутствии противопоказаний со стороны гемодинамики для купирования ангинозного приступа можно использовать сублингвальную форму нитроглицерина (НТГ). В отдельных случаях это позволяет получить регресс острых ишемических изменений на ЭКГ. При этом следует с осторожностью использовать НТГ при нижней локализации ИМ, т. к. может развиться тяжелая артериальная гипотония. НТГ также может вызвать сосудистый коллапс и резкое урежение сердечного ритма (вазовагальная реакция). При получении эффекта от сублингвального НТГ можно применить внутривенную инфузию данного препарата в низких дозах (5–10 мкг/мин). Применение НТГ не исключает использования анальгетиков. Не рекомендовано использование мощных вазодилататоров (например, антагонистов кальция) из-за возникновения тяжелой гипотонии и рефлекторной тахикардии. При отсутствии быстрого обезболивающего эффекта от НТГ назначают наркотические анальгетики — морфин гидрохлорид в/в до 10 мг с повторением введения препарата до полного купирования болевого синдрома. Помимо основного эффекта морфин способствует уменьшению пред- и постнагрузки на сердце, уменьшает давление в сосудах малого круга кровообращения. Из побочных эффектов основными являются гипотония и относительная брадикардия, угнетение дыхательного центра, тошнота и рвота. С целью обезболивания используют также Промедол.
Для усиления обезболивающего эффекта используют сочетание морфина и нейролептика, чаще дроперидола, обладающего также мощным противорвотным эффектом. Для больных пожилого возраста данные схемы нужно использовать с осторожностью из-за сопутствующей патологии, т. к. часто возможны нарушения функции дыхания. Для данной возрастной группы больных рекомендуется применение комбинации наркотического анальгетика и транквилизатора, например, Фентанила 0,005% 2 мл и Седуксена 0,5% 2 мл.
Большим достижением в обезболивании некупирующегося ангинозного приступа стала эпидуральная блокада. Широкое применение затруднено из-за развития специфических осложнений и наличия технических трудностей при ее выполнении.
Применение ингаляционных средств наркоза в настоящее время используется редко, только по определенным показаниям (проведение кардиоверсии, искусственная вентиляция легких, выполнение болезненных манипуляций).
2. Восстановление кровотока (реканализация) по инфаркт-ассоциированной артерии существенно уменьшает размеры зоны поражения миокарда. Эффективность тромболитической терапии (ТЛТ) прямо зависит от времени начала лечения. Желательно, чтобы время обращения за помощью и начало ТЛТ не превышало 90 минут. Показанием к ТЛТ считается наличие смещения сегмента ST вверх от изоэлектрической линии более 0,1 мВ не менее чем в двух смежных отведениях ЭКГ или блокады ножки пучка Гиса у больных, поступивших в первые 12 часов после появления симптомов ИМ. Однако при сохранении боли и указанных выше изменений на ЭКГ считается целесообразным проведение ТЛТ и в более поздние сроки (вплоть до 24 часов после начала заболевания). Под блокадой ножки пучка Гиса подразумевается вновь возникшая или предположительно вновь возникшая полная блокада левой ножки пучка Гиса, затрудняющая интерпретацию ЭКГ. Наиболее доступным с доказанной эффективностью считается препарат стрептокиназа. Препарат активизирует плазминоген непрямым способом. Препарат не следует назначать пациентам, которые перенесли ранее тяжелую стрептококковую инфекцию или которым данный препарат вводился в течение последних 5–6 месяцев. Быстрое введение стрептокиназы может вызывать резкое снижение артериального давления. Рекомендуемая доза стрептокиназы составляет 1500000 ЕД в течение часа.
Урокиназа является прямым активатором плазминогена, имеет короткий период полувыведения, вызывает более быстрое восстановление проходимости инфаркт-ассоциированной артерии, чем эквивалентная доза стрептокиназы. Рекомендуемая доза 2000000 ЕД болюсно и 3000000 ЕД в/в капельно в течение 90 минут.
Тканевой активатор плазминогена (ТАП) считается фибрин-специфичным активатором плазминогена. По сравнению со стрептокиназой и урокиназой ТАП способствует более раннему восстановлению проходимости инфаркт-ассоциированной артерии, возможно, именно этот фактор обусловлено снижает смертность при его использовании. Режим назначения ТАП 100 мг в/в в течение 3 часов: 10 мг болюсно, далее 50 мг в течение первого часа и еще 40 мг в течение последующих 2 часов. При массе тела пациента менее 65 кг назначается препарат в дозе 1,25 мг/кг (за 3 часа), при этом 10% от общей дозы должны быть введены в виде первичного болюса. Применение более высоких доз (больше 100 мг) ТАП ассоциировано с риском внутричерепного кровотечения.
С течением времени были синтезированы и другие ТАП с несколько иным молекулярным строением: ретеплаза, тенектеплаза.
Противопоказания к применению ТЛТ определяются риском возникновения серьезных кровотечений, в особенности внутричерепных. Существуют абсолютные противопоказания: активное внутреннее кровотечение, любой сосудистый эпизод в течение последних 2 месяцев, новообразование центральной нервной системы, тяжелая травма, хирургическое вмешательство в течение 3 месяцев, беременность, тяжелая артериальная гипертензия. К относительным противопоказаниям относят подозрение на расслоение аорты, сердечно-сосудистую реанимацию в течение 2 недель, злокачественные новообразования, язвенную болезнь в стадии обострения, нарушения гемостаза, системные заболевания, эндокардит и ряд других заболеваний. Следует индивидуально решать вопрос по проведению ТЛТ у больных старшего возраста, в связи с наличием большого количества сопутствующей патологии.
Сопутствующее лечение
Аспирин необходимо назначать всем больным с подозрением на ИМ, при отсутствии противопоказаний. Его положительное влияние на выживаемость, частоту реинфарктов и ишемических инсультов продемонстрировано как при проведении ТЛТ, так и в ее отсутствие. При сочетании Аспирина с ТЛТ эффективность последней значительно возрастает. Доказано, что Аспирин ингибирует агрегацию тромбоцитов и ускоряет фибринолиз. Поэтому всем больным ИМ следует назначать Аспирин немедленно в дозе 160–325 мг (разжевывать).
Гепарин при внутривенном введении совместно с активаторами плазминогена способствует ускорению проходимости инфаркт-ассоциированной артерии, особенно при использовании ТАП. При использовании стрептокиназы внутривенная инфузия гепарина не является столь необходимой. Стандартная схема гепаринтерапии предлагает первоначальное болюсное введение 5000 ЕД нефракционированного гепарина, а затем инфузию со скоростью 1000 ЕД/час, пока активированное частичное тромбопластиновое время (АЧТВ) не увеличится в 1,5–2 раза по сравнению с исходным. В связи с трудностями точной титрации данной формы гепарина, рекомендуется использовать низкомолекулярные гепарины (НМГ) с расчетом дозы на кг веса пациента.
β-блокаторы снижают риск повторного ИМ у больных, пролеченных тромболитической терапией. β-блокаторы снижают риск смерти, модулируют нейрогуморальные и гормональные системы, замедляют ремоделирование сердечно-сосудистой системы, вызывают нормализацию функционального состояния тромбоцитов. Рекомендуется применять препараты данной группы в первые 12 часов после начала ИМ у всех больных, не имеющих противопоказаний (бронхиальная астма, сахарный диабет, брадикардия, гипотония). Используются суточные доза метопролола, пропранолола.
Ингибиторы ангиотензин-превращающего фермента (иАПФ). Сердечная недостаточность (СН) является частым осложнением и одной из основных причин смертности в острый период ИМ и в отдаленные сроки после его развития. Возникновение и прогрессирование СН у больных, перенесших ИМ, связано с процессом ремоделирования миокарда ЛЖ, патофизиологический процесс которого запускается уже в первые часы заболевания. Повреждение клеточных и структурных компонентов миокарда и расширение зоны инфаркта предрасполагает к дилатации и дисфункции ЛЖ, которая определяет высокую смертность больных ИМ. Изменения в структуре ЛЖ в первые 3 дня, а в последующем пролиферация фибробластов и синтез коллагена приводят к прогрессированию ремоделирования сердца. Активным участником этих процессов являетcя ангиотензин II, вызывающий спазм коронарных артерий, увеличение работы сердца, повышение потребления миокардом кислорода, а в последующем пролиферацию фибробластов. Таким образом, появились теоретические основания для использования иАПФ при ИМ. Ингибиторы АПФ, уменьшая синтез ангиотензина II, вызывающего вазоконстрикцию как артериального, так и венозного сосудистого русла, способствуют нормализации центральной и периферической гемодинамики, тем самым предотвращают развитие кардиогенного шока, снижая нагрузку на сердце существенно, подавляют процесс ремоделирования ЛЖ. Однако применение иАПФ в остром периоде ИМ ограничивается риском снижения системного артериального давления (АД). В связи с этим, несмотря на доказанную эффективность иАПФ, не утратил своей актуальности поиск безопасных препаратов данной группы, пригодных для применения с первых суток ИМ в сочетании с ТЛТ. К препаратам, не вызывающим резкого снижения АД, относится лизиноприл (Диротон). Эффективность Диротона как средства, препятствующего ремоделированию ЛЖ и развитию СН, а также уменьшающего риск смерти после развития ИМ, показана в условиях эксперимента и клиники. В отличие от большинства иАПФ Диротон не нуждается в биотрансформации в печени для образования активных метаболитов, а также не содержит сульфгидрофильной группы, являющейся причиной ряда побочных эффектов. Отсутствие печеночного метаболизма у Диротона позволяет рекомендовать его больным с патологией печени. Диротон уменьшает риск взаимодействия с другими лекарственными препаратами, которые подвергаются биотрансформации в печени. Исследование эффективности Диротона у пациентов с ИМ и в раннем постинфарктном периоде показало снижение смертности, уменьшение СН. Диротон доказал свою эффективность также у больных пожилого возраста.
Антиаритмические препараты. Обычно речь идет о применении Лидокаина, который ранее назначался всем с профилактической целью купирования желудочковых нарушений ритма. Впоследствии оказалось, что реканализация инфаркт-ассоциированной артерии уменьшает вероятность развития таких аритмий, и доказано, что рутинное применение препарата способствует увеличению смертности. Лидокаин следует назначать только при желудочковой тахикардии или фибрилляции желудочков.
Магния сульфат (магнезия сульфат) может применяется при наличии лабораторно доказанной гипомагнемии или других специфических показаний (например, полиморфная желудочковая тахикардия).
Н. В. Журавлева, кандидат медицинских наук
О. А. Поворинская
РНИИ геронтологии, Москва
Читайте также:
