Прогестероновый рецептор. Строение и функция
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Стероидные гормоны и другие медиаторы имплантации. Введение в рецепторологию
Выше неоднократно говорилось, что главными регуляторами репродуктивных процессов у всех видов млекопитающих являются стероидные гормоны. Способность эндометрия к рецепции бластоцисты является результатом его гормональной подготовки. Практически для всех видов млекопитающих в репродуктивном цикле характерны две следующие закономерности:
1) возрастающая секреция эстрогенов в фазу развития фолликулов, которая в хронологическом плане влияет на имплантацию лишь косвенно;
2) лютеальная послеовуляторная функция, когда вырабатываются значительные количества прогестагенов; значительная эстрогенная секреция в эту фазу характерна далеко не для всех видов животных (67). Выработка больших количеств прогестагенов у всех видов совпадает по времени с имплантацией, в то время как сопутствующая этому секреция эстрогенов не характерна для всех видов. Например, среди приматов, характеризующихся очень близкими человеку гормональными профилями, у резуса и бабуина нет лютеального пика эстрогенов.
Что можно думать о роли эстрогенной секреции, облигатной для фазы роста фолликулов у всех млекопитающих? Кроме их гипоталамо-гипофизарного действия и вклада в эстральное поведение, эстрогены могли бы тормозить прогрессирующую атрофию матки в промежутке между беременностями. Однако такая интерпретация кажется менее логичной с учетом того, что у животных и в группах первобытных людей инфертильные циклы относительно редки, и после родов и лактации быстро следует новая беременность.
С эволюционной точки зрения эстрогенную секрецию в фолликулярную фазу следует считать неотъемлемой частью выработанной естественным отбором гормональной программы, которая создает наиболее благоприятные условия для наступления беременности и такого ключевого события, как имплантация. Нормальная секреторная трансформация эндометрия женщины возможна только после адекватной подготовки эндометрия эстрогенами. Мы подошли к такой важной теме, как рецепция половых стероидов.
Одним из самых перспективных направлений развития современной эндокринологии является изучение рецепции гормонов, и в частности, стероидных. Крупный американский биохимик Ленинджер, выступая на одном из международных конгрессов, сказал, что мы стоим на пороге новой эры развития медицины и биологии, связанной с развитием новой науки, рецепторологии, которая значительно расширит горизонты наших знаний о биологических системах.
Правота этого утверждения особенно очевидна в области физиологии и патологии репродукции, где знание динамики стероидных рецепторов позволило во многом по-новому взглянуть на патогенез, тактику лечения и прогноз таких заболеваний, как новообразования молочной железы и эндометрия и бесплодие при дефекте фазы желтого тела. Стероидные рецепторы необходимы для нормального функционирования всех органов-мишеней, но в данном обзоре целесообразно остановиться лишь на динамике стероидных рецепторов эндометрия. Стероидные рецепторы — это, по существу, регулирующие транскрипцию белки. Особенностью стероидных рецепторов является то, что для каждого типа стероидов (эстрогены, прогестерон, андрогены, глюкокортикоиды) имеется свой рецептор, и в одной и той же клетке могут одновременно находиться рецепторы для разных типов стероидов. Уровни стероидных рецепторов меняются в соответствии с сезонными и циркадными ритмами (62).
При отсутствии стероидных рецепторов для данного гормона в клетке, гормон не окажет своего физиологического действия до тех пор, пока в клетке не появятся рецепторы к нему. Одними из главных регуляторов уровней внутриклеточных стероидных рецепторов являются стероидные гормоны. Хотя до сих пор не создано метода быстрого и точного мониторинга уровней внутриклеточных стероидных рецепторов, рецепторология их достигла уже значительных успехов и синтез данных молекулярной эндокринологии, кинетики клеточного цикла и биохимии позволяет дать следующую схему действия женских половых стероидов на эндометрий (46).
I. Взаимодействие внутриклеточных стероидных рецепторов с гормонами зависит от уровня свободного гормона плазмы, представляющего .активное" состояние гормона. Количество свободного гормона плазмы крови находится под влиянием связывающих белков плазмы. Сродство гормонов к связывающим белкам плазмы колеблется от очень слабого (Кd 10 -3 M) до очень сильного (Кd 10 -10 M). Высоким сродством к эстрадиолу и тестостерону обладают SВР (sex steroid binding plasma protein, TEBG, testosterone-estrogen binding globulin) и aльфа-фетопротеин (уровень его падает от высокого в период новорожденности до низкого в препубертатный период). Прогестерон и кортикостероиды обладают высоким сродством к транскортину (СВG, corticosteroid binding globulin). Неспецифическим связывающим стероиды белком плазмы является альбумин (Kd 10 -4 — 10 -5 М, относительно слабое средство).
Сродство эстрадиола и эстриола к внутриклеточным эстрогенным рецепторам составляет соответственно 10 -10 и 10 -9 М. Таким образом, эстрадиол должен быть в 10 раз активнее эстриола. Однако по способности оказывать специфическое действие в организме активность их примерно одинакова. Это объясняется тем, что сродство альбумина сыворотки к эстрадиолу в 10 — 100 раз больше, чем к эстриолу. Эстрадиол сам может оказывать влияние на уровень сывороточного альбумина, так как он вызывает задержку и накопление сывороточного альбумина в тканях-мишенях, в частности, в матке (повышение уровня связанного эстрадиола в матке по сравнению с другими органами).
II. Стероидные гормоны одинаково легко входят в клетки-мишени и не-мишени при широком спектре концентраций (0,2 — 5 000 нг/мл), что проще всего объясняется простой диффузией.
III. После попадания стероидного гормона в клетку, он связывается либо с неспецифическим белковым компонентом цитоплазмы (низкое сродство, неспецифичность, большая связывающая способность), либо со специфическим рецептором (высокое сродство, специфичность, малая связывающая способность). В первую очередь гормон связывается со своим специфическим рецептором, к которому имеет наибольшее сродство. Например, рецептор эстрогенов прочнее связывает эстрадиол, чем эстриол и эстрон. В то же время он может очень активно связывать нестероидные эстрогены (диэтилстилбестрол). И, наконец, антагонисты эстрогенов (нафоксидин, тамоксифен). Напротив, эстрогеновый рецептор не связывает ни прогестерона, ни кортизола. Связь стероида с рецептором обратимая и нековалентная.
IV. Цитозольный комплекс гормона и рецептора следует в ядро. Ядерные и цитозольные рецепторы стероидных гормонов по современным представлениям идентичны. В физиологических условиях (температура 37 о С, ионная сила раствора 0,15 и рН 7,4) комплекс гормон-рецептор "активируется", либо трансформируется. Природа этой трансформации пока не ясна, однако известно, что такая трансформация благоприятствует переходу комплексов в ядро и сродство ядра к стероидным рецепторам резко повышается.
V. Биологические ответы эндометрия. Общим для стероидных гормонов действием является то, что гормональная стимуляция усиливает транскрипцию определенного числа генов. Это действие приписывается комплексам гормон-рецептор, выполняющим в ядре функцию регуляторов, модулирующих генную экспрессию. Однако точный механизм связывания рецепторов с ядерным материалом и тип регуляции пока не известны.
Одним из самых важных свойств стероидных гормонов является их влияние на уровни стероидных рецепторов внутри клеток-мишеней. Эстрадиол усиливает синтез собственных рецепторов, рецепторов прогестерона и рецепторов андрогенов. Андрогены могут усиливать синтез собственных рецепторов. Прогестерон не только не усиливает синтез собственных рецепторов, но подавляет его. Подавляет он и синтез рецепторов эстрадиола.
В фолликулярную фазу менструального цикла женщины концентрация рецепторов эстрадиола в эндометрии под влиянием секреции эстрадиола яичниками повышается и сопровождается повышением сродства их к ядру. Вероятно, что рецептор, синтезированный в цитоплазме, немедленно переходит в ядро вместе с гормоном. С началом секреторной фазы уровень эстрадиоловых рецепторов начинает быстро падать, что обусловлено растущей концентрацией прогестерона и одновременным снижением концентрации эстрадиола плазмы, активность которого снижается вдобавок и потому, что на уровне эндометрия усиливается трансформация эстрадиола в эстрон вследствие повышения активности 17-бета-гидроксистероид-дегидрогеназы, стимулируемой прогестероном (37).
Что касается рецепторов прогестерона, то их концентрация тоже повышается в пролиферативную фазу и держится на высоком уровне до тех пор, пока в кровообращении не появится прогестерон. После овуляции их уровень падает параллельно росту секреции прогестерона и относительному снижению уровня эстрадиола. Однако, что очень важно, не смотря на понижение общей внутриклеточной концентрации рецепторов прогестерона, их уровень в ядре к моменту имплантации (20 — 22 день) относительно повышается. Интересно отметить, что колебания уровней стероидных рецепторов в эндометрии женщины можно объяснить на основании принципов, открытых в опытах на лабораторных животных.
Рецепторы половых стероидов в клетках эндометрия женщины
Из сказанного выше ясно, что кроме метаболического действия, в общебиологическом плане фолликулярная секреция эстрогенов совершенно необходима для создания условий для нормальной рецепции эндометрием прогестерона в фазу желтого тела и для нормальной имплантации.
Действие прогестерона в секреторную фазу цикла:
1) Он может влиять на динамику собственных рецепторов и рецепторов эстрадиола.
2) Может быть, самое важное в смысле регуляции то, что растущие титры прогестерона могут влиять на генную экспрессию, индуцированную соединением комплекса эстрадиоловый рецептор — эстроген с хроматином ядра. Кроме изменения эстроген-индуцированной транскрипции, могут происходить изменения на уровне связанной с ней трансляции.
3) Собственные эффекты прогестерона, связанные со специфическими для него регуляторными факторами.
Общим результатом действия прогестерона во вторую фазу цикла является прогрессирующая дифференцировка клеток и завершение подготовки к приему бластоцисты. Эстрогены в эту фазу могут оказывать лишь модулирующее влияние на генную экспрессию обусловленную прогестероном.
Крайне сложную динамику стероидных рецепторов эндометрия при подготовке его к приему бластоцисты продемонстрировали исследования Martel и Psychoyos (1976, мышь). Они показали, что в преимплантационном периоде динамика комплексов эстроген-рецептор имеет четко выраженный циркадный ритм с максимальной концентрацией комплексов в ядре в полночь и минимальной концентрацией в полдень. Каждую ночь происходит как бы подзарядка ядра комплексами эстроген-рецептор, причем ночная концентрация комплексов в ядре может превышать дневную на 200%. Циркадная динамика стероидных рецепторов эндометрия женщины в периимплантационном периоде пока не изучена.
Кроме стероидных гормонов, важную роль в имплантации могут играть и некоторые другие гормоны. Так, пролактин тоже является гормоном поздней лютеиновой фазы и ранней беременности. Известно, что он синтезируется предецидуальными и децидуальными клетками эндометрия женщины независимо от присутствия зародыша (74). Высокими уровнями пролактина в лютеальную фазу объяснялось бесплодие у некоторых нормально овулирующих женщин (89). Возможно, он участвует в предотвращении иммунной реакции матери в ответ на зародыш (36). Фолликул, желтое тело и эндометрий женщины производят и релаксин. Концентрация его в перитонеальной жидкости очень высока между пятым и десятым днями после овуляции (119), а пролактин, возможно, является его антагонистом в действии на миометрий (12). Релаксин определяется в сыворотке крови в раннюю беременность, но роль его в имплантации не ясна (88).
Что касается простагландинов матки, то отношение простагландин E/простагландин F в пролиферативную фазу приблизительно равно единице, а в секреторную фазу этот индекс значительно повышается как в эндометрии, так и в миометрии (36). Кроме своего действия на сократимость матки, простагландины могут выполнять и другие функции. Они могут быть связаны о образованием децидуальных клеток, так как чувствительность матки к децидуогенным стимулам изменяется параллельно росту концентрации простагландина Е2. Простагландины Е и/или I повышают проницаемость сосудов эндометрия. Роль простагландинов в имплантации пока не ясна. У разных млекопитающих в разных концентрациях они могут оказывать как благоприятное, так и неблагоприятное действие на имплантацию.
Вместе с гистамином они могут повышать проницаемость капилляров матки в месте имплантации (34). Они могут участвовать и в освобождении бластоцисты от прозрачной оболочки (6). Простагландин Е, вероятно оказывает в месте имплантации неспецифическое иммуносупрессивное действие, защищающее зародыш. Это действие не связано с влиянием на сократимость матки (44).
Имплантация сопровождается изменениями стромы эндометрия. После адгезии бластоцисты в месте непосредственной близости к зародышу повышается проницаемость капилляров, развивается отек стромы, и повышается напряжение кислорода. Децидуальная трансформация начинает проявляться лишь на самых поздних стадиях имплантации у человека. У человека, как и у большинства других видов, децидуальная трансформация развивается вначале в непосредственной близости к бластоцисте и зависит от стимула со стороны бластоцисты (41). В физиологических условиях обязательным посредником в передаче децидуогенного сигнала зародыша строме является эпителий эндометрия. Децидуогенный сигнал бластоцисты может быть кратковременным. Однако запущенный им метаболический сигнал эпителия, передающий приказ о запуске децидуальной реакции строме, должен поддерживаться несколько часов. Роль химического посредника между эпителием и стромой в децидуальной реакции играют, видимо, гистамин и/или простагландины (66).
В течение всего прогестационного периода между бластоцистой и организмом матери идет обмен информацией, модулирующий как поведение и развитие бластоцисты, так и распознавание беременности организмом матери. Природа этих сигналов мало изучена и включает в себя пиноцитоз, непосредственный контакт, гормональные сигналы. Еще в преимплантационном периоде бластоциста начинает секретировать ХГ, поступающий в материнский кровоток до имплантации. Пока не известно, идентичен ли ХГ т. н. "фактору ранней беременности" (11), который подавляет реакцию розеткообразования лимфоцитов матери и позволяет диагностировать зачатие до имплантации. Расшифровка механизмов взаимодействия зародыша и материнского организма в преимплантационном периоде дело будущего.
Определенное значение в обеспечении нормальной имплантации может иметь двигательная активность миометрия, которая может быть локальной или распространяться вниз по миометрию. Вероятно, один водитель ритма вызывает серии разрядов с интервалами в несколько секунд, в то время как другой контролирует число разрядов в каждой серии. Частота серий определяет частоту сокращений, а число разрядов в каждой серии — их интенсивность. Локальная моторика небеременной матки характеризуется высокой частотой, низким активным давлением и нерегулярностью сократительных циклов.
Успешная пересадка бластоцисты в матку возможна, как правило, только в ночные часы (лучше в полночь) (34). Это может быть связано с циркадным ритмом моторики миометрия, а также с циркадными ритмами динамики стероидных рецепторов, выработки ХГ, кортикостероидов, простагландинов, пролактина, покоем центральной нервной системы. На спонтанную моторику миометрия могут оказывать влияние многочисленные внешние факторы: боль, страх, половое возбуждение, оргазм, волнение (36). Нарушение имплантации при стрессе (и при эмоциональном бесплодии ?) может быть связано с выбросом пролактина.
Практически не изучены иммунофизиология и иммунопатология имплантации. Понятно, что иммунологические факторы могут влиять на успешность репродуктивного процесса на многих этапах прогестации, но механизмы иммунного распознавания и иммунной защиты зародыша пока не раскрыты. Видимо, иммунное узнавание зародыша необходимо для включения иммунной защиты. Любопытные данные были получены при изучении хаттеритов, инбредного человеческого изолята, в котором запрещена контрацепция, и который характеризуется высокой плодовитостью и большими размерами семьи. Было установлено, что в семьях, в которых у супругов общие HLA А и HLА В антигены, репродуктивные показатели были хуже, чем в семьях, в которых у супругов эти антигены 6ыли различны. Авторы предполагают, что совместимые в иммунном отношении плоды могут не вызвать иммунного ответа матери, направленного на защиту плода, хотя при трактовке данных нужно быть очень осторожным (83).
Прогестероновый рецептор. Строение и функция
Как и в случае с эстрогеновыми рецепторами (ЭР), описаны две основные формы прогестероновых рецепторов (ПР) — ПР-А и ПР-В. Кодируются они одним и тем же геном. Они имеют идентичное строение, за исключением дополнительной N-терминальной 164-аминокислотной последовательности у ПР-В, именуемой В-апстрим-сегментом (BUS). ПР-А имеет молекулярную массу 94 кДа и содержит 768 аминокислот; ПР-В — молекулярную массу 114 кДа и 933 аминокислоты. Эти две формы происходят от двух отдельных эстрогенрегулируемых промоторов.
Домен функции транскрипции (TAF-1) прогестероновый рецептор (ПР) расположен на 91-аминокислотном сегменте регуляторного региона, a TAF-2 — на гормонсвязывающем домене. У ПР-В BUS содержит третий домен активации — TAF-3, который может либо усиливать действие TAF-1 и TAF-2, либо самостоятельно активировать транскрипцию. TAF-3 рекрутирует отдельный набор коактиваторов, которые не обладают способностью эффективно взаимодействовать с ПР-А, и инициирует их связывание с ПР-В.
Таким образом, прогестероновый рецептор-А (ПР-А) и прогестероновый рецептор-В (ПР-В) обладают разными трансактивационными свойствами, которые являются специфичными как по отношению к клетке, так и по отношению к промотору гена-мишени. Изоформы ПР-А и ПР-В в отсутствие связывания с лигандом четко локализованы в клетке: ПР-А — преимущественно в ядре, а ПР-В — в цитоплазме.
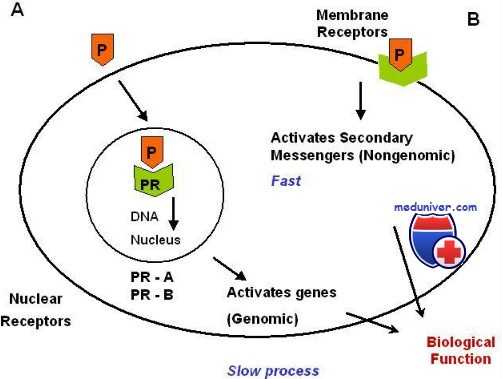
Значение изоформ прогестероновых рецепторов (ПР) до сих пор неясно. Селективное выключение экспрессии ПР-А у мышей вызвало грубые нарушения функции яичников и матки, приведшие к бесплодию, но не повлияло на чувствительность к прогестерону молочных желез и тимуса. Выключение же экспрессии ПР-В не влияет на чувствительность яичника, матки и тимуса к прогестерону, но проявляется недоразвитием млечных протоков.
Таким образом, прогестероновые рецепторы-А (ПР-А) необходимы для обеспечения фертильности женщин; в отсутствие прогестеронового рецептора-А (ПР-А) прогестеронового рецептора-B (ПР-B) функционируют тканеспецифично, опосредуя некоторые эффекты прогестерона в тканях молочных желез. Однако трансгенные мыши — носители избыточной копии гена ПР-А — демонстрировали патологию развития молочных желез, что свидетельствует о возможном физиологическом значении гиперэкспрессии ПР-А.
Относительные уровни двух изоформ в эндометрии различны в разные фазы менструального цикла. В матке прогестерон угнетает действие белков остановки клеточного цикла, стимулируя при этом факторы роста и рецепторы к ним, а также другие регуляторы; кроме того, он необходим для возникновения и сохранения беременности. Антагонист прогестерона RU-486 (мифепристон) первоначально был синтезирован как антагонист глюкокортикоидных рецепторов, но впоследствии выяснилось, что он оказывает выраженное антипрогестероновое действие.
Аффинность его связывания с глюкокортикоидным рецептором в 3 раза превышает аффинность дексаметазона, а связывания с прогестероновым рецептором — в 5 раз превышает аффинность эндогенного прогестерона. В противоположность прогестерону комплекс RU-486-ПР ингибирует транскрипцию благодаря тому, что у него имеются несколько иные конформационные изменения в домене TAF-2. При возникновении имплантации он негативно регулирует активируемые прогестероном гены, что приводит к некрозу децидуальной оболочки и отделению продуктов зачатия.
Взаимодействие стероидного гормона с клеткой. Биологическая активность гормона
Ядерные рецепторы к стероидным гормонам известны как лигандзависимые факторы транскрипции. Не связанные с лигандами рецепторы могут находиться либо в цитоплазме (например, рецептор к глюкокортикоидам), либо в ядре (например, рецепторы к эстрогену, прогестерону и гормонам щитовидной железы). Для большинства стероидных гормонов не связанные с лигандом рецепторы находятся в клеточном ядре в виде олигомеров с большой молекулярной массой (300 кДа, скорость оседания 7-10 с) и могут быть изолированы в цитозольной фракции от клеток и тканей, разрушенных в гипотонической среде.
Олигомеры образуются за счет нековалентной связи мономерного рецептора протеина с димером белка теплового шока (HSP90, HSP70 или HSP56).
Стероидные гормоны, легко проникая через клеточную мембрану, связываются со специфическими рецепторами ядра. Лиганд, связывающийся с рецептором, запускает его трансформацию — так называемый процесс активации. В процессе активации рецептор изменяет свою конформацию; в итоге это выражается в его отделении от белка теплового шока, который освобождает ДНК-связывающий участок. После этого происходит ядерная транслокация и димеризация активированного рецептора.
К настоящему времени накоплены данные, указывающие на термодинамическую необратимость этого процесса. Комплекс гормон-рецептор после этого связывается со специфическим регионом ДНК, так называемым гормонспецифичным элементом (ГСЭ), который расположен выше (upstream) гена. Первый ГСЭ был идентифицирован для глюкокортикоидного рецептора. Позднее выяснилось, что ГСЭ для прогестеронового, андрогенового, эстрогенового и минералокортикоидного рецепторов сходны с таковым для глюкокортикоидного рецептора.
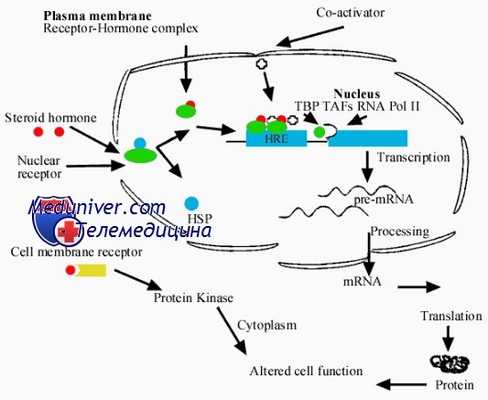
Стероидные ГСЭ генов-мишеней представляют собой палиндромные (с инвертированными повторами) последовательности ДНК из 15 нуклеотидных пар. Эта связь привлекает множество вспомогательных факторов, известных как корегуляторы (коактиваторы или корепрессоры), которые создают благоприятные (или неблагоприятные) для транскрипции условия в промоторной области и взаимодействуют с другими общими факторами транскрипции и РНК-полимеразой II. Коактиваторы можно представить как адаптеры на пути передачи сигнала.
Связывание с корегуляторами модулирует последующую транскрипцию, т.е. активацию и инактивацию специфических генов.
Например, антагонисты гормонов вызывают изменение конформации TAF-2, что закрывает коактиваторсвязывающий участок, вместо него давая путь корепрессору, что приводит к угнетению экспрессии гена. Содержание этих корегуляторов в разных тканях играет важную роль в определении реакции этих тканей на агонисты или антагонисты стероидных гормонов.
Биологическая активность гормона определяется по меньшей мере четырьмя факторами, тесно связанными со строением рецептора к данному гормону. Первый — родство гормона к гормонсвязывающему домену рецептора. Второй — различная экспрессия подтипов рецептора в ткани-мишени, изменяющая чувствительность к одному и тому же гормону. Третий — конформация лигандрецепторного комплекса и ее влияние на последующую димеризацию и модуляцию адаптерных протеинов. И наконец, четвертый — различная экспрессия адаптерных белков тканями-мишенями и разная степень фосфорилирования.
Более высокая концентрация коактиваторов или корепрессоров в ткани-мишени может оказывать влияние на клеточный ответ этой ткани на один и тот же лиганд. Фосфорилирование рецептора протеинкиназами повышает транскрипционную активность рецептора.
Ядерные рецепторы к стероидным гормонам: эстрогеновые, прогестероновые, андрогеновые
Ядерные рецепторы к стероидным гормонам (эстрогеновый рецептор — ЭР, прогестероновый рецептор и андрогеновые рецепторы) представляют собой лиганд-индуцируемые факторы транскрипции, которые регулируют экспрессию генов-мишеней, ответственных за процессы репродукции и метаболизма. Они принадлежат к надсемейству ядерных гормональных рецепторов и во многом сходны по своей структуре и функции. К другим представителям этого надсемейства относятся рецепторы к глюкокортикоидам, минералокортикоидам, гормонам щитовидной железы, 1,25-гидроксивитамину D3, ретиноевой кислоте, а также рецепторы-сироты, количество которых все возрастает, но при сходной структуре их лиганд до сих пор не найден.
Внутри надсемейства ядерных рецепторов выделяют три основные группы на основании характеристик их функции и распознавания: 1-й тип (подкласс стероидных рецепторов), 2-й тип (подкласс тиреоидных/ретиноидных/D3-рецепторов) и 3-й тип (подкласс рецепторов-сирот).
Рецепторы 1-го типа (стероидные, или классические). К ним относятся ЭР, а также рецепторы к прогестерону, андрогенам, глюкокортикоидам и минералокортикоидам. Они не могут связываться с ДНК в отсутствие лиганда и, таким образом, остаются функционально немыми. Рецепторы представлены цитоплазматическими/ ядерными многомерными комплексами, ассоциированными с белками теплового шока (например, HSP90, HSP70 и HSP56). Для активации рецептора необходимы связывание с ним лиганда и диссоциация белков теплового шока.
Рецепторы 2-го типа. К ним относятся рецепторы к гормонам щитовидной железы, витамину D3 и ретиноевой кислоте, а также ретиноид-Х-рецептор. В отсутствие лиганда эти рецепторы способны связываться с ДНК и оказывать репрессорный эффект или подавлять соответствующие промоторы. В отличие от стероидных рецепторов, рецепторы 2-го типа связываются только с элементами отклика и способны к образованию гетеродимеров с ретиноид-Х-рецептором. Такие взаимодействия могут модулировать интенсивность транскрипционной реакции на лиганд.
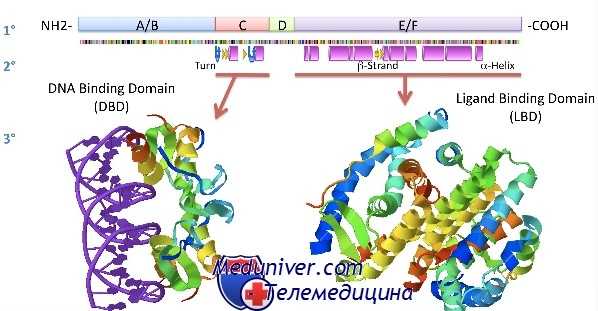
По большей части наши представления о механизме действия стероидных гормонов формировались на основании результатов исследований in vitro и in vivo, в которых в качестве лиганда использовался меченый радиоактивный эстрадиол. Роль ЭР в развитии рака молочной железы была хорошо изучена за последние 40 лет; ЭР был первым стероидным рецептором, описанным в начале 1960-х гг. Эти исследования позволили раскрыть многие общие механизмы действия стероидных гормонов. Говоря в общем, у всех ядерных рецепторов имеется сходная протеиновая архитектура — они состоят из пяти функциональных доменов, как показано на рис. 2-10, а.
Домен N-терминальной трансактивации (А/В-регион). Этот домен в семействе ядерных рецепторов наиболее вариабелен с точки зрения последовательности и длины. Он может содержать от 20 (рецептор к витамину D3) до 600 аминокислотных остатков (рецептор к минералокортикоидам). Обычно он содержит так называемую функцию активации транскрипции (TAF-1), которая взаимодействует с другими компонентами ядерного транскрипционного аппарата (например коактиваторами), чтобы запустить транскрипцию целевого гена.
Центральный ДНК-связывающий домен (С-регион). Регион, совершенно необходимый для активации транскрипции. Он кодирует два мотива типа «цинкового пальца» и характеризуется самой высокой степенью гомологичности среди всех ядерных рецепторов. Связывание гормона с рецептором вызывает специфические конформационные изменения этого региона, позволяющие рецептору связаться с гормонспецифичным элементом гена-мишени. Аминокислотная последовательность, расположенная между первым и вторым «цинковыми пальцами» (т.е. спираль распознавания), ответственна за создание специфического контакта с ДНК. Второй «цинковый палец» стабилизирует этот контакт и повышает аффинность рецептора к ДНК.
Скрепляющий регион (D-регион). Другое название этого региона — «шарнирный регион» — указывает на то, что именно в этом месте происходит вращение, позволяющее белку изменить свою конформацию после связывания с лигандом. Этот регион генерирует локационный сигнал, важный для перемещения рецептора к ядру в отсутствие лиганда, и содержит домен локализации ядра (глюкокортикоидный и прогестероновый рецепторы) и/или домен трансактивации (рецептор к гормонам щитовидной железы или к глюкокортикоидам).
Домен С-терминального связывания лиганда (Е-регион). Этот регион отвечает за связывание соответствующего лиганда и димеризацию или гетеродимеризацию рецептора. Он также содержит участок связывания белков теплового шока и функцию трансактивации (TAF-2), способную инициировать транскрипционную активность. В отличие от TAF-1, транскрипционная активность здесь зависит от связывания с гормоном. Конформационные изменения, произошедшие после связывания с лигандом, обеспечивают взаимодействие с коактиваторами или корепрессорами.
Исследование направлено на определение значения экспрессии прогестероновых рецепторов в опухолевом узле для лечения и прогноза рака яичников. Так, экспрессия прогестероновых рецепторов в эндометриоидных карциномах яичников сопряжена с благоприятным прогнозом опухолевого процесса, поскольку выживаемость этих больных значительно выше (5-летняя выживаемость равна 73,3% больных). Прогестероновые рецепторы в раковых клетках диагностируются преимущественно в высокодифференцированных эндометриоидных карциномах яичников. В случае выявления прогестерон-позитивных опухолей больным показано назначение химио- и гормонотерапии в составе комбинированного лечения, поскольку отмечается большая эффективность при меньшем количестве курсов лечения.
1. Колосов А.Е., Новичков Е.В., Вотинцев А.А. Плоидометрические и иммуногистохимические сопоставления в практике доклинической диагностики рецидива рака яичника // Российские медицинские вести. - 2006. - Т. 11, № 1. - С. 46-49.
2. Новичков Е.В., Вотинцев А.А. Зависимость прогноза рака яичников от экспрессии рецепторов к половым гормонам и пролиферативной активности опухолевых клеток // Архив патологии. - 2006. - Т. 68, № 2. - С. 10-13.
3. Новичков Е.В., Новичкова О.Н. Морфологическая характеристика и прогноз рецидива эндометриоидного рака яичников // Уральский медицинский журнал. - 2008. - № 5. - С. 75-78.
4. Сулейманова Н.Д. Факторы риска злокачественных новообразований женских половых органов (обзор литературы) // Вестник новых медицинских технологий. - 2014. - Т. 21, № 1. - С. 115-121.
5. Ткаля Ю.Г., Воробьева Л.И., Свинцицкий В.С., Неспрядько С.В., Турчак А.В., Гончарук И.В., Лукьянова Н.Ю., Чехун В.Ф. Клиническое значение экспрессии VEGF у больных серозным раком яичника в зависимости от гормонального рецепторного статуса опухоли // Здоровье женщины. - 2014. – Т. 6, № 92. - С. 169.
6. Cui J., Miner B.M., Eldredge J.B., Warrenfeltz S.W., Dam P., Xu Y., Puett D. Regulation of gene expression in ovarian cancer cells by luteinizing hormone receptor expression and activation // BMC Cancer. - 2011. - Vol. 11. - P. 280.
7. Sieh W., McGuire V., Rothstein J.H., Whittemore A.S., Longacre T.A., Köbel M., Bowtell D.D., Fereday S., George J., Galletta L., Chow C., deFazio A., Goodman M.T., Thompson P.J., Høgdall E., Kjær S.K., Jensen A., Deen S., Wentzensen N., Brinton L.A. et al. Hormone-receptor expression and ovarian cancer survival: an ovarian tumor tissue analysis consortium study // The Lancet Oncology. - 2013. - Vol. 14, № 9. - P. 853-862.
8. Tangjitgamol S., Manusirivithaya S., Khunnarong J. et al. Expressions of estrogen and progesterone receptors in epithelial ovarian cancer: a clinicopathologic study // Int. J. Gynecol. Cancer. - 2009. - Vol. 19, № 4. - P. 620-627.
9. Yang X.Y., Xi M.R., Yang K.X. et al. Prognostic value of estrogen receptor and progesterone receptor status in young Chinese ovarian carcinoma patients // Gynecol. Oncol. - 2009. - Vol. 113, № 1. - P. 99-104.
В последние годы во всём мире наблюдается рост заболеваемости раком яичников. Патогномоничной чертой овариальных злокачественных неоплазм следует отметить то, что они развиваются в гормонально зависимом органе. Большинство отечественных и зарубежных исследователей указывают на важную роль в потенцировании и дальнейшем канцерогенезе состояние прогестероновых рецепторов, которым приписывается основная роль в регуляции процессов пролиферации и дифференцировки клеток карцином женских гонад [4; 9]. Гормональное воздействие и гормональная регуляция органов женской половой системы обусловлены наличием в них стероидных рецепторов. Известно, что проникая через клеточные мембраны, прогестерон взаимодействует с рецепторами, расположенными на ядерной мембране, индуцируя, в том числе, и геномные эффекты [1]. Туморозные клетки, в которых не диагностируются рецепторы прогестерона, не могут быть подвергнуты воздействию гормонов, циркулирующих в крови. Наряду с этим мировой опыт убеждает в том, что даже при наличии в клетках карцином рецепторов к стероидным гормонам необязательно доказывает чувствительность их к химиотерапии [5].
В последнее время многие ученые большое внимание уделяют характеристикам рецепторного статуса гистологических компонентов опухолевого узла, который влияет на особенности лечения онкологического заболевания и прогноз для больных. Так, отмечается меньшая чувствительность к действию химиотерапии у пациенток с раком яичников при отсутствии рецепторов к прогестерону и андрогену в клетках карцином, чем в группе рецепторпозитивных новообразований. Также придаётся значение свойствам рецепторного статуса клеток овариальных новообразований в прогнозе рецидивирования и метастазирования неоплазмы [3]. При этом преимущественно используются биохимические методы гормональной оценки рецепторного статуса опухолей. Однако, по мнению ведущих онкоморфологов, стандартные биохимические методы исследования рецепторов к женским половым гормонам коррелируются с их иммуногистохимическим выявлением в 85-95% случаев. Сегодня очевидно, что иммуногистохимический метод определения экспрессии рецепторов к женским половым гормонам более объективно отражает состояние рецепторного статуса рака яичников, чем биохимическое исследование гомогенатов опухолевой ткани [3].
Цель исследования
Цель настоящего исследования направлена на определение значения экспрессии прогестероновых рецепторов в опухолевом узле для лечения и прогноза рака яичников.
Материалы и методы исследования
Для исследования использовали операционно-биопсийный материал 76 случаев злокачественных опухолей яичников эпителиального происхождения, у которых клинически была установлена I-III стадии процесса (включая TIcN0M0 и T3а-сN1M0 стадии по классификации TNM), первично леченных в Кировском областном клиническом онкологическом диспансере и в Республиканском клиническом онкологическом диспансере г. Чебоксары с 1991 по 2007 г. Использовались клинические истории болезни, операционные журналы, амбулаторные карты и сведения об отдалённых результатах наблюдения за больными раком яичников. Во всех случаях препараты для гистологического исследования толщиной 5 мкм окрашивались гематоксилином и эозином. Гистологическая форма неоплазм определялась в соответствии с рекомендациями Международной гистологической классификации опухолей яичников, степень дифференцировки опухоли устанавливалась в соответствии с критериями Browders. Также проводилось иммуногистохимическое фенотипирование рецепторного статуса опухолей с помощью моноклональных антител PR (Novocastro) в разведении 1:100 соответственно. В качестве системы визуализации реакции использовался диаминобензидин (ДАБ). Лечение всех 76 пациентов было одинаковым и заключалось в сочетании циторедуктивной операции (экстирпация или ампутация матки с придатками и резекцией сальника), с несколькими курсами (от 4 до 8 курсов) химиотерапии (цисплатин, 5-фторурацил, циклофосфан) и гормонотерапии (тамоксифен).
Результаты исследования и их обсуждение
В группу наблюдения вошли больные в возрасте от 43 до 63 лет. В ходе иммуногистохимического исследования мы установили наличие экспрессии антител к рецепторам прогестерона в 15 (19,7%) новообразованиях эндометриоидного гистотипа, в то время как отсутствие рецепторов к прогестерону диагностировано в туморозных узлах 61 (80,3%) пациентки без учета степени гистологической зрелости карциномы и возраста женщины.
При анализе зависимости экспрессии рецепторов к прогестерону в эндометриоидных раках яичников от возраста больных констатировали, что в группе прогестероннегативных опухолей средний возраст пациенток установлен в пределах 57 ± 5,2 года, в то время как в группе прогестерон-позитивных раков чаще встречались молодые женщины и средний возраст их колебался около 49 ± 5,9 года.
Сопоставляя степень гистологической дифференцировки эндометриоидных злокачественных опухолей яичников с наличием в раковых клетках рецепторов к прогестерону, мы визуализировали следующие показатели (табл. 1).
Сравнение степени дифференцировки серозных опухолей с наличием в них прогестероновых рецепторов
Читайте также:
- Прямая ларингоскопия. Шпатель-ларингоскоп
- Зубной сосочек эмбриона. Образование дентина плода
- Вспомогательные репродуктивные технологии (ВРТ). ЭКО, перенос гамет и зигот
- Показания к радикальному лечению множественного рака желудка. Гистология множественного рака желудка
- Диагностика мицетомы. Лечение и профилактика мицетомы
