Рабдомиолиз
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Острый рабдомиолиз – драматичное внезапное разрушение мышечных волокон скелетных мышц. К генетическим этиологическим факторам относят: метаболические расстройства, сопровождаемые дефицитом окисления жирных кислот, дефицитом липина-1, аномалии гликогенолиза и гликолиза, реже – дефицит митохондриальной дыхательной цепи, дефицит пурина и пероксизмальный дефицит α-метил-ацил-КоА-рацемазы (α-methyl-acyl-CoA-acemase, AMACR); структурные патологии в рамках дистрофинопатий и миопатий; аномалии кальциевого обмена с мутациями в гене RYR1; воспалительные реакции, ассоциированные с миозитом. Независимо от причины, дефицит аденозинтрифосфата в миоците приводит к повышению содержания внутриклеточного кальция и некрозу мышечных волокон. Провоцирующим фактором рабдомиолиза могут быть экзогенные факторы, среди которых травматизация мышц является самой частой причиной рабдомиолиза метаболического генеза. В случае лихорадки следует учитывать 2 фактора: повышение температуры тела и существование провоспалительных цитокинов. В статье описан случай рабдомиолиза у 3 детей от близкородственного брака, спровоцированный гипертермией и вызванный дефицитом альдолазы А, не сопровождаемой гемолитической анемией. В рассматриваемом случае миоглобинурия была всегда вызвана фебрильной температурой. В свою очередь, фермент альдолаза-А обладает тканеспецифичной термолабильностью: при тестируемых температурах он обнаружен в миобластах, но не в эритроцитах, что объясняет специфическую симптоматику у описываемых пациентов. Существуют предположения, что в клеточной липотоксичности участвуют так называемые жировые капли. В ходе исследований in vitro дефицит альдолазы А был возмещен добавлением аргинина. Другие типы рабдомиолиза метаболического генеза, вероятно, являются провоспалительными заболеваниями.
перевод: Мария Олеговна Ковальчук
Ключевые слова
Об авторах
Inserm U781, Institut Imagine des Maladies Génétiques, Université Paris Descartes, Centre de Référence des Maladies Héréditaires du Métabolisme
Франция
Hôpital Necker, AP-HP, Paris
Inserm U781, Institut Imagine des Maladies Génétiques, Université Paris Descartes, Centre de Référence des Maladies Héréditaires du Métabolisme
Франция
Hôpital Necker, AP-HP, Paris
Inserm U781, Institut Imagine des Maladies Génétiques, Université Paris Descartes, Centre de Référence des Maladies Héréditaires du Métabolisme
Франция
Hôpital Necker, AP-HP, Paris
Département de Biochimie, Toxicologie et Pharmacologie, CHU de Grenoble, Centre de Référence Rhône-Alpes des Maladies Neuromusculaires
Франция
Grenoble
Laboratoire Maladies Héréditaires du Métabolisme, Centre de Biologie et Pathologie Est, Hospices Civils de Lyon
Франция
Laboratoire Maladies Héréditaires du Métabolisme, Centre de Biologie et Pathologie Est, Hospices Civils de Lyon
Франция
Université Pierre et Marie Curie, UM 76, Inserm U974, CNRS UMR 7215, Institut de Myologie, GHU Pitié-Salpêtrière, AP-HP, Centre de Référence des Maladies Neuromusculaires
Франция
Paris
Список литературы
1. Sauret J.M., Marinides G., Wang G.K. Rhabdomyolysis. Am Fam Physician 2002;65(5):907– 12.
2. Brown C.V., Rhee P., Chan L. et al. Preventing renal failure in patients with rhabdomyolysis: do bicarbonate and mannitol make a difference? J Trauma 2004;56(6):1191–6.
3. Alpers J.P., Jones L.K. Jr. Natural history of exertional rhabdomyolysis: a populationbased analysis. Muscle Nerve 2010;42(4): 487–91.
4. Perreault S., Birca A., Piper D., et al. Transient creatine phosphokinase elevations in children: a single-center experience. J Pediatr. 2011 Oct;159(4):682–5.
5. Mackay M.T., Kornberg A.J., Shield L.K. et al. Benign acute childhood myositis: laboratory and clinical features. Neurology 1999;53(9):2127–31.
6. Zutt R., van der Kooi A.J., Linthorst G.E. et al. Rhabdomyolysis: review of the literature. Neuromuscul Disord 2014;24(8):651–9.
7. Tein I., DiMauro S., DeVivo D.C. Recurrent childhood myoglobinuria. Adv Pediatr 1990;37:77–117.
8. Tonin P., Lewis P., Servidei S. et al. Metabolic causes of myoglobinuria. Ann Neurol 1990;27(2):181–5.
9. Berardo A., DiMauro S., Hirano M. A diagnostic algorithm for metabolic myopathies. Curr Neurol Neurosci Rep 2010;10(2):118–26.
10. DiMauro S., Garone C., Naini A. Metabolic myopathies. Curr Rheumatol Rep 2010;12(5):386–93.
11. Laforêt P., Vianey-Saban C. Disorders of muscle lipid metabolism: diagnostic and therapeutic challenges. Neuromuscul Disord 2010;20(11):693–700.
12. Zeharia A., Shaag A., Houtkooper R.H. et al. Mutations in LPIN1 cause recurrent acute myoglobinuria in childhood. Am J Hum Genet 2008;83(4):489–94.
13. Michot C., Hubert L., Brivet M. et al. LPIN1 gene mutations: a major cause of severe rhabdomyolysis in early childhood. Hum Mutat 2010;31(7):E1564–73.
14. Michot C., Hubert L., Romero N.B. et al. Study of LPIN1, LPIN2 and LPIN3 in rhabdomyolysis and exercise-induced myalgia. J Inherit Metab Dis 2012;35(6):1119–28.
15. Kapina V., Sedel F., Truffert A. et al. Relapsing rhabdomyolysis due to peroxisomal alpha-methylacyl-coa racemase deficiency. Neurology 2010;75(14):1300–2.
16. Darras B.T., Friedman N.R. Metabolic myopathies: a clinical approach; part I. Pediatr Neurol 2000;22(2):87–97.
17. Quinlivan R., Jungbluth H. Myopathic causes of exercise intolerance with rhabdomyolysis. Dev Med Child Neurol 2012; 54(10):886–91.
18. Rosenberg H., Davis M., James D. et al. Malignant hyperthermia. Orphanet J Rare Dis 2007;2:21.
19. Shapiro M.L., Baldea A., Luchette F.A. Rhabdomyolysis in the intensive care unit. J Intensive Care Med 2012;27(6):335–42.
21. Luck R.P., Verbin S. Rhabdomyolysis: a review of clinical presentation, etiology, diagnosis, and management. Pediatr Emerg Care 2008;24(4):262–8.
22. Hotamisligil G.S., Shargill N.S., Spiegelman B.M. Adipose expression of tumor necrosis factor-alpha: direct role in obesitylinked insulin resistance. Science. 1993;259(5091):87–91.
23. Xu H., Barnes G.T., Yang Q. et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest 2003;112(12): 1821–30.
24. Weisberg S.P., McCann D., Desai M. et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003; 112(12):1796–808.
25. Molenaar J.P., Voermans N.C., van Hoeve B.J et al. Fever-induced recurrent rhabdomyolysis due to a novel mutation in the ryanodine receptor type 1 gene. Intern Med J 2014; 44(8):819–20.
27. Santos J. Jr. Exertional rhabdomyolysis. Potentially life-threatening consequence of intense exercise. JAAPA 1999;12(7):46–9, 53–5.
28. Hopkins P.M. Malignant hyperthermia: advances in clinical management and diagnosis. Br J Anaesth 2000;85(1):118–28.
29. Späte U., Schulze P.C. Proinflammatory cytokines and skeletal muscle. Curr Opin Clin Nutr Metab Care 2004;7(3):265–9.
30. Ostrowski K., Rohde T., Asp S. et al. Chemokines are elevated in plasma after strenuous exercise in humans. Eur J Appl Physiol 2001;84(3):244–5.
31. Chen X., Xun K., Chen L. et al. TNFalpha, a potent lipid metabolism regulator. Cell Biochem Funct 2009;27(7):407–16.
32. Feingold K.R., Grunfeld C. Tumor necrosis factor-alpha stimulates hepatic lipogenesis in the rat in vivo. J Clin Invest 1987;80(1):184–90.
33. Grunfeld C., Adi S., Soued M. et al. Search for mediators of the lipogenic effects of tumor necrosis factor: potential role for interleukin 6. Cancer Res 1990;50(14): 4233–8.
34. Vallerie S.N., Hotamisligil G.S. The role of JNK proteins in metabolism. Sci Transl Med 2010;2(60):60rv5.
35. Chen C.W., Lin J., Chu Y.W. iStable: offtheshelf predictor integration for predicting protein stability changes. BMC Bioinformatics 2013;14 Suppl 2:S5.
36. Yao D.C., Tolan D.R., Murray M.F. et al. Hemolytic anemia and severe rhabdomyolysis caused by compound heterozygous mutations of the gene for erythrocyte/muscle isozyme of aldolase, ALDO A(Arg303X/Cys338Tyr). Blood 2004;103(6):2401–3.
37. Michot C., Mamoune A., Vamecq J. et al. Combination of lipid metabolism alterations and their sensitivity to inflammatory cytokines in human lipin-1-deficient myoblasts. Biochim Biophys Acta 2013;1832(12):2103–14.
38. van Adel B.A., Tarnopolsky M.A. Metabolic myopathies: update 2009. J Clin Neuromuscul Dis 2009;10(3):97–121.
39. Kreuder J., Borkhardt A., Repp R. et al. Brief report: inherited metabolic myopathy and hemolysis due to a mutation in aldolase A. N Engl J Med 1996;334(17):1100–4.
40. Miwa S., Fujii H., Tani K. et al. Two cases of red cell aldolase deficiency associated with hereditary hemolytic anemia in a Japanese family. Am J Hematol 1981;11(4):425–37.
41. Beutler E., Scott S., Bishop A. et al. Red cell aldolase deficiency and hemolytic anemia: a new syndrome. Trans Assoc Am Physicians 1973;86:154–66.
42. Kishi H., Mukai T., Hirono A. et al. Human aldolase A deficiency associated with a hemolytic anemia: thermolabile aldolase due to a single base mutation. Proc Natl Acad Sci USA 1987;84(23):8623–7.
43. Pacheco P., Vieira-de-Abreu A., Gomes R.N. et al. Monocyte chemoattractant protein-1/CC chemokine ligand 2 controls microtubule-driven biogenesis and leukotriene B4-synthesizing function of macrophage lipid bodies elicited by innate immune response. J Immunol 2007;179(12):8500–8.
44. Gomes R.N., Figueiredo R.T., Bozza F.A. et al. Increased susceptibility to septic and endotoxic shock in monocyte chemoattractant protein 1/cc chemokine ligand 2-deficient mice correlates with reduced interleukin 10 and enhanced macrophage migration inhibitory factor production. Shock 2006;26(5):457–63.
45. Beernink P.T., Tolan D.R. Subunit interface mutants of rabbit muscle aldolase form active dimers. Protein Sci 1994;3(9):1383–91.
46. Takahashi I., Takasaki Y., Hori K. Sitedirected mutagenesis of human aldolase isozymes: the role of Cys-72 and Cys-338 residues of aldolase A and of the carboxyterminal Tyr residues of aldolases A and B. J Biochem 1989;105(2):281–6.
47. Tsantes A.E., Bonovas S., Travlou A. et al. Redox imbalance, macrocytosis, and RBC homeostasis. Antioxid Redox Signal 2006;8 (7–8):1205–16.
48. Marinkovic D., Zhang X., Yalcin S. et al. Foxo3 is required for the regulation of oxidative stress in erythropoiesis. J Clin Invest 2007;117(8):2133–44.
50. Crawford J.H., Isbell T.S., Huang Z. et al. Hypoxia, red blood cells, and nitrite regulate NO-dependent hypoxic vasodilation. Blood 2006;107(2):566–74.
51. Berendse K., Ebberink M.S., Ijlst L. et al. Arginine improves peroxisome functioning in cells from patients with a mild peroxisome biogenesis disorder. Orphanet J Rare Dis 2013;8:138.
52. Roth S.D., Schüttrumpf J., Milanov P. et al. Chemical chaperones improve protein secretion and rescue mutant factor VIII in mice with hemophilia A. PLoS One 2012;7(9):e44505.
53. Senesi P., Luzi L., Montesano A. et al. Betaine supplement enhances skeletal muscle differentiation in murine myoblasts via IGF-1 signaling activation. J Transl Med 2013; 11:174.
Рабдомиолиз (миоглобинурия), ген LPIN1 м.
Рабдомиолиз – синдром, развивающийся вследствие повреждения поперечно-полосатой мускулатуры, что приводит к высвобождению продуктов распада миоцитов и, в результате, появлению в системном кровотоке свободного миоглобина.
Одной из причин возникновения рабдомиолиза могут быть метаболические миопатии – группа наследственных заболеваний, ведущим симптомом которых является миоглобинурия. Общей особенностью метаболических миопатий является дефицит доставки энергии к мышцам вследствие дефекта метаболизма глюкозы, гликогена, липидов и нуклеозидов, В результате в тканях обнаруживается дефицит АТФ, вследствие чего происходит распад мышечных клеток и в системном кровотоке появляется свободный миоглобин. Миоглобин — кислород-связывающий белок скелетных мышц и мышцы сердца. В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает. Миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови, крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию передачи кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Ген LPIN1 кодирует Липин-1, фосфатидную кислую фосфатазу, которая катализирует преобразование фосфатидной кислоты (phosphatidate) в диацилглицерол (DAG), из которого синтезируется триацилглицерол (TAG), то есть играет важную роль в метаболизме триглицеридов.
Острый рецидивирующий рабдомиолиз манифестирует в возрасте до 7 лет. Основными симптомами во время обострения являются миоглобулинурия, резкое повышение уровня креатинфосфокиназы, болезненность и слабость мышц, потемнение мочи, может выявляться повышенная чувствительность икроножных мышц. Основной причиной обострений являются острые респираторные и вирусные заболевания, так же влиять на ухудшение процесса могут стрессы, тяжелые физические нагрузки, некоторые лекарственные средства и диета. Между приступами клинические проявления заболевания не обнаруживаются.
*Заполнение «анкеты молекулярно-генетического исследования» необходимо для того, чтобы врач-генетик, на основании полученных результатов, во-первых, имел бы возможность выдать пациенту максимально полное заключение и, во-вторых, сформулировать для него конкретные индивидуальные рекомендации.
ИНВИТРО гарантирует конфиденциальность и неразглашение предоставляемой пациентом информации в соответствии с законодательством Российской Федерации.
Типичная клиническая картина, сопровождающаяся миоглобулинурией и резким повышением уровня креатинфосфокиназы.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
- Мутация не выявлена
- Мутация выявлена в гетерозиготном состоянии
- Мутация выявлена в гомозиготном состоянии
- Мутация выявлена в компаунд –гетерозиготном состоянии.
*Заполнение «анкеты молекулярно-генетического исследования» необходимо для того, чтобы врач-генетик, на основании полученных результатов, во-первых, имел бы возможность выдать пациенту максимально полное заключение и, во-вторых, сформулировать для него конкретные индивидуальные рекомендации. ИНВИТРО гарантирует конфиденциальность и неразглашение предоставляемой пациентом информации в соответствии с законодательством Российской Федерации.
Рабдомиолиз (миоглобинурия)
Рабдомиолиз – синдром, развивающийся вследствие повреждения поперечно-полосатой мускулатуры, что приводит к высвобождению продуктов распада миоцитов и, в результате, появлению в системном кровотоке свободного миоглобина.
Миоглобин — кислород-связывающий белок скелетных мышц и мышцы сердца. В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает. Миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови, крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Причины возникновения рабдомиолиза могут быть различны. Одной из таких причин могут быть метаболические миопатии – группа наследственных заболеваний, ведущим симптомом которых является миоглобинурия. Общей особенностью метаболических миопатий является дефицит доставки энергии к мышцам вследствие дефекта метаболизма глюкозы, гликогена, липидов и нуклеозидов, в результате в тканях обнаруживается дефицит АТФ, вследствие чего происходит распад мышечных клеток.
К группе метаболических миопатий, главным симптомом которых является миоглобинурия, относят рабдомиолиз острый рецидивирующий (миоглобинурия семейная пароксизмальная OMIM 268200), болезнь Мак-Ардла (OMIM 232600) , дефицит карнитин-пальмитоил-трансферазы (OMIM 255110, 255120).
Рабдомиолиз острый рецидивирующий – аутосомно-рецессивное заболевание, вызванное мутациями в гене LPIN1. Ген LPIN1 кодирует Липин-1, фосфатидную кислую фосфатазу, которая катализирует преобразование фосфатидной кислоты (phosphatidate) в диацилглицерол (DAG), из которого в последствии синтезируется триацилглицерол (TAG), то есть играет важную роль в метаболизме триглицеридов. Острый рецидивирующий рабдомиолиз манифестирует в возрасте до 7 лет. Основными симптомами во время обострения являются миоглобулинурия, резкое повышение уровня креатинфосфокиназы, болезненность и слабость мышц, потемнение мочи, может выявляться повышенная чувствительность икроножных мышц. Основной причиной обострений являются острые респираторные и вирусные заболевания, так же влиять на ухудшение процесса могут стрессы, тяжелые физические нагрузки, некоторые лекарственные средства и диета. Между приступами клинические проявления заболевания не обнаруживаются.
Дифференциальная диагностика данного заболевания основывается на исключении всех ненаследственных видов рабдомиолиза, исследование уровня гликогена исключает болезнь Мак-Ардла, исследование уровней пальмитоилкарнитина и омоилкарнитина исключает дефицит карнитин-пальмитоил-трансферазы.
В Центре Молекулярной Генетики проводится поиск мутаций в кодирующей последовательности гена LPIN1 методом прямого автоматического секвенирования.
При проведении пренатальной (дородовой) ДНК-диагностики в отношении конкретного заболевания, имеет смысл на уже имеющемся плодном материале провести диагностику частых анеуплоидий (синдромы Дауна, Эдвардса, Шерешевского-Тернера и др), пункт 54.1. Актуальность данного исследования обусловлена высокой суммарной частотой анеуплоидий - около 1 на 300 новорожденных, и отсутствием необходимости повторного забора плодного материала.
Рабдомиолиз
Рабдомиолиз – последняя стадия миопатии, при которой возникает деструкция мышечной ткани на клеточном уровне, повышается концентрация уровня миоглобина и креатинкиназы, развивается внезапная почечная недостаточность.
Причины
Миоглобин является токсичным веществом, особенно, когда он массово загрязняет кровь. Естественно, его присутствие негативно отображается на обменных процессах.
- появление пролежней в результате длительного сдавливания тканей;
- генетические наследственные особенности;
- вирусно-бактериальные заболевания, при которых повышается температура тела;
- побочное действие некоторых лекарственных препаратов;
- сильные ожоги;
- физическое переутомление.
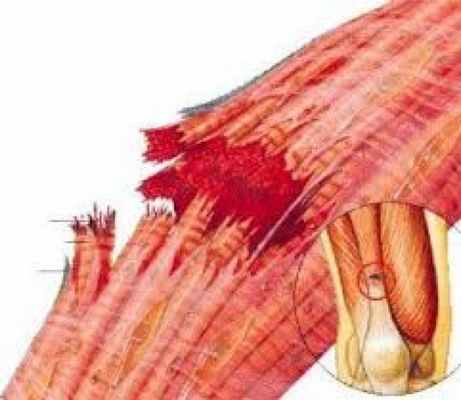
Проявление рабдомиолиза
Основные виды патологии:
- гипогликемия гипокетотическая;
- рабдомиолиз рецидивирующий;
- миопатия с дефицитом карнитин-пальмитоилтрансферазы второго типа.
Симптомы
На начальной стадии развития недуга люди жалуются на местный отек, вслед за которым появляются болевые ощущения в мышцах, ограничивающие движения исключительно в пораженном участке, а впоследствии становятся тотальными и часто приводят к параличу. Наряду с этим могут появиться и другие признаки:
- слабость; ;
- болезненные ощущения в пояснице.
Моча обычно приобретает темный окрас. Ее объем значительно уменьшается и через некоторое время мочеотделение прекращается. В результате развивается почечная недостаточность. При обнаружении одного из указанных проявлений нужна консультация невролога или ортопеда.

Деструкция мышечной ткани на клеточном уровне
Диагностика
На консультации доктор осмотрит больного, выслушает его жалобы, изучит симптоматику и даст рекомендации. В обязательном порядке следует сдать кровь и мочу на анализ. С целью дифференциации недуга показаны электромиография и биопсия.
Лечение
Домашний покой, обильное питье, применение методов регидратации – лечебная терапия при легкой форме заболевания. Интенсивный мониторинг уровня pH мочи, электролитов, а также кислотно-щелочного баланса, ЭКГ-показателей показан при тяжелой форме патологии.
Внутривенные капельницы с применением физраствора делаются, чтобы не допустить появления шокового состояния, увеличить движение жидкости в почках, снизить концентрацию токсинов. Использование фуросемида и маннитола предполагает увеличение осмоса и уменьшение повреждения почек.
В случае наличия осложнения в виде диссеминированного внутрисосудистого свертывания крови, прописывается переливание замороженной плазмы.
Хирургическое вмешательство выполняется в зависимости от тяжести патологического процесса. При сильном сдавливании тканей назначается фасциотомия.
Профилактика
С целью предупреждения развития заболевания, следует своевременно лечить травмы мышц.
Статин-ассоциированный рабдомиолиз у женщины 60 лет с декомпенсированным сахарным диабетом 2 типа
Рабдомиолиз является редкой и тяжелой формой статин-ассоциированного повреждения мышц, характеризующийся мышечной болью, некрозом мышц с миоглобинемией и/или миоглобинурией с высоким риском развития острого почечного повреждения и смерти. В статье представлено клиническое описание развития рабдомиолиза у пациентки среднего возраста с артериальной гипертензией, декомпенсированным сахарным диабетом 2 типа и альбуминурией. Женщина 60 лет поступила в стационар по экстренным показаниям с жалобами на выраженную мышечную слабость, начавшуюся с шеи, которая распространилась в течение нескольких дней на верхние и нижние конечности, с прогрессирующим нарастанием симптоматики до уровня пареза. По назначению участкового терапевта за 3 мес. до госпитализации пациентка была переведена с приема европейского генерического брендированного розувастатина 20 мг на отечественный генерический небрендированный аторвастатин в аналогичной дозе (не сопоставимой с позиции липидснижа-ющего эффекта) 20 мг. При лабораторном исследовании зафиксировано повышение уровня креатинфосфокиназы до 348 верхних границ норм — 50462 Ед/л (<145) в сочетании с выраженной гипокалиемией — 1,7 ммоль/л (3,55,1) при отсутствии почечной дисфункции. Отмена статина, метформина и эмпаглифлозина, проведение массивной инфузионной терапии и коррекция электролитных нарушений позволили предотвратить развитие острого почечного повреждения, жизнеугрожающих нарушений ритма сердца и полностью купировать мышечные жалобы в течение нескольких суток. Пациентка была выписана из стационара на 23 сут. с референсными значениями клинико-лабораторных показателей, в т.ч. креатинфосфокиназы, которая претерпевала постепенную положительную динамику в течение периода госпитализации. Данное наблюдение подчеркивает важность сохранения клинической настороженности в отношении развития рабдомиолиза у пациентов на статинотерапии при наличии факторов риска его развития (в описанном нами случае — женский пол, гипергликемия, хроническая болезнь почек, сопутствующая лекарственная терапия), а также актуальность своевременной диагностики и лечения данного состояния.
Ключевые слова
Об авторах
Новосибирский государственный медицинский университет Минздрава России; Научно-исследовательский институт терапии и профилактической медицины — филиал ФГБНУ ФИЦ ИЦиГ СО РАН
Россия
Цыганкова Оксана Васильевна — доктор медицинских наук, профессор, кафедра неотложной терапии с эндокринологией и профпатологией ФПК и ППВ НГМУ Минздрава России; старший научный сотрудник, лаборатория клинических биохимических и гормональных исследований терапевтических заболеваний НИИТПМ – филиал ИЦиГ СО РАН.
Конфликт интересов отсутствует.
Научно-исследовательский институт терапии и профилактической медицины — филиал ФГБНУ ФИЦ ИЦиГ СО РАН
Россия
Евдокимова Наталья Евгеньевна — младший научный сотрудник, лаборатория генетических и средовых детерминант жизненного цикла человека.
Конфликт интересов отсутствует
Научно-исследовательский институт терапии и профилактической медицины — филиал ФИЦ ИЦиГ СО РАН
Россия
Байрамова Сабина Саяровна — младший научный сотрудник, лаборатория неотложной терапии; врач-эндокринолог.
Конфликт интересов отсутствует.
Сусеков Андрей Владимирович — доктор медицинских наук, профессор, кафедра клинической фармакологии и терапии.
Конфликт интересов отсутствует.
Список литературы
1. Xiao M, Zhang L, Zhong Y, et al. Sudden rhabdomyolysis in an elderly patient after single atorvastatin dose: The need for early and frequent creatine kinase monitoring in high-risk patients. SAGE Open Med Case Rep. 2020;8:2050313X20919623. doi:10.1177/2050313X20919623.
4. Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapy — European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. European Heart Journal. 2015;36(17):1012-22. doi:10.1093/eurheartj/ehv043.
7. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. European Heart Journal. 2020;41:111-88. doi:10.1093/eurheartj/ehz455.
8. Kukharchuk VV, Ezhov MV, Sergienko IV, et al.; Russian National Atherosclerosis Society, Russian Society of Cardiology, Russian Diabetes Association. Diagnostics and correction of lipid metabolism disorders in order to prevent and treat of atherosclerosis Russian recommendations VII revision. The Journal of Atherosclerosis and Dyslipidemias. 2020;1(38):7-42. (In Russ.) doi:10.34687/2219-8202.JAD.2020.01.0002.
9. Mancini GB, Baker S, Bergeron J, et al. Diagnosis, Prevention, and Management of Statin Adverse Effects and Intolerance: Canadian Consensus Working Group Update (2016). Can J Cardiol. 2016;32(7 Suppl):S35-65. doi:10.1016/j.cjca.2016.01.003.
10. Simons JE, Holbrook AM, Don-Wauchope AC. Successful reintroduction of statin therapy after statin-associated rhabdomyolysis. J Clin Lipidol. 2015;9(4):594-6. doi:10.1016/j.jacl.2015.03.005.
11. Bouitbir J, Sanvee GM, Panajatovic MV, et al. Mechanisms of statin-associated skeletal muscle-associated symptoms. Pharmacol Res. 2020;154:104201. doi:10.1016/j.phrs.2019.03.010.
12. Stahl K, Rastelli E, Schoser B. A systematic review on the definition of rhabdomyolysis. J Neurol. 2020;267(4):877-82. doi:10.1007/s00415-019-09185-4.
13. Pennisi M, Di Bartolo G, Malaguarnera G, et al. Vitamin D Serum Levels in Patients with Statin-Induced Musculoskeletal Pain. Dis Markers. 2019;2019:3549402. doi:10.1155/2019/3549402.
14. Qu H, Guo M, Chai H, et al. Effects of Coenzyme Q10 on Statin-Induced Myopathy: An Updated Meta-Analysis of Randomized Controlled Trials. J Am Heart Assoc. 2018;7(19):e009835. doi:10.1161/JAHA.118.009835.
15. Dyadyk AI, Kugler TE, Zborowskyy SR, et al. Statin-associated muscle symptoms: epidemiology, risk factors, mechanisms and treatment. Kardiologiia. 2019;59(5S):4-12. (In Russ.) doi:10.18087/cardio.2522.
16. Hasan S, Abushahin A, Prayson R, et al. When Statins Cause an Autoimmune Response: A Report of a Severe Case of Rhabdomyolysis. Am J Med. 2020;133(1):50-1. doi:10.1016/j.amjmed.2019.05.043.
17. Tsygankova OV, Veretyuk VV, Mareev VYu. Modification of the of the cardiometabolic profile using combined therapy of the angiotensin receptor-neprilysin inhibitor and empagliflozin in comorbid patients with Chronic Heart Failure and type 2 Diabetes Mellitus. Kardiologiia. 2020;60(5):146-52. (In Russ.) doi:10.18087/cardio.2020.5.n840.
18. Kabadi UM. Marked Weight Loss, Muscle Wasting and Fatigue on Administration of Empagliflozin in a Subject with Type 2 Diabetes. Journal of Advances in Medicine and Medical Research. 2017;21(5):1-7. doi:10.9734/BJMMR/2017/33253.
19. Gao F, Hall S, Bach LA. Myopathy secondary to empagliflozin therapy in type 2 diabetes. Endocrinol Diabetes Metab Case Rep. 2020;2020:20-0017. doi:10.1530/EDM-20-0017.
20. Brailovski E, Kim RB, Juurlink D. Rosuvastatin Myotoxicity After Starting Canagliflozin Treatment: A Case Report. Ann Intern Med. 2020;173(7):585-7. doi:10.7326/L20-0549.
21. Gupta R, Alcantara R, Popli T, et al. Myopathy Associated With Statins and SGLT2 — A Review of Literature. Curr Probl Cardiol. 2021;46(4):100765. doi:10.1016/j.cpcardiol.2020.100765.
Читайте также:
