Распределение лекарственного препарата
Добавил пользователь Дмитрий К. Обновлено: 07.01.2026
Распределение препаратов — это перемещение препарата в кровь (из крови) и в различных тканях организма (например, в жировой и мышечной ткани и в ткани головного мозга), а также относительное содержание препарата в тканях.
По завершению абсорбции большинство препаратов распределяются по организму неравномерно. Препараты, растворимые в воде (водорастворимые препараты), например, антигипертензивный препарат атенолол, как правило, остаются в крови и в жидкости, окружающей клетки (интерстициальном пространстве). Препараты, растворимые в жирах (жирорастворимые препараты), такие как успокоительный препарат клоразепат, как правило, сосредотачиваются в жировой ткани. Другие лекарственные препараты сосредотачиваются в лишь в одном небольшом участке организма (например, йод сосредотачивается в основном в щитовидной железе), поскольку определенные ткани характеризуются особого рода склонностью (сродством) к лекарственному препарату и способностью его удерживать.
Препараты проникают в различные ткани с различной скоростью, в зависимости от их способности проникать через биологические мембраны. Например, антибиотик рифампин (препарат, обладающий высокой растворимостью в жирах) довольно быстро проникает в головной мозг, в то время как антибиотик пенициллин (водорастворимый препарат) такой способностью не обладает. В целом, жирорастворимые препараты проникают сквозь клеточные мембраны быстрее, чем водорастворимые препараты. Некоторые препараты перемещаются в ткани организма или выводятся из них посредством механизмов клеточного транспорта.
Некоторые лекарственные препараты покидают кровоток весьма медленно, поскольку они прочно связываются с белками, циркулирующими в крови. Другие препараты довольно быстро покидают кровоток и попадают в другие ткани организма, поскольку они менее прочно связаны с белками крови. Некоторое количество или практически все молекулы препарата, находящиеся в крови, могут связываться с белками крови. То количество препарата, которое связано с белками, как правило, неактивно. По мере распределения несвязанного препарата в тканях и снижения его концентрации в кровотоке белки крови постепенно высвобождают связанные с ними молекулы препарата. Таким образом, то количество препарата, которое связано в кровотоке с белками, может служить источником препарата.
Некоторые препараты накапливаются в определенных тканях (например, дигоксин накапливается в тканях сердца и в скелетных мышцах), которые также могут выступать в качестве источника дополнительного количества препарата. Эти ткани могут медленно высвобождать препарат в кровоток, предотвращая, таким образом, резкое снижение концентрации препарата в крови и продлевая действие препарата. Некоторые препараты, например, препараты, накапливающиеся в жировой ткани, покидают эти ткани настолько медленно, что они продолжают циркулировать в сосудистом русле на протяжении нескольких дней после того, как пациент перестал принимать препарат.
Процесс распределения препаратов также может варьироваться от человека к человеку. Например, у тучных людей могут накапливаться большие количества жирорастворимых препаратов, в то время, как у худых людей такие препараты накапливаются в относительно меньших количествах. У пожилых людей (даже худых) могут накапливаться значительные количества жирорастворимых препаратов по той лишь причине, что относительное содержание жира в организме увеличивается с возрастом.
ПРИМЕЧАНИЕ: Это — пользовательская версия ВРАЧИ: Нажмите здесь, чтобы перейти к профессиональной версии
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
1.1.3. Распределение лекарственных веществ
Распределяются лекарственные вещества в организме неравномерно. Характер распределения зависит от физико-химических свойств лекарства, васкуляризации тканей, наличия патологического процесса и т.д.
В крови лекарственное вещество взаимодействует с белками плазмы. Эффект наступает быстрее при использовании препаратов, не взаимодействующих или образующих с белками плазмы крови непрочные комплексы, так как свободная, не связанная с белками плазмы, фракция лекарства легко проникает в ткани, накапливается в достаточной концентрации и дает эффект. Если связи с белками прочные, комплекс "лекарство + белок" не проникает через тканевые барьеры, в ткани (клетке) концентрация лекарства будет низкой и эффект не проявится. Поэтому скорость наступления и величина эффекта зависят от полноты и прочности связи лекарств с белками плазмы. Например, все сердечные гликозиды улучшают сократительную способность миокарда, но только строфантин и гликозиды майского ландыша мало связываются с белками плазмы крови и применяются при острой сердечной недостаточности. Дигитоксин - гликозид наперстянки - прочно связывается с белками крови. Диффундирует в миокард только его свободная фракция, и в результате скорость наступления эффекта очень низка. Этот препарат может использоваться лишь при хронической сердечной недостаточности.
Связывание препаратов с белками крови снижается при кровопотере, обширных ожогах, белковом голодании, нефрозах, болезнях печени и т.д.; в этих условиях их активность и токсичность могут возрастать.
Процесс распределения и накопления лекарственного вещества в той или иной ткани связан с ее кровоснабжением и общим состоянием гемодинамики. При шоке, застойной сердечной недостаточности перфузия большинства органов снижается.
Проникновение лекарств через различные тканевые барьеры зависит от их липофильности и сродства к определенным тканям. Препараты с высокой липофильностью могут из водной фазы переходить в жировые депо, создавая в них резерв препарата. Медленно поступая в кровь из жирового депо, лекарственный препарат оказывает длительное последействие.
Некоторые лекарства могут избирательно (селективно) накапливаться в определенных органах и тканях. Например, при введении препаратов йода последний в большом количестве определяется в ткани щитовидной железы, поскольку йод используется в синтезе ее гормона - тироксина. Мышьяк в значительных количествах накапливается в ногтях и зубах, образуя прочные комплексы с кератином. Антибиотики тетрациклиновой группы связываются с кальцием и в период обызвествления зубов могут откладываться в твердых тканях зуба, вызывая гипоплазию эмали ("тетрациклиновые зубы").
На распределение лекарств влияет проницаемость тканевых барьеров. Например, тетрациклины не проникают через гематоэнцефалический барьер и не оказывают влияния на центральную нервную систему, а левомицетин - проникает и может вызывать возбуждение, бессонницу, галлюцинации. При патологии проницаемость мембран может меняться. Например, при остром воспалении она увеличивается, а при хроническом воспалительном процессе образование фиброзной капсулы может затруднить проникновение лекарственных препаратов в очаг воспаления (фиброз при туберкулезе).
Особенности распределения лекарственных веществ и различная чувствительность к ним тканей обусловливают не только основное, но и побочное действия препаратов.
Распределение лекарственного препарата
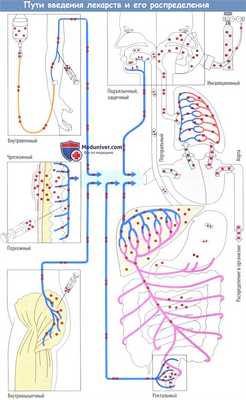
Распределение лекарств в организме в зависимости от пути введения
Как правило, лекарственные средства достигают органа-мишени через кровь. Поэтому в первую очередь они должны попасть в кровь, что обычно происходит через венозную сеть. Существует несколько возможных путей введения.
Лекарственный препарат можно ввести в виде инъекции или инфузии внутривенно, при этом он поступает непосредственно в кровоток. При подкожной или внутримышечной инъекции лекарственный препарат должен диффундировать из места введения в кровь. Поскольку при данных процедурах повреждается верхний слой кожи, необходимо придерживаться строгих правил их проведения.
По этой причине пероральный путь введения (т. е. прием внутрь), включающий последующий захват лекарственного средства из слизистой оболочки ЖКТ в кровь, выбирается гораздо чаще. Недостатком данного пути введения является то, что препарат должен пройти через печень на своем пути в общий кровоток. При всех перечисленных выше способах введения данный факт имеет большое практическое значение для любого лекарственного препарата, который быстро трансформируется или, возможно, инактивируется в печени (эффект первичного прохождения через печень, выделение до попадания в общий кровоток, биодоступность).
Более того, лекарственное средство проходит через легкие перед поступлением в общий кровоток. Легочная ткань может захватывать гидрофобные вещества. Поэтому легкие могут действовать как буфер и таким образом предупреждать быстрое повышение уровня лекарственного вещества в периферической крови после в/в инъекции (это важно, например, для в/в анестетиков). Даже при введении в прямую кишку как минимум часть лекарственного препарата попадает в общий кровоток через воротную вену, поскольку непосредственно в нижнюю полую вену течет кровь лишь из короткого терминального сегмента прямой кишки.
Эффект прохождения через печень удается миновать при всасывании препарата из щечной или подъязычной области, т. к. кровь из полости рта попадает в верхнюю полую вену. Аналогичный процесс происходит при введении в виде ингаляции. Тем не менее при данном пути введения обычно преследуется местный эффект, а системное действие требуется лишь в исключительных случаях. В определенных условиях лекарственный препарат можно также применять накожно с помощью чрескожной системы доставки. В данном случае лекарственное средство высвобождается из резервуара с постоянной скоростью в течение нескольких часов и затем проникает в эпидермис и субэпидермальную соединительную ткань, где попадает в кровь капилляров. Лишь очень небольшое число лекарственных препаратов можно использовать чрескожно.
Возможность данного пути введения определяется как физико-химическими свойствами лекарственного средства, так и терапевтическими требованиями (быстрый эффект в сравнении с продолжительным действием).
Скорость всасывания определяется путем и способом введения. Она самая быстрая при в/в инъекции, менее быстрая при в/м инъекция и самая медленная при подкожной инъекции. При введении лекарственного препарата через слизистую оболочку рта (защечный, подъязычный пути) его уровень в плазме повышается быстрее, чем при традиционном введении внутрь, т. к. он сконцентрирован непосредственно в месте всасывания, а в слюне накапливается очень высокая концентрация при растворении одной дозы.
Это приводит к тому, что захват через эпителий полости рта ускоряется. Более того, при всасывании лекарственного средства через слизистую оболочку полости рта отсутствует эффект первичного прохождения через печень и, следовательно, возможность его выведения до попадания в общий кровоток. Защечный или подъязычный путь не подходят для плохо растворимых в воде или плохо всасывающихся лекарственных средств. Такие препараты следует назначать внутрь, поскольку как объем для растворения жидкости, так и всасывающая поверхность гораздо больше в тонкой кишке, чем в полости рта.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Распределение лекарственных препаратов по тканям
После того как лекарственное средство попадает в системный кровоток, оно распределяется в тканях организма. Распределение обычно происходит неравномерно из-за различий в интенсивности кровоснабжения, связывания с тканями (например, с различным содержанием жира), местного рН и проницаемости клеточных мембран.
Степень проникновения лекарственного средства в ткань зависит от скорости кровотока, массы ткани и характера распределения вещества между кровью и тканью. Равновесное распределение (когда скорости проникновения и выхода из ткани совпадают) достигается быстрее в областях с богатой васкуляризацией, если диффузия через клеточную мембрану не является скорость-лимитирующим фактором. После достижения равновесия концентрация лекарственного средства в ткани и внеклеточных жидкостях пропорциональна концентрации в плазме крови. Метаболизм и элиминация происходят одновременно с распределением, делая процесс динамичным и сложным.
После того, как лекарственное средство проникло в ткани, его распределение в интерстициальной жидкости определяется, в первую очередь, перфузией. Для мало перфузируемых тканей (например, мышечной, жировой) характерно очень медленное распределение, особенно если ткань обладает высоким сродством к лекарственному веществу.
Объем распределения
Кажущийся объем распределения – это гипотетический объем жидкости, в котором могло бы распределиться общее количество введенного лекарственного средства для создания концентрации, соответствующей таковой в плазме крови. Например, если вводится 1 000 мг лекарственного средства, а концентрация в плазме крови составляет 10 мг/л, то 1 000 мг распределяется в 100 л (доза/объем = концентрация; 1 000 мг/x л = 10 мг/л; отсюда: x = 1 000 мг/10мг/л = 100 л).
Объем распределения не имеет никакого отношения к объему тела или содержанию в нем жидкости, а, скорее, зависит от характера распределения лекарственного вещества в организме. В случае препаратов, интенсивно связывающихся с тканями, очень малая их доля остается в системе кровообращения. Следовательно, концентрация в плазме крови будет низкой, а объем распределения – высоким. Лекарственные средства, которые преимущественно остаются в кровотоке, обычно имеют низкий объем распределения.
Объем распределения служит эталоном для плазменной концентрации, ожидаемой для введенной дозы, но дает мало информации о конкретной схеме распределения. Каждый препарат по-своему распределяется в организме. Одни препараты распределяются в основном в жировой ткани, другие – остаются во внеклеточной жидкости, а некоторые в значительной степени связаны с конкретными тканями.
Лекарственные препараты, являющиеся слабыми кислотами (например, варфарин, аспирин), зачастую хорошо связываются с белками плазмы и поэтому имеют невысокий кажущийся объем распределения. Многие основания (например, амфетамин, петидин), напротив, в большой степени захватываются тканями и, таким образом, имеют кажущийся объем распределения больше, чем объем всего организма.
Связывание
Степень распределения ЛС в ткани зависит от его относительного связывания с белками плазмы крови и тканями. В кровотоке лекарственные средства транспортируются частично как свободная (несвязанная) фракция, а частично – как связанная фракция (например, с белками плазмы крови или клетками крови). Из множества белков плазмы, которые могут взаимодействовать с препаратами, наиболее важными являются альбумин, альфа-1 кислый гликопротеин и липопротеины. ЛС-слабые кислоты обычно более интенсивно связываются с альбумином; основания, напротив, – с альфа-1-кислым гликопротеином и/или липопротеинами.
Только несвязанное лекарственное средство способно к пассивной диффузии в экстраваскулярные пространства или ткани, где происходит его фармакологическое действие. Поэтому концентрация несвязанного лекарственного средства в системном кровотоке обычно определяет концентрацию его в месте реализации эффекта и, таким образом, выраженность последнего.
При высоких концентрациях количество связанного лекарственного средства достигает верхнего предела, определяемого количеством доступных участков связывания. Их насыщение – основа эффекта вытеснения при взаимодействии лекарственных средств (см. Влияние препаратов на рецепторы Связывание ).
Лекарственные препараты способны связываться с различными веществами помимо белков. Связывание обычно происходит, когда лекарственное средство взаимодействует с макромолекулой в водной среде, но может также произойти, когда оно проникает в жировую ткань организма. Поскольку она слабо перфузируется, время достижения равновесного состояния обычно длительное, особенно если препарат является высоколипофильным.
Накопление лекарственных средств в тканях или компартментах организма может быть причиной пролонгирования их эффекта, т.к. ткани высвобождают накопленный препарат по мере того, как снижается концентрация его в плазме крови. Например, тиопентал обладает высокой липофильностью, быстро проникает в головной мозг после однократного внутривенного введения и характеризуется развитием выраженного и быстрого анестезирующего эффекта; затем его действие прекращается в течение нескольких минут по мере того, как он перераспределяется в медленно перфузируемую жировую ткань. Затем тиопентал медленно высвобождается из запасов жира, поддерживая субанестетическую концентрацию в плазме крови. При повторном введении концентрация может стать значительной, приводя к тому, что препарат в большом количестве накопится в жировой ткани. Таким образом, этот процесс сначала сокращает время действия лекарственного средства, а затем продлевает его.
Некоторые лекарственные средства накапливаются в клетках вследствие связывания с белками, фосфолипидами или нуклеиновыми кислотами. Например, концентрация хлорохина в лейкоцитах и гепатоцитах может быть в тысячу раз выше, чем в плазме крови. Лекарственное вещество в клетках находится в равновесии с его концентрацией в плазме крови и переходит туда по мере элиминации препарата из организма.
Гематоэнцефалический барьер
Лекарственные средства проникают в центральной нервной системы по капиллярам мозга и через спинномозговую жидкость (СМЖ). Хотя головной мозг получает примерно 1/6 сердечного выброса, распределение препаратов в ткань головного мозга ограниченно, поскольку проницаемость головного мозга отличается от других тканей. Хотя некоторые жирорастворимые лекарственные средства (например, тиопентал) легко попадают в головной мозг, проникновение полярных соединений затруднено. Причиной этого является гематоэнцефалический барьер, который состоит из эндотелия капилляров головного мозга и астроцитарных отростков. Эндотелиальные клетки капилляров головного мозга, которые более тесно соединены друг с другом, чем клетки других капилляров, замедляют диффузию водорастворимых лекарственных средств. Астроцитарная оболочка состоит из слоя глиальных клеток соединительной ткани (астроцитов), примыкающего к базальной мембране эндотелия капилляров. С возрастом защитная функция гематоэнцефалического барьера становится менее эффективной, что приводит к повышению проникновения различных веществ в головной мозг.
Лекарственные вещества могут попадать в спинномозговую жидкость желудочков через хориоидальное сплетение, затем пассивно диффундируя в ткань головного мозга из ликвора. Кроме того, в хориоидальном сплетении органические кислоты (например, пенициллин) активно транспортируются из спинномозговой жидкости в кровь.
Скорость проникновения лекарственного средства в спинномозговую жидкость, как и в случае других тканей, определяется в основном мерой связывания с белками, степенью ионизации и коэффициентом распределения лекарственного средства в жирах и воде. Проникновение в головной мозг замедлено для препаратов, в значительной степени связанных с белками, и практически отсутствует для ионизированных форм слабых кислот и оснований. Поскольку ЦНС хорошо кровоснабжается, скорость распределения лекарственного средства определяется, прежде всего, проницаемостью клеточных мембран.
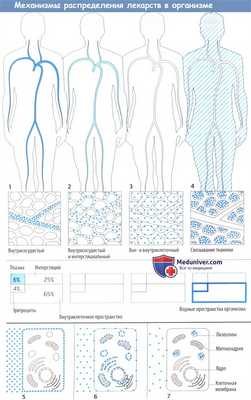
Механизмы распределения лекарств в организме
Лекарственное средство после захвата организмом распределяется в кровь и через нее в различные ткани организма. Распределение может ограничиваться внеклеточным пространством (плазма + интерстициальное пространство) или может включать и внутриклеточное пространство.
Некоторые лекарственные средства активно связываются тканевыми структурами, поэтому их концентрации в плазме значительно падают еще до начала выделения.
После распределения в кровь макромолекулы остаются в основном в сосудистом пространстве, т. к. они не могут проникнуть через гистогематический барьер или даже фенестрированный эндотел ий капилляров. Это свойство используется при потере крови, когда необходимо восполнить объем циркулирующей крови, например, путем инфузии растворов с декстраном.
Более того, в сосудистом пространстве преимущественно находятся вещества, обладающие высоким аффинитетом к белкам плазмы (определение объема плазмы с помощью связанных с белком красителей). Несвязанное (свободное) лекарственное средство покидает кровоток, но с различной скоростью, т. к. гистогематический барьер имеет неодинаковое строение в сосудах различных органов. Эти локальные отличия не показаны на приведенных рисунках.
Распределение в организме определяется свойством проникать сквозь мембранные барьеры. Гидрофильные вещества (инулин) не захватываются клетками и не связываются структурами клеточной поверхности, поэтому могут использоваться для определения внеклеточного объема жидкости. Липофильные вещества диффундируют сквозь клеточную мембрану; в результате достигается равномерное распределение в жидкостях организма.
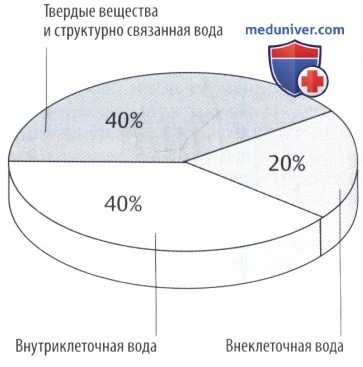
Масса тела может снизиться, как показано на секторной диаграмме. Другие подразделы указаны на рисунке ниже.
Отношение объема интерстициальной/внеклеточной жидкости варьирует в зависимости от возраста и массы тела. В процентном отношении объем интерстициальной жидкости высокий у недоношенных детей или у здоровых новорожденных (до 50% массы тела) и снижается при ожирении и старении.
Концентрация (с) раствора соответствует количеству (D) вещества, растворенного в объеме (V); из этого следует, что с = D/V. Если известна доза лекарственного препарата (D) и его концентрация в плазме (с), то можно вычислить объем распределения (V) по формуле: V=D/c. Тем не менее это кажущийся (теоретический) объем распределения (Vapp), т. к. при расчете предполагается равномерное распределение в организме.
Равномерное распределение нехарактерно при связывании лекарственных средств клеточными мембранами или мембранами внутриклеточных органелл либо при накоплении внутри органелл. В таких случаях концентрация в плазме уменьшается и Vapp может превысить фактическую величину имеющегося объема жидкости. Наоборот, если значительная часть молекул лекарственного вещества связана с белками плазмы, то с увеличивается, а вычисляемый Vapp может быть меньше, чем биологическое значение.
Читайте также:
