Кровоизлияния в мозг при коарктации аорты. Абсцессы мозга при врожденных пороках сердца
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Кровоизлияния в мозг при коарктации аорты. Абсцессы мозга при врожденных пороках сердца
Кровоизлияния в мозг также являются частым осложнением коарктации аорты. По данным большинства исследователей, 7—12% больных погибают от внутричерепного кровоизлияния на почве разрыва аневризм мозговых сосудов или измененной сосудистой стенки. Мозговые осложнения часто возникают у больных в возрасте около 30 лет (А. В. Покровский, И. 3. Мельник, 1967). Однако описаны случаи кровоизлияния в мозг и в детском возрасте (Lenegre, de Brux, 1946; Cleland с соавт., 1956; А. М. Прохорский и Г. С. Ольшанский, 1966). Мы наблюдали больных, перенесших кровоизлияние в мозг в возрасте 11 и 17 лет.
Лечебную тактику при нарушениях мозгового кровообращения следует подразделить на лечение неврологических осложнений и порока сердца.
Перенесенный инсульт не считается противопоказанием к оперативному лечению врожденного порока сердца. Напротив, при цианотических пороках сердца с выраженной гипоксией и полицитемией успешно проведенная операция на сердце является профилактикой повторных мозговых расстройств. При коарктации аорты только своевременная хирургическая коррекция порока сердца может предотвратить ранние склеротические изменения сосудов и гипертонию сосудов большого круга кровообращения.
Вопрос о сроке оперативного лечения порока сердца после перенесеннего инсульта должен решаться в зависимости от степени расстройства мозгового кровообращения и гемодинамических нарушений, но не раньше, чем через 6—8 месяцев после перенесенного инсульта.
В Институте хирургии им. А. В. Вишневского оперировано 10 детей, перенесших инсульт, в сроки 2—8 лет после инсульта. Только у одного больного, страдавшего тетрадой Фалло, в послеоперационном периоде развился повторный инсульт, и больной погиб. Все остальные успешно перенесли оперативное вмешательство.

Абсцессы мозга при врожденных пороках сердца
Абсцесс мозга, по литературным данным, является одним из частых осложнений. Впервые он описан Farre в 1814 г. Ballt (1880) сообщил о 6 наблюдениях и указал на этиологическую связь между этими заболеваниями.
Частота абсцессов мозга, по данным различных исследователей, различна, в среднем составляет 3—6%. В то же время среди населения она не превышает 0,4% (Gates, Kernohan, 1950).
По данным аутопсии Abbot (1936) установила абсцесс мозга в 7 (0,7%) из 1000 случаев, Наппа (1941) — в 6 (4%) из 160 за 21 год, Robbins (1950) —в 15 (7%) из 209.
Столь же противоречивы и клинические данные. Reifenstein с соавторами (1947) наблюдали абсцесс мозга у 5 из 115 больных. Д. Г. Жученко (1963) из 150 больных с метастатическими абсцессами мозга лишь у 2 обнаружил сочетание с врожденным пороком сердца. В. Б. Гельдфанд и Л. Д. Крымский (1967) нашли в литературе к 1965 г. 190 случаев абсцесса мозга при врожденных пороках сердца, причем наибольшее число (27) собрано Teyler, Clark (1957).
Абсцесс мозга чаще описан при врожденных пороках сердца «синего» типа и право-левом шунте: при тетраде Фалло, транспозиции магистральных сосудов, общем артериальном стволе и др.
Однако некоторые (Наппа, 1941; Marande, 1950; Ehni, Grain, 1952; Н. Л. Лейкинас, 1967, и др.) наблюдали абсцессы мозга при врожденных пороках сердца «белого» типа, но с обязательным внутрисердечным дефектом: межпредсердной или межжелудочковой перегородки и открытым артериальным протоком. Возникновение последних становится возможным при временном повышении давления в правых отделах сердца и временной инверсии шунта.
Большинство больных с абсцессом мозга в возрасте 2—20 лет. Только Marande, Greninger (1956) наблюдали это заболевание у 2 детей моложе 2 лет и Raimondi с соавторами (1965) — у ребенка 1-го дня.
Чаще отмечаются единичные абсцессы мозга. Множественные абсцессы мозга, располагающиеся в одном или обоих полушариях мозга (Vann, Miller, 1944; Н. А. Карлов и Н. М. Чеботарева, 1963), и абсцесс мозжечка при врожденных пороках сердца (Loulie, 1962; Н. Л. Лейкина, 1967) встречаются редко.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Неврологические осложнения болезней сердца у ребенка
а) Неврологические осложнения неоперированных врожденных заболеваний сердца. Врожденные заболевания сердца, особенно врожденные пороки сердца синего типа, являются важными причинами неврологических проблем.
1. Умственное и физическое развитие и мальформации сердца. Развитие детей с врожденными пороками развития сердца обычно нормальное. Тем не менее, познавательные функции у детей с врожденным пороком сердца синего типа могут нарушаться чаще, чем при нецианотических заболеваниях (Stieh et al., 1999), особенно у детей с гипоплазией левых отделов. Около половины детей с врожденной патологией сердца с необходимостью операции на открытом сердце в неонатальном периоде приобретают дефицит двигательных и познавательных функций с плохой успеваемостью в школе (Hovels-Gurich et al., 2002a, b).
Rogers et al. (1995) выявили, что 7 из 11 выживших с этим состоянием имеют серьезные когнитивные нарушения. Возможны различные механизмы подобных расстройств познавательных способностей, включая сопутствующие мальформации, последствия инфарктов или гипоксических приступов и хронической гипоксии. Роль гипоксии заподозрена на основании данных о том, что возраст, в котором проводится операция по транспозиции крупных сосудов, имеет отрицательную корреляцию с достигнуты м уровнем умственного развития (Newburger et al., 1984), указывая на то, что отсрочка хирургического вмешательства может быть связана с нарушением высших функций мозга.
Основной причиной являются факторы в процессе операции, однако недавние исследования показали, что у половины новорожденных с такими проблемами неврологические и нейроповеденческие симптомы имелись до операции, являясь существенным фактором риска для последующих нарушений (Limperopoulos et al., 2002). Было установлено, что хроническая гипоксия у детей с пороками сердца синего типа связана с нарушенной двигательной функцией, неспособностью к устойчивому вниманию и низкой успеваемостью (Wright и Nolan, 1994; Stieh et al., 1999).
Мальформации мозга встречаются чаще у детей с врожденными заболеваниями сердца, чем среди населения в целом. В исследовании цианотических заболеваний сердца патология ЦНС была выявлена в 2-5% случаев с транспозицией крупных сосудов, 5-10% с тетрадой Фалло, 4-10% с артериальным стволом и около 29% с гипоплазией левых отделов сердца (Glauser et al., 1990).
Мальформации мозга могут включать как большие, так и малые аномалии, а микроцефалия является самой распространенной. При нецианотических заболеваниях патология мозга встречается особенно часто, с дефектами эндокардиальной подушки, поскольку они сочетаются с синдромом Дауна, но иногда обнаруживаются коарктация аорты или аортальный стеноз. Коарктация аорты может сочетаться с аневризмами в мозге и также вызывать кровоизлияние в мозг при их отсутствии (Freedom, 1989).
2. Пароксизмальные эпизоды. Среди них различают синкопапьные состояния, которые могут встречаться у пациентов с клапанным аортальным стенозом. Цианотические приступы составляют главные осложнения порока сердца синего типа. Эти эпизоды провоцируются нагрузками, кормлением или актами дефекации и характеризуются гиперпноэ и внезапным усилением предшествующего цианоза. Сознание может ухудшаться, и в тяжелых случаях могут развиться генерализованные судороги. Иктальный мониторинг с помощью ЭЭГ показывает скорее гипоксический, чем эпилептический характер судорог (Daniels et al., 1987). В некоторых случаях диабетические приступы следуют за острым нарушением мозгового кровообращения.
3. Инсульты. Нарушения мозгового кровообращения встречаются в течение первых 20 месяцев жизни в 75% случаев, а тетрада Фалло и транспозиция магистральных сосудов насчитывает около 90% случаев (Phornphutkul et al., 1973). Их встречаемость значительно снизилась после выполнения раннего хирургического вмешательства у большинства детей. Тем не менее, нарушения мозгового кровообращения также возникают и после полного восстановления. Du Plessis et al. (1995) наблюдали инсульты у 17 (2,6%) из 645 детей, которым была выполнена операция по Фонтену. Они возникали в течение первых дней до 30 месяцев после хирургического вмешательства.
Инфаркты локализовались в основном в бассейне средней мозговой артерии, но могут быть вовлечены и другие крупные сосуды. Венозный тромбоз также встречается, отчасти коррелируя с дегидратацией и высоким гематокритом, тогда как артериальные инфаркты часто наблюдаются у пациентов с железодефицитной анемией (Tyler и Clark, 1957). Последняя часто связана с повышенной вязкостью крови. Гемиплегия с внезапным началом является обычным клиническим проявлением, но могут наблюдаться другие фокальные дефициты, такие как гемианопия или афазия. КТ дает обычную картину артериального инфаркта крупных сосудов, лакунарные инфаркты нехарактерны (Dusser et al., 1986). В четверти случаев отмечается задержка умственного развития и остаточная эпилепсия.
4. Абсцессы головного мозга. Они рассматривались в отдельной статье на сайте. Около 80% из них встречаются в случаях с тетрадой Фалло и транспозицией магистральных сосудов. Они редко встречаются до двухлетнего возраста, возможно, из-за развития в месте предшествующих небольших инфарктов. Отек сосочка зрительного нерва имеет небольшое значение в постановке диагноза абсцесса мозга у пациентов с цианотической болезнью сердца, поскольку извилистые сосуды сетчатки часто переполнены кровью, размывая границы диска.
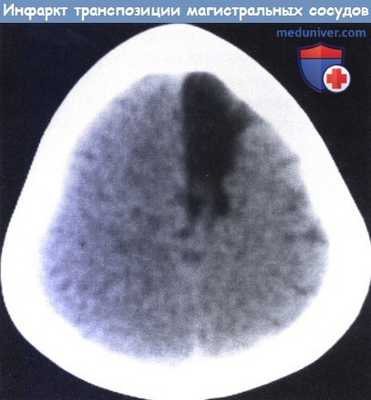
Инфаркт в области передней мозговой артерии у трехлетнего пациента с транспозицией магистральных сосудов.
В данном случае имело место внезапное начало гемиплегии с преобладанием поражения голени после корректирующего оперативного вмешательства.
б) Неврологические осложнения приобретенного заболевания сердца у ребенка. Эти случаи менее распространены, чем при врожденных заболеваниях сердца. Они включают хорею и эмболию сосудов мозга, которая может быть вызвана аритмиями сердца (Palacio и Hart, 2002) или бактериальным эндокардитом и последствиями сердечной недостаточности.
Бактериальный эндокардит может осложнять установленное заболевание сердца, но может также встречаться на очевидно нормальном сердце. Неврологические осложнения развиваются в 20-40% случаев и часто являются показательным проявлением. Они включают эмболы, гнойный менингит, мозговой абсцесс и грибковые аневризмы с возможным менингеальным или паренхиматозным кровоизлиянием. У детей судороги не являются редкостью (Chen et al., 2001, Ferrieri et al., 2002). В 70% случаев обнаруживаются изменения в ЦСЖ, с проявлениями гнойного или лимфоцитарного плеоцитоза, ликвор может быть геморрагического характера.
в) Неврологические осложнения операций при патологии сердца у ребенка. Осложнения сердечной хирургии стали чаще встречаться у детей после расширения возможностей оперативного лечения тяжелых пороков развития. Они представляют существенную причину последствий в развитии нервной системы при врожденных заболеваниях сердца.
Острые осложнения, которые встречаются в течение или сразу после операции, включают кому или меньшие степени нарушения сознания, судороги (генерализованные, парциальные или мультифокальные), гемипарез, изменения мышечного тонуса, органические синдромы психических нарушений, параличи взора, дискинезию и изменения личности. Особенно часты судороги (развиваются у 4-26% пациентов после операций на сердце с глубокой гипотермией), которые обычно исчезают без последствий (Du Plessis, 1997). Однако они бывают продолжительными и тяжелыми, и нейровизуализация выявляет связь некоторых из них с наличием очаговой ишемии.
Ehyai et al. (1984) наблюдали судороги у 15 из 166 оперированных новорожденных, связанные в двух случаях с гипокальциемией и гипомагниемией.
Судороги после трансплантации сердца встречаются примерно у 22-43% пациентов (Raja et al., 2003) и связаны с общей продолжительностью сердечно-легочного шунтирования и с развитием послеоперационных осложнений. Большинство из этих осложнений связано с нарушенной перфузией и эмболизмом и сопровождается заметной патологией на ЭЭГ (Olson и Shewmon, 1989). Патологическое исследование указывает на перивентрикулярную лейкомаляцию, некроз мозга и иногда некроз ствола мозга (Glauser et al., 1990): они характерны во время или после кардиопульмонарного шунтирования и заключаются в микротромбозе, жировой эмболии и особенно воздушной эмболии. КТ и МРТ исследования (McConnell et al., 1990) продемонстрировали, что встречаемость ишемических приступов, незаподозренной мозговой атрофии и субдуральных кровоизлияний была выше, чем предполагалось.
Механизмы, отвечающие за развитие экстрадуральных или субдуральных кровоизлияний, по-прежнему исследованы недостаточно, хотя вероятно влияние реперфузии.
Хореоатетотические дискинезии (Robinson et al., 1988; Curless et al., 1994), особенно затрагивающие мимическую мускулатуру, наблюдаются в частности после индуцированной глубокой гипотермии. Патологические движения обычно появляются через несколько дней после операции. Medlock et al. (1993) наблюдали это осложнение у 8 (1,2%) из 668 детей после операции с использованием искусственного кровообращения. У трех из них патологические движения были транзиторными, с исчезновением через несколько дней или недель, а у других пяти они были устойчивыми. Ни у одного из восьми детей не было нормального развития через 22-130 месяцев после проведения лечения. Du Plessis et al. (2002) выявили 36 детей с этим синдромом и выделили доброкачественные транзиторные формы с восстановлением в среднем за 70 дней и тяжелые формы, связанные с высоким уровнем смертности или устойчивые. Частота этого осложнения значительно уменьшилась за последние годы.
Ишемические повреждения спинного мозга могут возникать не только после восстановления коарктации аорты, но и при операциях на открытом сердце вследствие сосудистого коллапса (Puntis и Green, 1985). Это приводит главным образом к инфаркту в бассейне передней спинномозговой артерии.
Отдаленные последствия хирургии сердца. К ним относятся задержка умственного развития, церебральный паралич, расстройства походки, иногда судороги в форме синдрома Веста (Du Plessis, 1997) и специфические проблемы с обучением. Тем не менее, у большинства новорожденных с оперированной гипоплазией левых отделов сердца развиваются достаточно нормальные познавательные способности (Goldberg et al., 2000), но возможны нарушения поведения, а успеваемость часто ниже, чем у их здоровых сверстников (Mahle и Wernovsky, 2004; Schillingford и Wernovsky, 2004). Отклонения на МРТ обнаруживаются у большой части оперированных детей. Такие изменения включают вентрикуломегалию, атрофию и инфаркты белого вещества (McConnell et al., 1990), но необязательно связаны с неврологическими последствиями или нарушениями развития (Miller et al., 1994).
Имеется необъяснимо частая потеря слуха, но ухудшение общения связано со многими причинами. Гидроцефалия, связанная с повышенным внутричерепным венозным давлением, может возникать после операции по Мастарда. Вертебробазилярная ишемия после анастомоза Блелока-Тауссига может быть результатом значительного подключичного «обкрадования», но является редкостью (Kurlan et al., 1984).
Осложнения трансплантации сердца включают связанные с операцией в условиях искусственного кровообращения и вызванные иммуносупрессивной терапией (Adair et al., 1992). Несмотря на достигнутые в последнее время результаты, развитие нервной системы остается проблемой (Nield et al., 2000; Freed et al., 2006).
Механизмы развития абсцессов мозга при пороке сердца. Клиника и течение абсцессов мозга
До настоящего времени нет единого мнения о патогенезе абсцессов мозга при врожденных пороках сердца.
Нейрохирурги делят абсцессы мозга на метастатические, контактные и травматические. Абсцессы мозга при врожденных пороках сердца чаще представляют одну из разновидностей метастатических.
О развитии их имеются две точки зрения: первая рассматривает абсцессы мозга как следствие парадоксальных эмболии инфицированными эмболиями (Ehni, Grain, 1952; Marande, 1952, и др.), однако эта теория не объясняет избирательного абсцедирования мозга у больных врожденными пороками сердца. Согласно второй, в результате эмболии или тромбоза сосудов головного мозга, развивающихся на фоне гипоксии, полицитемии и стаза, вначале образуются очаги инфаркта и размягчение мозга (очаги наименьшего сопротивления).
В дальнейшем в результате гематогенной инфекции происходит вторичное инфицирование с развитием абсцессов (Sancetta, Zimmerman, 1950; Roger с соавт., 1952; 3. Я. Лурье, 1958, и др.). Такие очаги размягчения в головном мозгу установили Наnnа (1941), Gluck, Hall, Stewenson (1952), В. Б. Гельфанд (1967) и др.
Источником метастазирования и парадоксальных эмболии могут явиться подострый септический эндокардит, тромбоз вен нижних конечностей или геморроидальных вен, бронхоэктатическая болезнь, отит, экстракция кариозных зубов, удаление миндалин и др.

В ряде случаев не удается обнаружить источника метастазирования. Возможно развитие контактных абсцессов мозга в результате перехода гнойной инфекции на мозг из воспалительных очагов, расположенных во внутреннем ухе и придаточных пазухах носа, а также асептических абсцессов (Weber, 1957; Raimondi с соавт., 1965).
Клиническое течение абсцесса мозга нейрохирурги делят на четыре периода: 1) начальный, соответствующий внедрению в мозговую ткань гнойной инфекции и характеризующийся общими симптомами: недомогание, вялость, снижение аппетита, повышение температуры тела; 2) латентный, соответствующий отграничению гнойного процесса в мозгу с образованием вокруг него соединительнотканной капсулы и характеризующийся улучшением общего состояния, исчезновением жалоб, нормализацией воспалительных изменений в крови и ликворе; 3) манифестный, характеризующийся воспалительными симптомами общего характера (повышение температуры, изменения крови), изменениями в спинномозговой жидкости, симптомами повышения внутрипочечного давления и очаговыми симптомами поражения мозга; 4) терминальный.
Диагностика абсцессов мозга у больных с врожденными пороками сердца трудна, так как отсутствуют характерные для воспалительного процесса изменения крови (Soulie, 1962).
Течение абсцесса мозга острое, со склонностью к прорыву в желудочки мозга. В некоторых случаях возможно хроническое волнообразное с периодическими обострениями.
- Вернуться в оглавление раздела "Кардиология."
Коарктация аорты
Коарктация аорты – врожденный сегментарный стеноз (или полная атрезия) аорты в области перешейка - перехода дуги в нисходящую часть; реже – в нисходящем, восходящем или брюшном отделах. Коарктация аорты проявляется в детском возрасте беспокойством, кашлем, цианозом, одышкой, гипотрофией, утомляемостью, головокружением, сердцебиением, носовыми кровотечениями. При диагностике коарктации аорты учитываются данные ЭКГ, рентгенографии грудной клетки, ЭхоКГ, зондирования полостей сердца, восходящей аортографии, левой вентрикулографии, коронарной ангиографии. Методами хирургического лечения коарктации аорты служат транслюминальная баллонная дилатация, истмопластика (прямая и непрямая), резекция коарктации аорты, шунтирование.
МКБ-10
Общие сведения
Коарктация аорты – врожденная аномалия аорты, характеризующаяся ее стенозом, как правило, в типичном месте - дистальнее левой подключичной артерии, в месте перехода дуги в нисходящую аорту. В детской кардиологии коарктация аорты встречается с частотой 7,5%, при этом в 2—2,5 раза чаще у лиц мужского пола. В 60-70% случаев коарктация аорты сочетается с другими врожденными пороками сердца: открытым артериальным протоком (70%), дефектом межжелудочковой перегородки (53%), стенозом аорты (14%), стенозом или недостаточностью митрального клапана (3-5%), реже с транспозицией магистральных сосудов. У части новорожденных с коарктацией аорты выявляются тяжелые экстракардиальные врожденные аномалии развития.
Причины коарктации аорты
В кардиохирургии рассматривается несколько теорий формирования коарктации аорты. Принято считать, что в основе порока лежит нарушение слияния аортальных дуг в периоде эмбриогенеза. Согласно теории Шкоды, коарктации аорты формируется вследствие закрытия открытого артериального протока (ОАП) с одновременным вовлечением прилегающей части аорты. Облитерация Баталлова протока происходит вскоре после рождения; при этом стенки протока спадаются и рубцуются. При вовлечении в данный процесс стенки аорты происходит ее сужение или полное заращение просвета на определенном участке.
По теории Андерсона–Беккера причиной коарктации может служить наличие серповидной связки аорты, которая обусловливает сужение перешейка при облитерации ОАП в области ее расположения.
В соответствии с гемодинамической теорией Рудольфа, коарктация аорты – следствие особенностей внутриутробного кровообращения плода. В период внутриутробного развития через восходящую аорту проходит 50% выброса крови из желудочков, через нисходящую - 65%, в то же время в перешеек аорты поступает только 25% крови. С этим фактом связана относительная узость перешейка аорты, которая при некоторых условиях (при наличии септальных дефектов) сохраняется и усугубляется после рождения ребенка.
Особенности гемодинамики при коарктации аорты
Типичным местом расположения стеноза служит терминальный отдел дуги аорты между артериальным протоком и устьем левой подключичной артерии (область перешейка аорты). В этом месте коарктация аорты выявляется у 90-98% больных. Снаружи сужение может иметь вид песочных часов или перетяжки с нормальным диаметром аорты в проксимальном и дистальном отделах. Внешнее сужение, как правило, не соответствует величине внутреннего диаметра аорты, поскольку в просвете аорты располагается нависающая серповидная складка или диафрагма, которые в некоторых случаях полностью перекрывают внутренний просвет сосуда. Протяженность коарктации аорты может составлять от нескольких мм до 10 и более см, однако чаще ограничивается 1-2 см.
Стенотическое изменение аорты в месте перехода ее дуги в нисходящую часть обусловливает развитие двух режимов кровообращения в большом круге: проксимальнее места препятствия кровотоку имеется артериальная гипертензия, дистальнее – гипотензия. В связи с имеющимися гемодинамическими нарушениями у больных с коарктацией аорты включаются компенсаторные механизмы – развивается гипертрофия миокарда левого желудочка, увеличивается ударный и минутный объем, расширяется диаметр восходящей аорты и ветвей ее дуги, расширяется сеть коллатералей. У детей старше 10 лет в аорте и сосудах уже отмечаются атеросклеротические изменения.
На особенности гемодинамики при коарктации аорты значительное влияние оказывают сопутствующие врожденные пороки сердца и сосудов. Со временем в артериях, задействованных в коллатеральном кровообращении, (межреберных, внутренних грудных, боковых грудных, лопаточных, эпигастральных и т.д.), происходят изменения: их стенки истончаются, а диаметр увеличивается, предрасполагая к формированию престенотических и постстенотических аневризм аорты, аневризм артерий головного мозга и др. Обычно аневризматическое расширение сосудов наблюдается у больных старше 20 лет.
Давление извитых и расширенных межреберных артерий на ребра способствует образованию узур (зазубрин) на нижних краях ребер. Данные изменения появляются у пациентов с коарктацией аорты в возрасте старше 15 лет.
Классификация коарктации аорты
С учетом локализации патологического сужения различают коарктацию в области перешейка, восходящей, нисходящей, грудной, брюшной аорты. Некоторые источники выделяют следующие анатомические варианты порока - предуктальный стеноз (сужение аорты проксимальнее впадения ОАП) и постдуктальный стеноз (сужение аорты дисталтнее впадения ОАП).
По критерию множественности аномалий сердца и сосудов А. В. Покровский классифицирует 3 типа коарктации аорты:
- 1 тип - изолированная коарктация аорты (73%);
- 2 тип – сочетание коарктации аорты с ОАП; с артериальным или венозным сбросом крови (5%);
- 3 тип – сочетание коарктации аорты с другими гемодинамически значимыми аномалиями сосудов и ВПС (12%).
В естественном течении коарктации аорты выделяют 5 периодов:
- I (критический период) - у детей до 1 года; характеризуется симптомами недостаточности кровообращения по малому кругу; высокой смертностью от тяжелой сердечно-легочной и почечной недостаточности, особенно при сочетании коарктации аорты с другими ВПС.
- II (приспособительный период) - у детей от 1 до 5 лет; характеризуется уменьшением симптоматики недостаточности кровообращения, которая обычно представлена повышенной утомляемостью и одышкой.
- III (компенсаторный период) – у детей от 5 до 15 лет; характеризуется преимущественно бессимптомным течением.
- IV (период развития относительной декомпенсации) – у пациентов 15-20 лет; в периоде полового созревания нарастают признаки недостаточности кровообращения.
- V (период декомпенсации) – у пациентов 20-40 лет; характеризуется признаками артериальной гипертензии, тяжелой лево- и правожелудочковой сердечной недостаточности, высокой летальностью.
Симптомы коарктации аорты
Клиническая картина коарктации аорты представлена множеством симптомов; проявления и их выраженность зависят от периода течения порока и сопутствующих аномалий, влияющих на внутрисердечную и системную гемодинамику. У детей раннего возраста с коарктацией аорты могут отмечаться задержка роста и увеличения массы тела. Преобладают симптомы левожелудочковой недостаточности: ортопноэ, одышка, сердечная астма, отек легких.
В более старшем возрасте, в связи с развитием легочной гипертензии, характерны жалобы на головокружение, головную боль, сердцебиение, шум в ушах, снижение остроты зрения. При коарктации аорты нередки носовые кровотечения, обмороки, кровохарканье, чувство онемения и зябкости, перемежающаяся хромота, судороги в нижних конечностях, абдоминальные боли, обусловленные ишемией кишечника.
Средняя продолжительность жизни пациентов с коарктацией аорты составляет 30-35 лет, около 40% больных умирают в критическом периоде (возрасте до 1 года). Наиболее частыми причинами летального исхода в периоде декомпенсации служат сердечная недостаточность, септический эндокардит, разрывы аневризм аорты, геморрагический инсульт.
Диагностика коарктации аорты
При осмотре обращает внимание наличие атлетического типа телосложения (преимущественное развитие плечевого пояса при худых нижних конечностях); усиление пульсации сонных и межреберных артерий, ослабление или отсутствие пульсации на бедренных артериях; повышенное АД на верхних конечностях при снижении АД на нижних конечностях; систолический шум над верхушкой и основанием сердца, на сонных артериях и т. д.
В диагностике коарктации аорты решающую роль играют инструментальные исследования: ЭКГ, ЭхоКГ, аортография, рентгенография грудной клетки и рентгенография сердца с контрастированием пищевода, зондирование полостей сердца, вентрикулография и др.
Электрокардиографические данные свидетельствуют за перегрузку и гипертрофию левых и/или правых отделов сердца, ишемические изменения миокарда. Рентгенологическая картина характеризуется кардиомегалией, выбуханием дуги легочной артерии, изменением конфигурации тени дуги аорты, узурацией ребер.
Эхокардиография позволяет непосредственно визуализировать коарктацию аорты и определить степень стеноза. Детям старшего возраста и взрослым может выполняться чреспищеводная ЭхоКГ.
При катетеризации полостей сердца определяется престенотическая гипертензия и постстенотическая гипотензия, снижение парциального давления кислорода в постстенотическом отделе аорты. С помощью восходящей аортографии и левой вентрикулографии обнаруживается стеноз, оценивается его степень и анатомический вариант. Коронарография при коарктации аорты показана в случае наличия эпизодов стенокардии, а также при планировании операции пациентам старше 40 лет для исключения ИБС.
Коарктацию аорты следует дифференцировать от других патологических состояний, протекающих с явлениями легочной гипертензии: вазоренальной и эссенциальной артериальной гипертензии, аортального порока сердца, неспецифического аортита (болезни Такаясу).
Лечение коарктации аорты
При коарктации аорты возникает необходимость в медикаментозной профилактике инфекционного эндокардита, коррекции артериальной гипертензии и сердечной недостаточности. Устранение анатомического порока аорты проводится только оперативным путем.
Кардиохирургическая операция по поводу коарктации аорты осуществляется в ранние сроки (при критическом пороке - до 1 года, в остальных случаях в возрасте от 1 до 3-х лет). Противопоказаниями к хирургическому лечению коарктации аорты служат необратимая степень легочной гипертензии, наличие тяжелой или некорригируемой сопутствующей патологии, терминальная стадия сердечной недостаточности.
Для лечения коарктации аорты в настоящее время предложено следующие типы открытых операций:
- I. Местно-пластическая реконструкция аорты: резекция стенозированного участка аорты с наложением анастомоза «конец в конец»; прямая истмопластика с продольным рассечением стеноза и сшиванием аорты в поперечном направлении; непрямая истмопластика (с использованием лоскута из левой подключичной артерии или синтетической заплаты, с наложением сонно-подключичного анастомоза).
- II.Резекция коарктации аорты с протезированием: с замещением дефекта артериальным гомотрансплантатом или синтетическим протезом.
- III. Создание обходных анастомозов: обходное шунтирование с использованием левой подключичной артерии, селезеночной артерии или гофрированного сосудистого протеза.
При локальном или тандемном стенозе и отсутствии выраженного кальциноза и фиброза в области коарктации выполняется транслюминальная баллонная дилатация аорты. Послеоперационные осложнения могут включать развитие рекоарктации аорты, аневризмы, кровотечения; разрывы анастомозов, тромбозы реконструированных участков аорты; ишемию спинного мозга, ишемическую гангрену левой верхней конечности и др.
Прогноз коарктации аорты
Естественное течение коарктации аорты определяется вариантом сужения аорты, наличием других ВПС и в целом имеет крайне неблагоприятный прогноз. При отсутствии кардиохирургической помощи 40-55% больных погибает на первом году жизни. При своевременном хирургическом лечении коарктации аорты хороших отдаленных результатов удается достичь у 80-95% больных, особенно если операция проведена в возрасте до 10 лет.
Оперированные больные с коарктацие аорты пожизненно находятся под наблюдением кардиолога и кардиохирурга; им рекомендуется ограничение физической активности и нагрузок, регулярные динамические осмотры для исключения послеоперационных осложнений. Исход беременности после реконструктивных операций по поводу коарктации аорты обычно благоприятный. В процессе ведения беременности для профилактики разрыва аорты назначаются гипотензивные средства, проводится профилактика инфекционного эндокардита.
Лейкоз при врожденных пороках сердца. Парадоксальные эмболии и тромбозы сосудов мозга при пороке сердца
Под термином «лейкозы» подразумевается заболевание лейкопоэтического аппарата, проявляющееся количественными и качественными извращениями лейкопоэза. Этиология и патогенез этого заболевания еще не выяснены.
По течению лейкозы подразделяются на острые и хронические, по характеру изменения периферической крови — на лейкемические, сублейкемические и алейкемические.
И. А. Кассирский и Г. А. Алексеев (1955) отмечали, что для лейкозов характерны системное поражение органов кроветворения с явлениями лейкемической «взаимной» метаплазии, то есть замещение миелоидного кроветворения лимфатическим или лимфатического — миелоидным; лейкемическое замещение мезенхимы в различных органах (развитие так называемых очагов гетеротопного кроветворения); патологическая эмбрионализация кроветворной системы.
Сочетание лейкозов и врожденных пороков сердца отмечается чрезвычайно редко. Pleydel (1957, 1960) и Muller (1963) описали лейкоз у больных с различными врожденными аномалиями, в том числе и врожденными пороками сердца. Heath, Hasterlik (1963) и Heath, Marring, Zelkowitz (1964) сообщили о 7 больных с различными врожденными пороками сердца в возрасте от 4 дней до 5 лет, которых они наблюдали в 1956—1960 гг. Данные этих авторов в 5 случаях секционные и в 2 — клинические. Следует отметить, что авторы не указывают ни форму лейкоза, ни течение его, однако можно предположить, что у 5 детей до 1 года имелся острый лейкоз. При этом они проводят этиологическую связь между лейкозом и врожденными пороками сердца, полагая, что развитие обоих заболеваний обусловлено радиоактивным излучением.
Парадоксальные эмболии и тромбозы сосудов мозга при пороке сердца
Поражения мозга при врожденных пороках сердца давно привлекают внимание исследователей. Если в период до хирургического лечения пороков сердца они изучались в основном морфологами и носили чисто описательный характер, то с началом оперативного лечения появились работы невропатологов и психиатров, посвяг щенные неврологической симптоматике при врожденных пороках сердца (Bodechtel, 1953; Г. А. Акимов, 1961; Stephens, 1962; В. Б. Гельфанд, 1964, 1967; В. В. Гельфанд и Л. Д. Крымский, 1967, и др.). Мы остановимся на некоторых осложнениях.
Эмболии сосудов мозга у больных с врожденными пороками сердца наблюдаются сравнительно редко. Они отмечаются чаще при сложных врожденных пороках сердца (например при тетраде Фалло): эмболы из вен большого круга кровообращения через дефект межпредсердной, межжелудочковой перегородки или открытый артериальный проток проходят, минуя сосуды легких, в артерии большого круга, в частности артерии мозга (Bodechtel, 1953; Fluling, Markoux, 1953; З. Л. Лурье, 1958, 1960; П. Ф. Попелюк с соавт., 1964, и др.). Источником парадоксальных эмболов является тромбоз вен нижних конечностей или геморроидальных, однако возможно попадание эмболов при тромбоэмболии легочной артерии. Парадоксальные эмболии приводят к развитию абсцессов, очагов размягчения мозга, тромбозов сосудов мозга со смертельным исходом или развитием гемиплегии.

У больных с цианозом нарушения мозгового кровообращения развиваются на почве гипоксии, полицитемии, повышенной вязкости крови с последующими кровоизлияниями в мозг (В. Б. Гельфанд и Л. Д. Крымский, 1967). По мнению Teyler, Clark (1957), у детей раннего возраста большую роль играет гипоксия, а старше 2—3 лет — полицитемия.
Исследования Л. Д. Крымского (1963) показали, что при врожденных пороках сердца «синего» типа в мозгу наблюдаются застойное полнокровие, нарушение целостности аргирофильных мембран капилляров и повышение их проницаемости, вследствие чего сосуды головного мозга начинают пропускать жидкую часть крови, диаиедезные кровоизлияния в веществе головного мозга, очаги размягчения, возникающие независимо от оперативного лечения.
Неврологическая симптоматика острых нарушений мозгового кровообращения достаточно хорошо освещена в соответствующих руководствах, поэтому мы не будем на ней останавливаться.
Паралич и парезы типа гемиплегии наблюдаются, по данным Teyler и Clark (1957), у 3,8% больных с цианозом, по данным Methiann (1954) — у 2,5%.
В. Б. Гельфанд и Л. Д. Крымский (1967) наблюдали гемипарез или парапарез у 4 из 105 больных с врожденными пороками сердца «синего» типа. При неврологическом обследовании у всех больных выявлены и другие неврологические симптомы, свидетельствующие о хронической недостаточности мозгового кровообращения. Авторы полагают, что причиной этих нарушений являются артериальная гипоксия и полицитемия, приводящие к морфологическим изменениям в мозгу.
Мы наблюдали гемипарез у 15 больных: у 12 — из 684 больных с тетрадой Фалло, у 1 — из 66 с трикуспидальной атрезией, у 1 — из 484 с открытым артериальным протоком. Гемиплегия у большинства больных развивалась на первом-втором году жизни.
Таким образом, и по нашим данным, гемиплегия чаще наблюдается у больных с цианозом. У больных с лево-правым шунтом она бывает очень редко.
Читайте также:
- Медиастинальный (средостенный) доступ к легочным артериям. Выделение легочных артерий
- Симптомы риносинусита с ВИЧ и его лечение
- Диагностика перимезенцефального субарахноидального кровоизлияния на КТ, МРТ
- Капиллярная гемангиома глазницы: признаки, гистология, лечение, прогноз
- Мукоэпидермальная карцинома бронха на рентгенограмме, КТ
