Рецепторы к гонадотропному рилизинг гормону. Агонисты и антагонисты
Добавил пользователь Валентин П. Обновлено: 27.01.2026
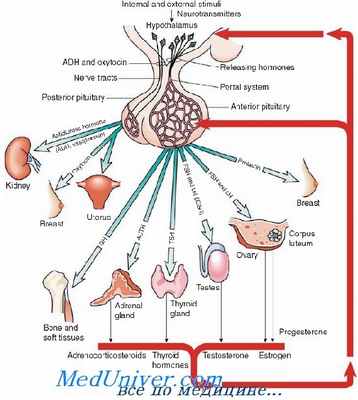
В качестве противоопухолевых средств в клинической практике применяют ряд гормональных препаратов — агонистов и антагонистов андрогенов, эстрогенов, гестагенов и других гормонов. Эти средства показаны преимущественно при гормональнозависимых опухолях. Гормональная противоопухолевая терапия имеет важное значение при лечении рака молочной железы, эндометрия, предстательной железы. Применяют гормональные средства также для лечения рака почки, карциноида, некоторых опухолей поджелудочной железы, меланомы и др.
Взаимодействие между гормонами и гормональнозависимыми опухолями было выявлено впервые в 1896 г., когда хирург из Глазго J. Beatson опубликовал данные успешного лечения трех женщин с прогрессирующим раком молочной железы, которым была произведена двусторонняя овариэктомия.
По механизму действия гормональные препараты отличаются от цитотоксических противоопухолевых средств. Основная их роль — восстановление нарушенной гуморальной регуляции функции клеток. Вместе с тем не исключается и специфическое влияние на опухолевые клетки: они в определенной степени тормозят деление клеток и способствуют их дифференцировке.
Эстрогены назначают для подавления действия в организме андрогенов (например, при раке предстательной железы), андрогены, напротив, — для уменьшения активности эстрогенов (при раке молочной железы и др.). При раке молочной железы и матки используют также прогестины (медроксипрогестерон).
К противоопухолевым гормональным средствам и антагонистам гормонов относят:
1. Андрогенные средства — тестостерон, метилтестостерон, дростанолон (медротестрона пропионат), пролотестон.
2. Эстрогенные средства — фосфэстрол, диэтилстильбэстрол, полиэстрадиола фосфат, эстрамустин, этинилэстрадиол, хлоротрианизен, полиэстрадиола фосфат, гексэстрол.
3. Гестагенные средства (прогестины) — гестонорона капроат, медроксипрогестерон, мегестрол и др.
4. Антагонисты эстрогенов (антиэстрогены) — тамоксифен, торемифен.
5. Антагонисты андрогенов (антиандрогены): бикалутамид, флутамид, ципротерон и др.
6. Гипоталамические факторы («рилизинг-факторы»), высвобождающие гормоны гипофиза: бусерелин, гозерелин, лейпрорелин, трипторелин и др.
7. Ингибиторы ароматазы (аминоглутетимид, анастрозол, эксеместан, летрозол).
8. Ингибиторы биосинтеза гормонов надпочечников (аминоглутетимид, митотан).
9. Глюкокортикоиды (преднизолон, дексаметазон и др.).
10. Аналоги соматостатина (октреотид, ланреотид).
Андрогены иногда применяют при метастатическом раке молочной железы. Назначают их женщинам с сохраненным менструальным циклом и в том случае, когда продолжительность менопаузы не превышает 5 лет. Нежелательными эффектами андрогенов, особенно при применении больших доз, являются вирилизация у женщин (огрубение голоса, чрезмерный рост волос на лице), задержка воды и солей в организме и др. Начало применения андрогенов (в частности тестостерона) для лечения рака молочной железы относят к 40-м гг. XX в.
Начиная с 1951 г. при лечении рака молочной железы широко используются прогестины. Гестагенные препараты применяют также для лечения рака эндометрия и рака почек, но мало используют для лечения рака простаты.
Основным показанием к назначению эстрогенов, начало использования которых в онкологической практике также относится к 40-м гг. XX в., является рак предстательной железы. При раке молочной железы их теперь назначают очень редко.
Важную роль в механизме действия гормональных препаратов играет их связывание со специфическими рецепторами, обнаруженными в тканях и некоторых опухолях.
Антиэстрогены конкурентно связываются с эстрогеновыми рецепторами в органах-мишенях и препятствуют образованию эстрогенрецепторного комплекса с эндогенным лигандом — 17-бета-эстрадиолом. В результате они тормозят стимулируемый эстрогенами рост опухоли. Чем больше эстрогенных рецепторов в опухоли — тем благоприятнее результат лечения антиэстрогенами.
Эффективным антиэстрогеном является тамоксифен — эталонный препарат для лечения рака молочной железы (особенно у женщин в менопаузе). Клиническое использование тамоксифена было начато в 1973 г. В настоящее время тамоксифен является широко используемым препаратом как для проведения адъювантной терапии, так и при лечении больных с диссеминированным процессом. Показано, что тамоксифен эффективен при всех стадиях заболевания, хорошо переносится при приеме в терапевтических дозах. Кроме основного показания — рак молочной железы у женщин — тамоксифен применяют при лечении рака грудной железы у мужчин, рака эндометрия, рака предстательной железы и др.
Среди антиандрогенов выделяют вещества, которые только блокируют андрогенные рецепторы (т.н. чистые андрогены) — бикалутамид, флутамид, и вещества, которые, кроме способности блокировать рецепторы, имеют гонадотропную активность (т.н. антиандрогены двойного действия) — ципротерон.
Флутамид и бикалутамид блокируют связывание андрогенов с клеточными рецепторами, вследствие чего препятствуют проявлению биологических эффектов андрогенов в андрогенчувствительных органах, в т.ч. в клетках предстательной железы, и таким образом препятствуют росту опухоли. После приема флутамида отмечается повышение плазменных уровней тестостерона и эстрадиола.
Ципротерон обладает более выраженным андрогенным действием, т.к. помимо блокирования действия дигидротестостерона на уровне рецепторов, подавляет высвобождение гонадотропинов и, следовательно, синтез андрогенов. Одновременно с тестостероном в крови снижается содержание ЛГ и ФСГ.
Особым видом антиандрогенной активности обладают соединения, ингибирующие 5-альфа-редуктазу — внутриклеточный фермент предстательной железы, способствующий превращению тестостерона в более активный андроген — дигидротестостерон (ДГТ). Одним из ингибиторов 5-альфа-редуктазы является финастерид, применяющийся при лечении доброкачественной гиперплазии предстательной железы.
Гипоталамические рилизинг-факторы — эндогенные пептидные соединения, оказывающие влияние на высвобождение гипофизом гонадотропных гормонов (в т.ч. лютеинизирующего и фолликулостимулирующего). В настоящее время в медицинских целях используют не естественные рилизинг-факторы из гипоталамуса животных (овец, свиней), а их синтетические аналоги. Аналоги (как агонисты, так и антагонисты) полипептидных гормонов создают путем присоединения, выделения, замещения или изменения некоторых аминокислот в полипептидной цепочке природного гормона. Гонадотропин-рилизинг-гормон (ГнРГ) — гонадорелин, гонадолиберин, гонадотропин-рилизинг фактор — один из представителей класса рилизинг-гормонов гипоталамуса. ГнРГ в большей степени влияет на секрецию ЛГ, нежели ФСГ, поэтому часто его называют также рилизинг-гормоном лютеинизирующего гормона (ЛГРГ).
ГнРГ представляет собой декапептид, состоящий из 10 аминокислот. Установлено, что аминокислоты в положении 2 и 3 ответственны за биологическую активность ГнРГ. Аминокислоты в положении 1, 6, 10 имеют структурную конфигурацию, необходимую для связывания с рецепторами клеток гипофиза. Замещение молекулы ГнРГ в положении 6 и 10 позволило создать агонисты рилизинг-гормона.
Синтетические гонадолиберины — нафарелин, гозерелин, гистрелин, лейпрорелин — аналоги гонадотропин-рилизинг-гормона — содержат D-аминокислоты в положении 6 и этиламидзамещающий глицин в положении 10. Результатом замены аминокислотных остатков в молекуле природного гормона является более выраженное сродство к рецепторам ГнРГ и более продолжительный период полураспада, поэтому аналоги имеют более сильное и более длительное действие, чем нативный гонадотропин-рилизинг-гормон. Так, активность гозерелина превышает активность нативного ГнРГ в 100 раз, трипторелина — в 36 раз, бусерелина — в 50 раз, а T1/2 синтетических гонадотропинов — 90–120 мин — намного превышает T1/2 нативного ГнРГ.
Гонадорелин секретируется гипоталамусом не постоянно, а в импульсном режиме, при этом пики следуют друг за другом с определенными интервалами, различными у мужчин и женщин: у женщин ГнРГ выделяется каждые 15 мин (фолликулярная фаза цикла) или 45 мин (лютеиновая фаза цикла и период беременности), у мужчин — 90 мин. ГнРГ обнаружен у всех млекопитающих. Пульсирующее выделение ГнРГ из гипоталамуса поддерживает выработку гонадотропинов в гипофизе.
Аналоги ГнРГ были предложены для клинического использования в 80-е гг. XX в. Эти лекарственные средства оказывают двухфазное действие на гипофиз: взаимодействуя с рецепторами ГнРГ клеток передней доли гипофиза, вызывают кратковременную стимуляцию с последующей длительной десенситизацией, т.е. снижением чувствительности рецепторов аденогипофиза к ГнРГ. После однократной инъекции аналога ГнРГ в результате стимулирующего эффекта усиливается секреция из передней доли гипофиза ЛГ и ФСГ (проявляется повышением содержания тестостерона в крови у мужчин и эстрогенов у женщин), обычно этот эффект наблюдается в первые 7–10 дней. При постоянном длительном применении аналоги гонадорелина подавляют высвобождение ЛГ и ФСГ, снижают функцию яичек и яичников и, соответственно, содержание половых гормонов в крови. Эффект проявляется примерно через 21–28 дней, при этом концентрация тестостерона в крови у мужчин снижается до уровня, наблюдаемого после хирургической кастрации (т.н. «лекарственная кастрация»), а уровень эстрогенов в крови у женщин — до уровня, наблюдаемого в постменопаузе. Эффект является обратимым и после окончания приема препаратов физиологическая секреция гормонов восстанавливается.
Применяют аналоги ГнРГ при раке предстательной железы — они способствуют регрессу опухоли простаты. Женщинам назначают при гормонозависимых опухолях молочной железы, эндометриозе, фиброме матки, т. к. они вызывают истончение эндометрия, уменьшение симптоматики и размеров объемных образований. Кроме того, аналоги ГнРГ применяют при лечении бесплодия (в программах экстракорпорального оплодотворения).
Побочные эффекты этих ЛС, возникающие в начале лечения и обусловленные временной стимуляцией гипофиза, проявляются в усилении симптомов, либо появлении дополнительных симптомов основного заболевания. Эти явления не требуют отмены препарата. Избежать их при лечении рака предстательной железы позволяет одновременное назначение на 2–4 неделе антиандрогена.
Наиболее часто встречающимися нежелательными эффектами у мужчин являются «приливы», снижение либидо, импотенция, гинекомастия. У женщин часто отмечаются «приливы», усиление потоотделения и изменение либидо. При применении аналогов ГнРГ у женщин существует риск усиления снижения плотности костных трабекул в позвонках (может быть необратимым). За период 6-месячного лечения это снижение плотности незначительно, за исключением больных с факторами риска (например остеопороз).
Аналоги ГнРГ выпускаются в различных лекарственных формах — для п/к, в/м, интраназального применения. Внутрь эти ЛС не назначаются, т.к. декапептиды легко расщепляются и инактивируются в ЖКТ. Учитывая необходимость длительного лечения, аналоги ГнРГ выпускаются также в виде лекформ пролонгированного действия, в т.ч. микрокапсул, микросфер.
Большая скорость разрушения ГнРГ (2–8 мин) не позволяет использовать его в клинической практике для длительного применения. Для ГнРГ величина T1/2 из крови составляет 4 мин, при п/к или интраназальном введении его аналогов — примерно 3 ч. Биотрансформация осуществляется в гипоталамусе и гипофизе. При почечной или печеночной недостаточности коррекции режима дозирования, как правило, не требуется.
Ингибиторы ароматазы начали применяться в онкологической практике в 70–80-е гг. XX в. Ароматаза — цитохром Р450-зависимый фермент, отвечающий за превращение синтезирующихся в коре надпочечников андрогенов в эстрогены. Ароматаза присутствует в различных тканях и органах, включая яичники, жировую ткань, скелетные мышцы, печень, а также ткань опухоли молочной железы. У женщин в пременопаузе основным источником циркулирующих эстрогенов являются яичники, тогда как в постменопаузе эстрогены образуются главным образом вне яичников. Ингибирование ароматазы приводит к уменьшению образования эстрогенов у женщин как в пременопаузе, так и в постменопаузе. Однако в пременопаузе снижение биосинтеза эстрогенов компенсируется усилением синтеза гонадотропинов по принципу обратной связи — снижение синтеза эстрогенов в яичниках стимулирует выработку гипофизом гонадотропинов, которые, в свою очередь, усиливают синтез андростендиона, и уровень эстрогенов вновь повышается. В связи с этим ингибиторы ароматазы неэффективны у женщин в пременопаузе. В постменопаузе, когда яичники перестают функционировать, ось гипоталамус — гипофиз — надпочечники разорвана, и ингибирование ароматазы приводит к значительному подавлению биосинтеза эстрогенов в периферических тканях, а также в ткани опухоли молочной железы.
Первым и фактически единственным представителем ингибиторов ароматазы I поколения является аминоглутетимид — неселективный ингибитор ароматазы. Поскольку аминоглутетимид ингибирует целый ряд ферментов, участвующих в стероидогенезе (подавляет секрецию надпочечниками глюкокортикоидов (кортизола) и используется поэтому при болезни Иценко — Кушинга и др.), при его применении необходимо следить за функциональным состоянием коры надпочечников (может развиться ее гипофункция).
Поиски новых средств, обладающих большей селективностью, лучшей переносимостью и более удобным режимом дозирования, привели к появлению ингибиторов ароматазы II и III поколений. К настоящему времени созданы новые нестероидные (летрозол, анастрозол и др.) и стероидные (эксеместан) соединения этой группы.
Основным показанием для ингибиторов ароматаз является рак молочной железы у женщин в постменопаузе, в т.ч. при резистентности к терапии антиэстрогенами.
К группе ингибиторов биосинтеза гормонов надпочечников, используемых в онкологии, относят митотан и аминоглутетимид. Они подавляют секрецию глюкокортикоидов и могут вызывать деструкцию нормальной и опухолевой ткани коры надпочечников.
Глюкокортикоиды — преднизолон, дексаметазон в связи с их лимфолитическим действием и способностью угнетать митоз лимфоцитов применяют при острых лейкозах (главным образом у детей) и злокачественных лимфомах.
В качестве противоопухолевых средств применяют также некоторые аналоги соматостатина. Например, октреотид и ланреотид используют для симптоматической терапии эндокринных опухолей гастроэнтеропанкреатической системы.
Рецепторы к гонадотропному рилизинг гормону. Агонисты и антагонисты
Рецепторы к гонадотропному рилизинг гормону. Агонисты и антагонисты
Рецептор к гонадотропному рилизинг гормону (ГнРГ) представляет собой G-протеин, который, используя в качестве вторичных медиаторов инозитолтрифосфат и диацилглицерол, стимулирует протеинкиназу, высвобождение ионов кальция и активирует циклический аденозинмонофосфат (цАМФ). Рецептор к гонадотропному рилизинг гормону (ГнРГ) кодируется геном 14q21.1 и экспрессируется во многих тканях вне мозга, в том числе фолликулах яичника и плаценте.
Предполагают, что у человека действие гонадотропного рилизинг гормона-2 осуществляется посредством рецептора к ГнРГ-1. Хотя рецептор к гонадотропному рилизинг гормону-2 присутствует у многих видов млекопитающих, его функциональные возможности ограничены за счет изменения порядка считывания и стоп-кодона. Регуляция функций рецептора к гонадотропному рилизинг гормону осуществляется многими веществами, в том числе самим гонадотропным рилизинг гормоном, ингибином, активином, эстрогеном и прогестероном.
Изменения аминокислотной последовательности гонадотропного рилизинг гормона могут удлинять период его полужизни на часы или дни и изменять его биологическую активность как в сторону агонизма, так и в сторону антагонизма. Все существующие на сегодняшний день агонисты гонадотропного рилизинг гормона обладают удлиненным периодом полужизни за счет замещения аминокислоты 6 (и иногда 10) исходного гонадотропного рилизинг гормона.
Непрерывная стимуляция рецептора к гонадотропному рилизинг гормону приводит к его десенситизации вследствие фосфорилирования и изменения строения рецептора, разрыва связей с G-протеинами, поглощением рецептора путем эндоцитоза и снижения его синтеза. Сразу же после введения все агонисты гонадотропного рилизинг гормона вызывают повышение секреции гонадотропина (эффект «вспышки»). Однако через 7-14 дней развивается десенситизация рецепторов к гонадотропному рилизинг гормону, вызывая угнетение функций гипофиза.
В противоположность этому антагонисты гонадотропного рилизинг гормона напрямую ингибируют секрецию гонадотропина. По своей структуре антагонисты гонадотропного рилизинг гормона являются тем же исходным декапептидом гонадотропного рилизинг гормона, но с замещением многих аминокислот. Существующие в продаже антагонисты гонадотропного рилизинг гормона цетрореликс и ганиреликс представляют собой исходный декапептид гонадотропного рилизинг гормона с добавлением больших аминокислотных последовательностей к аминокислоте 1.
Антагонисты гонадотропного рилизинг гормона конкурируют за гипофизарные рецепторы к гонадотропному рилизинг гормону и связываются с ними, блокируя таким образом эндогенное связывание гонадотропного рилизинг гормона с его рецептором. В отличие от агонистов гонадотропного рилизинг гормона антагонистам не свойствен эффект «вспышки». В связи с тем что утраты рецепторов при этом не наблюдается, необходимо обеспечивать постоянное поступление антагониста гонадотропного рилизинг гормона в организм, чтобы все рецепторы были всегда заблокированы. По этой причине терапевтическая доза антагонистов гонадотропного рилизинг гормона выше и исчисляется миллиграммами в отличие от микрограммов у агонистов.
Использование агонистов гонадотропных рилизинг-гормонов в терапии эндометриоза
В статье отражены современные представления о патогенезе эндометриоза. Приведено патогенетическое обоснование использования препарата Бусерелин-лонг ФС, обеспечивающего влияние на механизмы развития эндометриоза, с целью фармакологической коррекции данной патологии.
- КЛЮЧЕВЫЕ СЛОВА: эндометриоз, заболевания гипоталамо-гипофизарной системы, гинекологическая эндокринология, гинекология, эндокринология, гормональная терапия
В статье отражены современные представления о патогенезе эндометриоза. Приведено патогенетическое обоснование использования препарата Бусерелин-лонг ФС, обеспечивающего влияние на механизмы развития эндометриоза, с целью фармакологической коррекции данной патологии.
Эндометриоз – полиэтиологическое заболевание, которое следует рассматривать как патологический процесс с хроническим, рецидивирующим течением. Известно, что эндометриоз формируется и развивается на фоне нарушенных иммунных, молекулярно-генетических и гормональных взаимоотношений в женском организме [1], однако патогенез данного заболевания до сих пор не до конца изучен [2].
Эндометриоз чаще всего развивается при дефиците прогестерона, на фоне относительной и/или абсолютной гиперэстрогении [3]. В этой связи патогенетической основой гормональной терапии является временное угнетение функции яичников, то есть уменьшение секреции эстрадиола, приводящее к регрессу очагов эндометриоза [4]. Кроме того, целью лечения эндометриоза является удаление патологических очагов, купирование клинической симптоматики, восстановление репродуктивной функции [5].
Широкое внедрение агонистов гонадотропных рилизинг-гормонов (аГнРГ) в клиническую практику для лечения большого числа гормоночувствительных заболеваний послужило поводом для дальнейшего изучения механизмов действия препаратов этой группы. Для лечения эндометриоза аГнРГ используются с начала 80-х гг. XX века [4, 6]. В настоящее время аГнРГ признаны препаратами первой линии при лечении тазовых болей, обусловленных эндометриозом [7]. Препараты данной группы отличаются выраженной молекулярной специфичностью и взаимодействуют с соответствующими рецепторами передней доли гипофиза.
Механизм действия аГнРГ связан с восстановлением нарушенных взаимосвязей в гипоталамо-гипофизарной системе, возникающих у больных с миомой и эндометриозом, и заключается в следующем: после связывания аГнРГ с рецепторами на поверхности гонадотропных клеток происходит интенсивное высвобождение лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов и, опосредованно, увеличение синтеза эстрадиола в яичниках. Продолжительное, в течение нескольких часов, воздействие аГнРГ на гипофиз приводит к десенситизации клеток гипофиза и быстрому уменьшению интенсивности секреции и биосинтеза гонадотропинов, особенно ЛГ. В таком десенситизированном состоянии гонадотропные клетки могут оставаться до тех пор, пока продолжается непрерывное воздействие высоких доз агонистов ГнРГ на гипофиз [8].
Этот феномен называют «медикаментозная кастрация». Угнетение стероидогенеза, вызываемое агонистами ГнРГ, индуцирует атрофию самого эндометрия, эктопических эндометриальных желез и стромы. Блокада является обратимой, после отмены аГнРГ полностью восстанавливается чувствительность аденогипофиза к гипоталамической стимуляции [9, 10].
Помимо гипофиза рецепторы к аГнРГ обнаружены в яичниках, эндометрии, раковых клетках злокачественных опухолей яичников и молочных желез и других тканях, что послужило поводом для широкого использования данной группы препаратов в лечении гормонозависимых заболеваний.
В заключении Международного консенсуса по лечению эндометриоза (Зальцбург, 2005) эксперты, основываясь на данных рандомизированных исследований, квалифицировали аГнРГ как более эффективную группу препаратов для подавления эндометриодных очагов, чем прогестины и оральные контрацептивы [6].
Бусерелин-лонг ФС (компания ЗАО «Ф-Синтез», Россия) – агонист ГнГР, рекомендованный при всех видах гормонозависимых пролиферативных процессов матки. Препарат обеспечивает стойкий терапевтический эффект при внутримышечном введении один раз в 28 дней в дозировке 3,75 мг. Возможно эндоназальное использование препарата Бусерелин ФСинтез (ЗАО «Ф-Синтез», Россия) по 300 мкг 3–4 раза в сутки. Рекомендованная длительность лечения – до 6 месяцев. Необходимо отметить, что пролонгированные формы являются наиболее удобными для обеспечения длительного поступления препарата [11].
В препарате Бусерелин-лонг ФС активное вещество заключено в микросферы размерами от 30 до 150 и различным временем рассасывания, основу которых представляет биорастворимый сополимер DL молочной и гликолевой кислот. Микросферы в виде водной суспензии вводятся глубоко внутримышечно. После инъекции пролонгированной формы препарата начинается постепенное высвобождение аГнРГ с поверхности микросфер, что в течение нескольких первых суток приводит к стимуляции синтеза гонадотропинов, а затем к десенситизации гипофиза и блокаде гипофизарно-гонадной оси. В дальнейшем микросферы, подвергаясь биодеградации в тканях, медленно высвобождают содержащийся в них аГнРГ, длительно (до 28 дней) поддерживая необходимую для десенситизации гипофиза концентрацию препарата в крови. Сам сополимер метаболизируется в организме до мономеров молочной и гликолевой кислот.
Бусерелин-лонг ФС рекомендован для терапии распространенных форм эндометриоза, при эндометриозе и бесплодии, при наличии клинической симптоматики и др. Терапия проводится в течение 6 месяцев (Бусерелин ФСинтез 900 мкг/сутки интраназально, возможно увеличение дозы до 1200 мкг/сутки или Бусерелин-лонг ФС 3,75 мг внутримышечно 1 раз в 28 дней). В репродуктивном возрасте после отмены Бусерелина нормальный менструальный цикл восстанавливается через 2–3 месяца [12]. При комбинированной терапии эндометриоза на первом этапе проводится курс лечения препаратом аГнРГ в течение 3 месяцев (по одной инсуфляции препаратом Бусерелин ФСинтез 150 мкг в каждый носовой ход 3–4 раза в день или одна суспензия Бусерелин-лонг 3,75 мг внутримышечно 1 раз в 28 дней), затем выполняется хирургическое лечение, дальнейшая терапия аГнРГ продолжается в течение 3 менструальных циклов (в прежнем режиме) [13]. Альтернативный вариант – выполнение хирургического лечения на первом этапе, в дальнейшем – послеоперационная терапия препаратом аГнРГ в течение 6 месяцев (Бусерелин ФСинтез интраназально – в носовые ходы после их предварительного очищения – 2 полных нажатия помпы (0,3 мг) 3–4 раза в сутки через 6–8 часов или Бусерелин-лонг ФС внутримышечно 1 раз в 28 дней).
Предоперационная подготовка Бусерелином снижает интенсивность симптомов заболевания, уменьшает эндометриоидные очаги, облегчает проведение оперативного вмешательства.
Состояние медикаментозной псевдоменопаузы в сочетании с активизацией апоптоза и блокированием ряда ростовых факторов в гетеротропных имплантах при эндометриозе способствует устранению болевого синдрома и уменьшению распространенности эндометриоидных поражений примерно у 75–92% больных [10].
Необходимость гормонального лечения при эндометриозе яичников в пред- и послеоперационном периодах обусловлена высоким процентом рецидива заболевания даже после радикальной операции [4]. По мнению В.П. Баскакова и соавт., поскольку на данный момент нет метода, который бы обеспечил точную оценку радикальности хирургического удаления эндометриоидного образования во время операции, отсутствие рецидива не может быть гарантировано. Есть вероятность рецидива и при применении только медикаментозной терапии, что обусловлено ролью системных нарушений (изменение иммунитета, генетическая предрасположенность) в патогенезе эндометриоза яичников. При рассмотрении эндометриоза как доброкачественной опухоли все случаи рецидивирования следует расценивать либо как не диагностированный ранее эндометриоз яичников, либо как неполное удаление эндометриоидной ткани из яичника.
Появление в клинической практике аГнРГ позволило сохранить репродуктивную функцию у больных эндометриозом, отказаться от выполнения радикальных операций, улучшить результаты консервативной терапии.
Несмотря на описанные выше преимущества аГнРГ, широкое применение этой группы препаратов ограничено развитием эстрогендефицитных симптомов. Выраженность побочных эффектов, в частности снижение минеральной плотности костной ткани, накладывает определенные ограничения на продолжительность лечения. С целью уменьшения тяжести сопутствующих явлений при приеме аГнРГ рекомендуют назначение заместительной гормональной терапии (ЗГТ). Обоснованием данного подхода служит гипотеза пороговой концентрации эстрогенов, согласно которой концентрация эстрогенов в пределах определенного диапазона может частично предотвращать снижение минеральной плотности костной ткани при длительном лечении аГнРГ и в то же время не оказывать стимулирующего действия на рост эндометриоидных имплантатов. ЗГТ рекомендуется проводить с началом курса лечения аГнРГ не менее 6 месяцев [14].
Гормональная терапия эндометриоза многообразна и сложна, требует индивидуального подхода с учетом возраста, соматического статуса и характера выявленных нарушений. Наряду с хирургическим вмешательством медикаментозная терапия имеет важное значение в лечении этой социально значимой патологии. Уточнение патогенетических аспектов развития заболевания позволяет внедрять новые методы терапии. Дальнейшее изучение этиологических и патогенетических особенностей эндометриоза позволит разработать новые консервативные методы его лечения [15].
Агонисты гонадотропных релизинг–гормонов в лечении миомы матки
Согласно современным представлениям миома матки – это моноклональный [5–7] гормончувствительный пролиферат, состоящий из фенотипически измененных гладкомышечных клеток миометрия.
Моноклональная характеристика миомы матки позволила опровергнуть теорию о том, что миома матки развивается вследствие системных гормональных изменений, обозначив это образование, как локальную патологию миометрия.
Существуют две теории происхождения клетки–предшественника миомы матки: одна подразумевает появление дефекта клетки во время онтогенетического развития матки, вследствие длительного нестабильного периода формирования эмбриональных гладкомышечных клеток [8], вторая – предполагает возможность повреждения клетки в зрелой матке [10]. Тот факт что, согласно патологоанатомическим исследованиям распространенность миомы матки достигает 85% [9], позволяет считать вторую теорию происхождения клетки–предшественника более очевидной.
Формирование «зачатка роста» миоматозного узла вероятнее всего происходит следующим образом. Во время каждого овуляторного менструального цикла во время первой фазы под действием эстрогенов на поверхности клеток миометрия накапливаются рецепторы к половым гормонам и различным факторам роста (EGF, TGF бета, bFGF и др.) [23–25]. После овуляции под воздействием прогестерона, вырабатываемого желтым телом, происходит процесс гиперплазии миометрия. Прогестерон оказывает как прямое воздействие на клетки миометрия, связываясь со своими специфическими рецепторами, так и опосредованное, за счет экспрессии различных факторов роста [11–14]. Гиперплазия миометрия происходит равномерно, это, в частности, реализуется за счет сбалансированной экспрессии двух типов рецепторов прогестерона (А и В). А–тип рецепторов является блокирующим, а В–тип эффекторным. Равномерное распределение этих рецепторов обеспечивает равномерное увеличение ткани миометрия [15].
В случае ненаступления беременности концентрация прогестерона в крови падает и в ткани миометрия активизируется процесс апоптоза, за счет которого происходит элиминация избыточных гладкомышечных клеток. Именно благодаря этому механизму матка не увеличивается в размере от цикла к циклу.
Можно предполагать, что в ходе многократно повторяющихся циклов гиперплазии миометрия, сменяющихся апоптозом, происходит накопление гладкомышечных клеток, в которых нарушается процесс апоптоза, и эти пролиферирующие клетки подвергаются воздействию различных повреждающих факторов. Повреждающим фактором могут выступать ишемия, обусловленная спазмом спиральных артерий во время менструации, воспалительный процесс, травматическое воздействие вследствие медицинских манипуляций или очаг эндометриоза.
С каждым менструальным циклом количество поврежденных клеток накапливается, но судьба их может быть различной. Часть клеток рано или поздно элиминируется из миометрия, из других начинают формироваться «зачатки» миоматозных узлов с различным потенциалом к росту. «Активный зачаток роста» на первых стадиях развивается за счет физиологического колебания гормонов во время менструального цикла. В дальнейшем образовавшаяся кооперация клеток активизирует аутокринно–паракринные механизмы, обусловленные факторами роста, формирует локальные автономные механизмы поддержания роста (локальная продукция эстрогенов из андрогенов [16,17] и образование соединительной ткани [10]), и в результате значение физиологических концентраций половых гормонов для формирования миоматозного узла перестает быть основным.
Исходя из данных генетического анализа миоматозных узлов пролиферативная активность миомы матки обусловлена дисрегуляцией генов высокоподвижных групп протеинов (HMGIC и HMGIY) [18–20], расположенных в хромосомах 12 и 6 соответственно, то есть в локусах наиболее распространенных хромосомных дисрегуляций, характерных для этого образования. Продуктом экспрессии генов HMGIY и HMGIC являются белки, отнесенные к различным семействам группы высокоподвижных белков (high mobility group proteins), которые являются хроматин–ассоциированными негистонными белками [21]. Эти белки играют важную роль в регуляции структуры и функции хроматина. Помимо этого, они ответственны за правильность трехмерной конфигурации комплекса ДНК с белком, то есть участвуют в таких клеточных процессах, как транскрипция ДНК. Аберрантная экспрессия HMGIC и HMGIY белков чаще всего характеризует злокачественный процесс [20]. Дисрегуляция этих белков вследствие хромосомных перестроек наиболее часто выявляется в различных доброкачественных мезенхимальных образованиях, таких как липома, легочная гамартома, полип эндометрия, а также и в лейомиоме [20,21]. Эти белки экспрессируются практически во всех органах и тканях во время онтогенеза (надпочечники, аорта, кости, мозг, сердце, кишечник, почка, легкое, печень, мышцы, яичники, плацента, кожа, селезенка, желудок, яички и матка), в то время как во взрослом организме экспрессия этих белков выявлена только в легких и почках [22]. Помимо этого, HMG белки экспрессируются при выращивании
in vitro клеточных культур вышеуказанных тканей [22]. Подобный характер экспрессии HMGIC и HMGIY белков указывает на их участие в быстром росте эмбриональных тканей и тканей в культуре.
Моноклональный пролиферат гладкомышечных клеток миометрия, в которых за счет дисрегуляции HMG генов активизирована программа клональной пролиферации ткани, на фоне нормального гормонального фона увеличивается в размерах, в то время как клетки неизмененного миометрия находятся в состоянии относительного покоя.
Значение гормонального фона для роста миоматозного узла до определенного этапа критично. С увеличением его размера формирование аутокринно–паракринной регуляции роста и становление локальных автономных механизмов делает рост миомы относительно независимым.
Изучение системы взаимодействия гипоталамуса, гипофиза и яичников способствовало расширению представлений об этиологии и патогенезе ряда гинекологических заболеваний. Стало очевидным, что для их коррекции необходима возможность экзогенного введения различных гормонов, определяющих функционирование гипоталамо–гипофизарно–яичниковой системы (ГГЯС). Основными ее регуляторами являются гонадотропные релизинг–гормоны (ГнРГ). В начале 80–х годов прошедшего столетия удалось синтезировать их химические аналоги, этот факт был расценен, как одно из революционных свершений в медицине. Действительно, появление лекарственной возможности «корректировать» работу ГГЯС и устранять воздействие половых гормонов на основные мишени позволяет рассматривать применение аналогов ГнРГ в качестве истинно патогенетической терапии, в частности, таких распространенных гинекологических нозологий, как миома матки и эндометриоз.
Как известно, механизм действия агонистов ГнРГ (ГнРГа) заключается в следующем: после связывания ГнРГ с рецепторами на поверхности гонадотропных клеток происходит интенсивное высвобождение ЛГ и ФСГ. Вместе с тем продолжительное воздействие ГнРГа на гипофиз в течение нескольких часов приводит к утрате чувствительности гонадотропных клеток и быстрому уменьшению интенсивности секреции и биосинтеза гонадотропинов, особенно ЛГ. В таком десентизированном состоянии гонадотропные клетки могут оставаться до тех пор, пока продолжается непрерывное воздействие высоких доз агонистов на гипофиз.
Это приводит к прогрессивному падению концентрации эстрогенов до уровня, наблюдаемого в менопаузе. Уровни тестостерона, андростендиона и пролактина снижаются параллельно уменьшению концентрации ЛГ. После отмены препарата в крови постепенно начинается подъем концентрации ФСГ и эстрадиола, однако уровень ЛГ остается подавленным еще в течение 4 недель.
Аналоги гонадотропин–релизинг гормона, способные вызвать обратимое гипогонадотропное/гипогонадное состояние, давно используются с целью лечения миомы матки. Множество исследований показали, что ГнРГа терапия может уменьшить размер и привести к инволюции миомы матки. Было высказано предположение, что уменьшение размеров миомы связано с гипогонадным состоянием, вызванным ГнРГ агонистами. Однако различные миоматозные узлы в одной матке в связи с их доказанной моноклональностью имеют различную чувствительность к терапии ГнРГа. Уменьшение размеров миомы вызвано не только гипоэстрогенным состоянием, но и другими дополнительными факторами.
Одним из альтернативных механизмов действия ГнРГа может быть прямой эффект ГнРГа на клетки лейомиомы.
МРНК рецептора ГнРГ, как и самого ГнРГ, транскрибируются как в нормальном миометрии, так и в ткани лейомиомы [1]. Выращивание в культуре эксплантов нормального миометрия и лейомиомы выявило, что экспланты нормального миометрия растут в виде hills and valleys, в то время как экспланты лейомиомы образуют агрегаты ball–like. Анализ in vitro показал, что ГнРГа могут вызывать значительные морфологические изменения в структуре шаровидных агрегатов лейомиомы, но в то же время не оказывают никакого воздействия на экспланты нормального миометрия. При оценке характера воздействия ГнРГа на экспрессию продуктов генов, ассоциированных с G1 фазой клеточного цикла, таких как циклин D1, циклин Е, p33cdk2 и p34cdk4, было выявлено, что ГнРГа оказывают дозозависимый двухфазный эффект на экспрессию циклина E и p33cdk2 в культуре ткани из лейомиомы (2).
С помощью ФИТЦ меченных ГнРГ было показано, что ГнРГ непосредственно связывается с цитоплазматической мембраной гладкомышечных клеток миометрия и миомы, взаимодействуя со своим специфичным рецептором.
ГнРГ гипоталамического происхождения довольно быстро разрушается в гипофизе и присутствует в довольно низкой концентрации в периферическом кровотоке. Поэтому маловероятно, что гипоталамус является основным источником ГнРГ, воздействующим на рост лейомиомы в матке. Таким образом, наличие в миометрии и в миоме как мРНК рецептора ГнРГ, так и мРНК ГнРГ позволяет предполагать, что ГнРГ или ГнРГ–подобные пептиды вовлечены в аутокринную и/или паракринную регуляцию пролиферации миометрия и лейомиомы in vivo.
Так, гладкомышечные клетки, культивированные из миометрия и лейомиомы, экспрессируют мРНК ГнРГ рецептора и ГнРГ. Их обработка ГнРГа приводит к морфологическим изменениям в шаровидных агрегатах, полученных при выращивании in vitro экспланта лейомиомы, а также к изменениям в экспрессии генов, ассоциированных с фазой G1 клеточного цикла. В миометрии эти изменения отсутствуют. Эти результаты предполагают, что ГнРГа может воздействовать на клетки лейомиомы через свои мембранные рецепторы, что приводит к уменьшению экспрессии генов циклина Е и p33cdk2.
ГнРГ–агонисты также оказывают существенный эффект на экстрацеллюлярный матрикс миомы, который играет важную роль в ее росте и регрессии. Ремоделирование ткани, включающее перестройку экстрацеллюлярного матрикса (ЭЦМ), регулируется совместным действием матриксных металлопротеиназ (ММП) и их тканевыми ингибиторами (ТИММП). Было показано, что лейомиома экспрессирует мРНК как ММП, так и ТИММП и их экспрессия обратно пропорционально изменяется во время роста миомы и во время регрессии, индуцированной ГнРГ агонистами [2]. Обусловленная ГнРГа регрессия миомы сопровождается увеличением экспрессии ММП с сопутствующим уменьшением экспрессии ТИММП–1, что может обеспечивать благоприятную среду для деградации ЭЦМ.
В результате исследования эффекта терапии ГнРГа на миому матки не обнаруживается значительных различий в гистологической картине миоматозных узлов пролеченных и нелеченных больных, в то время как иммуногистохимические исследования выявляют значительное снижение клеточного пролиферативного индекса (на 85%) под воздействием агонистов, а индекс метки ингибитора апоптоза bcl–2 не имеет значительных различий среди сравниваемых групп больных. Таким образом, терапия ГнРГ–агонистами приводит к значительному снижению количества клеток в клеточном цикле. Также отмечается значительное уменьшение экспрессии рецепторов эстрогенов и прогестерона [3].
Результат консервативной терапии миомы может оказаться недостаточным при наличии у больной больших миоматозных узлов. В таких случаях избежать хирургического вмешательства невозможно, тем не менее применение ГнРГ–агонистов у оперированных больных также значительно улучшает конечные результаты лечения. Это обусловлено способностью ГнРГ–агонистов уменьшать выраженность спаечного процесса за счет снижения активности образования тромбина, фибрина, ингибитора активатора плазминогена на 25%, уровня продуктов деградации фибрина на 35%, а также снижения иммунной активности NK–клеток и тем самым уменьшения воспалительного ответа организма [4]. Однако длительность операции значительно возрастает у тех пациенток, у которых миоматозный узел после терапии ГнРГ–агонистами приобретал при предоперационном ультразвуковом исследовании выраженную гипоэхогенность вследствие значительного размягчения ткани миомы, что усложняло выделение такого узла из матки. С другой стороны, назначение ГнРГ–агонистов после консервативной миомэктомии позволяет подавить микроскопические регенерационные зачатки миомы в миометрии и тем самым снизить существующий уровень рецидивирования заболевания, а также использовать прямое антипролиферативное и проапоптическое свойство ГнРГ–агонистов на возможные скрытые очаги эндометриоза (внутреннего и наружного).
В настоящий момент специалистам в области гинекологии доступен широкий спектр различных форм а–ГнРГ, одним из которых является Диферелин®. Проведенные нами в течение последних лет клинические наблюдения применения Диферелина у 46 пациенток в возрасте от 32 до 52 лет показали высокую эффективность этого препарата в отношении регрессии миоматозных узлов при адекватном назначении препарата.
Первоначальный размер матки больных, включенных в исследование, не превышал 10 недель беременности, а диаметр доминантных узлов не превышал 3 см. В среднем за 3 месяца консервативной терапии Диферелином размеры матки уменьшились до 5–6 недель, а миоматозные узлы уменьшились на 30–80%. Подобный разброс в результатах лечения объясняется гетерогенностью миоматозных узлов, что, вероятно, обусловливает их различную чувствительность к препарату.
Таким образом, Диферелин® является эффективным препаратом для комплексного консервативного лечения миомы матки малых размеров. Особенно важно его применение при сочетанных гинекологических патологиях: миома матки, эндометриоз и гиперплазии эндометрия. Это обусловлено тем, что во многом лечение миомы матки, эндометриоза и гиперпластических процессов эндометрия осуществляется фактически с использованием одних и тех же лечебных подходов. Диферелин® применяется также в послеоперационном противорецидивном лечении этих заболеваний [10]. При этом при применении Диферелин®а отсутствуют прогестагенные и андрогенные побочные эффекты, негативный эффект в отношении липидного профиля. Он может применяться при сопутствующих заболеваниях: фиброзно-кистозной мастопатии, гиперкоагуляции, поликистозном овариальном синдроме, дислипидемиях. Диферелин® значительно лучше переносится, чем антигонадотропины, что способствует большей приверженности пациентов лечению [26], и на современном этапе является препаратом патогенетической терапии доброкачественных гиперплазий матки и эндометриоза всех локализаций.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Рецепторы к гонадотропному рилизинг гормону. Агонисты и антагонисты
Доступная, качественная и высокотехнологичная медицинская помощь женщине и ребенку, содействие сохранению и восстановлению репродуктивного здоровья в семье и как следствие - снижение материнских и перинатальных потерь, детской инвалидности.
Внимание!
Внимание!
На сегодняшний день Перинатальный центр остается одним из медицинских учреждений, не перепрофилированных для лечения пациентов с коронавирусной инфекцией.
В период сложившейся эпидемиологической обстановки хотим обратить внимание, что у нас одноместные палаты, а это значит:
- вы сможете проводить время со своим малышом только наедине;
- ежедневный осмотр врачами малыша и мамы проводится в индивидуальном порядке в палате;
- отсутствуют контакты с другими пациентами;
- запрещены посещения родственниками;
- питание по графику с разграничением по времени;
- уникальная современная вентиляционная система, в каждой палате установлен фильтр тонкой очистки (Hepa H13),что дает 99% очистку воздуха от вирусов, бактерий и токсичной пыли.
При входе всем пациентам проводят измерение температуры тела, в случае повышения температуры более 37˚С пациент в Перинатальный центр не допускается.
Данные меры исключают риск заражения коронавирусной инфекцией.
ВНИМАНИЕ.
Мы рады пригласить будущих мам в Областной перинатальный центр для подписания диспансерных книжек (на сроке после 28 недель).
Весь комплекс медицинских услуг по родоразрешению Вы сможете получить по полису ОМС.
Департамент здравоохранения и фармации Ярославской области информирует, что в рамках реализации типового пилотного проекта «Репродуктивное здоровье», утверждённого Заместителем Председателя Правительства Российской Федерации Голиковой Т.А. от 25 ноября 2021 года № 12752п-П12, продолжается проведение регулярных встреч граждан с экспертами по проблемным вопросам репродуктивного здоровья.
Встречи проводятся каждую субботу на канале «Репродуктивное здоровье», который доступен по ссылкам:
График просветительского проекта «Репродуктивное здоровье» на август – декабрь 2022 год
№ п/п
Дата
Время
Эксперт
Наименование темы
Ожирение как междисциплинарная проблема. Профилактика и коррекция нарушений пищевого поведения. Правильное питание и психологические аспекты нарушений женского здоровья.
Современные возможности лекарственного и хирургического лечения нарушений мужского репродуктивного здоровья. Вспомогательные репродуктивные технологии при мужском бесплодии.
Беременность, роды и аборты у подростков. Особенности профилактического осмотра несовершеннолетних. Современные методы контрацепции для подростков и молодежи.
Миома матки: бессимптомная, симптомная. Семейные формы. Возможные варианты обследования и лечения.
Последствия перенесенного COVID-19 у женщин (постковидный синдром).
Рак предстательной железы и стереотипы мужского репродуктивного здоровья. Возможности современной медицины и правильное отношение к своему здоровью.
ВИЧ, гепатит и беременность. Профилактика ВИЧ и гепатита среди молодежи.
Доброкачественная дисплазия молочных желез. Предраковые заболевания и факторы риска развития злокачественных новообразований молочной железы. Что надо знать: простые ответы на вопросы женщин.
«Письма к сыну»: о каких эндокринных аспектах репродуктивного здоровья нам необходимо рассказывать подросткам
Репродуктивное здоровье онкопациентов: возможности стать родителями реальны.
Профилактика послеродовой депрессии, в том числе в период ограниченного социального общения. Постковидный синдром.
Планирование семьи при сахарном диабете и патологии щитовидной железы: на что обратить внимание.
Онкология и беременность: сохранение репродуктивной функции, подготовка и ведение беременности при онкозаболеваниях.
Подростковая беременность: аборт нельзя родить. Где поставить знак препинания или что делать в непростой ситуации?
Современная эстетическая и пластическая гинекология. Единство красоты, сексуальности и психологического комфорта.
Мы то, что мы едим. Питание и мужская фертильность. Что и как необходимо есть, пить для сохранения фертильности?
Медико-генетическое консультирование при планировании беременности. Вспомогательные репродуктивные технологии, программы помощи семьям. Неэффективность ВРТ и пути преодоления.
Не только гены: роль родителей в формировании детского ожирения. Влияние ожирения на соматическое, психологическое и социальное благополучие детей и подростков.
Новые возможности в медицине и репродукции (генетика, иммунология, клеточные технологии, эндокринология, репродуктивная хирургия, гинекология, урология, онкология).
⚡⚡⚡ Партнерские роды возобновились.
На основании п. 811. Постановления Главного Государственного санитарного врача РФ от 28.01.2021 №4 «Об утверждении санитарных правил и норм СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» партнёр, присутствующий при партнерских родах, обязан предоставить результат обследования на туберкулез (флюорографию органов грудной клетки) давностью не более 1 года.
Кроме того, будущему отцу нужно при себе иметь паспорт, сменную обувь (чистые резиновые сланцы), сменную чистую одежду (футболку и штаны), можно пару чистых носовых платков, пачку влажных антибактериальных салфеток и маленькую бутылочку с питьевой водой.
⚡⚡⚡ Закрытие на плановую дезинфекцию акушерских стационаров ГБУЗ ЯО «Областной перинатальный центр» запланировано на период с 12 по 26 декабря 2022 года.
⚡⚡⚡ Информация для сопровождающих лиц
⚡⚡⚡ Информация для пациентов с бесплодием, нуждающихся в проведении ВРТ
В соответствие с приказом Минздрава РФ от 31.07.2020 №803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению», который вступил в силу 01.01.2021, наличие показаний к проведению программ ВРТ осуществляет лечащий врач. Он же оформляет направление на проведение лечение бесплодия методом ЭКО.
Читайте также:
