Редкие наследственные коагуляционные нарушения
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гемофилия: причины появления, симптомы, диагностика и способы лечения.
Определение
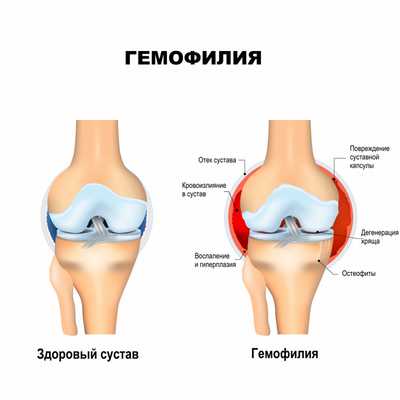
Гемофилия является редким, но серьезным наследственным заболеванием, связанным с нарушением функции свертывания крови, что приводит к неконтролируемым и часто спонтанным кровотечениям и кровоизлияниям в различные органы и ткани. При гемофилии организм человека не может естественным способом остановить кровотечение, возникшее из-за повреждения кровеносного сосуда в результате травмы, хирургического вмешательства или стресса. Интенсивность кровотечения сопоставима с таковой у здорового человека, однако оно продолжается значительно дольше.
Кровь содержит много белков, называемых факторами свертывания, которые помогают остановить кровотечение. Существует два различных типа гемофилии. Каждый отличается дефицитом определенного фактора свертывания крови. Заболевание появляется в результате мутации гена фактора свертывания крови VIII (гемофилия А) или фактора свертывания IX (гемофилия В). Наиболее распространенным типом заболевания является гемофилия А, которая встречается у 80-85% больных гемофилией. В типичном случае человек с тяжелой формой гемофилии А страдает кровотечением 35 раз в год.
Тяжесть гемофилии определяется количеством фактора свертывания крови — чем он ниже, тем больше вероятность возникновения кровотечения, которое может привести к серьезным проблемам со здоровьем.
Гемофилия известна человечеству более 2000 лет. Первые сведения о заболевании содержатся в Талмуде, согласно которому мальчику не делали обрезание, если двое его старших братьев умерли из-за кровопотери, вызванной этой же манипуляцией.
Еще гемофилию называют «викторианской», или «царской» болезнью. Самой знаменитой носительницей рокового гена была английская королева Виктория. Российская императрица Александра Федоровна, будучи ее внучкой, унаследовала злосчастный ген и передала его единственному сыну императора Николая II – Алексею.
Причины появления гемофилии
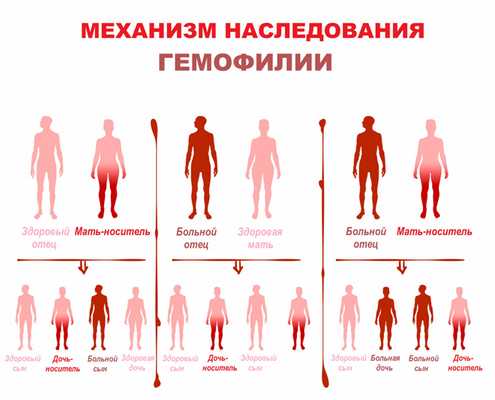
Заболевание передается от родителей к ребенку, хотя примерно в трети случаев вызвано спонтанной мутацией. Гены, кодирующие оба фактора свертывания крови, локализованы в Х-хромосоме. У женщин имеются две половые хромосомы ХХ. Хромосомный набор мужчин — ХY. При рождении девочек одна Х-хромосома наследуется от матери, а другая — от отца. Мужчина, больной гемофилией, имеет одну аномальную Х-хромосому и одну неповрежденную Y-хромосому. В случаях рождения мальчиков Y-хромосома наследуется от отца, а одна из Х-хромосом — от матери.
Сыновья мужчины, больного гемофилией, и здоровой женщины будут со 100% вероятностью здоровыми, а дочери — со 100% вероятностью носительницами гемофилии. В среднем, носительницы гемофилии будут иметь 30-50% от нормального уровня фактора свертывания.
Если женщина — носительница гемофилии имеет одну Х-хромосому здоровую, а другую аномальную, то от здорового мужчины у нее с равной долей вероятности могут родится как здоровые сыновья (50%), так и больные (50%) гемофилией, а дочери также с равной долей вероятности будут или здоровыми (50%), или носительницами (50%) гемофилии. Именно поэтому гемофилией страдают в основном пациенты мужского пола, которые наследуют пораженную X-хромосому от матери.
Дочери могут болеть гемофилией с вероятностью 25%, если она есть у отца, а мать – носительница гена. Но это случается крайне редко.
Классификация заболевания
Кодирование по Международной классификации болезней 10-го пересмотра:
- D66.0 – Наследственный дефицит фактора VIII.
- D67.0 – Наследственный дефицит фактора IХ.
- легкая – активность фактора 5-40% (0,05–0,40 МЕ/мл);
- средняя – активность фактора 1-5% (0,01–0,05 МЕ/мл);
- тяжелая – активность фактора менее 1% (менее 0,01 МЕ/мл).
- Типичные:
- гемартрозы крупных суставов 70-90%,
- гематомы (кровоизлияния в мышцы/мягкие ткани) 20-40%,
- кровотечения из слизистых (носовые, десневые, луночковые) 10%,
- гематурии 5-10%.
- в ЦНС – 5%,
- в ЖКТ – 5%,
- в области шеи/горла – 5%,
- забрюшинные гематомы – 5%.
Гемофилия средней тяжести имеет сходные проявления. Первые признаки, как правило, манифестируют после года. У пациентов с активностью факторов более 2% реже возникают кровоизлияния в суставы, забрюшинные гематомы и гематурии. Наиболее типичны посттравматические гематомы и длительные кровотечения, особенно при травмах слизистых оболочек.
Геморрагический синдром обычно возникает вследствие значительных травм или в результате хирургического лечения. Поражение опорно-двигательного аппарата встречается чрезвычайно редко.
Общие признаки гемофилии:
- длительные кровотечения после травм;
- внутрисуставные кровотечения, вызывающие отек и боль;
- кровоизлияние в кожу (гематомы) или мышцу и мягкие ткани;
- десневые кровотечения, которое трудно остановить после удаления или потери зуба;
- постинъекционные кровотечения;
- кровь в моче или кале;
- частые и трудно останавливаемые носовые кровотечения.
Диагностика гемофилии начинается с выявления наличия геморрагического синдрома в анамнезе у пациента и членов семьи. Сбор жалоб и анамнеза вкупе с физикальным осмотром позволяют определить необходимый объем обследования пациента.
Лабораторная диагностика
Рекомендуется проведение поэтапного лабораторного коагулологического исследования с целью верификации диагноза и исключения приобретенного дефицита фактора VIII или IX, а также исключения дефицита других факторов свертывания крови.
В качестве первого этапа выполняют коагулологический скрининг, в ходе которого определяются следующие показатели:
- активированное частичное тромбопластиновое время;
АЧТВ – скрининговый тест для оценки внутреннего пути активации свертывания крови (факторы XII, XI, IX, VIII, X, V и II) и мониторинга пациентов, получающих гепариновую те�.
Синонимы: Анализ крови на протромбин; Протромбин; Протромбиновое время; Протромбиновый индекс; Международное нормализованное отношение; МНО; Фактор свертывания к.
Синонимы: Анализ на тромбиновое время; ТВ; Антитромбин I. Thrombin Clotting Time (TCT); TT; Antithrombin I (AT I). Краткое описание исследования «Тромбиновое время» Тромби.
Фибриноген – белок, предшественник фибрина, составляющего основу сгустка при свертывании крови. Исследование направлено на оценку способности организма к тро�.
Синонимы: Анализ крови на тромбоциты; Тромбоциты, микроскопия (метод Фонио). Manual Platelet Count (PLT count): Indirect Method by Fonio. Краткое описание исследования «Тромб.
- активность факторов VIII, активность факторов IX;
Синонимы: Фактор свертывания VIII; Антигемофилический фактор (АГФ); Антигемофильный глобулин. Factor VIII Coagulant Activity (VIII); Coagulation Factor VIII; Factor VIII Activity Blood Test; Antihemophilia Factor A T.
Синонимы: Фактор свертывания крови IX; Антигемофильный глобулин B. Factor IX (FIX, Christmas Factor) Activity; Coagulation Factor IX Activity; Blood Clotting Factor 9 Activity; Factor IX Activity; Antihemophilic factor IX. Кр.
Синонимы: Фактор фон Виллебранда, антиген; Антиген фактора Виллебранда; von Willebrand Factor (vWF) Antigen Test; VWF Antigen. Краткое описание исследования «Фактор Виллебр.
Синонимы: Аутоантитела (IgG) против фосфолипидов; Lupus anticoagulant panel; Lupus inhibitor; LA sensitive PTT; PTT-LA; Dilute Russell viper venom test; DRVVT; Modified Russell viper venom tes; MRVVT. Краткая характеристик�.
Для исключения приобретенных дефицитов факторов VIII или IX требуется молекулярно-генетическая диагностика.
Исследование мутаций фактора IX при гемофилии B. Тип наследования. Х-сцепленный рецессивный. Гены, которые контролируют выработку FVIII или FIX , �.
Инструментальная диагностика позволяется визуализировать кровотечения/кровоизлияния различных локализаций, а также выявить осложнения, развившиеся в результате геморрагических проявлений. По показаниям проводятся следующие обследования:
Исследование слизистой оболочки верхнего отдела желудочно-кишечного тракта с возможностью выполнения биопсии или эндоскопического удаления небольших патологич.
Ультразвуковое сканирование структуры крупных суставов и определение их функциональной активности.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Комплексное ультразвуковое сканирование органов мочевыделительной системы, позволяющее обнаружить патологию на ранних стадиях развития.
Безопасное и информативное сканирование структур головного мозга для диагностики его патологий.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Лечением больных гемофилией занимается врач-гематолог. Для подтверждения наличия геморрагических проявлений или их последствий также рекомендуется проведение консультации специалистов. По показаниям возможны консультации:
- неонатолога или врача-педиатра ;
- врача-генетика;
- травматолога-ортопеда;
- хирурга ;
- уролога ;
- невролога ;
- оториноларинголога ;
- стоматолога.
Гемофилия является неизлечимым заболеванием, поэтому основная цель терапии – купирование симптомов. Главный принцип лечения – специфическая заместительная терапия концентратами факторов свертывания. Концентраты фактора производятся либо из человеческой плазмы (плазматические), либо они генетически модифицированы (рекомбинантные).
Если препараты произведены из плазмы, принимается ряд мер, чтобы убедиться в том, что в продукте отсутствует вирусная инфекция, и что пациенты не заразятся такими вирусами, как гепатит С или ВИЧ. С этой целью применяются строгие критерии к выбору доноров плазмы. Кроме того, производители разработали различные методы по очищению и дезактивации вирусов во время производственного процесса препаратов крови. Тем не менее, пациентам следует знать, что есть теоретическая вероятность заражения через использование препаратов плазмы.
Рекомбинантные препараты создают из живых клеток, таких как моноклональные антитела. Они считаются технологически более продвинутыми и несут меньший риск вирусного заражения.
В настоящее время нет оснований для предпочтительного выбора между плазматическими или рекомбинантными препаратами.
Концентраты факторов свертывания крови вводятся внутривенно. Однако примерно у 30% пациентов с тяжелой гемофилией организм начинает вырабатывать антитела, что крайне затрудняет лечение, а в некоторых случаях делает его невозможным.
Существует два вида специфической терапии – профилактическая и лечение по факту возникновения кровотечений (по требованию). Во всех случаях рекомендовано сразу использовать достаточную дозу и соблюдать кратность введения препарата.
Для лечения гемофилии среди более новых лекарственных средств можно отметить фитусиран (снижает выработку природного антикоагулянтного белка – антитромбина) и концизумаб (увеличивает выработку тромбина). Генная терапия с использованием аденовирусного вектора для доставки гена фактора VIII или IX также подвергается клиническим испытаниям.
Серьезные осложнения встречаются при тяжелой и умеренной гемофилии и чаще всего проявляются в виде разрушений суставов и развития артрита. Кровотечения в сустав приводят к разрушению его нормальных тканей и развитию хронического артрита, очень болезненного и приводящего к нарушению функции сустава. Кровоизлияния в суставы отмечаются и у детей с 2-3 летнего возраста. Чаще всего поражаются крупные суставы – коленные, локтевые, голеностопные. Если кровотечение продолжается, то крайне высок риск инвалидизации и ограничения движения в суставе (в худшем случае человек может потерять конечность).
![Сустав.jpg]()
Помимо негативного влияния на качество жизни человека, кровоизлияния нередко становятся жизнеугрожающими, если происходят в жизненно важных органах, например, в мозге.
Профилактика гемофилии
Профилактическая заместительная терапия концентратами факторов свертывания крови – необходимое условие сохранения физического и психологического здоровья пациентов с тяжелой и среднетяжелой гемофилией. Профилактическое лечение обычно назначается детям, чтобы снизить риск кровотечений и повреждений суставов. В последнее время с этой же целью профилактику стали назначать и пожилым людям. Профилактика предполагает вливание фактора свертывания крови на регулярной основе (через день), чтобы сохранить нормальное свертывание крови у больного и предотвратить спонтанные кровотечения.
Детей с гемофилией необходимо оберегать от травм, предотвращать удаление зубов путем тщательной санации полости рта и квалифицированной стоматологической помощи.
Пациентам перед оперативным вмешательством или удалением зуба проводят заместительную терапию фактором (предпочтительно с использованием рекомбинантного препарата).
Молодые люди должны осознать, что поддержание физической активности очень важно для укрепления мышц, связок и суставов. Мышечная слабость, плохая координация движений значительно повышают вероятность травмы сустава и последующего развития воспаления (артрита). Хорошая физическая форма, крепкий мышечный каркас снижают риск спорадических кровотечений. Оптимальный вид спорта для людей, страдающих гемофилией, – плавание.
Людям с гемофилией рекомендуется носить на себе медальон с информацией о болезни. Это может спасти жизнь в критической ситуации.
Для профилактики кровотечений больные гемофилией должны избегать применения аспирина и нестероидных противовоспалительных препаратов, поскольку они замедляют тромбоцитарную функцию.
Прививки для больного гемофилией не представляют большой опасности. Более того, в список обязательных входит вакцина против гепатита В. Большинство лекарственных препаратов все же следует принимать перорально из-за опасности кровотечения при внутримышечном введении.
- Клинические рекомендации «Гемофилия». Разраб.: Национальное гематологическое общество, Национальное общество детских гематологов и онкологов. – 2018.
- Румянцев А.Г., Румянцев С.А., Чернов В.М.. Гемофилия в практике врачей различных специальностей // – Москва. – 2012. – 132 с.
- Canadian Hemophilia Society. What is hemophilia? 2016. Last accessed 08 June 2016 .
- WFH. Guidelines for the management of hemophilia. 2012. Last accessed July 2019 .
Наследственные коагулопатии: гемофилия и болезнь Виллебранда
Система свертывания крови человека представляет собой многокомпонентный и чрезвычайно сложный механизм, играющий важнейшую роль в защите всего организма.
Указанный механизм представлен тремя звеньями: сосудистым, тромбоцитарным и плазменно-коагуляционным. Заболевания, связанные с неспособностью факторов свертывания крови обеспечивать нормальный процесс образования сгустка, составляют обширную группу коагулопатий. Эта группа болезней представлена наследственными коагулопатиями и множеством приобретенных форм коагулопатий, которые являются следствием других заболеваний: цирроз и рак печени, аутоиммунные (системная красная волчанка, иммунная тромбоцитопеническая пурпура, геморрагический васкулит и т.п.), инфекционные заболевания, токсическое воздействие лекарственных средств и ядов, наследственные заболевания обмена веществ.
Наследственные заболевания гемостаза
Гемофилия и болезнь Виллебранда являются наиболее частыми наследственными заболеваниями системы плазменного звена гемостаза. Фактор Виллебранда и фактор VIII в плазме крови представлены в виде молекулярного комплекса, при этом фактор Виллебранда выполняет защитную роль для фактора VIII, оберегая его от разрушения протеином С.
Именно поэтому при отсутствии фактора Виллебранда уровень фактора VIII может быть значительно снижен. Таким образом, несмотря на различие данных заболеваний, они проявляют определенный молекулярно-биологический синергизм. В этой связи для практикующих врачей целесообразно рассмотреть два заболевания, занимающих более 90% наследственных коагулопатий, обусловленных дефицитом или функциональной несостоятельностью пламенных факторов свертывания крови — VIII, IX (гемофилия А или В соответственно), или фактора Виллебранда (болезнь Виллебранда).
Крайне редко встречается и дефицит фактора VII. Гипопроконвертинемия проявляется геморрагическим синдромом в зависимости от выраженности дефицита фактора VII. В тяжелых случаях отмечаются гемартрозы, гематомы, у женщин меноррагии.
И встречаются, и диагностируются нечасто
В целом наследственные коагулопатии встречаются нечасто, а диагностируются еще реже. На это есть две основные причины: низкая распространенность, часто сопряженная с субклиническим течением заболевания (при болезни Виллебранда) и недостаточно развитая система лабораторной диагностики нарушений гемостаза в большинстве регионов нашей страны. Количество больных гемофилией в России составляет чуть более 7,5 тыс. человек, а с болезнью Виллебранда должно быть около 16 тыс. Точная цифра не установлена. Редкие наследственные формы коагулопатий — гипопроконвертинемия (дефицит фактора VII), гипо- и афибриногенемия, дефицит факторов XII, XIII, XI, V встречается крайне редко.
Наследственные коагулопатии неизлечимы, но возможности современной препаратной терапии позволяют обеспечить больным продолжительность и качество жизни, сравнимые с таковой в общей популяции.
Гемофилия, болезнь Виллебранда и гипопроконвертинемия относятся к группе социальных заболеваний, и без поддержки государства люди, страдающие наследственными формами коагулопатий, обречены. Это связано в первую очередь с обеспечением дорогостоящими препаратами факторов свертывания крови, которые больные получают пожизненно в «домашних условиях». Лечение этих пациентов во всем мире проводится в специализированных центрах гемофилии, ведущих медицинский регистр больных с наследственными коагулопатиями, и базируется на национальных стандартах и протоколах лечения. Медицинский регистр позволяет отслеживать динамику здоровья пациента в течение многих лет и корригировать лечение.
«Визитная карточка» гемофилии
Клиническое течение гемофилии и болезни Виллебранда отличается, но может иметь некоторую схожесть. Наличие гемартрозов является «визитной карточкой» гемофилии, однако следует помнить, что гемартрозы могут отмечаться и при болезни Виллебранда (т.н. тип III), а иногда и при выраженной гипопроконвертинемии (дефицит фактора VII). Гемофилия — заболевание, обусловленное различными типами мутаций гена фактора 8 или 9, в результате которых возникает наследственный дефицит фактора свертывания крови VIII (гемофилия А) или IX (гемофилия В).
Эти гены локализованы на длинном плече X-хромосомы и наследуются по рецессивному признаку, передаваясь через женщин только детям мужского пола. В популяции уровень факторов VIII и IX варьирует от 100 ± 50%, но у женщин — кондукторов гемофилии— он может быть ниже нормы, вслед-ствие функциональной неполноценности одного из двух генов. Тяжесть гемофилии зависит от уровня активности фактора VIII или IX. При тяжелой форме гемофилии фактор VIII (или IX) отсутствует или проявляет остаточную активность (менее 2%). В этом случае заболевание обычно проявляется с раннего детства.
Характерны кровотечения при нарушении целостности слизистых и кожных покровов, гематомы (кровотечение из пуповины, кефалогематомы, экхимозы). Когда ребенок начинает ходить, появляются первые кровоизлияния в суставы. При средней форме (от 2 до 5%) также отмечается поражение опорно-двигательной системы, а при легкой (более 5%) заболевание обычно проявляется при травмах и хирургических операциях, которые могут сопровождаться сильными кровотечениями из-за быстрого истощения эндогенного фактора VIII или IX. Поздняя диагностика заболевания может привести к трагическим последствиям.
Сегодня такого сценария можно избежать
Возникновение первичного гемартроза даже после его видимого устранения вызывает невидимые изменения в хрящевой ткани сустава, которые можно зарегистрировать на ЯМР-томограмме. Распавшиеся эритроциты формируют среду для возникновения вторичного асептического воспалительного процесса, а образовавшийся гемосидерин откладывается в хрящевой ткани суставных поверхностей.
Последующие кровоизлияния расширяют зону поражения, приводят к развитию хронического синовита, способствуя возникновению «спонтанных» кровоизлияний, сопровождающих больного в течение всей его жизни, приводя в конечном счете к анкилозу и атрофии мышц. До совершеннолетия такие больные ранее становились инвалидами с множественным поражением опорно-двигательной системы. В течение жизни этих больных, как правило, отмечаются массивные гематомы, желудочно-кишечные кровотечения и другие всевозможные кровоизлияния, представляющие угрозу для жизни пациента или приводящие к его смерти. Современная препаратная терапия позволяет избежать такого сценария развития болезни.
Следует отметить, что в течение всей жизни больного гемофилией уровень фактора не меняется, поэтому заместительная терапия остается единственным на сегодняшний день безальтернативным решением. Постоянное присутствие фактора VIII не ниже 5% создает условия нормализации скорости роста сгуст-ка, а клинически обуславливает отсутствие «спонтанных» кровоизлияний.
Известно, что полупериод инактивации фактора VIII и IX (T?) невелик. В среднем он составляет соответственно 12 и 24 часа, однако у каждого пациента он может значительно варьировать. При гемофилии А такой разброс для фактора VIII составляет от 7 до 20 часов. Этот показатель важно учитывать при коррекции системы гемостаза у больных гемофилией, особенно, если лечение проводится в течение длительного времени.
Проводимые в нашем центре исследования с использованием метода пространной динамики свертывания крови позволяют оценить уровень «достаточности» заместительной терапии у больных с коагулопатиями. Компенсация уровня недостающего фактора свертывания крови должна находиться в «коридоре» между гипо- и гиперкоагуляцией и поддерживаться в заданном диапазоне в течение всей жизни пациента. Подобная заместительная терапия, профилактирующая геморрагические эпизоды, должна определяться индивидуально. Этот подбор с одновременным использованием классических методов определения факторов свертывания крови позволяет задавать оптимальные, рассчитанные для конкретного пациента, параметры терапии и определять необходимое для лечение количество препарата.
Самое уязвимое звено в лечении этих пациентов — определение потребности при назначении факторов свертывания крови. Все существующие факторы свертывания крови вводятся внутривенно, т.е. их биодоступность составляет 100%, однако катаболизм этих сложных белковых структур зависит от многих индивидуальных параметров всей системы гемостаза.
На сегодняшний день профилактическая заместительная терапия пациентам с наслед-ственными коагулопатиями подбирается эмпирически, чаще руководствуясь только первоначально поставленным диагнозом и видимым клиническим результатом, который оценивается весьма субъективно. То же самое касается и однократных лечебных доз, направленных на купирование геморрагического эпизода. Для широкой клинической практики подобные тесты представляются затруднительными, во всяком случае, на сегодняшний день.
Лечение по требованию и по ситуации
Для того, чтобы формализировать стандарты терапии больных гемофилией, в 2005 году был разработан и утвержден Протокол ведения больных гемофилией. Это событие принципиально изменило качество жизни пациентов.
Заместительная терапия факторами свертывания крови может назначаться как с целью профилактики кровоизлияний — т.н. «профилактическое лечение»: для больных гемофилией А — 25 МЕ/кг веса тела 3 раза в неделю; для больных гемофилией В — 25 МЕ/кг — 2 раза в неделю, так и с целью остановки кровотечения (симптоматическая гемостатическая терапия — «лечение по требованию» — от 20 до 50 МЕ/кг и далее в зависимости от клинической ситуации). Эти две модели лечения могут чередоваться между собой в течение всей жизни пациента и являются «краеугольным камнем» протокола.
Лечение заболевания может осуществляться не только с целью профилактики кровоизлияний. Протокол ведения больных c гемофилией предусматривает модель лечения состоявшихся кровотечений или кровоизлияний. В этом случае пиковый уровень фактора VIII или IX через 30 минут после инъекции должен составлять 40—100% в зависимости от клинической ситуации.
Инъекции препарата повторяются каждые 12 часов при гемофилии А и каждые 24 часа при гемофилии В в дозе ? от первоначальной до исчезновения симптомов кровоизлияния. Как показывает наш опыт, такая схема лечения приемлема для пациентов с единичными геморрагическими осложнениями. Как и при многих других заболеваниях, при гемофилии легче профилактировать кровоизлияния, а не лечить их осложнения.
Документ общерекомендательного характера
Тем не менее лечащим врачам-гематологам надлежит помнить, что данный документ носит общерекомендательный характер, а подход к лечению каждого пациента должен быть индивидуальным, учитывая порой психоэмоциональный профиль пациента и даже членов его семьи.
Внутривенное введение препарата осуществляется самим пациентом или его род-ственниками после прохождения специализированной программы обучения, а наблюдение за пациентом осуществляет центр гемофилии или врач-гематолог.
Такое лечение получило название «домашнее лечение» и используется во всем мире. В нашей стране все больные гемофилией находятся в настоящий момент на «домашнем лечении».
Установлено также, что фенотип заболевания может отличаться от его генотипа. Не все больные с одинаковым уровнем фактора VIII или IX требуют одинакового лечения. 10—15% больных с тяжелой формой гемофилии А вообще не нуждаются в профилактическом лечении, т.е. в постоянном введении препаратов, однако все без исключения больные гемофилией нуждаются в пожизненном обеспечении факторами свертывания крови VIII или IX. Это касается и других наслед-ственных форм коагулопатий — болезни Виллебранда и гипопроконвертинемии (дефицит фактора VII).
Современные антигемофильные препараты факторов свертывания крови VIII и IX, с точки зрения этиотропной терапии, направленной на достижение клинического результата, не обладают между собой значительными различиями. Все они компенсируют уровень недостающего фактора свертывания крови в равной степени. Их активность выражается в стандартных международных единицах (МЕ). Условно они могут классифицироваться на факторы свертывания крови VIII содержащие фактор Виллебранда и не содержащие. Количество и качество фактора Виллебранда может значительно отличаться в них. Существуют препараты, в которых содержание фактора Виллебранда повышено. Есть изолированный фактор Виллебранда, не содержащий фактор VIII.
Рекомбинантные факторы свертывания крови
К препаратам плазмы фактора VIII, не содержащим фактора Виллебранда, количество которого у больных гемофилией не изменено, относятся препараты, прошедшие аффинную хроматографию, а также генно-инженерные (рекомбинантные) факторы свертывания крови VIII (МНН: октоког альфа). Группа препаратов октоког альфа представлена препаратами трех поколений (классификация условна): первое, содержащее добавленный альбумин, необходимый для стабилизации молекулы фактора VIII, второе — содержащее следы человеческого альбумина, и третье — свободное от присутствия альбумина.
Основой эффективной терапии наследственных коагулопатий является: ранняя диагностика, выбор правильной модели лечения и полноценное, беспрерывное обеспечение больных факторами свертывания крови VIII или IX. Если количество препарата недостаточно для лечения, заболевание начинает неуклонно прогрессировать и может свести на нет все ранее предпринятые усилия.
Существует рекомбинантный фактор VIII с модифицированной молекулой, т.е. удаленным гликопротеидным фрагментом (мороктоког альфа). Опыт его использования не так объемен, как у предыдущих препаратов. Для больных с гемофилией В могут быть использованы препараты фактора свертывания крови IX — рекомбинантные (наноког альфа) и полученные из донорской плазмы, а также препараты протромбинового комплекса (PPSB).
У больных с болезнью Виллебранда более целесообразно применять препараты, содержащие физиологическое или больше физиологического соотношения фактора Виллебранда к фактору VIII. Эти препараты были разработаны специально для лечения больных с болезнью Виллебранда, и содержание последнего указывается на этикетке флакона.
Почти абсолютная вирусная безопасность
Осложнения при гемофилии, как след-ствие лечения, также неизбежны. Наиболее опасное, но редко встречающееся в России (около 3—5% больных гемофилией А) — появление резистентности к терапии, обусловленное образованием иммуноглобулинов, чаще G класса, т.н. аутоантител, которые избирательно блокируют прокоагулянтную активность молекулы фактора VIII. При гемофилии В образование антител отмечается крайне редко (менее 1—2%).
Описаны случаи образования антител и к фактору Виллебранда. К фактору VII антитела практически не образуются. Для практикующих гематологов важно знать, что антигенная стимуляция (введение препарата) может стимулировать иммунный ответ и вызвать полную толерантность к заместительной терапии. Заподозрить ингибитор стоит в случае неэффективности эффективной ранее терапии. Этиология и патогенез этого явления остаются неясными.
Диагностика в регионах недоступна
Терапия и ее мониторинг у больных с гемофилией, осложненной ингибитором, представляет значительные трудности даже для опытных специалистов и лабораторных работников. Принципиально существуют два вида терапии: активация системы гемостаза через шунтирующие (обходные) пути. Для этого используется рекомбинантный активированный фактор VII или протромбиновый комплекс (активированный) — факторы свертывания крови II, VII, IX, X в комбинации. Второй вариант лечения — индукция иммунной толерантности, как правило, «Боннский протокол». В госпитальной практике может использоваться плазмаферез или иммуноадсорбция протеином А, однако эта терапия ведет к временному снижению титра ингибитора и в настоящее время применяется редко. Лечение ингибиторных больных гемофилией представляет серьезную медико-социальную проблему.
При болезни Виллебранда, характеризующейся снижением активности фактора Виллебранда, ристоцетин-индуцированной агрегации тромбоцитов, часто со снижением уровня фактора VIII и антигена фактора VIII, важно определить следующее: имеет ли место недостаток выработки фактора Виллебранда (количественный дефицит — тип I) или синтезируемая структура молекулы фактора неполноценна (качественный дефицит — тип II).
Диагностика заболевания достаточно сложна и часто недоступна в регионах, т.к. требует проведения сложных коагулологических исследований. Важными симптомами заболевания являются длительные носовые кровотечения, у женщин затяжные mensis, которые могут приводить к железодефицитной анемии, длительные кровотечения после удаления зуба или незначительных хирургических вмешательств и проявление таких же симптомов у близких родственников (отец, мать, брат, сестра). Пациенты с подобными симптомами должны быть обследованы в специализированных центрах.
Крайне редкое заболевание
Крайне редко встречающееся заболевание — наследственный дефицит фактора VII. При выраженном дефиците этого фактора отмечается тяжелый геморрагический синдром, сопровождающийся гематомами, гемартрозами, а у женщин — опасными для жизни меноррагиями.
Для лечения больных с гипопроконвертинемией может применяться фактор свертывания крови VII (плазменный) в дозе 30—40 МЕ/кг каждые 8—10 часов. При его отсутствии — эптаког альфа активированный в дозе 20—40 мкг/кг каждые 2—4 часа до полной остановки кровотечения.
Основой эффективной терапии наслед-ственных коагулопатий является: ранняя диагностика, выбор правильной модели лечения и полноценное, беспрерывное обеспечение больных факторами свертывания крови VIII или IX. Если количество препарата недостаточно для лечения, заболевание начинает неуклонно прогрессировать и может свести на нет все ранее предпринятые усилия.
Наблюдение за больными с наследственными коагулопатиями осуществляется в течение всей их жизни в специализированных центрах, часто совместно с врачами других специальностей, если возникают сопутствующие заболевания. Организация подобных центров в России — это организация «технологии лечения» больных, страдающих нарушениями свертывающей системы крови.
Наследственный ангионевротический отек: современные подходы к диагностике и терапии
Наследственный ангионевротичекий отек (НАО) – редкое жизнеугрожающее заболевание, которое относится к группе первичных иммунодефицитов, распространенность которого составляет всего 1 на 50 000 тысяч [1] . Болезнь вызывается рядом факторов и характеризуется отеком глубоких слоев дермы, подкожной клетчатки и/или слизистой оболочки. Представляем 5 основных фактов об этом заболевании, возможностях терапии и контроля над НАО.
Классификация наследственных ангиоотеков
Выделяют несколько типов наследственного ангиоотека. 85% случаев НАО относится к первому типу, при котором отмечается дефицит С1-ингибитора в плазме, обусловленный нефункционирующим геном. Около 15% пациентов с НАО диагностируется 2-й тип, при котором уровень С1-ингибитора в пределах нормы или повышен, при этом отмечается снижение его функциональной активности. Отдельно выделяют так называемый эстроген-зависимый тип ангиоотека.
Клинические проявления НАО
Острые приступы НАО возникают спонтанно или под действием различных триггеров: травматизация, стресс, хирургические или стоматологические вмешательства, острые респираторно-вирусные заболевания, ингибиторы АПФ, прием препаратов на основе сартанов, а также употребление алкоголя.
При этом в более чем половине случаев НАО триггером выступают именно нарушения кожного покрова: травма или хирургические вмешательства. Около трети обострений случается вследствие стресса. [2] Чаще всего приступы НАО происходят спонтанно, однако иногда у больных наблюдаются предвестники приступа в виде слабости, разбитости, мраморности кожи, обильных бледных высыпаний типа кольцевидной эритемы, сохраняющейся во время отека, не сопровождающиеся зудом, жжением или повышением температуры.
Жизнеугрожающая локализация НАО
В ряде случаев отеки могут иметь локализацию в абдоминальной области. При этом болевой синдром проявляется в виде разлитой боли в брюшной полости, кишечных колик, возможна кишечная непроходимость. Абдоминальные боли нередко сопровождаются рвотой и жидким стулом, характерна болезненность живота при пальпации. Развитию абдоминальных приступов часто предшествуют ощущения спазмов в околопупочной области, слабость, тошнота, спастические боли в эпигастрии. Около трети случаев пациентов с отеком брюшной полости подвергаются неоправданным хирургическим вмешательствам.
Доступность скрининга
Компания «Такеда Россия» в 2019 году запустила программу лабораторной диагностики НАО, которая бесплатно для пациентов позволяет проводить несколько видов исследований: первичное исследование ингибитора С1-эстеразы, а также генетические исследования генов C1NH, F12 и PLG, поиск семейных мутаций. В проекте участвуют Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева и Медико-генетический научный центр имени академика Н.П. Бочкова.
Инновации приходят на помощь
В 2021 году фармацевтическая компания «Такеда» планирует запустить мобильное приложение myHAE для поддержки людей с наследственным ангионевротическим отеком (НАО). Его задача помочь пациентам контролировать течение заболевания, а также совместно с лечащим врачом создавать и корректировать индивидуальный план лечения. Запуск приложения станет частью пациентоориентированного подхода компании к диагностике и лечению пациентов.
Лейкоз
Лейкоз: причины появления, симптомы, диагностика и способы лечения.
Определение
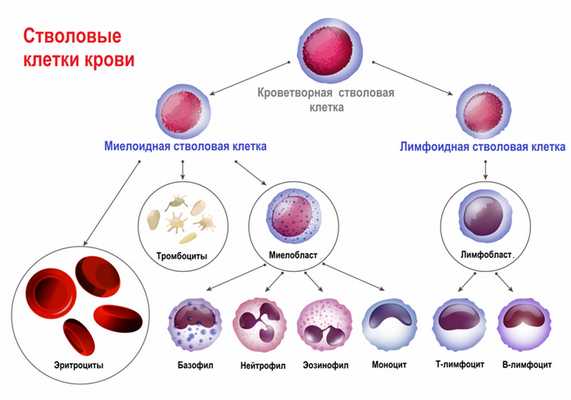
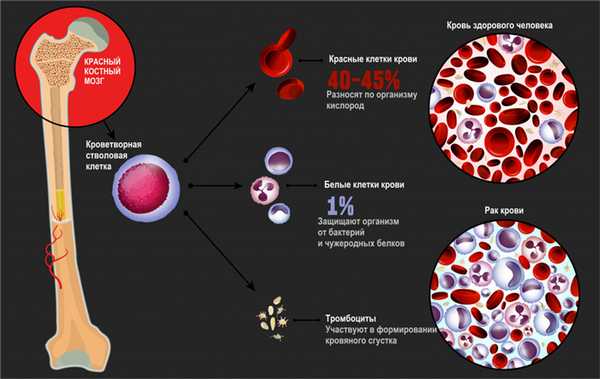
Лейкозы – большая группа заболеваний кроветворной системы. Кроветворение (гемопоэз) – это многоэтапный процесс образования форменных элементов крови в специализированных органах кроветворения. К форменным элементам крови относятся лейкоциты (белые кровяные тельца), которые участвуют во врожденном и приобретенном иммунитете, эритроциты (красные кровяные тельца), которые осуществляют транспорт кислорода и углекислого газа, и тромбоциты, обеспечивающие свертываемость крови.![Стволовые клетки.jpg]()
У всех клеток крови есть одна общая «родоначальница» – полипотентная стволовая клетка. Термин «полипотентная» означает, что такая клетка может развиваться в различные виды зрелых клеток.
Главный орган, где располагаются полипотентные стволовые клетки, - костный мозг, который как раз и поражается при лейкозах.
В результате повреждения (мутации) в генетическом материале полипотентной стволовой клетки-предшественницы нарушается процесс созревания клеток. При остром лейкозе возникает большое количество незрелых (бластных) клеток, из которых образуется опухоль, разрастается в костном мозге, замещает нормальные ростки кроветворения и имеет тенденцию к метастазированию – распространению с током крови или лимфы в здоровые органы. При хронических лейкозах заболевание течет годами, происходит частичная задержка созревания клеток и опухоль образуется из созревающих и зрелых клеток.
![Рак крови.jpg]()
Причины возникновения лейкозов
К факторам риска развития лейкоза относятся:
- ионизирующая радиация: лучевая терапия по поводу других опухолей, облучение на рабочем месте, ультрафиолетовое излучение;
- воздействие на организм химических канцерогенных веществ;
- некоторые вирусы: HTLV (Т-лимфотропный вирус человека);
- бытовые факторы: добавки в пищевые продукты, курение, плохая экологическая обстановка;
- наследственная предрасположенность к раковым заболеваниям.
Лейкозы подразделяют на острые и хронические, а по типу поражения ростка кроветворения - на лимфоидные и миелоидные. Острый лейкоз никогда не переходит в хронический, а хронический не может стать острым (но его развитие может перейти в стадию бластного криза).
В зависимости от преобладания тех или иных опухолевых клеток выделяют бластные, цитарные и недифференцированные лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) диагностируется у лиц любого возраста, начиная с младенческого и заканчивая пожилым, однако пик заболеваемости приходятся на детский возраст (60% пациентов с ОЛЛ моложе 20 лет). Острый лимфобластный лейкоз – самая распространенная опухоль кроветворной ткани у детей, которая составляет 30% всех злокачественных опухолей детского возраста. Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает: так, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 тыс. населения в возрасте 35–39 лет, до 2,1 случая на 100 тыс. населения в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет.
Острым миелоидным лейкозом (ОМЛ) страдает в среднем 3-5 человек на 100 тыс. населения в год. Заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.
Хронический лимфобластный лейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых, в то время как у детей этот вид опухоли не регистрируется. В европейских странах его частота составляет 4 случая на 100 тыс. населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30 случаев на 100 тыс. в год.
Хронический миелолейкоз (ХМЛ) – редкое заболевание: 0,7 на 100 тыс. взрослого населения, пик заболеваемости приходится на 50-59 лет, однако до 33% больных ОМЛ - люди моложе 40 лет.
Симптомы лейкозов
Острый лейкоз в большинстве случаев дебютирует резко - внезапно повышается температура, появляются озноб, боль в горле, в суставах, отмечается резко выраженная слабость. Реже острый лейкоз может проявиться кровотечением. Иногда острый лейкоз начинается с постепенного ухудшения состояния больного, появления невыраженной боли в суставах и костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания. У многих больных увеличиваются лимфоузлы и селезенка.
При хроническом лейкозе на начальной стадии, которая длится от года до трех лет, пациенты могут ни на что не жаловаться. Иногда беспокоят слабость, потливость, частые простудные заболевания, могут отмечаться тупые, ноющие боли в костях.
При подавлении эритроидного ростка, дающего красные кровяные тельца, возникает анемия и гемическая гипоксия (снижение количества кислорода в крови). При этом пациенты отмечают слабость, утомляемость, бледность кожных покровов.
При поражении мегакариоцитарного ростка падает количество тромбоцитов, поэтому возникает кровоточивость десен, слизистой оболочки носа, пищеварительного тракта, образуются синяки, кровоизлияния в различные органы. При прогрессировании лейкоза могут развиваться массивные кровотечения в результате ДВС синдрома (синдрома диссеминированного внутрисосудистого свертывания).
В результате недостатка лейкоцитов и снижения иммунитета развиваются инфекционные осложнения различной степени тяжести, что чаще всего проявляется лихорадкой.
Могут возникать язвенно-некротическая ангина, перитонзиллярные абсцессы, некротический гингивит, стоматит, пиодермия, параректальные абсцессы, пневмония, пиелонефрит. Существует значимый риск тяжелого течения инфекционных осложнений вплоть до развития сепсиса.
С током крови и лимфы опухолевые клетки попадают в здоровые органы, нарушают их структуру и функцию - наиболее подвержены метастатическим процессам печень, селезенка, лимфатические узлы, но метастазы могут поражать и кожу, и мозговые оболочки, и почки, и легкие.
Основные причины летальности у пациентов с лейкозом связаны с тем, что осложнения могут спровоцировать развитие сепсиса, полиорганную недостаточность, кровоизлияния в различные органы. Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев.
Диагностика лейкозов
Диагностика лейкозов основывается на оценке морфологических особенностей клеток костного мозга и периферической крови. Поэтому всем пациентам с подозрением на лейкоз назначают общий анализ крови с подсчетом лейкоцитарной формулы и определением числа тромбоцитов.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Comp.
Для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли рекомендовано выполнение общетерапевтического биохимического анализа крови: АСТ, АЛТ, общий билирубин, глюкоза, мочевина, креатинин, общий белок, ЛДГ, магний, натрий, калий, кальций.
Аланинаминотрансфераза − внутриклеточный фермент, участвующий в метаболизме аминокислот. Тест используют в диагностике поражений печени, сердечной и скелетн�.
Синонимы: Глутамино-щавелевоуксусная трансаминаза; Глутамат-оксалоацетат-трансаминаза сыворотки крови (СГОТ); L-аспартат 2-оксоглутарат аминотрансфераза; ГЩТ. As.
Синонимы: Общий билирубин крови; Общий билирубин сыворотки. Totalbilirubin; TBIL. Краткая характеристика определяемого вещества Билирубин общий Билирубин – пигмент �.
Материал для исследования Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазм.
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины. Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea. Краткая характеристика аналита Мочевина Моче�.
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat. Краткая характеристика определя�.
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок. Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР. Краткая характеристика определяемого вещества Общий бе�.
Синонимы: Анализ крови на ЛДГ; Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты. Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD. Кра.
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium. Краткая характеристика определяемого аналита Магний .
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl. Краткая характеристика определяемых �.
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в .
Для определения вероятности развития тяжелых коагуляционных нарушений (как геморрагических, так и тромботических) рекомендовано исследование свертывающей системы крови.
Синонимы: Гемостазиограмма, коагулограмма. Coagulation studies (coagulation profile, coag panel, coagulogram). Краткая характеристика исследования «Гемостазиограмма (коагулограмма), скри�.
С целью исключения поражения почек выполняют общий анализ мочи.
Метод определения Определение физико-химических параметров выполняется на автоматическом анализаторе методом «сухой химии». Аппаратная микроскоп.
Диагностику хронического лейкоза проводят с помощью иммунофенотипического исследования лимфоцитов крови (ИФТ) методом проточной цитометрии.
Рекомендовано проведение стернальной пункции (пункции грудины) для получения цитологического препарата костного мозга и цитологическое и цитохимическое исследование мазка с целью уточнения диагноза и определения прогноза.
В ряде случаев показана биопсия опухолевого образования или лимфатического узла (или другого метастатического очага) и патологоанатомическое исследование полученного биопсийного материала.
Кроме того, врач может рекомендовать проведение иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге, цитогенетическое исследование аспирата костного мозга, молекулярно-генетические исследования мутаций в генах и др.
Из инструментальных методов диагностики проводятся:
- эхокардиография для оценки функционального состояния сердечной мышцы;
Исследование, позволяющее оценить функциональные и органические изменения сердца, его сократимость, а также состояние клапанного аппарата.
Лечение лейкозов
Лечение лейкозов проводится в стационаре. Медикаментозное воздействие на опухоль специальными препаратами, губительно действующими на быстро делящиеся клетки, называется химиотерапией. При лечении острых лейкозов химиотерапию проводят в несколько этапов: индукция ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия и профилактика нейролейкемии (метастазирования опухолевых лейкозных клеток в головной и спинной мозг).
Период индукции ремиссии - это начальный этап, цель которого максимально уменьшить опухолевую массу и достичь ремиссии. Обычно для этого требуется 1-2 курса химиотерапии. Далее идет консолидация достигнутого эффекта - наиболее агрессивный и высокодозный этап лечения, задачей которого является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Этот этап также занимает 1-2 курса. За ним следует противорецидивное или поддерживающее лечение. При некоторых вариантах острых лейкозов требуется профилактика или, при необходимости, лечение нейролейкемии.
Для разных видов лейкозов у разных возрастных групп профессиональными сообществами разработаны схемы химиотерапии.
При лечении ХМЛ основными препаратами выбора являются ингибиторы тирозинкиназы, применяемые в непрерывном режиме – ежедневно, длительно, постоянно. Перерывы в приеме могут способствовать снижению эффективности терапии и прогрессированию заболевания. В случае неэффективности терапии может быть проведена трансплантацию гемопоэтических стволовых клеток или костного мозга.
В терапии ХЛЛ цели и схемы терапии химиотерапии определены возрастом пациента, числом и тяжестью сопутствующих заболеваний. Разработаны протоколы лечения для разных пациентов, в том числе схемы моно- и полихимиотерапии. Для профилактики инфекционных осложнений применяют внутривенное введение иммуноглобулина, рекомендована вакцинация от гриппа и пневмококковой инфекции.
Помимо химиотерапии пациенту может потребоваться трансфузионная терапия: переливание эритроцитарной массы, тромбоцитарной массы, изотонических растворов.
При присоединении инфекций показана антибиотикотерапия. На фоне лечения могут возникать тромботические осложнения, что требует антикоагулянтной терапии. Пациентам высокого риска в связи с вероятностью рецидива лейкоза применяют трансплантацию гемопоэтических стволовых клеток.
Осложнения
Основные осложнения лейкозов - инфекционные, вплоть до сепсиса, и тромботические и/или геморрагические осложнения с развитием синдрома диссеминированного внутрисосудистого свертывания. При метастазировании опухолевых клеток развивается полиорганная недостаточность, в т.ч. лейкозные клетки могут попадать в оболочки головного и спинного мозга, инфильтрировать периферические нервы с развитием разнообразных двигательных и чувствительных нарушений (лейкемоидная инфильтрация). Кроме того, встречается так называемый «синдром лизиса опухоли» - сложный процесс, возникающий в результате спонтанного или вызванного лечением разрушения большого числа опухолевых клеток с выходом внутриклеточного содержимого в кровоток. При этом может развиться острая почечная недостаточность. Летальность при лизисе опухоли достигает 70%.Профилактика лейкозов
Так как причины возникновения лейкозов не установлены, методов специфической профилактики до сих пор не существует.
Однако доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет.
Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения.
- Клинические рекомендации «Острые миелоидные лейкозы». Общероссийский национальный союз «Ассоциация онкологов России», некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга «Национальное гематологическое общество», 2020.
- Клинические рекомендации «Острые лимфобластные лейкозы». Общероссийский национальный союз «Ассоциация онкологов России», некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга «Национальное гематологическое общество», 2020.
- Клинические рекомендации «Хронический лимфоцитарный лейкоз/ лимфома из малых лимфоцитов». Общероссийский национальный союз «Ассоциация онкологов России», некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга «Национальное гематологическое общество», региональная общественная организация «Общество онкогематологов», 2020.
- Клинические рекомендации «Хронический миелолейкоз у взрослых». Национальное гематологическое общество, 2017.
Читайте также:
- Параоспенные поксвирусы. Представители параоспенных вирусов.
- КТ, пиелография при кистозном уретерите
- Разрыв сухожилий и туннельный синдром стопы. Диагностика и лечение
- Влияние алкоголя на потребление кислорода. Снижение потребления кислорода при алкоголизме
- Пренатальная диагностика при многоплодной беременности. Выявление монозиготной многоплодной беременности. Диагностика многоплодия.