Регуляция конгрессии хромосом
Добавил пользователь Alex Обновлено: 29.01.2026
Пресинтетический или постмитотический (G1) период (от англ. gap - промежуток) наступает сразу же после митотического деления клетки и характеризуется активным ростом клетки и синтезом белка и РНК, благодаря чему клетка достигает нормальных размеров и восстанавливает необходимый набор органелл. G1 -период длится от нескольких часов до нескольких дней. В течение этого периода синтезируются особые "запускающие" белки (trigger proteins), или активаторы S-периода. Они обеспечивают достижение клеткой определенного порога (точки R - рестрикции или ограничения), после которого она вступает в S-период.
Контроль, осуществляемый на уровне точки R (при переходе из G1 в S), ограничивает возможность нерегулируемого размножения клеток. Проходя эту точку, клетка переключается на последующую регуляцию внутренними факторами клеточного цикла, которая обеспечивает закономерное завершение ее деления.
Если клетка не достигает точки R, она выходит из цикла и вступает в период репродуктивного покоя (G0) для того, чтобы (в зависимости от причин остановки): дифференцироваться и выполнять свои специфической функции, выжить в условиях недостаточности питательных веществ или факторов роста, осуществить репарацию поврежденной ДНК. Клетки одних тканей при соответствующей стимуляции вновь способны возвращаться из периода (G0) в клеточный цикл, других - утрачивают эту способность по мере дифференцировки.
1.2. Синтетический период (s)
1.3. Постсинтетический период (g2)
Постсинтетический или премитотический (G2-)период следует за S-периодом и продолжается вплоть до митоза (часто обозначаемого буквой М). В течение этого периода клетка осуществляет непосредственную подготовку к делению. Происходит созревание центриолей, запасается энергия, синтезируются РНК и белки (в частности, тубу-лин), необходимые для процесса деления. Длительность G2-периода составляет 2-4 часа. Возможность выхода клетки из G2-периода в G0-neриод с последующим возвращением в G2-период в настоящее время большинством авторов отрицается.
1.4. Деление клетки
Итак, если всё в порядке, ДНК реплицировалась удачно, то наступает G2-период, финишная прямая. Во время него опять проверяется качество ДНК, клетка увеличивает свою массу. И при условии, что все внешние и внутренние факторы способствуют переходу G2/M, наступает митоз.
Для того, чтобы две дочерние клетки поровну получили генетический материал, организация процесса деления должна быть удобной и четкой. Хромосомы вне деления находятся в деконденсированном виде, т.е. представляют собой чрезвычайно длинные нити, рассредоточенные по всему ядру. Естественно, удобно разделить ДНК у каждой из них поровну просто не получится, поэтому первым делом хромосомы спирализуются и приобретают характерный вид, в это же время образуются абсолютно необходимые для деления органеллы — центросомы. Затем происходит разрушение ядерной оболочки, что знаменует начало следующей по списку стадии, прометафазы.
Микротрубочки, растущие из центросом, соединяются с хромосомами, образуется веретено деления и какое-то время совершается серия сложных движений, названных конгрессией — прикрепленные к микротрубочкам хромосомы движутся от и к полюсам, до тех пор, пока не выстроятся ровно на экваторе клетки, образуя метафазную пластинку. Когда все хромосомы примут это положение, начнется метафаза. Непосредственно в нее ничего не происходит, клетке нужна пауза, чтобы проверить, все ли хромосомы правильно прикрепились, читай чтобы каждый кинетохор был прикреплен к микротрубочкам своего полюса, а затем начинается анафаза.
Веретено деления - это уникальная структура, существующая только во время деления клетки, совершенно необходимая как для разделения хромосом, так и для разделения цитоплазмы дочерних клеток. Состоит она из центросом, состоящих из двух центриолей каждая, располагающихся в норме у человека на двух противоположных полюсах, микротрубочек, растущих от них в направлении к центру клетки — к хромосомам, астральных микротрубочек, идущих от центросом во всех направлениях, но не к хромосомам, белковых моторов, а также из самих хромосом.
В делении задействован особый участок хромосомы — центромера, представляющая из себя комплекс из ДНК и хроматина, к которой прикрепляется кинетохор, сложная структура, служащая для связывания с микротрубочкам веретена. Центромера состоит из специфических участков, названных CEN, и с ними связываются соответствующие белки, CENP. Последние остаются с хромосомами до самого конца, но есть ещё и "хромосомные пассажиры", меняющие свою локализацию в ходе деления, к ним относят в первую очередь некоторые киназы. Кинетохоров у каждой хромосомы два, и они находятся на противоположных сторонах центромеры, повернуты друг от друга, и основная их функция — захват и стабилизация микротрубочек. Первое осуществляет наружная часть кинетохора, корона, имеющая вид щупалец, а второе — наружная пластинка (См. Рисунок 3).
После того как ядро разрушилось, хромосомы вырываются на волю и норовят рассредоточиться по всей цитоплазме. В это же время центросомы начинают во всех направлениях сразу активно синтезировать микротрубочки, чтобы точно не промахнуться. Если микротрубочка не нашла свой кинетохор, она диссоциирует, если же нашла, то последний захватывает ее, и начинает перемещаться в направлении полюса, попутно связывая и другие, в результате чего образуется нить кинетохора. В какой-то момент кинетохор противоположной стороны также связывает какую-нибудь микротрубочку.
Движение хромосом, вообще, очень сложный процесс, и даже на данный момент неизвестно точно, как это происходит, но есть несколько теорий, а также свеженькая (2017 года) статья, авторы которой предлагают объединить оба главных предположения в одно: гипотезу Остергрена, что кинетохор находится на конце микротрубочки, а моторы на полюсах подтягивают ее к себе, причем усилие прямо пропорционально длине микротрубочки — таким образом хромосомы стремятся к экватору, где будет наблюдаться равновесие сил; и модель "пакман", в которой основное усилие создают моторы на кинетохорах, а концы микротрубочек, связанные с ними, диссоциируют, т.е. кинетохор как бы "поедает" кинетохорную нить. Также в движении участвуют моторные белки, хромокинезины, находящиеся на плечах хромосом, а также отталкивающая сила микротрубочек, неприкреплённых к кинетохорам (таким образом, при движении хромосомы к полюсу, её плечи будут отталкиваться растущими навстречу микротрубочками). В принципе. найдено более ста белков, участвующих в конгрессии хромосом, но точная функция установлена лишь для немногих.
Когда все хромосомы выстроились на экваторе клетки, белки-пассажиры, проверяют, достаточно ли микротрубочек прикрепилось к каждому кинетохору. И до тех пор, пока "достаточно" не станет, анафаза не не начнётся.
Анафазу условно делят на анафазу А и анафазу В. Но это не стадии этапа митоза, а скорее процессы, происходящие в неё. В анафазу А расходятся к полюсам хромосомы, в анафазу В — сами полюса. Но процессы эти идут практически одновременно. Первым делом хромосомы разделяются на две хроматиды, как раз в области центромеры, таким образом, что каждая хроматида обладает одним кинетохором. Те же силы, что управляют движением хромосом во время прометафазы, управляют движением и во время анафазы, но теперь ничто не мешает хроматиде спокойно двигаться к полюсу. В этом также участвуют многочисленные моторы, располагающиеся между микротрубочками, связанными с кинетохорами, между ними и микротрубочками, с ними не связанными, моторы полюсов. (См. Рисунок 4)
Во время анафазы В моторы, находящиеся на закрепленных у цитолеммы концах астральных микротрубочек, притягивают полюс к себе, а кинезиноподобные белки вроде Eg5, соединяясь с микротрубочками, идущими от противоположных полюсов, отталкивают микротрубочки от центра, и, таким образом, расходятся и сами полюса. В анафазу происходит и образование толстого пучка микротрубочек между расходящимися хромосомами, который после получит название остаточного тельца.
Далее наступает телофаза, в которую образуются две дочерние клетки. Процесс непосредственного разделения цитоплазмы на две части носит названия цитокинеза и является завершающим этапом митоза. Для него необходимо три элемента: веретено деления (оно никуда не делось после расхождения хромосом), остаточное тельце и сократимое кольцо. Последнее представляет собой пучок актиновых филаментов, связанных между собой миозинами, и находится оно прям под цитолеммой, образуя кольцо в области экватора. Веретено деления необходимо для образования в нужном месте остаточного тельца, а оно уже, в свою очередь, даёт клетке понять, где именно синтезировать сократимое кольцо.
Образовавшись, кольцо тут же начинает сокращение, благодаря взаимодействию актина и миозина II. Плазмалемма втягивается, образуется "бороздка деления". Интересен тот факт, что толщина сократимого кольца не увличивается при сокращениии, а остаётся неизменной до самого конца, что достигается за счёт постоянной диссоциации белков, его образующих. Итак, кольцо сжимается-сжимается, и в итоге дочерние клетки становятся, связаны друг с другом лишь перемычкой — остаточным тельцем, которое может существовать ещё долгое время. В случае, если какой-то генетический материал не до конца разошёлся, а остался посреди клетки, бороздка деления пропадает, и образуется двухядерная клетка, если же всё пошло по плану, то перемычка разрушается, так или иначе, и деление тем самым завершается.
Факторы, участвующие в конгрессии (выстраивании хромосом в геометрическом центре веретена)
2. ФАКТОРЫ, УЧАСТВУЮЩИЕ В КОНГРЕССИИ (ВЫСТРАИВАНИИ ХРОМОСОМ В ГЕОМЕТРИЧЕСКОМ ЦЕНТРЕ ВЕРЕТЕНА)
1) РОСТ И УКОРАЧИВАНИЕ МИКРОТРУБОЧЕК.
2) СИЛЫ НАПРАВЛЕННЫЕ К ПОЛЮСАМ
(ПРИЛОЖЕНЫ НА КИНЕТОХОРЫ - моторы,
деполимеризация микротрубочек).
3) СИЛЫ, НАПРАВЛЕННЫЕ ОТ ПОЛЮСОВ
(ПРИЛОЖЕНЫ НА КИНЕТОХОРЫ И ПЛЕЧИ
ХРОМОСОМ - толкающие силы от
некинетохорных и кинетохорных микротрубочек,
моторы – хромокинезины).
3. ОСНОВНЫЕ СОБЫТИЯ, ПРОИСХОДЯЩИЕ ВО ВРЕМЯ МЕТАФАЗЫ
4. ОСЦИЛЛИРОВАНИЕ КИНЕТОХОРОВ К ПОЛЮСУ И ОТ ПОЛЮСА ВО ВРЕМЯ ДВИЖЕНИЯ ХРОМОСОМ В ПОЗДНЕЙ ПРОМЕТАФАЗЕ И АНАФАЗЕ
5. ПЕРЕТЕКАНИЕ СУБЪЕДИНИЦ ТУБУЛИНА ПО МИКРОТРУБОЧКАМ ВЕРЕТЕНА
Субъединицы тубулина постоянно включаются в микротрубочки у
кинетохоров и перемещаются к полюсам, где они затем отсоединяются.
Таким образом, они постоянно перетекают от кинетохора к полюсу в составе
микротрубочки или кинетохорной фибриллы. Во время метафазы, длина
кинетохорных микротрубочек остается без изменений, так как добавление
субъединиц у плюс конца балансируется убавлением субъединиц у минус
конца..
6. «FLUX» ТУБУЛИНА ВО ВРЕМЯ МЕТАФАЗЫ
7. SPINDLE ASSEMBLY CHECKPOINT (SAC) – ПРОВЕРКА ПРИКРЕПЛЕНИЯ ХРОМОСОМ К МИКРОТРУБОЧКАМ ВЕРЕТЕНА
Клетка
на
стадии
прометафазы.
На
одном
кинетохоре
хромосомы
выявляется
белок
Mad2
(розовая стрелка).
Другой
кинетохор (белая стрелка),
который
прикрепился
к
микротрубочкам веретена, не
содержит Mad2.
SAC запрещает переход в анафазу до того
момента, как все сестринские кинетохоры
прикрепятся к микротрубочкам веретена, и
хромосомы
сформируют
метафазную
пластинку.
В состав SAC входят белки - Cdc20, Mad2,
Mad3 (BubR1), Bub3.
Белок Cdc20 является частью SAC и им же
регулируется.
Основной мишенью SAC является APCCdc20.
Фактически Cdc20, Mad2, Mad3 (BubR1), Bub3
образуют Mitotic Checkpoint Complex (МСС),
который ингибирует АРС для того, чтобы
преждевременно не началась анафаза.
8. ВОЗМОЖНЫЙ МЕХАНИЗМ РАБОТЫ БЕЛКОВ SAC НА КИНЕТОХОРЕ
9. Удаление белков чекпоинта с прикрепленного к микротрубочкам кинетохора (McHugh and Welburn, 2017)
12. ОСНОВНЫЕ СОБЫТИЯ, ПРОИСХОДЯЩИЕ В АНАФАЗЕ
13. ЭТАПЫ УДАЛЕНИЯ КОГЕЗИНОВ С ХРОМОСОМ ВО ВРЕМЯ МИТОЗА (Martson, 2015)
Удаление
когезинов
в
профазе
происходит
путем
фосфорилирования субъединицы Scc3/SA2 когезинов и
активации белка Wap1 (непротеолитический механизм).
Расщепление Scc1 субъединицы при участии сепаразы
запускает расхождение хромосом в начале анафазы
(протеолитический механизм).
14. ДВИЖУЩИЕ СИЛЫ АНАФАЗЫ А и АНАФАЗЫ В
15. Anaphase A: Disassembling Microtubules Move Chromosomes toward Spindle Poles (Asbury, 2017)
16. УЧАСТИЕ DAM1 И SKA1 В СОЧЕТАНИИ ПРИКРЕПЛЕНИЯ С ДЕПОЛИМЕРИЗАЦИЕЙ МИКРОТРУБОЧЕК
17. ВОЗМОЖНЫЕ МЕХАНИЗМЫ СОЧЕТАНИЯ РАЗБОРКИ МИКРОТРУБОЧЕК С ДВИЖЕНИЕМ ХРОМОСОМ К ПОЛЮСАМ
18. Models showing the possible mechanisms of KT-MT attachment in human cells vs yeast (from Thomas et al., 2017)
Models showing the possible mechanisms of KTMT attachment in human cells vs yeast (from
Thomas et al., 2017)
19. Direct kinetochore–spindle pole connections are not required for chromosome segregation (Sikirzhytski et al., 2014)
20. ВО ВРЕМЯ АНАФАЗЫ ХРОМОСОМЫ ДВИЖУТСЯ К ПОЛЮСАМ НА УКОРАЧИВАЮЩИХСЯ МИКРОТРУБОЧКАХ
В митотические клетки вводили
меченый тубулин, который
включался в микротрубочки
веретена. Сразу после начала
анафазы, с помощью лазера
было проведено
обесцвечивание полосы около
верхнего полюса. Затем
наблюдали за флюоресценцией
в зоне обесцвечивания. В
данной клетке хромосомы
достигали обесцвеченную зону
быстрее, чем полоса достигала
полюса веретена.
21. ФУНКЦИИ МОТОРНЫХ БЕЛКОВ В АНАФАЗЕ В
(+) конец ориентированные моторные белки связывают антипараллельные
межполюсные микротрубочки и вызывают их скольжение относительно друг
друга, расталкивая полюса друг от друга. Красные стрелки обозначают
направление скольжения.
(-) конец ориентированные моторные белки
связываются с клеточным кортексом и с астральными микротрубочками, и
тянут полюса в разные стороны.
Эти астральные микротрубочки
укорачиваются по мере того, как полюса притягиваются к кортексу.
Регуляция конгрессии хромосом
• Силы, действующие на плечи хромосом, отталкивают их от полюса
• Эти силы развиваются при взаимодействии плеч хромосом и микротрубочек веретена
• Кинетохоры могут переключаться между активным и пассивным состояниями
• Переключение сестринских кинетохоров между двумя состояниями представляет собой скоординированный процесс
Наряду с кинетохорами, плечи митотических хромосом также являются объектом приложения силы. Это можно продемонстрировать экспериментально, используя тонко сфокусированный лазерный пучок, которым можно отрезать плечи моноориентированной хромосомы от участков, содержащих кинетохоры.
Как показано на рисунке ниже, освободившись от основной части хромосомы, плечи быстро вытесняются из области полюса. Это означает, что в митозе к хромосомам также приложены силы, которые отталкивают их от полюса. Эти силы отталкивания, называются «полярными ветрами» и частично генерируются хромокинезинами. Эти представители семейства кинезинов локализованы на поверхности плеч хромосом, где они взаимодействуют с микротрубочками веретена и отодвигают хромосому от полюса.
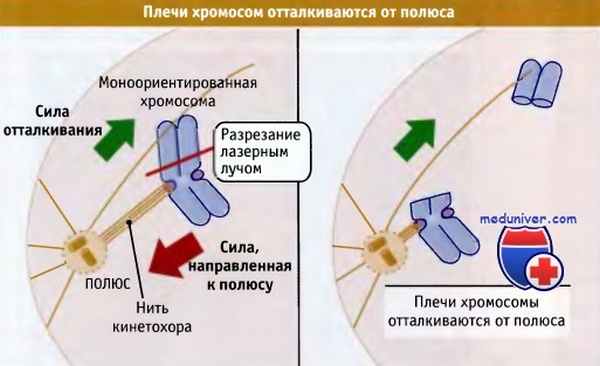
Схема эксперимента, демонстрирующего, что плечи хромосом подвержены действию силы, отталкивающей их от полюса.
Моноориентированная хромосома находится на некотором расстоянии от полюса, к которому она прикреплена.
Если хромосому разрезать с помощью лазерного луча, то часть ее, не содержащая кинетохора,
быстро отходит от полюса, в то время как оставшаяся часть перемещается на новое положение, ближе к полюсу.
Таким образом, силе, действующей на кинетохор в направлении полюса, противостоит другая сила, действующая на плечи хромосомы.
В этом процессе также участвует еще один, более тонкий механизм. По мере своего роста, концы микротрубочек способны отталкивать объекты, и микротрубочки, которые в митозе постоянно растут от каждого полюса, помогают вытеснять хромосомы. Оба механизма генерируют силу, величина которой уменьшается с ростом расстояния от полюса, т. е. по мере снижения плотности микротрубочек. В этих условиях хромосома, прикрепленная только к одному полюсу, остановится в том месте, где вытесняющая сила полярного ветра уравновешена силами, направленными к полюсу и действующими на кинетохор. В результате такая хромосома прекращает движение к полюсу.
Модель тянущей нити первоначально предполагала, что, раз кинетохор прикреплен к веретену, он постоянно испытыват воздействие силы, направленной к полюсу. Если бы это было так, то хромосома, прикрепленная к обоим полюсам, постоянно двигалась бы к середине веретена, а затем оставалась бы там до начала анафазы. Такое положение, по-видимому, сохраняется для многих типов клеток, включая растений и насекомых, в которых хромосомы не движутся после того, как они позиционировались на метафазной пластинке.
Однако в большинстве клеток при конгрессии хромосомы постоянно перемещаются на небольшие расстояния по обе стороны от веретена, как это иллюстрирует первая рамка видеосъемки.
Эти движения вызваны кинетохорами и иллюстрируют некоторые важные моменты их функционирования. Для того чтобы обеспечить подобный колебательный тип движения, каждый кинетохор должен обладать способностью пребывать в двух различных состояниях и уметь переключаться между ними. Как показано на рисунке ниже, переключение сестринских кинетохоров между разными функциональными состояниями, приводящее к изменению направления движения хромосомы, должно носить скоординированный характер.
По мере колебательного движения хромосомы, кинетохор, который движется к связанному с ним полюсу, производит или испытывает усилие, направленное к этому полюсу. При движении кинетохора из микротрубочек его нити должны теряться тубулиновые субъединицы. В то же время другой кинетохор должен пребывать в «нейтральном» состоянии, которое позволяет ему удаляться от полюса на конце нити кинетохора, которая активно включает субъединицы чтобы обеспечить элонгацию. Хромосома меняет направление, и когда два кинетохора меняются ролями, наступает новый колебательный цикл.
Периодическое переключение активности между сестринскими кинетохорами носит название динамическая нестабильность кинетохора, и положение хромосомы в веретене сильно зависит от того, насколько скоординированный характер носит этот процесс Неизвестно, что заставляет кинетохор переключаться между нейтральным и активным состоянием и каким образом координируется эта активность между сестринскими кинетохорами. Впрочем, переключение должно быть чувствительно к положению хромосомы по отношению к экватору веретена; в противном случае хромосома не смогла бы оставаться в надежно центрированном состоянии.
Кадры видеосъемки, иллюстрирующие, что на митотические хромосомы действует сила, которая отталкивает их от полюса. Схема, иллюстрирующая действие сил, приложенных к моноориентированной хромосоме.
За счет усилия на кинетохоре (показано красной стрелкой) хромосома оттягивается к полюсу,
а противоположно направленная сила (показана зеленой стрелкой) вызывает ее отталкивание от полюса.
Когда эти две силы уравновешиваются, хромосома занимает устойчивое положение (правый рисунок).
Если одна из сил больше другой, хромосома перемещается либо в направлении полюса, либо от него (левый рисунок). Первый кадр видеосъемки, показывающий,
что в течение метафазы хромосомы не находятся в стабильном положении в центре клетки,
а постоянно движутся взад и вперед. Прикрепившись к веретену, кинетохор находится в одном из двух активных состояний.
Одно состояние позволяет ему перемещаться в направлении полюса за счет укорачивания нити (слева).
Другое дает возможность оставаться в стационарном состоянии или отодвигаться от полюса при элонгации нити.
Активность обоих сестринских кинетохоров скоординирована таким образом, что они одновременно редко находятся а активном состоянии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Веретено
Микрофотография, на которой показаны конденсированные хромосомы в синем, кинетохорах в розовом и микротрубочках в зеленом во время метафазы митоза
В клеточной биологии, веретенообразный аппарат (или митотическое веретено ) относится к цитоскелетной структуре эукариотических клеток, которая формируется во время клетки деление для разделения сестринских хроматид между дочерними клетками. Он называется митотическим веретеном во время митоза, процессом, который производит генетически идентичные дочерние клетки, или мейотическим веретеном во время мейоза, процессом, который производит гаметы с половиной числа хромосом родительской клетки.
Помимо хромосом, веретенообразный аппарат состоит из сотен белков. Микротрубочки составляют самые многочисленные компоненты механизма.
Содержание
- 1 Структура веретена
- 1.1 Белки, ассоциированные с микротрубочками и динамика веретена
- 2.1 Модель «поиска и захвата», опосредованная центросомами
- 2.2 Хроматин- опосредованная самоорганизация митотического веретена
Структура веретена
На этой диаграмме изображена организация типичного митотического веретена, обнаруженного в клетках животных. Хромосомы прикрепляются к кинетохоре микротрубочкам через мультипротеиновый комплекс, называемый кинетохорой. Полярные микротрубочки переплетаются в средней зоне веретена и раздвигают полюса веретена через моторные белки. Астральные микротрубочки прикрепляют полюса веретена к клеточной мембране. Полимеризация микротрубочек зарождается в центре организации микротрубочек.
Присоединение микротрубочек к хромосомам опосредуется кинетохорами, которые активно контролируют формирование веретена и предотвращают преждевременную анафазу начало. Полимеризация микротрубочек и деполимеризация динамически приводят к конгрессу хромосом. Деполимеризация микротрубочек вызывает напряжение на кинетохорах; биполярное прикрепление сестринских кинетохор к микротрубочкам, исходящим от противоположных полюсов клетки, объединяет противодействующие силы натяжения, выравнивая хромосомы на экваторе клетки и настраивая их для сегрегации дочерними клетками. Как только каждая хромосома становится биориентированной, начинается анафаза и cohesin, который объединяет сестринские хроматиды, разрывается, что позволяет переходить сестринские хроматиды к противоположным полюсам.
Аппарат клеточного веретена включает веретено микротрубочки, ассоциированные белки, которые включают молекулярные моторы кинезин и динеин, конденсированные хромосомы и любые центросомы или звездочки, которые могут присутствовать на полюсах веретена в зависимости от типа клетки. Шпиндельный аппарат имеет в поперечном сечении нечетко эллипсоид и сужается на концах. В широкой средней части, известной как средняя зона веретена, антипараллельные микротрубочки связаны в пучки с помощью кинезинов. На заостренных концах, известных как полюса веретена, микротрубочки зарождаются с помощью центросом в большинстве клеток животных. Ацентросомные или анастральные веретена лишены центросом или звездочек на полюсах веретена, соответственно, и встречаются, например, во время мейоза самок у большинства животных. В этом случае градиент Ran GTP является основным регулятором организации и сборки микротрубочек веретена. У грибов веретена образуются между телами полюсов веретена, встроенными в ядерную оболочку, которая не разрушается во время митоза.
Связанные с микротрубочками белки и динамика веретена
Динамическое удлинение и укорочение микротрубочек веретена посредством процесса, известного как динамическая нестабильность, в значительной степени определяет форму митотическое веретено и способствует правильному выравниванию хромосом в средней зоне веретена. Связанные с микротрубочками белки (MAP) связываются с микротрубочками в средней зоне и полюсах веретена, чтобы регулировать их динамику. γ-тубулин - это специализированный вариант тубулина, который собирается в кольцевой комплекс, называемый γ-TuRC, который зарождается полимеризацией α / β тубулина гетеродимеров в микротрубочки. Привлечение γ-TuRC в перицентросомальную область стабилизирует минус-концы микротрубочек и закрепляет их около центра организации микротрубочек. Связанный с микротрубочками белок Augmin действует совместно с γ-TURC, чтобы зародить новые микротрубочки из существующих микротрубочек.
Растущие концы микротрубочек защищены от катастрофы действием белков отслеживания микротрубочек на плюс-конце (+ TIPs), чтобы способствовать их ассоциации с кинетохорами в средней зоне. CLIP170, как было показано, локализуется вблизи плюс-концов микротрубочек в клетках HeLa и накапливается в кинетохорах во время прометафазы. Хотя как CLIP170 распознает плюс-концы, остается неясным, было показано, что его гомологи защищают от катастроф и способствуют спасению, подтверждая роль CLIP170 в стабилизации плюс-концов и, возможно, опосредуя их прямое прикрепление к кинетохорам. CLIP-ассоциированные белки, такие как CLASP1 у людей, также, как было показано, локализуются на плюс-концах и на внешней кинетохоре, а также модулируют динамику микротрубочек кинетохор (Maiato 2003). Гомологи CLASP у Drosophila, Xenopus и дрожжей необходимы для правильной сборки веретена; у млекопитающих CLASP1 и CLASP2 вносят вклад в правильную сборку веретена и динамику микротрубочек в анафазе. Полимеризация плюсовых концов может дополнительно замедляться белком EB1, который напрямую связывает растущие концы микротрубочек и координирует связывание других + TIP.
Действие этих стабилизирующих микротрубочки белков противодействует ряду микротрубочек. -деполимеризующие факторы, которые позволяют динамическое ремоделирование митотического веретена, способствуя конгрессии хромосом и достижению биполярности. Суперсемейство MAP кинезин -13 содержит класс моторных белков, направленных на положительный конец, с ассоциированной активностью деполимеризации микротрубочек, включая хорошо изученные MCAK млекопитающих и Xenopus XKCM1. MCAK локализуется на растущих кончиках микротрубочек на кинетохорах, где он может вызвать катастрофу в прямой конкуренции со стабилизирующей активностью + TIP. Эти белки используют энергию гидролиза АТФ, чтобы вызвать дестабилизирующие конформационные изменения в структуре протофиламента, которые вызывают высвобождение кинезина и деполимеризацию микротрубочек. Потеря их активности приводит к многочисленным митотическим дефектам. Дополнительные дестабилизирующие микротрубочки белки включают Op18 / stathmin и катанин, которые играют роль в ремоделировании митотического веретена, а также в содействии сегрегации хромосом во время анафазы.
Активность этих MAPs. тщательно регулируются для поддержания надлежащей динамики микротрубочек во время сборки веретена, причем многие из этих белков служат субстратами Aurora и Polo-like kinase.
Организация веретенообразного аппарата
В модели «поиска и захвата», опосредованной центросомами (слева), микротрубочки, образовавшиеся из центросом, случайно контактируют с хромосомами и стабилизируются на кинетохорах с образованием веретена. В модели «самоорганизации», опосредованной хроматином (справа), микротрубочки зарождаются вокруг митотического хроматина и организуются в биполярный массив моторными белками.
В правильно сформированном митотическом веретене би-ориентированные хромосомы выровнены. вдоль экватора клетки с микротрубочками веретена, ориентированными примерно перпендикулярно хромосомам, их плюс-концы заключены в кинетохоры, а их минус-концы закреплены на полюсах клетки. Точная ориентация этого комплекса требуется для обеспечения точной сегрегации хромосом и определения плоскости деления клетки. Однако остается неясным, как веретено становится организованным. В этой области преобладают две модели, которые являются синергетическими и не исключающими друг друга. В модели поиска и захвата веретено преимущественно организовано за счет разделения полюсов центросомных центров организации микротрубочек (MTOCs). Микротрубочки веретена исходят из центросом и «ищут» кинетохоры; когда они связываются с кинетохорой, они стабилизируются и оказывают давление на хромосомы. В альтернативной модели самосборки микротрубочки подвергаются ацентросомному зарождению среди конденсированных хромосом. Ограниченные размерами клетки, латеральными ассоциациями с антипараллельными микротрубочками через моторные белки и концевыми присоединениями к кинетохорам, микротрубочки естественным образом принимают веретенообразную структуру с хромосомами, выровненными вдоль экватора клетки.
Центросомно-опосредованная модель «поиска и захвата»
В этой модели микротрубочки зарождаются в центрах организации микротрубочек и подвергаются быстрому росту и катастрофе, чтобы «искать» в цитоплазме кинетохоры. Как только они связываются с кинетохорами, они стабилизируются, а их динамика снижается. Недавно моноориентированная хромосома колеблется в пространстве около полюса, к которому она прикреплена, пока микротрубочка с противоположного полюса не свяжет сестринскую кинетохору. Это второе прикрепление дополнительно стабилизирует прикрепление кинетохор к митотическому веретену. Постепенно двунаправленная хромосома тянется к центру клетки до тех пор, пока натяжение микротрубочек не уравновесится с обеих сторон центромеры ; затем сжатая хромосома колеблется на метафазной пластинке, пока начало анафазы не высвободит сцепление сестринских хроматид.
В этой модели центры организации микротрубочек локализованы на полюсах клетки, их разделение обусловлено полимеризацией микротрубочек и «скольжением» антипараллельных микротрубочек веретена относительно друг друга в средней зоне веретена, опосредованной биполярным положительным концом. -направленные кинезины. Такие силы скольжения могут объяснять не только разделение полюсов веретена на ранних этапах митоза, но также удлинение веретена во время поздней анафазы.
Хроматин-опосредованная самоорганизация митотического веретена
В отличие от механизма поиска и захвата, в котором центросомы в значительной степени диктуют организацию митотического веретена, эта модель предполагает, что микротрубочки являются зарождаются ацентросомно около хромосом и спонтанно собираются в антипараллельные пучки и принимают веретенообразную структуру. Классические эксперименты Хилда и Карсенти показывают, что функциональные митотические веретена и ядра образуются вокруг покрытых ДНК шариков, инкубированных в экстрактах яиц Xenopus, и что биполярные массивы микротрубочек образуются в отсутствие центросом и кинетохор. В самом деле, также было показано, что лазерная абляция центросом в клетках позвоночных не ингибирует ни сборку веретена, ни сегрегацию хромосом. Согласно этой схеме форма и размер митотического веретена являются функцией биофизических свойств перекрестно-связывающих моторных белков.
Опосредованное хроматином зарождение микротрубочек с помощью градиента Ran GTP
Фактор обмена гуаниновых нуклеотидов для малой GTPase Ran (регулятор конденсации хромосом 1 или RCC1 ) прикрепляется к нуклеосомам через коровые гистоны H2A и H2B. Таким образом, вокруг митотического хроматина образуется градиент GTP-связанного Ran. Стеклянные шарики, покрытые RCC1, вызывают зарождение микротрубочек и формирование биполярного веретена в экстрактах яиц Xenopus, показывая, что одного градиента Ran GTP достаточно для сборки веретена. Градиент запускает высвобождение факторов сборки веретена (SAFs) от ингибирующих взаимодействий через транспортные белки importin β / α. Несвязанные SAF затем способствуют зарождению микротрубочек и стабилизации вокруг митотического хроматина, а биполярность веретена организована моторными белками микротрубочек.
Регуляция сборки веретена
Сборка веретена в значительной степени регулируется событиями фосфорилирования, катализируемыми митотическими процессами. киназы. Циклинзависимые киназные комплексы (CDK) активируются митотическими циклинами, трансляция которых увеличивается во время митоза. CDK1 (также называемая CDC2) считается основной митотической киназой в клетках млекопитающих и активируется циклином B1. Киназы Aurora необходимы для правильной сборки и разделения веретена. Aurora A ассоциируется с центросомами и, как полагают, регулирует митотический вход. Аврора B является членом хромосомного комплекса-пассажира и опосредует прикрепление хромосомы к микротрубочке и сцепление сестринских хроматид. Поло-подобная киназа, также известная как PLK, особенно PLK1, играет важную роль в поддержании веретена, регулируя динамику микротрубочек.
Структура митотической хромосомы
К концу ДНК При репликации сестринские хроматиды связаны вместе в аморфную массу запутанной ДНК и белка, которую было бы практически невозможно разделить на каждую дочернюю клетку. Чтобы избежать этой проблемы, митотическое вступление запускает драматическую реорганизацию дублированного генома. Сестринские хроматиды распутаны и отделены друг от друга. Хромосомы также укорачиваются в длину, до 10 000 раз в клетках животных, в процессе, называемом конденсацией. Конденсация начинается в профазе, и хромосомы максимально уплотняются в стержневидные структуры к тому времени, когда они выравниваются в середине веретена в метафазе. Это придает митотическим хромосомам классическую Х-образную форму, наблюдаемую в кариотипах, где каждая конденсированная сестринская хроматида связана по своей длине белками когезин и соединена, часто около центра, на центромера.
Хотя эти динамические перестройки жизненно важны для обеспечения точной и высокоточной сегрегации генома, наше понимание структуры митотической хромосомы остается в значительной степени неполным. Однако были идентифицированы несколько специфических молекулярных игроков: Топоизомераза II использует гидролиз АТФ, чтобы катализировать распутывание цепочек ДНК, способствуя разрешению сестринских хроматид. Конденсины представляют собой комплексы из 5 субъединиц, которые также используют АТФ-гидролиз для ускорения конденсации хромосом. Эксперименты с экстрактами яиц Xenopus также показали, что линкер гистон H1 является важным регулятором уплотнения митотических хромосом.
Контрольная точка сборки митотического веретена
Завершение формирования веретена имеет решающее значение Точка перехода в клеточном цикле называется контрольной точкой сборки шпинделя. Если к моменту этой контрольной точки хромосомы не прикреплены должным образом к митотическому веретену, наступление анафазы будет отложено. Отказ этой контрольной точки сборки веретена может привести к анеуплоидии и может быть вовлечен в старение и формирование рака.
Ориентация веретенообразного аппарата
Ориентация деления клеток имеет большое значение для архитектуры ткани, судьбы клеток и морфогенез. Клетки имеют тенденцию делиться вдоль своей длинной оси в соответствии с так называемым правилом Гертвига. Ось деления клеток определяется ориентацией веретенообразного аппарата. Клетки делятся по линии, соединяющей две центросомы веретенообразного аппарата. После образования веретенообразный аппарат совершает вращение внутри ячейки. Астральные микротрубочки, происходящие из центросом, достигают клеточной мембраны, где они тянутся к определенным кортикальным подсказкам. In vitro распределение кортикальных ключей устанавливается с помощью клейкого рисунка. Сигналы полярности in vivo определяются локализацией локализованных в вершинах клеток. Пространственное распределение корковых ключей приводит к силовому полю, которое определяет окончательную ориентацию веретенообразного аппарата и последующую ориентацию деления клеток.
Клеточный цикл
От того, насколько своевременно и точно делятся клетки, зависит адекватная работа ткани, органа и всего организма. При нарушениях этого процесса возникают опухоли, аутоиммунные заболевания и иммунодефициты, дефекты регенерации тканей. Жизнь клетки представляет собой цикл, по которому так или иначе суждено пройти каждой, поэтому пришла пора осветить этот вопрос подробно. Бесспорно, людей, связанных с медициной, интересуют больше вопросы регуляции деления, но для начала вспомним об основах.
Клеточный цикл выглядит следующим образом.
Непосредственно на деление (в нашем случае митоз) приходится меньшая часть времени, а большую часть занимает интерфаза, промежуток между делениями, во время которой клетка восстанавливается и готовится к следующему митозу. Или же не готовится: полностью дифференцированные клетки после последнего в своей жизни деления попадают в стадию G0, где и выполняют свои специфические функции. Надо сказать, для некоторых клеток это — еще не конец, и под действием каких-то внешних стимулов они могут вновь вернуться к делению, но, например, нейроны из этой стадии уже не выходят совсем.
Независимо от того, что делала клетка до интерфазы, чтобы перейти к делению, она должна пройти все ее периоды, т.е. G1, S и G2. Названия даны не случайно: в G- клетка растет, а в S -синтезирует ДНК, так, что общее количество ДНК удваивается. Забегая вперед, скажем, что переходы от одного этапа к другому управляются несколькими киназами, о чем мы скажем подробно позднее. Каждый этап проверяется — существуют "точки рестрикции", где деление останавливается, если результат конкретного периода не удовлетворяет требованиям.
Итак, в G1, сразу после митоза (или G0) клетка восстанавливает объем и массу и готовится к репликации, именно в этот период инициируется дупликация центриолей, которая сама, правда, случится позднее — в S-фазу. Если в среде присутствуют факторы роста, нет повреждений в ДНК, то клетка переходит в S-период, в который происходит репликация ДНК и дупликация центриолей. Что важно, клетка жестко следит за тем, чтоб дупликация центриолей произошла только один раз. Итак, если всё в порядке, ДНК реплицировалась удачно, то наступает G2-период, финишная прямая. Во время него опять проверяется качество ДНК, клетка увеличивает свою массу. И при условии, что все внешние и внутренние факторы способствуют переходу G2/M, наступает митоз.
Для того, чтобы две дочерние клетки поровну получили генетический материал, организация процесса деления должна быть удобной и четкой. Хромосомы вне деления находятся в деконденсированном виде, т.е. представляют собой чрезвычайно длинные нити, рассредоточенные по всему ядру. Естественно, удобно разделить ДНК у каждой из них поровну просто не получится, поэтому первым делом хромосомы спирализуются и приобретают характерный вид, в это же время образуются абсолютно необходимые для деления органеллы — центросомы. Затем происходит разрушение ядерной оболочки, что знаменует начало следующей по списку стадии, прометафазы.
Микротрубочки, растущие из центросом, соединяются с хромосомами, образуется веретено деления и какое-то время совершается серия сложных движений, названных конгрессией — прикрепленные к микротрубочкам хромосомы движутся от и к полюсам, до тех пор, пока не выстроятся ровно на экваторе клетки, образуя метафазную пластинку. Когда все хромосомы примут это положение, начнется метафаза. Непосредственно в нее ничего не происходит, клетке нужна пауза, чтобы проверить, все ли хромосомы правильно прикрепились, читай чтобы каждый кинетохор был прикреплен к микротрубочкам своего полюса, а затем начинается анафаза.
Прежде чем идти дальше, поговорим о веретене деления. По сути, это уникальная структура, существующая только во время деления клетки, совершенно необходимая как для разделения хромосом, так и для разделения цитоплазмы дочерних клеток. Состоит она из центросом, состоящих из двух центриолей каждая, располагающихся в норме у человека на двух противоположных полюсах, микротрубочек, растущих от них в направлении к центру клетки — к хромосомам, астральных микротрубочек, идущих от центросом во всех направлениях, но не к хромосомам, белковых моторов, а также из самих хромосом.
В делении задействован особый участок хромосомы — центромера, представляющая из себя комплекс из ДНК и хроматина, к которой прикрепляется кинетохор, сложная структура, служащая для связывания с микротрубочкам веретена. Центромера состоит из специфических участков, названных CEN, и с ними связываются соответствующие белки, CENP. Последние остаются с хромосомами до самого конца, но есть ещё и "хромосомные пассажиры", меняющие свою локализацию в ходе деления, к ним относят в первую очередь некоторые киназы. Кинетохоров у каждой хромосомы два, и они находятся на противоположных сторонах центромеры, повернуты друг от друга, и основная их функция — захват и стабилизация микротрубочек. Первое осуществляет наружная часть кинетохора, корона, имеющая вид щупалец, а второе — наружная пластинка.
Итак, как только ядро разрушилось, хромосомы вырываются на волю и норовят рассредоточиться по всей цитоплазме. В это же время центросомы начинают во всех направлениях сразу активно синтезировать микротрубочки, чтобы точно не промахнуться. Если микротрубочка не нашла свой кинетохор, она диссоциирует, если же нашла, то последний захватывает ее, и начинает перемещаться в направлении полюса, попутно связывая и другие, в результате чего образуется нить кинетохора. В какой-то момент кинетохор противоположной стороны также связывает какую-нибудь микротрубочку.
А как же в итоге хромосомы выстраиваются точно на экваторе, если у одного кинетохора уже образовался целый пучок, а к другому присоединена какая-то жалкая пара микротрубочек? А хороший вопрос. Движение хромосом, вообще, очень сложный процесс, и даже на данный момент неизвестно точно, как это происходит, но есть несколько теорий, а также свеженькая (2017 года) статья, авторы которой предлагают объединить оба главных предположения в одно: гипотезу Остергрена, что кинетохор находится на конце микротрубочки, а моторы на полюсах подтягивают ее к себе, причем усилие прямо пропорционально длине микротрубочки — таким образом хромосомы стремятся к экватору, где будет наблюдаться равновесие сил; и модель "пакман", в которой основное усилие создают моторы на кинетохорах, а концы микротрубочек, связанные с ними, диссоциируют, т.е. кинетохор как бы "поедает" кинетохорную нить. Также в движении участвуют моторные белки, хромокинезины, находящиеся на плечах хромосом, а также отталкивающая сила микротрубочек, неприкреплённых к кинетохорам (таким образом, при движении хромосомы к полюсу, её плечи будут отталкиваться растущими навстречу микротрубочками). В принципе. найдено более ста белков, участвующих в конгрессии хромосом, но точная функция установлена лишь для немногих. Обзор в прикреплённом документе.
Когда все хромосомы выстроились на экваторе клетки, белки-пассажиры, (об анафазном промотором комплексе скажем в следующий раз), проверяют, достаточно ли микротрубочек прикрепилось к каждому кинетохору. И до тех пор, пока "достаточно" не станет, анафаза не не начнётся.
Анафазу условно делят на анафазу А и анафазу В. Но это не стадии этапа митоза, а скорее процессы, происходящие в неё. В анафазу А расходятся к полюсам хромосомы, в анафазу В — сами полюса. Но процессы эти идут практически одновременно. Первым делом хромосомы разделяются на две хроматиды, как раз в области центромеры, таким образом, что каждая хроматида обладает одним кинетохором. Те же силы, что управляют движением хромосом во время прометафазы, управляют движением и во время анафазы, но теперь ничто не мешает хроматиде спокойно двигаться к полюсу. В этом также участвуют многочисленные моторы, располагающиеся между микротрубочками, связанными с кинетохорами, между ними и микротрубочками, с ними не связанными, моторы полюсов.
Во время анафазы В моторы, находящиеся на закрепленных у цитолеммы концах астральных микротрубочек, притягивают полюс к себе, а кинезиноподобные белки вроде Eg5, соединяясь с микротрубочками, идущими от противоположных полюсов, отталкивают микротрубочки от центра, и, таким образом, расходятся и сами полюса. В анафазу происходит и образование толстого пучка микротрубочек между расходящимися хромосомами, который после получит название остаточного тельца.
И затем наступает телофаза, в которую образуются две дочерние клетки. Процесс непосредственного разделения цитоплазмы на две части носит названия цитокинеза и является завершающим этапом митоза. Для него необходимо три элемента: веретено деления (оно никуда не делось после расхождения хромосом), остаточное тельце и сократимое кольцо. Последнее представляет собой пучок актиновых филаментов, связанных между собой миозинами, и находится оно прям под цитолеммой, образуя кольцо в области экватора. Веретено деления необходимо для образования в нужном месте остаточного тельца, а оно уже, в свою очередь, даёт клетке понять, где именно синтезировать сократимое кольцо.
Образовавшись, кольцо тут же начинает сокращение, благодаря взаимодействию актина и миозина II. Плазмалемма втягивается, образуется "бороздка деления". Интересен тот факт, что толщина сократимого кольца не увличивается при сокращениии, а остаётся неизменной до самого конца, что достигается за счёт постоянной диссоциации белков, его образующих. Итак, кольцо сжимается-сжимается, и в итоге дочерние клетки становятся связаны друг с другом лишь перемычкой — остаточным тельцем, которое может существовать ещё долгое время. В случае, если какой-то генетический материал не до конца разошёлся, а остался посреди клетки, бороздка деления пропадает, и образуется двухядерная клетка, если же всё пошло по плану, то перемычка разрушается, так или иначе, и деление тем самым завершается.
Регуляция клеточного цикла
Такое ответственное дело, как деление, должно быть тщательно спланировано и отрегулировано, особенно в условиях многоклеточного организма. Клетки проходят по клеточному циклу не непрерывно, а могут долгое время находиться на одной из стадий, если внешних и внутренних стимулирующих сигналов недостаточно, или же преобладают ингибирующие сигналы. Контроль за соблюдением всех необходимых условий проходит в нескольких контрольных точках. Если все удовлетворяет требованиям, то клетка может совершить переход (transition) от одной фазы к другой.
Основные точки это: точка рестрикции, находящаяся в конце G1 фазы интерфазы, символизирующая начало деления, точка на границе G2/M (репликация ДНК прошла успешно) и точка выхода из митоза.
Регуляция в фазе G1
Основную регуляцию осуществляют комплексы из белков-представителей семейства циклинов и представителей семейства циклин-зависимых киназ (CDK). В организме млекопитающих эти киназы преимущественно специфичны по отношению к определенному периоду клеточного цикла. Так, например, CDK1 (совместно с циклином В) проявляет свою активность во время митоза, а CDK 2,4,6 — в интерфазе. Интересный момент, что каждый циклин не строго специфичен к какой-то определенной киназе, таким образом возникает огромное количество вариаций, позволяющих тонко регулировать транскрипцию и клеточное деление (для понимания масштабов, скажем, что циклинов в человеческой клетке 29, а CDK — 20).
Активность комплексов циклин/CDK регулируется несколькими способами.
Во-первых, классика — фосфорилирование киназы. Но здесь все не так просто. Если для большинства ферментов фосфорилирование означает либо активацию, либо ингибирование, то в данном случае все зависит от того, что именно будет фосфорилировано. Если треонин в 167 положении, то киназа активируется, если же треонин в 14 и тирозин в 15, то наоборот.
Во-вторых, связывание с ингибитором (CKI), самым известным представителем которых является р27.
В-третьих, циклины в составе комплекса могут быть убиквитинированы и подвергнуты протеолизу.
А в-четвертых, основных участников можно просто не пускать в ядро. Так, циклин В1 в нефосфорилированном виде экранирует на поверхность сигнал ядерного экспорта (NES), а сигнал ядерной локализации (NLS) в это время спрятан, в силу чего этот белок не может попасть в ядро и осуществлять положенные ему функции.
Для помощи в принятии решения клетке, вступать ли в митоз, природой предусмотрено несколько механизмов.
Первый из них — связывание специфическими рецепторами различных факторов роста. Самый первый из открытых — тромбоцитарный фактор роста (PDGF). Две его молекулы связываются с двумя рецепторами, являющимися тирозиновыми киназами, после чего последние образуют димер, способный к аутофосфорилированию. Затем к этому фосфорилированному димеру присоединяются различные адапторные белки и ГТФ-азы Ras, образуя комплекс, а этот комплекс, в свою очередь, запускает активацию киназного каскада Ras/Raf/MEK/ERK, итогом чего служит фосфорилирование транскрипционных факторов с-Jun, c-Myc, c-Fos — их активация, а активированные белки далее либо сами по себе (с-Мус), или образуя димер, АР-1 (c-Fos + с-Jun) запускают транскрипцию генов раннего ответа (Jun, Myc, Fos), что активируют далее транскрипцию т. н. генов замедленного ответа, непосредственно участвующих в регуляции клеточного цикла, ярким примером которых служит циклин G1-фазы — циклин D.
Во-вторых, как уже было сказано, комплексы циклин/CDK могут быть связаны с ингибитором. Для удаления последнего существует специальная убиквитин-зависимая система протеолиза (UPC), состоящая из трех типов ферментов: E1 (убиквитин-активирующего), Е2 (убиквитин-связывающего) и Е3 (убиквитин-лигазы). Вообще, убиквитин очень широко используется в клетке: помеченный им (в большинстве случаев не одной, а несколькими молекулами) субстрат, как правило, подвергается протеолизу. В нашем случае, когда мы рассматриваем переход G1/S, субстратом являются ингибиторы циклин-зависимых киназ (CKI), а убиквитин-лигаза будет принадлежать к семейству куллин-содержащих лигаз под именем SCF, но отметим, что UPC работает на протяжении всего клеточного цикла и точкой рестрикции ее действие не ограничивается.
SCF является комплексом, состоящим из четырех компонентов: трех константных (Skp1, Rbx1, Cullin1) и одного вариабельного, белка F-бокса, которых на данный момент насчитывают около 70, и именно они отвечают за специфичность по отношению к конкретному субстрату. Причем белки F-бокса могут быть как активаторами деления (Skp2), так и супрессорами (FBW7), или быть и теми и другими в зависимости от обстоятельств (β-TrCP); нарушения их функционирования замечено в некоторых опухолях. Итак, при протеолизе ингибитора CDK комплекс циклин/CDK становится активен и может далее выполнять свою задачу.
Третьим же механизмом, благодаря которому клетка может преодолеть точку рестрикции, является система Rb/E2F. E2F — семейство факторов транскрипции, играющих важную роль в апоптозе и клеточном цикле. Ранее считалось, что его представители играют сугубо активирующую роль, запуская транскрипцию необходимых для прохождения клеточного цикла генов. Сейчас же стало известно, что не все так просто (в общем, как и всегда), и, к примеру, E2F1 может быть как онкогеном, так и онкосупрессором в зависимости от обстоятельств, но в целом E2F1-3 факторы являются активаторами транскрипции как самих себя, так и циклина Е. Современная модель выглядит следующим образом (схема): в G0 и в течение ранней G1 E2F связаны с промоторами и белком ретинобластомы (Rb). Под действием cycD/CDK4,6 Rb фосфорилируется и Rb отсоединяется от E2F, в результате запускается транскрипция как E2F, так и циклина Е, который совместно с циклином-2 по механизму положительной обратной связи тоже фосфорилирует Rb, за счет чего достигается амплификация данного циклина и переход в следующую фазу — фазу S.
Читайте также:
