Реинфузия крови - показания, противопоказания, эффективность
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Проблема профилактики акушерских кровотечений и восполнения кровопотери всегда актуальна и требует постоянного изучения и новых рациональных подходов к ее решению. По литературным данным известно, что более 2/3 всех акушерских кровотечений связаны с нарушением состояния гемостаза, т.е. являются первично коагулопатическими.
Аутоплазмодонорство - метод кровесбережения, заключающийся в заготовке собственной плазмы индивидуума и предназначенный исключительно для последующей аутологичной трансфузии. В акушерстве сущность методики заключается сборе, замораживании и хранении плазмы женщины для последующего переливания ее во время или после родоразрешения с целью возмещения объема циркулирующей плазмы и факторов свертывания крови, а также купирования или лечения ДВС - синдрома.
Показания к заготовке и хранению аутоплазмы в акушерстве:
1. Беременные группы высокого риска по развитию кровотечения.
2. Беременные с высоким риском по развитию гемотрансфузионных осложнений.
3. Беременные с редкими группами крови.
4. Отказ пациентки от переливания донорских компонентов крови, при отсутствии противопоказаний к аутодонации.
Противопоказания к заготовке аутоплазмы в акушерстве:
1. Анемия - Нв2. Гипопротеинемия - общий белок 3. Изокоагуляция не характерная сроку беременности.
4. Заболевания крови - гемофилия, тромбоцитопения и др.
5. Тяжелая экстрагенитальная патология.
6. Онкологические заболевания.
7. Тромбозы.
Показания к трансфузии аутоплазмы в акушерстве:
1. Кровотечение в родах или при абдоминальном родоразрешении.
2. ДВС - синдром.
Противопоказания к трансфузии аутоплазмы в акушерстве:
1. Наличие выраженной гиперкоагуляции перед родами и отсутствие кровотечения во время родов.
2. Наличие выраженной гиперкоагуляции в послеродовом или послеоперационном периоде.
Технология использования метода
Заготовка аутоплазмы проводится беременным, в сроках 32-37 недель, методом прерывистого или аппаратного плазмафереза однократно или двукратно с перерывом в неделю в условиях кабинета переливания крови или отделения гравитационной хирургии крови лечебного учреждения. За проведение процедуры отвечает врач, работающий в данных подразделениях лечебного учреждения.
Обследование, необходимое для проведения аутоплазмодонорства:
1. ВИЧ - 1/ВИЧ2, RW, гепатит В, гепатит С;
2. Гемостазиограмма;
3. Группа крови, Rh - фактор;
4. Клинический анализ крови;
5. Общий белок крови.
Аутоплазмодонорство у беременных является эффективным методом кровесбережения при учете критериев заготовки и использования аутоплазмы на основе гемостазиологического мониторинга на всех этапах аутоплазмодонорства. Трансфузия аутоплазмы, заготовленной у беременных на фоне физиологической гиперкоагуляции, во время родоразрешения способствует минимизации кровопотери за счет корригирующего влияния на состояние системы гемостаза при проявлениях хронического ДВС - синдрома, нарушениях механизмов адаптации системы гемостаза перед родами, приводящихк снижению коагуляционной активности крови. Использование аутоплазмы позволяет в 2 раза снизить применение донорской плазмы, а в ряде случаев и полностью отказаться от ее использования.
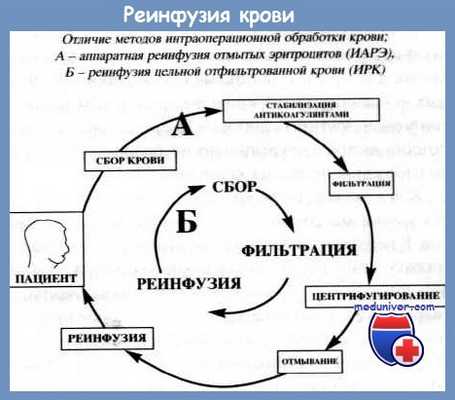
Интраоперационная реинфузия крови
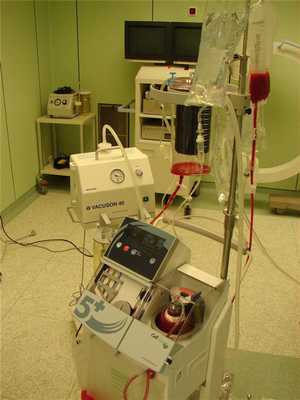
Реинфузия крови, теряемой во время операции, предполагает аспирацию такой крови из операционной раны или полостей тела стерильным отсосом в стерильную емкость с последующим отмыванием, а затем возврат реципиенту во время операции или в срок, не превышающий 6 часов после начала сбора. Применение интраоперационной реинфузии крови показано только при тех обстоятельствах, когда предполагаемая кровопотеря превышает 20% объема циркулирующей крови, что наблюдается в сердечно-сосудистой хирургии, при внематочной беременности, в ортопедии, в травматологии.
Противопоказана интраоперационная реинфузия крови при ее бактериальном загрязнении, попадании амниотической жидкости, при отсутствии возможности отмывания излившейся во время операции крови.
Излившаяся в полости тела кровь отличается по своему составу от циркулирующей крови. В ней снижено содержание тромбоцитов, фибриногена, 2,3-дифосфоглицерата, высок уровень свободного гемоглобина, имеются продукты деградации фибриногена. В какой-то степени эти недостатки нивелируются в процессе обязательного отмывания эритроцитов перед реинфузией.
Фильтрование излившейся крови через несколько слоев марли в настоящее время недопустимы. Созданы специальные приборы для проведения интраоперационного сбора и отмывания крови, теряемой во время операции.
Недостаток метода – высокая стоимость аппаратуры и расходных материалов. Возможен также гемолиз при нарушении техники, реинфузия частиц, более плотных, чем эритроциты (раковые клетки, микробные тела), развитие коагулопатии из-за потери плазменных элементов.

Обновлённый график приема граждан в комитете здравоохранения Волгоградской области председателем комитета здравоохранения Волгоградской области, первым заместителем председателя комитета здравоохранения Волгоградской области и заместителями председателя комитета здравоохранения Волгоградской области.
Поздравляем всех вас и принимаем поздравления с нашим профессиональным праздником - Днём медицинского работника!
01.06.2022 - 1 июня - Международный день защиты детей, приходящийся на первый день лета - один из самых старых международных праздников.
Реинфузия крови - показания, противопоказания, эффективность
Техника реинфузии аутокрови. Компоненты аутокрови
Если заготовка аутокрови как перед операцией, так и во время интраоперационной гемодилюиии практически не отличается от заготовки крови у доноров, то реинфузия аутокрови во время операции сопряжена с определенными трудностями. Ее необходимо эвакуировать из раны с наименьшей травматизацией, отфильтровать от сгустков, нитей фибрина и попавших в отсос кусочков тканей, а также принять меры по предупреждению ее свертывания.
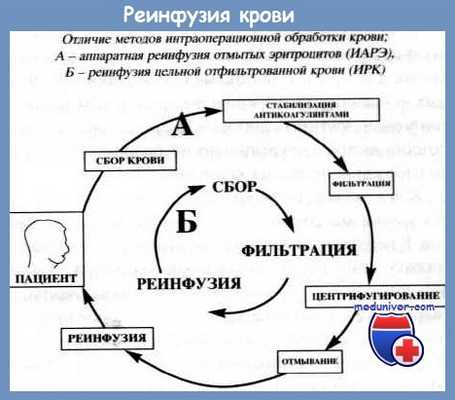
В основе метода реинфузии лежат ключевые принципы:
• сбор и стабилизация операционной крови;
• фильтрация;
• центрифугирование;
• отмывание.
При операциях с использованием искусственного кровообращения методика реинфузии дополнительно включает в себя сбор кардиоплегического раствора, когда реинфузор работает как гемоконцентратор, а также сбор «аппаратной» крови. На данных этапах стабилизация крови не производится из-за наличия в ней гепарина.
Для стабилизации крови чаще всего используют гемокон-сервант, применяемый при заготовке донорской крови: 4 %-ный раствор лимоннокислого натрия из расчета 10 мл на 100 мл крови; раствор «глюгицир» из расчета 100 мл на 500 мл крови; раствор ACD в соотношении 1:3; раствор гепарина из расчета 1000 ЕД на 500 мл крови. Гепарин вводится в физиологический раствор из расчета 5 мл на 1 л. Скорость подачи стабилизирующего раствора в реинфузируемую кровь 50—60 капель в минуту.
Отмывание аутокрови практически не отличается от методики приготовления отмытых эритроцитов из донорской крови. В зависимости от степени повреждения красной крови, ориентируясь на уровень свободного гемоглобина, который не должен превышать 2,5 г/л, определяется количество процедур отмывания — 1,2 или 3 раза, до получения бесцветной надосадочной жидкости.
При отмывании эритроцитов из реинфузата, содержащего кардиоплегический раствор, достаточна одна, реже две процедуры, в то время как при отмывании реинфузата, содержащего большое количество свободного гемоглобина, процедуру повторяют, как правило, трижды. Отмывание эритроцитов, собранных из магистралей аппарата ИК, проводят дважды, удаляя в основном содержащийся в ней гепарин.
В аппаратах «Cell-saver» отмывание производится в ротореколоколе автоматически при скорости вращения 5600 оборотов в минуту 1,0—1,5 л физиологического раствора. Применение «Cell-saver» оправданно при операциях, где прогнозируемая кровопотеря требует массивных, более 50 % ОЦК, гемотрансфузий.
Так же как и с донорской кровью, более целесообразно, как с медицинской, так и с экономической точки зрения, заготавливать вместо цельной консервированной аутокрови ее компоненты — (аутогенные) аутологичные гемокомпоненты: эритроцитную массу, свежезамороженную плазму, в отдельных случаях тромбоконцентрат. При адекватной медикаментозной подготовке пациента (препараты железа, витаминотерапия, эритропоэтин) за 2-3 недели до операции можно заготовить от 600-700 мл до 1500-1800 мл ауто СЗП, 400-500 мл эритроцитной массы.
По технике выполнения процедуры получение аутоэритроцитной массы у больных практически не отличается от метода получения эритроцитной массы у доноров крови. Этот компонент можно получить центрифугированием крови больного или методом автоматического гемафереза. Как правило, одновременно с аутоэритроцитной масой получают и аутоплазму свежезамороженную, а при необходимости — и ауторомбоцитный концентрат.
В ряде случаев из аутоэритроцитной массы получают аутоэритроцитную взвесь с физиологическим раствором или при дополнительной фильтрации — аутоэритроцитную взвесь с ресуспендирующим раствором, фильтрованную. Для иммуноскомпрометированных больных рекомендуется аутоэритроцитная масса, гамма-облученная или аутоэритроцитная взвесь с ресуспендирующим раствором, гамма-облученная.
Условия хранения те же, что и для консервированной донорской крови.
Гемотрансфузия аутоэритроцитной массы осуществляется в интра- или постоперационный периоды по показаниям.
Аутоплазма свежезамороженная из дозы крови
Аутоплазма является высокоэффективным корректором плазменно-коагуляционного гемостаза.
Получение аутоплазмы больного, последующее замораживание и хранение по своей технологии и процедурам выполнения практически не отличаются от получения донорской СЗП. В соответствии с ОК ККЧиК данная среда обозначена как аутоплазма свежезамороженная из дозы крови.
Аутоплазму у больных можно получить тремя способами:
• фракционированием цельной консервированной крови методом центрифугирования (аутоплазма свежезамороженная, полученная дискретным аферезом);
• на автоматических сепараторах (аутоплазма свежезамороженная, полученная автоматическим аферезом);
• методом пропускания консервированной крови через специальные мембраны (аутоплазма свежезамороженная, фильтрованная).
Применяют размороженную (аналогично донорской СЗП) аутоплазму в интра- и постоперационном периодах в целях коррекции плазменно-коагуляционного гемостаза.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Обратное переливание пострадавшему собственной крови, излившейся в результате ранения сосудов в серозные полости, возвращая собственные клеточные элементы и иммунные тела, является наиболее физиологичным методом восполнения кровопотери.
Преимущества реинфузии крови заключаются в следущем:
• аутокровь - абсолютно совместимая трансфузионная среда, готовая к немедленному использованию;
• нет необходимости определения групповой и индивидуальной совместимости;
• отсутствует риск реакций непереносимости и переноса вирусных заболеваний;
• эритроциты аутокрови циркулируют в сосудистом русле в 1,5-2 раза дольше донорских эритроцитов и сразу включаются в кровоток, в отличие от донорских эритроцитов, для которых характерно депонирование;
• использование реинфузии крови, являясь эффективным в клиническом плане, дает значительный экономический эффект.
В то же время для крови, собранной из серозных полостей, характерно полное отсутствие фибриногена на фоне высокой фибринолитической и тромбопластической активности, повышенное содержание свободного гемоглобина и ионов калия, что при реинфузии трех и более литров крови может повлиять на показатели гемостаза циркулирующей крови и на полноценность клубочковой фильтрации, особенно при нестабильной гемодинамике [Абакумов М.М. и др.].
В 1988 г. нашим сотрудником Н. В. Лебедевым была выполнена научная работа, в которой изучено влияние массивной реинфузии на систему гемостаза у пострадавших с травмой груди и живота. Было выяснено, что кровь, излившаяся в серозные полости при травме внутренних органов и находящаяся там в течение различного времени, претерпевает некоторые изменения. Исследованы образцы крови у 82 пострадавших с травмой груди и живота.
В этой крови было снижено количество эритроцитов до 3,9+0,77 х 10 12 /л, тромбоцитов до 181+42,4х10 9 /л, увеличено содержание свободного гемоглобина (1,7±0,5 г/л) за счет частичного разрушения форменных элементов. Обращало на себя внимание полное отсутствие фибриногена в излившейся в полость крови, а также повышение ее фибринолитической активности до 27,2±4,7 мин при травме груди и 54+10 мин при травме живота. Уровень плазминогена составлял 1,9±0,1 КЕ/мл, а содержание плазмина — 0,31±0,13 КЕ/мл.
Содержание ингибиторов протеолиза было несколько снижено и в среднем составляло 53,8+1,6 КЕ/мл.
Таким образом, кровь из брюшной полости не отличается от крови из грудной полости, за исключением величины фибринолитической активности плазмы.
Влияние массивной (более 1 л) реинфузии крови на состояние системы гемостаза циркулирующей крови изучено у 44 пострадавших с травмой груди и живота. Анализ системы гемостаза циркулирующей крови у пострадавших с внутриполостным кровотечением (до реинфузии) выявил выраженные гипокоагуляционные изменения. При этом временные показатели тромбоэластограммы (Р и К) были удлинены соответственно на 25% и в 1,5 раза, а максимальная амплитуда (МА) снижена на 20-25%. Содержание фибриногена находилось на уровне нижней границы нормы, а время рекальцификации плазмы было удлинено на 30-35% (составляя в среднем 175+21,5 с при травме живота и 210+21,0 с при травме груди).
Фибринолитическая активность крови была повышена на 11-22% по сравнению со средним уровнем, но не выходила за пределы физиологической нормы. При этом более выраженная активация фибринолиза отмечена в группе больных с ранениями груди, а гипокоагуляционные изменения в большей степени выражены у пострадавших с ранениями живота.
У больных до реинфузии отмечено повышение протеолитической активности циркулирующей крови, что, вероятно, связано с поступлением в кровоток протеолитических ферментов из поврежденных тканей. В то же время антипротеиназный потенциал, который оценивался по содержанию основных ингибиторов протеолиза а1-АТ и а2-МГ, был выше нормы на 25-150%. Количество тромбоцитов в этот период было снижено незначительно -до (220-235)х109/л (при норме (250-350) х109 л).
Реинфузия оказывала влияние и на тромбоцитарное звено гемостаза: количество тромбоцитов в венозной крови снижалось до (140-180)х10 9 /л, а их агрегационная способность уменьшалась в 1,5 раза по сравнению с нормой.
Состояние выраженной гипокоагуляции сохранялось после реинфузии в течение суток. Однако уже начиная со вторых суток наблюдалась тенденция к нормализации показателей плазменного звена системы гемостаза циркулирующей крови. Так, к концу первых суток после операции и реинфузии уровень фибриногена достигал своих физиологических параметров, время рекальцификации плазмы снижалось до 218+24 с, сокращались временные показатели R и К тромбоэластограммы, максимальная амплитуда удлинялась до 21±2,9 мм при ранениях живота и до 35,9+2,0 мм при ранениях груди. Содержание плазминогена оставалось к концу суток сниженным до 2,55+0,24 КЕ/мл при ранениях живота и 2,97+0,34 КЕ/мл при ранениях груди.
Данные тромбоэластограммы свидетельствовали о нормализации коагуляционных свойств крови. Количество и агрегационная способность тромбоцитов к концу наблюдений были в пределах нормы. У обследованных пострадавших не было отмечено клинического проявления ДВС-синдрома в виде различного вида геморрагии или тромботических осложнений.
Таким образом, данные, полученные при исследовании системы гемостаза у пострадавших с ранениями органов грудной и брюшной полостей, позволяют утверждать, что непосредственное влияние реинфузии на состояние гемостаза сказывается только в первые сутки. В последующем развиваются такие изменения в системе гемостаза, которые в целом характерны для патологических состояний, протекающих с воспалительными реакциями. Реинфузия крови на фоне гипокоагуляции не приводит к устойчивым патологическим сдвигам в системе гемостаза, которые требовали бы специфической коррекции.

В настоящее время во всех странах признана высокая эффективность такого метода восполнения кровопотери. Наибольшее распространение получила реинфузия аппаратом Cell Saver. Следует заметить, что еще в 1986 г. Н. В. Лебедевым совместно с инженером Всесоюзного Научно-исследовательского института медицинского приборостроения И. Н. Швырковым был создан и применен в клинической практике у 42 пострадавших с ранениями груди первый в СССР аппарат для реинфузии крови АРПК-1. Однако в силу исторических событий немедицинского характера этот аппарат после демонстрации на ВДНХ был благополучно забыт. (Стоимость аппарата Cell Saver в ценах 2010 г. колеблется от 30 до 50 тыс. евро.)
При использовании аппарата Cell Saver кровь, удаленная из серозной полости, попадает в систему центрифуг, позволяющую отделять эритроциты от плазмы и их промывать. Кровь пропускается сначала через макрофильтр с величиной пор 180-200 мкм, а затем через микрофильтр с величиной пор 20-40 мкм. Отмытые эритроциты, взвешенные в изотоническом растворе хлорида натрия, насосом перекачиваются в емкость для реинфузии. Использование аппаратов Cell Saver позволяет быстро осуществить забор крови из серозных полостей, в течение 5-10 мин ее обработать и начать реинфузию клеточного компонента.
Технология этого процесса сводится к сбору крови в стерильную емкость через фильтры, ее стабилизации, аппаратной фрагментации на компоненты (плазму и клетки), отмыванию клеток, повторную фрагментацию и концентрацию клеточного компонента.
Сбор крови осуществляет хирург с помощью двухпросветной трубки, на наконечник которой по микроканалу со скоростью 40-60 капель в минуту подается раствор антикоагулянта и по основному каналу с разрежением 100-150 мм рт. ст. кровь поступает в стерильный резервуар. В качестве стабилизатора обычно используют стандартный раствор цитрата натрия (АСД) в соотношении 15 мл цитрата на 100 мл крови.
Собранная кровь поступает в сепаратор, где центрифужным методом отделяется основная часть плазменной фракции, а оставшаяся клеточная часть крови разбавляется изотоническим раствором хлорида натрия, что обеспечивает более полное отмывание неизмененных клеток от их фрагментов и оставшейся части плазмы. Оставшийся клеточный компонент представляет собой концентрат клеток в изотоническом растворе, в котором практически нет плазмы (с концентрацией общего белка не более 1,7 г/л). Уровень гематокрита в этом клеточном концентрате составляет около 70 %, уровень гемоглобина — около 200 г/л.
Удаляя 97-98 % белков плазмы, методика Cell Saver обеспечивает освобождение клеточного компонента крови от активаторов плазминогена, плазмина, продуктов распада фибрина и других биологически активных веществ, влияющих на систему гемостаза. Отсутствие фибринолитической активности в компонентах крови, возвращаемых пациенту, позволяет избежать таких нежелательных последствий, как развитие ДВС-синдрома в случаях реинфузии объемов крови, превышающих ОЦК.
В то же время применение аппаратной реинфузии крови сопряжено с рядом трудностей. Во-первых, метод требует полноценного замещения плазменных компонентов путем инфузии не только и не сколько кристаллоидных и коллоидных растворов, сколько больших объемов свежезамороженной плазмы.
Во-вторых, при наличии в серозных полостях большого количества сгустков крови объем забора жидкой крови резко уменьшается, и в таких случаях глобулярный объем приходится восполнять переливанием донорской крови.

При продолжающемся массивном кровотечении может наступить тромбирование всех стерильных магистралей аппарата Cell Saver, что требует их срочной замены.
Резкое уменьшение объема возвращаемого клеточного компонента (по сравнению с объемом забранной крови) наблюдается при попытке подвергнуть реинфузии гемолизированную «старую» кровь. В таких случаях в процессе сепарации удаляются все неполноценные и фрагментированные эритроциты и возвращается не более 20-25 % клеточного компонента.
Наконец, и при аппаратной реинфузии существует проблема микробной контаминации. При ранениях полых органов брюшной полости (в меньшей степени — бронхов) и при массивной кровопотере (более 3,5 л) появляются жизненные показания для реинфузии, например, у пострадавших с редкой группой крови или при отсутствии донорской крови (эритромассы). Как показал опыт НИИ СП им. И. В. Склифосовского, в таких случаях многократное отмывание контаминированной крови позволяет в 10-12 раз снизить уровень контаминации микроорганизмов в клеточном компоненте, реинфузия которого не приводит к бактериемии [Кобзева Е. Н.]. С целью профилактики гнойно-септических осложнений этим пациентам проводится антибактериальная и иммунная терапия.
Таким образом, эффективность аппаратной реинфузии крови при ранениях шеи, груди, живота, и тем более при сочетанных ранениях,— несомненна. Но этот метод достаточно дорог. Кроме того, его широкое применение требует создания специальной трасфузиологической службы, введение в состав дежурной бригады специалиста — трансфузиолога. Поэтому во многих стационарах страны реинфузия осуществляется без аппаратов.
Обычно кровь собирают из полостей специальным черпаком в стерильный сосуд емкостью 1000 мл, содержащий 150 мл 4% раствора натрия цитрата (из расчета 15 мл стабилизирующего раствора на 100 мл крови). После стабилизации кровь переливается во флакон для внутривенной инфузии через самодельный фильтр (8 слоев марли). Однако такая методика несовершенна: эвакуация крови происходит слишком медленно, что затрудняет поиск источника кровотечения, открытое переливание из черпака во флакон и из флакона с консервантом в резервуар для реинфузии увеличивает опасность загрязнения крови.
Поэтому большинство хирургов используют закрытые аспирационные системы. Самая простая система состоит в следующем. Пробку стерильного флакона емкостью 500 мл, содержащего 75 мл 4 % раствора цитрата натрия, обрабатывают антисептическим раствором и прокалывают двумя иглами для гемотрансфузии: к длинной игле, конец которой опускают до дна флакона, присоединяют трубку с наконечником, обернутым в несколько слоев марли и забирающим кровь из серозной полости, а к короткой игле — шланг от электроотсоса. После наполнения флакона его переворачивают пробкой вниз и устанавливают в штатив для переливания крови.
Для предотвращения разрушения эритроцитов величина разрежения не должна превышать 100-140 мл рт. ст. Трубка, соединяющая наконечник отсоса с флаконом, должна быть из силиконизированной резины и должна быть цельной, без отдельных отрезков с переходниками, что увеличивает турбулентность крови и ее повреждение в ходе аспирации.
При массивной реинфузии (более 1,5-2 л) для нейтрализации гипокоагуляционного эффекта рекомендуется одновременно вводить фибриноген, раствор аминокапроновой кислоты. Для предупреждения нежелательного побочного действия больших доз цитрата натрия при реинфузии каждых 500 мл аутокрови внутривенно следует вводить 10% раствор хлорида или глюконата кальция.
Показанием к реинфузии является наличие 500 мл и более жидкой крови в плевральных или брюшной полостях. Постоянная готовность дежурных бригад к проведению реинфузии позволяет использовать ее у каждого пострадавшего с кровотечением.
Абсолютных противопоказаний для реинфузии крови в неотложной хирургии практически нет. Считается, что реинфузия противопоказана при повреждении полых органов брюшной полости или крупных бронхов, при длительном (свыше суток) нахождении крови в серозной полости и при выраженном гемолизе.
1. Ранения полых органов. Ясно, что при умеренной кровопотере и стабильном состоянии пострадавшего реинфузия контаминированной крови абсолютно противопоказана. Она противопоказана и при массивной кровопотере, если в наличии имеется достаточное количество компонентов донорской крови. Но как поступить при кровопотере 3-4 л и недостатке донорской крови или отсутствии крови подходящей группы?
К настоящему времени в литературе опубликованы около 400 наблюдений реинфузии контаминированной крови. Все эти наблюдения можно разделить на непреднамеренные и преднамеренные.
Реинфузия контаминированной крови является непреднамеренной, когда хирург собрал большое количество крови и принял решение о начале реинфузии еще до завершения тщательной ревизии органов. Как правило, это происходит в условиях дефицита донорской крови и критическом состоянии пострадавшего. К моменту, когда обнаруживается повреждение полого органа брюшной полости, реинфузии может подвергнуться 1000 мл крови.
На преднамеренную реинфузию хирурги шли в безвыходной ситуации, когда пациент практически погибал, а донорской крови не было в достаточном количестве (или не было вообще).
По данным отечественных и зарубежных авторов — Е. А. Вагнера и соавт.; С.Д.Попова и соавт.; И.И.Дерябина и соавт.; R.N. Smith и соавт.; J.W. Hauer и соавт., во всех этих наблюдениях имелась быстро проходящая бактериемия, которая исчезала под влиянием антибактериальной терапии в течение 3-5 дней. Ни в одном наблюдении у выживших пациентов не развился сепсис. Но при этом многие авторы предостерегают об опасности развития смертельного эндотоксического шока в случае добавления антибиотиков непосредственно в емкость с контаминированной кровью.
В НИИ СП им. Н. В. Склифосовского реинфузия крови при повреждении органов желудочно-кишечного тракта произведена 22 пострадавшим. У пяти пострадавших реинфузия производилась до ревизии органов брюшной полости и выявления повреждения кишечника, у 17 — в связи с тяжелым или терминальным состоянием пострадавшего, вызванным шоком и крово-потерей и недостаточным количеством донорской крови.
Общий объем перелитой аутокрови при ранении органов желудочно-кишечного тракта составил 21 050 мл (в среднем 1 л крови на пострадавшего). Ни в одном случае летальные исходы и осложнения не были связаны с проведением реинфузии крови.
Проведенный клинический анализ позволил нам сделать вывод, что при большой кровопотере, угрожающей летальным исходом, и при отсутствии достаточного количества донорской крови можно пренебречь наличием повреждения полых органов и произвести реинфузию. В подобных случаях обратное переливание излившейся в полости крови может сыграть решающую роль в спасении жизни пострадавшего.
2. Длительная экспозиция крови в серозных полостях. В настоящее время нет оснований полагать, что кровь, находившаяся в плевральной или брюшной полости без повреждения полых органов в течение 24 ч, непригодна для реинфузии. Кровь остается стерильной в течение 2-3 сут, а уровень свободного гемоглобина не превышает 500 мг% (310 мкмоль/л). По жизненным показаниям реинфузию следует применять и через 48 ч: наш опыт показал, что такая кровь остается стерильной, а концентрация свободного гемоглобина не достигает 200 мг% (124 мкмоль/л). Разумеется, чем дольше кровь находится вне сосудистого русла, тем меньше ее биологическая ценность; в ней уменьшается количество эритроцитов и тромбоцитов и увеличивается степень гемолиза.
3. Гемолиз. Патологическое действие гемолиза зависит от степени его выраженности во всем объеме циркулирующей крови, т.е. от концентрации свободного гемоглобина в реинфузируемой крови и от объема реинфузии.
Например, при реинфузии 2 л крови с содержанием свободного гемоглобина 800 мг% (596 мкмоль/л) его концентрация в циркулирующей крови пациента в первые часы достигнет уровня всего 30-40 мг% (18,6-24,8 мкмоль/л). Через сутки концентрация свободного гемоглобина в циркулирующей крови, независимо от степени его повышения сразу после реинфузии, не отличается от физиологической нормы.
Появление интенсивного розового окрашивания плазмы после центрифузирования крови означает, что уровень свободного гемоглобина более 800 мг%, что служит относительным противопоказанием для реинфузии более 2 л такой крови.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Восполнение кровопотери при множественных и сочетанных ранениях груди
Специалист в хирургии повреждений, владеющий техникой операций на органах шеи, груди и живота, должен:
1) быстро выявить все повреждения;
2) определить повреждение, превалирующее по тяжести и опасности для жизни пострадавшего;
3) применить оптимальный доступ и минимальный объем вмешательства, цель которого состоит в обеспечении гемостаза и прекращении инфицирования.
На протяжении всей истории хирургии остановка кровотечения была главной и первейшей задачей. В руководстве по оперативной хирургии, изданном в 1840 г., X. Соломон писал: «Во всякой ране особенного внимания достойно кровотечение, которое должно стараться остановить, когда оно бывает стремительное. Не должно приступать к какой-либо операции, не обдумавши наперед, каким образом остановить кровотечение, могущее при ней встретиться: оно первое при операциях и ранениях составляет самую большую опасность».
Следует помнить, что при нестабильной гемодинамике, когда для спасения жизни пациента необходимо быстрое завершение операции, возрастает опасность просмотренных повреждений. В таких случаях хирург должен быть готов к повторному вмешательству, как только удастся стабилизировать гемодинамику.
Восполнение кровопотери
Как известно, с целью быстрого восполнения дефицита ОЦК анестезиолог начинает инфузионную терапию с введения больших объемов (до 200 мл/ мин) плазмозамещающих растворов. В критическом состоянии пострадавшего единственной задачей хирурга является быстрейшая временная остановка кровотечения. По достижении этой цели операция по согласованию с анестезиологом может быть приостановлена до стабилизации гемодинамики. В арсенале анестезиолога имеется ряд эффективных инфузионных сред и прежде всего компоненты донорской крови.
Интраоперационная компенсация острой кровопотери после достижения гемостаза хирургическим методом является одним из условий сохранения жизни пострадавшего. Исследования ученых показали, а клинический опыт подтвердил, что лечение надо начинать с введения в организм коллоидных кровезаменителей гемодинамического действия с большим молекулярным весом, таких как инфузол, альбумин, желатиноль.
Их введение восстанавливает объем циркулирующей крови и показатели центральной гемодинамики, что приводит к ликвидации циркуляторной гипоксии, первопричиной которой является гиповолемия. Кроме того, повышение коллоидно-осмотического давления в сосудистом русле привлекает в его просвет большое количество межтканевой жидкости, разгружая ткани от избытка воды, солей и мелкодисперсного белка и предупреждая развитие отека легких.
В то же время при ранениях крупных сосудов инфузия больших объемов представляет собой определенную опасность. Закрывающий дефект стенки сосуда сверток крови при повышении давления может оторваться и временно остановившееся кровотечение может возобновиться. Поэтому при подозрении на ранение магистрального сосуда тактика реаниматолога-анестезиолога должна быть такой же, что и при разрывах аневризмы аорты: максимальное артериальное давление не поднимать выше 100-110 мм рт. ст.
Однако компенсация дефицита объема циркулирующей крови плазмозаменителями приводит в то же время к гемодилюции, так как число переносчиков кислорода (эритроцитов) остается по-прежнему малым. Если при этом увлечься введением больших объемов плазмозамещающих растворов, это приведет к увеличению нагрузки на сердечно-сосудистую систему, нарушению функционального состояния миокарда из-за недостатка его кислородного снабжения и к сердечной недостаточности.
Кроме того, гемодилюция может привести к коагулопатии потребления из-за гипокоагуляции вследствие разведения концентрации свертывающих факторов, а также к гипопротеинемии. Следовательно, одновременно с крупномолекулярными коллоидными растворами необходимо ввести в организм эритроциты.
С точки зрения сегодняшнего дня, переливание крови от одного человека к другому является трансплантацией биологической ткани, проблемы которой не до конца решены, а некоторые возникли совершенно неожиданно (перенос вирусов гепатита, СПИДа, сифилиса). В то же время этот раздел медицины насчитывает многовековую историю.
Смерть от массивного истечения крови в результате ранения во время сражения или на охоте в самой глубокой древности создали представление о крови, как о вместилище души и жизненной силы.
Медея пыталась возвратить молодость старому отцу — царю Язону, выпустив из его тела старую кровь, а затем влив свежую от юноши.
Плиний описывает существовавший в Древнем Риме обычай пить кровь погибших на арене гладиаторов, чтобы предупредить «падучую болезнь». Отсюда берет начало мифология «вампиризма», столь распространеная в Средневековье и в эпоху Возрождения.
В XV веке одряхлевший папа Иннокентий VIII лечился кровью, взятой от нескольких мальчиков, эликсир не помог, папа умер, осужденный на сожжение на костре врач сбежал.
В 1538 г. Вильям Гарвей опубликовал свой труд «Анатомические исследования над движением сердца и крови». Примерно через 100 лет студенты Оксфордского университета Кларк и Бойль вводили в вену осужденным на смерть преступникам молочную сыворотку, цельное молоко и даже пиво, но не добились какого-либо эффекта. Однако в 1665 г. Кокс в эксперименте путем обескровливания доводил животных до агонии, а затем возвращал их к жизни путем переливания крови.
Через 2 года, в 1667 г. во Франции профессор математики, философии и медицины Дэни перелил 9 унций крови ягненка юноше 16 лет, ослабевшему от «лечебных» кровопусканий, больной выздоровел. Однако дальнейшие попытки Дэни и других исследователей переливать человеку кровь животных заканчивались плачевно, и в 1675 г. появился запретительный эдикт Ватикана, прекративший эти попытки более чем на столетие.
Тем не менее ученые по-прежнему верили в целесообразность переливания крови, но от человека к человеку. Один из таких энтузиастов писал: «Людовику XIII за десять месяцев болезни сделали 47 кровопусканий, 215 раз давали слабительные и произвели 210 очистительных клизм вместо того, чтобы сделать ему только одно переливание крови от здорового человека, которое его спасло бы».
Первое в мире переливание крови от человека к человеку было произведено в 1819 г. в Англии. В 1832 г. в Санкт-Петербурге доктор Вольф перелил кровь женщине, умиравшей от кровотечения после родов. Женщина выздоровела.
Переливание крови периодически применялось на всем протяжении XIX в., особенно во время войн. Но эта операция часто давала серьезные осложнения, вплоть до смерти. Положение коренным образом изменилось в начале XX в., когда были открыты группы крови, а также свойства цитрата натрия предотвращать свертывание крови, полученной от донора.
Мы не будем углубляться в современную технологию гемотрансфузии, так как это слишком специальный вопрос. Отметим лишь еще раз, что в устранении последствий острой кровопотери переливание клеточных компонентов (эритроцитов) имеет решающее значение.
Общеизвестна тяжело и плохо решаемая современная проблема трансмиссивных инфекций — гепатита, ВИЧ, сифилиса. Поэтому кровь доноров подвергают карантину, повторным исследованиям, фракционируют: эритроциты, тромбоциты, лейкоциты, плазма.
Переливание только эритроцитов резко повышает вязкость циркулирующей крови пациента, поэтому эритроцитную массу переливают вместе с электролитным сбалансированным раствором (Дэрроу, Рингера) в отношении 1:1. Солевые растворы положительно влияют на реологию и нормализуют вязкость крови.
Для профилактики гипокоагуляционного эффекта от введения коллоидных растворов необходимо восполнять плазменные факторы свертываемости, для чего переливают не менее 1 л свежезамороженной плазмы человека (предварительно ее оттаивают и нагревают до 37 °С).
Тромбоцитопения (менее 100 тыс/мм3) является показанием к переливанию тромбоцитной массы. При кровопотере свыше 2 л некоторые авторы рекомендуют внутривенное введение антибиотиков во время операции. Решение о продолжении антибактериальной терапии в послеоперационном периоде в таких случаях принимается в зависимости от находок на операции и наличия сопутствующих повреждений.
Для компенсации гипопротеииемии в сосудистое русло пострадавшего добавляют либо сухую или нативную плазму, либо такие препараты, изготовленные из плазмы доноров, как 20% раствор альбумина или 4,8% протеина (от 100 до 300 мл). На каждый литр донорской крови необходимо вводить внутривенно 10 мг хлорида кальция.
Следует подчеркнуть, что при переливании большого объема донорской крови может развиться угрожающая гипотермия, поэтому в задачу анестезиолога входит обеспечение согревания пострадавшего, находящегося в критическом состоянии.
Применение компонентов консервированной донорской крови связано с трудностями, обусловленными ее недостатком, необходимостью индивидуального подбора, возможностью переноса ряда вирусных заболеваний. Переливание цельной крови в настоящее время используется крайне редко. Это обусловлено внедрением в службу крови современных технологий заготовки клеточных компонентов. Действующие в настоящее время нормативные документы, в значительной мере отражающие интересы банков крови во всем мире, предписывают использование только разделенных компонентов.
Однако в критической ситуации переливание свежестабилизированной цельной крови может спасти жизнь пострадавшему с коагулопатиеи. Примером может служить публикация S. M. Grosso и J. О. Vecman с красноречивым названием «Переливание цельной крови при обескровливающей коагулопатии в полевом хирургическом госпитале США в послевоенном Косово». После переливания больших объемов эритроцитной массы и свежезамороженной плазмы у пострадавшего возникла прогрессирующая коагулопатия. В связи с отсутствием тромбоцитной массы пациенту была перелита цельная кровь, что позволило купировать коагулопатию и стабилизировать гемодинамику.
Гемотрансфузия представляет собой один из видов аллогенной трансплантации ткани, при которой возможно развитие иммунного конфликта. В результате консервации и хранения компоненты крови теряют биологическую ценность из-за разрушения форменных элементов, повышения содержания калия, снижения рН, изменения ферментативной активности и кислород-транспортной функции. Массивная трансфузия компонентов крови от разных доноров приводит к тяжелой почечной недостаточности, острому респираторному дистресс-синдрому, системным нарушениям микроциркуляции. Кроме того, возможно переливание компонентов, несовместных по резус-фактору, kill-антигену.
Наиболее безопасным и эффективным методом восполнения кровопотери при ранениях шеи, груди и живота является интраоперационная реинфузия крови. С нашей точки зрения, использование реинфузии крови или отказ от нее относится к проблемам хирургической тактики, поскольку речь идет о интраоперациоиных действиях хирургической бригады и решение о начале реинфузии, ее проведении остается за хирургом.
ФГБНУ "Российский научный центр хирургии им. акад. Б.В. Петровского", Москва
Отдел хирургии пороков сердца Российского научного центра хирургии им. акад. Б.В. Петровского, Москва, Россия
Оптимизация трансфузиологического обеспечения многопрофильной хирургической клиники
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(1): 55‑60
Качество трансфузиологического обеспечения имеет клиническую и экономическую составляющую, влияет на результаты хирургического лечения. Цель настоящего исследования - определение оптимального варианта обеспечения клиники гемокомпонентами, а также снижения расхода донорской крови за счет использования комплекса кровесберегающих технологий. Материал и методы. Анализировали показатели расхода донорских гемокомпонентов, объем аутогемотрансфузий и их соотношение в 2012-2014 гг. Результаты. За 2 года наблюдения число реципиентов эритровзвеси сократилось на 18,5%, свежезамороженной плазмы - на 25%, тромбоконцентрата - на 80%. Потребление донорской плазмы снизилось на 35%. Расход аутологичной плазмы в кардиохирургии составил 76% общего объема. Внедрена предоперационная заготовка аутоплазмы у пациентов с аневризмой аорты. Число кардиохирургических операций, выполненных без донорской крови, возросло на 7-31% в зависимости от сложности вмешательства.
Высокотехнологичные виды хирургической деятельности невозможны без адекватного обеспечения компонентами и препаратами крови, кровезаменителями, а также необходимым спектром лечебных экстракорпоральных методов гемокоррекции и трансфузиологическими кровесберегающими технологиями. Суммарно все эти виды деятельности объединяются понятием "трансфузиологическое обеспечение" (ТО). Самое уязвимое звено этой цепи - снабжение клиники качественными компонентами донорской крови. Проблемы организации ТО лечебных учреждений обсуждают крайне мало. Между тем в этой сфере больше нерешенных вопросов, чем решенных [1, 3, 18, 19, 21,22, 28]. Качество отечественных гемокомпонентов не всегда соответствует международным стандартам и удовлетворяет потребностям клиники [2].
Расход компонентов крови является одним из показателей деятельности хирургического лечебного учреждения, так как свидетельствует о соблюдении трансфузиологических правил, сложившихся на основании передового отечественного и зарубежного опыта и действующего законодательства РФ об адекватности использования кровесберегающих технологий и о количестве и тяжести периоперационных и ранних послеоперационных осложнений. Снижение расхода препаратов крови является общей проблемой [21, 22], так как увеличение объема гемотрансфузий приводит к лишним экономическим затратам, к сбою поставок, переносу плановых операций, увеличению риска посттрансфузионных осложнений, получению части крови сомнительного качества от сомнительных поставщиков [22].
Основные требования, предъявляемые к гемотрансфузионной терапии - высокое качество гемокомпонентов, рациональность их использования, клиническая эффективность и максимальная безопасность проводимой терапии, экономическая доступность .
Проблема качества гемокомпонентов решается на этапе их заготовки, переработки, транспортировки и хранения. В зарубежных странах заготовкой донорской, а иногда и аутологичной крови заняты крупные организации - банки крови [6, 17]. Обеспечение лечебных учреждений США компонентами донорской крови осуществляют 140 банков крови, в Японии - 29. Обеспечение компонентами крови в России осуществляется следующим образом.
1. Отделение переливания крови (ОПК) лечебного учреждения осуществляет заготовку крови, ее обработку, хранение и распределение.
2. Обеспечение компонентами крови, произведенными на станции переливания крови (СПК); эти обязанности выполняют сотрудники кабинета переливания крови или отделения клинической трансфузиологии.
3. Сочетанное использование возможностей собственного ОПК и СПК.
Практика здравоохранения показывает, что содержание ОПК для лечебных учреждений по ряду показателей является нерентабельным и соответственно нецелесообразным. Мало того, современная тенденция службы крови предусматривает слияние маломощных СПК в крупные центры крови [5].
Цель настоящего исследования - определение оптимального варианта обеспечения клиники гемокомпонентами, а также снижение расхода донорской крови за счет комплекса кровесберегающих технологий.
В 2013-2014 гг. в РНЦХ им акад. Б.В. Петровского был принят ряд организационных, методических и клинических мер, направленных на реализацию плана "бескровной хирургии".
- Изменение порядка обеспечения лечебного учреждения гемокомпонентами. С начала 2013 г. РНЦХ снабжается гемокомпонентами, производимыми крупными СПК Москвы и Поволжья. В результате реконструкции Центра в начале февраля 2013 г. была создана Лаборатория трансфузиологии с экспедицией, выполняющая все функции по ТО клиники. В штате лаборатории 10 специалистов. Существовавшее ранее отделение трансфузиологии имело штат из 46 сотрудников, 37 из которых были заняты заготовкой и освидетельствованием донорской крови.
- Внедрение кровесберегающей идеологии; ограничение трансфузий компонентов крови показателями, соответствующими законодательным стандартам МЗ РФ и рекомендациям Международных съездов трансфузиологов [6, 8, 13, 17, 23, 24, 29].
- Более широкое и жесткое внедрение комплекса кровосберегающих технологий, в том числе трансфузиологических, преимущественно в кардиохирургии.
Результаты и обсуждение
Современные принципы службы крови предусматривают максимально возможную стандартизацию гемокомпонентов с целью повышения качества трансфузионной терапии и снижения числа изоиммунных и инфекционных гемотрансфузионных осложнений. Они могут быть реализованы только в условиях крупных специализированных СПК, эквивалентных по мощности зарубежным банкам крови. Технический регламент производства гемокомпонентов в России предусматривает [7, 9, 11]:
- фенотипирование аллоэритроцитов по эритроцитарным антигенам А, В, Д, С, с, Е, е, К, к, Сʷ;
- лейкоредукцию эритроцитсодержащих гемокомпонентов и тромбоконцентрата (ТК);
- автоматизированное получение свежезамороженной плазмы (СЗП) и ТК;
- соблюдение оптимальных сроков обследования на маркеры гемотрансмиссивных инфекций (не ранее 18 ч после кроводачи);
- карантинизацию донорской плазмы.
Можно предполагать, что следующим шагом станет обязательная вирусинактивация всех производимых донорских гемокомпонентов.
Современную СПК следует рассматривать как высокоточное производство, работающее с биологическим сырьем. Требования к продукции такого производства весьма высоки. Так, в США производство компонентов крови регулируется аналогично производству медикаментов и биологических продуктов, правила организации производства были законодательно утверждены еще в 70-е годы прошлого столетия [17]. Любая СПК располагает постоянным штатом доноров [20]. Соблюдение правил организации производства, контроль состояния здоровья доноров, контроль качества производимой продукции позволяют обеспечить высокое качество гемокомпонентов.
Единственная проблема, возникающая при обеспечении лечебного учреждения гемокомпонентами, производимыми СПК, - отсутствие шаговой доступности. При удаленном расположении СПК в лечебном учреждении формируется нормативный вынужденный запас гемокомпонентов [10], что неизбежно приводит к частичному списанию эритровзвеси. Отечественные данные свидетельствуют о вероятности списания до 20% запаса эритровзвеси [3], образцовые американские клиники списывают около 2% [4].
Двухлетний опыт РНЦХ свидетельствует об однозначной зависимости объема списания эритроцитарных гемокомпонентов от удаленности поставщика. Так, в 2013 г. при получении крови из московского региона было списано всего 3% затребованной эритровзвеси, в 2014 г. при получении гемокомпонентов из Поволжья - 7,5%. При этом финансовые затраты на компоненты крови не изменились.
Кардиоанестезиологи и кардиореаниматологи обосновали некоторые коррективы при определении показаний к трансфузиям гемокомпонентов.
В кардиохирургии, особенно в раннем послеоперационном периоде, показанием к гемотрансфузии считали уровень гемоглобина менее 90 г/л и гематокрита менее 27%, что связано с низким сердечным выбросом у оперированных больных и соответственно с низкими компенсаторными возможностями при послеоперационной анемии. Целевым уровнем гемоглобина при этом является 100-105 г/л, гематокрита - 33-35% [19].
Были определены показания к трансфузии ТК в кардиохирургии: содержание тромбоцитов перед операцией менее 100·109/л; повторные операции на сердце, аневризмы аорты на фоне соединительнотканной дисплазии. Прием плавикса (клопидогреля) в предоперационном периоде может быть показанием к назначению ТК только в том случае, если антиагрегантная терапия продолжалась до дня операции.
Трансфузиологические кровесберегающие технологии (предоперационная заготовка аутогемокомпонентов, острая управляемая нормоволемическая гемодилюция, интра- и послеоперационная реинфузия эритроцитов, отмытых из раневого содержимого) в полной мере представлены при выполнении операций на сердце и аорте [12, 14, 22, 25-27, 30]. Единая методическая и правовая база аутодонорства в России, как и во всем мире, отсутствует [17], поэтому каждое лечебное учреждение составляет программу трансфузиологического кровесбережения самостоятельно. В РНЦХ на протяжении 20 лет последовательно разрабатывали программы интраоперационного кровесбережения [12, 18, 19], а также предоперационного аутоплазмодонорства в кардиохирургии [15].
Сердечная хирургия в силу ее особенностей является той областью, где нужно и можно заготавливать собственную плазму пациентов. Внедренная в РНЦХ программа аутоплазмодонорства [15, 16] предусматривает безопасность сдачи и получения полноценной гемотрансфузионной среды. Заготовка двух доз плазмы осуществляется за 2-5 сут до операции методом дискретного центрифужного плазмафереза с замещением удаленного объема коллоидом последнего поколения (гелофузин, волювен) и кристаллоидом в соотношении 2:1. Принципиальными противопоказаниями к заготовке плазмы являются острое инфекционное заболевание, например инфекционный эндокардит, явные и потенциальные источники кровотечения. Гемостатический потенциал аутологичной плазмы, заготовленной у пациентов с заболеваниями сердца, выше, чем в плазме, полученной у здоровых доноров [16].
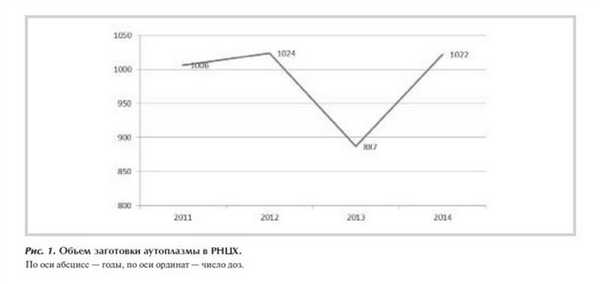
Объем заготовки аутоплазмы за последние 4 года (рис. 1 ) был довольно стабильным с небольшим спадом в 2013 г. вследствие снижения количества операций. В 2014 г. аутоплазма была заготовлена у 515 больных, из которых 265 страдали ИБС, 198 - пороками сердца.
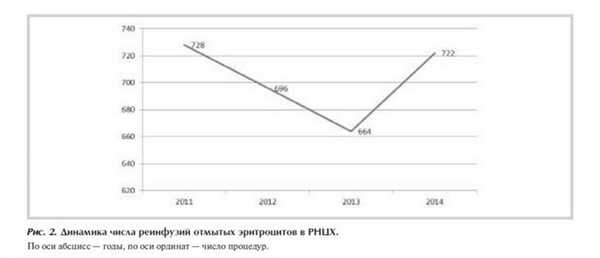
Количество процедур реинфузии аутоэритроцитов, отмытых во время и после операции, показано на рис. 2 . Из общего числа процедур в среднем 2-5% были осуществлены в отделениях общей хирургии. В 15% наблюдений выполняли послеоперационную реинфузию эритроцитов, отмытых из крови, поступившей по дренажам.
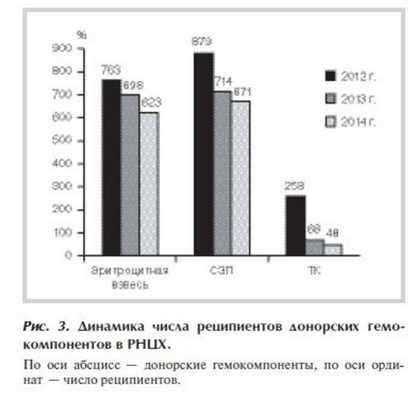
Вследствие активизации всех кровесберегающих методик число реципиентов гемокомпонентов закономерно снизилось (рис. 3 ). Количество реципиентов эритроцитсодержащих сред сократилось за первый год наблюдения на 8,5%, за второй еще на 10%; число реципиентов СЗП снизилось соответственно на 19 и на 6%.
Число реципиентов ТК сократилось в 2013 г. на 74%, в 2014 г. на 29% относительно показателя 2013 г. Такую динамику можно объяснить изменением качества продукта - первое снижение, а также использованием ТК строго по показаниям - второе. В 2014 г. было перелито всего 50 доз ТК 48 реципиентам.
Расход гемокомпонентов был соотнесен с количеством операций, выполненных с использованием высоких медицинских технологий: в 2012 г. этот показатель составил 2691, в 2013 г. - 1899, в 2014 г. - 2235. Расход эритровзвеси на одну операцию (рис. 4) изменялся незначительно: максимальное снижение на 14% отмечено в 2014 г. Расход СЗП в 2013 г. составил 70% показателя 2012 г., в 2014 г. - 65%. Снижение потребления донорской плазмы на 30-35% является позитивным изменением в деятельности хирургического стационара и соответствует тенденциям современной трансфузиологии.
Кардиохирургия относится к тем областям медицины, в которых допустимо использование донорской СЗП [6]. Использование собственной плазмы пациентов позволило сократить расход донорской: в 2013 г. он составлял 31% всей использованной СЗП, в 2014 г. - 24%, т.е. на 7% меньше.
В 2013-2014 гг. положительная динамика отмечена при операциях по поводу порока сердца, когда расход донорской СЗП сократился на 7,5%. При операциях по поводу аневризмы аорты расход донорской плазмы сократился на 14% в пользу аутологичной (табл. 1 ).
В результате внедрения программы "бескровной хирургии" в кардиологии значительная часть операций была выполнена без использования донорской крови (табл. 2 ). За 2 года наблюдения число "бескровных" операций по поводу ишемической болезни сердца, выполненных с ИК, увеличилось на 7%, без ИК - на 31%. В 2014 г. все операции АКШ, выполненные без ИК, не потребовали использования донорской крови. Количество операций по поводу аневризм аорты, при которых не потребовались компоненты донорской крови, составило 38%, что в 4 раза больше, чем 2 года назад. Следует подчеркнуть, что снижение числа гемотрансфузий позволило избежать гемотрасфузионных осложнений, кроме того, не было отмечено ДВС-синдрома, снизилось количество послеоперационных кровотечений и рестернотомий.
Результаты, полученные при использовании комплекса мер, предпринятых с целью сокращения расхода донорской крови и безопасности гемотрансфузий:
- повышение качества гемокомпонентов;
- уменьшение числа реципиентов донорских гемокомпонентов;
- снижение расхода компонентов донорской крови на одну операцию;
- уменьшение расхода донорской плазмы в кардиохирургии;
- увеличение количества кардиохирургических операций, выполненных без использования донорской крови.
Таким образом, внедрение кровесберегающей идеологии, интенсификация кровесбережения, повышение качества используемых гемотрансфузионных сред способствовали уменьшению гемотрансфузионных рисков, улучшению результатов хирургического лечения и, по-видимому, дали значительный экономический эффект.
Анализ клинической эффективности гемотерапии, количества гемотрасфузионных осложнений, а также экономической составляющей свидетельствует, что обеспечение РНЦХ гемокомпонентами, производимыми крупными станциями переливания крови, более целесообразно, чем содержание собственного отделения переливания крови.
Читайте также:
