Реинфузия миокарда. Реперфузионный синдром
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Цель исследования: определить информативность электрической импедансметрии, как метода оценки защиты миокарда при разных кардиоплегических модификациях.
В исследование включено 54 больных, оперированных в отделении неотложной хирургии приобретенных пороков сердца НЦ ССХ им. А.Н. Бакулева РАМН по поводу пороков клапанного аппарата сердца, в том числе при сочетании с патологией коронарных артерий. В зависимости от метода защиты миокарда больные разделены на 3 группы: группа №1 - составили пациенты, в качестве защиты миокарда у которых использовалась кардиоплегия по Buckberg (n=31); группа №2 - пациенты, оперированные в условиях фармакохолодовой кардиоплегии с использованием раствора Custodiol (n=9); группа №3 - пациенты, у которых в качестве интраоперационной защиты миокарда использовался гиперкалиевый раствор №3 (п=14). У всех пациентов исследовался биоэлектрический импеданс миокарда. Для многосторонней оценки адекватности защиты миокарда и сравнения с результатами электрической импедансметрии, мы также воспользовались некоторыми общепринятыми методами исследования.
Результаты исследования показали, что электрическая импедансметрия: достаточно хорошо оценивает состояние миокарда во время операции.
Ключевые слова
Полный текст
Совершенствование методов интраоперационной защиты миокарда, является одной из самых актуальных проблем современной хирургии «открытого сердца». Для определения состояния метаболизма миокарда после перенесенной кардиоплегической ишемии в современной медицине используются такие методы как оценка работы сердца с использованием ЭКГ и ЭХО-кардиографии, оценка клинического состояния, потребности в использовании инотропных препаратов, определение уровня биохимических маркеров повреждения (лактат, миоглобин, тропонин и т.д.), а также морфологическое исследование биопсийного материала.
До настоящего времени в клинической практике нет надежного диагностического метода, способного во время операции в режиме реального времени определить состояние метаболизма миокарда.
Для характеристики токопроводности живых клеток и тканей прибегают к эквивалентным схемам, т.е. к таким комбинациям омического и емкостного сопротивлений, которые могут моделировать электрические параметры клеток и тканей. Так, для последовательной соединения омического сопротивления и ем кости электрический импеданс (Z) равен
Z = R 2 + 1 ω 2 C 2
где Ꞷ - частота тока, с - электрическая емкость, омическая составляющая равна R,
а емкостная - 1 ωC
При параллельном соединении электрический импеданс равен
Z = 1 1 R 2 + Ꞷ 2 C 2
Для живых клеток характерно более сложное сочетание последовательного и параллельного соединения элементов.
Получить абсолютные значения величины сопротивления трудно, т.к. эта величина зависит от условий исследования, например, от площади электродов, от расстояния между ними, от плотности прилегания ткани к электродам, от толщины объекта и т.д. [10].
Для оценки физиологического состояния биологической ткани более надежными следует считать данные, характеризующие крутизну дисперсии электропроводности. Некоторые свойства дисперсии удобно выражать отношением величины сопротивления, измеренного на низкой частоте, к величине сопротивления, измеренного на высокой частоте, исходя из того, что если два сопротивления измеряются на разной частоте в одних и тех же условиях, то отношение между ними оказывается весьма постоянным для нормального состояния данной ткани [11]
R нч = ρ нч l s R вч = ρ вч l s
где ρнч и ρвч - удельные сопротивления биологической ткани на используемых частотах, l - расстояние, S - площадь измерительного электрода.
Тогда из выражения:
К п = R нч R вч = ρ нч ρ вч
следует, что величина коэффициента не зависит от параметров измерительного электрода и определяется только свойствами ткани.
После умирания ткани указанный коэффициент приближается к единице. В нормальных неповрежденных клетках и тканях его величина зависит от положения организма в эволюционном ряду. Например, для млекопитающих К=2,5-10, лягушки К=1,5-3. Величина коэффициента зависит также от строения, функции и состояния ткани. В органах с интенсивным обменом веществ (печень, селезенка) оно выше, чем, например, в мышцах того же организма [И, 12].
Таким образом, можно заключить следующее. Переменный ток частотой ниже 40 кГц распространяется преимущественно по сосудам и межклеточному пространству, огибая при этом клетки, удельное сопротивление которых (за счет высокого омического сопротивления мембран) намного выше удельного сопротивления жидких сред. На частотах порядка сотен и тысяч кГц емкостное сопротивление мембран уже незначительно мешает проникновению тока в клетки и его плотность вне- и внутри клеток становится сравнимой. На таких частотах ток легко проходит как через внеклеточную, так и внутриклеточную среду. В отличие от низкочастотного измерения, проводимость тока повышается, соответственно сопротивление ткани (биоимпеданс) снижается.
Цель исследования: определить информативность электрической импедансметрии, как метода оценки защиты миокарда при разных кардиоплегических модификациях.
Материал и методы
В исследование включено 54 больных, оперированных в отделении кардиохирургии ФГБУ ФНКЦ ФМБА и отделении неотложной хирургии приобретенных пороков сердца НЦ ССХ им. А.Н. Бакулева РАМН с 2009 г. по 2011 г. по поводу пороков клапанного аппарата сердца, в том числе при сочетании с патологией коронарных артерий. В зависимости от метода защиты миокарда больные разделены на 3 группы: группу №1 составили пациенты, в качестве защиты миокарда у которых использовалась холодовая кровяная кардиоплегия по Buckberg (n=31); группа №2 - пациенты, оперированные в условиях фармакохолодовой кардиоплегии с использованием внутриклеточного раствора Custodiol (n=9); группа №3 - пациенты, у которых в качестве интраоперационной защиты миокарда использовался гиперкалиевый раствор №3 (n=14). Характеристика этих пациентов представлена в таблице 1. У всех пациентов исследовался биоэлектрический импеданс миокарда.
Система измерения состоит из датчика, биоимпедансметра и компьютера, последовательно подключенных между собой.
Датчик представляет два комбинированных миокардиальных электрода для четырехполюсного измерения. Небольшие размеры и форма электродов предусматривали его надежную фиксацию к миокарду. Корпус выполнен из композиционного материала, который обеспечивает герметичную конструкцию электрода. В нижней части корпуса расположены два стержня, из сплава благородных металлов. В конструкцию одного из электродов встроен термоэлемент для измерения температуры миокарда (рис. 1).
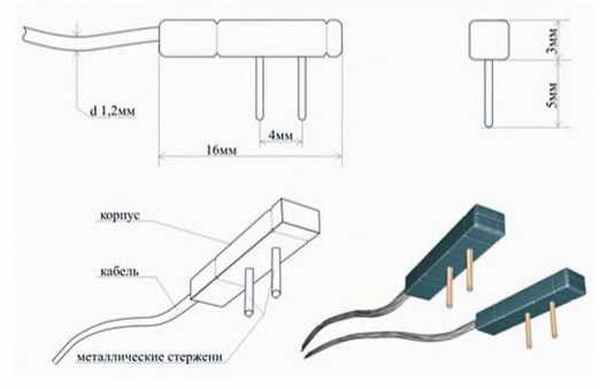
Рис. 1. Датчик для четырехполюсного измерения электрического импеданса миокарда
Электроды фиксировались таким образом, чтобы максимально охватить исследуемый участок миокарда при этом расстояние между ними составляло около 3 см (рис. 2). У всех пациентов мы исследовали биоимпеданс передней стенки правого желудочка.
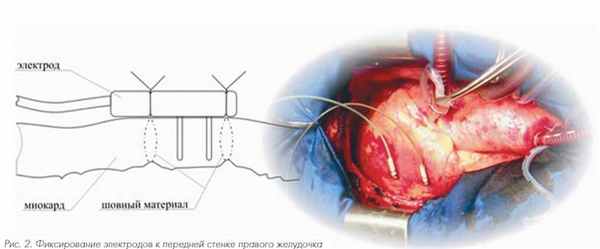
Рис. 2. Фиксирование электродов к передней стенке правого желудочка
Измерение электрического импеданса проводилась на двух частотах 110 кГц и 9,4 кГц. Полученные данные высокочастотного и низкочастотного импеданса (Zbч, Zhч) а также отношение Zhч/Zbч (Кп - крутизна дисперсии)
Таблица 1. Клиническая характеристика пациентов, включенных в исследование
Buckberg
Custodiol
Раствор №3
Всего
Длительность пережатия аорты, мин
Длительность ИК, мин
Достоверность различий по отношению к значениям 1-группы: р
непрерывно мониторировались практически весь период искусственного кровообращения. Параллельно мониторировалась температура в исследуемом участке миокарда. Проводилась температурная поправка кривой импеданса к 37 °C с использованием специальной программы. Данные обрабатывались и записывались на компьютере.
Особый интерес представляли показатели импеданса (Zbч, Zhч и Кп), снимаемые в следующие моменты операции (контрольные точки):
- начало ИК - исходные значения (Zbч-0, Zhч-O, Кп-0),
- непосредственно перед пережатием аорты (Zbч-1, Zhч-I, Кп-1)
- непосредственно перед введением кардиоплегического раствора (Zbч-2, Zhч-2, Кп-2),
- в конце введения кардиоплегического раствора (Zbч-3, Zhч-З, Кп-3),
- непосредственно перед снятием зажима с аорты (Zbч-4, Zhч-4, Кп-4),
- первые минуты реперфузии миокарда (Zbч-5, Zнч-5, Кп-5),
- через 20 мин после восстановления коронарного кровотока (Zbч-6, Zhч-6, Кп-6),
- восстановление исходных значений импеданса, если оно имело место до окончания ИК (Zbч-7, Zhч-7, Кп-7),
- начальная точка снижения Zbч (Zbч-8).
Результаты и обсуждение
Все показатели импеданса рассматривались относительно исходных значений (табл. 2), которые фиксировались на «теплом сердце» при температуре 36-37°С.
Большой разброс исходных значений высокочастотного и низкочастотного импеданса (Zbч, Zhч), где стандартное отклонение от среднего составило 14,7 для всех пациентов, обусловлен несколькими факторами:
Таблица 2. Средние значения исходного импеданса, Ом
электропроводимостью ткани, толщиной исследуемого участка миокарда и расстоянием между фиксированными электродами [5, 4, 10]. Важно отметить, что у всех пациентов исходные значения отношений низкочастотного к высокочастотному импедансу (Кп - крутизна дисперсии) в среднем составляют 2,14±0,03 и не зависят от объема исследуемого участка миокарда. Поэтому вместо абсолютных значений импеданса мы рассматривали изменения последнего относительно исходного.
При анализе материала выявлены общие закономерности изменения электрического импеданса миокарда (рис. 3).
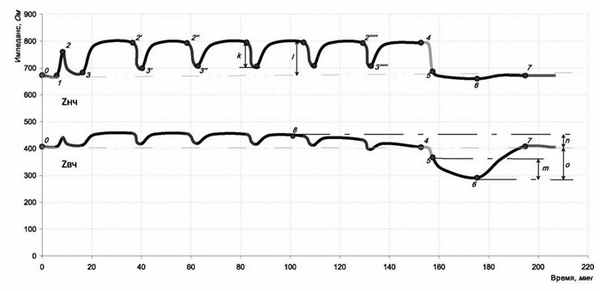
Рис. 3. Схематический разбор графика электрического сопротивления миокарда.
0 - начало И К - исходные значения, 1. - непосредственно перед пережатием аорты, 2. - непосредственно перед введением кардиоплегического раствора, 3. - в конце введения кардиоплегического раствора, 4. - непосредственно перед снятием зажима с аорты, 5,- первые минуты реперфузии миокарда, 6. - через 20 минут после восстановления коронарного кровотока, 7. - восстановление исходных значений импеданса, 8. - начальная точка снижения Zвч.
До пережатия аорты, сопротивление миокарда практически не менялось, что показывало стабильность состояния внеклеточного и внутриклеточного пространства. Через несколько секунд после пережатия аорты, импеданс резко возрастал за счет Zнч. о чем свидетельствовало увеличение Кп. Это изменение объясняется объемной разгрузкой мелких кровеносных сосудов с последующим относительным обезвоживанием интерстициального пространства (рис. 3, промежуток 1-2). Этот процесс длится в среднем 1,8±0,1 минут, после чего электрическое сопротивление миокарда стабилизируется, если к тому времени не начато введение кардиоплегического раствора.
Первая кардиоплегия (индукция) проводилась в среднем через 1,2±0,1 минуты после пережатия аорты с целью достижения асистолии. Сразу после введения раствора импеданс стремительно снижался к исходному значению в основном за счет Zнч, что свидетельствовало о наполнении сосудистого русла и интерстициального пространства кардиоплегическим раствором. Снижение импеданса наблюдалось до определенного значения и держалось на этом уровне до окончания инфузии (рис. 3, промежуток 2-3). После кардиоплегии величина импеданса снова возрастала, и достигала максимального значения (рис. 3, точка 2'), так называемого «импеданса сухого миокарда» (ИСМ).
Последующие сеансы кардиоплегии (реинфузия) влекли за собой аналогичные изменения импеданса (рис. 3, промежутки 2'-3', 2"-3" и т.д.).
В таблице 3. представлены средние значения объемной скорости введения кардиоплегического раствора и степень снижения Zhч импеданса при антеградном и ретроградном пути введения кардиоплегического раствора.
Чтобы найти зависимость между объемной скоростью введения кардиоплегического раствора и снижением низкочастотного импеданса, мы попытались определить степень, с которой значения двух переменных «пропорциональны» друг другу. Для решения этой задачи был использован метод простой линейной корреляции Пирсона (рис 4.).
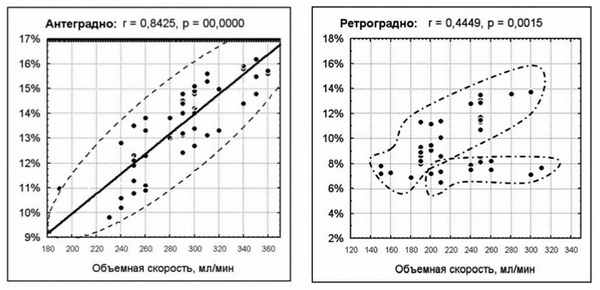
Рис. 4. Корреляция между объемной скоростью перфузии миокарда И степенью снижения Zнч во время антеградного и ретроградного введения кардиоплегического раствора.
Таблица 3. Средние значения объемной скорости перфузии миокарда и степень снижения низкочастотного импеданса во время кардиоплегии
Количество наблюдений
Объемная скорость (мл/мин)
DZ-H4
r
Р
Антеградно
Ретроградно
группа А
внутренняя окклюзия КС
внешняя окклюзия КС
группа Б
внутренняя окклюзия КС
внешняя окклюзия КС
В случае с ретроградным введением раствора через коронарный синус, данные оказались не коррелируемы. Но при детальном разборе диаграммы рассеяния можно заметить разнородность данных, область которых помечена пунктирной линией (рисунок 4, справа). В подобных ситуациях низкая корреляция может быть следствием разбиения данных на две группы, а вовсе не отражать «истинную» зависимость между двумя переменными.
В данном случае мы попытались вычислить корреляции отдельно для каждого множества, разделив пациентов с ретроградной кардиоплегией на две экспериментальные группы - «А» и «Б» (рис. 5).
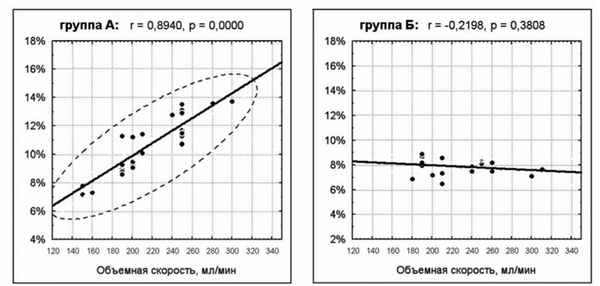
Рис. 5. Корреляция между объемной скоростью перфузии миокарда и степенью снижения 2нч вовремя ретроградного введения кардиоплегического раствора.
Хотелось бы напомнить, что нами исследовался биоимпеданс передней стенки правого желудочка - бассейн, дренируемый преимущественно передними венами сердца.
Учитывая вышеперечисленное, можно предположить, что в группу «А» вошли пациенты n=27 (61,4%), у которых передние вены сердца дренируются в систему коронарного синуса. Поэтому ретроградная кардиоплегия через коронарный синус в данной группе пациентов предусматривала адекватную перфузию миокарда передней стенки правого желудочка.
Группу «Б» могли составить больные n=17 (38,6%), у которых передние вены сердца дренировались в правые отделы сердца, минуя коронарный синус. У таких пациентов ретроградная кардиоплегия через коронарный синус не предусматривала адекватной перфузии передней стенки правого желудочка. Следовательно, в данной группе форсирование объемных скоростей кардиоплегии, не влечет за собой изменения низкочастотного импеданса.
Средняя кардиальная вена, которая дренирует кровь от некоторых областей МЖП, открывается в коронарный синус очень близко к его устью. Среднее расстояние между устьем коронарного синуса и средней кардиальной веной 1,7 0,6 мм у взрослых. Соответственно, невозможно гарантировать положения баллона при РКП в синусе без окклюзии открывающихся там вен 15.
По методу канюляции коронарного синуса пациенты разделены на две подгруппы: внутренняя окклюзия коронарного синуса раздутым баллоном и внешняя окклюзия - ограничение отверстия коронарного синуса с помощью кисетного шва. Результаты биоимпедансной спектроскопии в подгруппах с разными методами окклюзии коронарного синуса, достоверных различий не показали.
Все вышеперечисленные изменения импеданса происходили преимущественно за счет Zhч, что характеризуют объемные изменения внеклеточного пространства.
После 15-20 минут интраоперационной ишемии в условиях анаэробного гликолиза происходит аккумуляция лактата и протонов в цитоплазме, развивается внутриклеточный ацидоз. Возникает гипергидратация каналов эндоплазматического ретикулуума, вакуолизация вставочных дисков. В условиях нарастающей ишемии наблюдается избыточное накопление ионов водорода, что приводит к распространенному отеку, прежде всего, перинуклеарной области, расширению и набуханию канальцев саркоплазматического ретикулуума и Т-системы. С прогрессирующим нарушением обмена электролитов и ионного равновесия клетки, нарастает осмотическое давление в миоцитах. Это приводит к частичному перемещению экстрацелюлярной воды в миоциты и к формированию клеточного отека. На этой стадии повреждения миокарда также наблюдается гидратация эндотелия капилляров, за счет частичного перемещения тканевой воды в эндотелиоциты.
Эти изменения, приводят к увеличению суммарного внутриклеточного пространства и соответственно повышению электрической проводимости миокарда, что в свою очередь проявляется снижением импеданса [12, 16].
Кардиоплегия продлевает время нарастания клеточного отека в той или иной степени.
Таблица 4. Средние значения времени начала снижения и степень снижения Z-BЧ на высоте ишемии
Реперфузионный синдром, методы профилактики и лечения вторичного повреждения тканей при ишемии

В работе представлены данные о патогенезе и клинических проявлениях реперфузионного синдрома, встречающегося во всех случаях восстановления кровотока после острой ишемии органов и тканей. На основании собственного опыта и данных литературы авторы разработали схемы фармакологической защиты тканей и органов от вторичного повреждения.
Актуальность. Критические состояния, травмы, многие заболевания и ранний послеоперационный период часто сопровождаются ишемией тканей и органов. Возникающие расстройства кровообращения могут проявляться клинически значимыми симптомами (гипотонией, тахикардией), а также протекать без видимых клинических проявлений. Чаще всего эти нарушения происходят на уровне микроциркуляции, быстротечны и проходят бесследно, однако при тяжелых критических состояниях кровообращение нарушается и в регионарных бассейнах системы кровоснабжения, что приводит к развитию органной или полиорганной недостаточности. Лечение больных в этот период чрезвычайно сложно, требует больших усилий и затрат.
В клинической практике врач довольно часто встречается с различными проявлениями ишемии тканей, которая может быть как кратковременной, так и длительной, локальной или распространенной. В зависимости от этого итогом ишемии может быть полное восстановление функции и структуры, или некроз и анатомический дефицит.
Основной задачей клинициста в этих случаях становится восстановление макро- и микроциркуляции. Между тем, парадокс лечения заключается в том, что при восстановлении кровообращения в ишемизированных тканях, доставка кислорода сопровождается образованием его активных форм, которые повреждают мембраны клеток [9, 15]. В результате этого возникает вторичное повреждение тканей и органов, развивается реперфузионный синдром. Благо превращается во вред. Степень выраженности данного синдрома определяется распространенностью и длительностью ишемии, предшествовавшей восстановлению кровообращения.
Реперфузионный синдром – это комплекс клинических проявлений восстановления кровообращения в ранее ишемизированных тканях, сопровождающийся повреждением клеток, тканей и органов на местном и системном уровне с развитием полиорганной недостаточности.
Этот синдром является универсальным ответом организма на ишемию любой этиологии.
Клинические состояния, при которых развивается реперфузионный синдром
В медицинской практике давно отмечено, что при некоторых состояниях на фоне улучшения показателей гемодинамики отмечается ухудшение общего состояния. Известен факт, что после черепно-мозговой травмы (ЧМТ) и относительной стабилизации гемодинамики с началом лечения состояние пострадавших ухудшается, нарастает степень угнетения сознания [2, 3, 5]. Нейрохирурги и реаниматологи давно ищут пути профилактики этого вторичного повреждения головного мозга при тяжелой ЧМТ.
Описан также синдром включения у пациентов после восстановительных операций при окклюзионных поражениях сосудов нижних конечностей, когда возникают нарушения функции почек, коронарного кровоснабжения, дыхательные расстройства по типу острого респираторного дистресс-синдрома (ОРДС) [3]. Пик этих проявлений отмечается через сутки от начала лечения.
Яркую клиническую картину синдрома включения отмечали при использовании перфторана у больных с синдромом Лериша. Улучшение периферического кровообращения (потепление конечности) сопровождалось выраженными болями в пояснице, повышением уровня азотистых шлаков и молекул средней массы, ацидозом, нарушениями сердечного ритма, снижением индекса оксигенации, развитием острого повреждения легких.
При восстановлении кровообращения в коронарных сосудах при инфаркте миокарда после выполненной баллонной ангиопластики, стентирования или тромболизиса часто возникают нарушения сердечного ритма, которые трудно поддаются лечению, а эффективных методов профилактики этих аритмий до настоящего времени не предложено [4, 6, 9]. Реперфузионный синдром при экспериментальном инфаркте миокарда был впервые описан в 1960 году [14]. Авторы описали признаки повреждения миокарда: клеточный отек, контрактуру миофибрилл, разрывы сарколеммы и повреждения митохондрий. На сегодняшний день с реперфузионными повреждениями миокарда связывают осложнения операций по восстановлению кровотока в инфаркт-зависимой артерии [9, 10, 11, 13].
Тяжелые сочетанные травмы, расширенные и комбинированные оперативные вмешательства, массивные кровопотери, интоксикации и другие состояния сопровождаются централизацией кровообращения. Важной составляющей лечения таких пациентов является восстановление кровообращения в системе микроциркуляции. При этом основная задача – доставить кислород к тканям, где его недостаточно. Доставка кислорода в ишемизированные ткани сопровождается развитием оксидативного каскада. В восстановлении кровообращения в системе микроциркуляции и регуляции капиллярного кровотока важную роль играет серотонин [1, 7].
Значительные поражения тканей в период восстановления кровообращения клинически сопровождаются местными и общими нарушениями. Так, местно, при реперфузии мозга, увеличивается отек, клинически нарастает неврологический дефицит; в оперированной конечности появляются боли, нарастают трофические расстройства; изменения в сердце приводят к нарушениям ритма. Системным проявлением реперфузионного синдрома является развитие полиорганной недостаточности. Чаще всего при этом нарастают явления ОРДС, почечной недостаточности и энцефалопатии.
Таким образом, реперфузионный синдром развивается в том месте, где был эпизод ишемии с последующим восстановлением кровообращения и доставки кислорода [8]. Чем большая длительность и обширность ишемии, тем более выражены симптомы реперфузии.
Патогенез реперфузионного синдрома
В критических ситуациях, сопровождающихся расстройствами кровообращения, от гипоксии страдают большие объемы тканей. Биохимическая «буря» приводит к катастрофическому росту соответствующих маркеров ишемии, повышению уровня лактата. Кислые продукты вызывают спазм прекапиллярных сфинктеров. При ишемии длительностью более 2-х часов наступает гибель большинства клеток, страдают анатомические структуры, развивается органная недостаточность. У данной категории больных чаще развиваются почечная, дыхательная и сердечная недостаточности.
При шунтировании крови метаболизм становится на путь анаэробного гликолиза, возникает энергетическая недостаточность клеток. Накапливаются кислые промежуточные продукты обмена веществ. При восстановлении кровообращения и доставки кислорода тканям активируется процесс окисления, что ведет к вторичному повреждению мембран клеток активными кислородными радикалами (Рис. 1). Количество их возрастает в геометрической прогрессии.
В ходе ишемии АТФ превращается в АМФ, затем следует образование аденозина, инозина, гипоксантина. Основная продукция активных форм кислорода (АФК), повреждающих ткани, наступает при реперфузии, когда в присутствии ксантиноксидазы кислород преобразует гипоксантин в ураты и образуются активные радикалы. АФК разрушают клеточные мембраны, это приводит к дальнейшему ухудшению состояния тканей [3, 5, 15]. Так возникает вторичное повреждение тканей (рис. 2).
Лечение и профилактика реперфузионного синдрома
Основные цели лечения данных состояний направлены на восстановление кровоснабжения, доставку кислорода тканям и перфузию в системе микроциркуляции. Это достигается путем восполнения объема циркулирующей крови (ОЦК), глобулярного объема, снижения вязкости крови и улучшения микроциркуляции в зонах нарушенного кровообращения, путем применения различных групп лекарственных средств, включая прямые антикоагулянты, периферические вазодилататоры (преимущественно блокаторы медленных кальциевых каналов), пентоксифиллин (трентал), серотонин, миотропные спазмолитики (папаверин) и др. [7, 10, 12]. Папаверин оказывает терапевтический эффект и в кислой среде, снимает спазм сосудов даже после снятия длительно наложенного жгута.
В последние годы весьма перспективно применение серотонина, который по данным ультразвуковой допплерографии увеличивает объемную систолическую (Qas) и среднюю (Qam) скорость капиллярного кровотока до 20 раз, уменьшая тем самым переходные зоны ишемии (Врублевский О. Ю. с соавт. , 1997). Этот эффект серотонина позволяет назначать его больным с инфарктом миокарда, ишемическим инсультом, при синдроме диабетической стопы, ОРДС.
Чем лучше восстанавливается кровообращение в тканях и повышается доставка кислорода, тем больше образуется АФК и наиболее выраженным становится вторичное повреждение. Для коррекции таких состояний были предложения уменьшать доставку кислорода к поврежденным тканям, но это не выход из сложившейся ситуации. Для нейтрализации АФК в последнее время стали широко применять антиоксиданты (рис. 3). Наиболее часто из препаратов данной группы используют мексидол, который существенно снижает выраженность оксидативного стресса. Тем не менее, следует понимать, что его воздействие направлено на субстраты, которые уже образовались в зонах устранения ишемии. С этой же целью применяются и другие антирадикальные средства: препараты супероксиддисмутазы, витамин Е, Витамин А, Витамин С и др.
Супероксиддисмутаза (СОД) является катализатором обратной реакции – дисмутации (обратного превращения) АФК в кислород и перекись водорода. СОД работает вместе с каталазой, которая расщепляет Н2О2 на молекулярный кислород и воду. В связи с этим в комплекс терапии реперфузионного синдрома следует включать препараты супероксиддисмутазы (Орготеин, Рексод и др. ).
Патогенетически наиболее эффективным средством лечения реперфузионного синдрома должен стать препарат, способный препятствовать образованию активных кислородных радикалов. Этим можно предотвратить образование АФК и тем самым вторичное повреждение мембран клеток, что и будет профилактикой реперфузионного синдрома.
Данными фармакологическими свойствами характеризуется препарат аллопуринол, который обладает специфической способностью ингибировать фермент ксантиноксидазу, который принимает участие в превращении гипоксантина в ксантин. В ходе данной реакции также запускается процесс активного образования АФК [6, 15]. Ингибируя ксантиноксидазу, аллопуринол предотвращает образование активных форм кислорода, и, являясь по сути прооксидантом, защищает ткани от химически активных воздействий. С этой целью следует применять таблетки аллопуринола внутрь (парентеральных форм аллопуринола в настоящее время на фармацевтическом рынке не представлено), через желудочный или интестинальный зонд после измельчения, растворив в воде. Доза составляет 300-500 мг в сутки. Назначается после восстановления всасывающей функции кишечника. Также аллопуринол может назначаться внутрь за 2-3 часа перед большими травмирующими оперативными вмешательствами, перед предстоящим тромболизисом или баллонной ангиопластикой, перед восстановлением кровообращения в конечностях.
В комплексе терапии тяжелых состояний следует применять и другие антиоксиданты, которые значительно улучшают результаты лечения. Антиоксиданты гасят «костер» оксидативного стресса, а аллопуринол не дает ему разгореться.
Таким образом, включение аллопуринола в комплекс интенсивной терапии тяжелых состояний позволит предотвратить реперфузионные повреждения клеток и тканей, развитие органной и полиорганной недостаточности. Применение аллопуринола для профилактики реперфузионного синдрома должно поставить эффективность интенсивной терапии на ступень выше и дать хороший клинический и экономический эффект.
Профилактика реперфузионного синдрома исключает образование АФК, обеспечивая поступление О2 сразу в клетку, восстанавливает аэробный путь обмена веществ и повышает его энергетическую ценность, что позволяет защитить ткани и органы от вторичного повреждения. Можно предотвратить повторное повреждение тканей при ЧМТ; появление аритмий, порой фатальных, после тромболизиса и ангиопластики коронарных сосудов; развитие полиорганной недостаточности, острой почечной недостаточности, ОРДС при тяжелой сочетанной травме; острый коронарный синдром при восстановлении кровообращения в конечностях при синдроме Лериша, диабетической стопе.
Аллопуринол в качестве профилактики реперфузионного синдрома должен применяться на этапе скорой помощи перед проведением тромболизиса или ангиопластики у больных с инфарктом миокарда, ишемическим инсультом головного мозга, перед операцией у больных с острым тромбозом, ишемией, наложением жгута, при обширных хирургических операциях с предстоящей большой кровопотерей. Он должен стать патогенетически обоснованным средством профилактики вторичного повреждения тканей при любой значимой ишемии тканей.
Реинфузия миокарда. Реперфузионный синдром
Реинфузия миокарда. Реперфузионный синдром
Показаниями к реперфузии служат:
1) стенокардические боли длительностью 20—30 минут, не купирующиеся нитроглицерином;
2) появление на ЭКГ патологического зубца Q или Повышение ST-сегмента на 2 мм не менее чем в двух отведениях (II-III и aVF при диафрагмальном поражении; двух прекордиальных или I и aVL при переднем); 3) длительность острых нарушений не более 4—6 часов; 4) возраст больных не старше 75 лет.
К противопоказаниям относятся:
1) длительность болевого приступа свыше 6 часов;
2) возраст больных старше 75 лет;
3) артериальная гипертензия более 190/110 мм рт.ст.;
4) мозговой инсульт, перенесенный в сроки ближе 4 месяцев;
5) злокачественные новообразования, полипы; 6) повышенная кровоточивость;
7) наличие беременности.

Для тромболизиса применяются препараты группы стрептокиназ. Приводим схему тромболизиса одним из наиболее активных препаратов—целиазой. Она применяется Ёнутривенно капельно или внутрикоронарно. Препарат перед введением растворяется в изотоническом растворе хлористого натрия или 5% глюкозе, затем вводится внутривенно в дозе 3 млн. ЕД в течение 18—24 часов. Предварительно делается инъекции преднизолона (60 мг). Начальная скорость введения целиазы 30 капель в 1 мин, затем замедляется до 15 капель в мин.
Внутрикоронарно медленно вводится до 500 ЕД.
Сразу после введения, целиазы начинаются инъекции гепарина в суточной дозе 20 тыс.ЕД, а затем назначается аспирин. В последние годы наиболее эффективным из фибринолнти-ков признан тканевый активатор плазминогена.
У части больных, леченных фибринолитиками (до 20%): на протяжении 2—3 суток развивается ретромбоз. Вновь появляются клинические й ЭКГ-признаки окклюзии коронеров. Иногда при этом приходится осуществлять повторный тромболизис или проводить хирургическое лечение.
Для профилактики ретромбоза используют средства, влияющие на тромбообразование, особенно на агрегацию тромбоцитов. Из них эффективным является применение гепарина в виде непрерывной или прерывистой инфузии в дозах примерно 20—25 тысяч ЕД в сутки, а также малые дозы аспирина (160 мг в сутки).
Грозным осложнением тромболиза является развитие реперфузионного синдрома (PC).
Сущность реперфузионного синдрома заключается в том, что при восстановлении коронарного кровообращения патологические продукты нарушенного метаболизма миокарда и вазоконстриктивные вещества из резко поврежденных областей устремляются в соседние с ними малоповрежденные и нормальные зоны. Реперфузионный синдром разной степени выраженности развивается тогда, когда восстановление кровообращения проведено в сроки более 60—120 минут от обтурации КА. Все его проявления соответствуют клинике "потрясенного" миокарда. При этом более легкими из них являются кратковременные аритмии!
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Реперфузионное повреждение миокарда: стратегия медикаментозной терапии
Ущерб, нанесенный сердечной мышце при остром инфаркте миокарда (ИМ), является результатом двух процессов: ишемии и последующей реперфузии (Ibanez B., Heusch G., 2015). Реперфузионное повреждение – синдром, возникающий вследствие восстановления коронарного кровотока в ишемизированной зоне и характеризующийся миокардиальной, электрофизиологической и/или сосудистой дисфункцией (Ватутин Н. Т. и соавт., 2013).
В настоящее время внимание исследователей сфокусировано на внутриклеточных процессах и функциональном состоянии клеток и субклеточных структур, что находит отражение в изменении стратегии медикаментозной терапии пациентов с острым коронарным синдромом (ОКС) (Fourth Universal Definition of Myocardial Infarction ESC Clinical Practice Guidelines, 2018).
Ишемия и реперфузия
Процесс полного или частичного восстановления кровотока в ишемизированной зоне миокарда происходит спон-танно или с использованием реперфузионных технологий.Спонтанная реперфузия может развиваться вследствие лизиса либо реканализации коронарного тромба, прекращения спазма коронарной артерии, усиления коллатерального кровотока в участке ишемии. Также реперфузия достигается с помощью внутривенного введения тромболитических агентов, а также путем стентирования коронарных артерий. Несмотря на дифференцированный механизм, возобновление кровотока в окклюзированной артерии вызывает ряд процессов, объединенных в термин «реперфузионное повреждение миокарда», которые негативно влияют на восстановление функции ишемизированного миокарда (ESC/EACTS Guidelines on Myocardial Revascularization, 2018).
Реперфузионное повреждение может проявляться контрактильной дисфункцией («станнированный» или «оглушенный» миокард), повреждением сосудов микроциркуляторного русла и отсутствием восстановления кровотока на уровне тканей (феномен no-reflow), реперфузионными аритмиями и необратимым повреждением миокарда, заключающимся в ускоренной гибели кардиомиоцитов, функция которых была нарушена предшествовавшей ишемией (Ватутин Н.Т. и соавт., 2013). Согласно экспериментальным данным, именно реперфузионным повреждением cпровоцировано около 50% окончательного размера зоны некроза при остром ИМ (Yang X.C. et al., 2007).
В основе развития реперфузионного повреждения миокарда и реперфузионных аритмий лежат следующие механизмы, которые дополняют друг друга и взаимосвязаны:
- неблагоприятные эффекты реоксигенации ишемизированной ткани с образованием свободных радикалов кислорода («кислородный парадокс»);
- избыточное поступление ионов кальция из экстрацеллюлярного пространства внутрь кардиомиоцитов с последующим нарушением функции митохондрий, снижением продукции аденозинтрифосфата (АТФ), образованием контрактуры кардиомиоцитов и в последующем их гибелью («кальциевый парадокс»);
- механическое повреждение кардиомиоцитов при восстановлении кровотока (Долженко М.Н., Довганич Н.В., 2008).
Митохондриальная пора
Один из основных патогенетических механизмов реализации реперфузионного повреждения
При ишемии миокарда и его последующей реперфузии кардиомиоциты гибнут в результате апоптоза. Наиболее вероятной причиной в этой ситуации считается развитие дисфункции митохондрий из-за открытия в их внутренней мембране неспецифических каналов высокой проводимости для молекул размером менее 1500 дальтон. Этот канал именуется митохондриальная пора. Митохондриальная Са 2+ -зависимая пора образована комплексом белков и представляет собой неселективный канал, который проходит через наружную и внутреннюю мембраны митохондрии и играет значительную роль в кальциевом обмене между данными органеллами и средой (mitochondrial permeability transition pore, mPTP) (Gordan R. еt al., 2016).
mPTP функционирует путем изменения структуры составляющих ее белков, регулируя тем самым энергетические процессы и электролитный обмен в «экстремальных ситуациях». Открытие происходит при определенных патологических состояниях, таких как инсульт, черепно-мозговая травма, нейродегенеративные заболевания, печеночная энцефалопатия, мышечная дистрофия, ИМ и др. (Linkermann A. et al., 2016). В частности, при ишемии миокарда наличие активной mPTP является фактором, который играет важную роль в реперфузионном повреждении миокарда, поскольку во время самого эпизода ишемии mPTP закрыта, но открывается сразу, как только возобновляется ток крови к тканям (Левченкова О.С. и соавт., 2014; Ong S.B., Samangouei P., 2015). Помимо транспортной, mPTP выполняет также регуляторную функцию, инициируя процесс клеточной деградации и непосредственно участвуя в реализации митохондриального сигнального пути апоптоза. Открытие mPTP во внутренней мембране сопровождается падением потенциала между внутренней и внешней средой клетки, поступлением воды и ионов в матрикс митохондрий, их набуханием и разрывом внешней мембраны. Разобщение дыхательной цепи, выброс цитохрома С и других факторов апоптоза, а также преобладание гидролиза АТФ над синтезом в конечном итоге приводят к гибели клетки.
Таким образом, судьба клетки после ОКС зависит от степени и продолжительности открытия ее mPTP (Cung T.T. et al., 2015). Если повышение проницаемости mPTP происходит кратковременно, клетка может восстановиться, если же открытие более выраженное и продолжительное, то клетка подвергается апоптозу.
…и мишень для фармакотерапии
Для уменьшения реперфузионного повреждения миокарда применяют эндогенную (пре-, пери-, посткондиционирование) кардиопротекцию, ингибирование сигнальных путей апоптоза кардиомиоцитов, эндотелио- и вазопротекцию, а также гипотермию (Ruiz-Meana M., Garcia-Dorado D., 2009, Ватутин Н.Т. и соавт., 2013).
Для предупреждения возникновения осложнений ОКС необходимо уменьшить прогрессирующее повреждение кардиомиоцитов и выраженность внутриклеточных нарушений, возникающих с первых секунд развития ишемии. Поэтому в настоящее время интенсивно разрабатываются методы уменьшения реперфузионного повреждения и миокардиальной цитопротекции. Ранее изучались возможности действия гемодинамически активных лекарственных средств, обладающих свойствами антиоксидантов, ингибиторов катаболических ферментов и мембранопротекторов (Вакалюк И.П., 2016). Сегодня будущее за препаратами, имеющими сразу гемодинамические и цитопротекторные эффекты.
При этом именно mPTP является перспективной мишенью для фармакологического воздействия, поскольку выполняет важнейшую регуляторную функцию в жизнедеятельности клетки. Она участвует не только в регуляции метаболических процессов в различных условиях функционирования клетки, но и в реализации митохондриального сигнального пути апоптоза (Левченкова О.С. и соавт., 2014; Linkermann A. et al., 2016).
Ингибиторы митохондриальной поры: L-карнитин и L-аргинин
Свойствами блокаторов mPTP обладают молекулы левокарнитина (L-карнитина) и L-аргинина (Opie L.H., 1979, Еvans N.W. et al., 2002; Шиманская Т.В. и соавт., 2009; Левченкова О.С. и соавт., 2014; Jiang H., Liu M., 2018).
L-карнитин участвует в процессе β-окисления жирных кислот (ЖК) и выработке энергии в митохондриях, а также выступает в качестве специфического ко-фактора, контролирующего скорость окисления длинноцепочечных ЖК и облегчающего их перенос через внутреннюю мембрану митохондрий. Кроме того, L-карнитин участвует в удалении избытка ЖК из митохондрий, а затем и из цитоплазмы, предупреждая таким образом развитие цитотоксического эффекта. В условиях ишемии в митохондриях накапливается ацилкоэнзим А, баланс которого со свободным коэнзимом А поддерживается за счет работы так называемого карнитинового челнока, транспортирующего ацильные остатки ЖК (Вакалюк И.П., 2016).
При ОКС антиоксидантный и защитный эффект L-карнитина носит комплексный характер и обусловлен его способностью удалять уже образовавшиеся активные формы кислорода, выступая в качестве акцептора для таких радикалов (Opie LH., 1979). L-карнитин транспортирует свободные жирные кислоты в митохондрию и стимулирует β-окисление для коррекции энергетического обмена, способствуя выработке АТФ, и ингибирует активность mPTP с транзиторной проницаемостью (Opie L.H., 1979; Асташкин Е.И., 2016).
Еще в 2013 г. был опубликован систематический обзор 13 контролируемых исследований, включавших в общей сложности 3629 пациентов, который показал, что применение L-карнитина приводит к достоверному снижению смертности от любых причин и с высокой степенью достоверности – к уменьшению частоты возникновения желудочковых аритмий и развития ИБС. Было показано, что механизм, лежащий в основе положительного действия L-карнитина при сердечно-сосудистой патологии, является многофакторным и связан, в частности, со способностью данного вещества улучшать энергетический метаболизм в митохондриях кардиомиоцитов (Dinicolatonio J.J., Lovie C.J. et al., 2013).
Сегодня накоплен значительный опыт применения L-карнитина у пациентов с различными формами ИБС и кардиомиопатиями (Площенко Ю.О., Клигуненко О.М., 2017). Показано, что уровень L-карнитина в миокарде снижается при ИБС, остром ИМ, а также сердечной недостаточности различного генеза (Regitz V. et al., 1990).
В свою очередь, высокие концентрации L-карнитина оказывают положительный клинический эффект при стенокардии, заболеваниях периферических сосудов, артериальной гипертензии (Arsenian M.A., 1997; Ferrari R. et al., 2004; Miguel-Carrasco J.L. et al., 2008; Zambrano S. et al., 2013). У пациентов с хронической сердечной недостаточностью он улучшает фанкцию миокарда и клиническую симптоматику, а также хорошо переносится (Xiaolong Song et al., 2017). Установлено, что левокарнитин способствует снижению риска атеросклероза и ИБС у лиц с сахарным диабетом (Tappia P.S. et al., 2011). При этом его антиангинальный и противоишемический эффекты обусловлены улучшением метаболизма миокарда и сохранением запасов АТФ в период ишемии (Bartels G.L. et al., 1994).
Хорошо изучено применение L-карнитина при ОКС. L-карнитин является физиологически важным ко-фактором энергетического обмена в кардиомиоците в условиях острой и хронической ишемии. В частности, применение L-карнитина в течение 8 часов после появления симптомов уменьшает распространенность острого ИМ (Rebuzzi A.G. et al., 1984; Singh R.B. et al., 1996; Tarantini G. et al., 2006).
L-карнитин уменьшает размер зоны инфаркта, предотвращает желудочковые аритмии, дилатацию левого желудочка и сердечную недостаточность, а также улучшает выживаемость пациентов (Dinicolantonio J.J. et al., 2014).
Согласно данным Европейского общества кардиологов (ESC, 2013), в основе патогенеза ишемии миокарда лежит микрососудистая (эндотелиальная) дисфункция. L-аргинин имеет и гемодинамический, и эндотелиопротекторный эффекты. Аргинин является субстратом для образования NО-синтазы – фермента, катализирующего синтез оксида азота в эндотелиоцитах (Topcu B., Uzun M., 2013). Он способствует расширению сосудов – это увеличивает доставку кислорода, что критично важно в условиях ишемии. Аргинин оказывает защитные эффекты: антигипоксический, мембраностабилизирующий, цитопротекторный, антиоксидантный, дезинтоксикационный. Он участвует в регуляции промежуточного обмена и процессов энергообеспечения, оказывает защитное действие при реперфузионном повреждении ишемизированного сердца посредством угнетения Ca-индуцированного открытия митохондриальной поры (Шиманская Т.В. и соавт., 2009; Левченкова О.С. и соавт., 2014).
Аргинин подавляет также синтез асимметричного диметиларгинина – мощного эндогенного стимулятора оксидативного стресса. В експериментах на лабораторных животных был подтвержден защитный эффект аргинина на лизосомные ферменты и связанные с мембраной АТФазы при индуцированном ИМ (Ebenezar K. et al., 2003).
Таким образом, комплексная терапия в ранний период с использованием L-карнитина и L-аргинина является патогенетически обоснованным методом, действующим на основные активаторы митохондриальной поры и уменьшающим время и степень ее открытия, а также снижающим выраженность внутриклеточных нарушений миокарда и уменьшающим реперфузионное повреждение при острой ишемии миокарда.
Справка ЗУ
L-карнитин и L-аргинина гидрохлорид входят в состав комбинированного препарата Тиворель ® , разработанного компанией «Юрия-Фарм».
Тиворель ® является необходимым компонентом ранней терапии ОКС и применяется с первых часов непосредственно после проведения базового лечения и восстановления кровотока.
В составе комплексной терапии препарат оказывает выраженный антиишемический эффект, а также предупреждает дальнейшее повреждение кардиомиоцитов и распространение зоны некроза (Вакалюк И.П., 2016).
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (61) грудень 2018 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Сьогодні в рамках оцінки чинників ризику серцево-судинних (СС) захворювань дедалі більший інтерес наукового світу прикутий до ендотелію та його функції. Ендотелій уражається насамперед унаслідок артеріальної гіпертензії (АГ), це проявляється розвитком його дисфункції та морфологічною перебудовою артеріальної стінки. Добре відомо, що з віком підвищується судинна жорсткість, що пов’язують зі зниженням в артеріальній стінці вмісту еластину та підвищенням кількості колагену 4. У разі АГ перебіг цих процесів значно прискорюється – судинний вік починає випереджати хронологічний (паспортний). Тому дедалі більше науковців для опису функціонального та морфологічного стану серцево-судинної системи використовують термін «синдром раннього старіння судин», або EVA‑синдром (early vascular aging), як модель старіння судин, яка більш точно відображає структурні та функціональні зміни, що відбуваються в організмі в міру його старіння [1].
Ішемічна хвороба серця (ІХС) є провідною причиною інвалідизації та смертності від серцево‑судинних захворювань (ССЗ). У розвинених країнах Європи на 1 млн населення припадає 30-40 тис. хворих, які страждають на ІХС [1]. До того ж немає пояснень для показників смертності українських чоловіків і жінок, які в 14 і 23 рази більше, ніж у Франції [2]. Крім базисної терапії пацієнтів з ІХС, потенційним напрямом лікування є застосування підходів, які здатні покращити енергозабезпечення кардіоміоцитів, мікроциркуляцію та функцію ендотелію судин [3].
COVID‑19 чинить суттєвий негативний вплив на серцево-судинну (СС) систему. Наявні у пацієнтів серцево-судинні захворювання (ССЗ) до інфікування COVID‑19 та вірусне навантаження асоційовані з пошкодженням міокарда й гіршими результатами. Пандемія триває, зокрема, з’являються нові варіанти коронавірусу, тож розуміння патофізіології та відповідних клінічних наслідків допоможе розширити уявлення про основні механізми розвитку хвороби. Вирішальне значення також мають встановлення нових біомаркерів СС-ускладнень і розробка ефективних методів лікування COVID‑19. Пропонуємо до вашої уваги консенсусний документ Європейського товариства кардіологів (ESC) та Асоціації невідкладної кардіологічної допомоги (ACVC) у співпраці з Європейською асоціацією серцевого ритму (EHRA) 2021 р., у якому підсумовано сучасні відомості про ураження СС-системи на тлі COVID‑19 та його постгострі наслідки. .
Незважаючи на сучасні методи відновлення коронарного кровотоку, показники смертності після перенесеного гострого коронарного синдрому (ГКС) залишаються досить високими, що пов’язують з ушкодженням міокарда під час реперфузії. Відповідно до сучасних уявлень, провідною причиною цього явища є ішемічний каскад, який може запускати процеси загибелі кардіоміоцитів і бути відповідальним за 50% кінцевого розміру зони некрозу при ГКС, виникнення реперфузійних аритмій, систолічної мікросудинної дисфункції. Саме тому адекватне блокування ішемічного каскаду, спрямоване на елімінацію активних форм кисню, активацію антиоксидантів, на сьогодні вважається важливою складовою менеджменту пацієнтів із ГКС. .
Академик РАН и РАМН Лео Антонович БОКЕРИЯ,
президент «НМИЦ ССХ» им. А.Н. Бакулева,
главный редактор издательства Центра
Кардиохирург, ученый, педагог и организатор науки, доктор медицинских наук (1973 г.), профессор (1982 г.), академик РАМН (1994 г.), академик РАН (2011 г.), заслуженный деятель науки РФ (1994 г.), лауреат Ленинской премии (1976 г.), Государственной премии СССР (1986 г.), Государственной премии РФ (2002 г.), Премии Правительства РФ (2003 г.).
В 1994 г. Л.А. Бокерия избран по конкурсу на должность директора НМИЦССХ им. А.Н. Бакулева. В 1998 г. одновременно становится директором Центра хирургической и интервенционной аритмологии МЗ РФ.
С 1994 г. является заведующим кафедрой сердечно-сосудистой хирургии Российской медицинской академии последипломного образования (РМАПО) МЗ РФ. С 1995 г. заведует созданной им кафедрой сердечно-сосудистой хирургии № 2 Московской медицинской академии (ныне Первого МГМУ) им. И.М. Сеченова МЗ РФ.
С 2003 г. возглавляет кафедру сердечно-сосудистой хирургии и интервенционной кардиологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова МЗ РФ.
По инициативе Л.А. Бокерия в НМИЦССХ успешно функционирует учебно-исследовательский центр «Современные медицинские технологии», который ежегодно проводит 4–6 курсов последипломного повышения квалификации специалистов высшего звена.
Л.А. Бокерия выполняет весь известный арсенал операций на сердце при самой разнообразной патологии: от 3 до 6 операций в день, то есть от 700 до 900 операций с использованием искусственного кровообращения в год.
С 1996 г. он является главным кардиохирургом МЗ РФ.
Л.А. Бокерия принадлежат уникальные работы по теоретическому обоснованию и клиническому использованию метода гипербарической оксигенации в хирургии сердца и сосудов. Он крупнейший специалист в области диагностики и хирургического лечения нарушений ритма и проводимости сердца (особенно тахиаритмий), включая различные сочетания сердечных аритмий с врожденными и приобретенными пороками и аномалиями развития сердца, коронарной болезнью.
Л.А. Бокерия является инициатором развития и другого нового раздела кардиохирургии в нашей стране – минимально инвазивной хирургии сердца. Большой вклад внес Л.А. Бокерия в решение проблемы хирургического лечения ИБС.
Велика роль Л.А. Бокерия в разработке новых подходов к хирургическому лечению терминальной сердечной недостаточности. Его заслугой является разработка новых операций у тяжелой категории кардиохирургических больных с различными формами кардиомиопатий. Он первым развил концепцию динамической кардиомиопластики, в том числе и у детей. Л.А. Бокерия выполнил первую в нашей стране имплантацию искусственного желудочка сердца и после большого перерыва инициировал возобновление в Центре выполнения операций по трансплантации сердца.
По инициативе Л.А. Бокерия в клиническую практику внедрены передовые технологии диагностики и реконструктивной хирургии заболеваний восходящего отдела и дуги аорты.
Он генерировал развитие и другого направления современной медицинской науки – креативной кардиологии, которая определяет необходимость созидательного сотрудничества врачей разных специальностей: кардиологов, кардиохирургов, специалистов по функциональной диагностике, фундаментальным и прикладным дисциплинам.
Под руководством Л.А. Бокерия в Центре разрабатываются и внедряются в клиническую практику новые высокотехнологичные принципы профилактики и лечения больных с сердечно-сосудистой патологией – использование методов генной и клеточной терапии.
Академик Л.А. Бокерия проводит приоритетные исследования по созданию биопротезов клапанов сердца для коррекции клапанных пороков – низкопрофильного, изогнутого по плоскости биопротеза митрального и трикуспидального клапанов, воспроизводящего естественную форму фиброзного кольца, на упругоподатливом каркасе. Продолжено изучение эффективности защиты миокарда у детей первого года жизни при применении нового внутриклеточного кардиоплегического раствора «Бокерия – Болдырева», созданного в НМИЦССХ под руководством Л.А. Бокерия.
Л.А. Бокерия активно занимается методологией медицинской науки и педагогической деятельностью. Он является создателем крупнейшей в стране кардиохирургической школы, воспитавшим не одно поколение врачей – кардиохирургов, кардиологов, реаниматологов и специалистов других смежных специальностей.
Л.А. Бокерия – научный руководитель 350 кандидатских и консультант более 100 докторских диссертаций. Он создатель издательства НМИЦССХ им. А.Н. Бакулева с типографией, основатель и главный редактор журналов «Анналы хирургии», «Бюллетень НМИЦССХ им. А.Н. Бакулева «Сердечно-сосудистые заболевания», «Детские болезни сердца и сосудов», «Клиническая физиология кровообращения», «Анналы аритмологии», «Креативная кардиология», информационного сборника «Сердечно-сосудистая хирургия»; главный редактор журнала «Грудная и сердечно-сосудистая хирургия».
Активная деятельность Л.А. Бокерия и его вклад в отечественное здравоохранение отмечены званиями и премиями самого высокого достоинства. Он лауреат Ленинской премии (1976 г.), двух Государственных премий (1986 г. – СССР, 2002 г. – РФ), Премии Правительства Российской Федерации (2003 г.). За выдающиеся достижения Л.А. Бокерия награжден орденом «За заслуги перед Отечеством» III (1999 г.), II (2004 г.) и IV (2010 г.) степени, орденом Достоинства и Чести (Республика Грузия, 1999 г.), орденом Преподобного Сергия Радонежского II степени (2001 г.). Русский биографический институт неоднократно признавал Л.А. Бокерия «Человеком года», а в 2000 г. – «Человеком десятилетия» в номинации «Медицина». В 2002 г. он удостоен титула «Человек-легенда», общероссийской премии «Русский национальный Олимп», учрежденной Правительством, Союзом промышленников и фондом «Третье тысячелетие». Как одному из ведущих кардиохирургов мира в 2003 г. Л.А. Бокерия вручена международная премия «Золотой Гиппократ». В 2004 г. он удостоен премии РАН «Триумф» в номинации «Наука о жизни – медицина». В 2004 г. он отмечен наградным знаком – орденом «Меценат», который присуждается Благотворительным фондом «Меценаты столетия» за выдающийся вклад в дело возрождения и процветания мира, за величие души, за бескорыстную щедрость; в 2004 и 2005 г. – Золотым почетным знаком «Общественное признание», который присуждается Национальным фондом «Общественное признание», Национальным гражданским комитетом по взаимодействию с правоохранительными, законодательными и судебными органами и независимой организацией «Гражданское общество» за большой личный вклад в развитие отечественной медицины, проведение уникальных кардиохирургических операций с применением новейших медицинских технологий, спасших жизни сотен детей и новорожденных, многолетнюю и плодотворную научно-практическую, педагогическую и просветительскую деятельность, активную гражданскую позицию.
В 2006 г. Л.А. Бокерия награжден Почетным алмазным орденом «Общественное признание», удостоен диплома Президиума Парламента народов России «за спасение многочисленных жизней, выдающиеся знания, умение руководить, за уникальные личные качества – благородство, мужество, чувство долга, умение беречь честь и достоинство, держать слово и делать дело, в также за веру в великое будущее Отечества», Золотой медали – за выдающийся вклад в образование России и Золотой звезды «Честь, гордость и слава России».
В 2008 г. Л.А. Бокерия награжден медалью «За практический вклад в укрепление здоровья нации», Орденом Чести с присуждением звания «Опора честного бизнеса» и почетного титула «Выдающийся кардиохирург современности». В 2009 г. огромный вклад Л.А. Бокерия в науку и отечественное здравоохранение отмечен присуждением ему Премии имени А.Н. Косыгина «За большие достижения в решении проблем развития экономики России» и премии города Москвы в области медицины «за разработку и внедрение в клиническую практику нового биологического клапана «Биоглис».
Л.А. Бокерия – действительный член Американской ассоциации торакальных хирургов (1991 г.), член правления (1992 г.) и член Президиума (с 2003 г., консул) Европейского общества грудных и сердечно-сосудистых хирургов, член правления Европейского общества сердечно-сосудистых хирургов, член научного правления Международного кардиоторакального центра Монако (1992 г.), член Сербской академии наук (1997 г.), почетный член Американского колледжа хирургов (1998 г.), академик АМН Украины, почетный профессор МГУ им. М.В. Ломоносова (2011 г.), иностранный член Национальной Академии наук Грузии (2012 г.).
Он президент Ассоциации сердечно-сосудистых хирургов России (1995 г.), президент Общероссийской общественной организации «Лига здоровья нации» (2003 г.), член Общественной палаты РФ всех созывов.
Читайте также:
