Репродукция ДНК-вирусов. Репликативный цикл ДНК-содержащих вирусов. Репродукция паповавирусов. Репродукция аденовирусов.
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Аденовирусы (греч. aden — железа + вирусы) — группа возбудителей респираторных и других заболеваний, включающая около 50 разновидностей (серотипов), выделенных от людей, обезьян, собак, рогатого скота, грызунов и птиц. Резистентны к действию эфира и кислот, обладают общим групповым комплементсвязывающим антигеном, эпителиотропны.
Вызывая по преимуществу заболевания дыхательных путей, аденовирусы, в отличие от других респираторных вирусов, значительно чаще поражают другие системы организма: конъюнктиву, лимфатические узлы, желудочно-кишечный тракт (см. Аденовирусные болезни). Легко преодолевая желудочный барьер в связи с резистентностью к кислотам, аденовирусы интенсивно размножаются в кишечнике.
Первые штаммы аденовирусов стали известны благодаря исследованиям Роу, Хюбнера, Гилмора, Парротта и Уорда (W. P. Rowe, R. J. Huebner, L. Gilmore. R. Parrott, Т. E. Ward, 1953), посвященным изучению цитопатогенного агента, выделенного из аденоидной ткани человека. Аденоидная ткань, извлеченная оперативным путем, культивировалась во вращающихся пробирках в среде, содержащей смесь коровьей амниотической жидкости (85%), эмбрионального экстракта (10%) и сыворотки (5%). Было замечено, что в такой культуре происходит спонтанная дегенерация клеток на 7—10-й день наблюдения. Последующие пассажи дегенерировавшей ткани на клетках перевиваемой линии HeLa и других тканях выявили наличие вируса, обладающего своеобразными свойствами. Выделенные новые штаммы вируса от клинически здоровых детей были отнесены к группе «латентных» и получили название «агентов аденоидной дегенерации». Вскоре было установлено, что такие же вирусы часто обнаруживаются не только в аденоидной ткани и миндалинах клинически здоровых детей, но и выделениях больных острым фарингитом и конъюнктивитом. Тогда вирусы получили второе название «аденоидно-фаринго-конъюнктивальных вирусов».
Независимо от первых исследователей Хиллеман и Вернер (1954), изучая этиологию заболеваний органов дыхания у военнослужащих, нашли, что часть заболеваний, протекающих по типу острых катаров дыхательных путей и атипичных пневмоний, связана с новым, ранее неизвестным вирусом, названным R1-67. Этот вирус удалось выделить от больных и вырастить в культуре ткани, в частности в клетках HeLa. В дальнейшем обе группы исследователей показали сходство изучаемых вирусов и нашли, что они могут быть выделены как от здоровых людей, так и от больных различными заболеваниями с преимущественным пораженцем дыхательных путей.
Первоначальные названия вирусов были заменены в 1956 году общим групповым названием «аденовирусы». В наст. время известно не менее 32 серотипов аденовирусов, выделенных от человека.
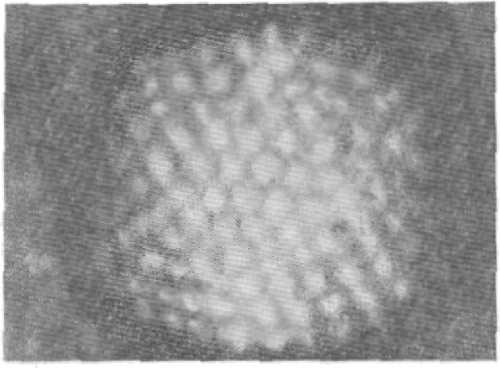
Рис. 2. Внутренние субъединицы вириона — капсомеры (негативное контрастирование фосфорно-вольфрамовой кислотой).
Содержание
Действие физических и химических факторов
Адновирусы инактивируются прогреванием и t° 56° в течение 5 мин. или 20— мин. при t° 50°; сохраняют активность в течение 7 дней при t°36°, 14 дней — при t° 22—23°, 70 дней — при t° 4°. Устойчивы в кислой зоне pH от 6,5 до 3,0; при pH 1,5—2,5 частично инактивируются в течение 30 мин. при t° 36 . При комнатной температуре хорошо сохраняются в зоне pH от 6,0 до 9,5, более чувствительны к повышению щелочной, чем кислой, границы pH. Резистентны к органическим растворителям (эфиру, хлороформу, флуорокарбону), а также к трипсину, папаину, рибонуклеазе, дезоксирибонуклеазе и к желчи.
Антигенная структура
С помощью хроматографии и электрофореза выделены три различных растворимых антигена, отличающихся по иммунологическим свойствам и связанных с различными морфологическими субъединицами вируса.
1. А-антиген, гексон,— групповой, общий для всех серотипов вируса антиген, локализованный в 240 капсомерах капсида, каждый из которых граничит с шестью соседними капсомерами, что определило название антигена (hexon). Антитела против очищенного гексонного антигена нейтрализуют инфекционные свойства только гомологичного серотипа. В то же время эта сыворотка реагирует в реакции связывания комплемента с любыми гетерологичными серотипами, так как в составе гексонного антигена имеются две реактивные группы, одна из которых стимулирует образование группоспецифических, а другая — типоспецифических антител.
2. В-антиген, пентон,— токсический антиген, вызывающий округление и скучивание (агрегация) чувствительных клеток однослойной культуры и отделение клеток с поверхности стекла. Локализован в капсомерах, расположенных на вершине двенадцати угловых участков вириона, каждый из которых граничит с пятью соседними капсомерами (pepton). Чувствителен к действию трипсина. Ингибирует активность интерферона (см.) и повышает тяжесть ассоциированных респираторных инфекций.
3. С-антиген — нитевой (fiber) антиген, имеет морфологически форму нити с узловым утолщением, прикрепленной к пентонному антигену. Представляет собой типоспецифический антиген, устойчив к действию трипсина, способствует адсорбции аденовирусов на эритроцитах обезьяны или крысы и их агглютинации.
Цикл размножения
Адсорбция аденовирусов на чувствительных клетках тканевой культуры занимает 4—6 час., после чего вирус проникает в цитоплазму с помощью пиноцитоза. Освобождение нуклеоида (депротеинизация) осуществляется в пиноцитарных вакуолях в течение 60—90 мин., вслед за чем вирусная ДНК транспортируется к ядру клетки. Латентный период репродукции продолжается от 13 до 15 час., когда в ядре синтезируется ДНК, а на цитоплазматических рибосомах — вирусные белки. Через 16 час. после заражения возникают зрелые структурные частицы, сборка которых происходит в ядрах клеток. Но более 10—15% вирусных ДНК и белков тканевой культуры используется для синтеза вирионов, вся остальная масса стимулирует поражения ядер клетки и нарушения синтеза клеточных ДНК и белков, с прекращением деления клеток через 10—11 час. после заражения культуры.
Максимальный выход вируса обеспечивается в случае массивного заражения и инкубации культуры до полного развития цитопатических поражений. Для получения максимального выхода вируса из достаточно сохранившихся клеток их разрушают повторным 3—6-кратным замораживанием и оттаиванием, гомогенизируют ультразвуком или механическим размалыванием. При этом концентрация вируса колеблется в зависимости от серотипа от тысяч до миллиардов частиц в 1 мл тканевой жидкости.
Размножение аденовирусов в тканевых культурах очень часто сопровождается параллельным развитием в ядрах клеток мелких вирионов диаметром около 200 А, икосаэдральной симметрии, получивших наименование аденоассоциированных вирусов (см.). По антигенной структуре и биологическим свойствам они не имеют ничего общего с аденовирусами. Размножение аденоассоциированных вирусов находится в полной зависимости от присутствия аденовирусов, оказавшихся «помощниками» этих, не способных к самостоятельному развитию агентов.
Клеточные поражения
Зараженные аденовирусами клетки округляются и формируют гроздевидные скопления различной величины, облегчающие распознавание агентов данной группы. Цитопатические изменения сопровождаются повышением гликолиза и скоплением органических кислот, подкисляющих тканевую жидкость.
Клеточный лизис отсутствует и зараженные клетки длительное время сохраняют жизнеспособность.
Рис. 3. Цитопатогенное действие аденовирусов на перевиваемые клетки амниона человека: 1 — незараженные клетки; 2 — начальная фаза дегенерации; 3 — конечная фаза дегенерации.

В процессе дегенерации клеток под действием аденовирусов различают две фазы (рис. 3): первая связана с токсическим эффектом, вторая — с истинным размножением вирусов, которое происходит внутри ядер и в цитоплазме. При этом аденовирусы образуют внутриядерные включения из вирусных частиц, которые составляют агломераты кристаллоподобного строения (рис. 4).
Электронномикроскопические исследования Перейры и Валентина (Н. G. Pereira, R. С. Valentine, 1958) показали, что одна цитопатогенная доза вируса содержит от 10 до 103 вирусных частиц.
Размножение в перевиваемых линиях клеток КВ, HeLa, а также в почечных культурах обезьян под агаровым покрытием сопровождается формированием видимых глазом колоний (бляшек) в районе пораженных клеток.
Гемагглютинирующие свойства
Все серотипы аденовируса человека, кроме типа 18, способны агглютинировать эритроциты обезьян резус или крыс. По этому признаку аденовирусы можно классифицировать на следующие четыре подгруппы: первая включает девять серотипов (3, 7, 11, 14, 16, 20, 21, 25, 28), агглютинирующих только эритроциты обезьян; вторая включает двенадцать серотипов (8, 9, 10, 13, 15, 17, 19, 22, 23, 24, 26, 27), агглютинирующих эритроциты крыс; третья — шесть серотипов (1, 2, 4, 5, 6, 12), агглютинирующих эритроциты крыс после взаимодействия с иммунной аденовирусной сывороткой против других типов (например, 6 типа); четвертая включает серотип 18, не способный к гемагглютинации.
Патогенность для человека и животных
В отличие от других респираторных вирусов, аденовирусы размножаются не только в цилиндрическом мерцательном эпителии верхних дыхательных путей, трахеи и бронхов, но и в под слизистой оболочке. С участием аденовирусов наиболее часто связано развитие острой респираторной инфекции, протекающей с явлениями ангины, фарингита, кашля, озноба, боли в мышцах, головной боли, при непостоянном насморке и повышении температуры (см. Аденовирусные болезни, Респираторные вирусные болезни).
Наиболее частыми возбудителями оказались первые семь серотипов, а также типы 14 и 21. У грудных детей часто развиваются тяжелые пневмонии, изредка с детальным исходом, вызванные серотипами 1, 2, 3, 7 и 7а.
Еще недавно считалось общепризнанным положение об отсутствии у аденовирусов человека патогенности для животных.
Многочисленные опыты заражения многих видов млекопитающих, включая обезьян, давали либо отрицательные, либо сомнительные результаты. Это остается справедливым для обычных условий получения экспериментальной инфекции, однако при изменении методов исследования получены новые данные. Дженнингс и Беттс (A. R. Jennings, А. О. Betts, 1962) адаптировали аденовирусы 1, 2, 4 и 6 серотипов к культуре ткани свиной почки. Затем интратрахеально заражали поросят, рожденных и выращенных в стерильных условиях в безмикробной внешней среде. На 4-й день после заражения у большинства животных развилась бронхопневмония с выраженной лимфоидной гиперплазией.
Интраназальное или подкожное заражение взрослых сирийских хомяков, собак, кроликов, а также новорожденных мышей и крыс вирусами 3, 4, 5, 7, 12, 18 типов приводило к развитию бессимптомных инфекций.
Заражение новорожденных хомяков серотипом 5 вызывало, по данным Перейры, смерть животных через 4 дня с типичными поражениями легких и выделением вируса. Патогенность для обезьян выделяющихся от них аденовирус не доказана.
В ряде лабораторий нередко выделяются аденовирусы от больных вирусным гепатитом как из кала, так и из крови. Возможно, аденовирусы являются спутниками истинного возбудителя, но нельзя исключить и наличие у некоторых штаммов определенного гепатотропизма. Заслуживает внимания работа Л. Г. Руденко и др. (1972), где показана восприимчивость новорожденных хомяков в возрасте до 5 суток к аденовирусу 1 типа (штамм 1237) при подкожном заражении. У зараженных хомяков развивается гепатит и происходит избирательная репродукция вируса в печени.
Онкогенные свойства
Способность аденовирусов человека вызывать развитие злокачественных опухолей (сарком) у новорожденных сирийских хомяков, зараженных подкожно массивной дозой активного вируса, впервые выявлена у серотипа 12. Онкогенные свойства подтверждены сейчас у семи других типов аденовирусов человека, а также у шести типов от обезьян и у одного от птиц. Наибольшую активность проявили серотипы 12, 18 и 31; тип 12 вызывал опухолевый рост, помимо хомяков, также у новорожденных крыс, диких африканских грызунов Mastomys и некоторых линий мышей. В образовавшихся опухолях инфекционные частицы аденовирусов отсутствовали.
Злокачественная трансформация клеток наблюдалась также в опытах in vitro при заражении типом 12 нормальных эпителиальных клеток культуры почек новорожденных сирийских хомяков, а также фибробластов зародыша крысы. Через 3—10 нед. после инокуляции культур массивной дозой вируса развивался рост опухолевых клеток, свободных от инфекционного вируса. Клетки, трансформированные in vivo или in vitro, содержали два новых антигена: Т-антиген (неоантиген) и трансплантационный (TSTA) антиген. Их продукция индуцируется частью ДНК опухолеродного А. Весьма большой мол. вес ДНК аденовируса (более 20 млн. дальтон) обеспечивает возможность кодирования синтеза более 50 различных белков. Т-антиген, обнаруживаемый нерегулярно в ранние этапы обычной цитолитической инфекции, постоянно присутствует в опухолевых клетках и стойко передается при их культивировании in vitro. Обнаруживается в реакции связывания комплемента и по иммунофлуоресценции с сыворотками хомяков с развивающейся опухолью, которые не взаимодействуют со структурными белками вирусов. Т-антиген малоустойчив к нагреванию, воздействию кислоты и щелочи, не содержит РНК или ДНК, имеет мол. вес 78 000 дальтон.
По антигенным свойствам различают Т-антиген группы А (высокоонкогенные аденовирусы 12, 18 и 31 серотипов) и группы В (слабоонкогенные аденовирусы 3, 7, 11, 14, 16 и 21 серотипов). Попытки обнаружить Т-антиген групп А и В в опухолевых клетках и гомологичные для них антитела в сыворотках людей, болеющих раком различной локализации, дали отрицательный результат. В опухолевой ткани хомяков этот антиген присутствует в весьма высокой концентрации и легко обнаруживается с помощью флуоресцирующих антител в каждой опухолевой клетке.
Выделение аденовирусов осуществляется заражением чувствительных тканевых культур отделяемым из полости носа, зева, конъюнктивы, а также кишечным содержимым. Аденовирусы лучше размножаются (с развитием характерных цитопатических изменений) в перевиваемых эпителиальных культурах (HeLa, КВ, НЕр-2), а также в первичной культуре эмбриональной почки человека; слабее размножаются в первичных эпителиальных культурах человеческой трахеи, амниона, почечной ткани обезьян и кроликов. Оптимальный метод выделения — заражение первичной клеточной культуры эмбриональной почки человека с пассажами на перевиваемых линиях после адаптации вируса.
Серологическая идентификация выделенных штаммов
Для отнесения к группе аденовирусов выделенные агенты дифференцируются иммунологически путем установления общего группового антигена в РСК или в реакции преципитация (по методу диффузия в агаровом геле). Определение серотипа проводится с помощью реакции торможения гемагглютинации или нейтрализации. Для идентификации серотипа выделенного штамма определяют его принадлежность к одной из четырех подгрупп по гемагглютинации, после чего ставят реакцию торможения гемагглютинации (РТГА) с иммунными сыворотками кроликов или лошадей, обработанными каолином и истощенными чувствительными для данной подгруппы эритроцитами. Результаты РТГА проверяют в реакция нейтрализация на тканевых культурах с гомологичной иммунной сывороткой (см. Вирусологические исследования).
В современной классификации вирусов человека аденовирусы занимают самостоятельное положение среди ДНК-содержащих вирусов, четко дифференцируясь от других сочленов этой группы по свойствам вирионов.
Библиография
Руденко Л. Г. и др. Динамика репродукции аденовируса в печени новорожденных хомяков и изменение гуморальных факторов иммунитета при экспериментальном аденовирусном гепатите, Вопр. вирусол., № 3, с. 269, 1972; Смородинцев А. А. и Коровин А. А. Грипп, с. 73, Л., 1961, библиогр.; Шубладзе А. К. и др. Некоторые итоги изучения штаммов вирусов, выделенных от больных эпидемическим гепатитом, Всстн. АМН СССР, № 6, с. 49, 1963; Buescher Е. L. Respiratory disease and adenoviruses, Med. Clin. N. Amer., v. 51, p. 779,1967; Enderb J. P. a. o. Adenoviruses, Science, v. 124, p. 119, 1956; Ginsberg H. S. Identification and classification of adenoviruses, Virology, v. 18, p. 312, 1962, bibliogr.; Hilleman M. R. a. Werner J. H. Recovery of a new agent from patients with acute respiratory illness, Proc. Soc. exp. Biol. (N. Y.), v. 85, p. 183, 1954, bibliogr.; HuebnerR. J., Rowe W. P. a. Сhanосk R. M. Newly recognized respiratory tract viruses, Ann. Rev. Microbiol., v. 12, p. 49. 1958, bibliogr.; Pereira H. G. a. Valentine R. C. Infectivity titrations and particle counts of adenovirus type 5, J. Gen. Microbiol., v. 19, p. 178, 1958, bibliogr.; Rose H. M. Adenoviruses, в кн.: Diagnostic rocedures for viral a. ricket. infections, ed. у E. H. Lennette a. N. J. Schmidt, p. 205, N. Y., 1969;Rosen L. Hemagglutination-inhibition techniques for typing adenoviruses, Amer. J. Hyg., v. 71, p. 120, 1960; Sohier R., C hard onnet Y. a. Prunieras M. Adenoviruses. Progr. med. Virol., v. 7, p. 253, 1965, bibliogr.
Репродукция ДНК-вирусов. Репликативный цикл ДНК-содержащих вирусов. Репродукция паповавирусов. Репродукция аденовирусов.
Репродукция герпесвирусов. Репликативный цикл герпесвирусов. Поксвирусы. Репродукция поксвирусов.
Основные отличия репродуктивного цикла герпесвирусов от остальных ДНК-вирусов связаны с более сложной структурой генома. Адсорбция вирусов на клетках осуществляется через специфические рецепторы. После взаимодействия с рецепторами вирусная оболочка сливается с клеточной мембраной, а нуклеокапсид высвобождается в цитоплазму. Раздевание (депротеинизация) вирусного генома происходит на ядерной мембране, и вирусная ДНК оказывается в ядре клетки-хозяина. Репродукция включает раннюю и позднюю стадии, однако они разграничиваются нечётко.
Ранняя стадия репродукции герпесвирусов. В ранней стадии синтезируются «ранние белки», кодируемые проксимальной третью молекулы ДНК. Они проявляют регуляторные свойства, включая активацию транскрипции других участков вирусного генома, кодирующих ДНК-полимеразу и ДНК-связывающие белки.
Поздняя стадия репродукции герпесвирусов. В позднюю стадию вирусная ДНК-полимераза индуцирует репликацию материнской ДНК. В результате образуются молекулы ДНК дочерней популяции. Часть дочерней ДНК считывают клеточные полимеразы, что вызывает транскрипцию концевых генов, кодирующих структурные протеины (белки оболочки и гликопротеины шипов).
Сборка дочерних популяций герпесвирусов осуществляется в ядре, где капсидные белки окружают молекулы ДНК, формируя нуклеокапсиды. Финальная стадия морфогенеза герпесвирусов — формирование суперкапсида на внутренней поверхности ядерной мембраны. Зрелые дочерние популяции отпочковываются от модифицированной ядерной мембраны, транспортируются через цитоплазму и выделяются наружу.

Поксвирусы. Репродукция поксвирусов.
Поксвирусы обладают наиболее сложным репродуктивным циклом, при этом синтезируется более 100 различных белков, входящих в состав вирионов (большинство образует наружную оболочку). Репродукция поксвирусов характеризуется следующими особенностями.
• Транскрипция ДНК начинается до полной депротеинизации вируса, так как она полностью осуществляется вирусными полимеразами.
• Репликация происходит только в цитоплазме и полностью независима от клеточных полимераз, так как, в отличие от прочих вирусов, поксвирусы имеют собственную ДНК-зависимую РНК-полимеразу, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий.
В репродуктивном цикле выделяют три стадии— начальную, раннюю и позднюю.

Рис. 5-4. Репликативный цикл ДНК-содержащих вирусов (на примере репродукции вируса герпеса). После адсорбции (1) вирус проникает в клетку путём слияния с мембраной (2). Нуклеокапсид транспортируется к ядерной оболочке (3), и вирусная ДНК (вДНК) проникает в ядро клетки, где начинается её транскрипция клеточной ДНК-зависимой РНК-полимеразой (4). Вначале транскрибируются «ранние гены». В результате трансляции «ранней порции» вирусного генома синтезируются «ранние белки» (5), включая регуляторные, матричные и вирусные полимеразы. Вирусная полимераза проникает в геном клетки (6), где запускает синтез молекул ДНК дочерних популяций (7). Часть вирусной ДНК («поздние гены») дочерних популяций транскрибируется клеточной РНК-полимеразой (8), что приводит к синтезу «поздних белков» (9), необходимых для сборки дочерних популяций (10). Последние покидают ядро, отпочковываясь от его мембраны (11), фрагменты которой содержат в составе своей обопочки.
Начальная стадия репродукции поксвирусов запускается сразу же после раздевания вируса и выхода вирусной ДНК в цитоплазму.
Ранняя стадия репродукции поксвирусов. На этом этапе транскрибируется примерно половина вирусной ДНК. Синтезируются ферменты, кодируемые «ранними генами» и участвующие в репликации вирусной ДНК. Параллельно в небольшом количестве образуются структурные белки.
Поздняя стадия репродукции поксвирусов совпадает с началом репликации ДНК (что переключает механизмы транскрипции на считывание второй половины генома). Регуляторные белки блокируют трансляцию «ранней мРНК» и запускают синтез поздних (структурных) белков. Сборка вирионов осуществляется только в цитоплазме посредством реакций мембранного синтеза. Высвобождение зрелых популяций сопровождается лизисом клетки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусы, лишённые суперкапсида (например, аденовирусы) проникают в клетки путём виропексиса, а имеющие таковой (покс- и герпесвирусы) — за счёт слияния суперкапсида с клеточной мембраной. Репродуктивный цикл ДНК-содержащих вирусов включает раннюю и позднюю стадии (рис. 5-4). У крупных ДНК-вирусов имеется явное несоответствие между кодирующе ёмкостью генома и молекулярной массой вирусиндуцированных белков и белков, входящих состав вирионов. Например, у герпесвирусов лишь 15% ДНК кодирует все белки вирионов и их предшественников. Возможно, значительная часть генома содержит гены, кодирующие синтез ферментов и регуляторных белков. Папова-, адено- и герпесвирусы репродуцируются относительно однотипно, в то время как репродукция поксвирусов имеет некоторые особенности.
Ранняя стадия репродукции. Вирусная ДНК проникает в ядро клетки, где транскрибируется клеточной ДНК-зависимой РНК-полимеразой. При этом считываетеся, а затем транслируется часть вирусного генома («paнние гены»). В результате синтезируются «ранние белки» (регуляторные и матричные белки вирусные полимеразы).
Регуляторные белки выполняют различные функции. При заражении клетки они блокируют синтез клеточных РНК, ДНК и белка и одновременно способствуют экспрессии вирусного генома, изменяя специфичность реагирования клеточных полимераз и полирибосом. Они так же запускают репликацию клеточной ДНК, модифицированной встроенными геномами ДНК содержащих вирусов и ретровирусов, то есть репликацию вирусных геномов. Вирусспецифические полимеразы. В репликацию вирусных геномов также вовлечены вирусоспецифические ДНК-полимеразы, участвующие в образовании молекул ДНК дочерних популяций.

Матричные белки необходимы для репликации нуклеиновых кислот и сборки дочерних популяций. Они образуют электронно-плотные скопления в клетке, известные как тельца включений (например, тельца Гварнери при натуральной оспе).
Поздняя стадия репродукции. На этом этапе происходит синтез нуклеиновых кислот вируса. Не вся вновь синтезированная вирусная ДНК упаковывается в вирионы дочерней популяции. Часть ДНК («поздние гены») используется для синтеза «поздних белков», необходимых для сборки вирионов. Их образование катализируют вирусные и модифицированные клеточные полимеразы.
Паповавирусы и аденовирусы. Репродукция паповавирусов. Репродукция аденовирусов.
Адсорбция, проникновение и депротеинизация аналогичны таковым у РНК-содержащих вирусов, но у папова- и аденовирусов депротеинизация протекает в ядре, а у РНК-вирусов — в цитоплазме.

Ранняя фаза репродукции. Вирусная ДНК («ранние гены») транскрибируется в ядре клетки. На одной из нитей ДНК реализуется транскрипция вирусной «ранней» мРНК. Механизмы транскрипции вирусной ДНК аналогичны считыванию информации с клеточной ДНК. Специфическая мРНК транслируется, начинается синтез ферментов, необходимых для образования дочерних копий ДНК. Синтез клеточной ДНК может временно усиливаться, но затем обязательно подавляется регуляторными белками вируса.
Поздняя фаза репродукции. В течение поздней фазы дочерняя вирусная ДНК продолжает активно транскрибироваться клеточными РНК-полимеразами, в результате чего появляются продукты поздних вирусспецифических синтезов. «Поздняя» мРНК мигрирует в цитоплазму и транслируется на рибосомах. В результате синтезируются капсидные белки дочерней популяции, которые транспортируются в ядро и собираются вокруг молекул дочерней ДНК новых вирусных частиц. Выход полных дочерних популяций сопровождается гибелью клетки.
Типы инфицирования клеток вирусами. Репродуктивный цикл вирусов. Основные этапы репродукции вирусов. Адсорбция вириона к клетке.
По характеру взаимодействия генома вируса с геномом клетки выделяют автономное (геном вируса не интегрирован в геном клетки) и интеграционное (геном вируса интегрирован в геном клетки) инфицирование. Особую форму составляют латентное и персистирующее инфицирование.
Латентное инфицирование клеток вирусам. ДНК некоторых вирусов (герпесвирусы, ретровирусы) может находиться в клетке вне хромосом, либо вирусная ДНК интегрируется в ядерный геном, но вирусспецифические синтезы не происходят. Такая вирусная ДНК образует латентный провирус, реплицирующийся вместе с хромосомой. Подобные состояния вирусной ДНК нестабильны, возможны периодические реактивации с переходом в продуктивное взаимодействие «вирус-клетка», либо клетка трансформируется, давая начало злокачественному росту.

Персистирующее инфицирование клеток вирусам. Некоторые РНК-вирусы могут вызывать персистиру-ющие инфекции, проявляющиеся образованием дочерних популяций возбудителя после завершения острой фазы болезни. При этом происходит постепенное выделение вирусных частиц, но инфицированная клетка не лизируется. Нередко дочерние популяции вирионов дефектны (часто наблюдают у лиц с иммунодефицитами). Иногда такие хронические поражения протекают без клинических проявлений. В частности, вирус гепатита В способен вызывать персистирующее поражение гепатоцитов с развитием хронического гепатита; в дальнейшем возможна малигнизация клеток.
Репродуктивный цикл вирусов
Изображённые на рис. 2-3 этапы репродукции (от адсорбции вирионов до высвобождения дочерней популяции) происходят при продуктивном взаимодействии вируса с клеткой.

Рис. 2-3. Основные этапы репродукции вирусов.
Адсорбция вириона к клетке
Первая стадия репродуктивного цикла — адсорбция вириона на поверхности инфицируемой клетки. Адсорбция происходит путём взаимодействия вириона со специфическими клеточными рецепторами. За распознавание рецепторов ответственны белки, входящие в состав капсида либо суперкапсида. Таким образом, понятие «тропизм вирусов» объясняется специфическим взаимодействием вирусных белков с поверхностными рецепторами инфицируемой клетки. Например, полиовирус проникает в клетки центральной нервной системы (ЦНС) и желудочно-кишечного тракта (ЖКТ) и размножается в них, так как у человека и приматов только эти клетки имеют рецепторы к белкам полиовирусов,
• Процесс адсорбции не зависит от температуры (то есть не требует энергетических затрат) и протекает в две фазы; фаза ионного притяжения обусловлена неспецифическим взаимодействием, фаза прикрепления происходит благодаря структурной гомологии либо комплемен-тарности взаимодействующих молекул.
• Количество инфекционных вирусных частиц, адсорбированных па клетке, определяет термин «множественность заражений» (инфицирования). Обычно животная клетка содержит около 50 000 рецепторов, и её заражение носит множественный характер, то есть на клетке может сорбироваться большое количество вирионов. Тем не менее инфицированная вирусом клетка обычно толерантна к повторному заражению гомологичным вирусом.
ПАПОВАВИРУСЫ
ПАПОВАВИРУСЫ (Papovaviridae) — семейство, объединяющее группу ДНК-содержащих вирусов. Название образовано из первых слогов названий вирусов, первоначально составлявших эту группу: па (pa) — вирус папилломы (papilloma), по (po) — вирус полиомы (polyoma) и ва (va) — обезьяний вакуолизирующий вирус.
П. вызывают латентную и хроническую формы инфекции. Онкогенные свойства большинства из них выявлены в экспериментах на животных. Нек-рые П. обусловливают развитие первичных злокачественных опухолей у новорожденных грызунов вскоре после их заражения. В естественных условиях у диких и домашних животных П. вызывают одиночные доброкачественные опухоли, к-рые могут малигнизироваться; П. обладают высокой специфичностью по отношению к хозяину. Паразитируют П. на животных; нек-рые из них, напр, вирусы папилломы, поражают и человека (см. Папиллома, папилломатоз).

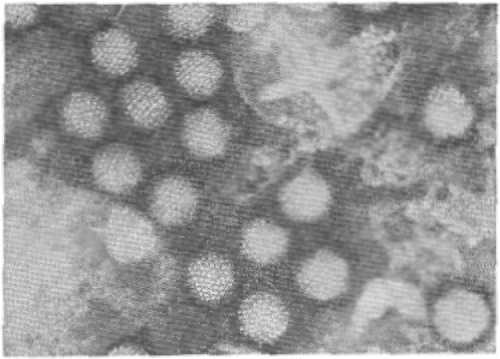
Рис. 1. Электронограмма вируса папилломы человека (негативное контрастирование): а— «полные» вирионы; б— «пустые» вирусные частицы, не содержащие дезоксирибонуклеиновой кислоты (ДНК); Х 200 000.
Вирионы П. представляют собой небольшие изометрические частицы. Оболочка у П. отсутствует, капсид имеет косую икосаэдрическую структуру, построенную из 72 капсомеров, представляющих собой полые цилиндры длиной 7,5 — 10 нм. Описаны также филаментозные формы П. и пустые сферические частицы (у них отсутствует ДНК) с плавучей плотностью 1,29 г/см 3 (рис. 1).

Рис. 2. Электронограмма ДНК, выделенной из вируса папилломы человека: стрелками указаны сверхспирализованные циклические молекулы.
Геном П. представлен циклической молекулой двухнитчатой сверх-спирализованной ДНК (рис. 2) с молекулярным весом (массой) 3—5 X 106 дальтон. Нуклеиновая к-та, выделенная из многих вирусов, обладает инфекционными и трансформирующими свойствами; разрыв одной из цепей не влияет на эти свойства.
П. термостабильны: нагревание при t° 50° в течение часа практически не отражается на титре вирусов и только при t° 70—80° достигается полная инактивация. Термоустойчивость П. снижается при добавлении солей магния. Они устойчивы в кислой среде (до pH 3,0). Углеводы и липиды в вирионах не обнаружены, что, в частности, объясняет их нечувствительность к жирорастворителям (эфиру). Додецилсульфат натрия нарушает целостность структуры вирионов. Ряд П. обладает гемагглютинирующей активностью, взаимодействуя с рецепторами эритроцитов, разрушаемыми нейраминидазой. Сам названный фермент у П. отсутствует. Групповые антигены у П. не выявлены.
Цикл репродукции П. осуществляется в ядрах инфицированных клеток позвоночных, характерно длительное протекание этого цикла, имеющего продолжительный латентный период: новый вирус появляется только через 24 часа, максимальное накопление вируса и цитопатические изменения в культуре клеток отмечаются в период от 1 до 2—3 нед.
В состав семейства П. входят два рода: папилломавирусы и полиомавирусы.
Род папилломавирусов — Papillomavirus (лат. papilla сосок + —oma). Типовой вид — вирус папилломы кроликов (вирус Шоупа). В состав рода входят также вирусы папиллом (бородавок) человека и различных животных: (коров, собак, хомяков и др.)-У отдельных хозяев выявляют различные серотипы возбудителей папиллом, что, по-видимому, будет использовано при разработке классификации вирусов этого рода.
Папилломавирусы имеют в диаметре 55 нм, вес 28 X Ю6 дальтон* характеризуются плавучей плотностью 1,34 г/см 3 и коэффициентом седиментации 296—300 S. Молекулярный вес ДНК (составляет ок. 10% веса вириона) 5 X 106 дальтон, содержание гуанина и цитозина от 41% (вирус человека) до 48—49% (вирус кроликов). Инфекционность ДНК установлена только для вируса папилломы кроликов. Метод гибридизации не выявляет гомологии между ДНК различных вирусов этого рода.
Белки папилломавирусов изучены плохо. Перекрестные серол, реакции в иммунодиффузионных тестах вирусов папиллом собак, человека, коров и кроликов дают отрицатель ный ответ, что свидетельствует об отсутствии типоспецифических ал-тигенов.
Процесс репродукции папиллома-вирусов изучен мало. Известно, что вирус образуется в ядре, где синтезируется его ДНК и аккумулируются структурные белки. Патогенность каждого вируса ограничивается его естественным хозяином и проявляется образованием папиллом, к-рые могут перерождаться в карциномы. Инфицирование животных происходит через травматические повреждения кожи. Доказана возможность механической передачи вируса папилломы кроликов членистоногими.
Вирус папилломы кроликов широко распространен среди диких американских кроликов (Sylvilagus floridanus), у к-рых он вызывает крупные, довольно длительно существующие кератизированные опухоли кожи («рога»), имеющие эпителиальное происхождение. Домашние кролики (Oryctolagus cuniculus) легко заражаются этим вирусом, вследствие чего и у них развиваются сходные опухоли. В отличие от папиллом диких кроликов, в к-рых формируются вирионы, в папилломах домашних кроликов репродукция этого вируса отсутствует. Спустя 4—9 мес. папилломы перерождаются в плоскоклеточный рак, что наблюдается как в эксперименте у диких и домашних кроликов, так и в естественных условиях у диких кроликов. В образовавшихся карциномах вирусы обычно уже не синтезируются. Особенностью вируса папилломы кроликов является возможность выделения инфекционной нуклеиновой к-ты из клеток опухоли, не содержащих соответствующий вирус.
Вирус папилломы крупного рогатого скота морфологически идентичен вирусу папилломы кроликов. Как интактный вирус, так и выделенная из него ДНК трансформируют бычьи и мышиные клетки (с низкой эффективностью).
Вирус папилломы человека вызывает возникновение контагиозных папиллом и морфологически идентичен названным выше папилломави-русам. Частота трансформации клеток человека в культуре чрезвычайно низка. Папилломы возникают из одной зараженной клетки базального эпителия, клетки делятся, и клональные потомки исходной зараженной клетки образуют папиллому. Вовлечения соседних базальных клеток в папиллому не происходит, очевидно, вследствие отсутствия в них инфекционного вируса, к-рый обнаруживается лишь в клетках, начавших кератинизироваться.
Род полиомавирусов— Polyomavirus (греч. poly много + -oma). Типовой вид — вирус полиомы мышей (полиомави-рус типа 1, вирус SE-полиомы мышей). В состав рода входят также обезьяний вакуолизирующий вирус (ОВ40 или SV40, где S от англ. simian обезьяний, а V от virus) — полиомавирус типа 2; вирус К (полиомавирус типа 3); кроличий вакуолизирующий вирус (полиомавирус типа 4); вирус ВК, выделенный из мочи человека после трансплантации почки (полиомавирус типа 5); вирус GC, выделенный от человека с прогрессивной множественной лейкоэнцефалопатией (полиомавирус типа 6).
Изучение полиомавирусов человека началось в 1971 г., когда они впервые были обнаружены в тканях человека. Ок. 70% взрослых людей имеют к ним антитела. Считают, что первичное заражение полиомавирусами происходит в период раннего детского возраста. В последующем полиомавирусы находятся у человека в латентном состоянии и могут выявляться при снижении иммунного статуса вследствие хрон, болезней, врожденных дефектов, беременности или химиотерапии. Вирус локализуется в мозге и мочевыводящих путях. Выделение вируса из организма происходит с мочой. Этиол, роль полиомавирусов в патологии человека неясна. Высказываются предположения о связи вируса ВК с патологией почек. Вирус G С неоднократно выделяли от больных с прогрессирующей множественной лейкоэнцефалопатией. Существует гипотеза, что вирус GC является возбудителем демиелини-зирующего заболевания с летальным исходом. Вирусы В К и G С обусловливали в эксперименте развитие опухолей у лаб. животных, однако для человека онкогенная потенция этих вирусов не установлена.
Полиомавирусы имеют в диаметре 45 нм, вес 20—25 X Ю6 дальтон, характеризуются плавучей плотностью 1,34 г/см 3 и коэффициентом седиментации 220—240S. Молекулярный вес ДНК (составляет ок. 12% веса вириона) 3 X 10 6 дальтон; содержание гуанина и цитозина от 41 % (обезьяний вакуолизирующий вирус) до 49% (вирус полиомы мышей), всего в ДНК ок. 5000 пар оснований. ДНК нек-рых полиомавирусов обладает как инфекционными, так и трансформирующими свойствами.
Белки полиомавирусов содержат полипептиды 6 или 7 типов, на один из к-рых приходится 70—80% от общего количества белка. Три компонента белка с наименьшим молекулярным весом (15 000, 14 000 и 12 000 дальтон), относительно богатые основными аминокислотами, наиболее прочно связаны с вирусной ДНК, что позволяет считать их внутренними вирусными белками (т. е. локализующимися внутри вириона). Полагают, что эти белки кодируются клеточным геномом и включаются в состав вирусной частицы в процессе ее сборки. Остальные белки — капсидные и кодируются вирусным геномом. Вирус полиомы мышей и обезьяний вакуолизирующий вирус не обнаруживают антигенного родства в серологических реакциях, но вирус полиомы человека давал перекрестные реакции с обезьяньим вакуо-лизирующим вирусом. Вирус полиомы мышей при t° 4° агглютинирует эритроциты морских свинок, тогда как обезьяний вакуолизирующий вирус этой способностью не обладает.

Рис. 3. Электронограмма обезьяньего вакуолизирующего вируса (ОВ40), расположенного в виде многочисленных точек в ядре клетки почки обезьяны (ультратонкий срез); Х25 000.
Читайте также:
