Сборка нуклеосом при репликации ДНК и хроматина
Добавил пользователь Cypher Обновлено: 27.01.2026
Лабораторные части МГУ старой застройки имеют особую атмосферу. Их мрачные коридоры ассоциируются с советскими секретными лабораториями, и кажется, что за железными дверями в тени громоздких приборов скрываются угрюмые ученые-творцы. Но вот мы оказываемся в лаборатории Василия Студитского, расположенной в корпусе Б. Конечно, есть и творцы, и приборы, но атмосфера светлая и дружелюбная.
Здесь расположено историческое ядро лаборатории, вокруг которого сконцентрирована работа группы регуляции транскрипции и репликации ДНК. Коллектив занимается исследованием эпигенетических факторов — всего того, что определяет, будет ли реализована наследственная информация и, если будет, как. В таких механизмах важную роль играет структура хроматина (комплекса из ДНК, РНК и белков), постоянно изменяющаяся под действием различных факторов. Это называется динамикой структуры хроматина. Важную роль в этом процессе играют ядерные белки гистоны. ДНК несколько раз обвивает их, формируя стабильную катушку-нуклеосому, которую можно создать из очищенных белков и фрагментов ДНК в пробирке, а потом наблюдать за поведением получившегося хроматина в присутствии различных факторов. Если кратко, то в этом и заключается суть работы лаборатории.
Значительная часть оборудования предназначена для получения объектов исследования: сборки многокомпонентных структур, синтеза и очистки ДНК и белков. Для анализа используется два прибора. Первый, Typhoon, позволяет сканировать и анализировать объекты, отдельные фрагменты которых содержат радиоактивную или окрашенную метку. Таким образом можно увидеть интересующие исследователя молекулы, определить содержание вещества, понять, с чем и насколько эффективно взаимодействует соединение.
Второй прибор – настоящая гордость коллектива. Он создан на основе конфокального микроскопа и позволяет исследовать взаимодействие между молекулами и их частями методом FRET. Суть этого метода заключается в том, что при сближении несущих флуоресцентную метку молекул возникает характерное свечение. Такой принцип лежит в основе исследований динамики структуры хроматина: мечение частей нуклеосомы разными флюорофорами позволяет наблюдать изменение цвета свечения и его интенсивности в зависимости от того, что с чем взаимодействует и на каком расстоянии находится.
Наталия Малюченко, доцент кафедры биоинженерии, у конфокального микроскопа
Евгения Фролова/Кафедра фотожурналистики и технологий СМИ факультета журналистики МГУ
Лаборатория создана в рамках первой волны мегагрантов (2010-2012 годы), и после завершения программы ее судьба сложилась непросто, но успешно. О том, как она была создана, через что прошла и чего добилась, рассказал Василий Студитский, профессор Центра исследований рака Фокс Чейз в США, заведующий лабораторией механизмов и регуляции транскрипции.
Василий Студитский, заведующий лабораторией механизмов и регуляции транскрипции
Фото из личного архива
— С чего началась ваша лаборатория?
— Лаборатория была создана на основе мегагранта, который мы получили в 2010 году. Мне предложили работать вместе с уже существующими группами на базе кафедры биоинженерии. В первую очередь было интересно разработать в России новые техники, в числе которых наша основная — FRET. В Москве я общался с возможными коллабораторами, однако наиболее интересное и продуктивное сотрудничество сложилось здесь, в МГУ. У Алексея Валерьевича Феофанова — профессора кафедры биоинженерии биологического факультета МГУ — уже были приборы, регистрирующие флуоресценцию, хоть и заточенные под другие задачи. На деньги от мегагранта Алексей Валерьевич построил подходящие для наших общих задач устройства. Также оказалось интересно сотрудничать с двумя другими коллегами. Это Ольга Сергеевна Соколова, доцент кафедры биоинженерии, высокого уровня микроскопист, и Алексей Константинович Шайтан, ведущий научный сотрудник кафедры биоинженерии, замечательный моделировщик, с моей легкой руки перешедший к работе с хроматином [смеется].
Хроматин в то время был (и остается) моей основной тематикой, однако у коллег, уже состоявшихся в собственных областях ученых, экспертиза по данной теме оказалась минимальной. Поначалу было сложно, но мы справились. Я думаю, хорошим показателем является тот факт, что после окончания мегагранта и потери денег ни один из сотрудников не захотел отойти от нашей тематики. В этот критический момент, не без поддержки руководства университета, мы выжили. Лаборатория получила новый грант и осталась на плаву.
— Каковы основные направления работы?
— В начале этого века профессор Университета Рокфеллера Дэвид Эллис предложил концепцию гистонового кода. Ее суть заключается в существовании набора из более чем десяти химических модификаций белков-гистонов, определяющих развитие многих клеточных программ, в том числе связанных с развитием рака. Свою работу по этой тематике я начал в Институте молекулярной биологии имени В.А. Энгельгардта под руководством академика РАН Андрея Дарьевича Мирзабекова, который тогда занимался хроматином. Мои ранние исследования посвящены изучению его динамики непосредственно в клетке. Затем я перешел в американскую лабораторию известного ученого Гэри Фельзенфельда в Национальном институте здоровья США. Здесь начался очень продуктивный период: я начал работать с биологическими системами in vitro, применяя биохимические и биофизические методы исследования, за три года опубликовал несколько статей в Science, Cell и других хороших журналах.
Тут же я совершил свое первое серьезное открытие. Поскольку нуклеосомы являются очень стабильными структурами, было непонятно, как через них проходят ферменты РНК- и ДНК-полимеразы, тоже прочно связывающиеся с ДНК в ходе своей работы по синтезу полинуклеотидных цепей. На модельных ферментах бактерий я выяснил механизм этого загадочного процесса. При транскрибировании (синтезе РНК с ДНК-матрицы) временно возникают очень маленькие внутринуклеосомные петли, по которым движется полимераза. Сзади и спереди от нее возникают контакты с гистонами, позволяющие системе как бы переносить белки-гистоны вокруг фермента. После этого я получил собственную лабораторию, где были открыты подобные механизмы и для эукариотических ДНК- и РНК-полимераз. Предложенные механизмы позволяют объяснить, как гистоны и их модификации сохраняются в различных клеточных процессах.
Этот опыт и осознание важности гистонового кода в клеточных процессах стали основой для научных интересов созданной лаборатории. Кроме продолжения исследований открытых механизмов, ведутся работы с гистоновыми шаперонами — белками, отвечающими за формирование и функционирование нуклеосом. Один из них — PARP-1 — уже долгое время служит мишенью для разработки антираковых лекарств. Другой представитель класса, шаперон FACT, играет важную роль в транскрипции, репликации и, опять же, в развитии рака. Эти белки во многом похожи, однако есть значительные структурные и функциональные отличия.
Роль АТФ-зависимых хроматин-ремоделирующих факторов в процессе сборки хроматина in vivo
Сборка хроматина – фундаментальный процесс, необходимый для дупликации хромосом в процессе репликации ДНК. Кроме того, удаление гистонов и их инкорпорирование постоянно происходят в течение клеточного цикла в ходе процессов метаболизма ДНК, таких как транскрипция, восстановление повреждений или рекомбинация. Исследования in vitro показали, что сборка хроматина требует совместного действия гистоновых шаперонов и использующих энергию АТФ хроматин-ремоделирующих факторов – ACF или CHD1. Несмотря то, что АТФ-зависимые факторы сборки и ремоделирования хроматина хорошо охарактеризованы биохимически, оставалось неясным, до какой степени сборка нуклеосом является АТФ-зависимым процессом in vivo. Наши собственные и опубликованные в литературе данные о функциях АТФ-зависимых хроматин-ремоделирующих факторов показывают, что эти белки существенны для сборки нуклеосом и обмена гистонов и in vivo. CHD1 – критически важный фактор при реорганизации мужского пронуклеуса после оплодотворения, в процессе которой происходит независимая от репликации сборка хроматина, содержащего вариантный гистон Н3.3. Следовательно, молекулярные моторные белки, такие как CHD1, функционируют in vivo не только в ремоделировании существующих нуклеосом, но также и в сборке нуклеосом de novo из ДНК и гистонов. АТФ-зависимые факторы сборки и ремоделирования хроматина участвуют в процессе обмена гистонов во время транскрипции и репарации ДНК, в поддержании центромерного хроматина и образовании и ремоделировании нуклеосом позади прохождения репликационной вилки. Таким образом, хроматин-ремоделирующие факторы участвуют в процессах как зависимой, так и не зависимой от репликации сборки хроматина. Их роль особенно заметна в процессах крупномасштабной реорганизации хроматина, например при реорганизации хроматина мужского пронуклеуса или при восстановлении повреждений ДНК. Гипероновые шапероны, модифицирующие хроматин ферменты и АТФ-зависимые факторы сборки хроматина совместно образуют сеть факторов, обеспечивающих поддержание целостности хроматина.
Ключевые слова
Об авторах
Петербургский институт ядерной физики им. Б.П. Константинова Национального исследовательского центра «Курчатовский институт».
Россия
Гатчина.
Петербургский институт ядерной физики им. Б.П. Константинова Национального исследовательского центра «Курчатовский институт».
Россия
Гатчина.
Список литературы
1. Borner K., Jain D., Vazquez-Pianzola P., Vengadasalam S., Steffen N., Fyodorov D.V., Tomancak P., Konev A., Suter B., Becker P.B. A role for tuned levels of nucleosome remodeler subunit ACF1 during Dro¬sophila oogenesis. Dev. Biol. 2016;411(2):217-230. DOI 10.1016/j. ydbio.2016.01.039.
3. Corona D.F., Eberharter A., Budde A., Deuring R., Ferrari S., Varga- Weisz P., Wilm M., Tamkun J., Becker P.B. Two histone fold pro-teins, CHRAC-14 and CHRAC-16, are developmentally regulated subunits of chromatin accessibility complex (CHRAC). EMBO J. 2000;19(12):3049-3059. DOI 10.1093/emboj/19.12.3049.
4. Corona D.F., Siriaco G., Armstrong J.A., Snarskaya N., McCly- mont S.A., Scott M.P., Tamkun J.W. ISWI regulates higher-order chromatin structure and histone H1 assembly in vivo. PLoS Biol. 2007;5(9):e232. DOI 10.1371/journal.pbio.0050232.
5. de Dieuleveult M., Yen K., Hmitou I., Depaux A., Boussouar F., Bou Dargham D., Jounier S., Humbertclaude H., Ribierre F., Baulard C., Farrell N.P., Park B., Keime C., Carriere L., Berlivet S., Gut M., Gut I., Werner M., Deleuze J.F., Olaso R., Aude J.C., Chanta- lat S., Pugh B.F., Gerard M. Genome-wide nucleosome specificity and function of chromatin remodellers in ES cells. Nature. 2016; 530(7588):Ш-116. DOI 10.1038/nature16505.
6. Deuring R., Fanti L., Armstrong J.A., Sarte M., Papoulas O., Prestel M., Daubresse G., Verardo M., Moseley S.L., Berloco M., Tsukiyama T., Wu C., Pimpinelli S., Tamkun J.W. The ISWI chromatin-remodeling protein is required for gene expression and the maintenance of high¬er order chromatin structure in vivo. Mol. Cell. 2000;5(2):355-365.
7. Doyen C.M., Chalkley G.E., Voets O., Bezstarosti K., Demmers J.A., Moshkin Y.M., Verrijzer C.P. A Testis-specific chaperone and the chromatin remodeler ISWI mediate repackaging of the paternal ge-nome. Cell Rep. 2015;13(7):1310-1318. DOI 10.1016/j.celrep.2015. 10.010.
8. Drane P., Ouararhni K., Depaux A., Shuaib M., Hamiche A. The death- associated protein DAXX is a novel histone chaperone involved in the replication-independent deposition of H3.3. Genes Dev. 2010; 13(7):1310-1318. DOI 10.1101/gad.566910.
9. Eberharter A., Ferrari S., Langst G., Straub T., Imhof A., Varga- Weisz P., Wilm M., Becker P.B. Acf1, the largest subunit of CHRAC, regulates ISWI-induced nucleosome remodelling. EMBO J. 2001; 20(14):3781-3788.
10. Elbakry A., Juhasz S., Mathes A., Lobrich M. DNA repair synthesis and histone deposition partner during homologous recombination. Mol. Cell. Oncol. 2018;5(5):e1511210. DOI 10.1080/23723556.2018. 1511210.
11. Elsasser S.J., Huang H., Lewis P.W., Chin J.W., Allis C.D., Patel D.J. DAXX envelops a histone H3.3-H4 dimer for H3.3-specific recogni¬tion. Nature. 2012;491(7425):560-565. DOI 10.1038/nature11608.
12. Emelyanov A.V., Konev A.Y., Vershilova E., Fyodorov D.V. Protein complex of Drosophila ATRX/XNP and HP1a is required for the formation of pericentric beta-heterochromatin in vivo. J. Biol. Chem. 2010;285(20):15027-15037. DOI 10.1074/jbc.M109.064790.
13. Emelyanov A.V., Vershilova E., Ignatyeva M.A., Pokrovsky D.K., Lu X., Konev A.Y., Fyodorov D.V. Identification and characteriza¬tion of ToRC, a novel ISWI-containing ATP-dependent chromatin assembly complex. Genes Dev. 2012;26(6):603-614. DOI 10.1101/ gad.180604.111.
14. Fei J., Torigoe S.E., Brown C.R., Khuong M.T., Kassavetis G.A., Boeger H., Kadonaga J.T. The prenucleosome, a stable conforma-tional isomer of the nucleosome. Genes Dev. 2015;29(24):2563- 2575. DOI 10.1101/gad.272633.115.
16. Fyodorov D.V., Kadonaga J.T. Binding of Acf1 to DNA involves a WAC motif and is important for ACF-mediated chromatin assembly. Mol. Cell. Biol. 2002;22(18):6344-6353.
17. Fyodorov D.V., Kadonaga J.T. Chromatin assembly in vitro with pu-rified recombinant ACF and NAP-1. Methods Enzymol. 2003;371: 499-515.
18. Gaspar-Maia A., Alajem A., Polesso F., Sridharan R., Mason M.J., Heidersbach A., Ramalho-Santos J., McManus M.T., Plath K., Me- shorer E., Ramalho-Santos M. Chd1 regulates open chromatin and pluripotency of embryonic stem cells. Nature. 2009;460(7257):863- 868. DOI 10.1038/nature08212.
22. Hanai K., Furuhashi H., Yamamoto T., Akasaka K., Hirose S. RSF governs silent chromatin formation via histone H2Av replace¬ment. PLoS Genet. 2008;4(2):e1000011. DOI 10.1371/journal.pgen. 1000011.
23. Harada A., Okada S., Konno D., Odawara J., Yoshimi T., Yoshimura S., Kumamaru H., Saiwai H., Tsubota T., Kurumizaka H., Akashi K., Tachibana T., Imbalzano A.N., Ohkawa Y. Chd2 interacts with H3.3 to determine myogenic cell fate. EMBO J. 2012;31(13):2994-3007. DOI 10.1038/emboj.2012.136.
24. Hartlepp K.F., Fernandez-Tornero C., Eberharter A., Grune T., Mul¬ler C.W., Becker P.B. The histone fold subunits of Drosophila CHRAC facilitate nucleosome sliding through dynamic DNA inter-actions. Mol. Cell. Biol. 2005;25(22):9886-9896.
25. Hauer M.H., Gasser S.M. Chromatin and nucleosome dynamics in DNA damage and repair. Genes Dev. 2017;31(22):2204-2221. DOI 10.1101/gad.307702.117.
26. Haushalter K.A., Kadonaga J.T. Chromatin assembly by DNA-translo- cating motors. Nat. Rev. Mol. Cell. Biol. 2003;4(8):613-620.
27. Henikoff S., Ahmad K. Assembly of variant histones into chromatin. Annu. Rev. Cell Dev. Biol. 2005;21:133-153.
28. Hennig B.P., Bendrin K., Zhou Y., Fischer T. Chd1 chromatin remodel¬ers maintain nucleosome organization and repress cryptic transcrip¬tion. EMBO Rep. 2012; 13(11 ):997-1003. DOI 10.1038/embor. 2012.146.
29. Ito T., Bulger M., Pazin M.J., Kobayashi R., Kadonaga J.T. ACF, an ISWI-containing and ATP-utilizing chromatin assembly and re-modeling factor. Cell. 1997;90(1):145-155.
30. Ito T., Levenstein M.E., Fyodorov D.V., Kutach A.K., Kobayashi R., Kadonaga J.T. ACF consists of two subunits, Acf1 and ISWI, that function cooperatively in the ATP-dependent catalysis of chromatin assembly. Genes Dev. 1999;15;13(12):1529-1539.
31. Juhasz S., Elbakry A., Mathes A., Lobrich M. ATRX promotes DNA repair synthesis and sister chromatid exchange during homologous recombination. Mol. Cell. 2018;71( 1): 11-24 e7. DOI 10.1016/j. molcel.2018.05.014.
32. Kari V., Mansour W.Y., Raul S.K., Baumgart S.J., Mund A., Grade M., Sirma H., Simon R., Will H., Dobbelstein M., Dikomey E., John- sen S.A. Loss of CHD1 causes DNA repair defects and enhances prostate cancer therapeutic responsiveness. EMBO Rep. 2016; 19(10):pii: e46783. DOI 10.15252/embr.201846783.
35. Konev A.Y., Tribus M., Park S.Y., Podhraski V., Lim C.Y., Emelya-nov A.V., Vershilova E., Pirrotta V., Kadonaga J.T., Lusser A., Fyo¬dorov D.V. CHD1 motor protein is required for deposition of his¬tone variant H3.3 into chromatin in vivo. Science. 2007;317(5841): 1087-1090.
37. Kukimoto I., Elderkin S., Grimaldi M., Oelgeschlager T., Varga- Weisz P.D. The histone-fold protein complex CHRAC-15/17 en-hances nucleosome sliding and assembly mediated by ACF. Mol. Cell. 2004;13(2):265-277.
38. Lee J.S., Garrett A.S., Yen K., Takahashi Y.H., Hu D., Jackson J., Sei-del C., Pugh B.F., Shilatifard A. Codependency of H2B monoubi- quitination and nucleosome reassembly on Chd1. Genes Dev. 2012; 26(9):914-919. DOI 10.1101/gad.186841.112.
39. Lee Y., Park D., Iyer V.R. The ATP-dependent chromatin remodeler Chd1 is recruited by transcription elongation factors and maintains H3K4me3/H3K36me3 domains at actively transcribed and spliced genes. Nucleic Acids Res. 2017;45(12):7180-7190. DOI 10.1093/ nar/gkx321.
40. Lewis P.W., Elsaesser S.J., Noh K.M., Stadler S.C., Allis C.D. Daxx is an H3.3-specific histone chaperone and cooperates with ATRX in replication-independent chromatin assembly at telomeres. Proc. Natl. Acad. Sci. USA. 2010;107(32):14075-14080. DOI 10.1073/ pnas.1008850107.
41. Liu J.C., Ferreira C.G., Yusufzai T. Human CHD2 is a chromatin as-sembly ATPase regulated by its chromo- and DNA-binding domains. J. Biol. Chem. 2015;290(1):25-34. DOI 10.1074/jbc.M114.609156.
42. Loppin B., Bonnefoy E., Anselme C., Laurencon A., Karr T.L., Coub- le P. The histone H3.3 chaperone HIRA is essential for chromatin assembly in the male pronucleus. Nature. 2005;4437(7063):1386- 1390.
43. Loyola A., Huang J.Y., LeRoy G., Hu S., Wang Y.H., Donnelly R.J., Lane W.S., Lee S.C., Reinberg D. Functional analysis of the sub-units of the chromatin assembly factor RSF. Mol. Cell. Biol. 2003; 23(19):6759-6768.
44. Luijsterburg M.S., de Krijger I., Wiegant W.W., Shah R.G., Smeenk G., de Groot A.J., Pines A., Vertegaal A.C., Jacobs J.J., Shah G.M., van Attikum H. PARP1 links CHD2-mediated chromatin expansion and H3.3 deposition to DNA repair by non-homologous end-joining. Mol. Cell. 2016;61(4):547-562. DOI 10.1016/j.molcel.2016.01.019.
45. Lusser A., Urwin D.L., Kadonaga J.T. Distinct activities of CHD1 and ACF in ATP-dependent chromatin assembly. Nat. Struct. Mol. Biol. 2005;12(2):160-166.
46. Morettini S., Podhraski V., Lusser A. ATP-dependent chromatin re-modeling enzymes and their various roles in cell cycle control. Front. Biosci. 2008;13:5522-5532.
47. Morettini S., Tribus M., Zeilner A., Sebald J., Campo-Fernandez B., Scheran G., Worle H., Podhraski V, Fyodorov D.V., Lusser A. The chromodomains of CHD1 are critical for enzymatic activity but less important for chromatin localization. Nucleic Acids Res. 2011; 39(8):3103-3115. DOI 10.1093/nar/gkq1298.
48. Narlikar G.J., Sundaramoorthy R., Owen-Hughes T. Mechanisms and functions of ATP-dependent chromatin-remodeling enzymes. Cell. 2013;54(3):490-503. DOI 10.1016/j.cell.2013.07.011.
49. Ohzeki J., Shono N., Otake K., Martins N.M., Kugou K., Kimura H., Nagase T., Larionov V, Earnshaw W.C., Masumoto H. KAT7/ HBO1/MYST2 regulates CENP-A chromatin assembly by antago-nizing Suv39h1-mediated centromere inactivation. Dev. Cell. 2016; 37(5):413-427. DOI 10.1016/j.devcel.2016.05.006.
50. Okada M., Okawa K., Isobe T., Fukagawa T. CENP-H-containing com¬plex facilitates centromere deposition of CENP-A in cooperation with FACT and CHD1. Mol. Biol. Cell. 2009;20(18):3986-3995. DOI 10.1091/mbc.E09-01-0065.
51. Orsi G.A., Algazeery A., Meyer R.E., Capri M., Sapey-Triomphe L.M., Horard B., Gruffat H., Couble P., Ait-Ahmed O., Loppin B. Drosophila Yemanuclein and HIRA cooperate for de novo assembly of H3.3-containing nucleosomes in the male pronucleus. PLoS Genet. 2013;9(2):e1003285. DOI 10.1371/journal.pgen.1003285.
52. Perpelescu M., Nozaki N., Obuse C., Yang H., Yoda K. Active es-tablishment of centromeric CENP-A chromatin by RSF complex. J. Cell Biol. 2009;185(3):397-407. DOI 10.1083/jcb.200903088.
53. Piatti P., Lim C.Y., Nat R., Villunger A., Geley S., Shue Y.T., Soratroi C., Moser M., Lusser A. Embryonic stem cell differentiation requires full length Chd1. Sci. Rep. 2015;5:8007. DOI 10.1038/srep0800.
54. Podhraski V, Campo-Fernandez B., Worle H., Piatti P., Niederegger H., Bock G., Fyodorov D.V., Lusser A. CenH3/CID incorporation is not dependent on the chromatin assembly factor CHD1 in Drosophila. PLoS One. 2010;5(4):e10120. DOI 10.1371/journal.pone.0010120.
57. Robinson K.M., Schultz M.C. Replication-independent assembly of nucleosome arrays in a novel yeast chromatin reconstitution sys-tem involves antisilencing factor Asf1p and chromodomain protein Chd1p. Mol. Cell. Biol. 2003;23(22):7937-7946.
58. Scacchetti A., Brueckner L., Jain D., Schauer T., Zhang X., Schnor- rer F., van Steensel B., Straub T., Becker P.B. CHRAC/ACF contri-bute to the repressive ground state of chromatin. Life Sci. Alliance. 2018;1(1):e201800024. DOI 10.26508/lsa.201800024.
59. Schneiderman J.I., Orsi G.A., Hughes K.T., Loppin B., Ahmad K. Nucleosome-depleted chromatin gaps recruit assembly factors for the H3.3 histone variant. Proc. Natl. Acad. Sci. USA. 2012;109(48): 19721-19726. DOI 10.1073/pnas.1206629109.
60. Schneiderman J.I., Sakai A., Goldstein S., Ahmad K. The XNP remodel¬er targets dynamic chromatin in Drosophila. Proc. Natl. Acad. Sci. USA. 2009;106(34):14472-14477. DOI 10.1073/pnas. 0905816106.
62. Serra-Cardona A., Zhang Z. Replication-coupled nucleosome assembly in the passage of epigenetic information and cell identity. Trends Biochem. Sci. 2018;43(2):136-148. DOI 10.1016/j.tibs.2017.12.003.
64. Simic R., Lindstrom D.L., Tran H.G., Roinick K.L., Costa P.J., John-son A.D., Hartzog G.A., Arndt K.M. Chromatin remodeling protein Chd1 interacts with transcription elongation factors and localizes to transcribed genes. EMBO J. 2003;22(8):1846-1856.
65. Siriaco G., Deuring R., Chioda M., Becker P.B., Tamkun J.W. Dro-sophila ISWI regulates the association of histone H1 with inter-phase chromosomes in vivo. Genetics. 2009;182(3):661-669. DOI 10.1534/genetics.109.10205.
66. Smolle M., Venkatesh S., Gogol M.M., Li H., Zhang Y., Florens L., Washburn M.P., Workman J.L. Chromatin remodelers Isw1 and Chd1 maintain chromatin structure during transcription by prevent¬ing histone exchange. Nat. Struct. Mol. Biol. 2012;19(9):884-892. DOI 10.1038/nsmb.2312.
67. Strohner R., Nemeth A., Jansa P., Hofmann-Rohrer U., Santoro R., Langst G., Grummt I. NoRC-a novel member of mammalian ISWI- containing chromatin remodeling machines. EMBO J. 2001;20(17): 4892-4900.
68. Tagami H., Ray-Gallet D., Almouzni G., Nakatani Y. Histone H3.1 and H3.3 complexes mediate nucleosome assembly pathways dependent or independent of DNA synthesis. Cell. 2004;1116(1):51-61.
69. Torigoe S.E., Patel A., Khuong M.T., Bowman G.D., Kadonaga J.T. ATP- dependent chromatin assembly is functionally distinct from chro¬matin remodeling. Elife. 2013;2:e00863. DOI 10.7554/eLife.00863.
71. Torres-Padilla M.E., Bannister A.J., Hurd P.J., Kouzarides T., Zernicka- Goetz M. Dynamic distribution of the replacement histone variant H3.3 in the mouse oocyte and preimplantation embryos. Int. J. Dev. Biol. 2006;50(5):455-461.
73. Vary J.C. Jr., Gangaraju V.K., Qin J., Landel C.C., Kooperberg C., Bar¬tholomew B., Tsukiyama T. Yeast Isw1p forms two separable com¬plexes in vivo. Mol. Cell. Biol. 2003;23(1):80-91.
75. Vincent J.A., Kwong T.J., Tsukiyama T. ATP-dependent chromatin remodeling shapes the DNA replication landscape. Nat. Struct. Mol. Biol. 2008;15(5):477-484. DOI 10.1038/nsmb.1419.
77. Wong L.H., McGhie J.D., Sim M., Anderson M.A., Ahn S., Han¬nan R.D., George A.J., Morgan K.A., Mann J.R., Choo K.H. ATRX interacts with H3.3 in maintaining telomere structural integrity in pluripotent embryonic stem cells. Genome Res. 2010;20(3):351- 360. DOI 10.1101/gr.101477.109.
78. Xella B., Goding C., Agricola E., Di Mauro E., Caserta M. The ISWI and CHD1 chromatin remodelling activities influence ADH2 ex-pression and chromatin organization. Mol. Microbiol. 2006;59(5): 1531-1541.
79. Yadav T., Whitehouse I. Replication-coupled nucleosome assembly and positioning by ATP-dependent chromatin-remodeling enzymes. Cell Rep. 2016;15(4):715-723. DOI 10.1016/j.celrep.2016.03.059.
81. Zhou J., Li J., Serafim R.B., Ketchum S., Ferreira C.G., Liu J.C., Coe K.A., Price B.D., Yusufzai T. Human CHD1 is required for early DNA-damage signaling and is uniquely regulated by its N termi-nus. Nucleic Acids Res. 2018;46(8):3891-3905. DOI 10.1093/nar/ gky128.
Сборка нуклеосом при репликации ДНК и хроматина
• При репликации не сохраняются октамеры гистонов, однако димеры Н2А-Н2В и тетрамеры Н32-Н42 сохраняются
• Существуют различные и независимые от репликации пути сборки нуклеосом при репликации
• Для облегчения процесса сборки нуклеосом требуются дополнительные белки
• CAF-1 представляет собой белок сборки, связанный с PCNA субъединицей реплисомы. Этот белок необходим для поддержания тетрамеров Н32-Н42 после репликации
• Для сборки, независимой от репликации, может использоваться другой белок сборки и вариантная форма гистона Н3
При репликации происходит разделение цепей ДНК, и при этом структура нуклеосомы неизбежно должна нарушаться. Репликативная вилка обладает характерной структурой. Она более устойчива к микрококковой нук-леазе и при ферментативной обработке дает полосы, по размеру отличающиеся от ДНК нуклеосом. Область с такой измененной структурой находится в непосредственной близости от репликативной вилки. Это позволяет считать, что в репликации ДНК участвует крупный белковый комплекс, причем по мере его продвижения за ним довольно быстро реформируются нуклеосомы. Это иллюстрируется на микрофотографии, на которой показан участок недавно реплицированной ДНК, уже упакованный в нуклеосомы на обоих дочерних дуплексных сегментах.
Поэтому биохимический анализ и непосредственные наблюдения над репликативной вилкой позволяют считать, что нарушение структуры нуклеосом ограничено коротким участком, находящимся рядом с вилкой. При росте вилки нуклеосомы разрушаются, однако по мере продвижения вилки они очень быстро образуются на дочерних дуплексах. Фактически сборка нуклеосом прямо связана с реплисомой, где происходит репликация ДНК.
Каким образом гистоны связываются с ДНК, образуя нуклеосомы? Образуют ли гистоны вначале октамер белков, вокруг которого впоследствии оборачивается ДНК? Или же октамер собирается на ДНК из свободных гистонов? На рисунке ниже показано, что, в зависимости от конкретных условий, in vitro могут использоваться две схемы сборки нуклеосом. Согласно первой схеме, с ДНК связывается уже сформированный октамер. Вторая схема предполагает, что вначале образуется тетрамер Н32-Н42, к которому затем добавляются два димера Н2А-Н2В. Обе схемы имеют отношение к процессам, происходящим in vivo. Первая отражает способность хроматина к перестройке, которая обеспечивается движением октамера гистонов по ДНК. Вторая схема соответствует событиям, происходящим при репликации.
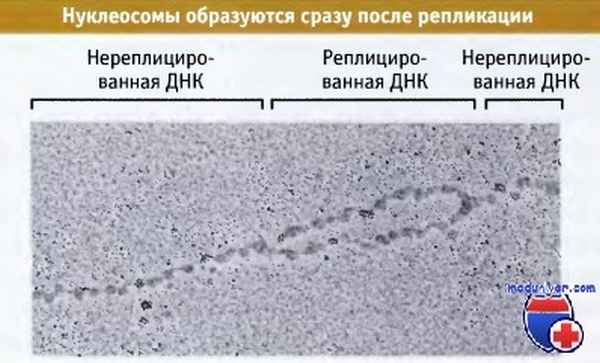
Реплицирующаяся ДНК сразу же включается в состав нуклеосом.
Связыванию гистонов с ДНК способствуют дополнительные белки. Эти белки можно идентифицировать в экстрактах, участвующих в сборке гистонов и экзогенной ДНК в нуклеосомы. Дополнительные белки могут выполнять роль «молекулярных шаперонов», которые связываются с гистонами, чтобы контролировать связывание индивидуальных гистонов или их комплексов (Н32-Н42 или Н2А-Н2В) с ДНК. Это может оказаться необходимым, поскольку гистоны, являясь основными белками, вообще проявляют высокое сродство к ДНК. При таком взаимодействии гистоны образуют нуклеосомы, минуя промежуточные продукты (т. е. не участвуя в образовании других компактных комплексов, которые могут возникать при их связывании с ДНК).
Предложена система, позволяющая воспроизвести процесс сборки нуклеосом при репликации. Эта система использует экстракты клеток человека, которые реплицируют ДНК SV40 и осуществляют сборку хроматина. Сборка преимущественно происходит на реплицирующейся ДНК. Неообходимо присутствие дополнительного фактора, CAF-1, состоящего из > 5 субъединиц, с общей массой 238 кДа. Этот фактор попадает в область репликативной вилки под действием PCNA, который является процессивным фактором ДНК полимеразы. Таким образом обеспечивается связь между репликацией ДНК и сборкой нуклеосом, причем сборка происходит сразу же после завершения репликации.
CAF-1 стехиометрически связывается с вновь синтезированными Н3 и Н4. Это позволяет предполагать, что при сборке новых нуклеосом вначале образуется Н32-Н42 тетрамер, к которому затем добавляются Н2А-Н2В димеры. Образующиеся in vitro нуклеосомы характеризуются длиной повтора 200 пн, хотя и не имеют Н1 гистона. Это позволяет предполагать, что надлежащее расположение нуклеосом может обеспечиваться и без участия гистона Н1.
При репродукции хроматина происходит репликация релаксированной ДНК, уже связанной с нуклео-сомами. При этом образуются два дочерних дуплекса. Что происходит в этот момент с предсуществующими нуклеосомами? Диссоциирует ли октамер гистонов на свободные белки, которые потом утилизируются, или же гистоны остаются связанными? Ответить на этот вопрос можно, выращивая клетки в среде, содержащей тяжелые (меченные дейтерием) аминокислоты, и переводя их на среду с легкими аминокислотами непосредственно перед репликацией. При последующем использовании сшивающих агентов можно выяснить, входят ли в белки октамера только один или оба типа аминокислот. Полученные результаты позволяют предполагать, что перед репликацией происходит смешивание гистонов, синтезированных до репликации, с синтезированными при репликации гистонами. Это говорит в пользу по крайней мере частичной диссоциации и реассоциации компонентов октамера.
Процесс сборки и разборки нуклеосом трудно охарактеризовать детально, однако на рисунке ниже представлена наша рабочая модель. Репликативная вилка смещает октамер гистонов, который диссоциирует на Н32-Н42 тетрамер и Н2А-Н2В димер. Эти «старые» тетрамеры и димеры поступают в общий пул, который также содержит «новые» тетрамеры и димеры, собранные из ново-синтезированных гистонов. Нуклеосомы собираются на расстоянии примерно 600 пн за репликативной вилкой. Сборка начинается, когда Н32-Н42 тетрамеры связываются с каждым из дочерних дуплексов, при участии дополнительного белка CAF-1. Затем два димера Н2А-Н2В связываются с каждым Н32-Н42 тетрамером и образуют полный октамер гистонов. Сборка тетрамеров и димеров носит случайный характер по отношению к утилизации «старых» и «новых» субъединиц. Это объясняет, почему в октамере смешаны «старые» и «новые» гистоны. Возможно, что нуклеосомы разрушаются и собираются аналогичным образом и при транскрипции.
В клетках эукариот, находящихся в S-фазе (т. е. в периоде репликации ДНК), дупликация хроматина требует синтеза большого количества гистонов для упаковки всего генома — фактически должно быть синтезировано такое же количество гистонов, которое уже содержится в нуклеосомах. Синтез гистоновой иРНК находится под контролем клеточного цикла и сильно увеличивается в S-фазе. Схема сборки хроматина в S-фазе из равной смеси старых и новых гистонов носит название пути, связанного с репликацией (RC).
Другой путь называется независимым от репликации (RI) и используется при сборке нуклеосом в остальные фазы клеточного цикла, вне синтеза ДНК. Использование этого пути становится необходимым при возникновении повреждений в ДНК или при смещении нуклеосом в результате транскрипции. Очевидно, в этом случае процесс сборки должен отличаться от пути RC, поскольку он не связан с репликативным аппаратом. Одна из наиболее интересных особенностей пути, независимого от репликации, заключается в том, что в нем участвуют различные варианты некоторых гистонов из числа тех, которые используются при репликации.
Н3.3 вариант отличается от консервативного гистона Н3 положением четырех аминокислот. В дифференцирующихся клетках, в которых не происходит репликации ДНК, этот вариант гистона постепенно замещает гистон Н3. Это происходит в результате сборки новых октамеров гистонов взамен тех, которые в силу разных причин были удалены из структуры хроматина. Механизм использования Н3.3 в независимом от репликации пути в двух исследованных случаях оказался различным.
Использование гистонов организмом простейшего Tetrahymena определяется исключительно их доступностью. Гистон Н3 синтезируется только в клеточном цикле, вариант этого гистона — только в неделящихся клетках. Однако у Drosophila существует механизм, обеспечивающий использование Н3.3 по схеме RI. Новые нуклеосомы, содержащие Н3.3, собираются на месте транскрипции, предположительно замещая нуклеосомы, смещенные РНК полимеразой. В процессе сборки гистоны Н3 и Н3.3 распознаются по структуре, и Н3 в сборке не участвует. Наоборот, при сборке по пути RC используются оба варианта гистона Н3 (хотя Н3.3 доступен в гораздо меньших количествах, чем Н3, и поэтому входит только в небольшое количество нуклеосом).
По-видимому, белок CAF-1 не участвует в сборке по схеме RI. (Также в таких организмах, как дрожжи и Arabidopsis, ген, кодирующий этот белок, не играет существеной роли, что позволяет предполагать существование альтернативных процессов сборки по схеме RC.) Белок, возможно участвующий в сборке по пути RI, называется HIRA. Исключение этого белка из бесклеточной системы сборки нуклеосом приводит к ингибированию их образования на нереплицирующейся, но не на реплицирующейся ДНК. Это является свидетельством того, что оба пути действительно используют различные механизмы сборки хроматина.
Сборка нуклеосом, содержащих альтернативный вариант гистона Н3, происходит также на центромерах. В ходе репликативной фазы клеточного цикла ДНК центромеры реплицируется рано (в противоположность окружающим гетерохроматиновым последовательностям, которые реплицируются позже. Включение Н3 в центромерную область подавляется, и вместо него у высших эукариот включается белок, называемый CENP-A (у Drosophila он называется Cid, а у дрожжей Cse4p). Это происходит с участием RI-пути сборки, что связано с блокировкой пути RC в течение короткого промежутка времени, пока реплицируется ДНК центромеры.
In vitro ДНК может или непосредственно взаимодействовать с интактным (сшитым) октамером гистонов,
или связываться с Н32-Н42 тетрамером, после чего к комплексу добавляются Н2А-Н2В димеры гистонов. При движении репликативной вилки октамеры гистонов удаляются с ДНК.
Они диссоциируют на тетрамеры Н3-Н4 и димеры Н2А-Н2В. Вновь синтезированные гистоны собираются в Н33-Н4 тетрамеры и Н2А-Н2В димеры.
Предсуществующие и вновь образованные тетрамеры и димеры собираются с помощью белка CAF-1 случайным образом;
при этом новые нуклеосомы образуются непосредственно за репликативной вилкой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биология и медицина
Основная масса гистонов откладывается после репликации ДНК
Для упаковки по существу всей ДНК эукариотической клетки в нуклеосомы необходимо, чтобы хроматин дуплицировался, когда реплицируется ДНК ( рис. 13.3 ). Таким образом, канонические гистоны продуцируются в фазе синтеза ДНК клеточного цикла (фазе S). Сопряжение синтеза гистонов с синтезом ДНК в фазе S находится под строгим контролем клеточного цикла ( Marzluff and Duronio, 2002 ). Это особенно очевидно у животных, где специальный процессинг гистоновых транскриптов малым ядерным рибонуклеопротеидным комплексом U7 и стабилизация иРНК белком SLBP (stem-loop-binding protein) вносят вклад в тесную координацию синтеза гистонов с репликацией ДНК. Весьма вероятно, что необходимость в быстром и массивном производстве гистонов в фазе S ответственна за тот факт, что сопряженные с репликацией ( RC , replication-coupled) гистоны у животных закодированы в кластерах, содержащих много гистоновых генов. Например, в геноме человека имеется 14 генов Н4 , большинство из которых находятся в двух главных кластерах, где эти гены Н4 чередуются с генами других гистонов RC ( Marzluff et al., 2002 ). У животных гистоны RC узнаются по наличию З'-последовательности длиной 26 п.о., которая образует структуру "стебель-петля (stem-loop)" для распознавания комплексом SLBP при транскрипции в гистоновую иРНК. Канонические гистоны растений тоже кодируются множественными генами и откладываются в фазе S, хотя транскрипты растительных гистонов полиаденилированы, а аналог SLBP, по- видимому, отсутствует.
В той мере, в какой эпигенетическая наследственность является результатом наследования "состояния" хроматина, процесс сборки нуклеосом RC представляет исключительный интерес. Биохимия этого процесса была выяснена, когда были разработаны системы in vitro, способные собирать нуклеосомы на реплицирующейся ДНК. Эти исследования показали, что трехсубъединичный комплекс, фактор сборки хроматина 1 ( CAF-1 , chromatin assembly factor 1) действует как гистоновый шаперон , облегчающий включение НЗ*Н4 в качестве первого этапа сборки нуклеосом ( Loyola and Almouzni, 2004 ). Было показано, что CAF-1 взаимодействует с фиксатором репликационной процессивности (replication processivity clamp), PCNA , что означает, что репликация ДНК и сборка RC происходят в тесной близости. Работы на почкующихся дрожжах показали, что ни одна из субъединиц комплексов, участвующих в сборке RC in vitro, не является существенной для роста; это позволяет предполагать, что in vivo существуют избыточные механизмы для сборки RC. Тот факт, что большая часть хроматина дрожжей собирается независимым от репликации ( RI , replication-independent) образом ( Altheim and Schultz, 1999 ), дает разумное объяснение для этой явной избыточности. Как показано ниже, варианты гистонов , как правило, откладываются путем RI-сборки нуклеосом.
У почкующихся дрожжей RC -сборка не является полностью избыточной. Интригующим оказалось открытие, что отсутствие большой субъединицы CAF-1 ведет к утрате эпигенетического сайленсинга в теломерах ( Loyola and Almouzni, 2004 ). Эта связь между RC-сборкой и эпигенетическим сайленсингом была распространена и на Arabidopsis , где утрата субъединиц CAF-1 приводит к ряду дефектов, которые можно приписать утере эпигенетической памяти. Хотя механистическая основа этих наблюдений неизвестна, кажется очевидным, что правильная откладка новых нуклеосом позади репликационной вилки важна для поддержания эпигенетически сайленсированного состояния.
Предпосылкой эпигенетической наследственности нуклеосомного состояния является тот факт, что предсуществовавшие нуклеосомы после репликации должны быть распределены по дочерним хроматидам ( рис. 13.3 ). Действительно, так оно и есть: детальные исследования показали, что старые нуклеосомы наследуются дочерними хроматидами интактными и очевидно случайным образом ( рис. 13.3 ) ( Annunziato, 2005 ). Однако этот процесс наследования плохо понят, как и процесс, посредством которого новые гистоны могли бы приобретать эпигенетическую информацию. Популярная модель состоит в том, что новые нуклеосомы модифицируются в результате того, что они находятся вблизи старых нуклеосом ( Jenuwein, 2001 ), однако данные в пользу этого гипотетического процесса отсутствуют, и необходимо рассматривать альтернативные средства воспроизведения эпигенетического состояния ( Неnikoff and Ahmad, 2005 ). Каким образом эпигенетическая информация наследуется дочерними клетками, остается главным невыясненным вопросом биологии, и изучение вариантов гистонов и механизмов их откладки может дать ответ на этот вопрос.
Нуклеосомная структура хроматина.
Уровни компактизации ДНК хроматина. Нуклеосома как единица структурной организации хроматина. Октамер гистонов в составе нуклеосомы. Линкер и линкерные гистоны. Нуклеосомы и транскрипция. Сборка нуклеосом при репликации ДНК, ее этапы, нуклеоплазмин. Варианты белков-гистонов. Замещение вариантов гистонов без репликации ДНК. Структура 10 нм (нуклеосомной) фибриллы. Роль гистона Н1 в укладке нуклеосомного филамента.
Гистоновый код.
Химические модификации гистонов: aцетилирование, фосфорилирование, метилирование, убиквитинилирование и АДФ-рибозилирование. Понятие о ”гистоновом коде”. Активный и неактивный хроматин. Механизмы репрессии генов, обусловленные деацетилированием и метилированием гистонов. Белковые домены, осуществляющие мечение гистонов и чтение меток.
Позиционирование нуклеосом на ДНК. Ремоделирование хроматина.
Динамика хроматина и регуляция его компактизации. Фазирование нуклеосом. Подвижность (скольжение) нуклеосом.
Роль структуры хроматина на уровне нуклеосом в регуляции транскрипции. Чувствительность хроматина к ДНКазе I. Возможные варианты декомпактизации хроматина для обеспечения инициации и элонгации транскрипции. Белковые ферментативные комплексы, осуществляющие АТФ-зависимое ремоделирование. Роль нуклеосомного позиционирования в связывании TBP. Участие HMG-белков как архитектурных факторов в активации транскрипции.
Организация хроматина в ядре клетки.
Структура 30-нм фибриллы хроматина. Роль отдельных доменов гистонов в ее образовании. Модели укладки 30 нм фибриллы. Высшие уровни организации хроматина: доменно-петлевой (60-80 нм) и фибрилла 100-130 нм, интерфазный хроматин, хромосома. Представление о петельной организации хромосом. Функциональная компартментализация клеточного ядра. Хромосомные территории в интерфазном ядре. Особенности пространственной структуры интерфазных хромосом и активность генов. Политенные хромосомы.
Роль структуры хроматина в регуляции активности генов.
Роль нуклеосомных структур в активации экспрессии гена. Эухроматин и гетерохроматин. Распространение гетерохроматинизации по хромосоме. Эффекты положения генов. Роль ядерной ламины в инактивации генов.
Регуляция экспрессии генов посредством метилирования ДНК.
Механизмы инактивации генов при метилировании ДНК. Репликативное метилирование ДНК. Дезаминирование 5-метилцитозина и мутации. ДНК-метилтрансферазы эукариот. Наследование метилированного состояния и метилирование de novo. “Родительский” геномный импринтинг как эпигенетическая регуляция экспрессии генов. Динамика метилирования ДНК в ходе развития у млекопитающих.
Созревание и транспорт мРНК.
Кепирование, сплайсинг и полиаденилирование транскриптов, синтезируемых полимеразой II. Процессинг 3’-конца транскрипта: участие цис-регуляторных последовательностей и транс-факторов в этом процессе; эндонуклеазы процессинга и polyA-полимераза. Альтернативные промоторы и сайты полиаденилирования. Формирование рибонуклеопротеиновых частиц. “Контроль качества” пре-мРНК в ядре. Транспорт мРНК через ядерную мембрану. Сопряжение транскрипции, сплайсинга и транспорта РНК из ядра в цитоплазму. Ядерные поры.
Сплайсинг мРНК.
Открытие интронов. Типы интронов. Механизмы сплайсинга. Роль малых ядерных РНК и белковых факторов. Сплайсосома. Альтернативный сплайсинг, примеры. Энхансеры сплайсинга. Биологическая роль альтернативного сплайсинга, примеры. Роль белков, связывающихся с РНК-полимеразой на промоторе, в определении специфичности сплайсинга. Механизмы узнавания/обозначения экзонов и интронов. Сплайсинг и его роль в определении специфичности функционирования мРНК в цитоплазме. Транс-сплайсинг, его распространение. “Самосплайсинг”.
Процессинг тРНК и рРНК.
Процессинг тРНК и рРНК у про- и эукариот. РНКаза Р как рибозим при процессинге предшественников тРНК. Метилирование рибозы и образование псевдоуридина. Роль малых ядрышковых РНК. Интроны групп 1 и 2. Интроны группы 1 как рибозимы. Редактирование РНК. Типы редактирования. Инсерции уридиловых остатков, дезаминирование урацила и аденина. Редактирование двухцепочечных участков РНК.

Читайте также:
