Секреция иммуноглобулинов. Этапы секреции антител
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Автореферат диссертации по медицине на тему Влияние антител и цитокинов на эффективность фагоцитоза Staphylococcus aureus
На правах рукописи
СЛОБОДЧИКОВА СВЕТЛАНА ВАДИМОВНА
ВЛИЯНИЕ АНТИТЕЛ И ЦИТОКИНОВ НА ЭФФЕКТИВНОСТЬ ФАГОЦИТОЗА STAPHYLOCOCCUS AUREUS
J 4.03.09 — клиническая иммунология, аллергология
АВТОРЕФЕРАТ диссертации на соискание учёной степени кандидата медицинских наук
Работа выполнена в лаборатории экологической иммунологии Федерального государственного бюджетного учреждения науки Института экологии и генетики микроорганизмов Уральского отделения Российской академии наук, Пермь.
Научный руководитель: доктор медицинских наук
Шмагель Константин Владимирович
Официальные оппоненты: доктор медицинских наук, профессор,
заведующий лабораторией иммунологии воспаления ФГБУН Институт иммунологии и физиологии УрО РАН Гусев Евгений Юрьевич
доктор медицинских наук, профессор, заведующий отделом иммунобиологических методов диагностики ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» Долгих Олег Владимирович
Ведущая организация: Государственное бюджетное образовательное учреждение высшего профессионального образования Южно-Уральский государственный медицинский университет Министерства здравоохранения Российской Федерации (454092, г. Челябинск, ул. Воровского, 64).
Защита состоится «/т^» 2014 г. в час. на заседании
диссертационного совета 004.019.01 в Институте экологии и генетики микроорганизмов Уральского отделения Российской академии наук (614081, г. Пермь, ул. Голева, 13). Факс: (342) 280 92 11.
Автореферат разослан « » 2014 г.
Ученый секретарь диссертационного /^р^^у* Максимова Юлия Геннадьевна совета, кандидат биологических наук С/
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. S. aureus является основным возбудителем нозокомиальных инфекций во всем мире (Смирнов В. В., 1988; Fry D. Е. et al., 2011; May А. К. et al, 2011; Phakade R. S. et al., 2012). Одной из причин распространённости стафилококковых инфекций является отсутствие надёжных средств специфической профилактики (Weems J. J. et al., 2006; Simor A. E. et al., 2011 ) и лечения. Вакцины, предотвращающие развитие стафилококковых инфекций, отсутствуют. Антибиотики могут оказаться неэффективными в результате развития у бактерий антибиотикорезистентности (Выгодчиков Г. В., 1963; Graves S. F. et al., 2010). Учитывая, что наличие антибиотикоустойчивости стафилококков является серьёзной проблемой, надежда на создание альтернативных средств лечения возлагается на препараты, действие которых направлено на макроорганизм.
Известно, что ключевым механизмом защиты макроорганизма от стафилококка является фагоцитоз (Quie P. G. et al, 1977; Lekstrom-Himes J. A. et al, 2000; Moine L. et al, 2000). На эффективность фагоцитоза оказывает влияние локальное микроокружение, важнейшими компонентами которого являются антитела и цитокины. Антитела обладают наиболее выраженной опсонизирующей активностью по сравнению с другими молекулами (Williams A. J. et al., 1980; Szejda P. et al, 1984; Munro C. S. et al., 1985). Цитокины участвуют в регуляции количества лейкоцитов в очаге инфекции (Kimura M. et al., 1997; Matsukawa A. et ai, 1997) и осуществляют прайминг фагоцитов (Sheppard F. R. et al., 2005; El-Benna J. et al., 2008).
При создании иммунотропных средств лечения основные усилия разработчиков были сосредоточены на улучшении опсонизации бактерий с помощью введения или индукции in vivo образования антител. Однако препараты с указанными свойствами не смогли успешно пройти клинические испытания (Projan S. J. et al., 2006; Middleton J. R., 2008). В России в качестве дополнительного средства лечения стафилококковых инфекций в клинической практике используется антистафилококковый иммуноглобулин. Следует отметить, что этот препарат не проходил испытаний согласно требованиям доказательной медицины (Kelly J., 2000).
Неудачные попытки создания иммунопрепаратов для лечения стафилококковых инфекций свидетельствуют о недостаточном понимании их патогенеза (François P. et al, 2009; Garcia-Lara J. et al, 2009; Кузьменко О. M. и др., 2010). Всё это
обуславливает необходимость вновь обратиться к вопросам изучения механизмов фагоцитоза S. aureus и факторов, определяющих его эффективность.
Цель работы - исследование влияния антител и цитокинов на эффективность фагоцитоза S. aureus.
Основные задачи исследования:
1. Оценить выраженность влияния опсонизации S. aureus антителами на реакцию интернализации и выработку активных форм кислорода лейкоцитами человека при поглощении стафилококков в системе in vitro.
2. Оценить опсонизирующую и агрегационную активность коммерческого антистафилококкового иммуноглобулина по отношению к S. aureus и сравнить указанные свойства специфического препарата со свойствами нормального иммуноглобулина человека.
3. Определить закономерности продукции основных провоспалительных и противовоспалительных цитокинов клетками крови при контакте со стафилококком, а также оценить выраженность влияния цитокинов на процессы интернализации и продукции активных форм кислорода лейкоцитами при фагоцитозе S. aureus в системе in vitro.
Научная новизна. Впервые показано, что антитела в несколько раз усиливают процесс поглощения стафилококков, однако это не приводит к адекватному повышению выработки активных форм кислорода фагоцитами. Впервые обнаружено, что опсонизирующие свойства препарата коммерческого антистафилококкового иммуноглобулина по отношению к S. aureus уступают таковым препарата нормального иммуноглобулина человека. Впервые показана возможность применения спектротурбидиметрии для оценки агрегационных свойств антител. Впервые получены данные о зависимости интенсивности синтеза провоспалительных и противовоспалительных цитокинов в суточных культурах цельной крови от широкого диапазона концентраций S. aureus. Впервые показано, что цитокины, вырабатываемые при контакте клеток крови со стафилококком, преимущественно усиливают выработку активных форм кислорода фагоцитами, оказывая незначительное влияние на интенсивность поглощения бактерий.
Теоретическое и практическое значение работы. В теоретическом плане полученные результаты расширяют представления о механизмах фагоцитарных реакций по отношению к S. aureus. Показано, что основная проблема антистафилококковой защиты макроорганизма заключается в низком уровне кислородзависимой бактерицидности фагоцитов, поглотивших стафилококк. В практическом плане результаты работы позволяют по-новому взглянуть на эффективность повышения опсонизации S. aureus и применение цитокинов для усиления бактерицидного потенциала лейкоцитов при лечении стафилококковых инфекций.
Положения, выносимые на защиту:
1. Опсонизация стафилококков антителами в значительной степени усиливает интернализацию S. aureus лейкоцитами, оказывая при этом слабое стимулирующее влияние на выработку клетками активных форм кислорода.
2. Действие препарата коммерческого антистафилококкового иммуноглобулина на процесс поглощения S. aureus и агрегационная активность специфических антител уступают соответствующим свойствам нормального иммуноглобулина человека. Оба препарата в равной степени влияют на продукцию активных форм кислорода фагоцитами при поглощении S. aureus.
3. Цитокины, вырабатываемые клетками цельной крови при контакте со стафилококком, усиливают образование активных форм кислорода лейкоцитами, фагоцитирующими S. aureus-, влияние цитокинов на реакцию поглощения стафилококков выражено в меньшей степени.
Основные результаты исследования представлены в 4 печатных работах, из них 3 статьи вышли в рецензируемых журналах, рекомендуемых ВАК РФ для публикации материалов диссертационных исследований.
Объём и структура диссертации. Диссертация изложена на 122 страницах машинописного текста, состоит из введения, обзора литературы, описания материалов и методов исследования, двух глав собственных результатов исследований, заключения, выводов, списка сокращений и условных обозначений, списка цитируемой литературы, включающего 194 источника, из них 18 отечественных и 176 зарубежных, списка иллюстративных материалов, содержащего 13 рисунков и 12 таблиц.
Связь работы с научными программами и собственный вклад автора.
Исследования поддержаны программой Президиума РАН «Фундаментальные науки -медицине», № проекта: 09-П-4-1015.
Научные положения и выводы диссертации полностью базируются на результатах собственных исследований автора.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ Материалы и методы исследования
Источник биологического материала. В исследованиях использована периферическая венозная кровь 81 условно здорового добровольца (56 мужчин и 25 женщин), средний возраст - 33 года (от 18 до 62 лет).
Объекты фагоцитоза. В качестве объектов фагоцитоза были взяты обезвреженные формалином стафилококки S. aureus Cowan I (белок А+) и S. aureus Wood 46 (белок А"), модельные иммунные комплексы (Королевская JI. Б. и др., 2010) и опсонизированный зимозан. Окраску стафилококков осуществляли флюоресцеина изотиоцианатом (FITC; Sigma, США) (Пинегин Б. В. и др., 2001). Бактерии опсонизировали путем их инкубирования в растворах антистафилококкового и нормального иммуноглобулинов («Пермское НПО «Биомед»).
Определение средних размеров частиц взвеси стафилококков проводили методом спектротурбидиметрии (Кпенин В. И. и др., 1977; Королевская Л. Б. и др., 2010).
Культивирование клеток крови и получение супернатантов культур крови. Гепаринизированную венозную кровь смешивали с культуральной средой; к смеси добавляли один из стимуляторов: взвесь S. aureus Cowan 1, неопсонизированный зимозан, липополисахарид (LPS, Sigma) или фитогемагглютинин (РНА, Serva). После инкубации в течение суток надосадок культур использовали для определения содержания в нём цитокинов методом ИФА (Swaak A. J. G. et ai, 1997) и для экспериментов по исследованию влияния супернатантов на фагоцитарные реакции.
Исследование поглотительной активности лейкоцитов. Взвесь лейкоцитов получали путем обогащения в растворе декстрана сульфата 500 Т (Loba Feinchemic) (Leijh P.C.J, et al., 1979). Оценку поглощения FlTC-меченых стафилококков проводили на проточном цитофлюориметре BD FACSCalibur (Becton Dickinson, США) (Пинегин Б. В. и др., 2001).
Исследование люминолзависимой хемилюминесценции лейкоцитов (JT3XJI). Лейкоциты получали методом естественного оседания форменных элементов крови. В качестве стимуляторов использовали стафилококки, опсонизированный зимозан или иммунные комплексы. Измерение люминесценции проводили в динамическом режиме на микропланшетном люминометре «Luminoskan Ascent» («Thermo Electron Corporation», Финляндия). Результаты выражали в виде интегральных значений относительных световых единиц люминесценции (relative luminescence light units, RLU).
Статистическую обработку результатов проводили с использованием парного и непарного t-критерия Стьюдента (Лакин Г. Ф., 1990). Для определения влияния факторов применяли дисперсионный анализ; силу влияния факторов (у\2) оценивали по Плохинскому (Плохинский Н. А., 1980).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ
Изменение поглотительной активности гранулоцитов и моноцитов по отношению к S. aureus под влиянием опсонизации бактерий нормальным иммуноглобулином
Исследование поглотительной активности фагоцитов проводили методом проточной цитометрии. По полученным результатам рассчитывали следующие показатели: фагоцитарный индекс (ФИ) - процент клеток, поглотивших объекты
фагоцитоза, и фагоцитарное число (ФЧ) - отношение средней интенсивности флюоресценции одного поглотившего стафилококки фагоцита к средней интенсивности флюоресценции FITC-меченой бактериальной клетки.
Для упрощения анализа поглотительной активности фагоцитов нами был введён новый показатель - интегральный показатель поглощения (ИПП), который
Секреция иммуноглобулинов. Этапы секреции антител
Секреция иммуноглобулинов. Этапы секреции антител
Многочисленными исследованиями, проведенными главным образом на миеломных клетках, было установлено, что секретироваться могут как целые молекулы иммуноглобулинов, так и различные промежуточные продукты сборки: HL-, Н2-, L-субъединицы и т. д.
Кинетика синтеза и секреции для IgM, IgA, IgGl, IgG2a и каппа-цепей очень сходна. Одна плазматическая клетка секретирует 50— 700 молекул иммуноглобулинов в 1 сек. Как же осуществляется этот процесс?
Опытами по фракционированию клеток миелом было показано, что раньше всего вновь синтезированные цепи (метка 3Н-амипокислотами) обнаруживаются во фракции полирибосом, связанных с шероховатыми мембранами. Затем меченые иммуноглобулины переходят в гладкие мембраны, т. е. в аппарат Гольджи, и, наконец, секретируются во внеклеточную среду (Melchers, 1973). Скорость переноса молекул от шероховатых мембран к гладким выше, чем скорость переноса их из гладких мембран во внеклеточную среду. Сопоставляя время появления меченных аминокислотами иммуноглобулинов во внеклеточной среде (через 20—30 мин) со скоростями их синтеза на полирибосомах (~2 мин) и высвобождения в микросомальные везикулы (~2 мин) и из везикул (5 мин), легко подсчитать, что на перенос иммуноглобулинов через гладкие мембраны и клеточную оболочку уходит от 10 до 20 мин. Что же происходит за это время с транспортируемыми иммуноглобулинами?
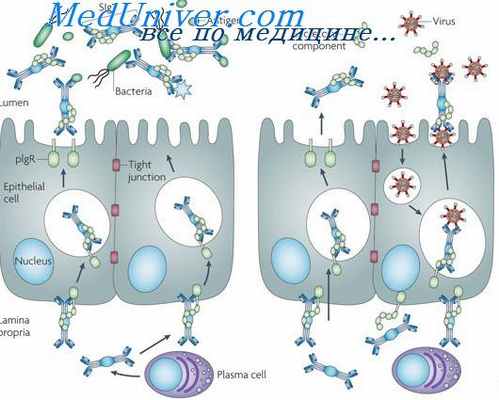
Одним из наиболее изученных процессов является присоединение к молекуле различных олигосахаридов. Включение Сахаров носит ступенчатый характер. Раньше всего присоединяются глюкозамин и манноза, а позже всего — галактоза и фукоза. Предполагается, что присоединение глюкозамина и маннозы способствует конформационным изменениям тяжелых цепей, облегчающим замыкание S—S-связей, и что поэтому оно характерно для ранних этапов сборки. Кроме того, не исключено, что присоединение глюкозамина необходимо для инициации транспорта иммуноглобулинов и что именно оно и определяет, будет молекула се-кретироваться или нет (Melchers, 1973). Данные о последовательности присоединения различных углеводных остатков к молекулам легких цепей, секретируемых клетками миеломы МОРС 46. Можно думать, что в принципе так же обстоит дело и с присоединением углеводов к Ы-цепи.
У разных животных процессы гликозилирования иммуноглобулинов идут неодинаково.
Какова же роль углеводного компонента в молекулах иммуноглобулинов? Возможно, что наличие углеводов в молекуле существенно для связи ее с мембранами клеточного ретикулума и секреции из клетки_ Причина этого пока не выяснена. С другой стороны, считать, что отсутствие секреции иммуноглобулинов из клеток при некоторых патологиях связано с отсутствием в иммуноглобулинах углеводного компонента, по-видимому, неверно. Так, описаны случаи (Sherr, Uhr, 1971a), при которых иммуноглобулин содержит и галактозу, и фукозу, но тем не менее не секретируется. Не секретируются содержащие углеводный компонент, но не связанные с L-цепями Н-цепи и, наоборот, легко секретируются миеломные L-цепи, лишенные углеводных компонентов, и IgGl с «недоделанным» углеводным компонентом (Melchers, 1973). Очевидно, сахара не являются все же строго необходимыми для транспортировки и секреции иммуноглобулинов.
До недавнего времени углеводному компоненту иммуноглобулинов уделялось меньше внимания, чем белковому. Не исключено, однако, что углеводы играют весьма существенную роль не только в конформации молекул иммуноглобулинов или транспортировке их из клеток, но и в биологической активности этих молекул, поэтому изучение этого вопроса является чрезвычайно важным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Секреция иммуноглобулинов. Этапы секреции антител
Ткани и органы. Иммунная система
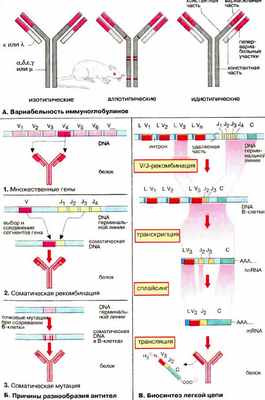
А. Вариабельность иммуноглобулинов
Несмотря на сходство своей основной структуры иммуноглобулины (Ig) чрезвычайно разнообразны. Считается, что в организме человека имеется примерно 10 8 различных вариантов антител. Вариабельность Ig относится как к легким, так и тяжелым цепям.
Имеется пять разновидностей тяжелых H-цепей (α, β, ε, γ и μ, см. с. 288), которые и определяют классы антител, и две разновидности легких L-цепей (κ и λ). Эти типы вариаций называют изотопическими . При биосинтезе Ig может происходить переключение плазматических клеток с продукции одного изотипа на другой («переключение генов»). Аллотипические вариации относятся к вариабельности аллелей в пределах вида, т. е. к генетически определяемым различиям одного индивидуума от другого. Идиотипические вариации определяют различия в антигенсвязывающем участке антител, Они касаются вариабельных доменов (на схеме розового цвета) легкой и тяжелой цепей. Некоторые их участки являются гипервариабельными (красного цвета на рисунке), т.е. их отличия особенно велики. Эти последовательности непосредственно участвуют в связывании антигена.
Б. Причины разнообразия антител
Исключительная вариабельность антител обусловлена тремя причинами.
1. Множественность генов. Имеется множество генов, кодирующих белки вариабельных доменов, однако выбирается и экспрессируется только один ген.
2. Соматические рекомбинации. Гены разделены на несколько сегментов, для которых имеются различные версии. Во время созревания В-клеток благодаря случайной комбинации сегментов возникают новые гены (мозаичные гены).
3. Соматические мутации. Во время дифференциации В-клеток и превращения в плазматические клетки происходят мутации в кодирующих генах. Таким образом, изначальные гены терминальной линии могут стать различными соматическими генами в индивидуальных клонах В-клеток.
В. Биосинтез легкой цепи
Рассмотрим основные особенности организации гена иммуноглобулина и его экспрессии на примере биосинтеза мышиной κ-цепи. Сегменты гена, кодирующие эту легкую цепь, обозначаются как L, V, J и С. Они локализованы на хромосоме 6 в ДНК (DNA) терминальной линии клеток мыши (у человека на хромосоме 2) и разделены друг от друга интронами различной длины.
Примерно 150 идентичных сегментов L гена кодируют сигнальный пептид (17-20 аминокислот) для секреции продукта (см. рис. 233). Наибольшая часть вариабельного домена (95 из 108 аминокислотных остатков) кодируется около 150 различными V-сегмен тами , расположенными рядом с L-сегментом. L- и V-сегменты всегда расположены парами, так называемым тандемом. Напротив, для J-сегмента (от англ. joining) существует максимально только пять вариантов. Они кодируют пептид из 13 аминокислотных остатков, который связывает вариабельную и константную части κ-цепи. Константная часть легкой цепи (84 аминокислоты) кодируется единственным С-сегментом .
Во время дифференциации В-лимфоцитов уникальная V/J-комбинация возникает в каждой В-клетке. Один из 150 сегментов L-V-тандема выбирается и связывается с одним из пяти J-сегментов. Это приводит к возникновению соматического гена, который значительно меньше по сравнению с геном терминальной линии. Транскрипция этого гена ведет к образованию гяРНК (hnRNA) для κ-цепи. Из этой РНК удаляются путем сплайсинга интроны и лишние J-сегменты (см. рис. 243). Зрелая мРНК (mRNA) содержит сегменты L-V-J-C и после транспорта в цитоплазму готова для трансляции. Последующие шаги биосинтеза Ig те же, что и для других мембранных или секреторных белков (см. рис. 233).
Множественная миелома.
Множественная миелома — злокачественное заболевание системы крови, при котором в костном мозге происходит повышенная выработка опухолевых плазматических клеток, синтезирующих патологический белок. Вследствие большого количества плазматических клеток меняется структура костного мозга, вытесняются нормальные клетки, нарушается саморегуляция кости. Это приводит к развитию болей в костях, патологическим переломам (переломы в покое, при перевороте во сне, при минимальной нагрузке), появлению анемических жалоб – общей слабости, недомоганию, одышки, учащению сердцебиения. Плазматические клетки в норме и при патологии. Иммуноглобулин и парапротеин.) 3
Ниже изображена упрощенная схема кроветворения. Гемопоэтическая (кроветворная) стволовая клетка дает начало миелоидной и лимфоидной клеткам-предшественницам, из которых в дальнейшем образуются все клетки крови. Как представлено на рисунке, плазматическая клетка образуется из В-клетки в костном мозге, а В-клетки – это производное лимфоидных предшественников. Поэтому множественная миелома является лимфопролиферативным заболеванием, то есть, в основе болезни лежит пролиферация (увеличение) клеток лимфоидного ряда, а именно плазматических клеток (плазмоцитов).
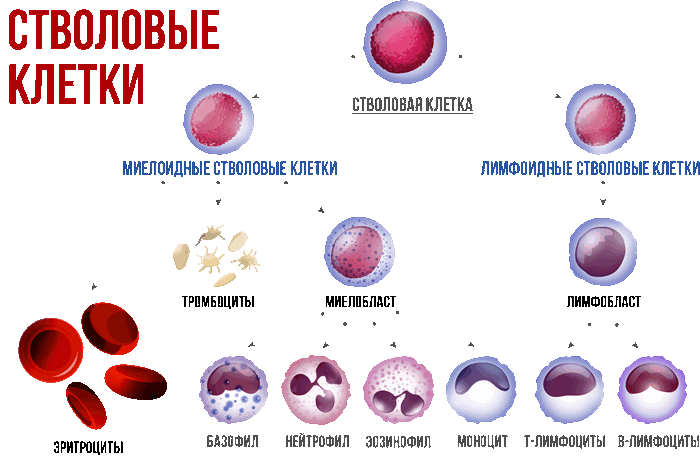
В норме в костном мозге находится около 1% плазматических клеток. Основная функция плазматических клеток заключается в выработке иммуноглобулинов – антител, которые распознают и «выключают» чужеродные агенты – антигены. Выработка специфических антител плазматическими клетками – это важная часть иммунной системы. Когда чужеродный антиген попадает в организм человека (молекулы бактерий, вирусов, грибов, токсины и др.), В-клетка продуцирует плазматическую клетку, которая вырабатывает антитело, строго специфичное для данного чужеродного агента. Антитело связывается с антигеном, что приводит к развитию классического иммунного ответа.
Молекула иммуноглобулина содержит 2 тяжелые и 2 легкие цепи. По типу строения тяжелой цепи различают 5 классов иммуноглобулинов (IgG, IgM, IgA, IgD, IgE), а легкие цепи существуют 2 типов – каппа (κ) и лямбда (λ).
При множественной миеломе на этапе созревания плазматической клетки происходит сбой (генетическая аберрация), в результате чего происходит бесконтрольное увеличение опухолевых клональных плазматических клеток, которые продуцируют (синтезируют) большое количество белка. Этот белок называется моноклональным, то есть он вырабатывается клоном опухолевых миеломных клеток (так, миелома может протекать с секрецией моноклонального белка Аk, или G λ, или Mk и т.д. – в зависимости от типа легкой и тяжелой цепи). У моноклонального белка много синонимов: парапротеин, М-градиент, М-компонент, М-белок. Этот белок не несет функций иммунной системы – является дефектным, он не связывается с антигеном, продуцируется в большом количестве и является причиной многообразия симптомов множественной миеломы. Чаще всего встречается множественная миелома с секрецией парапротеина G (58% случаев), парапротеина А (20%). Редко выявляется секреция парапротеина М, D, E.
Примерно в 18% случаев изолировано синтезируется большое количество легких цепей парапротеина (каппа или лямбда), моноклональные легкие цепи (их называют СЛЦ – свободные легкие цепи) могут выявляться в крови и моче. Белок, представленный легкими цепями в моче, называется белком Бенс-Джонса, а данный тип миеломы называется миеломой Бенс-Джонса (BJ). Также довольно часто наблюдается сочетанная секреция (например, множественная миелома, протекающая с секрецией Gk и BJk).
Стоит уточнить, что не всегда при миеломе вырабатывается моноклональный белок. Примерно в 3% случаев наблюдается несекретирующая форма множественной миеломы. В этом случае в основе заболевания также лежит бесконтрольная пролиферация опухолевых плазматических клеток в костном мозге, однако они не синтезируют белок.
ЭПИДЕМИОЛОГИЯ ЗАБОЛЕВАНИЯ
Множественная миелома составляет 1% среди всех злокачественных опухолей, и 13% всех опухолевых заболеваний кроветворной системы. Множественная миелома чаще встречается у мужчин. Заболевают миеломой преимущественно пожилые люди, только 5% пациентов моложе 40 лет. Число заболевших увеличивается с возрастом. Так, заболеваемость в Европе составляет 6 на 100 тыс. человек населения в год, при этом в возрастной группе 70-79 лет этот показатель достигает 20 на 100 тыс. человек. Смертность составляет 4,1 на 100 тыс. в год. Заболеваемость множественной миеломой в РФ составляет 2,7 на 100 тыс. в год.
Причины развития множественной миеломы неизвестны. 4
« На современном этапе развития медицины множественная миелома является хроническим заболеванием, однако достигнуты значительные успехи в терапии, которые позволяют контролировать течение болезни. В ряде случаев лечение приводит к многолетней ремиссии, что способствует хорошему самочувствию пациентов, сохранению качества жизни. »
СИМПТОМЫ МНОЖЕСТВЕННОЙ МИЕЛОМЫ
Симптоматической миеломе, как правило, предшествует состояние, называемое моноклональная гаммапатия неясного значения (сокращенно МГНЗ). Это состояние означает, что в крови пациента присутствует моноклональный белок, однако симптомы болезни отсутствуют. От момента появления МГНЗ до развития симптоматической множественной миеломы может пройти более 10 лет.
Симптомы множественной миеломы крайне разнообразны, не существует четко очерченной клинической картины. Наблюдается вариабельное течение болезни –заболевание иногда протекает очень быстро, агрессивно, а может наблюдаться медленное вялотекущее течение миеломы. В ряде случаев имеет место бессимптомная форма болезни.
Основные симптомы множественной миеломы обусловлены 3 патологическими механизмами, происходящими в организме при этом заболевании. Рассмотрим основные признаки миеломы.
- Повышенная выработка опухолевых плазматических клеток лежит в основе симптомокомплекса CRAB (C – гиперкальциемия, R – нарушение функции почек; А – анемия, В – поражение костей скелета);
- Синтезируемый патологический белок вызывает синдром повышенной вязкости крови, периферическую полинейропатию;
- Вследствие снижения выработки нормальных иммуноглобулинов у больного возникает иммунодефицит, что приводит к частым разнообразным инфекционным проявлениям.
Какие симптомы встречаются чаще всего?
Какие симптомы встречаются чаще всего?
Наиболее ранний и частый симптом – боли в костях (70% больных). Почему поражаются кости при множественной миеломе? В норме костная ткань находится в динамическом равновесии – слажено работают остеобласты (молодые клетки кости), и остеокласты (клетки, разрушающие костную ткань, растворяя минеральную составляющую костей). При множественной миеломе этот баланс нарушается. В костном мозге происходит повышенная выработка опухолевых плазматических клеток. Нормальная работа костной ткани при этом нарушается из-за продукции различных активных молекул, остеокласты начинают разрушать костную ткань, а остеобласты подавляются и не работают. Развиваются деструкции в костях (от лат. destructio – разрушение). На рисунке ниже представлен массивный остеодеструктивный процесс в костях позвоночника.
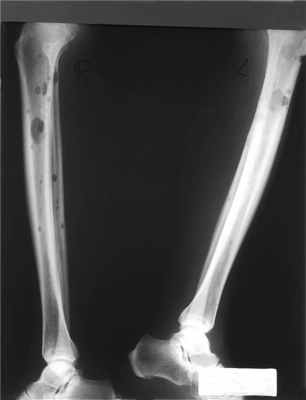
Остеодеструктивный процесс у больного множественной миеломой.
Чаще деструкции развиваются в плоских костях (череп, таз, грудина, ребра, позвонки), проксимальных отделах длинных трубчатых костей (плечевых, бедренных). Вследствие того, что кости становятся ломкими, истонченными, происходят патологические переломы костей. Перелом называется патологическим, если он произошел в зоне патологической перестройки кости. Он случается от травмы, неадекватной по силе (подъем незначительного груза, переворот во сне, резкое движение), или же может произойти в покое. Часто при миеломе возникают компрессионные переломы позвонков, они могут привести к сдавлению спинного мозга, параличу.
Довольно часто при множественной миеломе опухолевые плазматические клетки способны «жить» не только в костном мозге, но и за его пределами. В этом случае возникает «плюс» - ткань – образование. Из-за того, что образование (опухоль) состоит из плазматических клеток, ее называют плазмоцитома. Наиболее часто (примерно у 20% больных в дебюте миеломы) плазматические клетки активно пролиферируют в костном мозге, разрушают костную пластинку и выходят за пределы кости. Такой вид опухоли называется костная плазмоцитома – она исходит из кости. Также плазматическая клетка может выйти в периферическую кровь и с током крови (гематогенным путем) попасть в любой орган или ткань, формируя в этом месте образование. Такая опухоль, не связанная с костью, называется экстрамедуллярное поражение или экстрамедуллярная плазмоцитома. Это более редкое явление (3-7% в дебюте миеломы), поражаться может абсолютно любой орган или ткань. Клинически пациент может заметить появление плотного безболезненного образования на туловище и конечностях. Увеличиваться оно может медленно, а может очень быстро – это зависит от биологических особенностей миеломы. Клинические симптомы плазмоцитомы обусловлены ее локализацией. Например, при плазмоцитоме плечевой кости опухоль может проникать в окружающие ткани, мышечно-нервные пучки, что приведет к ограничению движения и болевому синдрому. Костная плазмоцитома позвонка может привести к сдавлению спинного мозга, что вызовет неврологический дефицит. Экстрамедуллярная плазмоцитома с поражением желудка вызовет симптомы, характерные для гастрита, а плазмоцитома с поражением головного мозга может проявиться появлением двоения в глазах, головокружения, головных болей, потерей сознания. При лечении плазмоцитома может подвергнуться полному обратному развитию.
Другой симптом из симптомокомплекса CRAB – гиперкальциемия, то есть повышение в крови уровня кальция. Это происходит вследствие того, что кальций из разрушенной кости попадает в кровь. Наблюдается этот симптом у 10-30% больных и может проявляться тошнотой, рвотой, запорами, гипотонией, мышечной слабостью, аритмиями.
Поражение почек – значимый и грозный симптом множественной миеломы, встречается у 20% в дебюте заболевания и более чем у 50% больных в рецидиве. При остром повреждении почек дебют миеломы бурный. У пациента возникает тошнота, рвота, может быть уменьшение объема выделяемой мочи. С этими симптомами больной поступает экстренно в стационар, выполняется биохимический анализ крови, где выявляется высокий креатинин. Пациент переводится в нефрологическое отделение, где незамедлительно начинается программный гемодиализ, а далее, при дообследовании, устанавливается диагноз множественная миелома.
Вследствие вытеснения нормальных клеток костного мозга часто (у 60-70% больных) развивается анемия. При этом у пациента могут быть следующие симптомы: головокружение, общая слабость, недомогание, одышка, шум в ушах, учащение сердцебиения.
В связи с нарушенной выработкой нормальных иммуноглобулинов у больного развивается иммунодефицит, что приводит к частым затяжным инфекциям.
К более редким симптомам миеломы относятся проявления синдрома повышенной вязкости крови. Этот синдром развивается в связи с большим количеством патологического белка, который циркулирует в кровяном русле. Основные проявления: кровоточивость слизистых, повышение артериального давления, неврологические, общемозговые нарушения – головная боль, головокружение, повышение артериального давления, снижение слуха, двоение в глазах. Другим редким симптомом является периферическая полинейропатия – состояние, когда человек ощущает покалывание, жжение в стопах, голенях, реже – кистях. Поражение, как правило, симметрично. На рисунке ниже наглядно представлен спектр ощущений, которые может испытывать человек, страдающий полинейропатией.

Ощущения, которые испытывает больной, страдающий периферической полинейропатией.
ДИАГНОСТИКА
Первые признаки, которые могут натолкнуть на мысль о множественной миеломе, обнаруживаются при исследовании крови и мочи во время обычного медицинского обследования еще до появления клинических симптомов болезни. Так, в общем анализе крови у пациента может выявляться повышенная скорость оседания эритроцитов (СОЭ), снижение гемоглобина (анемия). В моче может наблюдаться белок (протеинурия). В биохимическом анализе крови – повышение общего белка (протеинемия), креатинина, кальция, активности ЛДГ (лактатдегидрогеназы). Но все эти проявления не обязательно указывают на диагноз. Они позволяют заподозрить миелому, а подтвердить заболевание помогут следующие исследования:
- иммунохимическое исследование крови и мочи;
- миелограмма (исследование костного мозга);
- инструментальные методы исследования.
Иммунохимическое исследование крови и мочи – это анализ, который позволяет понять природу белка, находящегося в сыворотке и моче. Правильно выполненный полноценный иммунохимический анализ дает количественные и качественные характеристики белка – к какому типу он относится (G,A,M,D,E; тип СЛЦ – каппа или лямбда).
Исследование костного мозга также необходимо для диагностики множественной миеломы. В пунктате костного мозга при миеломе определяется более 10 % плазматических клеток. Также при множественной миеломе важно выполнять генетическое исследование клеток костного мозга. Это специальный генетический анализ, который выявляет различные перестройки в хромосомах, на основании чего врач может прогнозировать, насколько агрессивно будет протекать заболевание в данном конкретном случае.
Инструментальные методы исследования необходимы для того, чтобы обнаружить повреждение костей, характерное для миеломы – деструкции, переломы, новообразования (плазмоцитомы). Есть несколько методов исследования: рентгенография, КТ, МРТ.
Диагноз симптоматической множественной миеломы устанавливается при обнаружении более 10% плазматических клеток в костном мозге и наличии признаков симптомокомплекса CRAB (см. выше). При этом, может быть лишь один признак, а могут присутствовать и все четыре симптома.
Адекватный перечень обследований, необходимых для диагностики множественной миеломы, может назначить только врач. Вследствие разнообразия симптомов заподозрить множественную миелому бывает сложно. Пациентам нужно знать, что боль в любом отделе позвоночника требует уточнения ее причины. Противопоказано принимать обезболивающие, ходить к мануальному терапевту, посещать курс массажа, если присутствует болевой синдром неуточненного происхождения. Требуется выполнение инструментальных методов исследования (КТ или МРТ) для того, чтобы понять причину болевого синдрома.
1. Алгоритмы диагностики и протоколы лечения заболеваний системы крови Менделеева Л.П. и др. в кн. под ред. В.Г.Савченко, Москва,2018г Т2, с.407-496
2. Трудности морфологической диагностики множественной миеломы В. В. Байков Онкогематология – 2007. – № 2– 10–14с
3. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний под ред. И.В.Поддубной, В.Г.Савченко, Москва,2018г, с.213-217
4. Множественная миелома (патогенез, клиника, диагностика, дифференциальный диагноз). часть I Бессмельцев С.С. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2013. Т. 6. № 3. С. 237-257.
Секреция иммуноглобулинов. Этапы секреции антител
В процессе формирования приобретенного инфекционного иммунитета важная роль принадлежит антителам (анти - против, тело - русское слово, т. е. вещество). И хотя чужеродный антиген блокируется специфическими клетками организма и подвергается фагоцитозу, активное действие на антиген возможно лишь при наличии антител.
Антитела - специфические белки, иммуноглобулины, образующиеся в организме под воздействием антигена и обладающие свойством специфически с ним связываться и отличающиеся от обычных глобулинов наличием активного центра.
Антитела являются важным специфическим фактором защиты организма против возбудителей болезней и генетически чужеродных веществ и клеток.
Антитела образуются в организме в результате инфицирования (естественная иммунизация), или вакцинации убитыми и живыми вакцинами (искусственная иммунизация), или контакта лимфоидной системы с чужеродными клетками, тканями (трансплантанты) либо с собственными поврежденными клетками, ставшими аутоантигенами.
Антитела относятся к определенной фракции белка, главным образом к a -глобулинам, обозначаемым IgY.
- первая - небольшие молекулы с константой седиментации 7S (a-глобулины);
- вторая - большие молекулы с константой седиментации 19 S (a - глобулины).
Молекула антитела включает четыре полипептидные цепи, состоящие из аминокислот. Две из них тяжелые (м.м. 70000 дальтон) и две легкие (м.м. 20000 дальтон). Легкие и тяжелые цепи связаны между собой дисульфидными мостиками. Легкие цепи являются общими для всех классов и подклассов. Тяжелые цепи имеют характерные особенности строения у каждого класса иммуноглобулинов.
В молекуле антитела имеются активные центры, располагающиеся на концах полипептидных цепей и специфически реагирующие с антигеном. Неполные антитела одновалентны (антидетерминанта одна), полные имеют две, реже более антидетерминантны (рис.4).
Рис. 4. Структура иммуноглобулина.
Отличие специфических иммуноглобулинов в строении тяжелых цепей, в пространственном рисунке антидетерминант. Согласно классификации Всемирной организации здравоохранения (ВОЗ), различают пять классов основных иммуноглобулинов: IgG циркулируют в крови, составляют 80% всех антител. Проходят через плаценту. Молекулярная масса 160000. Размер 235 х 40А o . Важны как специфический фактор иммунитета. Обезвреживают антиген путем его корпускуляризации (преципитации, осаждения, агглютинации), что облегчает фагоцитоз, лизис, нейтрализацию. Способствуют возникновению аллергических реакций замедленного типа. По сравнению с другими иммуноглобулинами IgG относительно термоустойчив - выдерживает нагревание при 75 o С 30 мин.
Ig M, - циркулирует в крови, составляя 5-10% всех антител. Молекулярная масса 950000, константа седиментации 19 S, функционально пятивалентен, первым появляется после заражения или вакцинации животного. Ig M не участвует в аллергических реакциях, не проходит через плаценту. Действует на грамположительные бактерии, активизирует фагоцитоз. К классу Ig M относят антитела групп крови человека - А, В, О.
Ig A, - включает два вида: сывороточный и секреторный. Сывороточный Ig A имеет молекулярную массу 170000, константа седиментации 7 S. Не обладает способностью преципитировать растворимые антигены, принимает участие в реакции нейтрализации токсинов, термоустойчив, синтезируется в селезенке, лимфатических узлах и в слизистых оболочках и поступает в секреты - слюну, слезную жидкость, бронхиальный секрет, молозиво.
Секреторный Ig A (S Ig A) характеризуется наличием структурного добавочного компонента, представляет собой полимер, константа седиментации 11 S и 15 S, молекулярная масса 380000, синтезируется в слизистых оболочках. Биологическая функция S Ig A заключается в основном в местной защите слизистых оболочек, например при заболеваниях желудочно-кишечного тракта или дыхательного. Обладают бактерицидностью и опсоническим эффектом.
Ig D, - концентрация в сыворотке крови не более 1%, молекулярная масса 160000, константа седиментации 7 S. Ig D обладает активируемой активностью, не связывается с тканями. Отмечено увеличение его содержания при миеломной болезни человека.
Ig E, - молекулярная масса 190000, константа седиментации 8,5 S. Ig E термолабилен, прочно связывается с клетками тканей, с тканевыми базофилами, принимает участие в реакции гиперчувствительности немедленного типа. Ig E играет защитную роль при гельминтозах и протозойных болезнях, способствует усилению фагоцитарной активности макрофагов и эозинофилов.
Антитела лабильны к температуре 70 0 С, и спирты денатурируют их. Активность антитела нарушается при изменении (отключении) pH среды, электролитов и др.
Все антитела имеют активный центр - площадь участка в 700 А o , что составляет 2% поверхности антитела. Активный центр состоит из 10-20 аминокислот. Чаще всего в них присутствуют тирозин, лизин, триптофан. К положительно заряженным гаптенам антитела имеют отрицательно заряженную группировку - СООН - . К гаптенам, заряженным отрицательно, присоединяется группировка NH4 + .
Антитела обладают способностью отличать один антиген от другого. Они взаимодействуют только с теми антигенами (за редким исключением), против которых они выработаны и подходят к ним по пространственной структуре. Эта способность антитела получила название комплиментарности.
Специфичность антитела обусловлена химической структурой, пространственным рисунком антидетерминант. Она связана с первичной структурой (чередованием аминокислот) белковой молекулы антитела.
Тяжелые и легкие цепи иммуноглобулинов обусловливают специфичность активного центра.
В последнее время обнаружено, что существуют антитела против антител. Они останавливают действие обычных антител. На основе этого открытия возникает новая теория - сетевая регуляция иммунной системы организма.
Теория образования антител затрагивает ряд вопросов из различных смежных дисциплин (генетики, биохимии, морфологии, цитологии, молекулярной биологии), стыкующихся в настоящее время с иммунологией. Существует несколько гипотез синтеза антител. Наибольшее признание получила клонально-селекционная гипотеза Ф. Бернета. Согласно ей, в организме присутствует более 10000 клонов лимфоидных и иммунологически компетентных клеток, способных реагировать с различными антигенами или их детерминантами и вырабатывать антитела. Допускается, что клоны таких клеток способны вступать в реакцию с собственными белками, в результате чего уничтожаются. Так погибают клетки, образующие антиагглютинины против А - антигена у организмов с группой крови А и анти - В - агглютины с группой крови В.
Если эмбриону ввести какой- либо антиген, то аналогичным образом он уничтожает соответствующий клон клеток, и новорожденный в течение всей последующей жизни будет толерантным к данному антигену. Теперь у новорожденного осталось только "свое", либо попавшее извне "чужое", которое распознается мезенхимными клетками, на поверхности которых имеются соответствующие рецепторы "флажки" - антидетерминанты. По мнению Ф. Бернета, мезенхимная клетка, получившая антигенное раздражение, дает начало популяции дочерних клеток, которые вырабатывают специфические (соответствующие антигену) антитела. Специфичность антител зависит от степени их взаимодействия с антигеном.
В формировании комплекса антиген-антитело участвуют возникающие между ионными группами кулоновские силы и силы притяжения Ван-Дер-Ваальса, полярные силы и силы Лондона, межатомные ковалентные связи.
Известно, что взаимодействуют они как целые молекулы. Поэтому на одну молекулу антигена приходится значительное количество молекул антител. Они создают слой толщиной до 30 А o . Комплекс антиген-антитело разъединим с сохранением первоначальных свойств молекул. Первая фаза соединения антитела с антигеном неспецифическая, невидимая, характеризуется абсорбцией антитела на поверхности антигена или гаптена. Протекает при температуре 37 o С за несколько минут. Вторая фаза специфическая, видимая, завершается феноменом агглютинации, преципитации или лизиса. В этой фазе необходимо присутствие электролитов, а в некоторых случаях и комплемента.
Несмотря на обратимость процесса, комплексообразование между антигеном и антителом играет положительную роль в защите организма, которая сводится к опсонизации, нейтрализации, иммобилизации и ускоренной элиминации антигенов.
- коагулирующие (преципитины, агглютинины), облегчают фагоцитоз;
- лизирующие (комплементсвязывающие: бактериолизисы, цитолизисы, гемолизисы), вызывают растворение антигена;
- нейтрализующие (антитоксины), лишают антиген токсичности.
Реакция антиген-антитело может быть для организма полезной, вредной или индифферентной. Положительное влияние реакции в том, что она нейтрализует яды, бактерии, облегчая фагоцитоз, преципитирует белки, лишая их токсичности, лизирует трепонемы, лептоспиры, животные клетки.
Комплекс антиген-антитело может быть причиной лихорадки, расстройства клеточной проницаемости, интоксикации. Может возникнуть гемолиз, анафилактический шок, крапивница, сенная лихорадка, бронхиальная астма, аутоиммунное расстройство, отторжение трансплантата, аллергические реакции.
В иммунной системе нет готовых структур, вырабатывающих антитела и осуществляющих реакции иммунитета. Антитела образуются в ходе иммуногенеза.
Читайте также:
