Симптомы лимфаденопатии при токсоплазмозе и ее лечение
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Причиной увеличения лимфоузлов в большинстве случаев являются процессы, не связанные с гемобластозами: чаще всего это общепедиатрические, инфекционные, иммунные и другие состояния Тот факт, что врач-педиатр достаточно часто обнаруживает у своих
Причиной увеличения лимфоузлов в большинстве случаев являются процессы, не связанные с гемобластозами: чаще всего это общепедиатрические, инфекционные, иммунные и другие состояния
Тот факт, что врач-педиатр достаточно часто обнаруживает у своих пациентов увеличенные лимфатические узлы (ЛУ) и ему приходится в сжатые сроки находить ответ на вопросы «почему?» и «что делать?», позволяет обойтись без длинного введения. Так, при проведении педиатрического скрининга и последующего анализа 1607 диагнозов острых и хронических заболеваний у детей и подростков в возрасте 5 — 17 лет выявлено, что болезни ЛУ обнаружены в 3,35% случаев [6]. Традиционно при обнаружении увеличенных ЛУ, не учитывая другие составляющие этого синдрома (анамнез, общую клиническую картину, местную симптоматику), педиатр думает об онкогематологическом заболевании. Вследствие этого такие больные составляют 40% всех пациентов онкогематологов [7], что представляется неоправданным. Частота впервые выявленных случаев онкогематологических заболеваний в нашей стране невелика. Заболеваемость острыми лейкозами составляет 4,0 — 5,0 случаев на 100 000 детей в год, неходжкинскими лимфомами — 0,9 — 1,1 на 100 000 детей в год. Отсюда понятно, почему подавляющая масса детей с увеличенными ЛУ с приемов гематологов возвращаются к педиатрам с диагнозом лимфаденит. То есть причиной увеличения ЛУ в большинстве случаев являются процессы, не связанные с гемобластозами: общепедиатрические, инфекционные, иммунные и другие состояния. Исходя из вышесказанного, мы решили представить нашу точку зрения на синдром увеличения лимфатических узлов.
 |
| Рисунок 1. Подчелюстные лимфатические узлы при лимфогранулематозе (УЗИ, 7,5 МГц) |
 |
| Рисунок 2. Подчелюстной узел при туберкулезе (УЗИ, 7,5 МГц) |
Увеличение ЛУ может быть результатом лимфаденита (ЛА) и лимфаденопатии (ЛАП).
ЛА — воспаление лимфатических узлов, возникающее как осложнение после различных гнойно-воспалительных заболеваний и специфических инфекций (туберкулез, актиномикоз, чума и др.). ЛА, как правило, представляет собой вторичный процесс.
ЛАП — системное увеличение лимфатических узлов, не связанное с воспалением (воздействие некоторых медикаментов, пролиферация, метастазирование и т. п.).
Эпидемиология ЛА и ЛАП не разработана. Можно только отметить, что, по данным И. С. Тарасовой [6], при сплошных массовых исследованиях детей Брянской области ЛА встречается, как и следовало ожидать, несколько чаще (1,86% среди всех осмотренных), чем ЛАП (1,49% от общего контингента).
Методы исследования ЛУ должны быть максимально стандартизованы. В клинической практике оценивают жалобы (местная болезненность, местное или общее повышение температуры, общесоматические жалобы), анамнез (эпиданамнез, давность появления, локализация увеличенных ЛУ в одной или нескольких группах, одновременное их увеличение или постепенное, скорость манифестации болезни и т. д.). Особое значение имеет осмотр больного. Наряду с тщательным общепедиатрическим осмотром по системам необходимо обратить внимание на число измененных ЛУ и их локализацию по группам. Размеры лимфоузлов должны оцениваться только объективно: в миллиметрах или сантиметрах. Принятое в нашей стране и широко рекомендуемое в отечественной литературе сравнение размеров ЛУ с зерном, горохом, вишней, лесным или грецким орехом нерационально, дает несопоставимые результаты и должно быть изжито. Необходимо тщательно фиксировать соотношение увеличенных ЛУ между собой. Например, расположение ЛУ по типу «солнечной системы» (один большой ЛУ в центре и по периферии от него ЛУ меньшего диаметра) типично для туберкулезного лимфаденита [2]. ЛУ могут быть эластичными, плотными, с явлениями флюктуации. Обязательно описывается спаянность ЛУ с соседними узлами и окружающими тканями, наличие или отсутствие болезненности при пальпации. Необходимо осмотреть и описать состояние всех доступных ЛУ: затылочных, подчелюстных, передних и задних шейных, над- и подключичных, подмышечных, локтевых, паховых, подколенных. Данные осмотра и пальпации дополняются, подтверждаются и уточняются инструментальными методиками. Прежде всего это методы неинвазивной визуализации, использующиеся для изучения глубоко расположенных ЛУ. Они позволяют точно определить размеры ЛУ, изменения групп ЛУ, недоступных осмотру и пальпации, характеристики капсулы, спаянность, топографические особенности, внутреннюю структуру; исключить состояния, симулирующие увеличение ЛУ (опухоли, не исходящие из ЛУ, гематомы, аномалии почек и т. п.). Крайне важно получение информации о состоянии печени и селезенки. На первом месте по доступности и быстроте получения информации стоит эхография (УЗИ). ЛУ диаметром менее 1,5 см по плотности приближаются к окружающей жировой ткани, визуализируются редко, ограничить их опухолевое поражение от иных причин увеличения только по данным УЗИ практически невозможно. Такие ЛУ наблюдаются прежде всего при инфекционных процессах, реактивных поражениях, а у детей с гемобластозами — в состоянии полной ремиссии. ЛУ диаметром 1,5 — 2 см хорошо визуализируются в случае, если они проецируются на эхонегативные структуры или изменяют обычные топографо-анатомические соотношения. Весь спектр УЗИ-изменений может быть сведен к нескольким основным группам [3].
1. Увеличение отдельных ЛУ оценивается как небольшое, если они не теряют своей обычной УЗИ-картины, сохраняют капсулу, четкость и ровность контура, не изменяют топику органа. Такой тип характерен для инфекционных поражений, особенно туберкулеза, вирусного гепатита, коллагенозов, иммунодефицитов, гемобластозов у детей низкой группы риска.
2. Дальнейший рост ЛУ приводит к появлению сливающихся между собой масс, оттесняющих сосуды. Наблюдается при гнойном расплавлении группы лимфоузлов, при гемобластозах, метастазирующих опухолях.
3. Сдавление или оттеснение внутренних органов. При этом может возникнуть гидронефроз за счет сдавления мочеточников, значительное смещение матки, мочевого пузыря. Типично для крайне неблагоприятных вариантов миелолейкозов, лимфом Ходжкина и неходжкинских лимфом.
УЗИ-заключения могут быть подтверждены компьютерной томографией (КТ). Дополнительно КТ позволяет уточнить структуру ЛУ, их топографические соотношения, обнаружить другие группы ЛУ.
Если поверхностные лимфоузлы есть смысл оценивать только эхографически, а мезентериальные и забрюшинные ЛУ практически одинаково хорошо выявляются методами УЗИ и КТ, то внутригрудные ЛУ выявляются почти исключительно рентгенологически.
| Принятое в нашей стране и широко рекомендуемое в отечественной литературе сравнение размеров лимфоузлов с зерном, горохом, вишней, лесным и грецким орехом нерационально, дает несопоставимые результаты и должно быть изжито |
Такие методы диагностики, как изотопная сцинтиграфия и лимфография, могут применяться по очень строгим показаниям в специализированных клиниках или ограниченно при динамических исследованиях и не используются в широкой практике.
Достоверное выявление причин увеличения ЛУ возможно лишь гистологическими методами. При этом материал должен быть получен только путем открытой биопсии ЛУ, хотя современные методики тонкоигольной биопсии позволяют получить достоверные результаты. Рекомендовавшаяся ранее пункционная биопсия дает очень большой процент ложно-положительных и ложноотрицательных результатов.
Увеличение ЛУ схематически [5, 11] можно представить (с описанием некоторых практически значимых, но малоизвестных форм) как связанное с инфекцией (ЛА) и не связанное с инфекцией (ЛАП).
1. ЛА вирусной природы.
- цитомегалия.
- инфекционный мононуклеоз.
- корь.
- краснуха.
- орнитоз.
- синдром Ардмора.
2. ЛА при бактериальных инфекциях.
- кариес.
- абсцесс.
- болезнь кошачьей царапины. Вызывается Bortanella (Rochalimeae) hensella. Чаще доброкачественно протекающее со спонтанным выздоровлением двустороннее воспаление ЛУ (в т. ч. мезентериальных и внутригрудных) с общими и кожными неспецифическими симптомами, обусловленное ранениями кожи кошками, собаками, реже — посторонними острыми предметами. Описаны гранулематозный гепатит, спленомегалия, энцефалитические реакции, судорожный синдром [8, 10]. Наблюдается в основном у детей и подростков преимущественно поздней осенью и зимой.
- Боррелиоз. Известен как псевдолимфома. Лимфопролиферативное поражение ЛУ и кожи при заражении Borrelia burgdorferi после укуса клещами. Описаны переходы в злокачественные лимфомы.
- Туберкулез. Наряду с типичными формами туберкулеза следует помнить о т. н. атипичных микобактериозах. По данным Ф. Миллера [2], до 50% подчелюстных ЛА у детей до 5 лет вызываются атипичными штаммами микобактерий (в частности, типа avium), и вероятность микобактериального поражения ЛУ тем выше, чем младше ребенок (рис. 1).
- Сепсис.
- Аллергический субсепсис. Рассматривается и как вариант ювенильного ревматоидного артрита, т. н. болезнь Стилла.
- Сифилис. Темпы роста заболеваемости сифилисом детей значительно опережают аналогичный показатель у взрослых. Так, заболеваемость сифилисом среди взрослых возросла за 4 года в 15,8 раз, а среди детей — в 21 раз. 65,6% детей заразились половым путем [1].
- Генито-аноректальный симптомокомплекс — осложнение хронического ЛА при хламидиозе серотипов L1—L3 с перипроктитом, хронически рецидивирующими перианальными и промежностными свищами, стриктурами и фиброзом генитоуретрального трактов, элефатиазисом вульвы. Встречается в основном у больных женского пола.
3. ЛА при грибковых заболеваниях.
4. ЛА при паразитарных заболеваниях.
5. ЛА при протозойных инфекциях.
- токсоплазмоз. Субклинический вариант — шейный подострый некротизирующий ЛА. Клинически — болезненный, чаще шейный ЛА, со спонтанной ремиссией через 3 — 6 месяцев, лихорадка, экзантема. Нейтропения. Гистологически — коагуляционные некрозы с гистиоцитарными и иммунобластными клетками без гранулем, без нейтрофилов. Дифференциальная диагностика проводится со злокачественными лимфомами, туберкулезом, гистиоцитозом, а по данным гистологии (васкулит) — с системной красной волчанкой.
- кала-азар.
- малярия.
Формы, не связанные с инфекциями (ЛАП)
1. ЛАП медикаментозная.
- производные гидантоина (дифенин и др.) — противосудорожные препараты. При таком осложнении терапии ЛАП рассматривается как аутоиммунобластная.
- аллопуринол (используется при лечении гиперурикемий, в т. ч. и при миелопролиферативных состояниях).
- противолепрозные средства (используются в гастроэнтерологии для лечения хронических колитов, в ревматологии — для лечения артритов и спондилоартритов, особенно ассоциированных с антигеном гистосовместимости HLA В-27).
- поствакцинальные.
- на фоне инородных тел.
2. При системных процессах в организме.
- коллагенозы (в этом случае наибольшее увеличение ЛУ регистрируется все-таки при инфицированных вариантах диффузных болезней соединительной ткани, то есть имеется сочетание ЛА и ЛАП).
- локальный опухолевидный амилоидоз. Традиционно описывается как патология исключительно взрослых [4]. Однако мы обнаружили эту форму диспротеиноза у 2 из 44 детей с системным амилоидозом. Локальный опухолевидный амилоидоз у наших пациентов протекал с выраженной общей параспецифической реакцией, что в сочетании с пальпируемым образованием в брюшной полости привело первоначально к ошибочному диагнозу лимфомы.
- амилоидоз Любарха, генетически детерминированный. Генерализованная ЛАП, ортостатическая гипотония, обструктивная инфильтративная кардиомиопатия, спленомегалия, нейропатия, туннельный синдром.
- синдром Дорфмана-Розаи (интермиттирующая доброкачественная лимфаденопатия). Вероятно аутоиммунное заболевание с доброкачественной пролиферацией плазмоцитов, гистиоцитов, фибробластов. Пик заболеваемости — в первые 10 лет жизни. Протекает с двухсторонним шейным, часто генерализованным увеличением ЛУ, лихорадкой, лейкоцитозом, узловатой эритемой. По нашим наблюдениям, при поражении внутренних органов прогноз плохой. Прогноз ухудшается при наличии одновременно иммунодисфункции (ускорение СОЭ, диспротеинемия).
- десквамативная эритродермия Лейнера. Вероятнее всего дефект хемотаксиса лейкоцитов и дефицит фрагмента комплемента С5. Заболевание манифестирует в первые 3 — 4 месяца жизни. Проявляется генерализованным увеличением всех лимфоузлов, вторичной эритродермией, дистрофией ногтей, анемией, рвотой, диареей. Чаще встречается при грудном вскармливании. Известны семейные случаи. Прогноз благоприятный.
3. Гранулематозы
- саркоидоз.
- аллергический гранулематоз Чарг — Штрауса. Сочетается с атопией в анамнезе. Проявляется в виде бронхиальной астмы, выраженной эозинофилии, ЛАП, нейропатии, кожных язв, поражения сердца, легких, кишечника и васкулита мелких артерий и вен.
- мультицентрический ретикулогистиоцитоз. Системное гранулематозное заболевание с образованием кожных узлов, деструктивным артритом, поражением внутренних органов. Протекает по типу псориатической артропатии.
- ретикулез липомеланотический (синдром Паутриера-Ворингера) — локализованное или генерализованное увеличение ЛУ как сопровождение дерматозов, прежде всего меланоэритродермии.
4. ЛАП при гемобластозах.
- острые лейкемии.
- неходжкинские лимфомы.
- ходжкинские лимфомы (по старой терминологии — лимфогранулематоз).
- болезнь альфа-тяжелых цепей (средиземноморская лимфома). Наблюдается в основном в детском и юношеском возрасте, клиника обусловлена тяжелым синдромом мальабсорбции, являющимся результатом лимфопролиферативных процессов с инфильтрацией тонкой кишки и мезентериальной ЛАП.
- болезнь гамма-тяжелых цепей. Обусловлена моноклональной гаммапатией, протекает по типу лимфопролиферативного системного заболевания.
- гистиоцитарные синдромы
5. ЛАП при метастазировании солидных опухолей в ЛУ.
6. Паранеопластические реакции [12].
- ПОЭМК-комплекс. Паранеопластический симптомокомплекс (особенно часто при склерозирующих плазмоцитомах) = полинейропатия + органомегалия + эндокринопатия + дисглобулинемия (М-градиент) + поражение кожи.
7. ЛАП при первичных иммунодефицитных состояниях (ПИД).
- общая вариабельная иммунная недостаточность.
- аутоиммунный лимфопролиферативный синдром.
- гранулематоз септический. Гетерогенная группа дефектов иммунитета, объединенных незавершенным внутриклеточным фагоцитозом каталазо-позитивных микробов в результате дефицита перекиси водорода и атомарного кислорода [11]. В настоящее время известны 4 различных молекулярных дефекта: а) Х-хромосомно связанный рецессивный дефект тяжелых цепей цитохрома В558; б) аутосомно-рецессивно наследуемый дефект легких цепей цитохрома В558; в) дефект 47 kd цитозолфактора; г) дефект 65 kd цитозолфактора. Клинические признаки: острые абсцедирующие инфекции кожи, легких, желудочно-кишечного тракта, ЛУ, печени, селезенки, вызванные каталазо-позитивными бактериями (стафилококки, энтеробактерии), а также аспергиллами; хроническое гранулематозное воспаление в желудочно-кишечном тракте и мочевыводящих путях с возможным стенозированием; снижение образования атомарного кислорода и перекиси водорода в ответ на растворимые и опсонированные раздражители.
8. Генетически обусловленные ЛАП [9].
- синдром Клиппель — Треноне. Сочетание локальных лимфангиом и гемангиом.
- синдромы с наследственно обусловленными лимфатическими отеками. Синдромы Вевера-Смита и Мильроя.
- легочная мышечная гипертрофия — мышечный цирроз легкого. Разрастание гладкомышечных волокон периальвеолярно, перибронхиально, интерстициально, интерлобарно. Увеличение ЛУ ворот легких. ДД проводится с саркоидозом, туберкулезом, синдромами эмфиземы легких, альвеолярно-капиллярного блока. Диагноз верифицируется только гистологически.
9. Синдром приобретенного иммунодефицита (СПИД).
В процессе диагностики заболеваний, протекающих с увеличением ЛУ, объединяются усилия педиатров, инфекционистов, иммунологов, онкогематологов. Главная роль при этом отводится именно педиатру, так как большинство ЛА и ЛАП связано у детей с инфекционным процессом. В то же время нельзя настаивать на инфекционном генезе увеличения ЛУ, если двухнедельный курс антибиотикотерапии не привел к существенному улучшению клинико-лабораторной и инструментальной картины. В пользу онкогематологического генеза изменения ЛУ свидетельствует увеличение их диаметра до 4 см и более, каменистая плотность, бугристость, образование конгломератов ЛУ, их спаянность с окружающими тканями, внутригрудные конгломераты, особенно в верхнем средостении, внутрибрюшинные конгломераты.
Четкое знание многообразия причин увеличения ЛУ поможет педиатрам в диагностике и дифференциальной диагностике этого синдрома.
Литература
1. Государственный доклад о состоянии здоровья населения Российской Федерации в 1994 г. М., 1995. с. 43.
2. Миллер Дж. Туберкулез у детей и подростков. М.: Медицина, 1984. с. 296.
3. Назаренко О. Р. Сравнительная ценность эхографии в оценке состояния органов брюшной полости у детей с острым лимфобластным лейкозом. Автореф. дис. . к. м. н, М., 1997. с. 24.
4. Нихамкин Л. И. Локальный опухолевидный амилоидоз брыжейки. Архив патологии, 1966. 4. с. 76 — 78.
5. Самочатова Е. В., Владимирская Е. Б., Жесткова Н. М., Наволоцкий А. В. и др. Болезнь Ходжкина у детей. М.: Алтус. — 1997. 96.
6. Тарасова И. С. Клинико-гематологическая характеристика детей при различных дозовых радиационных нагрузках. Автореф. дис. . к.м.н. М., 1997. с. 25.
7. Чернов В. М., Финогенова Н. А., Шахталин В. В., Сидорович Г. И. Структура гематологической заболеваемости детей в г. Клинцы Брянской области. В кн.: Медицинские аспекты влияния малых доз радиации на организм детей и подростков. Обнинск — Москва, 1992. с. 92 — 95.
8. Dangman B. C., Albanese B. A., Kocia M. Cat scratch disease with fever of unknoun origin: imaging features and association with new causative agent Rochalimea henselae. Pediatrics, 1995. v. 5. p. 767 — 771.
9. Emery A., Rimoin D. Principles and practice of medical genetics. 1988. V. 1, 2.
10. Flexman J. Bortanella henselae is a causative agent of cat scratch disease in Australia. J.Infect., 1995. V. 31. № 3. p. 241 — 245.
11. Leiber B. Die klinischen Syndrome. Muenchen, 1990, Bdd. 1,2.
12. Siegenthaler W. Differentialdiagnose innerer Krankheiten. Stuttgard, 1993. s. 800.
Симптомы лимфаденопатии при токсоплазмозе и ее лечение
Симптомы шейного лимфаденита и его лечение
Код по МКБ-10: L04.0
а) Симптомы и клиника шейного лимфаденита у детей и взрослых. Для острой шейной лимфаденопатии характерно появление болезненной припухлости в области пораженных лимфатических узлов. Локализация лимфаденопатии зависит от локализации первичного очага инфекции. При недостаточно энергичном лечении или особенно высокой вирулентности возбудителей появляется флуктуация.
Возможен прорыв абсцедировавшего лимфатического узла через кожу. При первичной лимфаденопагии, связанной с ВИЧ-инфекцией, острой стадии, проявляющейся гриппоподобным синдромом в сочетании с зудящей кожной сыпью и генерализованным лимфаденитом, предшествует инкубационный период длительностью 1-3 нед.
б) Причины и механизмы развития. Первый пик заболеваемости приходится на возраст до 10 лет; лимфаденопатия в таких случаях бывает связана с носоглоточной инфекцией. Наиболее часто высевают стрептококки. Из других возбудителей следует отметить также вирус краснухи, цитомегаловирус, вирус Эпштейна-Барр, ВИЧ и микобактерии.
Второй пик заболеваемости приходится на возраст 50-70 лет. У этой категории больных лимфаденит часто бывает вызван воспалительным процессом, сопутствующим злокачественной опухоли.
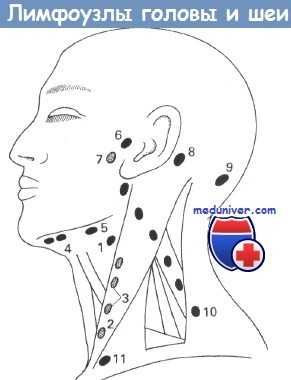
Лимфатические узлы головы и шеи:
(1) Двубрюшно-яремные. (2) Яремно-лопаточно-подъязычные. (3) Глубокие шейные.
(4) Подподбородочные. (5) Поднижнечелюстные. (6) Предушные.
(7) Околоушной железы. (8) Заушные. (9) Затылочные.
(10) Заднего треугольника шеи. (11) Надключичные.
При диагностике острого шейного лимфаденита следует тщательно исследовать область головы и шеи больного для обнаружения первичной инфекции.
P.S. После разрешения воспалительного процесса в первичном очаге инфекции увеличение шейных лимфатических узлов может сохраниться.
в) Диагностика. Первичный очаг инфекции следует искать в той области шеи, которая дренируется пораженными лимфатическими узлами. Лимфатические узлы могут быть болезненными, возможно появление флуктуации. При возникновении сомнений в диагнозе следует вскрыть размягченный лимфатический узел и выполнить биопсию.
г) Дифференциальный диагноз. В круг дифференцируемых заболеваний входят метастазы в лимфатические узлы, лимфогранулематоз и неходжкинская лимфома, воспаление щитоязычного протока при бранхиогенной кисте (боковая киста шеи), туберкулезная лимфаденопатия, токсоплазмоз и СПИД.
Увеличение шейных лимфатических узлов, которое сохраняется более 4 нед., следует дифференцировать со злокачественной опухолью, в частности злокачественной лимфомой и метастазами рака.
Выбор методов исследования при хронической шейной лимфаденопатии зависит от факторов риска, возраста больного, специфических и неспецифических симптомов и анамнеза заболевания.
Клиническое обследование включает пальпацию, УЗИ в В-режиме, которое позволяет уточнить локализацию пораженных лимфатических узлов и определить их размеры. Для дифференцирования специфических форм лимфаденопатии выполняют серологическое исследование. Хирургическое иссечение лимфатического узла обеспечивает возможность наиболее точной диагностики, но может быть выполнено лишь после полного обследования и исключения первичной опухоли дыхательных путей.
д) Лечение шейного лимфаденита. Назначают антибиотики широкого спектра действия. При формировании абсцесса необходимы разрез и дренирование. Аспирация содержимого абсцесса недостаточна для излечения. После разреза и санации полости абсцесса рану можно ушить, но обязательно оставить дренаж. Гной отправляют на бактериологическое исследование, а ткань, если ее иссекают, исследуют гистологически.
Видео техники пальпации лимфатических узлов
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Особенности диагностики и лечения токсоплазмоза у беременных
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.

Этиология. Возбудитель токсоплазмоза Toxoplasma gondii относится к царству Protozoa, классу Coccidia, отряду Eucoccidiorida, типу Apicomplexa. T. gondii — условно патогенный внутриклеточный паразит, поражающий в организме промежуточных хозяев, в том числе человека, любые ядерные клетки гистеофагоцитарной системы.
Эпидемиология. Пораженность или инфицированность токсоплазмами населения Российской Федерации в среднем составляет около 20,0%. Показатели пораженности выше в регионах с теплым климатом; среди лиц ряда профессиональных групп: рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринарные работники и др. Инфицированность женщин, как правило, в 2–3 раза выше, чем у мужчин.
Заболеваемость токсоплазмозом во много раз ниже показателей инфицированности, однако трудности диагностики, несмотря на обязательную регистрацию, не позволяют судить об истинном уровне инфекции.
Восприимчивость к токсоплазмозу — практически поголовная. Распространение инфекции — повсеместное в виде носительства и спорадических заболеваний. Основной источник инфекции — дикие и домашние кошки.
Основной фактор передачи токсоплазм — сырое или недостаточно термически обработанное мясо, мясные продукты с находящимися в нем цистами токсоплазм. К дополнительным факторам передачи инфекции относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки с находящимися на них ооцистами возбудителя.
Основные пути передачи:
- пищевой — связанный с употреблением в пищу термически плохо обработанного мяса, содержащего цисты паразита;
- контактный — ассоциированный с больными кошками, выделяющими токсоплазмы с фекалиями;
- трансплацентарный — при котором становится возможным проникновение токсоплазм в плод, с последующим развитием врожденного токсоплазмоза у новорожденного;
- парентеральный — при котором не исключается передача инфекции реципиенту при переливании крови, пересадке органов и тканей.
Беременная с токсоплазмозом не представляет эпидемиологической опасности ни для окружающих, ни для медицинского персонала, что делает возможным лечение этих пациентов как в амбулаторных условиях, так и в любом соматическом стационаре.
Патогенез. Вышедшие из цист или ооцист возбудители внедряются в эпителиальные клетки тонкого кишечника, где они размножаются, образую первичный аффект и проникая затем в региональные лимфатические узлы, а из них с током лимфы — в кровь. Диссеминация возбудителя приводит к поражению самых различных органов и тканей.
При беременности, в условиях сниженного иммунитета, наряду с первичным заражением токсоплазмами, опасным является и реактивация паразита (при инфицировании до беременности), что в значительной степени определяет течение и исход беременности.
При выходе токсоплазм из цист происходит диссеминация возбудителей. Их концентрация в тканях ассоциирована со способностью токсоплазм проникать трансплацентарно, что приводит к развитию внутриутробной патологии на любом сроке беременности.
Заражение плода наблюдается у беременных как с первичным инфицированием токсоплазмами, так и реактивацией возбудителя во время беременности у серопозитивных женщин. Поражение плода может возникать на любом сроке гестации, но особую опасность представляет его инфицирование в первом и втором триместрах. При заражении в третьем триместре беременности преобладают бессимптомные формы течения заболевания, а поздние клинические признаки проявляются через месяцы и годы.
Заражение на ранних сроках эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, вызывает тяжелые нарушения развития — анэнцефалию, анофтальмию, гидроцефалию, гепатоспленомегалию и др. (табл.).
Формирование иммунитета приводит к исчезновению возбудителя из крови, прекращается его размножение в клетках. Образуются истинные тканевые цисты, которые могут длительно, десятилетиями, в интактном состоянии сохраняться в организме (носительство токсоплазм).
Клиника. Приобретенный токсоплазмоз по характеру течения делится на острый и хронический. Кроме того, в зависимости от длительности болезни и выраженности клинических симптомов возможно подострое, а также инаппарантное (субклиническое) течение инфекции, которое характеризуется определенной динамикой либо высоким уровнем специфических антител в крови, при отсутствии клинических проявлений болезни. Таким образом, наиболее удобной для практического здравоохранения, с нашей точки зрения, является следующая классификация приобретенного токсоплазмоза: острый, подострый, хронический, инаппарантный и носительство.
Клинические проявления токсоплазмоза у беременных не имеют каких-либо существенных отличий от уже известной клинической картины заболевания.
Лабораторная диагностика. Для лабораторной диагностики токсоплазмоза чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM. Существенное значение в диагностике токсоплазмоза, особенно в дифференциации острого и хронического процессов, имеет определение классов иммуноглобулинов, в частности антител класса IgM. Надежно диагностировать токсоплазменную инфекцию можно лишь при сравнении результатов серологических реакций в динамике. Антитела всех классов существенно повышаются к концу второй — началу третьей недели от момента инфицирования и достигают диагностического уровня. Диагноз токсоплазмоза при наличии соответствующей клиники может быть поставлен при положительной серологической конверсии, когда второй анализ сыворотки становится положительным.
Диагностика токсоплазмоза у беременных женщин включает в себя весь комплекс необходимых клинических, параклинических и специальных (иммунобиологических) исследований, которые применяются для диагностики токсоплазмоза вообще.
Обязательным условием обследования беременной на токсоплазмоз должна быть консультация врача-инфекциониста для подтверждения либо исключения текущего инфекционного манифестного или бессимптомного (инаппарантного) токсоплазменного процесса.
Учитывая исключительную важность результатов иммунологического обследования в диагностике токсоплазмоза у беременных, необходимо правильно интерпретировать полученные данные.
Вариант 1: клинические проявления у беременной женщины отсутствуют; серологические реакции отрицательные. Заключение: токсоплазмоза нет, опасности инфицирования плода нет. Рекомендации: женщина относится к группе «риска» на врожденный токсоплазмоз; динамическое серологическое обследование на токсоплазмоз каждый триместр беременности.
Вариант 2: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких и средних показателях (РНИФ 1:40, 1:80 ИФА IgG ≤ 40 Ед/мл; ИФА IgM — отрицательно). При исследовании парных сывороток (через 3–4 недели) динамики уровня специфических антител нет. Заключение: носительство; опасности инфицирования плода нет. Рекомендации: женщина относится к «спокойной группе»; этиотропная терапия не показана; беременность сохраняется.
Вариант 3: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких, средних, иногда высоких титрах (РНИФ 1:640, ИФА IgG ≥ 200 Ед/мл; ИФА IgM — положительно). При исследовании парных сывороток (через 3–4 недели) регистрируется достоверное нарастание уровня специфических антител класса IgM.
Заключение: инаппарантный токсоплазмоз — реальная угроза инфицирования плода.
Рекомендации: женщина относится к группе «повышенного» риска; проводится превентивная этиотропная терапия (но не ранее II триместра), при заражении в I триместре возможно прерывание по медицинским показаниям; новорожденный подлежит обследованию на токсоплазмоз. В случае подтверждения диагноза получает этиотропное лечение с диспансерным наблюдением; при отсутствии у новорожденного клинических проявлений и неубедительности иммунологических показателей за ним устанавливается диспансерное наблюдение в течение 5 лет.
Вариант 4: имеются клинические проявления токсоплазмоза; серологические реакции положительные в низких и средних (иногда высоких) титрах: РНИФ 1:1280, ИФА IgG ≥ 200 Eд/мл; ИФА IgM — положительно, при исследовании парных сывороток в динамике регистрируется достоверное нарастание уровня специфических антител; выявляются специфические антитела класса IgM-класса. Заключение: острый токсоплазмоз.
Рекомендации: экстренная превентивная этиотропная терапия (не ранее чем со II триместра беременности); в I триместр — рассмотреть вопрос о прерывании беременности; проводят кордо- и амниоцентез на 22–23 неделях беременности; новорожденный обследуется на токсоплазмоз, и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 5: имеются клинические проявления инфекции; серологические реакции положительные в высоких или средних показателях; при исследовании парных сывороток в динамике регистрируется снижение уровня специфических антител (РНИФ ≤ 1:1280, ИФА IgG — 200 Eд/мл; ИФА IgM — положительно). Заключение: подострый токсоплазмоз. Рекомендации: этиотропная терапия (не ранее чем со II триместра); в I триместр — ставится вопрос о прерывании беременности; новорожденный обследуется на токсоплазмоз и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 6: имеются клинические проявления токсоплазмоза; серологические реакции положительны в низких или средних показателях (РНИФ 1:640, ИФА IgG — 200 Eд/мл; ИФА IgM — отрицательно); при исследовании парных сывороток (через 3–4 недели) динамики уровня антител нет; антитела класса IgM отсутствуют. Заключение: хронический приобретенный токсоплазмоз. Рекомендации: этиотропная терапия не проводится; при необходимости специфическая терапия вне беременности; прерывание беременности не показано.
Лечение. Показанием к назначению этиотропной терапии у беременных женщин являются острый, подострый и инаппарантный токсоплазмоз. Лечение хронического токсоплазмоза следует проводить строго по клиническим показаниям либо до, либо после беременности. При отсутствии жалоб и клинических показаний не нуждаются в лечении женщины, переболевшие токсоплазмозом до беременности. Эти женщины расцениваются как практически здоровые лица, не требующие специального медицинского наблюдения. Лечение беременных женщин следует проводить не ранее 12–16 недель беременности (со II триместра беременности).
Назначаются препараты группы пириметамина (Фансидар, Ровамицин).
Фансидар содержит сульфадоксин 500 мг и пириметамин 25 мг. Этиотропная терапия состоит из 2–3 циклов. Назначается 1 таблетка 1 раз в 3 дня № 8 таблеток на цикл. Учитывая возможность угнетения кроветворения под действием этиотропных препаратов, рекомендуется назначение фолиевой кислоты (в средних терапевтических дозах), а также проведение общих анализов крови и мочи. При непереносимости препаратов группы пириметаминов назначают Ровамицин, 1 таблетка которого содержит спиромицина 3 млн МЕ. Назначают по 3 млн МЕ 3 раза в день с семидневным перерывом. Хорошая переносимость Ровамицина больными, отсутствие лекарственного взаимодействия, высокая эффективность позволяют назначать его для лечения токсоплазмоза у беременных. При непереносимости пириметаминов возможна замена на антибиотики, например, эритромицин.
Противопоказаниями для назначения Фансидара и его аналогов, а также сульфаниламидных препаратов и антибиотиков являются: нарушения эритропоэза с анемией, заболевания почек с нарушением их функций, заболевания печени, декомпенсация сердечной деятельности.
В зависимости от сроков беременности целесообразно проведение не менее двух полных курсов этиотропной терапии с перерывами между ними 1–1,5 месяца.
Как показала практика, у пациенток с инаппарантным течением острого токсоплазмоза хороший эффект дает комплексное применение Фансидара с иммуномодуляторами (Галовит, Полиоксидоний). Уже после первого цикла лечения наблюдается значительное снижение IgM.
Профилактика врожденного токсоплазмоза. Профилактика врожденного токсоплазмоза должна строиться с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Оптимально профилактика врожденного токсоплазмоза должна включать в себя обследование женщин детородного возраста на токсоплазмоз до или, в крайнем случае, во время беременности. Неиммунные беременные женщины должны быть обязательно взяты на диспансерное наблюдение и обследоваться на токсоплазмоз 1 раз в триместр.
Литература
- О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
- Лысенко А. Я. Клиническая паразитология. Женева, 2002.
- Hill D., Dubey J. P. Toxoplasma gondii: transmission, diagnosis and prevention // Clin. Microbiol. Infect. 2002. № 10.
- Desmonts G., Couvreur J. Toxoplasmosis in pregnancy and its transmission to the fetus // Bull. N. Y. Acad. Med. 1974. № 2.
Ф. К. Дзуцева*
Г. Ю. Никитина**
Ю. В. Борисенко*
Л. П. Иванова***, кандидат медицинских наук, доцент
С. Х. Зембатова***
*Городской центр по токсоплазмозу, **ГКБ им. С. П. Боткина, ***РМАПО, Москва
Токсоплазмоз - симптомы и лечение
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.

Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
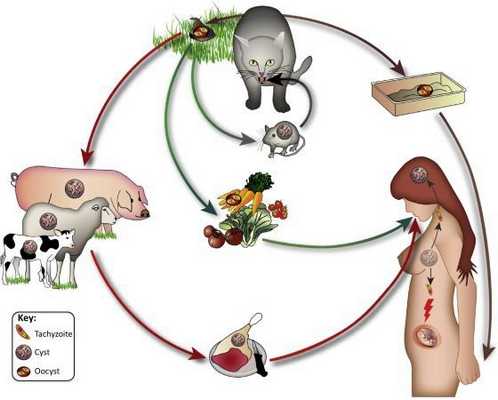
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
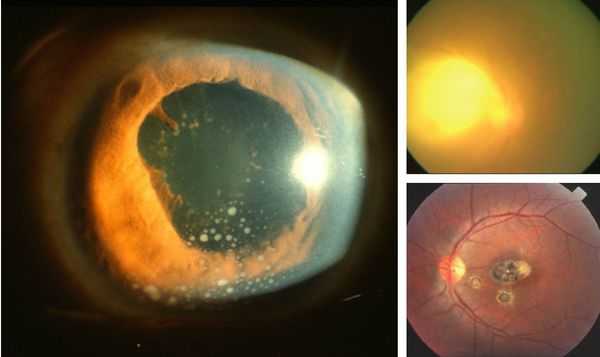
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
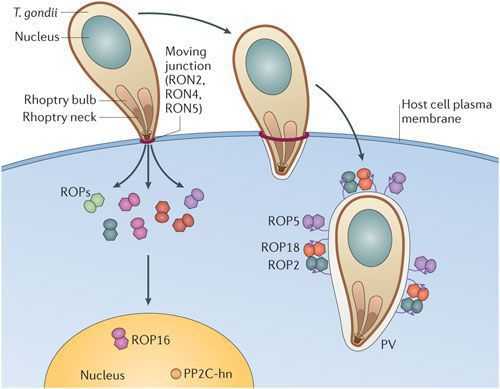
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
- (ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Читайте также:
