Синдром Гийена — Барре. Воспалительные полирадикулоневропатии.
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Чайковская А.Д. 1 Иванова А.Д. 1 Терновых И.К. 1 Исабекова П.Ш. 1 Веселов А.М. 1 Топузова М.П. 1 Яруш И.В. 1 Алексеева Т.М. 1
1 ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации
Синдром Гийена–Барре (синонимы: синдром Ландри–Гийена–Барре, острый полирадикулоневрит, восходящий паралич Ландри, острая воспалительная демиелинизирующая полирадикулоневропатия) представляет собой острую воспалительную полирадикулоневропатию аутоиммунной природы, в большинстве случаев характеризующуюся демиелинизацией корешков спинномозговых, черепных и периферических нервов. Этиология этого заболевания полиморфна. Предполагается, что в основе развития данного синдрома лежит токсический или нейровоспалительный процесс, запускающийся различными патогенными факторами. Неврологическим расстройствам могут предшествовать симптомы инфекции верхних дыхательных путей или желудочно-кишечного тракта, однако инфекционный агент не всегда удается достоверно установить. В типичных случаях синдром Гийена–Барре (СГБ) клинически проявляется развитием восходящего вялого тетрапареза и снижением сухожильных рефлексов; нарушения чувствительности могут отсутствовать или быть незначительными. Нейровизуализационные и электрофизиологические признаки СГБ, как и иммунологические диагностические тесты, не являются абсолютно специфичными и могут наблюдаться при других заболеваниях нервной системы. Кроме того, в условиях пандемии COVID-19 имеются затруднения проведения инструментальной диагностики. В статье представлено описание клинического случая СГБ на фоне инфицирования вирусом SARS-CoV-2 у пациента, находившегося на лечении в инфекционном отделении Национального медицинского исследовательского центра (НМИЦ) имени В.А. Алмазова.
1. Пирадов М.А., Шнайдер Н.А., Супонева Н.А., Спирин Н.Н., Гришина Д.А. Синдром Гийена-Барре у взрослых. Клинические рекомендации. M.: Горячая линия-Телеком, 2016. 32 с.
2. Willison H.J., Jacobs B.C., Van Doom A.P. Guillain-Barré syndrome. The Lancet. 2016. vol. 388. no. 10045. P. 717-727.
3. Супонева Н.А. Клиническая и диагностическая роль аутоантител к ганглиозидам периферических нервов: обзор литературы и собственные данные // Нервно-мышечные болезни. 2013. № 1. С. 26-34.
4. Ruts L., Drenthen J., Jongen J.L. Pain in Guillain-Barre syndrome: a long-term follow-up study. Neurology. 2010. vol. 75. no. 16. P. 1439-1447.
5. Yuki N., Kokubun N., Kuwabara S. Guillain-Barré syndrome associated with normal or exaggerated tendon reflexes. Journal of Neurology. 2012. vol. 259. no. 6. P. 1181-1190.
6. Wong A.H., Umapathi T., Nishimoto Y., Wang Y.Z., Chan Y.C., Yuki N. Cytoalbuminologic dissociation in Asian patients with Guillain-Barré and Miller Fisher syndromes. The Journal of the Peripheral Nervous System. 2015. vol. 20. no. 1. P. 47-51.
7. Irie S., Saito T., Kanazawa N. Relationship between anti-ganglioside antibodies and clinical characteristics of Guillain-Barre syndrome. Internal Medicine. 1997. vol. 36. no. 9. P. 607-612.
9. Yuki N., Tagawa Y., Handa S. Autoantibodies to peripheral nerve glycosphingolipids SPG, SLPG, and SGPG in Guillain-Barre syndrome and chronic inflammatory demyelinating polyneuropathy. Journal of Neuroimmunology. 1996. vol. 70. P. 1-6.
10. Fredman P., Vedeler C.A., Nyland H. Antibodies in sera from patients with inflammatory demyelinating polyradiculoneuropathy react with ganglioside LM1 and sulfatide of peripheral nerve myelin. Journal of Neurology. 1991. vol. 238. P. 75-79.
11. Jacobs B.C., van Doorn P.A., Groeneveld J.H. Cytomegalovirus infection and anti-GM2 antibodies in Guillain-Barre syndrome. Journal of Neurology, Neurosurgery and Psychiatry. 1997. vol. 62. no. 6. P. 641-643.
13. Gupta A., Paliwal V.K., Garg R.K. Is COVID-19-related Guillain-Barré syndrome different? Brain, behavior, and immunity. 2020. vol. 87. P. 177–178.
15. Fokke C., van den Berg B., Drenthen J., Walgaard C., van Doorn P.A., Jacobs B.C. Diagnosis of Guillain-Barré syndrome and validation of Brighton criteria. Brain. 2014. vol. 137. P. 33-43.
Заболеваемость синдромом Гийена–Барре (СГБ) в Российской Федерации соответствует общемировым данным и варьирует от 0,34 до 1,9 на 100 000, составляя в среднем 1,8 на 100 000 населения в год [1]. Большинство исследований, описывающих уровень заболеваемости СГБ, проведенных в Европе и Северной Америке, демонстрируют схожий уровень заболеваемости – 0,8–1,9 случая на 100 000 человек в год [2].
Предполагается, что ведущую роль в патогенезе развития СГБ играют аутоиммунные процессы, которые запускаются различными патогенами. Заболеванию могут предшествовать различные инфекции, включая инфекционный мононуклеоз, микоплазменную инфекцию, клещевой боррелиоз, диарею с лихорадкой, вызванную Campylobacter jejuni, и др. У трети больных определяется повышение титра антител к цитомегаловирусу. Случаи СГБ были также описаны вскоре после вакцинации от вируса простого бешенства и от гриппа типа А. Инфекция запускает в организме выработку циркулирующих иммунных комплексов и аутоантител к ганглиозидам и вызывает разные формы СГБ. Так, антитела к Campylobacter jejuni играют роль в образовании антител к ганглиозиду CQ1b, локализующемуся в перехватах Ранвье глазодвигательных нервов. Таким клиническим фенотипом данного варианта поражения являются синдром Миллера–Фишера и СГБ с глазодвигательными нарушениями. Антитела к ганглиозиду GD1a (аксоны передних корешков) провоцируют развитие аксональных форм СГБ. Клиническим фенотипом аутоагрессии к ганглиозиду GM1, локализующемуся в передних корешках спинного мозга, является острая моторная аксональная невропатия [3].
Наиболее типичным клиническим проявлением СГБ является развитие восходящего вялого тетрапареза. Слабость, как правило, появляется сначала в дистальных отделах конечностей, однако может дебютировать в проксимальных отделах рук или ног. В последнем случае у клинициста может возникнуть ложное представление о поражении пирамидной системы (на уровне спинного мозга или выше), однако легко объясняется фокальным блоком проведения на люмбальном или цервикальном корешковом уровне. В иных случаях болезнь проявляется поражением лицевого, глазодвигательного нервов, нервов бульбарной группы. Такая разновидность СГБ описана как синдром Миллера–Фишера, который также может перейти в генерализованную форму. Помимо вялого пареза, пациент может иметь расстройства в чувствительной сфере, сенситивную атаксию, дисфункцию вегетативной нервной системы. Мышечные или корешковые боли являются частым ранним симптомом, который способен усложнить постановку диагноза, поскольку боль предшествует слабости примерно у трети пациентов [4]. Большинство больных имеют снижение сухожильных рефлексов (СХР) в пораженных конечностях. В начале заболевания СХР могут быть не изменены, особенно в случае чисто моторных или аксональных форм болезни, а иногда может выявляться и гиперрефлексия [5].
Тяжесть и течение заболевания различны и могут выражаться как в незначительной слабости (в этом случае характерно спонтанное выздоровление), так и в выраженной тетраплегии и потребности в респираторной поддержке в течение нескольких месяцев.
СГБ – прежде всего клинический диагноз, однако вспомогательные методы обследования могут быть полезны или даже необходимы для подтверждения диагноза. В анализе ликвора характерно обнаружение белково-клеточной диссоциации, однако нормальный уровень белка (в особенности на первой неделе заболевания) не опровергает диагноз [6]. Электронейромиография помогает в подтверждении диагноза и дифференцировании форм СГБ, позволяя отличить острую воспалительную демиелинизирующую полинейропатию, аксональную моторную нейропатию и моторно-сенсорную аксональную полиневропатию, а также является ценной для определения прогноза заболевания. Выявляемые при проведении электронейромиографии нарушения нервной проводимости наиболее характерны на второй неделе от дебюта заболевания. Диагностически ценным является определение уровня аутоантител к ганглиозидам периферических нервов. Согласно данным литературы при исследовании корреляции между антиганглиозидными аутоантителами и клиническими проявлениями СГБ было установлено, что анти-GM1 и анти-GD1b-антитела были чаще ассоциированы с предшествующей диареей, а IgG-антиGQ1b – с офтальмоплегией [7, 8]. При этом анти-LM1 IgG-антитела выявляются у 5–58% больных с СГБ [9, 10], антитела к SGPG класса IgG – у 9% пациентов с СГБ, класса IgM – в 15–29% случаев [10]. Одним из возможных патогенов, являющихся триггером аутоиммунной атаки при СГБ, признан цитомегаловирус (ЦМВ), с которым ассоциированы антитела класса IgM к ганглиозиду GM2 [11].
Пандемия COVID-19 («Coronavirus disease 2019») поставила перед специалистами здравоохранения непростые задачи, связанные с необходимостью быстрой диагностики и оказания медицинской помощи [12] в условиях затруднения проведения многих инструментальных методов. На конец июня 2020 г. в литературе описано более 50 случаев СГБ на фоне инфицирования SARS-CoV-2, среди них наиболее часто встречались варианты острой воспалительной демиелинизирующей радикулопатии и острой моторной и моторно-сенсорной аксональной невропатии, реже – случаи развития синдрома Миллера–Фишера [13].
С целью обратить внимание клиницистов на возможность развития СГБ на фоне инфицирования вирусом SARS-CoV-2 приводим описание собственного клинического наблюдения.
Описание клинического случая
В мае 2020 г. пациент 42 лет с неотягощенным эпидемиологическим анамнезом поступил в тяжелом состоянии в отделение анестезиологии-реанимации для инфекционных больных НМИЦ им. В.А. Алмазова, временно перепрофилированного в инфекционную больницу для пациентов с COVID-19.
Из анамнеза, собранного со слов пациента, и из данных предоставленной медицинской документации было известно, что за месяц до поступления он участвовал в уличной драке. На следующий день после травмы обратился за медицинской помощью по поводу перелома правой орбиты и был госпитализирован в офтальмологическое отделение, где проходил лечение в течение недели. После выписки, ориентировочно на десятый день после травмы, стал отмечать субфебрильную лихорадку до 37,5°С. Через 2 недели появилась слабость в конечностях, еще через 2 дня пациент не смог встать с постели из-за мышечной слабости. Прибывший на вызов участковый врач, помимо мышечной слабости, отметил наличие одышки и речевых нарушений в виде дизартрии, ввиду чего экстренно госпитализировал пациента с представлением о возможной коронавирусной инфекции.
В связи с нарастанием гипоксемии (paO2 54,8 mmHg) пациент был интубирован. Были выполнены бронхоскопия, по результатам которой у пациента диагностировали слизисто-гнойный эндотрахеобронхит с обтурацией левого нижнедолевого бронха, и экстренное дренирование правой плевральной полости по поводу правостороннего гемопневмоторакса. Проводилась вазопрессорная поддержка.
В лабораторных анализах на момент поступления были выявлены незначительная гипоальбуминемия (34 г/л), гипротеинемия (59 г/л), тромбоцитоз (521х10 9 /л), нейтрофильный лейкоцитоз (28,8х10 9 /л) с преобладанием сегментоядерных нейтрофилов (23,04х10 9 /л), моноцитозом (1,73х10 9 /л). В венозной крови sO2 составило 94,5%, отмечалось снижение уровня кальция в крови до 0,83 ммоль/л, респираторный ацидоз – уровень рН 7,22. Обращало на себя внимание повышение уровня С-реактивного белка до 27,15 мг/л, Д-димера – 2,650 мкг/мл. Прокальцитотиновый тест был отрицательный.
В неврологическом статусе при поступлении сознание, ориентация в месте, времени и собственной личности были сохранены, однако отмечалась заторможенность, отчего продуктивному речевому контакту пациент был практически недоступен. Со стороны черепных нервов были выявлены некоторая асимметрия глазных щелей (D≥S), установочный горизонтальный нистагм в крайних отведениях, а также значительное снижение конвергенции с обеих сторон. Отмечались правосторонний легкий прозопарез до 4 баллов, асимметрия корнеального (S>D) и глоточного (D>S) рефлексов при сохранности чувствительности на лице. Оценка фонации была затруднена ввиду выраженной деформации носовой перегородки, отмечалась дизартрия тяжелой степени, дисфагии выявлено не было. В конечностях выявлялись диффузное снижение мышечного тонуса, а также вялый тетрапарез, более выраженный в дистальных отделах нижних конечностей (до 2 баллов в стопах) и проксимальных отделах верхних конечностей (до 2 баллов в мышцах плеча, до 3 баллов в кистях). Брюшные рефлексы были симметрично снижены, СХР с нижних конечностей не вызывались, с верхних – были симметрично низкие. Определялся непостоянный симптом Бабинского слева. Выявлялись нарушения поверхностной чувствительности по полиневритическому типу, выпадение суставно-мышечного чувства до уровня коленных суставов на ногах и в пальцах кистей. Координаторные пробы ввиду парезов не выполнял. Функции тазовых органов были нарушены по типу задержки. Менингеальные симптомы были отрицательными. Симптомов натяжения нервных стволов выявлено не было.
В то же время был получен положительный результат ПЦР мазка на SARs-CоV-2, взятого при поступлении, что подтверждало коронавирусную инфекцию.
Проводилась антибактериальная (амоксициллин с клавулановой кислотой 1,2 г 2 раза в сутки 7 дней), противовоспалительная (дексаметазон 12 мг 1 раз в сутки 1 день, затем 8 мг 1 раз в сутки 8 дней), антикоагулянтная (эноксапарин натрия 4000 МЕ 2 раза в сутки 8 дней, затем 2000 МЕ 2 раза в сутки 30 дней), муколитическая терапия (флуимуцил 300 мг 2 раза в сутки 7 дней, затем амброксол 30 мг 3 раза в сутки 10 дней). Был назначен гидроксихлорохин (400 мг 1 раз в сутки в первый день, далее 200 мг 1 раз в сутки на 7 дней). На третьи сутки от начала терапии наблюдалось клиническое улучшение: переведен с искусственной вентиляции легких на инсуффляцию кислорода через носовые канюли. Пациент стал контактен, ориентирован во времени, пространстве, собственной личности. Однако сохранялся вялый тетрапарез.
На шестые сутки госпитализации пациент был переведен из отделения анестезиологии-реанимации для инфекционных больных в инфекционное отделение.
Проводился дифференциальный диагноз между энцефалополинейропатией смешанного генеза, черепно-мозговой травмой, спинальной травмой и СГБ. С диагностической целью пациенту в типичном месте в асептических условиях была проведена люмбальная пункция, получено 4,0 мл бесцветного прозрачного ликвора, вытекающего под давлением 120 мм вод. ст. В цереброспинальной жидкости была выявлена белково-клеточная диссоциация: цитоз в пределах нормы (3,0х10 6 /л), значительно повышен уровень белка (до 3,91 г/л).
С учетом анамнеза с целью исключения черепно-мозговой и спинальной травмы была проведена МСКТ головного мозга и шейного отдела позвоночника, по результатам которой был выявлен перелом костей носа с девиацией носовой перегородки, данных за травматическое поражение нервной системы получено не было, очаговых изменений и патологических образований не обнаружено. Была описана умеренная внутренняя неокклюзионная гидроцефалия.
Таким образом, учитывая совокупность клинических, лабораторных и инструментальных данных, был установлен диагноз:
Основной: Коронавирусная инфекция, подтвержденная, тяжелое течение.
Осложнение: Полисегментарная двухсторонняя внебольничная вирусная пневмония. Правосторонний гемопневматоракс. Слизисто-гнойный эндотрахеобронхит с обтурацией левого нижнедолевого бронха.
Острая воспалительная демиелинизирующая полиневропатия, вариант СГБ. Вялый глубокий тетрапарез, сенситивная атаксия в нижних конечностях, расстройство поверхностной чувствительности по полиневритическому типу в верхних и нижних конечностях. Транзиторное нарушение функции тазовых органов по типу задержки.
В связи с определением у пациента СГБ к терапии на восьмой день госпитализации были добавлены внутривенный иммуноглобулин (интратект) из расчета 0,4 г на 1 кг веса курсом 5 дней, нейропротекторная терапия (цитиколин 500 мг 1 раз в сутки 10 дней) и ипидакрин (по 15 мг 1 раз в сутки 14 дней), отменены глюкокортикостероиды.
На фоне проводимого лечения на 12-й день после начала терапии внутривенным иммуноглобулином были отмечены регресс чувствительных расстройств, нарушений функций тазовых органов, дисфагии, уменьшение выраженности дизартрии, уверенное нарастание тонуса и силы мышц в конечностях и появление живых симметричных СХР. Лабораторные данные свидетельствовали о прекращении воспалительного процесса. Пациент отмечал улучшение общего состояния и постепенное восстановление двигательной активности и коммуникативных возможностей.
К концу первого месяца лечения получено два отрицательных результата мазка на SARS-CoV-2, после чего пациент был переведен в реабилитационный стационар.
Ввиду ограниченности диагностических ресурсов в рамках экстренной реформации медицинских учреждений в контексте пандемии COVID-19 не представлялось возможным обеспечить полный спектр лабораторных (антитела к ганглиозидам) и инструментальных обследований (электронейромиография, магнитно-резонансная томография сплетений) для подтверждения диагноза СГБ. Был очевидным приоритет неотложной диагностики и лечения жизнеугрожающего состояния – тяжелой полисегментарной внебольничной пневмонии с правосторонним пневмогемотораксом, осложнившей течение верифицированной коронавирусной инфекции.
Диагноз СГБ был установлен согласно международным критериям диагностики СГБ Всемирной организации здравоохранения от 1993 г. [14] с учетом наличия прогрессирующей мышечной слабости в ногах и руках, отсутствия или угасания СХР в первые дни заболевания, симптомов прогрессирования в течение не более 4 недель. Наблюдались относительная симметричность поражения, нарушение чувствительности по полиневритическому типу, вовлечение черепных нервов – лицевого, языкоглоточного, блуждающего и подъязычного, нестойкое нарушение тазовых функций, белково-клеточная диссоциация в ликворе от второй недели заболевания.
Также по критериям Брайтона [15] были подтверждены 6 из 7 пунктов: 1) билатеральный вялый парез в конечностях; 2) снижение СХР на первой неделе заболевания; 3) повышение уровня белка в ликворе; 4) нормальный уровень цитоза в ликворе; 5) монофазное течение заболевания от манифестации до регресса симптоматики 12 часов – 28 дней; 6) исключены иные возможные причины развития пареза. Не была проведена электронейромиография ввиду недоступности метода в описанных условиях функционирования стационара. Верно поставленный диагноз СГБ позволил провести своевременный курс патогенетической терапии внутривенным иммуноглобулином с выраженным положительным эффектом.
Дискутабельным остается вопрос об этиологическом факторе развития СГБ у данного пациента. Наиболее вероятным для данного больного триггером, запустившим развитие аутоиммунного процесса, является верифицированный вирус SARS-CoV-2, учитывая, что симптомы острой респираторной вирусной инфекции появились ориентировочно за две недели до развития СГБ.
Синдром Гийена-Барре
Эти формы объединяет клиническая картина - развитие острого вялого тетрапареза, когда быстро (в течение менее 4 недель) развивается слабость мышц конечностей и туловища.
Другие формы СГБ (синдром Миллера Фишера, острая пандизавтономия, фаринго-цервико-брахиальная форма, лицевая диплегия и др.) встречаются крайне редко (<1%).
Как часто встречается данное заболевание?
Синдром Гийена-Барре (СГБ) в настоящее время является самой частой причиной острых периферических параличей во многих странах мира, в том числе и в России. Эта нозология входит в число первых семи приоритетных научно-исследовательских направлений в мировой неврологии и включена в европейский перечень орфанных болезней. Заболеваемость составляет 1-2 случая на 100 000 населения в год. Это означает, что в городе Москве заболевает примерно до 200 человек в год.
Какой механизм развития данного заболевания?
В настоящее время практически полностью раскрыт патогенетический механизм развития СГБ. Многочисленные исследования продемонстрировали, что СГБ является дизиммунной полинейропатией, которая может быть спровоцирована различными инфекционными агентами (бактериями, вирусами), а также вакцинацией, оперативными вмешательствами, травмами, стрессом, физической нагрузкой, переохлаждением и т.д.
В большинстве случаев, за 1–3 недели до развития СГБ, отмечаются признаки того или иного инфекционного заболевания: ОРВИ, грипп, гайморит, бронхит, корь, паротит, краснуха, гастроэнтерит и другие. Основными инфекционными триггерами считаются Campylobacter jejuni, цитомегаловирус, Mycoplasma pneumoniae, вирусы Epstein-Barr, ECHO, Коксаки, гриппа А, В и герпеса. Многочисленные серологические, иммунологические, морфологические, микробиологические и другие исследования к настоящему временя позволили достоверно установить, что развитие СГБ после инфицирования C. jejuni происходит по механизму "молекулярной мимикрии", обусловленной схожестью антигенов структурных компонентов периферических нервов человека с антигенами данного возбудителя. Однако СГБ может развиваться и на фоне полного здоровья.
Последнее время активно проводятся исследования по установлению генетической предрасположенности к СГБ, а также выявлению иммуногенетических факторов, повышающих вероятность развития данного заболевания у каждого конкретного человека.
- симметричная слабость мышц, которая нарастает с ног и распространяется выше и выше, вовлекая мышцы туловища, рук, шеи и иногда лица
- нарушение походки вплоть до невозможности самостоятельно ходить
- симметричное онемение и покалывание в руках и ногах ("как будто перчатки и носки надели")
- болевой синдром в спине, в руках и ногах
- у каждого четвертого пациента развивается слабость дыхательных мышц, нарушение глотания и речи - это "опасные" симптомы, при появлении которых требуется перевод в реанимационное отделение
Как развивается синдром Гийена-Барре (СГБ)?
СГБ - это острая полинейропатия, симптомы которой прогрессируют быстро, в пределах 1 месяца (в среднем за 2 недели). СГБ в большинстве случаев развивается "по восходящему типу": сначала захватывая стопы (слабость и онемение), а затем симптомы распространяются выше - на бедра, тазовый пояс, туловище (мышц спины и брюшного пресса), кисти, плечевой пояс. В тяжелых случаях вовлекаются мышцы лица и глотки.
Не характерны для СГБ симптомы поражения центральной нервной системы и нарушение функции тазовых органов.
СГБ опасно развитием жизнеугрожающих нарушений - слабости дыхательных и бульбарных мышц (нарушение глотания и речи). Предсказать их развитие невозможно.
. При подозрении на синдром Гийена-Барре необходима срочная госпитализация.
Всегда ли синдром Гийена-Барре протекает тяжело?
СГБ протекает с разной степенью тяжести. Встречаются легкие и среднетяжелые формы, когда пациент сохраняет способность ходить. Это характерно для большинства пациентов. Тяжелые и крайне тяжелые формы заболевания, при которых пациент обездвижен и нуждается в искусственной вентиляции легких из-за слабости дыхательной мускулатуры, отмечаются у каждого четвертого пациента.
- анализ истории развития заболевания
- оценка неврологического статуса
- общий анализ ликвора
- общий клинический и развернутый биохимический анализы крови;
- RW, анти-ВИЧ, НВsAg и анти-HCV;
- общий анализ мочи;
- электролиты крови (Na+,K+);
- КФК общий
- магнитно-резонансная томография (МРТ) - по необходимости
Проведение ЭНМГ-исследования необходимо во всех случаях при подозрении на СГБ, поскольку данный метод позволяет не только подтвердить поражение периферических нервов, но и уточнить характер их повреждения, следовательно определить форму заболевания. Исследование пациентов в ранние сроки заболевания (когда симптоматика только нарастает и очень важно быстро поставить диагноз) имеет особенности, поэтому должно быть проведено хорошо подготовленным и опытным специалистом на миорафе высокого класса. Методологические ошибки и недостаточный объем данного исследования часто приводят к ошибочным диагнозам. Поэтому мы рекомендуем проведение ЭНМГ в нашем центре.
- высокообъемный программный плазмаферез (ПФ) или
- высокодозную внутривенную иммунотерапию препаратами иммуноглобулина человеческого класса G (ВВИГ).
Патогенетическая терапия используются, прежде всего, с целью прерывания "аутоиммунной агрессии", развивающейся при СГБ. При этом предполагается достичь торможения дальнейшего развития заболевания, снизить длительность периода нарастания симптоматики, ускорить начало периода восстановления и добиться максимально полного выздоровления.
Глюкокортикостероиды при СГБ неэффективны и ухудшают прогноз!
К неспецифическим методам лечения относят симптоматическую терапию и реабилитацию. При этом восстановительное лечение является ключевым как в остром, так и в отдаленном периодах. Прием нейрометаболических, ноотропных препаратов, витаминов группы В при СГБ не рекомендован ни в остром периоде, ни в восстановительном, в связи с отсутствием доказательной базы.
Какой прогноз у пациентов с диагнозом синдром Гийена-Барре?
Прогноз восстановления при СГБ благоприятный - в подавляющем большинстве случаев пациенты полностью выздоравливают. Неблагоприятное течение и неполное восстановление ассоциированы с возрастом старше 60 лет, предшествующей диареей, необходимостью в ИВЛ, развитием грубого тетрапареза в течение 7 дней от начала болезни, неэффективностью патогенетической терапии.
При правильной терапевтической тактике, средней степени тяжести заболевания ходьба с опорой становится возможной у 90% больных уже к концу 1-3 месяцев от начала заболевания. Иная ситуация наблюдается после тяжелых форм СГБ: ходьба с опорой становится возможной у большинства больных только к полугоду от начала заболевания; а процесс восстановления затягивается на годы.
ФГБНУ НЦН уже многие годы занимается диагностикой и лечением пациентов с синдромом Гийена-Барре. Коллективом ФГБНУ НЦН во главе с член-корреспондентом РАН Супоневой Н.А. подготовлены клинические рекомендации по ведению данной категории пациентов (в настоящий момент проходят утверждение).
- , где в полном объеме опытными специалистами проводится необходимая патогенетическая терапия (высокообъемный плазмаферез или введение иммуноглобулина при наличии у пациента препарата), тщательный уход, контроль и поддержка жизненоважных функций (в том числе ИВЛ) , где накоплен большой опыт по поэтапному восстановлению пациентов с СГБ.
Сотрудники центра заболеваний периферической нервной системы консультируют пациентов амбулаторно в рамках ОМС и на коммерческой основе.
Синдром Гийена-Барре
При синдроме Гийена-Барре иммунная система человека поражает часть периферической нервной системы. При этом синдроме могут быть затронуты нервы, контролирующие движения мышц или передающие болевые, температурные и осязательные ощущения. Это может приводить к мышечной слабости и потере чувствительности в ногах и/или руках.
Это редкое заболевание, оно может поражать людей в любом возрасте, но чаще всего он встречается у взрослых людей и у мужчин.
Симптомы
Обычно симптомы длятся несколько недель, и большинство людей выздоравливают без каких-либо длительных, тяжелых неврологических осложнений.
- Первые симптомы синдрома Гийена-Барре включают слабость или покалывающие ощущения. Обычно они начинаются в ногах и могут затем распространяться на руки и лицо.
- У некоторых людей эти симптомы могут приводить к параличу ног, рук или лицевых мышц. У 20%-30% людей поражается грудная мускулатура, что затрудняет дыхание.
- В тяжелых случаях синдром Гийена-Барре может привести к нарушению способности говорить и глотать. Эти случаи считаются представляющими угрозу для жизни, и таких пациентов следует лечить в отделениях интенсивной терапии.
- Большинство людей полностью выздоравливают даже в самых тяжелых случаях синдрома Гийена-Барре, хотя некоторые из них продолжают испытывать слабость.
- Даже в наилучших условиях 3%-5% пациентов с синдромом Гийена-Барре умирают от осложнений, которые могут включать паралич дыхательных мышц, инфекцию крови, тромб в легких или остановку сердца.
Причины
Синдрому Гийена-Барре нередко предшествует та или иная инфекция, которая может быть бактериальной или вирусной. Толчком к развитию синдрома Гийена-Барре также может послужить вакцинация или хирургическая операция.
В контексте вирусной инфекции Зика в затронутых странах был отмечен неожиданный рост числа случаев синдрома Гийена-Барре. Наиболее вероятное объяснение имеющихся фактических данных о вспышках вирусной инфекции Зика и синдрома Гийена-Барре состоит в том, что вирусная инфекция Зика выступает одной из причин развития синдрома Гийена-Барре.
Диагностика
Диагностика основана на симптомах и результатах неврологического осмотра, в том числе таких, как снижение или утрата глубоких сухожильных рефлексов. Для получения вспомогательной информации может быть произведена спинномозговая пункция, однако это не должно вести к отсрочке лечения.
Для того, чтобы диагностировать синдром Гийена-Барре не требуется других исследований, таких как анализы крови, которые служат для определения причин возникновения синдрома, и эти исследования не должны вести к отсрочке лечения.
Лечение и уход
Ниже приводятся рекомендации по лечению пациентов с синдромом Гийена-Барре и уходу за ними:
- Синдром Гийена-Барре несет в себе потенциальную угрозу для жизни. Пациентов с синдромом Гийена-Барре обычно госпитализируют, чтобы они находились под тщательным наблюдением.
- Симптоматическая терапия включает мониторинг дыхания, сердцебиения и кровяного давления. В случае нарушения дыхания пациента обычно подключают к аппарату искусственной вентиляции легких и следят за ним на предмет развития осложнений, которые могут включать нарушения сердечных сокращений, инфекции, образование тромбов и высокое или низкое кровяное давление.
- Лекарственных средств от синдрома Гийена-Барре нет, но лечение может ослабить симптомы синдрома Гийена-Барреи сократить их продолжительность.
- С учетом аутоиммунного характера болезни на ее острой стадии обычно проводится иммунотерапия, такая как замещение плазмы для удаления антител из крови или внутривенное введение иммуноглобулина. Это лечение наиболее эффективно при его проведении через 7-14 дней после появления симптомов.
- В случае если мышечная слабость сохраняется после острой стадии болезни, пациентам могут потребоваться службы реабилитации для укрепления мышц и восстановления двигательных функций.
Деятельность ВОЗ
ВОЗ оказывает странам поддержку в ведении синдрома Гийена-Барре в контексте вирусной инфекции Зика следующим образом:
Синдром Гийена-Барре (СГБ)
(острый идиопатический полиневрит; острая воспалительная демиелинизирующая полирадикулонейропатия)
, MDCM, New York Presbyterian Hospital-Cornell Medical Center
Синдром Гийена – Барре – это острая, обычно быстро прогрессирующая воспалительная полинейропатия, характеризующаяся мышечной слабостью и умеренным выпадением дистальной чувствительности и самоограничивающимся течением. Заболевание имеет аутоиммунную природу. Диагноз ставится на основе клинических данных. Лечение включает в себя плазмаферез, внутривенные иммуноглобулины, искусственную вентиляцию легких при тяжелом течении.
Этиология синдрома Гийена-Барре (СГБ)
Хотя причина синдрома Гийена-Барре до конца не изучена, считается, что он является аутоиммунным.
Примерно у двух третей пациентов синдром Гийена-Барре возникает через 5 дней - 3 недели после банального инфекционного заболевания, операции или вакцинации. Инфекция – триггерный фактор у более 50% пациентов; наиболее частые патогены включают:
Побочные эффекты ингибиторов контрольных точек иммунного ответа включают синдром, который напоминает синдром Гийена-Барре.
Симптомы и признаки СГБ
У большинства пациентов с cиндромом Гийена-Барре доминирует вялый парез; всегда проксимальные мышцы поражаются в большей степени и нарушения чувствительности выражены меньше. Обычно практически симметричная мышечная слабость с парестезиями начинается распространяться с ног и затем поражает руки, но в некоторых случаях парез начинается с мышц рук или головы. В 90% случаев слабость обычно достигает максимума на 3-4 неделе заболевания. Выпадают глубокие сухожильные рефлексы. Функция сфинктеров обычно не нарушается. Слабость остается неизменной в течение различного периода времени, как правило, в течение нескольких недель, а затем разрешается.
При тяжелом течении более чем в половине случаев страдают лицевые и орофарингеальные мышцы. Может развиваться дегидратация и недостаточность питания. В 5–10% случаев в связи с параличом дыхательных мышц требуется интубация трахеи и проведение ИВЛ.
У некоторых пациентов (возможно, при вариантной форме) развивается выраженная, угрожающая жизни вегетативная дисфункция с колебаниями артериального давления, нарушением секреции антидиуретического гормона, аритмиями, закупоркой желудочно-кишечного тракта, задержкой мочи и нарушением реакции зрачков на свет.
При нетипичном варианте (синдроме Фишера или синдроме Миллера-Фишера) могут развиваться офтальмоплегия, атаксия и арефлексия.
Диагностика СГБ
Исследование спинномозговой жидкости (СМЖ)
Диагноз синдром Гийена-Барре ставится, прежде всего, на основании клинической картины.
Дифференциальная диагностика
Аналогичная острая слабость Слабость Мышечная слабость – одна из наиболее частых причин, по которой пациент обращается за медицинской помощью. Мышечная слабость представляет собой снижение мышечной силы, однако многие пациенты. Прочитайте дополнительные сведения может возникать при миастении грависа, ботулизме, полиомиелите (в основном за пределами США), клещевом параличе, инфицировании вирусом Западного Нила, метаболических невропатиях и поперечном миелите, но эти нарушения обычно можно различить по следующим критериям:
Инфекция, вызванная вирусом Западного Нила, сопровождается головной болью, лихорадкой и асимметричным вялым параличом, но без нарушений чувствительности.
Метаболические нейропатии развиваются на фоне хронических метаболических нарушений.
Поперечный миелит сопровождается болью, слабостью, нарушением чувствительности и дисфункцией мочи.
Обследование
Необходимы проведение анализов на наличие инфекционных заболеваний и оценка иммунного статуса, включая тесты на гепатит и ВИЧ, и электрофорез белков сыворотки.
При подозрении на синдром Гийена – Барре показана госпитализация для выполнения нейрофизиологического исследования (анализ скорости распространения возбуждения по нерву и электронейромиография), проведения анализа ликвора и наблюдения с определением форсированной жизненной емкости легких каждые 6–8 часов. При нейрофизиологическом исследовании в двух третях пациентов выявляется замедление скорости распространения возбуждения и признаки сегментарной демиелинизации; тем не менее, нормальные результаты, в особенности в первые 5-7 дней, не позволяет исключить диагноз и не должно становиться причиной откладывания лечения.
При анализе ликвора может выявляться белково-клеточная диссоциация (повышение уровня белка и нормальное количество лейкоцитов), но ее может не быть в течение 1-й недели заболевания, а в 10% случаев она вообще отсутствует.
В отдельных случаях, компрессия шейного отдела спинного мозга могут имитировать синдром Гийена-Барре, особенно когда присутствует сопутствующая полинейропатия (вызывая или способствуя пониженной рефлекторности) и бульбарное поражение отчетливо не выражено; в таких случаях выполняют МРТ-исследование.
Прогноз при СГБ
Синдром Гийена – Барре фатальный в
Лечение СГБ
Интенсивная поддерживающая терапия
Внутривенный иммуноглобулин (ВВИГ) или плазмаферез
Синдром Гийена – Барре – это неотложное состояние, требующее постоянного мониторинга и поддержания жизненно важных функций, обычно в палате интенсивной терапии и реанимации. Необходимо часто измерять форсированную жизненную емкость легких, чтобы при необходимости начать респираторную поддержку. При снижении форсированной жизненной емкости до уровня
При невозможности приема жидкости через рот следует проводить инфузионную терапию с поддержанием диуреза на уровне не менее 1,0–1,5 л/день. В условиях постельного режима конечности следует оберегать от травм и сдавливания.
Тепло облегчает боль, что может использоваться при назначении ранней физиотерапии. Следует избегать иммобилизации, чреватой развитием анкилозов и контрактур. Как можно раньше следует обеспечивать пассивные движения в суставах в полном объеме, а после уменьшения остроты симптомов начинают активные упражнения. Низкомолекулярный гепарин (НМГ) помогает предотвратить тромбоз глубоких вен у пациентов, прикованных к постели. В нескольких рандомизированных исследованиях и мета-анализах сообщалось, что НМГ более эффективны, чем нефракционированный гепарин в низких дозах (обычно назначается в дозе 5000 единиц 2 раза в день), при этом риск кровотечения при их применении одинаковый.
При раннем назначении ВВИГ (IVIG) 2 г/кг в течение 1-2 дней или, более медленно, 400 мг/кг внутривенно 1 раз в день в течение 5 дней подряд является терапией выбора; оно имеет некоторые преимущества в период до 1 месяца от начала заболевания.
Плазмаферез Плазмаферез Аферез – это процесс разделения клеточных и растворимых компонентов крови с помощью прибора. Аферез часто проводится на донорах, цельная кровь которых центрифугируется для получения отдельных. Прочитайте дополнительные сведения помогает при проведении на ранних стадиях заболевания; он применяется также при неэффективности IVIG (внутривенного иммуного глобулина). Плазмаферез он позволяет укоротить длительность заболевания и пребывания в стационаре и снижает риск смерти и частоту развития стойкого паралича. Тем не менее он может вызвать гипотонию из-за большого объема жидкости, а внутривенный доступ может быть затруднен или вызвать осложнения. Плазмаферез удаляет введенные ранее внутривенные иммуноглобулины, нивелируя их эффект, поэтому его не следует проводить во время или вскоре после завершения лечения иммуноглобулинами, рекомендуется соблюдать интервал как минимум 2–3 сут. Рекомендовано подождать, по крайней мере, 2-3 дня после отмены IVIG.
Синдром Гийена — Барре. Воспалительные полирадикулоневропатии.
МРТ — магнитно-резонансная томография
ПБ-ПНП — постбариатрическая полиневропатия
СГБ — синдром Гийена—Барре
СМЖ — спинномозговая жидкость
В последнее время проблема ожирения постепенно приобретает характер пандемии, что привело к широкому распространению бариатрических операций как самого эффективного и надежного метода лечения больных с лишней массой тела [1, 2]. Показанием к проведению операции служит индекс массы тела (ИМТ) >35 кг/м 2 , хотя в настоящее время рассматривается возможность выполнения операции больным с ИМТ >30 кг/м 2 с наличием одного или более сопутствующих заболеваний. Наибольшее распространение получили 4 типа операций, выполняемых лапароскопическим доступом: регулируемое банджирование желудка, рукавная резекция желудка, гастрошунтирование (см. рисунок) и билиопанкреатическое шунтирование.
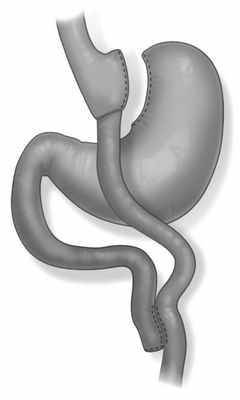
Схема гастрошунтирования.
Операция гастрошунтирования применяется у лиц, страдающих тяжелыми формами ожирения, и представляет собой безопасный и эффективный способ борьбы с лишней массой тела. Суть операции заключается в следующем: желудок пересекают таким образом, что формируется часть объемом 30—50 мл, к ней подводится дистальная часть тонкой кишки. Большая часть желудка не удаляется, его секрет вместе с соком поджелудочной железы и желчными кислотами поступает по другой петле и смешивается с пищей. Исходя из этого становится очевидным, что эффективность данной операции заключается в смешанном типе действии: присутствует и рестриктивный компонент (объем желудка составляет всего 30—50 мл) и принцип мальабсорбции (пища минует большую часть тонкой кишки, где происходит всасывание жиров и углеводов).
В результате гастрошунтирования происходит стойкое снижение массы тела, однако существует и «обратная сторона медали» в виде побочных реакций, основной причиной которых является нарушение всасывания нутриентов [3]. К часто встречающимся неврологическим осложнениям бариатрической хирургии относится полиневропатия (ПНП). По данным литературы, частота ее развития колеблется от 0,06 до 6,2% [4—6]. Мы приводим описание и обсуждение пациента, у которого развился редкий вариант постбариатрической полиневропатии (ПБ-ПНП).
Клинический случай. У мужчины 34 лет установлен диагноз: патологическое ожирение IV степени. На момент обращения масса тела составляла 150 кг при росте 180 см; ИМТ 46,2 кг/м 2 . В феврале 2014 г. выполнено лапароскопическое гастрошунтирование. Тонкая кишка пересечена на расстоянии 100 см от связки Трейца. В 200 см дистальнее места пересечения кишки наложен энтероэнтероанастомоз бок в бок, сформирован «малый желудочек» объемом около 50 мл.
Операция и послеоперационный период протекали без особенностей. При выписке назначена поддерживающая терапия, включающая витамины и микроэлементы. В течение 2 мес масса тела снизилась на 43 кг. В начале апреля отметил появление гриппоподобного заболевания с повышением температуры тела, по поводу чего принимал доксициклин. Тогда же появилась тошноты с периодически возникающей рвотой после приема пищи. Госпитализирован. В общих анализах крови и мочи патологических изменений не выявлено; по данным рентгенографии гастроанастомоз свободно проходим, затекания контрастного препарата за пределы анастомоза не выявлено. Состояние расценено как тревожно-астенический синдром, в связи с чем пациенту назначен сульпирид по 100 мг 2 раза в сутки, адеметионина 1,4-бутандисульфонат по 400 мг 2 раза в сутки. На фоне терапии симптомы регрессировали.
Проведено обследование: общий анализ крови и мочи, железо, кальций, магний, общий белок, общий билирубин, креатинин, калий, натрий, витамин В 12 , фолиевая кислота в норме. Однако отмечалось снижение уровня витаминов В 6 до 1,2 мкг/л (норма 4,8—17,7 мкг/л) и В 1 до 29 мкг/мл (норма 30—66 мкг/мл). Не маловажно, что содержание витаминов в плазме крови измерялось на фоне витаминотерапии. В общем анализе спинномозговой жидкости (СМЖ) выявлялась белково-клеточная диссоциация: нормальный уровень цитоза — 5/3 и увеличение содержания белка до 1,2 г/л (норма 0,15—0,45 г/л). Магнитно-резонансная томография головного мозга, шейного, верхнегрудного отделов позвоночника: патологических изменений не выявлено. Данные электромиографии (изменения проводимости в периферических нервах) указывали на преимущественно демиелинизирующий характер поражения без признаков заинтересованности аксонов.
Проводилось лечение: комплекс витаминов группы В (мильгамма) 4 мл/сут, тиамин 500 мг/сут внутривенно, пиридоксин 3 мл внутривенно, аевит 1 таблетка 3 раза в сутки, железа сульфат 640 мг/сут.
Через 9 дней от дебюта неврологических симптомов состояние стабилизировалось, а через 2 нед началась медленная положительная динамика в виде регресса чувства онемения в руках и болевого синдрома в стопах. В дальнейшем стала постепенно нарастать мышечная сила в проксимальных отделах ног до 3,5 балла, понизился порог вибрационной чувствительности. На 30-е сутки появилась способность передвигаться с опорой на ходунки. При повторной стимуляционной электромиографии (ЭМГ) проводимость по периферическим нервам без существенных изменений, а при игольчатой ЭМГ признаки нарушения проведения по аксонам.
На основе совокупности анамнестических, клинических и электрофизиологических данных у пациента диагностирована постгастропластическая полирадикулоневропатия, протекающая по типу синдрома Гийена—Барре — СГБ (острой воспалительной полирадикулоневропатии). С учетом мягкого течения заболевания (отсутствие дыхательных нарушений, грубых парезов, вовлечения черепных нервов), отчетливой спонтанной положительной динамики от проведения специфической терапии (плазмаферез, иммунотерапия) решено воздержаться. Пациент выписан домой под наблюдение невролога по месту жительства. На момент выписки передвигался в пределах палаты без опоры, самостоятельно принимал душ и совершал гигиенические процедуры.
Таким образом, в представленном клиническом случае у пациента, перенесшего гастрошунтирование, спустя 3,5 мес развилась симптоматика острой полирадикулоневропатии, причину которой установить было достаточно сложно. По данным литературы, неврологические осложнения бариатрических вмешательств главным образом обусловлены дефицитом витаминов (А, В 1 , В 2 , В 6 , фолиевой кислоты, В 12 , D, E), меди и цинка [7]. В зависимости от характера нутритивной недостаточности может вовлекаться любой отдел нервной системы, что проявляется симптомами энцефалопатии, оптического неврита, миелопатии, радикулопатии, поли- и мононевропатии.
Поражение периферической нервной системы наблюдается у 16% пациентов в постоперационном периоде в течение года. К факторам риска развития периферической невропатии, в частности ПНП, относятся избыточная относительная и абсолютная потеря массы тела, длительные желудочно-кишечные расстройства, несоблюдение диеты, гипоальбуминемия и снижение уровня трансферрина после операции, послеоперационные осложнения, обусловливающие необходимость госпитализации [6]. В представленном случае наблюдались желудочно-кишечные расстройства легкой степени выраженности, быстрое снижение массы тела после операции, недостаточное соблюдение больным назначений врача, касающихся диеты и поддерживающей терапии.
Основываясь на клинических, электрофизиологических и гистологических данных выделяют несколько форм периферических невропатий: изолированная невропатия тонких немиелинизированных волокон, аксональная ПНП, демиелинизирующая полирадикулоневропатия [8]. Для ПНП в рамках постгастропластического синдрома в целом характерно развитие чувствительных нарушений (онемение, парестезии) вначале в дистальных, а затем в проксимальных отделах нижних конечностей. В некоторых случаях симптоматика развивается на фоне нарушения уровня сознания, амнестического синдрома, глазодвигательных нарушений, психоэмоциональных расстройств, миелопатии [4]. Ряд авторов связывают появление ПБ-ПНП в первую очередь с дефицитом витамина В 1 (тиамина) и витамина В 12 [9, 10]. Известно, что для дефицита витамина В 1 характерно сочетание полиневритических изменений с энцефалопатией Вернике—Корсакова. Обычно энцефалопатия Вернике—Корсакова наблюдается через 4—12 нед после бариатрической операции [11] и характеризуется выраженными когнитивными и психотическими расстройствами, спутанностью сознания, поражением черепных нервов, в первую очередь глазодвигательной группы, атаксией [12]. По данным МРТ в 47% выявляются изменения в веществе головного мозга в виде гиперинтенсивности МР-сигнала в околоводопроводном сером веществе и дорзомедиальных ядрах таламуса [13]. Кроме ПНП, у пациентов с гиповитаминозом В 1 могут отмечаться признаки вегетативной (ортостатическая гипотензия) и сердечной недостаточности [4, 14]. Нарушения белково-клеточного соотношения в анализе СМЖ нехарактерно для дефицита витаминов группы В [15]. У нашего пациента, несмотря на профилактическую терапию, при поступлении выявлено снижение уровня витаминов В 1 и В 6 . Клиническая симптоматика ограничивалась только вовлечением периферической нервной системы, по данным МРТ признаков очагового поражения головного мозга не наблюдалось.
Важно, что дефицит других витаминов и микроэлементов может вносить существенный вклад в развитие ПБ-ПНП (см. таблицу) [16—19].

Неврологические осложнения, возникающие в следствие нутритивной недостаточности
Прямую связь между нутритивной недостаточностью и развитием неврологических осложнений у больных, перенесших бариатрическую операцию, не всегда удается отследить [20, 21]. Исключение составляет миелопатия, возникающая на фоне дефицита витамина В 12 и меди [22]. Так, C. Chang и соавт. [5] на ретроспективном материале из 168 010 больных, перенесших бариатрическое вмешательство, установили, что из 109 случаев развития острой постгастропластической невропатии (APGARS neuropathy) только в 40% наблюдался дефицит витамина В 1 и/или В 12 [5]. Схожие наблюдения сделаны при энцефалопатии Вернике—Корсакова. В 1/3 случаев уровень витамина В 1 в плазме крови и активность тиаминтранскетолазы эритроцитов оставались нормальными [23]. Представленный нами случай отличался от классического варианта витамин В 1 -дефицитной ПНП по типу болезни бери-бери: в неврологическом статусе преобладала мышечная слабость в проксимальных отделах нижних конечностей, болевая гипестезия — в области передней поверхности живота и бедер.
Трудность в постановке диагноза создает интерпретация клинических данных вследствие полиморфизма постбариатрической полиневропатии, одним из вариантов которой является течение по типу СГБ. K. Aluka и соавт. [15] описали 40-летнию женщину, у которой спустя 5 мес после бариатрической операции развились нижний парапарез и невропатический болевой синдром. По данным игольчатой ЭМГ регистрировалась спонтанная активность в мышцах голени. Состояние расценено как аксональный вариант СГБ. Специфического лечения не проводилось, симптомы полностью регрессировали спустя 6 мес [15]. G. Paulson и соавт. [24] дали описание четырех таких больных, C. Chang и соавт. [5] сообщают о двух случаях.
СГБ — острая воспалительная полирадикулоневропатия, в основе патогенеза которой лежит молекулярная мимикрия и продукция аутоантител, направленных против структур периферических нервов. В большинстве случаев заболевание развивается через 2—4 нед после перенесенной острой инфекции (вирусной или бактериальной этиологии), но в ряде случаев в качестве пусковых факторов могут выступать любые хирургические вмешательства [25]. В диагностике данного заболевания опираются на клинические симптомы: остро возникшая и достаточно быстро прогрессирующая слабость в конечностях, чаще всего распространяющаяся по восходящему типу — от дистальных отделов конечностей к проксимальным, отсутствие сухожильных рефлексов, нарушения чувствительности по полиневритическому типу. Дополнительными критериями служат симметричность клинических проявлений, наличие невропатического болевого синдрома, а также отсутствие проводниковых расстройств и тазовых нарушений. Со 2-й недели заболевания в общем анализе СМЖ выявляется белково-клеточная диссоциация. В сыворотке крови могут обнаруживаться антитела к ганглиозидам периферических нервов [26, 27]. СГБ характеризуется самоограничивающим течением (болезнь прогрессирует не более 4 нед) спонтанным и практически полным восстановлением даже без патогенетической терапии [28], в качестве которой используется программный плазмаферез или внутривенная иммунотерапия [26]. Однако опасность этого заболевания заключается в том, что в остром периоде состояние может ухудшиться до степени тетраплегии, развития нарушений глотания и дыхания, требующих проведения реанимационных мероприятий, в том числе длительной респираторной поддержки.
Можно выделить некоторые общие черты, характерные для ПБ-ПНП, развивающейся по типу СГБ, т. е. остро, по восходящем» типу: неврологические расстройства обычно возникают в первые 6 мес (чаще 3—5 мес) после операции, им предшествует дисфункция верхних отделов желудочно-кишечного тракта и астенический синдромом, симптомы заболевания быстро прогрессируют (в течение нескольких дней), парезы преимущественно наблюдаются в нижних конечностях, отмечается болевой синдром. Однако восстановление носит затяжной характер и не сопровождается резким улучшением даже на фоне удовлетворительной нутритивной поддержки [22].
У представленного нами больного имелись все эти признаки, а наличие белково-клеточной диссоциации в СМЖ на 2-й неделе от появления неврологических симптомов свидетельствует в пользу острой воспалительной природы данного состояния. Однако верифицированный дефицит витаминов В 1 и В 6 не позволяет полностью исключить гиповитаминоз в качестве одной из причин имеющегося поражения периферических нервов.
Как считают N. Philippi и соавт. [8], патогенез ПБ-ПНП представлен сочетанием мальнутритивных, воспалительных и дизиммунных нарушений. По нашему мнению, у представленного больного бариатрическое вмешательство с выключением из пищеварения длинного участка тонкой кишки, а также недостаточно точное соблюдение рекомендаций хирурга по профилактическому приему витаминов и микроэлементов послужили неблагоприятным фоном для возникновения аутоиммунной агрессии в отношении периферических нервов и как следствие развития СГБ. В данном случае развилась тяжелая форма заболевания (с нарушением функции ходьбы), но с благоприятным течением — без нарушения жизненно важных функций. Нарастание симптоматики ограничилось 9-дневным периодом, регресс двигательного и сенсорного дефицита последовал через 2 нед, возник спонтанно, без специфической терапии, способность ходить самостоятельно вернулась спустя 1 мес от начала болезни.
Заключение
В настоящее время бесспорной является высокая эффективность бариатрических операций в отношении лечения патологического ожирения. Однако распространенность хирургического лечения ведет также к росту числа различных осложнений. Хорошо изучены и понятны осложнения, непосредственно связанные с хирургическим вмешательством, но до сих пор продолжают регистрироваться и активно изучаются все новые нарушения функции органов и систем, напрямую не связанные с качеством проведенной операции и послеоперационного пособия. Описанный нами случай демонстрирует одно из поздних осложнений, представляющее собой тяжелое неврологическое расстройство, нередко приводящее к временной инвалидности пациентов. Поэтому очевидна необходимость тщательного обследования и наблюдения больных, перенесших бариатрические операции, особенно в первый год после лечения, а также проведение пред- и послеоперационной профилактики нутритивных нарушений, позволяющей потенциально уменьшить количество осложнений, связанных с нарушением работы иммунной системы.
Читайте также:
