Синдром Клиппеля—Треноне—Вебера - лучевая диагностика
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Врожденные сосудистые мальформации (ВСМ) описываются в медицинской, исторической и художественной литературе уже на протяжении нескольких тысяч лет. На протяжении столетий мальформации называли именами людей, впервые их описавших: Мафуччи, Паркса Вебера, Клиппеля—Треноне, Сервелла, Мартореля, Ослера—Рандю и т. д.
Первые упоминания, касающиеся артериовенозных соустий конечностей, относятся к XVIII в., когда в 1737 г. появилась публикация Hunter, описавшего артериовенозные фистулы (цит. по Н. И. Краковскому, 1978).
Наиболее ранней капитальной работой по врожденной сосудистой патологии является монография Trelat и Movod (1869). Авторы, анализируя заболевания, характеризовавшиеся гипертрофией конечности и варикозным расширением сосудов (капилляры и подкожные вены), пришли к выводу, что патологический процесс в конечности связан с врожденными нарушениями развития сосудов.
Синдром заболевания, описанный перечисленными выше авторами, был детализирован в работе M. Klippel, P. Trenaunay (1900). Он включал три симптома: 1) наличие сосудистого невуса, захватывающего часто всю конечность; 2) возникновение в раннем возрасте варикозного расширения вен конечности; 3) гипертрофию всех тканей, особенно костей, которые увеличиваются как в длину, так и в ширину. К вторичным изменениям в конечности авторы относили нейротрофические расстройства. M. Klippel, P. Trenaunay назвали это заболевание остеогипертрофическим варикозным невусом.
В 1907 г. P. F. Weber описал синдром, аналогичный описанному ранее M. Klippel, P. Trenaunay. Однако, не ограничившись этим, автор позднее объединил в одну группу заболевания, характеризующиеся этим синдромом, и другие формы врожденных уродств сосудов под общим названием gemangiectasiae hypertrophiea, подчеркнув тем самым их сосудистый характер, сочетающийся с тяжелыми трофическими нарушениями. Термин «гемангиоэктатическая гипертрофия конечности», или болезнь Паркса—Вебера, в дальнейшем получил широкое распространение и применялся при любой остеогипертрофической форме. Вместе с тем, признавая сосудистый характер заболевания, P. F. Weber в первые годы изучения проблемы не связывал его с развитием артериовенозных свищей. Лишь в 1928 г. автор высказал мысль о том, что имеется прямая связь артериовенозных свищей с врожденной деформацией конечности.
Несколько позднее С. М. Рубашов (1933) также сообщил о наличии у таких больных множественных артериовенозных соустий и предположил, что они являются причиной страдания, обозначенного как macrosomia partialis congenital, но в литературе встречаются и другие различные названия этой патологии. В английской и североамериканской литературе это заболевание чаще обозначается как врожденные артериовенозные фистулы и врожденные артериовенозные аневризмы; в европейской и южноамериканской литературе — как синдром Клиппеля—Треноне или Паркса Вебера. По мнению Н. И. Краковского, Р. С. Колесниковой, Г. М. Пивоваровой (1978), наиболее оправданно название «врожденные артериовенозные свищи». Эти авторы считают, что оно наиболее точно отражает этиологию, патогенез и клиническую картину заболевания, а также патологоанатомический характер связи между артериальной и венозной системами конечности.
Клиническая картина, подобная врожденным артериовенозным свищам, может наблюдаться и при некоторых других заболеваниях, например при аплазии глубоких вен [Вагнер Е. А., Шалаев М. И. и др., 1971]. P. Piulach и F. Vidal-Borraquer (1960) считают, что синдром Клиппеля —Треноне характерен не для врожденных, а для приобретенных нарушений гемодинамики конечностей и является, в частности, последствием перенесенного тромбоза глубоких вен. M. Servelle (1967) выделил болезнь Клиппеля—Треноне из числа ангиодисплазий, связанных с артериовенозным сбросом через врожденные шунты. Автор полагает, что этот синдром возникает в результате аплазии глубоких вен. Этиология врожденной сосудистой патологии до сих пор точно не выяснена. Существует множество теорий ее развития (генетическая, эндокринная, травматическая и др.), но по мнению большинства авторов, формирование артериовенозных свищей связано с нарушением в развитии сосудистой системы эмбриона.
Зачаток сосудистой системы первоначально образуется из масс ангиобластических клеток, которые, соединяясь между собой, создают сеть капилляров — модель сосудистой системы любой соматической области. Ток крови в пределах этой сети способствует дифференциации ее на артериальные и венозные ветви, отличающиеся друг от друга различным направлением движения крови [Рыжков Е. В., 1961]. В дальнейшем, под влиянием генетических и локальных гемодинамических факторов, таких как направление, распределение и давление крови, происходит образование первичной капиллярной сети. Изменяется величина капилляра, часть капилляров, которые не были использованы для тока крови, исчезают. Все эти превращения способствуют образованию сосудистого ствола эмбриона. За этой стадией следует стадия образования окончательных «стволов». Дисэмбриологические процессы, возникающие во второй стадии развития кровеносных сосудов, могут вызвать формирование микро- и макрофистул между артериолами и венулами. При нарушении формирования стадии сосудистых стволов могут возникать аномалии развития артерий и вен. Гемодинамические факторы в развитии заболевания имеют существенное значение, так как они служат связующим звеном между аномальными сосудистыми образованиями и системой циркуляции. Гемодинамические изменения с течением времени приводят к снижению резистентности шунтов, а следовательно, и к увеличению их диаметра. Когда же размеры шунта постепенно начинают превосходить критическую величину нормальной артерии, возникает ангиоэктазия с распространением ее на всю регионарную систему вен, артерий и коллатералей [Holman E., 1962; Malan E., 1965]. Извращенный кровоток приводит в свою очередь к развитию клинической картины хронической венозной гипертензии, степень выраженности которой зависит как от объема диспластических изменений, так и от длительности их существования [Краковский Н. И., Колесникова Р. С., Пивоварова Г. М., 1978]. Регионарные гемодинамические нарушения ведут к изменению трофики тканей. Переполнение артериальной кровью венозного русла при длительно существующем артериовенозном свище приводит к повышению давления дистальнее свища. В связи с этим расширяются глубокие, коммуникантные и поверхностные вены, в результате чего возникает относительная недостаточность их клапанного аппарата. Повышение объемной скорости кровотока может вызвать и морфологические изменения стенки вены с развитием флебэктазии и истинных венозных аневризм. Венозная регионарная гипертензия в дистальных отделах конечности приводит к уменьшению градиента давления между артериальной и венозной частями капилляров. Это способствует развитию регионарной гипоксии тканей с последующими трофическими нарушениями.
Термин «врожденная мальформация сосудов» используется для описания дефектов сосудов, образовавшихся в результате остановки развития на разных этапах эмбриогенеза. ВСМ являются следствием врожденных дефектов сосудистой системы и поэтому присутствуют с самого рождения, хотя выявить их при рождении удается не всегда. Они могут затрагивать от одной до трех сосудистых систем (артериальную, венозную и лимфатическую), причем возможна ситуация, когда врожденные сосудистые мальформации доминируют в какой-то одной системе (например, венозная мальформация) либо когда они одновременно присутствуют в разных системах (например, гемолимфатическая мальформация). Мальформации продолжают рост вне зависимости от их типа.
Классификация врожденных пороков развития периферических кровеносных сосудов В. Н. Дана (1989) широко принята в нашей стране. Она позволяет провести разделение и систематизацию ВСМ с учетом их анатомических, гистологических, патофизиологических и гемодинамических характеристик.
Хронический абсцесс легкого у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова
Авторы: Скорняков С.Н. 1 , Сабадаш Е.В. 1 , Медвинский И.Д. 1, 2 , Бердников Р.Б. 3, 4 , Хольный П.М. 4 , Дьячков И.А. 3, 4 , Николаева М.О. 3 , Щиголев М.И. 3 , Масютина Д.Д. 3 , Иванчикова Е.Д. 3
1 УНИИФ — филиал ФГБУ «НМИЦ ФПИ» Минздрава России, Екатеринбург, Россия
2 ФГОУ ВО УГМУ Минздрава России, Екатеринбург, Россия
3 ФГБОУ ВО УГМУ Минздрава России, Екатеринбург
4 УНИИФ — филиал ФГБУ НМИЦ ФПИ Минздрава России, Екатеринбург
Синдром Клиппеля – Треноне – Вебера – Рубашова (СКТВР) — врожденная ангиодисплазия периферических сосудов с формированием патологических артериовенозных соустий, наличие которых обусловливает нарушение кровотока по магистральным венам пораженной конечности с развитием варикозной трансформации поверхностных вен. Для синдрома характерно разнообразие клинических проявлений, поэтому лечение требует мультидисциплинарного подхода. Лечение заболевания — хирургическое, зачастую с большим количеством осложнений. В подавляющем большинстве случаев применяется поэтапное хирургическое лечение, травматичное и приводящее к большому количеству осложнений (кровотечения, трофические язвы, гипертрофические и келлоидные рубцы). Частота послеоперационных рецидивов достигает 30–48%. В статье представлен клинический случай хронического абсцесса легких у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова. Приведенный клинический случай является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого. Пациенты с СКТВР редко попадают в поле зрения врача-пульмонолога или торакального хирурга, а приведенный клинический случай является наглядной иллюстрацией возможного легочного проявления врожденной ангиодисплазии.
Ключевые слова: синдром Клиппеля – Треноне – Вебера – Рубашова, абсцесс легкого, клинический случай.
Для цитирования: Скорняков С.Н., Сабадаш Е.В., Медвинский И.Д. и др. Хронический абсцесс легкого у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова. РМЖ. 2018;3(I):36-39.
The chronic lung abscess in a patient with Klippel – Trenaunay – Weber Syndrome
Skornyakov S.N. 1,2 , Sabadash Е.V. 1,2 , Medvinsky I.D. 1,2 , Berdnikov R.B. 1,2 , Holny P.M. 2 , Dyachkov I.A. 1,2 , Nikolaeva M.O. 1 ,ShchigolevM.I. 1 , Masyutina D.D. 1 , Ivanchikova E.D. 1
1 Ural State Medical University, Yekaterinburg
2 Ural research Institute of Phthisiopulmonology, Yekaterinburg
Klippel – Trenaunay – Weber (KTW) syndrome is a congenital angiodysplasia of peripheral vessels with the formation of pathological arteriovenous communications, the presence of which causes the violation of blood flow along the main veins of the affected limb with the development of varicose transformation of superficial veins of the extremities. The syndrome is characterized by a variety of clinical manifestations, so treatment requires a multidisciplinary approach. The disease needs surgical treatment, often with a large number of complications. In the vast majority of cases, staged surgical treatment is used, it is often traumatic and leads to a large number of complications (bleeding, trophic ulcers, hypertrophic and keloid scars). The frequency of postoperative relapse reaches 30–48%. The article presents a clinical case of chronic lung abscess in a patient with Klippel-Trenaunay-Weber syndrome. The presented clinical case is a unique example of the combination of the syndrome of congenital angiodysplasia and chronic lung abscess. Patients with KTW syndrome rarely come into the view of a pulmonologist or thoracic surgeon, and this clinical case is a clear illustration of the possible pulmonary manifestation of congenital angiodysplasia.
Key words: Klippel – Trenaunay – Weber syndrome, lung abscess, clinical case.
For citation: Skornyakov S.N., Sabadash Е.V., Medvinsky I.D. et al. The chronic lung abscess in a patient with Klippel – Trenaunay – Weber Syndrome // RMJ. 2018. № 3(I). P. 36–39.
В статье представлен клинический случай хронического абсцесса легких у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова, который является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого.
Введение
Синдром Клиппеля – Треноне – Вебера – Рубашова (СКТВР) — врожденная ангиодисплазия периферических сосудов с формированием патологических артериовенозных соустий, наличие которых обусловливает нарушение кровотока по магистральным венам пораженной конечности и как следствие — развитие варикозной трансформации поверхностных вен верхних и/или нижних конечностей с неуклонно прогрессирующим течением [1–6].
По данным литературы, в основе заболевания предполагается роль нарушения эмбриогенеза с дисплазией глубокой венозной системы, однако наследственный фактор в развитии СКТВР играет незначительную роль. В структуре причин, нарушающих отток крови по глубоким венам, как правило, выделяют аплазию или гипоплазию вен, сдавление вен эмбриональными тяжами или артериальными сосудами, врожденное недоразвитие клапанного аппарата с расширением просвета глубоких вен. Патологические врожденные артериовенозные фистулы-шунты неизменно приводят к варикозному расширению вен, артериовенозные соустья усиливают венозный отток и тем самым увеличивают минутный объем сердца, вызывают его перегрузку и в зависимости от локализации шунта, длительности его существования и калибра измененных артерий приводят к гипертрофии сердца и сердечно-сосудистой недостаточности. В дальнейшем наблюдается снижение артериального и повышение венозного давления, уменьшение общего периферического сопротивления. За счет артериовенозного сброса происходит повышение содержания кислорода в венозной крови, что является одним из наиболее выраженных и постоянных симптомов артерио венозных фистул [2, 3, 6].
Для СКТВР характерна классическая триада симптомов: кожные ангиомы, расширение поверхностных вен, гипертрофия пораженной конечности (синдром Клиппеля – Треноне). Кроме того, может иметь место наличие артериовенозных анастомозов (синдром Паркса – Вебера) [1, 4]. Ряд авторов указывают на высокий процент распространенности таких системных проявлений СКТВР, как висцеромегалия и ангиоматоз висцеральных органов, гемангиомы желудочно-кишечного тракта, мочевой системы, добавочные крупные сосуды, аневризмы почечных артерий, гемангиомы почек, таза, матки [4, 5–7]. СКТВР обладает разнообразием клинических проявлений, что обусловливает необходимость мультидисциплинарного подхода к лечению заболевания с участием специалистов различных профилей (хирургов, педиатров, дерматологов, врачей лучевой диагностики) [1–4, 8]. В подавляющем большинстве случаев применяется этапное хирургическое лечение, зачастую травматичное и приводящее к большому количеству осложнений, по данным литературы, в 7,4–20% случаев (кровотечения, трофические язвы, гипертрофические и келлоидные рубцы). Частота послеоперационных рецидивов достигает 30–48% [2, 7, 9–11].
Клинический случай
В туберкулезное легочно-хирургическое отделение Уральского научно-исследовательского института фтизиопульмонологии 17 апреля 2017 г. поступил пациент П., 46 лет, с жалобами на периодический кашель с выделением светлой мокроты, одышку при умеренной физической нагрузке (вынужденная остановка при ходьбе на 2–3-лестничном пролете), множественные телеангиоэктазии латеральной, задней шейных, дельтовидной, грудной, локтевой областей слева.
История болезни.
В 2003 г. при прохождении обследования (подготовка к плановому оперативному лечению по поводу СКТВР) по результатам обзорной рентгенографии органов грудной клетки (ОГК) впервые диагностирован поликистоз нижней доли левого легкого. За медицинской помощью пациент не обращался. В октябре 2016 г. заболел остро, когда на фоне фебрильной лихорадки появился продуктивный кашель с отделением небольшого количества гнойной мокроты с геморрагическим компонентом (прожилки крови). В последующие дни стал отмечать усиление кашля по ночам при положении на правом боку. Выраженность кашлевого синдрома значительно снижалась при положении на левом боку и в дневное время суток. Самостоятельно не лечился, за медицинской помощью по-прежнему не обращался. В ноябре 2016 г. отметил некоторое улучшение в виде урежения ночных приступов кашля. В январе 2017 г. состояние вновь ухудшилось, появились выраженная общая слабость, снижение толерантности к физическим нагрузкам, кровохарканье. После обращения за медицинской помощью был обследован. По данным мультиспиральной компьютерной томографии (КТ) ОГК и КТ с внутривенным контрастным усилением диагностировано разрушенное левое легкое на фоне поликистозного поражения. Рекомендовано плановое оперативное лечение в объеме пульмонэктомии слева.
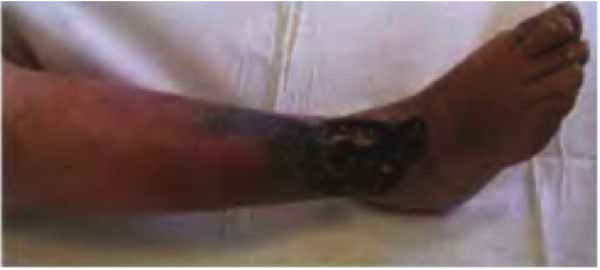
В анамнезе. В детстве на фоне интенсивных физических нагрузок (занимался спортивной греблей) было отмечено появление и медленное прогрессирование следующих симптомов: нарушение местной терморегуляции, периодические ноющие боли и варикозная деформация поверхностных вен левой верхней конечности (рис. 1). Диагностирована врожденная ангиодисплазия. После отказа от занятий спортом прогрессирование клинических проявлений заболевания замедлилось. В 2003 г. по поводу СКТВР было выполнено разобщение артериовенозных соустий левой верхней конечности. Впоследствии и по настоящее время синдром проявляется в виде редких эпизодов спонтанно возникающих непродолжительных ноющих болей в левой верхней конечности, особенно в указательном пальце, продолжительностью около 10 мин. Продолжительность периодов бессимптомного течения может достигать нескольких месяцев, чаще 4–6 нед.
Прочие сопутствующие заболевания. С детства отмечает частые острые респираторные вирусные инфекции, бронхиты. Гипертоническая болезнь II стадии.
Семейный анамнез отягощен по заболеваниям сердечно-сосудистой системы.
При поступлении: общее состояние удовлетворительное. Телосложение гиперстеническое. Кожные покровы физиологической окраски. На коже левых латеральной, задней шейных областей располагается телеангиоэктатический сосудистый невус («винный» невус) неправильной формы, 4–6 см в диаметре, не возвышающийся над поверхностью кожи, а также множественные телеангиоэктазии дельтовидной, частично грудной и локтевой областей слева (рис. 2). Щитовидная железа не увеличена. Дыхание через нос свободное. Грудная клетка правильной формы. Обе половины ее одинаково участвуют в акте дыхания. Перкуторно над легкими справа: ясный легочной звук, слева: в верхних отделах коробочный, в нижних — тимпанит. В правом легком дыхание везикулярное, в левом выслушиваются разнокалиберные влажные хрипы. ЧДД — 16 в минуту. Границы сердца не смещены, не расширены. Тоны сердца ясные, ритм правильный, шумы отсутствуют. ЧСС — 89 в минуту, АД — 125/80 мм рт. ст. Пульс — 89 уд/мин, ритмичный, нормального наполнения и напряжения. Живот правильной формы, пальпаторно мягкий, безболезненный во всех отделах. Нижний край печени выше края реберной дуги. Поясничные области визуально и пальпаторно не изменены. Симптомы поколачивания отрицательные с обеих сторон. Дизурии нет. Очаговой неврологической симптоматики нет.
При обследовании: в общем анализе крови: лейкоциты — 9,8×10 9 /л, эритроциты — 5,55×10 12 /л, тромбоциты — 263×10 9 /л, гемоглобин — 143 г/л, гематокрит 43,1%, СОЭ —13 мм/ч. Общий анализ мочи: удельный вес — 1,030 г/л, рН — 5,0, уробилиноген — 3 мг/дл. Биохимия крови: глюкоза — 4,5 ммоль/л, общий белок — 73,4 г/л, альбумин — 39,6 г/л, АСТ — 19,0 Ед/л, АЛТ — 55,8 Ед/л, мочевина — 7,2 ммоль/л. Коагулограмма: тромбоциты — 450×10 9 /л, активированное частичное тромбопластиновое время — 29,2 с, протромбиновое время — 13,3 с, международное нормализованное отношение — 1,26 (удлинение коагуляции по внешнему пути).
ФГДС: варикозно расширенные вены нижней трети пищевода II–III степени. ЭКГ: синусовая тахикардия до 90 уд/мин. Метаболические нарушения, неполная блокада правой ножки пучка Гиса. Дуплексное сканирование вен верхних конечностей с цветным картированием: поверхностные и глубокие вены правой верхней конечности проходимы. Посттромботическая болезнь левой верхней конечности, реканализация срединной подкожной вены, частичная реканализация латеральной подкожной вены в области локтевого сгиба, без флотации. Варикозная трансформация латеральной подкожной, срединной подкожной, лучевой, локтевой вен слева. КТ ОГК с внутривенным контрастным усилением: в паренхиме правого легкого очаговых и фокусных изменений нет. В левом легком во всех сегментах, преимущественно в нижней доле, определяются множественные крупные и средних размеров округлые полости (кисты, буллы), разделенные тонкими септами. Некоторые полости (в задних и нижних отделах) с жидкостью, дренируются соответствующими бронхами. Артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной. Оставшаяся паренхима избыточно воздушна, сосудистый рисунок обеднен. Свободного выпота в плевральных полостях нет. Ствол легочной артерии не расширен. Костные элементы и мягкие ткани грудной стенки не изменены. Заключение: кистозно-буллезная трансформация паренхимы левого легкого (рис. 3).
Осмотр офтальмолога: пигментный невус сетчатки левого глаза.
Предоперационный диагноз: разрушенное левое легкое. Поликистоз левого легкого (?). Абсцесс левого легкого с пневмонией (?).
15.05.17 пациенту была выполнена пульмонэктомия слева.
Интраоперационно: плевральная полость свободна, грубые рубцовые сращения в задних отделах и над диафрагмой. Легкое выделено из сращений остро-тупо. Легкое практически полностью выполнено кистами: воздушными и наполненными (напряженными). Элементы корня легкого обработаны раздельно: поочередно перевязаны и дважды прошиты легочная артерия, верхняя и нижняя легочные вены (DSTSeries™ TA™, typeTA30V3S, Covidien, NewHaven, CT, USA, 6 шт.). Культя главного бронха мобилизована до бифуркации, произведена ее реампутация на уровне 2–3-го полукольца. Культя ушита вручную узловыми швами атравматично проленом 3/0 по Суиту с шагом 1–1,5 мм. Дренаж. Послойные швы.
Послеоперационный период протекал гладко. Проведен курс антибактериальной профилактики гнойных осложнений. По дренажам из плевральной полости в 1-е сутки после операции выделилось 250 мл серозно-геморрагической жидкости, в течение 2-х дней после операции количество отделяемого в сутки уменьшилось до 100 мл, сброса воздуха по плевральному дренажу и явлений подкожной эмфиземы не отмечалось. На 3-и сутки после операции дренаж удален с подпусканием воздуха в плевральную полость. Операционная рана зажила первичным натяжением.
Патогистологическое исследование № 459/17. Практически всю нижнюю долю занимает гигантская полость многокамерного строения, с кожистой стенкой, заполненная большим количеством зеленоватых масс. Стенка полости 3-слойная: гнойно-некротический слой с большим количеством нейтрофилов, слой грануляционной ткани неспецифического вида, широкий фиброзный слой. Вокруг большое количество гемосидерофагов интраальвеолярно, участки организации, бронхоэктазы. В легочной ткани также определяются гемосидерофаги интраальвеолярно, имеется утолщение и перекалибровка сосудов с резким утолщением их стенки и сужением просвета. По линии резекции — склероз стенки бронха. Окраска по Цилю — Нильсену отрицательная.
Заключение: гигантский многокамерный хронический абсцесс в нижней доле левого легкого в активной фазе гнойного воспаления. Гемосидероз легкого (кровохарканье в анамнезе) (рис. 4).
При контрольном осмотре через 1 мес.: жалобы на умеренные боли в области торакотомного разреза (рубец без признаков воспаления), температура тела в норме. Обзорная рентгенография ОГК: слева — остаточная полость частично заполнилась гомогенным содержимым. Других дополнительных затемнений и уровней жидкости нет; справа — очаговых и фокусных изменений нет.
Через 6 мес. после оперативного вмешательства состояние удовлетворительное, никаких жалоб пациент не предъявляет. При рентгенографии ОГК: слева — остаточная полость полностью заполнилась гомогенным содержимым, справа — очаговых и фокусных изменений нет.
Заключение
Приведенный клинический случай является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого. Поражение паренхимы легкого, вероятно, обусловило длительное бессимптомное прогрессирование кистозной гипоплазии левого легкого. На фоне вовлечения в процесс нижнедолевого бронха нарушения мукоцилиарного клиренса и кинетики бронхов достигли критических значений с последующей их колонизацией неспецифической микрофлорой, при этом заболевание манифестировало в виде острого абсцесса легкого с полным разрушением его паренхимы и последующей хронизацией процесса. Таким образом, данный процесс можно рассматривать как вариант системного проявления СКТВР.
В пользу предположения о сосудистом генезе поражения паренхимы легкого говорят данные: патоморфологического исследования (перекалибровка сосудов с резким утолщением их стенки и сужением просвета), КТ-исследования (артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной). Кроме того, обращает на себя внимание локализация изменений: левосторонняя — наружных проявлений СКТВР и кистозно-буллезная трансформация паренхимы только левого легкого. В пользу того, что хронический абсцесс развился именно на фоне кистозной гипоплазии, свидетельствуют его гигантский многокамерный характер, локализация в нижней доле левого легкого (расположение наиболее выраженного кистозного изменения легочной паренхимы). Наличие в легочной ткани гемосидерофагов свидетельствует о выраженном внутрилегочном кровотечении, вызванном разрушением большого количества кистозных полостей.
В доступной литературе мы не встретили каких-либо упоминаний, подтверждающих нашу гипотезу.
Важно отметить, что пациенты с СКТВР редко попадают в поле зрения врача-пульмонолога или торакального хирурга, а приведенный клинический случай является наглядной иллюстрацией возможного легочного проявления врожденной ангиодисплазии. Такие клинические проявления СКТВР, как эпизоды кашля с мокротой и кровохарканье, долгое время не оценивались специалистами как клинически значимые, поскольку не сопровождались изменениями лабораторных показателей, наличием проявлений, характерных для интоксикационного синдрома. Но при более детальном обследовании пациента выявлен патологический процесс, который явился абсолютным показанием для плановой пульмонэктомии.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Синдром Клиппеля—Треноне—Вебера - лучевая диагностика
Синдром Клиппеля ‒ Треноне ‒ Вебера ‒ состояние, влияющее на развитие кровеносных сосудов, кожи, мышц и костей. Данное расстройство имеет характерные черты в виде классической триады: капиллярную гемангиому, называемую винным пятном, гипертрофию мягких тканей и костей, пороки развития вен. Это состояние было впервые описано французскими врачами Морисом Клиппелем и Паулем Треноне в 1900 году, которое они его называли «nevus vasculosus osteohypertrophicus». Немецко-британский врач Фредерик Паркес Вебер описал случаи 1907 и 1918 годов, которые были похожи, но не идентичны тем, которые описывали Клиппель и Треноне. Врожденный дефект поражает мужчин и женщин в равной степени и не ограничивается в пределах какой-либо расовой группы. Не имеется абсолютного подтверждения, что патология носит генетический характер, хотя изучение ее все еще продолжается.
4. Sfaihi L, Aissa K, Fourati H, Kamoun F, Mnif Z, Kamoun T, et al. Klippel Trenaunay syndrome in association with Sturge Weber syndrome about one case. Tunis Med. 2016 Feb. 92(2):173-4.
5. Sung HM, Chung HY, Lee SJ, Lee JM, Huh S, Lee JW, et al. Clinical Experience of the Klippel-Trenaunay Syndrome. Arch Plast Surg. 2015 Sep. 42 (5):552-8.
7. Vahidnezhad H, Youssefian L, Uitto J. Klippel-Trenaunay syndrome belongs to the PIK3CA-related overgrowth spectrum (PROS). Exp Dermatol. 2016 Jan;25(1):17-9.
В 1900 году известные французские медики Клиппель и Треноне впервые описали синдром у 2-х пациентов с винным пятном, варикозным расширением вен конечности, а также с гипертрофией костных и мягких тканей пораженных конечностей. Они назвали синдром «naevus vasculosus osteohypertrophicus». В 1907 году Паркс Вебер, не подозревая об открытии Клиппеля и Треноне, описал пациента с тремя вышеупомянутыми симптомами, а также с артериовенозной мальформацией пораженной конечности. Он назвал этот процесс гемангиэктатической гипертрофией [1].
Определение и клиника
Синдром Клиппеля - Треноне - Вебера - состояние, влияющее на развитие кровеносных сосудов, кожи, мышц и костей. Данное расстройство имеет характерные черты в виде классической триады: капиллярную гемангиому, называемую винным пятном, гипертрофию мягких тканей и костей, пороки развития вен [4].
Большинство людей с синдромом Клиппеля - Треноне - Вебера с рождения имеют винное пятно, которое появляется в результате отека мелких кровеносных сосудов вблизи поверхности кожи [2]. Винные пятна плоские, имеют четкие границы, варьируются от бледно-розового до темно-бордового цвета, обычно локализуются на латеральной части одной конечности. С возрастом пораженный участок может стать светлее или темнее. Глубина гемангиомы может быть различной: она может быть ограничена кожей или проникать в низ лежащие слои, включающие мышцы и кости [1]. Висцеральные органы, такие как селезенка, печень, мочевой пузырь и толстая кишка, а также плевра, тоже могут быть вовлечены в патологический процесс [7].
Гипертрофия костных и мягких тканей является третьим признаком синдром Клиппеля - Треноне - Вебера. Гипертрофия конечности может быть вторичной по отношению к увеличенной длине (костное участие) и / или увеличению обхвата (вовлечение мягких тканей) [3]. Гипертрофия может быть оценена при рождении, а также в первые годы жизни. Большую степень гипертрофии можно наблюдать у пациентов с имеющейся у них артериовенозной мальформацией [1].
Обычно паталогический рост ограничен одной конечностью, чаще всего ногой, однако, разрастание также может затронуть руки, реже шею, голову и поясницу [5]. Аномальный рост может вызывать боль, чувство тяжести, снижение объема активных движений в зоне поражения. Также чрезмерный рост одной ноги приводит к проблемам с ходьбой. Иногда вовлеченная в процесс конечность может быть атрофирована, а не гипертрофирована [6].
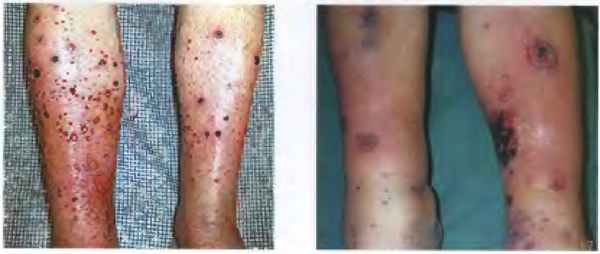
Пороки развития вен являются третьей важной особенностью клинического течения синдрома Клиппеля - Треноне - Вебера. В эту группу аномалий входят варикозные расширения вен (обычно на латеральных сторонах бедер и на икрах ног), которые иногда замечаются при рождении [7]. Варикоз может не визуализироваться до тех пор, пока ребенок не начнет ходить. Варикозы могут быть обширными, хотя чаще всего они локализуются в пределах подкожной вены ноги [2].
Глубокие вены конечностей также могут вовлекаться в патологический процесс, повышая риск возникновения тромбоза, называемого тромбозом глубоких вен. Впоследствии оторвавшийся тромб, проходя с током крови через легкие, может привести к развитию легочной эмболии. В редких случаях варикозное расширение сосудов наблюдаются в мочевом пузыре, толстой кишке и легких [4].
Варикозы могут остаться стабильными в размере или постепенно расширяться, о чем будут свидетельствовать появление болей и лимфостаз. Эти симптомы могут ухудшиться во время беременности [1].
Другими особенностями клинического течения этого синдрома являются: лимфатическая обструкция, расщепление позвоночника, гипоспадия, синдактилия, олигодактилия, полидактилия, гипергидроз, гипертрихоз, парестезии, декальцификация костей, хроническая венозная недостаточность, застойный дерматит, плохое заживление ран, изъязвление, тромбоз, ангиосаркома. Орофасциальные аномалии могут потребовать специализированного ухода за зубами и анестезию [2].
Синдромом Клиппеля - Треноне - Вебера страдает не менее 1 на 100 000 человек по всему миру. Нет подтверждения о том, что данная патология развивается у представителей определенной расы. Страдают как мужчины, так и женщины в равной степени [3].
Точная причина синдрома Клиппеля - Треноне - Вебера неизветна, хотя существуют несколько теорий. Близнак и Стэпл предложили теорию внутриутробного повреждения симпатических ганглиев или латерального промежуточного тракта, что приводит к дилатации микроскопических артериовенозных анастомозов [3]. Сервелль считал, что аномалии развития глубоких вен, с результирующей обструкцией венозного потока, приводят к венозной гипертензии, развитию варикоза и гипертрофии конечностей [6]. МакГрори и Амадио полагали, что лежащая в основе смешанная мезодермальная и эктодермальная дисплазия, вероятно, ответственны за развитие данного синдрома [7].
Синдром Клиппеля - Треноне - Вебера почти всегда является спорадическим, что означает, что он возникает у людей, не имеющих данной патологии в своей семье [2]. Исследования показывают, что это состояние является следствием генных мутаций, которые не наследуются. Эти генетические изменения, вызываемые соматическими мутациями, возникают случайным образом в одной клетке на ранних стадиях развития до рождения. По мере того как клетки продолжают делиться в период внутриутробного развития организма, одни дочерние клетки, возникшие от мутировавшей материнской, будут иметь мутации, а другие нет. Эта смесь клеток с генетической мутацией и без нее именуется понятием мозаицизм [1].
Также Кихичаком было высказано предположение, что синдром Клиппеля - Треноне - Вебера может быть вызван мутацией гена PIK3CA. Этот ген кодирует белок р110α, который является субъединицей фермента, называемого фосфатидилинозитол-3-киназа (PI3K). PI3K играет важную роль в клеточной жизнедеятельности, в том числе влияние на их пролиферацию, миграцию и выживаемость.
При возникновении мутаций в гене PIK3CA, подвергается изменению как белок p110α, так и фермент PI3K, вследствие чего у последнего неестественным образом повышается активность, позволяющая клеткам непрерывно расти и делиться. Повышенная клеточная пролиферация приводит к патологическому росту мягких тканей, костей и кровеносных сосудов [1].
Артерио-венозные мальформации
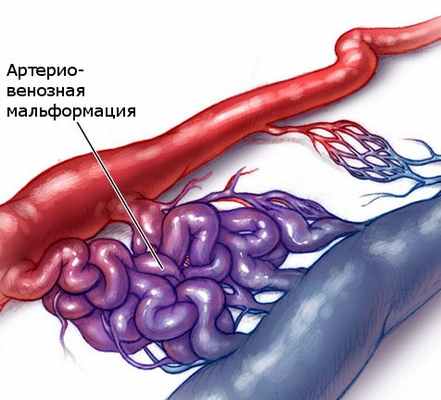
Сосудистые пороки - это общий термин, который включает в себя врожденные сосудистые аномалии : только вен - венозные мальформации (ВМ) только лимфатические сосудов - лимфатические пороки одновременно вен и лимфатических сосудов: вено-лимфатические мальформации аномалии артерий, связанных непосредственно с венами без капиллярной сети между ними: артериовенозные мальформации(АВМ)
Происхождение сосудистых мальформаций
Мальформации возникают во внутриутробном периоде . Генетики проводят много исследований по изучению этого феномена, но к определённой концепции до сих пор не пришли. Поэтому вопрос о причинах возникновения мальформаций остается не до конца изучен.
Врожденные ангиодисплазии (синдром Паркса-Вебера-Рубашова) - характеризуются наличием патологических соустий (фистул) между артериями и венами.
Артериовенозные соустья часто бывают множественными, имеют разнообразный калибр и форму. В зависимости от диаметра различают макрофистулы, заметные невооруженным глазом, и микрофистулы, которые выявляются только при микроскопическом исследовании тканей конечности.
Окончательно причины развития синдрома Паркса-Вебера-Рубашова не установлены. Ряд авторов рассматривают его как результат мутаций в гене RASA1, который кодирует белок p120-RasGAP, участвующий в передаче химических сигналов из внеклеточного пространства к ядру клетки. Вместе с тем, каким именно образом эти изменения приводят к специфическим сосудистым аномалиям у лиц с синдромом Паркса Вебера-Рубашова, не установлено.
Патологические соустья чаще располагаются в зоне бедренной, ветвей подколенной артерии, а также по ходу большеберцовых артерий. Интенсивный сброс артериальной крови через артерио-венозные свищи ведет к повышению давления крови в венах.
Из-за повышенной функциональной нагрузки изменяется гистологическая структура венозной стенки. Происходит утолщение ее мышечной оболочки и формирование внутренней эластической мембраны ("артериализация" вены).
Значительная часть артериальной крови при наличии свищей поступает в венозное русло, минуя капиллярную сеть, поэтому возникает тяжелое кислородное голодание в тканях и нарушаются обменные процессы. Из-за венозной гипертензии усиливается нагрузка на сердце, что постепенно приводит к расширению его границ и сердечной декомпенсации.
Основные симптомы
Каковы симптомы сосудистой мальформации? Сосудистые мальформации могут вызвать различные симптомы, зависящие от расположения их в теле: Общим симптомом всех мальформаций является боль. Венозный и лимфатический пороки могут вызвать подкожную припухлость, над которой может располагаться родинка. При поражениях кожи может сочиться лимфа или возникнуть кровотечение . Лимфатические мальформации, как правило, осложняются инфекционным процессом, требуя лечения антибактериальными препаратами. Вено-лимфатические мальформации могут быть связаны с феноменом под названием синдром Клиппеля-Треноне.
Артериовенозные мальформации (АВМ) могут также вызвать боль. Они являются наиболее опасными из-за быстрого сброса крови из артерий в вены. В зависимости от их расположения, они также могут привести к кровотечению (например , из матки, мочевого пузыря). Легочные артериовенозные мальформации несколько отличаются тем, что они как бы являются шунтом, по которому кровь из правых отделов сердца сбрасывается в левые отделы сердца, не повышая уровень кислорода в легких. Это приводит к симптомам пониженного содержания кислорода, одышке, усталости. Такие пороки могут кровоточить, в результате чего возникает кровохарканье или гемоторакс (появление крови в грудной клетке). Кроме того, эта аномалия может позволить сгусткам крови пройти через легкие и попасть в другие артерии тела человека, тем самым вызвав инсульт или абсцесс мозга. Это является существенной причиной для немедленного лечения легочных артериовенозных мальформаций.
Преимущества лечения в клинике
Диагностика
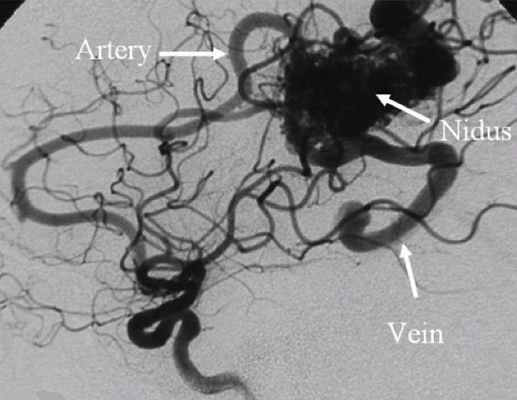
Помимо клинической картины и внешнего осмотра, для диагностики мальформаций используются ультразвуковые методы, компьютерная и магнито-резонансная томография, ангиография. С помощью этих методов удается выявить распространенность процесса в мягких тканях, те угрозы которые таит эта мальформация и подобрать правильное лечение. Диагностические исследования проводятся последовательно от простых к сложным. Наиболее трудны в диагностике артериовенозные мальформации головного мозга и внутренних органов. Нередко о них можно думать только при развитии осложнений связанных с кровотечением.
Клиническая симптоматика обусловлена нарушениями регионарного кровообращения и центральной гемодинамики. Конечность удлинена на 3-8 см, мягкие ткани ее гипертрофированы. Удлинение конечности обусловлено продуктивной перестройкой костной ткани из-за усиленной васкуляризации эпифизарных линий.
Характерно наличие варикозно расширенных поверхностных вен на нижней или верхней конечности. Их появление связано с высокой венозной гипертензией вследствие заброса крови из артерии. Стенки вен плотноэластической консистенции, с трудом сжимаемые. Расширенные вены не исчезают после придания конечности возвышенного положения. Иногда при осмотре над ними определяется пульсация.
Рука, приложенная к месту проекции артериовенозного соустья, ощущает вибрацию (симптом "кошачьего мурлыкания"). При аускультации в этой области выслушивают непрерывный систоло-диастолический шум, усиливающийся в момент систолы.
Наиболее ранний и постоянный симптом заболевания - повышение температуры кожи конечности, особенно значительное над местом расположения артериовенозных соустий. Разница в температуре симметричных участков непораженной и пораженной конечности достигает 4-8°.
Нарушения микроциркуляции, связанные с регионарными гемодинамическими расстройствами, в ряде случаев приводят к образованию язв и некрозов дистальных отделов конечностей. Из язв часто возникают повторные обильные кровотечения, приводящие к тяжелой анемии. Нередко бывает гипертрихоз и гипергидроз.
Ряд клинических симптомов связан с изменениями центральной гемодинамики. При значительной венозной гипертензии увеличивается нагрузка на правые отделы сердца, следствием ее являются гипертрофия сердечной мышцы, увеличение ударного и минутного объема сердца Однако по мере прогрессирования заболевания сократительная функция сердца начинает ослабевать, происходит миогенная дилатация сердца с расширением его полостей Развивается сердечная недостаточность, проявляющаяся одышкой, сердцебиениями, отеками, застойной печенью, асцитом, анасаркой. Для врожденных артериовенозных свищей характерно урежение пульса, наступающее после пережатия приводящей артерии.
Реографическая кривая, записанная с сегмента конечности, где расположены артериовенозные соустья, характеризуется высокой амплитудой, отсутствием дополнительных зубцов на катакроте, увеличением реографического индекса. В дистальных сегментах конечности амплитуда кривой, напротив, снижена. Артериализация венозной крови ведет к увеличению насыщения ее кислородом, содержание которого в расширенных венах увеличивается на 20-30%.
Наиболее важным методом диагностики врожденных артериовенозных свищей является ангиография. Различают прямые и косвенные ангиографические признаки артериовенозных свищей Наличие на ангиограммах контрастированного соустья или сосудистой полости, сообщающейся с артерией и веной, относят к прямым признакам. Косвенно о наличии свища свидетельствуют одновременное контрастирование артерий и вен, расширение просвета приводящей артерии, обеднение сосудистого рисунка дистальнее расположения артериовенозного свища.
Синдром Клиппеля—Треноне—Вебера - лучевая диагностика
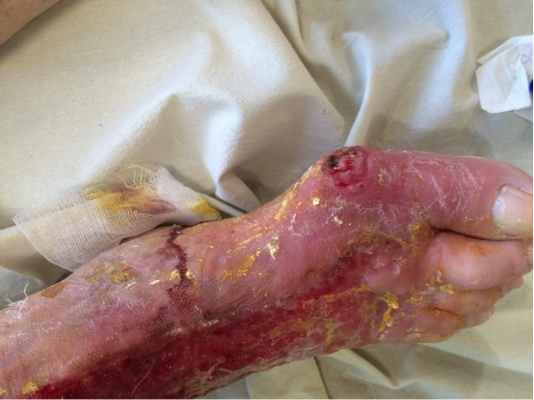
Язва (ulcus) — дефект кожи или слизистой оболочки, для которого характерно хроническое течение без склонности к спонтанному заживлению либо периодическое рецидивирование. Среди многочисленных гнойно-некротических заболеваний нижних конечностей трофические язвы занимают особое положение ввиду их широкого распространения и сложности лечения.
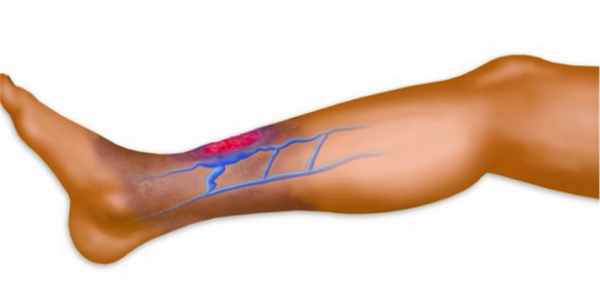
О формировании язвы следует говорить в том случае, если кожный дефект не заживает в течение шести недель и более.
Кожную язву считают не самостоятельным патологическим состоянием, а осложнением различных (более 300) заболеваний и синдромов. Причиной язвообразования могут быть различные врождённые или приобретённые заболевания сосудов, последствия травм, инфекций, общие заболевания и другие факторы, которые нередко очень сложно систематизировать ввиду огромного числа болезней и состояний, приводящих к развитию язвенного дефекта.
Классификация язвенно-эрозивных поражений кожи в зависимости от причины возникновения:
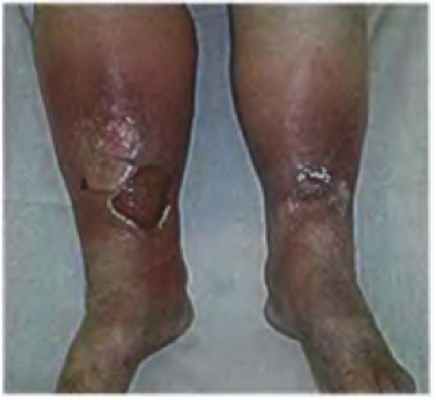
I. Язвы, обусловленные хронической венозной недостаточностью на фоне:
- посттромбофлебитической болезни;
- варикозной болезни;
- врождённых венозных ангиодисплазий, синдрома Клиппеля-Треноне.
II. Язвы, обусловленные заболеваниями артерий нижних конечностей (ишемические язвы):
- на фоне макроангиопатий:
- облитерирующий атеросклероз сосудов нижних конечностей;
- облитерирующий тромбангиит (болезнь Бюргера-Винивартера),
- постэмболическая окклюзия артерий нижних конечностей.
- диабетические;
- гипертензионно-ишемические язвы (синдром Мартореля).
![]()
III. Язвы, вызванные артериовенозными фистулами:
- врождёнными (синдром Паркса Вебера);
- посттравматическими.
IV. Язвы на фоне нарушений лимфатического оттока:
- первичные лимфедемы (болезнь Милроя и др.);
- вторичные лимфедемы (после перенесённой рожи, оперативных вмешательств, лучевой терапии и др.);
- лимфедема на фоне филяриоза и др.
V. Посттравматические язвы:
- после химических, термических поражений и электротравмы;
- вследствие механических и огнестрельных повреждений мягких тканей;
- вследствие укусов человека, животных и насекомых;
- остеомиелитические;
- декубитальные;
- ампутационных культей стопы, голени, бедра;
- послеоперационных рубцов (рубцово-трофические язвы);
- постинъекционные;
- лучевые.
VI. Нейротрофические язвы:
- вследствие заболеваний и повреждений головного и спинного мозга;
- вызванные повреждениями периферических нервных стволов;
- на фоне инфекционных, врождённых, токсических, диабетических и других полинейропатий.
VII. Язвы, возникающие на фоне общих заболеваний:
- системных болезней соединительной ткани (коллагенозов) и сходных с ними болезней и синдромов (ревматоидного полиартрита, системной красной волчанки, дерматомиозита, склеродермии, узелкового периартериита, болезни Рейно, гранулематоза Вегенера, болезни Крона, антифосфолипидного синдрома, криоглобулинемии, гангренозной пиодермии и др.);
- хронических заболеваний сердечно-сосудистой системы (ишемической болезни сердца, пороков сердца, кардиомиопатий и др.), протекающих с тяжёлой недостаточностью кровообращения;
- хронических заболеваний печени, почек;
- тяжёлой хронической анемии и других заболеваний крови (серповидно-клеточной анемии, наследственного сфероцитоза, талассемии и др.);
- эндокринопатий («стероидных» язв и др.);
- болезней обмена (подагры, амилоидоза и др.);
- авитаминоза и алиментарного истощения.
VIII. Язвы, обусловленные инфекционными, вирусными, микотическими и паразитарными заболеваниями кожи:
- туберкулёзные (уплотнённая эритема Базена, колликвативный туберкулёз кожи, скрофулодерма и др.), сифилитические, лепрозные, сибиреязвенные, при болезни Лайма (боррелиоз), сапе, мелиоидозе, лейшманиозе кожи (болезнь Боровского), нокардиозе, эпителиоидном ангиоматозе (болезнь кошачьих царапин) и др.;
- эрозивно-язвенные поражения herpes simplex или varicella zoster,
- микотические (фунгозные);
- пиогенные, развившиеся в связи с неспецифическими инфекционными заболеваниями кожи и подкожной клетчатки (флегмона, рожа, пиодермия и др.).
![]()
IX. Язвы, возникшие на фоне новообразований:
![]()
- доброкачественных кожных новообразований (папиллом, невусов, фибром и др.);
- злокачественных новообразований кожи и мягких тканей (саркомы Капоши и других сарком, меланомы, базалиомы и др.);
- заболеваний крови — язвенно-некротических васкулитов (геморрагического васкулита, геморрагической пурпуры Шенлейна-Геноха, лейкозов, грибовидного микоза, агранулоцитоза и др.);
- злокачественных новообразований внутренних органов;
- распада злокачественных опухолей (например, рака молочной железы и др.) и метастазов в кожу и подкожные лимфатические узлы.
X. Язвы и язвенно-эрозивные поражения кожи, возникшие на фоне острых и хронических кожных заболеваний — экземы, дерматита, псориаза, пузырных дерматозов и др.
XI. Артефициальные язвы на почве членовредительства, патомимии, введения инородных тел, инъекций наркотических и других веществ и др.
XII. Смешанные язвы, сочетающие несколько причин.
XIII. Хронические язвы другой, трудно классифицируемой этиологии.
В зависимости от глубины деструкции тканей, связанной с язвенным процессом, различают:
- I степень — поверхностную язву (эрозию) в пределах дермы;
- II степень — язву, достигающую подкожной клетчатки;
- III степень — язву, проникающую до фасции или распространяющуюся на субфасциальные структуры (мышцы, сухожилия, связки, кости), пенетрирующую в полость суставной сумки, сустава или внутренние органы.
В зависимости от размеров различают язвы:
- малые, площадью до 5 см2;
- средние — от 5 до 20 см2;
- большие — от 20 до 50 см2;
- обширные (гигантские) — свыше 50 см2.
Перспективы заживления язвенного дефекта во многом зависят от выраженности нарушений кровотока в коже, расположенной вокруг язвы. В некоторых ситуациях даже при ликвидации основных причин, приводящих к образованию язвы, в окружающих тканях развиваются необратимые нарушения микроциркуляции, которые не оставляют возможностей для самостоятельного заживления дефекта.
Все язвенные дефекты инфицированы. В ГКБ29 проводят посев раневого отделяемого, микроскопию мазка-отпечатка из язвы позволяющие в короткие сроки определить состав микрофлоры и её количество, чувствительность к антибиотикам. При подозрении на малигнизацию язвы (озлокачествление) или на её злокачественную природу производят гистологическое исследование биоптатов, взятых из подозрительных участков краёв и дна язвы.
В отделении гнойной хирургии ГКБ29 первоочередное внимание оказывается установке причины язвообразования, что помогает производить не симптоматическое, а этиотропное лечение и улучшает прогноз в отношении сроков окончательного закрытия дефекта. Предпочтение отдается активной хирургической тактике с проведением ранних некрэктомий, при необходимости производится монтаж системы вакуум-аспирации для более быстрого и эффективного очищения язвенных дефектов и перевода раневого процесса в 3ю стадию –стадию заживления. При невозможности спонтанного заживления язвенного дефекта после устранения причины, приведшей к его развитию (например, гигантский язвенный дефект) выполняются реконструктивно-пластические операции.
Особое внимание оказывается пациентам, у которых язвообразование произошло на фоне варикозной болезни вен нижних конечностей. В отделении гнойной хирургии ГКБ29 производится комбинированный подход в лечении данных пациентов вне зависимости от пола, возраста, а так же наличия сопутствующих заболеваний. Предпочтение отдается оперативному вмешательству на венозной сосудистой системе (комбинированная флебэктомия по оригинальной методике в модификации заведующего отделением Селезнева В.В., а также профессора, сосудистого хирурга Дубровского А.В.) с последующим пластическим закрытием язвенного дефекта после купирования воспалительного процесса.
Государственная клиническая больница №29 им. Н.Э.Баумана – это современная многопрофильная высокотехнологичная больница с уникальной полуторавековой историей и традицией, оказывающая высококачественную медицинскую помощь в круглосуточном режиме.
Читайте также: