Синдром Лемье — Нимех: синдром Шарко-Мари-Тута, нефрит и глухота
Добавил пользователь Владимир З. Обновлено: 23.01.2026
Тяжелая гипертензия, почечная недостаточность, стероидогенез, гипогенитализм и глухота
Hamet с соавт. сообщили о 3 сибсах с тяжелой гипертензией, гипогенитализмом, почечной недостаточностью и нейросенсорной глухотой.
Клинические данные. Почки. У всех 3 сибсов отмечалась прогрессирующаяся почечная недостаточность. Двое сибсов умерли в четвертом десятилетии жизни. На вскрытии у мужчины сибса был обнаружен злокачественный нсфросклероз, в то время как у его сестры был найден фокальный нефрит.
Сердечно-сосудистая система. В поздней юности у всех сибсов выявилась выраженная гипертензия.
Эндокринная система. У мужчины сибса отмечался кринтор-хизм. Яички были уменьшены в размерах, а сперматогенез был редуцирован. У обеих женщин сибсов наблюдалась первичная аменорея. Яичники содержали фиброзные тяжи, а матка была инфантильной. У одной из сестер отмечалось недоразвитие молочных желез. У обеих сестер на лобке, в подмышечных впадинах и на теле отсутствовали волосы.
На вскрытии обнаружена гиперплазия зернистой зоны надпочечников. Возможно, это явилось следствием неспецифического действия почечной недостаточности.
Орган слуха. У брата прогрессирующая глухота была впервые обнаружена в 5-летнем возрасте и в течение нескольких последующих лет развилась тотальная потеря слуха. У сестры была умеренная двусторонняя нейросенсорная глухота. О состоянии слуха у второй сестры информации не имелось.

Вестибулярная система. Данные не опубликованы.
Лабораторные данные. У 2 женщин сибсов был снижен костный возраст. Отмечался демонстративный дефект адреналового биосинтеза, совместимый с неполной патологией 17-гидроксилирования и 11-гидроксилирования.
Наследственность. Три больных сибса, канадцы французского происхождения, имели 2 здоровых сибсов и здоровых, не состоящих в кровно-родственном браке родителей. Наследование синдрома, очевидно, аутосомпо-рецессивное.
Диагноз. Синдром Альпорта может быть исключен на основании отсутствия при нем гипогенитализма, рецессивного наследования и гипертензии, встречающейся на более поздних стадиях настоящего заболевания. ХХ-дисгенсзия гонад с врожденной нейросенсорной глухотой должна быть исключена как аутосомно-рецессивный синдром (Josso et al., Christakos et al.).
Лечение. Гипертензию нужно лечить гипотензивными средствами.
Прогноз. Прогноз неблагоприятный. Брат и сестра умерли в возрасте 30 и 35 лет от кровоизлияния в мозг.
Выводы. Характеристика данного синдрома включает:
1) аутосомпо-рецессивное наследование;
2) прогрессирующую почечную недостаточность;
3) резко выраженную гипертензию, выявляющуюся в поздней юности;
4) гипогенитализм, проявляющийся крипторхизмом или первичной аменореей; и
5) прогрессирующую нейросенсорную глухоту, выявляющуюся в детстве.
Синдром Лемье — Нимех: синдром Шарко-Мари-Тута, нефрит и глухота
Синдром Лемьё — Нимех: синдром Шарко-Мари-Тута, нефрит и глухота
Lemieux и Neemeh описали синдром, выявившийся в двух семьях и характеризующийся начинающейся в детском возрасте прогрессирующей дистальной мышечной атрофией, нефропатией с протеинурией и гематурией, а также прогрессирующей нейросенсорной глухотой. Спорадический случай был описан Hanson с сотр..
Клинические данные. Почки. У всех больных наблюдался нефрит, характеризующийся протеинурией и микроскопической гематурией. Функциональные почечные пробы были нормальными. При биопсии почек обнаружены очаги атрофичных канальцев. У 2 больных были выявлены многочисленные гиалинизированные клубочки. Интерстициальные пенистые клетки были найдены только в одном случае (Lemieux, Neemeh).
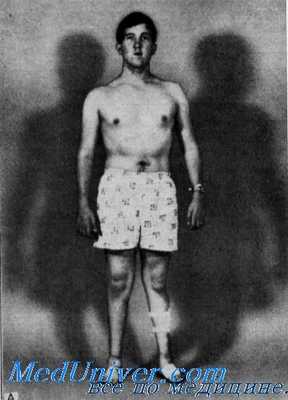
Мышечная система. Дистальная мышечная атрофия начиналась в детстве и медленно прогрессировала. Это состояние сопровождалось прогрессирующей мышечной слабостью, что затрудняло ходьбу и удержание в руках предметов. В старшем детском возрасте медленно развивалась «когтеобразная кисть». Неврологическое исследование обнаружило выраженные атрофии и слабость дистальной мускулатуры ног и собственных мышц кистей. Проксимальные мышцы конечностей оставались нормальными. У больных отмечались неустойчивая походка и двусторонние отвисающие стопы, но истинной атаксии не наблюдалось.
У младшего больного были нормальными рефлексы с двуглавой и трехглавой мышц, а коленные рефлексы и клонус стопы отсутствовали. У 3 старших больных не вызывался ни один из рефлексов. Чувствительность у всех больных была нормальной.
Орган слуха. Нарушения слуха начинались в детстве и медленно прогрессировали. У 2 из 3 больных, изученных Lemieux и Neemeh, а также у больного, описанного Hanson с сотрудниками, была выявлена прогрессирующая нейросенсорная глухота. У последнего больного отмечалась умеренная потеря слуха, выраженная резче на высоких частотах, замеченная впервые в 7-летнсм возрасте. У представленных Lemieux и Neemeh 25- и 34-летних больных отмечалась глухота около 50 дБ. По-видимому, сибсу 21 года аудиометрическое исследование не было проведено.
Вестибулярная система. У мальчика, описанного Hanson с соавторами, с обеих сторон отсутствовала реакция на калорическую пробу.
Лабораторные данные. Скорость проведения в двигательных (локтевом и срединном) нервах составляла около половины нормальной, т. е. от 20 до 25 м/с (Hanson). Электромиография показала отсутствие электрической активности в покое или при попытках добровольного сокращения дистальной мускулатуры. Проксимальные мышцы показали нормальные потенциалы. Полученные данные позволили диагностировать неврогенное происхождение поражения дистальной мускулатуры.
Биопсия икроножного нерва патологии не выявила. Биопсии большой берцовой, икроножной мышц и латеральной широкой мышцы бедра обнаружила изменения, согласующиеся как с миопатией, так и с невральной атрофией.
Наследственность. Наследуется ли этот синдром по рецессивному или по доминантному типу, неясно. Возможно, описанное здесь состояние действительно для двух различных синдромов. В первой изученной Lemieux и Neemeh семье были поражены 4 из 11 сибсов. У одного был синдром Шарко— Мари — Тута, у другого — нефропатия и у двух остальных — оба заболевания. Остальные 7 сибсов и мать не были обследованы. Отец умер от коронарной болезни сердца в 55-летнем возрасте.
Во второй семье у пробанда в возрасте 21 года отмечались дистальные мышечные атрофии и нефропатия, но не было глухоты. У его 12-летней сестры, 13-летнего брата и их 46-летней матери имелись дистальные мышечные атрофии. Исследование мочи выявило у 7 членов семьи легкую протеинурию.
Больной, описанный Hanson с сотр., был единственным пораженным среди 5 братьев и сестер. Его родители были здоровы.
Диагноз. Нефропатия при этом заболевании чрезвычайно напоминает ту, что наблюдается при синдроме Альпорта. Однако синдром Альпорта не сочетается с синдромом Шарко — Мари — Тута.
Лечение. Может оказать пользу применение слуховых аппаратов.
Прогноз. Продолжительность жизни трудно прогнозировать, так как все больные с нефропатией были относительно молодыми. Синдром Шарко — Мари — Тута представляется вполне классическим по своему течению.
Выводы. Синдром характеризуется:
1) вероятным аутосомно-доминантным наследованием;
2) нефропатией, похожей на ту, что наблюдается при синдроме Альпорта;
3) синдромом Шарко — Мари — Тута и
4) прогрессирующей нейросенсорной глухотой, начинающейся в детстве.
Почечный канальцевый ацидоз у подростков. Гиперпролинурия и ихтиоз с глухотой
Konigsmark описал 17-летнюю девушку и ее 20-летнего брата с почечным канальцевым ацидозом и медленно прогрессирующей лсйросенсорной глухотой, выявившимися впервые в юности. Несколько лет спустя об этих же самых сибсах сообщил Walker.
Клинические данные. Данные осмотра. Рост и физическое развитие нормальные.
Почки. У женщины сибса, обследованной Konigsmark, были выявлены почечные камни с обеих сторон, появившиеся в 12-лстпем возрасте. Согласно данным Walker, у нее наблюдались повторные приступы почечной колики, после которых выходили многочисленные маленькие камушки. Установленный при лабораторном исследовании почечный канальцевый ацидоз протекал легко.
Орган слуха. Нейросенсорная глухота прогрессировала медленно, достигла только умеренной степени и была резче выражена па высоких частотах. Walker сообщил, что дефект слуха у мальчика был впервые замечен в 5-лстием возрасте. Различение речи было нормальным. Результаты SISI-теста составляли 100%, предполагая кохлеарную локализацию глухоты.
Вестибулярная система. Результаты исследований не приведены.
Лабораторные данные. Рентгенологическое исследование выявило почечный кальциноз. Был обнаружен гиперхлоремический ацидоз. В результате нагрузки хлоридом аммония показатель рН мочи не снизился.
Наследственность. Болезнь наследуется по аутосомно-рецессивному типу.
Диагноз. На основании времени выявления заболевание должно быть отдифференцировано от детского почечного канальцевого ацидоза с врожденной нейросенсорной глухотой.
Лечение. Больным были назначены щелочные растворы и обильное питье.
Прогноз. Прогноз относительно благоприятный. Почечный канальцевый ацидоз характеризуется легким течением. Несмотря на то что он сочетается с почечным кальцинозом, лечение может быть эффективным.
Выводы. Синдром характеризуется: 1) аутосомно-рецессивным наследованием; 2) легким почечным канальцевым ацидозом, выявляющимся в юности или молодости; 3) медленно прогрессирующей нейросенсорной глухотой.
Гиперпролинурия и ихтиоз с глухотой
Goyer, Reynolds, Burke и Burkholder обнаружили у 23 членов одной семьи заболевание почек, глухоту, гиперпролниурию и ихтиоз в различных комбинациях.
Клинические данные. Данные осмотра. В возрасте 12 лет пробанд был помещен в клинику по поводу прогрессирующей утомляемости И недостаточной прибавки в весе.
Почки. У 8 больных была обнаружена нефропатия различной степени выраженности. В 13-летнем возрасте у пробанда развились альбуминурия и гематурия. Уровень мочевого азота в его крови постепенно повышался. У его 9-летнсго брата была выявлена легкая протеинурия, а у второго брата в 14-летнем возрасте появилась массивная гематурия. Внутривенная пислограмма показала большую кисту в левой почке, а в правой — маленький камушек и кортикальную кисту. Мать перенесла массивную гематурию в возрасте 22 лет. Позже у нее были обнаружены почечные камни.
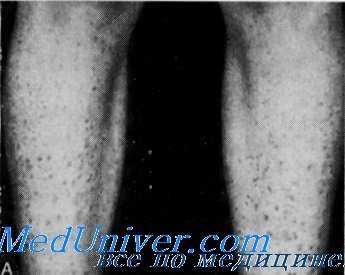
Покровная система. У многих членов семьи была сухая кожа, а у 6 из 23 больных родственников пробанда отмечался коричневатый шелушащийся ихтиоз.
Лабораторные данные. Единственной рентгенологической патологией, выявленной в семье, были двусторонние почечные кисты, обнаруженные у 15-летнего брата пробанда, и, кроме того, отмечены камни почек.
У пробанда примерно в 3 раза против нормы был повышен уровень пролина в плазме крови. Уровень пролина и гидроксипролина в моче был также повышен. У его брата в крови уровень пролина был нормальным, но содержание пролина в моче было повышенным, что позволило предположить сниженную способность к реабсорбции пролина в канальцах. У 2 других членов семьи отмечалось повышение уровня пролипа в плазме.
Патология. Биопсия почки пробанда обнаружила склероз клубочков. Интерстициальпая ткань была интенсивно инфильтрирована лимфоцитами. В артериях нашли различную степень гипертрофии срединной оболочки и субэндотелиального склероза. Электрономикрофотографии выявили утолщение срединной соединительнотканной сосудистой оболочки. В межклеточном веществе — плотные отложения.
Наследственность. Родословная показывает, что в пяти поколениях семьи имеется 23 больных с различными симптомами данного синдрома. У 2 из 3 детей, родившихся от кровпо-родствеиного союза больных родителей, отмечались все компоненты синдрома, кроме глухоты. У одного из родителей была только глухота, а у другого — только заболевание почек. Имеются основания предполагать, что это заболевание, передающееся доминантным геном, характеризуется варьирующей экспрессивностью.
Диагноз. У больных с синдромом гиперпролинемии, аномалий почек и глухоты (гиперпролинемия тип I) не наблюдается ихтиоза, встречающегося при описанном ниже синдроме. Более того, это заболевание наследуется по аутосомно-рецессивному тину. При синдроме гиперпролинемии с микроскопической гематурией, описанном как аутосомно-доминантное заболевание в американской семье, не наблюдалась глухота (Perry et al.).
Ихтиоз, сходящееся косоглазие и нейросенсорная глухота были описаны у девочки, рожденной от кровно-родственного брака. В этой семье у 7 из 10 сибсов наблюдались комбинации двух или большего числа симптомов болезни. Но ни почечной патологии, ни гиперпролинурии отмечено не было (Fischman, Crystal).
Лечение. Можно использовать слуховые аппараты. Терапия почечной патологии не указана, кроме случаев уремии.
Прогноз. Данный синдром вопреки уремии не ведет к сокращению продолжительности жизни. Глухота, вероятно, медленно прогрессирует, приводя к довольно глубокой потере слуха в поздних десятилетиях жизни.
Выводы. Характеристика данного синдрома включает:
1) аутосомно-доминантное наследование с варьирующей экспрессивностью;
2) нефропатию различной степени выраженности;
3) гиперпролинурию;
4) ихтиоз и
5) медленно-прогрессирующую нейросенсорную глухоту.
Невральная амиотрофия Шарко-Мари-Тута
Невральная амиотрофия Шарко-Мари-Тута — это прогрессирующее хроническое наследственное заболевание с поражением периферической нервной системы, приводящем к мышечным атрофиям дистальных отделов ног, а затем и рук. Наряду с атрофиями наблюдается гипестезия и угасание сухожильных рефлексов, фасцикулярные подергивания мышц. К диагностическим мероприятиям относятся электромиография, электронейрография, генетическое консультирование и ДНК-диагностика, биопсия нервов и мышц. Лечение симптоматическое — курсы витаминотерапии, антихолинэстеразной, метаболической, антиоксидантной и микроциркуляторной терапии, ЛФК, массажа, физиопроцедур и водолечение.
МКБ-10
Общие сведения
Невральная амиотрофия Шарко-Мари-Тута (ШМТ) относится к группе прогрессирующих хронических наследственных полиневропатий, в которую входят синдром Русси-Леви, гипертрофическая невропатия Дежерина-Сотта, болезнь Рефсума и другие более редкие заболевания.
По различным данным, невральная амиотрофия Шарко-Мари-Тута встречается с частотой от 2 до 36 случаев на 100 тыс. населения. Зачастую болезнь носит семейный характер, причем у членов одной семьи клинические проявления могут иметь различную выраженность. Наряду с этим наблюдаются и спорадические варианты ШМТ. Лица мужского пола болеют чаще, чем женщины.
Причины
На сегодняшний день практическая неврология как наука не располагает достоверными сведениями о этиологии и патогенезе невральной амиотрофии. Проведенные исследования показали, что у 70-80% пациентов с ШМТ, прошедших генетическое обследование, отмечалось дублирование определенного участка 17-й хромосомы. Определено, что невральная амиотрофия Шарко-Мари-Тута имеет несколько форм, вероятно обусловленных мутациями различных генов. Например, исследователи выяснили, что при форме ШМТ, вызванной мутацией кодирующего митохондриальный белок гена MFN2, происходит образование сгустка митохондрий, нарушающего их продвижение по аксону.
Болезнь Шарко-Мари-Тута характеризуется аутосомно-доминантным наследованием с пенетрантностью на уровне 83%. Встречаются также случаи аутосомно-рецессивного наследования.
Патогенез
Установлено, что большинство форм ШМТ связаны с поражением миелиновой оболочки волокон периферических нервов, реже встречаются формы с патологией аксонов — осевых цилиндров проходящих в центре нервного волокна. Дегенеративные изменения затрагивают также передние и задние корешки спинного мозга, нейроны передних рогов, пути Голля (спинномозговые проводящие пути глубокой чувствительности) и столбы Кларка, относящиеся к заднему спинномозжечковому пути.
Вторично, в результате нарушения функции периферических нервов, развиваются мышечные атрофии, затрагивающие отдельные группы миофибрилл. Дальнейшее прогрессирование болезни характеризуется смещением ядер сарколеммы, гиалинизацией пораженных миофибрилл и интерстициальным разрастанием соединительной ткани. В последующем нарастающая гиалиновая дегенерация миофибрилл приводит к их распаду.
Классификация
В современной неврологической практике невральная амиотрофия Шарко-Мари-Тута подразделяется на 2 типа. Клинически они являются практически однородными, однако имеют ряд особенностей, позволяющих провести такое разграничение.
- Невральная амиотрофия I типа характеризуется существенным снижением скорости проведения нервного импульса. Биопсия нерва обнаруживает сегментарную демиелинизацию нервных волокон, гипертрофический рост непораженных шванновских клеток;
- При амиотрофии ШМТ II типа скорость проведения страдает незначительно, анализ биоптата показывает дегенерацию аксонов.
Отмечена связь болезни Шарко-Мари-Тута и атаксии Фридрейха. В отдельных случаях у пациентов с ШМТ со временем отмечаются типичные признаки болезни Фридрейха и наоборот — иногда по прошествии многих лет клиника атаксии Фридрейха сменяется симптоматикой невральной амиотрофии. Некоторыми авторами даны описания промежуточных форм этих заболеваний. Наблюдались случаи, когда у одних членов семьи диагностировалась атаксия Фридрейха, а у других — амиотрофия ШМТ.
Симптомы
Невральная амиотрофия Шарко-Мари-Тута начинается с развития симметричных мышечных атрофий в дистальных отделах ног. Начальные симптомы манифестируют, как правило, в первой половине второго десятилетия жизни, реже в период от 16 до 30 лет. Они заключаются в повышенной утомляемости стоп при необходимости длительно стоять на одном месте. При этом наблюдается симптом «топтания» - чтобы снять утомляемость стоп пациент прибегает к ходьбе на месте.
В отдельных случаях невральная амиотрофия манифестирует расстройствами чувствительности в стопах, наиболее часто — парестезиями в виде ползания мурашек. Типичным ранним признаком ШМТ является отсутствие ахилловых, а позже и коленных сухожильных рефлексов. Основной симптом, на который пациенты чаще всего сами обращают внимание – приступообразные болезненные сокращения в икроножных мышцах (крампи), усиливающиеся в ночное время или после длительной физической нагрузки.
Развивающиеся первоначально атрофии затрагивают в первую очередь абдукторы и разгибатели стопы. Результатом является свисание стопы, невозможность ходьбы на пятках и своеобразная походка, напоминающая вышагивание лошади, — степпаж. Далее поражаются приводящие мышцы и сгибатели стопы. Тотальная атрофия мышц стопы приводит к ее деформации с высоким сводом, по типу стопы Фридрейха; формируются молоткообразные пальцы стопы. Постепенно атрофический процесс переходит на более проксимальные отделы ног — голени и нижние части бедер. В результате атрофии мышц голени возникает болтающаяся стопа. Из-за атрофии дистальных отделов ног при сохранности мышечной массы проксимальных отделов ноги приобретают форму перевернутых бутылок.
Зачастую при дальнейшем прогрессировании болезни Шарко-Мари-Тута атрофии появляются в мышцах дистальных отделов рук — вначале в кистях, а затем и в предплечьях. Из-за атрофии гипотенара и тенара кисть становиться похожей на обезьянью лапу. Атрофический процесс никогда не затрагивает мышцы шеи, туловища и плечевого пояса.
Часто невральная амиотрофия Шарко-Мари-Тута сопровождается легкими фасцикулярными подергиваниями мышц рук и ног. Возможна компенсаторная гипертрофия мышц проксимальных отделов конечностей. Сенсорные нарушения при невральной амиотрофии характеризуются тотальной гипестезией, однако поверхностная чувствительность (температурная и болевая) страдает значительно больше глубокой. В некоторых случаях наблюдается цианоз и отек кожи пораженных конечностей.
Для болезни Шарко-Мари-Тута типично медленное прогрессирование симптомов. Период между клинической манифестацией заболевания с поражения ног и до появления атрофий на руках может составлять до 10 лет. Несмотря на выраженные атрофии, пациенты длительное время сохраняют работоспособное состояние. Ускорить прогрессирование симптомов могут различные экзогенные факторы: перенесенная инфекция (корь, инфекционный мононуклеоз, краснуха, ангина, ОРВИ), переохлаждение, ЧМТ, позвоночно-спинномозговая травма, гиповитаминоз.
Осложнения
Невральная амиотрофия Шарко-Мари-Тута характеризуется ранней инвалидизацией. Вследствие прогрессирующей атрофии дистальных отделов конечностей и выраженных нарушений чувствительности больные постепенно теряют способность к самостоятельной ходьбе. Из-за грубых деформаций кистей рук пациенты не могут сами себя обслуживать. Контрактуры суставов нередко требуют хирургической коррекции.
На ранней стадии заболевания слабость в мышцах ног, гипестезия и гипорефлексия приводят к частым падениям, что повышает вероятность травм и переломов. Наиболее грозные неблагоприятные последствия происходят при сочетании болезни Шарко-Мари-Тута и атаксии Фридрейха. К ним можно отнести слепоту, кардиомиопатию, дыхательную недостаточность.
Диагностика
Курацией пациентов занимаются врачи-неврологи и ортопеды. При опросе больного уточняется возраст, в котором начали появляться симптомы (для болезни ШМТ типична манифестация в 15-25 лет). Важное значение имеет семейный анамнез (наличие близкого родственника с этой патологией). Во время общего осмотра обращается внимание на изменение походки, деформацию стоп и кистей.
При неврологическом осмотре отмечается уменьшение тонуса дистальных отделов верхних и нижних конечностей, ослабление или полное отсутствие сухожильных рефлексов (ахилловых, коленных), снижение кожной чувствительности. Для уточнения диагноза проводятся следующие методы исследования:
Дифференциальный диагноз невральной амиотрофии Шарко-Мари-Тута необходимо проводить с наследственными нейромышечными заболеваниями (спинальная мышечная атрофия Верднига-Гоффмана, адренолейкодистрофия, болезнь Пелицеуса-Мерцбахера) и приобретенными хроническими полинейропатиями (синдром Гийена-Барре).
Лечение невральной амиотрофии Шарко-Мари-Тута
Медикаментозная терапия
Для прохождения лечения все больные подлежат обязательной госпитализации в стационар. В настоящее время не существует специфической терапии, способной замедлить прогрессирование аксональной дегенерации и демиелинизации. Однако своевременно начатая грамотная и индивидуально подобранная терапия способна значительно улучшить качество жизни пациентов. Из лекарственных препаратов для симптоматического лечения невральной амиотрофии ШМТ применяются:
- Витамины. Для улучшения микроциркуляции и восстановления нервных волокон назначаются инъекции витаминов группы В (В1, В3, В12). К витамину В6 стоит относиться с осторожностью, так как превышение его дозы оказывает нейротоксический эффект. По данным некоторых исследователей, аскорбиновая кислота способна подавлять образование периферического белка миелина (PMP22).
- Миорелаксанты. С целью устранения болезненных мышечных сокращений пациентам рекомендуется прием медикаментов, расслабляющих скелетную мускулатуру – баклофен, толперизон.
- Кальций и витамин Д. Так как примерно 40% больных имеют остеопороз, для уменьшения риска переломов им показаны препараты кальция и витамина Д (холекальциферол).
- Антихолинэстеразные средства. При болезни ШМТ 2 типа для улучшения нервно-мышечной проводимости целесообразно назначение прозерина, галантамина.
Немедикаментозная терапия
Основное внимание уделяется немедикаментозному лечению невральной амиотрофии Шарко-Мари-Тута. Для достижения максимального терапевтического эффекта применяется комплекс следующих мероприятий:
- Электростимуляция. Для усиления нейротрофики, активации метаболизма в паретичных мышцах и проводимости периферических нервов используется направленная подача электрических импульсов.
- ЛФК. С целью повышения мышечного тонуса рекомендуются регулярные занятия лечебной физкультурой. Наиболее эффективно совмещение активных (выполняются самим пациентом) и пассивных (выполняются специалистом) упражнений.
- Массаж. Для улучшения кровообращения и лимфооттока в мышцах (в первую очередь нижних конечностей) выполняются различные виды массажа – ручной (стимулирующий, расслабляющий) и аппаратный (вибромассаж).
- Бальнеотерапия. Грязевые ванны и грязевые аппликации способствуют коррекции нарушений вегетативной нервной системы и замедлению формирования контрактур.
- Ортопедическое лечение. Чтобы предупредить развитие грубых деформаций больным назначается ношение ортопедической обуви. При нестабильности суставов из-за мышечной слабости, для фиксации стоп в заданном положении используются специальные приспособления (ортезы, подтяжки).
Хирургическое лечение
При выраженных атрофических явлениях и деформации стопы, значительно затрудняющих самостоятельную ходьбу, когда консервативные методы оказываются безуспешными, показаны ортопедические оперативные вмешательства – метатарзальная остеотомия, остеотомия пяточной кости. В некоторых случаях для восстановления опорной функции стопы может понадобиться проведение артродеза.
Экспериментальное лечение
Продолжаются поиски эффективного лекарства для борьбы с невральной амиотрофией Шарко-Мари-Тута. В клинических испытаниях, где пациенты принимали препарат PXT3003 (комбинация малых доз баклофена, налтрексона и сорбитола), были отмечены положительные результаты в виде увеличения мышечной силы, возобновления чувствительности и сухожильных рефлексов.
Рассматривается возможность использования в качестве лечения ингибиторов HDAC6 – ферментов, стимулирующих регенерацию белков цитоскелета нервных клеток. Эксперименты на лабораторных животных показали, что данные вещества способны значительно замедлить прогрессирование демиелинизации и аксональной дегенерации.
Прогноз и профилактика
Невральная амиотрофия Шарко-Мари-Тута – тяжелое инвалидизирующее заболевание. Большинство пациентов утрачивают способность ходить через 15-20 лет после начала появления симптомов. Однако в виду того, что преимущественно поражаются дистальные отделы конечностей, продолжительность жизни больных практически не отличается от таковой в общей популяции.
Летальные исходы в молодом и среднем возрасте наблюдаются при сочетании с атаксией Фридрейха, когда в патологический процесс вовлекается дыхательная мускулатура и миокард. Специфических методов первичной профилактики не существует. Предупредить развитие осложнений и максимально сохранить работоспособность позволяет своевременное начало комплексной терапии.
1. Оценка качества жизни больных с наследственной невропатией Шарко—Мари—Тута в Красноярском крае/ Шнайдер Н.А., Глущенко Е.В., Козулина Е.А.// Бюллетень Сибирской медицины. - 2011.
2. Клинико-генетическая характеристика наследственной невропатии Шарко—Мари—Тута (на примере Красноярского края): Автореферат диссертации/ Глущенко Е.В. - 2011.
3. Ведение и реабилитация пациентов с наследственной невропатией Шарко—Мари—Тута/ Шнайдер Н.А., Глущенко Е.В.// Комплексная реабилитация: наука и практика. - 2010.
4. Наследственная невропатия Шарко—Мари—Тута/ Шнайдер Н.А., Глущенко Е.В., Кантимирова Е.А. и др. - 2010.
Синдром Русси-Леви
Синдром Русси-Леви — наследственное заболевание из группы мотосенсорных невропатий, по некоторым представлениям являющееся фенотипическим вариантом амиотрофии Шарко-Мари-Тута. Основные симптомы включают сенситивную атаксию, слабость и гипотрофию мышц дистальных отделов конечностей (преимущественно нижних), сухожильную арефлексию. При установлении диагноза опираются на особенности клинического симптомокомплекса и течения заболевания, семейный анамнез, результаты электронейромиографии. Пациентам показано регулярное симптоматическое лечение: антихолинэстеразные фармпрепараты, витамины, калий, АТФ, массаж, физиопроцедуры, ЛФК.
Синдром Русси-Леви носит эпонимическое название в честь описавших его в 1926 году французских медиков невролога Леви и патолога Русси. Авторы обозначили описанный синдром как семейную арефлекторную дистазию с медленным прогрессированием. Базисными клиническими проявлениями синдрома выступают атаксия и сухожильная арефлексия, что легло в основу другого его названия - «синдром атаксии-арефлексии». Согласно международной классификации 10-го пересмотра, синдром Русси-Леви отнесен к группе наследственных мотосенсорных невропатий (НМСН). Однако среди клиницистов нет однозначного мнения, как классифицировать данную патологию. В соответствии с симптоматикой ряд специалистов в области неврологии относит синдром Русси-Леви к клинической форме, занимающей промежуточное положение между болезнью Шарко-Мари-Тута и атаксией Фридрейха, другие авторы считают его отдельным клиническим вариантом спинальной амиотрофии. Не смотря на полученные генетические доказательства последнего утверждения, многие неврологи до сих пор выделяют синдром Русси-Леви как отдельную нозологию.
Причины синдрома Русси-Леви
Семейный характер заболевания указывает на его наследственный генез. Ранее было установлено, что невропатия Русси-Леви встречается в семьях с повторными случаями болезни Шарко-Мари-Тута. Молекулярно-генетические исследования последних лет выявили, что генетическим субстратом синдрома выступают нарушения в 17-й хромосоме (локус 17р11.2) в виде наличия дубликатов отдельных генов, точковые мутации гена MPZ — нулевого миелинового протеина. Это открытие позволяет считать синдром Русси-Леви фенотипической формой невральной амиотрофии Шарко-Мари-Тута (НМСН вариант IА).
Наследование синдрома осуществляется аутосомно-доминантным путем. Морфологически определяются дегенеративные изменения задних спинальных корешков и периферических нервных стволов в виде умеренной демиелинизации и уменьшения числа нервных волокон; дистрофические изменения пирамидных и мозжечковых трактов, проходящих в боковых столбах спинного мозга; дегенерация задних столбов; атрофия мышечных волокон скелетной мускулатуры.
Симптомы синдрома Русси-Леви
Дебют симптоматики обычно приходится на детский возраст, иногда — пубертат, в отдельных случаях возможен у взрослых. Первоначальной жалобой выступает неловкость при ходьбе за счет снижения силы мышц голени (в большей степени перонеальной группы) и сенситивной атаксии. Мышечная слабость обуславливает затрудненное тыльное сгибание стоп, их свисание в состоянии подошвенного сгибания. Ранним признаком заболевания является выпадение сухожильных рефлексов нижних конечностей (коленных, ахилловых). Со временем наблюдается арефлексия верхних конечностей, слабость мышц дистальных отделов рук и атрофии мышц кисти. Отмечаются полиневритические нарушения чувствительности: болевая и температурная гипестезия в виде «носков» и «перчаток», расстройство глубоких видов (мышечно-суставного, вибрационного восприятия). Последнее обуславливает существование сенситивной атаксии.
Во внешнем виде пациента обращает на себя внимание гипотрофия мышц голеней, т. н. «ноги аиста». Выраженность нарушения походки вариабельна: от легкой неловкости до типичного степпажа с высоким подъемом согнутой в колене ноги и свисанием стопы. Атаксия редко достигает грубого выражения, характеризуется неустойчивостью при ходьбе, общей неловкостью, несоразмерностью и асимметричностью точных движений. Наблюдается шаткость в позе Ромберга, промахивание и тремор при выполнении координаторных проб. Характерна полая стопа, отличающаяся от стопы Фредрейха сочетанием с арахнодактилией, расположением пальцев в форме трезубца или двузубца, деформациями пальцев. Типично исчезновение высокого свода стопы при опоре на нее во время ходьбы. Наряду с деформацией стоп наблюдается похожая деформация кистей. У многих пациентов имеются деформации грудной клетки, искривление позвоночника по типу кифосколиоза и прочие маркеры соединительнотканной дисплазии (гипертелоризм, расширенная переносица, гидроцефальный череп, готическое небо).
Диагностика синдрома Русси-Леви
Диагноз базируется на клинической картине заболевания и ее изменении в динамике. От невральной амиотрофии невропатию Русси-Леви отличает меньшая выраженность мышечных гипотрофий, от болезни Фридрейха — отсутствие дизартрии и склонность к стабилизации состояния. Дифдиагностика проводится также с другими видами полиневропатий, с миопатией и миотонией, боковым амиотрофическим склерозом, болезнью Рефсума, миелопатиями. Пациентам показана консультация генетика и генеалогический анализ.
С целью уточнения диагноза невролог назначает электронейромиографию, результаты которой говорят о замедлении проведения импульсов по нервным стволам. В сложных диагностических случаях проводится биопсия мышц и/или поверхностных нервов нижних конечностей. Микроскопическое исследование мышечной ткани выявляет атрофические изменения отдельных пучков мышечных волокон. При микроскопии препаратов нерва определяется разрастание элементов шванновской оболочки, приводящее к гипертрофии нервных волокон, по своей форме напоминающей луковицу.
Лечение и прогноз синдрома Русси-Леви
В настоящее время разработана только симптоматическая терапия, базирующаяся на фармпрепаратах, облегчающих проведение нервного импульса и улучшающих обменные процессы нервной ткани. Составляющими лечения обычно выступают тиамин, пиридоксин, витамин С, цианокобаламин, оротат калия, антихолинэстеразные средства (амбенония хлорид, дистигмин, галантамин, пиридостигмин, неостигмин), АТФ. Параллельно рекомендованы занятия лечебной физкультурой, массаж, физиолечение и сегментарно-рефлекторная терапия. Деформация стоп является показанием к консультации ортопеда с подбором ортопедической обуви.
Синдром Русси-Леви отличается хорошим для жизни прогнозом. Медленное нарастание симптоматики с последующей стабилизацией процесса обеспечивает большинству пациентов длительную сохранность трудоспособности и негрубое ее снижение. В некоторых случаях наблюдается неуклонное прогрессирование мышечной слабости и гипотрофии, приводящее к затруднению самостоятельной ходьбы.
Читайте также:
